Journal of microbiology, epidemiology and immunobiology
The Journal is published on behalf of the Russian scientific and practical society of epidemiologists, microbiologists and parasitologists.
This Platinum Open Access peer-reviewed Journal intends to publish the cutting edge research results focused on control of spread, prevention and treatment of human infectious diseases in the field of medical microbiology, virology, epidemiology, immunology including immunodiagnostics and immunoprophylaxis.
The Journal covers the issues of human infectious diseases from the point of research of pathogen — bacteria, viruses and prions in relationship to the human immune response, intra- and interspecific interaction, environment, as well as related evolutionary processes and public health.
The Journal is intended for professionally interested physicians, epidemiologists, researchers, university lecturers, postgraduates and students.
The Journal accepts for publication Russian and foreign original research articles, reviews, short communications, mini reviews, opinion and other special featured articles as well as lectures, methodological materials related to its profile.
All papers are subject to mandatory double-blind review.
The Journal does not charge authors any fees.
JMEI belongs to the IV quartile of SJR (2022) in the specialties Epidemiology, Immunology, Immunology and Microbiology (miscellaneous), Virology and to the III quartile in the specialty Medicine (miscellaneous), is included in international bibliographic systems and international citation databases: SCOPUS, DOAJ, ULRICHS PERIODICAL DIRECT, EBSCO, OPENALEX, Fatcat, RSCI, RUSMED, ZEITSCHRIFTEN DATENBANK, GOOGLE SCHOLAR, CYBERLENINKA, RUCONT, to the recommended by Higher Attestation Commission “List of peer-reviewed scientific publications in which the main scientific results of dissertations for the degree of candidate of science should be published, competition for the scientific degree of Doctor of Science" in the following specialties:
- 03.02.02 Virology (medical and biological sciences)
- 03.02.03 Microbiology (medical and biological sciences)
- 14.02.02 Epidemiology (medical and biological sciences)
- 14.03.09 Clinical immunology, Allergology (medical and biological sciences).
In accordance with the recommendations of the Higher Attestation Commission (Letter of the Higher Attestation Commission dated December 06, 2022 No. 02-1198), the Journal belongs to the K1 category, as a publication included in the SCOPUS and RSCI databases.
The Journal follows the ICMJE's Recommendations for the Conduct, Reporting, Editing and Publication of Scholarly Work in Medical Journals.
The Journal is presented in the following online sci-hub libraries and abstract and citation databases:
- SCOPUS
- DOAJ
- ULRICHS PERIODICAL DIRECT
- Russian Science Citation Index (RSCI)
- Google Scholar
- CYBERLENINKA
- RUCONT
The most significant articles by the decision of the Editorial Board are published in full-text translation on the Journal's website under the same DOI as the original.
Each article of the Journal is assigned a digital object identifier — DOI (Crossref).
The content is available under the Creative Commons — Attribution 4.0 International, CC-BY license.
![]()
The CrossMark service is used to keep the content of the Journal up-to-date and to inform readers about changes in published articles if they occur.

The Journal uses Online First Pre-Publication — the online publication of the final version of an article that has been reviewed and accepted for publication in the Journal, without waiting for placement in a specific issue and pagination. DOI are assigned to the articles, which makes it possible to fully cite before the publication of the Journal issue.
The Editorial Board consists of 24 leading Russian and 8 foreign microbiologists, virologists, immunologists and infectious diseases doctors, including 11 full members and 6 corresponding members of the Russian Academy of Sciences.
All papers are subject to mandatory double-blind review.
The Journal is registered by the Federal service for supervision of communications, information technology and mass communications. Certificate of PI NOFS77-75442.
The Journal publishes regular issues bimonthly, six times per year.
Founders:
- Central Research Institute for Epidemiology
- Russian Scientific Society of Epidemiologists, Microbiologists and Parasitologists
Publisher:
- Central Research Institute for Epidemiology
Current Issue
Vol 102, No 4 (2025)
- Year: 2025
- Published: 15.09.2025
- Articles: 12
- URL: https://microbiol.crie.ru/jour/issue/view/191
SCIENCE AND PRACTICE
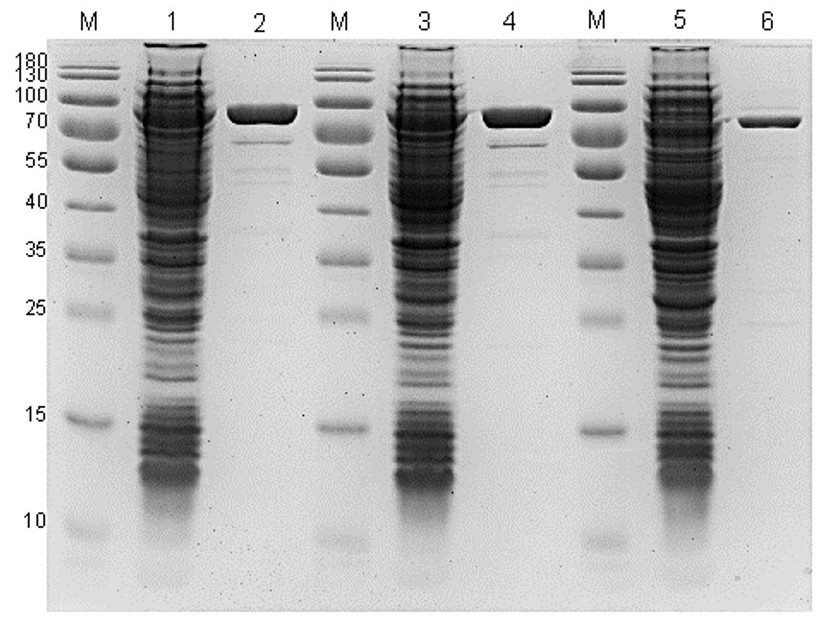
Production and characterization of chimeric Bst-like polymerases and their application in isothermal amplification combined with rapid RNA extraction methods using the example of the mumps virus
Abstract
Introduction. Bst polymerase plays a key role in the rapid diagnosis of infectious diseases due to its unique biochemical properties and potential application in loop-mediated isothermal amplification (LAMP). Several analogs of Bst polymerase have been described in the literature; however, these enzymes have not been widely used in molecular diagnostics.
The aim of the study is to obtain recombinant Bst and Btlv polymerases with the Sso7d domain and to test new possibilities for their application.
Materials and methods. Expression constructs carrying the polymerase gene were obtained using standard genetic engineering methods. The target enzyme was produced in Escherichia coli cells. Purification was carried out using metal-affinity chromatography methods followed by dialysis and concentration. RNA-dependent DNA polymerase (reverse transcriptase) and DNA polymerase activities of the enzymes were determined using non-radioactive methods with fluorescent detection. The functional properties of the enzymes were assessed using the Amplisens SARS-CoV-2-IT reagent kit and a method designed for the detection of mumps virus RNA in biological material using the LAMP format combined with reverse transcription.
Results. In the E. coli-based expression system, the following recombinant chimeric enzymes with displacing activity have been obtained: Bst_Sso7d, Bst_Sso7d_mut4 and Btlv_Sso7d. The developed cultivation and purification protocols allow for the production of enzymes in soluble form with a yield of up to 25% of the collected cell mass. Functional testing showed that in LAMP, the chimeric polymerases demonstrated similar activity to Bst polymerase without the Sso7d domain. At the same time, the Btlv_Sso7d polymerase exhibited increased reverse transcriptase activity and resistance to inhibitors.
Conclusion. The obtained chimeric polymerase Btlv_Sso7d, due to its improved properties, can be used in reagent kits for the diagnosis of infectious diseases by the LAMP method when using nucleic acid extraction methods.
 391-403
391-403


ORIGINAL RESEARCHES
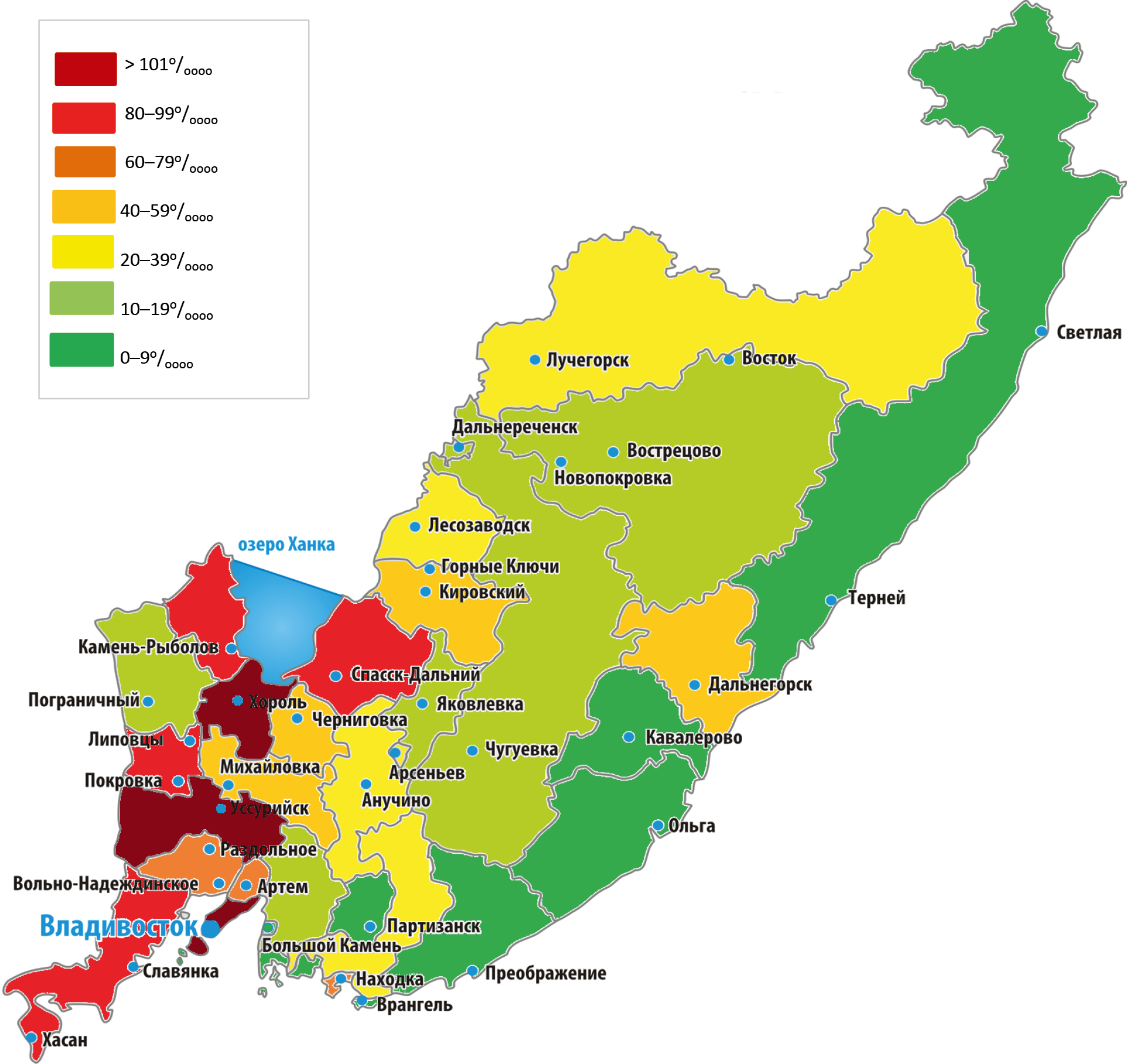
Characteristics of salmonellosis pathogens circulating in Primorsky Krai before and during the COVID-19 pandemic
Abstract
Introduction. To date, among intestinal infections, salmonellosis is a pressing health problem worldwide, including in the Russian Federation, causing acute infectious outbreaks of disease.
Objective of the study: to assess the impact of the COVID-19 pandemic on the epidemiological patterns and molecular biological characteristics of salmonella infection in Primorsky Krai for 2019–2023.
Materials and methods. A retrospective epidemiological analysis of salmonellosis incidence during the COVID-19 pandemic in the population of Primorsky Krai was conducted. Plasmid characteristics of non-typhoidal Salmonella strains and their serotype were established using alkaline lysis and serological typing methods.
Results. During the COVID-19 pandemic, both in the Russian Federation and in Primorsky Krai, the registration of salmonellosis was significantly lower than in the pre-pandemic period, and the seasonality of salmonellosis shifted to the autumn months. An inverse relationship of medium strength was revealed between the monthly incidence of salmonellosis and COVID-19. No significant changes in the plasmid spectrum and in the proportion of registration by serogroups and serotypes of Salmonella were observed. It was shown that salmonellosis infection in Primorsky Krai is mainly caused by S. enteritidis strains with a plasmid characteristic of 38 MDa, 38:1.4 MDa, 38:2.3 MDa, 38:4.4 MDa, rare variants of plasmid types were also detected, the influence of the COVID-19 pandemic on the emergence of new plasmid types has not been established.
Conclusion. The presented results of the study on the molecular biological characteristics of Salmonella circulating in Primorsky Krai during the COVID-19 pandemic will open up prospects for understanding the ecological and epidemiological patterns of the development of the epidemic process of salmonella infection.
 404-412
404-412


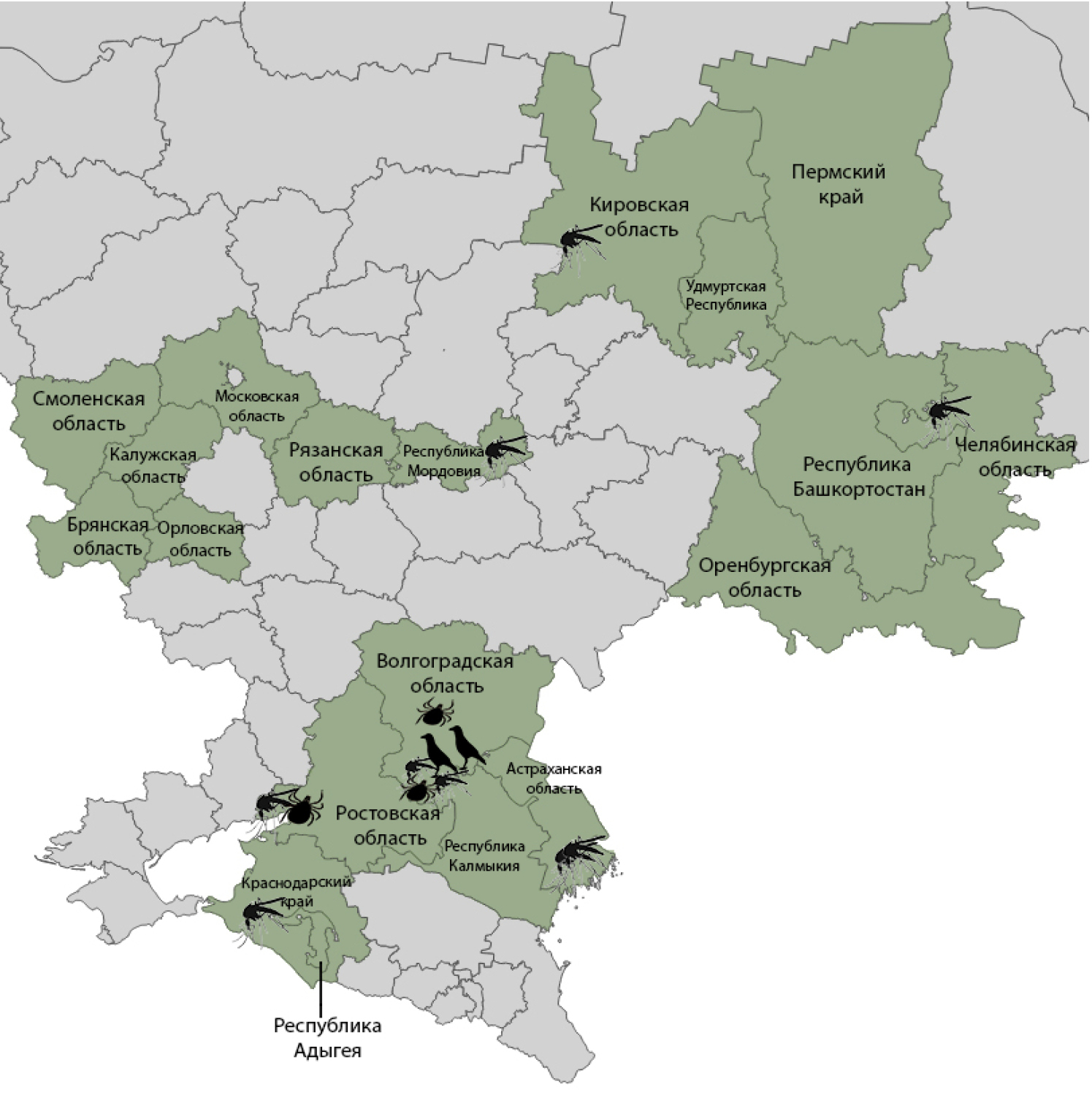
Results of reconnaissance epizootiological monitoring for West Nile fever in certain regions of European Russia and the Urals in 2024
Abstract
Introduction. Climate warming contributes to the intensification of epizootic and epidemic processes of West Nile fever (WNF). In southern Russia, the activity of the epizootic process is recorded annually, but in the central region of the European part of the country and in the Urals, the enzootic circulation of the West Nile virus (WNV) has not been confirmed in the territory of 20 subjects.
The aim of the study is to investigate zoological and entomological material for WNV infection to confirm the ongoing epizootic process in old WNV foci and in previously non-endemic areas.
Materials and methods. Field samples were collected in 2024 in 19 subjects in accordance with the methods regulated in normative documents. The material was studied using the reverse transcription polymerase chain reaction method.
Results. In total, during the 2024 field season, 5,419 samples of field samples were examined: 684 samples of birds from 74 species, 455 samples of small mammals from 13 species, 45 samples of frogs from 1 species, 3,665 samples of blood-sucking mosquitoes from 33 species (93,438 specimens), and 570 samples of ixodid ticks from 17 species (4,809 specimens). Markers of WNV in field samples were detected in 7 subjects from 3 federal districts. In the Kirov and Chelyabinsk regions and the Republic of Mordovia, evidence of the ongoing epizootic process of WNF has been obtained for the first time. WNV RNA was detected in 6 (0.5%) out of 1184 tested samples of vertebrate animals and in 27 (0.6%) out of 4235 samples of arthropods. The level of individual infection was 0.03% in blood-sucking mosquitoes, 0.06% in ixodid ticks, and 0.9% in birds.
Conclusion. The results of the studies confirm the enzootic circulation of WNV in the territories of the Southern, Volga and Ural Federal Districts.
 413-424
413-424


Analysis of HIV-1 genetic variants and drug resistance among men with high-risk sexual behavior, Cuban citizens, living in Moscow in 2022–2024
Abstract
Introduction. The characteristics of the HIV epidemic in Cuba are comparable to those of the HIV epidemic in Russia. Migration between Cuba and Russia can affect HIV-1 genetic diversity and drug resistance in Russia. The vulnerable group of men with risk sexual behavior including men who have sex with men (MSM) and commercial sex workers (CSW) deserves special attention. The aim of our study was the analysis of HIV-1 genetic variants and HIV-1 drug resistance in blood plasma samples obtained from MSM migrants from Cuba living in Moscow.
Materials and methods. A collection of blood plasma samples, epidemiological and clinical information was collected from MSM patients — migrants from Cuba, nucleotide sequences of the HIV-1 genome were obtained. HIV-1 genotyping, cluster analysis and analysis of drug resistance (DR) were carried out.
Results. Samples and epidemiological data obtained in 2022–2024 from 27 patients were analyzed. 24/27 patients (including 12/15 suspected of infection in Moscow and all 10 — in Cuba) harbored HIV-1 variants typical for Cuba, not Russia. This indicates that 88.89% of patients were infected by their fellow citizen. DR was detected in 9 patients (33.33%; 95% CI 15.55–51.11). The most common resistance was DR to efavirenz (EFV) and nevirapine (NVP), which was associated with K103N, Y181C and P225H mutations.
Conclusion. The migration factor should be taken into account in HIV-1 prevention and control of HIV-spreading programs in Russia, and the genetic characteristics of HIV-1 in migrants should be taken into account in effective therapy selecting.
 425-435
425-435


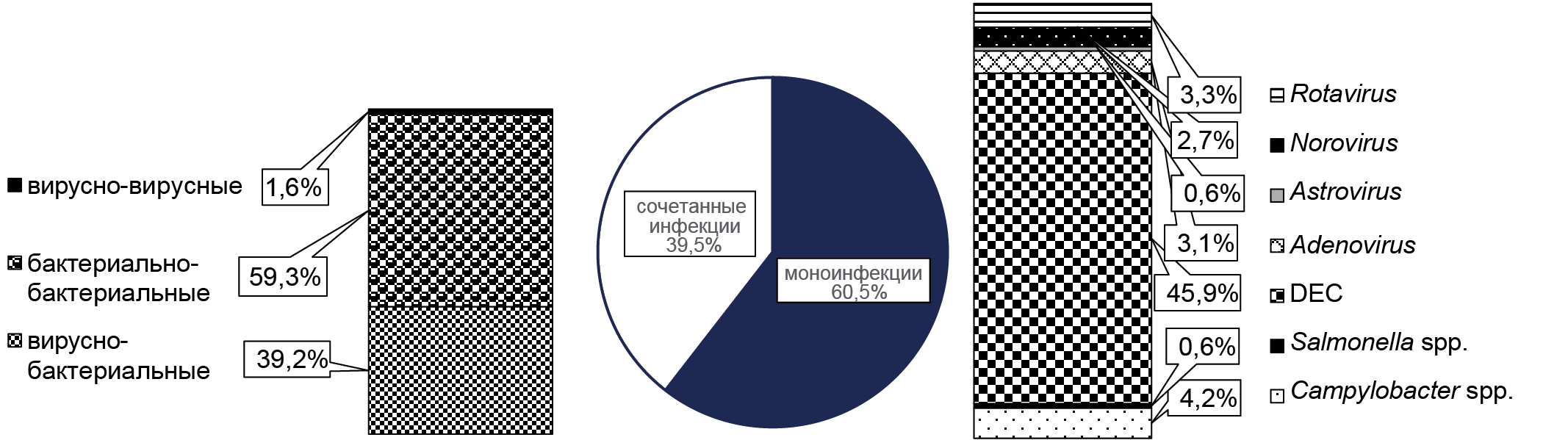
Etiological structure of acute intestinal infections based on the results of exterritorial monitoring
Abstract
Introduction. Acute intestinal infections cause high morbidity and mortality, especially in Africa and Southeast Asia, where millions of children under the age of five die every year. The Republic of Guinea urgently requires large-scale research aimed at studying the causes of diarrheal diseases, necessary for the development of effective preventive measures to ensure the preservation of the health of its population.
Aim. To conduct a analysis of the etiological structure of acute intestinal infections in the Republic of Guinea.
Materials and methods. Stool samples (n = 724) from residents of the Republic of Guinea with diarrheal syndrome were studied by real-time PCR with two reagent kits: 1) AmpliSens OKI screen-FL for the detection of DNA (RNA) of microorganisms Shigella spp./EIEC, Salmonella spp., Campylobacter spp., Adenovirus, Rotavirus, Norovirus and Astrovirus; 2) AmpliSens Escherichiosis-FL for the detection of DNA of diarrheagenic Escherichia coli (DEC) of five pathogroups: EPEC, EHEC, ETEC, EIEC, EAgEC.
Results. In the period 2019-2022, 66.2% of the examined children and adults revealed the presence of genetic markers of acute intestinal infections, mainly of bacterial etiology (74.1%), among which diarrheagenic E. coli dominated (62.4%). Genetic markers of viral pathogens were detected significantly less frequently by 25.9%, p < 0.05. Young children are most vulnerable to infection caused by E. coli. Bacterial pathogens dominate both in cases of monoinfections and in cases of mixed infection with two or more types of pathogens.
Conclusion. A study has shown that DEC is the main cause of intestinal infections in Guinea. The data obtained will become the basis for the development of an effective program for the prevention and treatment of acute intestinal infections in the republic.
 436-444
436-444


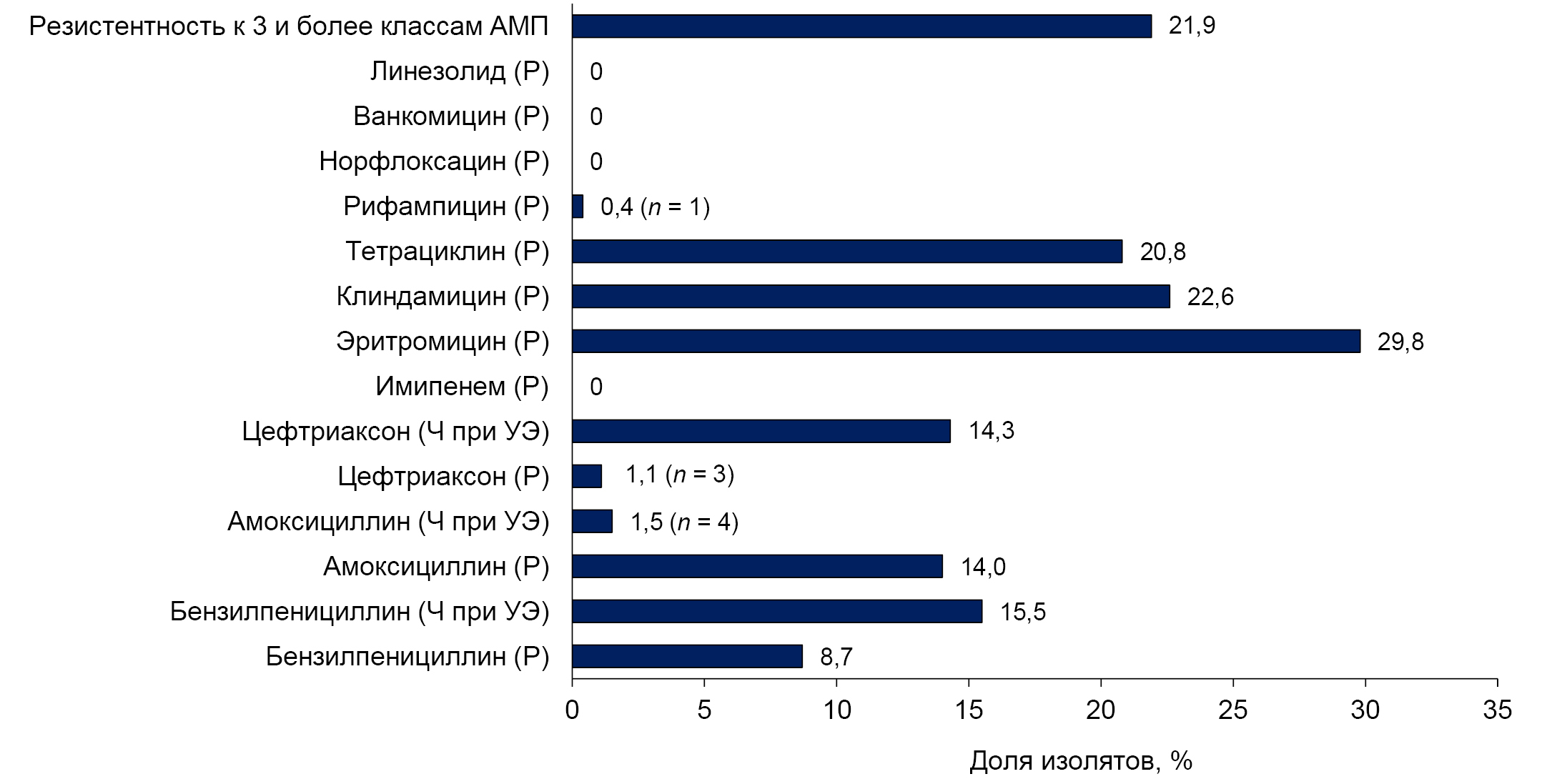
Antimicrobial resistance of Streptococcus pneumoniae strains isolated from children following immunization with a 13-valent conjugated vaccine
Abstract
Introduction. Monitoring the resistance of Streptococcus pneumoniae to antimicrobials is an important component of epidemiological surveillance of pneumococcal infection, addressing the challenges of improving therapeutic approaches and containing the spread of resistance at regional and national levels.
The aim of the study is to investigate pneumococcal antibiotic resistance in preschool children following immunization with a 13-valent conjugated vaccine within the national immunization schedule.
Materials and methods. From 2016 to 2022, 1250 healthy children under the age of 6 from organized groups were examined. Detection of nasopharyngeal carriage of pneumococcus was performed using the culture method, and serotype was determined by polymerase chain reaction. Antimicrobial susceptibility was investigated using the disk diffusion method, and the minimum inhibitory concentration of antibiotics in resistant isolates was determined using E-tests.
Results. 265 isolates of S. pneumoniae were studied, and resistance to antimicrobials was found in 36.6%. The proportion of resistant isolates was 33.8% in the early post-vaccination period (2016–2018) and 45.3% in the late period (2020–2022) (p = 0.097). Penicillin-resistant pneumococci were detected only in the early post-vaccination period, with a frequency of 11.4% (p = 0.005). The prevalence of macrolide-resistant isolates in the analyzed periods was 27.9% and 35.9% (p = 0.219), and those resistant to 3 or more classes of antibiotics were 23.4% and 17.2%, respectively (p = 0.297). The serotype composition of resistant S. pneumoniae has changed: vaccine serotypes 19F, 6A, 6B, etc. (83.8%) have been replaced by non-vaccine serotypes – 15AF, 23A, etc. The proportion of vaccine serotypes in the late post-vaccination period was only 10.3%.
Conclusion. Against the backdrop of child immunization against pneumococcal infection, there has been a decrease in the prevalence of pneumococci with reduced susceptibility to β-lactams. S. pneumoniae resistance to macrolides remains high (35.9%). Resistant pneumococcal isolates primarily belong to serogroup 15 (15AF) and serotype 23A, which are not included in the 13-valent conjugate vaccine.
 445-455
445-455


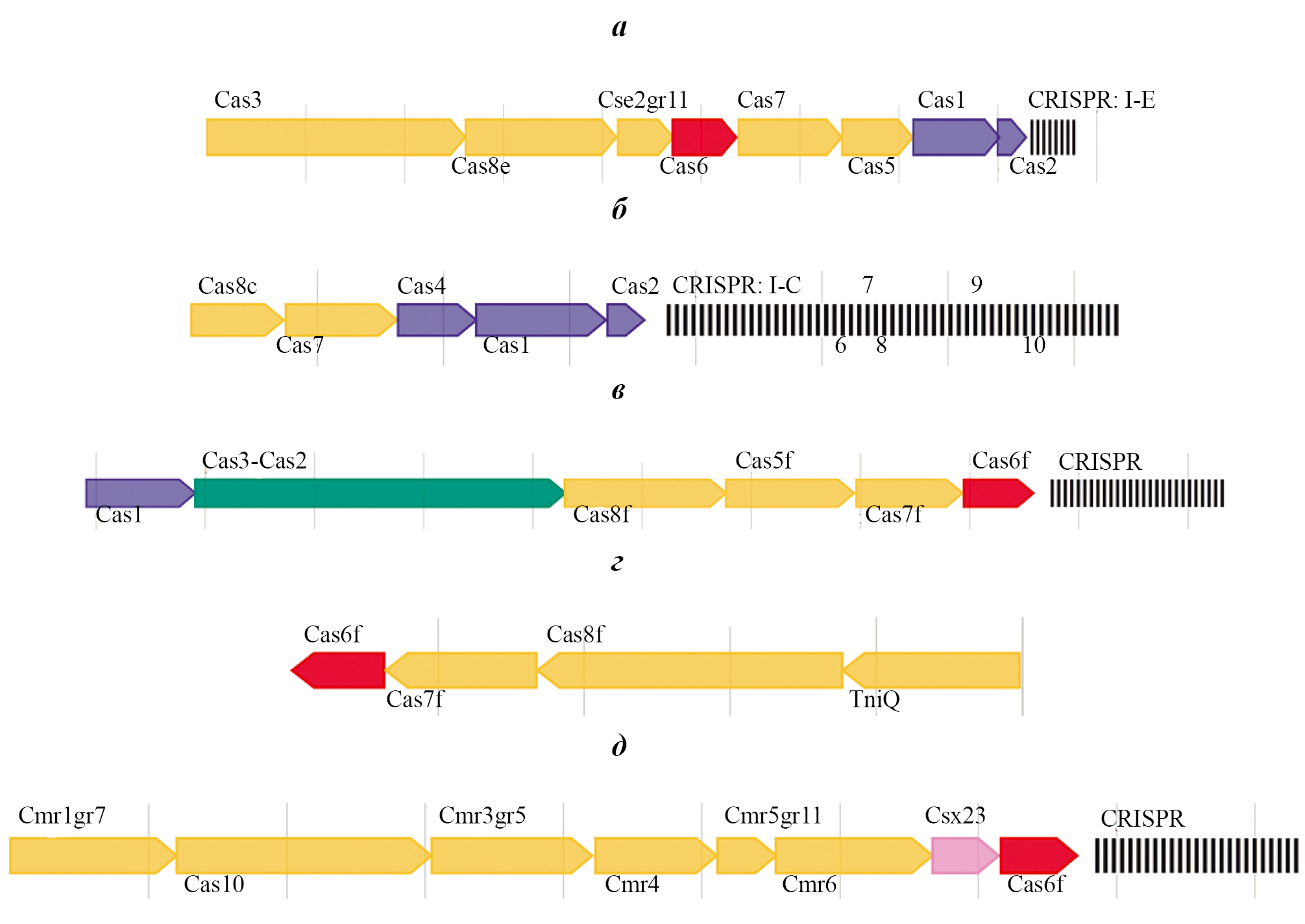
Analysis of the gene structure of antiphage systems of non-toxigenic strains of Vibrio cholerae O1 biovar El Tor
Abstract
Introduction. The presence and structure of antiphage systems that contribute to the resistance of cholera vibrios to lytic phages in non-toxigenic strains of Vibrio cholerae O1 biovar El Tor isolated in the Russian Federation and neighboring countries has not been studied.
The aim of the study is the detection and analysis of antiphage systems of non-toxigenic strains of V. cholerae O1 biovar El Tor.
Materials and methods. The study involved 126 non-toxigenic (ctxAB–tcpA+ and ctxAB–tcpA–) strains of V. cholerae O1 El Tor isolated from 1972 to 2018. DNA sequencing was performed on the MGI DNBSEQ-G50 platform. For bioinformatics analysis, the following programs were used: fastp v. 0.23, unicycler v. 0.4.7, Blast 2.16.0, MEGA X, CRISPRCasty-per and CRISPRCasFinder.
Results. Phage-inducible islands of the PLE, BREX and DISARM systems were not detected in the genome of the studied strains. It was found that 80% of ctxAB–tcpA+ strains contain the type I restriction-modification system, while this system was not detected in ctxAB–tcpA– isolates. The genes of the CBASS system were detected in single strains of both groups. In the genome of 35 (32%) studied ctxAB–tcpA– strains isolated in different regions of the Russian Federation and neighboring countries, the presence of the CRISPR–Cas system of class 1 types I (subtypes I-E, I-F, I-C) and III (subtype III-B) was established. The number of spacers in this system varied from 0 to 80 and their sequence was homologous to the protospacer regions of DNA of lytic and temperate phages, transposons, plasmids of V. cholerae, representatives of the genus Vibrio and unrelated bacteria. The presence in a number of strains of spacers homologous to the genetic material of the phage circulating in endemic territories may indicate the imported nature of these strains.
Conclusion. The heterogeneity of the studied non-toxigenic strains of V. cholerae O1 El Tor in the presence of antiphage systems was revealed, which expands the information on their genetic organization. In their genome, restriction-modification systems of type I (ctxAB–tcpA+), CBASS (ctxAB–tcpA+ and ctxAB–tcpA–) and CRISPR–Cas class 1 types I (subtypes I-E, I-F, I-C) and III (ctxAB–tcpA–) were identified. The detection of several types and subtypes of the CRISPR–Cas system in the genome of a number of ctxAB–tcpA strains may indicate its repeated acquisition through horizontal transfer.
 456-464
456-464


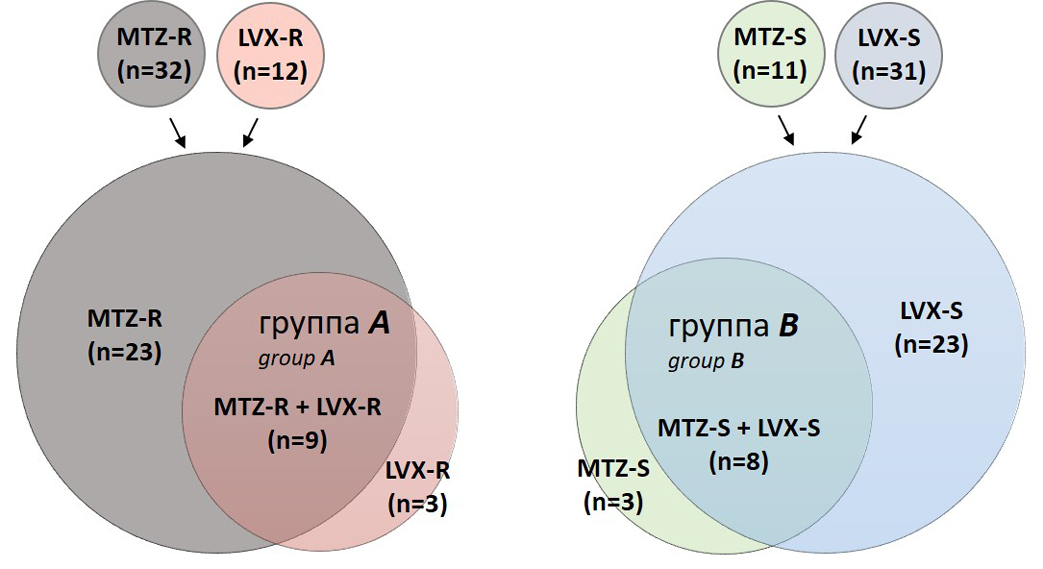
Determinants of resistance to levofloxacin and metronidazole in Russian clinical isolates of Helicobacter pylori based on whole-genome sequencing data
Abstract
Introduction. Helicobacter pylori infection, however, data on the mechanisms of metronidazole (MTZ) and levofloxacin (LVX) resistance in Russia remain scarce. and levofloxacin (LVX) in Russia.
The aim of the study is to identify the determinants of resistance in clinical isolates of H. pylori to MTZ and LVX using whole-genome sequencing data.
Materials and methods. A retrospective analysis of 43 H. pylori isolates obtained from adult patients (2014–2022) was conducted. Susceptibility to antibiotics was determined using the bacteriological disk diffusion method. Whole-genome sequencing of 43 H. pylori strains was performed using a DNBSEQ-G50 sequencer.
Results. The evaluation of the phenotypic drug susceptibility test results showed that 11 isolates were susceptible to MTZ (MTZ-S), 31 were susceptible to LVX (LVX-S), while 32 isolates were resistant to MTZ (MTZ-R), and 12 were resistant to LVX (LVX-R). To identify the association between phenotypic and genotypic resistance, an analysis of nucleotide substitutions in the gyrA, gyrB, rdxA, frxA, fdxB and fur genes was conducted. Of all the mutations identified in the gyrA and gyrB genes, only D91/GNY in the gyrA gene was associated with phenotypic resistance to LVX and was found in 4/12 (33.3%) of the isolates (p < 0.05). The combined mutation D91G/N/Y+N87K in the gyrA gene was detected in 6/12 (50.0%) of LVX-R isolates (p < 0.001). Point mutations in the rdxA gene were detected in 21.9% (7/32) of MTZ-R isolates, leading to a frameshift or premature termination of protein synthesis. None of the mutations in the frxA, fur and fdxB genes were associated with H. pylori resistance to MTZ.
Conclusion. Based on the results of whole-genome sequencing of Russian clinical isolates of H. pylori, the detection of the combined mutation D91G/N/Y+N87K in the gyrA gene can serve as a predictor of the phenotypic resistance of H. pylori to levofloxacin.
 465-473
465-473


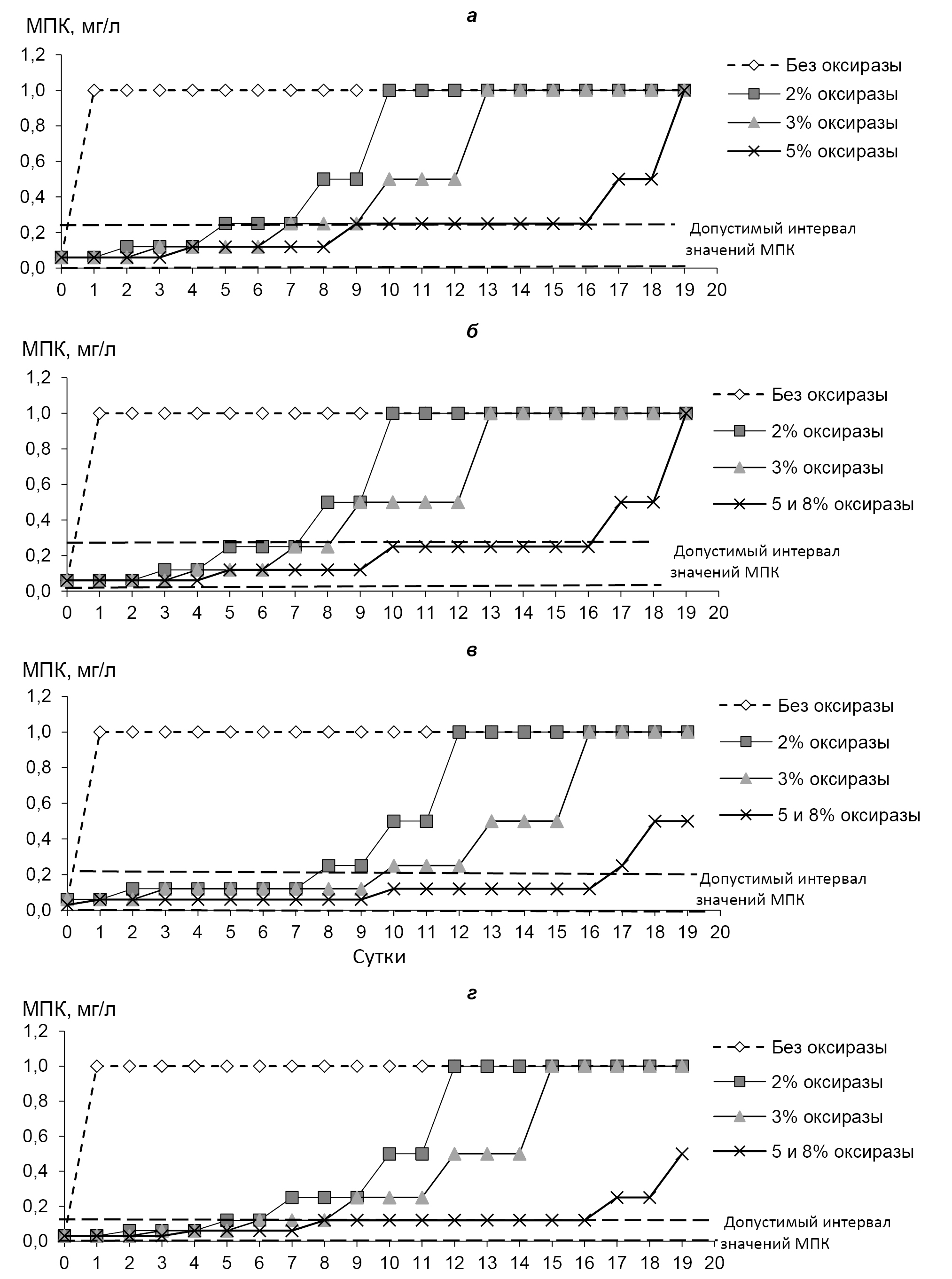
Stabilization of tigecycline solutions during susceptibility testing of microorganisms by broth microdilution method
Abstract
Introduction. Tigecycline is widely used in the treatment of infections, leading to the emergence of resistant bacteria. Determining susceptibility by broth microdilution method is recommended to be conducted using freshly prepared Mueller–Hinton broth (MHB) or MHB with antioxidant additives, due to the oxidation of the antibiotic. At the same time, there is no information on the possibility of storing and further using antibiotic solutions.
The aim of the study is to determine the feasibility of stabilizing and rationally using tigecycline solutions to achieve acceptable values of minimum inhibitory concentrations (MIC) when testing control strains by the reference method.
Materials and methods. In the study, the MIC of tigecycline for Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 29213, Enterococcus faecalis ATCC 29212, and Streptococcus pneumoniae ATCC 49619 was determined using the microdilution method in MHB, which was pre-prepared and stored for 24–48 hours prior to the study. For the study, a tigecycline stock solution was prepared in water with the addition of various concentrations of Оxyrase, which were stored at 2–6°C and –70°C, and then testing was conducted in accordance with GOST R ISO 20776-1-2022.
Results. The stability of the tigecycline stock solutions does not exceed 5 hours at 2–6°C, but with the addition of 5.0–8.0% Оxyrase, it increases to 16 days, allowing for the determination of MIC values for all test strains within the acceptable range. Changing the storage temperature to –70°C increases the stability of the solutions to 43 days, and with the addition of 5.0–8.0% Оxyrase, to at least 48 weeks
Conclusion. The possibility of stabilizing tigecycline solutions stored at negative temperatures (with and without the addition of Оxyrase) has been determined to obtain acceptable MIC values when determining the susceptibility of control strains to antimicrobial agents. The use of these solutions allowed for a reduction in testing costs through the rational use of the antibiotic.
 474-481
474-481


REVIEWS
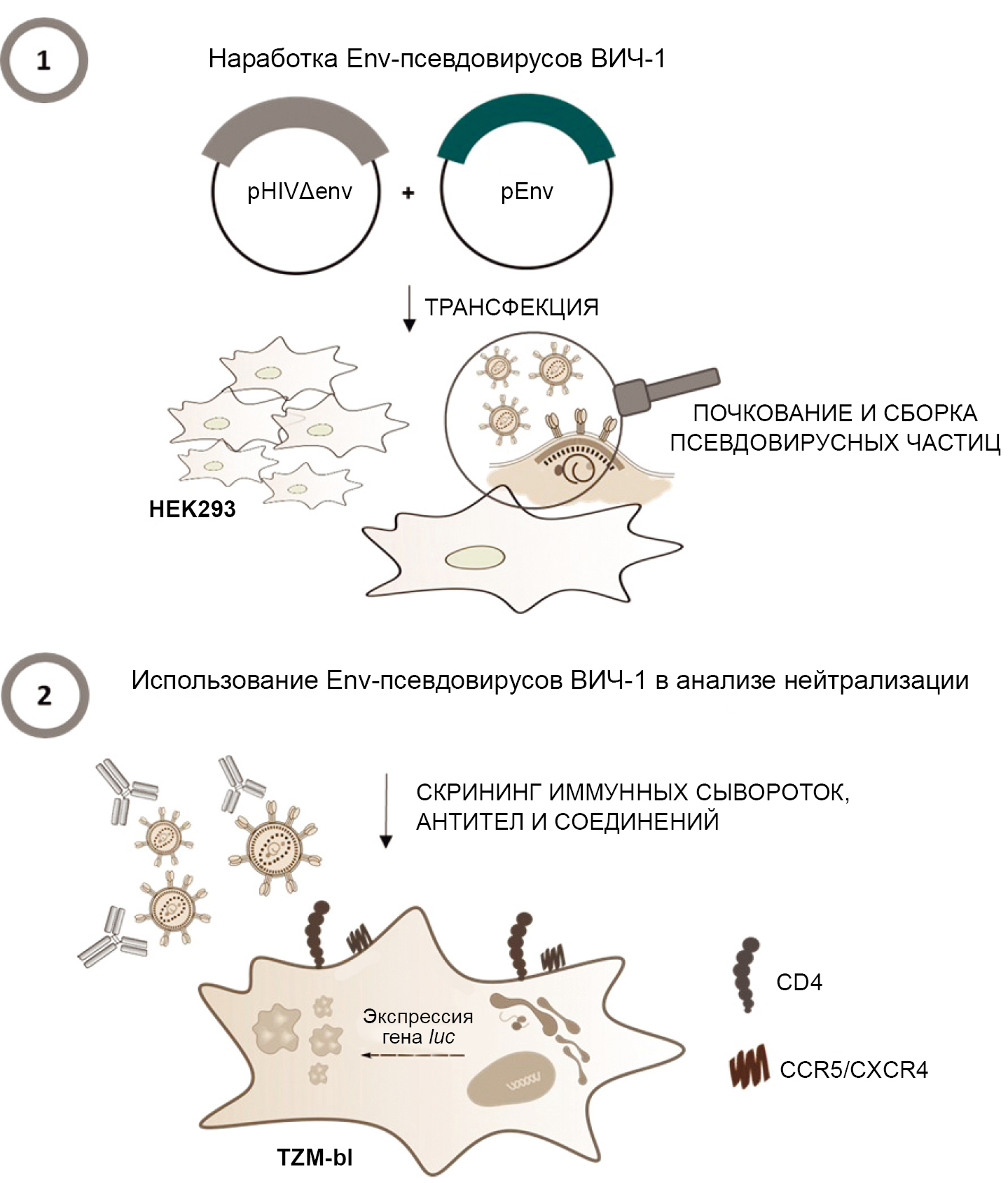
Application of the pseudovirus-based neutralization assay in the search for new antiviral drugs
Abstract
In recent years, significant progress has been made in the field of drug development, particularly due to the use of computer modeling methods. One of the key stages in the development of new antiviral drugs is testing the efficacy of promising candidates in in vitro experiments using target viruses. The application of new technologies for conducting primary screening with pseudotyped viruses simplifies research, increases its efficiency and ensures the biosafety of the conducted studies.
The aim of this review is to analyze previous studies that have demonstrated the successful use of pseudovirus technology for the search of new chemotherapeutic agents against a range of RNA-containing viruses.
The analysis involved the literature presented in the PubMed, Scopus, Elsevier, and Google Scholar databases as of March 1, 2025. For the search, the following keywords were used: pseudovirus, virus inhibition, antiviral drugs, RNA viruses.
Pseudotyped viruses are recombinant viral particles that have the core proteins of one virus and the surface proteins of another, studied virus. The advantages of pseudovirus technology are its safety, high level of reproducibility of results, and the possibility of standardization. The lentivirus-based system was one of the first to be developed and remains one of the most in-demand. Using pseudoviruses, candidate molecules for infections caused by RNA-containing viruses, such as HIV-1, hepatitis C virus, tick-borne encephalitis virus, avian influenza viruses, and SARS-CoV-2, have been selected and studied. Most of the selected drugs act at the initial stage of the virus entry into the target cell. The examples provided illustrate the significant contribution of pseudovirus technology in dealing with serious socially significant diseases caused by RNA-containing viruses.
 482-494
482-494


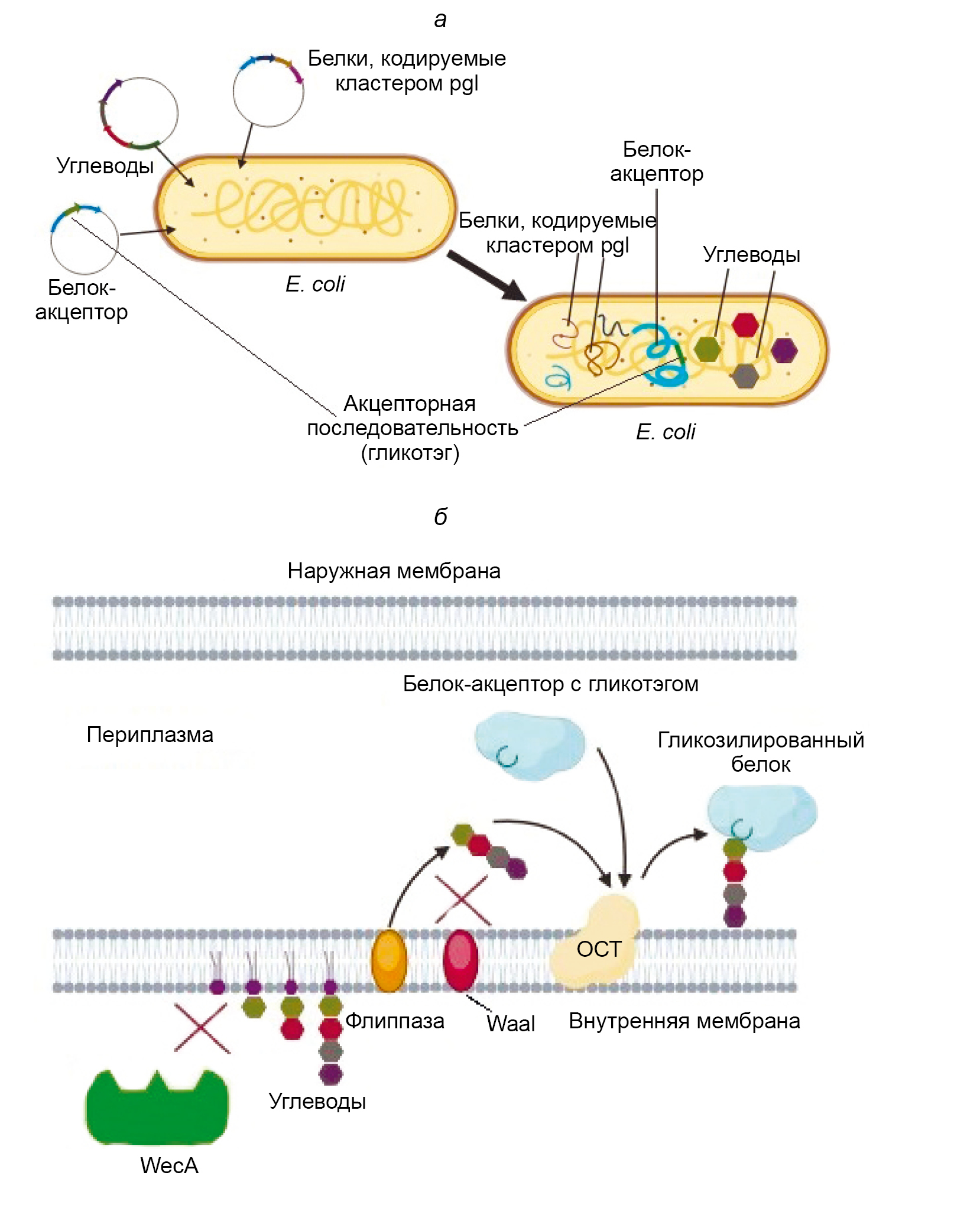
Bioconjugation as a promising method for vaccine development
Abstract
Introduction. Bioconjugation, or protein glycan coupling technology, PGCT, is a method for creating carbohydrate-protein composites based on the ability of certain bacteria to perform eukaryotic-type glycosylation. This method allows for the production of glycoproteins directly in the cells of producer bacteria, most often Escherichia coli, bypassing the stage of chemical conjugation. This significantly simplifies the creation and production of conjugated vaccines, consisting of polysaccharide antigens combined with a protein carrier that performs the functions of a T-cell antigen and an adjuvant.
The aim of the review is to analyze and summarize current data on both the bioconjugation method itself and the underlying biochemical processes, as well as on the vaccines being developed using this method.
The preparation of the review involved studies presented in the PubMed, Scopus, Google Scholar, eLIBRARY.RU databases as of February 2025. The following keywords were used for the search: bioconjugation, vaccines, PGCT, conjugated vaccines, bacterial glycosylation.
An analysis of literature sources dedicated to the study of bacterial N-glycosylation, on the basis of which the bioconjugation technology was developed, as well as similar processes occurring in certain bacterial species, was conducted. Reports on the development of new vaccines and the improvement of existing vaccines against the most relevant pathogens have been analyzed. At present, vaccination appears to be the most effective way to combat infectious diseases, including efforts to counter the spread of antibiotic-resistant microorganisms. The diversity of pathogens encountered by the human population compels the search for multiple approaches of creating effective and safe vaccines. Simplifying and reducing the cost of producing new drugs allows for a more confident response to the threat of new epidemics. Bioconjugation helps create new vaccines and improve existing vaccines, although there are certain limitations.
Conclusion. Modern vaccine production is characterized by a variety of approaches united by a single goal — to effectively counter the threats of new epidemics. Bioconjugation is one of the new, yet quite promising methods through which several vaccine candidates are already being developed. The analysis of the current state of these projects may be useful in choosing an approach for developing subsequent preventive immunological drugs.
 495-506
495-506


ANNIVERSARIES
 507-508
507-508