Immunological and epidemiological effectiveness of pediatric vaccination against hepatitis A using a single dose of inactivated vaccine
- Authors: Lopatukhina M.A.1,2, Kyuregyan K.K.1,2,3, Mikhailov M.I.1,2,4
-
Affiliations:
- Central Research Institute of Epidemiology
- Mechnikov Research Institute for Vaccines and Sera
- Russian Medical Academy of Continuous Professional Education
- Belgorod National Research University
- Issue: Vol 102, No 5 (2025)
- Pages: 626-634
- Section: REVIEWS
- URL: https://microbiol.crie.ru/jour/article/view/18910
- DOI: https://doi.org/10.36233/0372-9311-682
- EDN: https://elibrary.ru/USUKRM
- ID: 18910
Cite item
Abstract
Hepatitis A is an acute liver disease caused by the hepatitis A virus (HAV), which can be prevented by means of vaccination. The standard hepatitis A vaccination schedule consists of two doses of inactivated vaccine, but for economic reasons and the purpose of improving vaccination coverage, universal pediatric single-dose vaccination programs have been implemented in certain regions of the world.
The aim of this review is to summarize and analyze published data on the duration of protective antibody levels after a single-dose pediatric immunization, as well as hepatitis A incidence in countries where hepatitis A vaccination is carried out using a single dose of inactivated vaccine.
Recent data from different regions of the world, including the Russian Federation, support the effectiveness of the single-dose hepatitis A vaccination strategy, both in terms of the duration of the immune response and the impact on the incidence rates. However, further studies on the long-term effectiveness of single-dose immunization with inactivated vaccine, as well as continuous hepatitis A surveillance, are necessary to assess the duration of protection and the necessity for booster vaccination later in life
Full Text
Introduction
Hepatitis A is an acute liver disease caused by the hepatitis A virus (HAV) that can be prevented through vaccination. There are two types of vaccines against hepatitis A: live attenuated vaccines used in China [1] and inactivated vaccines available worldwide [2]. Targeted immunization of at-risk groups is effective in preventing sporadic cases and small outbreaks of hepatitis A, but it does not lead to the formation of a significant herd immunity; therefore, it is ineffective in terms of reducing the incidence of hepatitis A among the general population [3]. It has been proven that the strategy of universal vaccination of toddlers provides significant epidemiological and economic benefits in regions with transitional endemicity from high to medium regarding hepatitis A. In such regions, the HAV circulation among children decreases due to improved sanitary conditions, resulting in an increased proportion of susceptible adolescents and adults. Since HAV infection in children under 5 years old is usually asymptomatic, and the proportion of clinically apparent cases increases with age, this leads to an overall increase in the number of clinically significant and severe cases of the disease. According to the recommendations of the World Health Organization (WHO), a significant number of countries have included universal two-dose vaccination against HAV in their national pediatric immunization programs (Israel, Panama, Turkey, Greece, Kazakhstan, Mongolia, South Korea, Australia, Saudi Arabia, Qatar, and Bahrain) or have implemented regional programs for specific parts of the country (Russia, the USA, China, Italy) [4].
The standard immunization schedule for inactivated vaccines against hepatitis A consists of two doses administered at 6-month intervals and ensures the production of protective levels of antibodies to HAV (anti-HAV) that persist for decades [5]. For economic reasons and for the purpose of increasing vaccination coverage in certain countries, a single-dose vaccination against hepatitis A was implemented. For the first time, universal single-dose vaccination of toddlers was conducted in Argentina in 2005 [6]. In 2013, the Republic of Korea also introduced a single-dose vaccination for military personnel [7]. In 2014, Brazil began mass vaccination of children over 12 months old using a single dose of the vaccine [8]. Subsequently, this lead to more countries preferring single-dose immunization when conducting universal vaccination of children against hepatitis A (Chile, Paraguay, Colombia, Mexico, Canada (Quebec), Tunisia, Turkmenistan) [4].
Based on the experience of Argentina and in accordance with WHO recommendations, since August 2012, the Republic of Tuva (Russian Federation) has been conducting universal vaccination against hepatitis A for children aged 3 years and older with single-dose immunization [9]. Since the duration of immune protection with the administration of only a single dose of the vaccine remains a concern, countries that have implemented single-dose immunization against the disease continue to monitor the epidemiological and immunological effectiveness of this vaccination strategy.
The aim of this review is to summarize and analyze published data on the duration of protective antibody levels after a single immunization of children, as well as on the incidence of disease in countries where vaccination against hepatitis A is conducted with single-dose immunization.
Duration of protective immunity after administration of a single dose of inactivated hepatitis A vaccine in individual cohorts
Data on the immunogenicity of inactivated vaccines against hepatitis A support the possibility of a single-dose immunization. Thus, 2–4 weeks after the administration of the first dose of inactivated vaccine, anti-HAV IgG antibodies at titers above 20 mIU/ml (the level considered protective) are produced in 100% of immunocompetent children and young adults [10]. Moreover, a single administration of inactivated vaccine successfully suppresses outbreaks of hepatitis A and prevents the disease in contact individuals [11]. The notion of the necessity of administering a booster dose of inactivated vaccine against hepatitis A was initially based on assumptions about the decline of antibody levels over time. However, long-term observations conducted among Europeans vaccinated before traveling to endemic regions have demonstrated the maintenance of protective anti-HAV levels for at least 4–11 years after the administration of the first dose of the vaccine [12]. The first randomized trials of immunization using a single dose of inactivated vaccine against hepatitis A were conducted in 2003 in Nicaragua [13]. The study included 239 children aged 1.5 to 6.0 years, negative for anti-HAV antibodies, with a follow-up period of 18 months. Cases of hepatitis A infection, confirmed by the detection of anti-HAV IgM antibodies, were recorded in 4 children in the vaccinated group and in 22 children who did not receive the vaccine. All 4 cases of hepatitis A infection in vaccinated children occurred within the first 6 weeks after immunization, indicating infection before vaccination or in the first few days after the procedure. Thus, the protective efficacy of vaccination with single dose was 85% in the first 6 weeks and 100% 6 weeks post-immunization. In a study conducted in Thailand, the immunogenicity of a single dose of the vaccine was evaluated after 18 months of observation among 193 healthy children, with the proportion of individuals with protective levels of anti-HAV antibodies being 98%, and the geometric mean titer (GMT) of antibodies not differing from the level observed 6 months after the administration of the first dose of the vaccine [14]. In a study conducted in Argentina involving 546 healthy children, protective levels of anti-HAV antibodies were observed in 99.7% of participants three years after a single-dose immunization, and in 100% after the standard two-dose immunization schedule [15]. It should be noted that in this study, a protective concentration of anti-HAV antibodies was accepted as 10 mIU/ml, rather than 20 mIU/ml, in accordance with the revised stance of the expert community on the minimum protective concentration of anti-HAV antibodies [16].
In two studies, a direct comparison of immunogenicity and the duration of protective antibody levels was conducted when administering 1 or 2 doses of inactivated vaccine against hepatitis A to children. In the first study, 8 years after vaccination, differences were noted both in the frequency of detecting protective levels of anti-HAV in one- and two-dose immunization schemes (74.3% vs. 97.7%) and in GMT values (123.9 vs. 40.2 mIU/ml) [17]. In the second study, 100% and 96.7% of participants who received a double and single dose of inactivated vaccine against hepatitis A, respectively, had protective levels of anti-HAV seven years after vaccination, but the GMT levels were higher among those who received 2 doses of the vaccine (712.5 vs. 125.6 mIU/ml) [18].
Thus, data on the duration of anti-HAV persistence in individual cohorts after a single administration of the inactivated HAV vaccine against hepatitis A allowed for the consideration of the possibility of applying such a single-dose strategy in the implementation of mass vaccination programs against hepatitis A.
Immunological efficacy of a single-dose vaccination against hepatitis A in universal immunization programs
Argentina was the first country in the world to implement universal vaccination against hepatitis A using a single dose of the vaccine in 2005, after a nationwide outbreak in 2003–2004. Vaccination is carried out among children aged 12 months and older, and since 2006, vaccination coverage has exceeded 90%, with the average coverage rate across the country from 2006 to 2011 being 96.8% (77–100%). Only in 3 out of 24 provinces during this period did coverage not exceed 90% [19, 20]. After the campaign began, the Ministry of Health of Argentina organized continuous and intensified monitoring for hepatitis A incidence and post-vaccination immunity levels [21]. Among children examined 4 years after a single immunization at 12 months of age, a protective antibody level (10 mIU/ml and above) was found in 93% of cases [20]. Based on these results, in April 2012, the WHO Strategic Advisory Group of Experts on Immunization concluded that national immunization programs could consider including single-dose immunization schedules using inactivated vaccine against hepatitis A in their immunization schedules as an acceptable alternative to the standard two-dose regimen, while regional health authorities should regularly monitor long-term immunological protection with the single-dose vaccination schedule [22]. In accordance with this recommendation, the Ministry of Health of Argentina conducted a second study in 2013 to assess the long-term prevalence of protective antibodies among 1,088 children on average 7.7 years (6.3–9.2 years) after single-dose immunization at 12 months of age. In 97.4% of the study participants, the concentration of anti-HAV antibodies was ≥ 10 mIU/ml, and the GMT was 170.5 mIU/ml [23]. Currently, based on the experience in Argentina, there is data on the maintenance of protective levels of anti-HAV antibodies for up to 12 years after a single immunization. The level of seroprotection after 12 years was 93%, although these data were obtained from a very small cohort of 27 children [24].
The data obtained in Brazil as a result of the implementation of a child immunization program using single dose of inactivated vaccine against hepatitis A, initiated in 2014, also indicate the immunological effectiveness of this approach. Thus, 6–7 years after immunization, the level of seroprotection was 64.2% [25], while the proportion of seropositive individuals in the cohort examined 1 month after immunization was 93.6% [26].
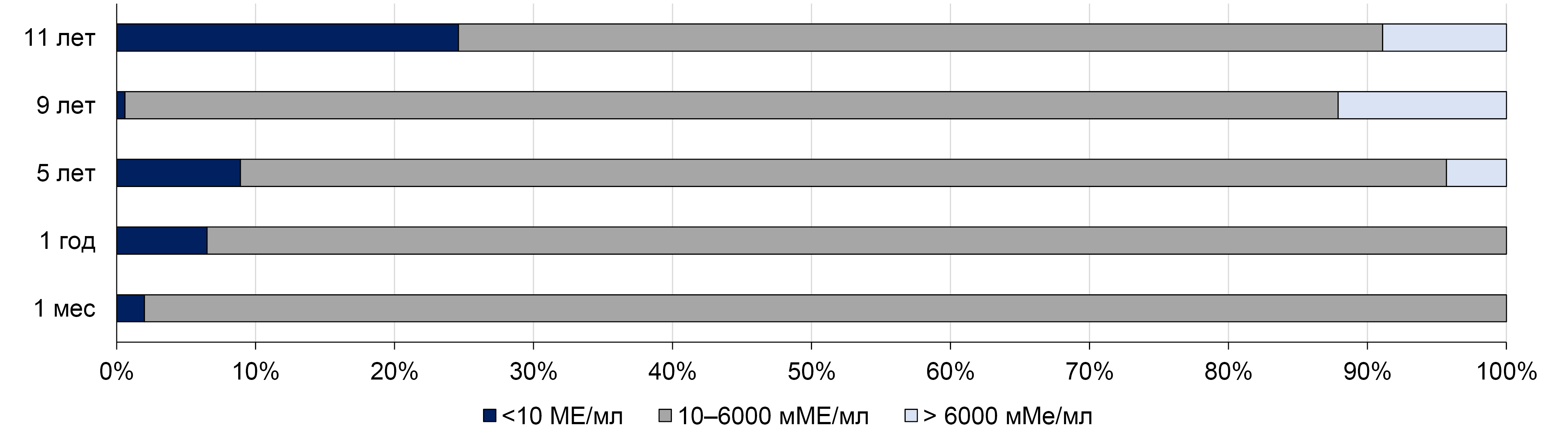
Priority data on the duration of anti-HAV antibody persistence after a single immunization were obtained in one of the regions of the Russian Federation — the Republic of Tuva. Since 2012, in the Republic of Tuva, where the incidence of hepatitis A during the pre-vaccination period exceeded the national average by 10–15 times, a universal single vaccination against hepatitis A for children aged 3 years and older has been conducted. By the end of 2012, 65,097 children received a single immunization, resulting in a coverage rate of 87.4% for children aged 3 to 8 years [9]. Since then, vaccination against hepatitis A has been included in the regional vaccination schedule of Tuva for children aged 3 years and older. The immunological efficacy of a single immunization of children in Tuva was assessed in 5 independent cohorts, examined 1 month, 1, 5, 9 and 11 years after vaccination [9, 27]. The results obtained in these studies are summarized in Fig. 1.
Fig. 1. The proportion of children with different concentrations of anti-HAV antibodies after a single-dose vaccination against hepatitis A in the Republic of Tuva [27].
Protective concentrations of anti-HAV antibodies (10 mIU/ml and above) were detected in 98.0% of those examined 1 month after a single immunization, in 93.5%, 91.1%, 99.4%, and 75.4% of children 1, 5, 9 and 11 years after a single immunization, respectively [9, 27]. Differences in seroprotection rates between cohorts examined 1, 5 and 9 years after vaccination were not statistically significant, although the observed decrease in the frequency of detecting protective levels of anti-HAV antibodies was statistically significant compared to the cohort examined 1 month after vaccination. In the cohort examined 11 years after a single-dose immunization, the decrease in the frequency of detecting protective antibody levels was statistically significant compared to previous years. The values of anti-HAV GMT were also similar in cohorts examined at 1, 5 and 9 years (449.6, 577.3, and 1446.3 mIU/ml, respectively; p > 0.05), but a significant decrease was noted in the cohort examined 11 years after vaccination (282.6 mIU/ml; p < 0.05) [27].
Data on the duration of protective anti-HAV antibody levels after single-dose immunization within mass vaccination programs are summarized in Table 1. Taken together, these data suggest that humoral immunity to HAV after a single-dose vaccination may decline more rapidly compared to the standard two-dose vaccination schedule, which provides seroprotection in over 90% of vaccinated children for up to 15 years [2, 28]. However, it should be noted that a decrease in humoral immunity does not necessarily indicate a lack of potential protection against hepatitis A. A study of the HAV-specific T-cell response in children under 12 years of age after a single-dose vaccination demonstrated the presence of CD4+ and CD8+ memory T-cells in 53.8% and 26.9% of seronegative children, respectively [24]. Similarly, the production of interferon-γ in peripheral blood mononuclear cells stimulated by the VP1 antigen of HAV was observed in 32.4% of seronegative children 6–7 years after a single dose of the inactivated vaccine, indicating the presence of cell-mediated immune memory [25].
Table 1. Persistence of protective levels of antibodies to HAV after a single dose of inactivated vaccine during mass immunization of children
Country/Region | Maximum duration of surveillance, years | Proportion of individuals with protective levels of anti-HAV antibodies, % | Reference |
Argentina | 4 years | 93.0 | [20] |
7,7 years | 97.4 | [23] | |
12 years | 93.0 | [24] | |
Brazil | 7 years | 64.2 | [25] |
Russian Federation (Tuva Republic) | 5 years | 91.1 | [9] |
9 years | 99.4 | [27] | |
11 years | 75.4 | [27] |
Epidemiological effectiveness of single-dose vaccination against hepatitis A in universal immunization programs
The epidemiological effectiveness of universal vaccination programs for children against HAV, implemented using the standard two-dose immunization schedule, assessed by the reduction in registered incidence rates, number of hospitalizations, HAV-associated mortality, and the number of HAV-positive environmental samples, is well-known and documented in all countries that have implemented such programs [2, 4]. Data on the epidemiological effectiveness of vaccination programs against HAV using single-dose immunization are presented in Table 2.
Table 2. Epidemiological effectiveness of vaccination programs using a single dose of inactivated vaccine against hepatitis A
Year of implementation | Country /Region | Groups under vaccination | Efficiency | Reference |
2005 | Argentina | Children ≥ 12 months of age | Reduction in incidence by 88% from 2006 to 2011; disappearance of cases of fulminant hepatitis A | [29] |
2012 | Russian Federation (Tuva Republic) | Children ≥ 3 years of age | Reduction in incidence in 2013 by an average of 96.7% and by 96.9% among children. The absence of registered cases of the disease since 2016 | |
2013 | Republic of Korea | Military personnel | Reduction in incidence by 75.9% after 1.5–2.0 years of implementation | [7] |
2014 | Brazil | Children 15-24 months of age | The reduction in incidence during 2014–2016 was on average by 85.5%, and by 96.8% among children. | [8] |
In Argentina, which introduced single-dose vaccination in 2005, the incidence of HAV decreased by ≥ 88.0%, from 66.5 (in 2000–2002) to 7.9 (in 2006–2011) cases per 100,000 population, with an average vaccination coverage of 96.8% in 2006–2011. Moreover, from 2007 to 2022, no cases of fulminant hepatitis or liver transplantation associated with HAV were recorded, despite HAV being the main cause of fulminant hepatitis and liver transplantation in children during the pre-vaccination period [29]. In Brazil, where universal vaccination of children with a single dose of the hepatitis A vaccine was implemented in 2014, vaccination coverage varied from 60.1% to 97.1% in 2014–2017. The recorded annual incidence rates of hepatitis A decreased from 3.02–3.48 cases per 100,000 people in 2010–2013 to 0.47–1.46 cases per 100,000 population in 2015–2017. From 2014 to 2016, the overall reduction in hepatitis A cases in Brazil was 85.5%. The most significant decrease in the incidence of hepatitis A was observed among children under 14 years of age, but a decrease was also observed in other age groups [8].
In the Republic of Korea, single-dose immunization against hepatitis A was implemented for military personnel starting in 2013. To evaluate the effectiveness of this vaccination program, the incidence of hepatitis A among vaccinated and unvaccinated military personnel during the implementation period of the vaccination, from 2013 to 2016, was analyzed. Among vaccinated military personnel, the incidence was 3 cases per 603,550 people per year, while among unvaccinated personnel, it was 21 cases per 1,020,450 people per year (which corresponds to 0.5 versus 2.06 per 100,000 population). Thus, the effectiveness of single-dose immunization against HAV was 75.85% [7].
The incidence of hepatitis A in Tuva during the pre-vaccination period (2001–2012) was the highest in Russia, with the majority of cases being registered among children and adolescents under 18 years old. In this group, peak incidence rates reached 450–860 cases per 100,000 population (Fig. 2). After the introduction of single-dose immunization for children in 2012, the incidence sharply decreased to 7.5 cases per 100,000 people among children and adolescents under 18 years old and to 3.2 cases per 100,000 people in the general population one year after the start of the vaccination program. Since 2016, no cases of hepatitis A have been registered in the region, not only among vaccinated children but also among unvaccinated adults.
Fig. 2. The incidence of hepatitis A in the Republic of Tuva and the national average for 2001–2023 among the general population (a), children aged 0–14 (b) and 0–17 years (c) [27].
It should be noted that from 2013 to 2023, against the background of practically nonexistent incidence of hepatitis A in Tuva, neighboring regions recorded significant incidence rates of hepatitis A, which confirms that the decrease in incidence in Tuva is not a result of reduced HAV circulation throughout the Siberian Federal District. Thus, in 2013–2023, the incidence of hepatitis A ranged from 0.1 to 6.48 per 100,000 population in the Republic of Buryatia, from 0.19 to 34.55 in the Republic of Khakassia, from 0.04 to 9.83 in the Irkutsk region, and from 0.0 to 34.93 in the Krasnoyarsk Krai [27]. Moreover, the high annual incidence rates of enterovirus infections and shigellosis recorded in Tuva from 2013 to 2023 indicate the persistence of sanitary unsafety in the region [27]. These data indicate that the decrease in the hepatitis A incidence observed in Tuva from 2013 to 2023 was not related to improvements in sanitary conditions, but was a result of the vaccination prevention program.
The frequency of detecting HAV RNA in environmental samples (wastewater, open water bodies) is an important indicator reflecting the intensity of virus circulation and, therefore, represents a crucial criterion for the epidemiological effectiveness of HAV vaccination. It is expected that a significant reduction in the number of symptomatic hepatitis A infections will be accompanied by a decrease in the detection rates of hepatitis A in wastewater. However, the monitoring of HAV RNA in wastewater and various open water bodies in Tuva, conducted in 2021–2023, confirmed the continued presence of the virus in the environment [27]. Moreover, phylogenetic analysis confirmed that the sequences of the virus isolated from water samples in Tuva in 2021 and 2022 belonged to a group of genetic variants that were isolated from patients in this region in 2008 (pre-vaccination period), suggesting the stable circulation of this particular variant of the virus. However, in 2023, another variant of HAV, closely related to sequences isolated in various regions of Russia from 2019 to 2023, including the Irkutsk region bordering Tuva, was detected in wastewater and environmental samples [27]. This finding confirms the presence of a new strain in Tuva.
Based on the presented data, it cannot be definitively stated that the single vaccination strategy led to a decrease in the frequency of detecting HAV RNA in wastewater samples in Tuva, as such monitoring had not been conducted in the region before. However, in 2002–2004, wastewater samples in Tuva were tested for the HAV antigen, resulting in a positive rate of 12.5–63.3% [30]. Considering that the average proportion of samples positive for HAV RNA in 2021–2023 was below 2.5%, it can be assumed that vaccination has indeed led to a significant reduction in virus shedding in the region.
During the monitoring of HAV RNA in environmental objects in Argentina, conducted in 2009–2010 and 2017–2022, a constant presence of HAV RNA in wastewater was also detected [31, 32]. However, unlike Tuva, the detection of HAV RNA in wastewater samples in Argentina correlates with cases of acute hepatitis A [33].
A possible explanation for the continued shedding of the virus in Tuva and its detection in environmental samples and wastewater, despite the absence of reported cases of acute hepatitis A, may be related to the age of the vaccinated children. It is evident that the detection of the virus in the absence of registered cases of the disease is most likely indicative of the presence of an asymptomatic infection, as HAV infection in children under 5 years old most often occurs asymptomatically [23]. In most countries that have implemented universal vaccination against hepatitis A, immunization of children is carried out at the age of 12 months and older [2]. However, in Tuva, a single-dose vaccination for children aged 3 years and older has been implemented, primarily in order to be able to use a domestic vaccine against hepatitis A, licensed for children aged 3 years and older. Thus, children under 3 years of age are not immunized and remain susceptible to HAV.
The most likely hypothesis explaining the persistence of HAV circulation in the absence of symptomatic cases is the transmission of the virus among children under 3 years of age. Confirmation of the hidden circulation of HAV in Tuva is also evidenced by the increasing proportion over time of individuals with high (above 6000 mIU/ml) concentrations of anti-HAV antibodies [27], which indicates the boosting of the post-vaccination humoral response upon encountering the virus.
The accumulated experience to date of using single immunization in the implementation of hepatitis A vaccination programs has demonstrated the high epidemiological effectiveness of this approach and the preservation of immunological effectiveness for at least a decade. At the same time, those who received a single dose of inactivated vaccine against hepatitis A in childhood may require revaccination in adulthood, considering the lack of actual data or mathematical modeling results on the preservation of humoral immunity for decades after such a vaccination scheme. Moreover, although it is believed that the standard two-dose immunization provides immunity to HAV that lasts for decades or even a lifetime, rare cases of infection in at-risk adults who were vaccinated in childhood have been described. In such patients, the presence of low levels of post-vaccination antibodies did not protect against infection with a high dose of the virus, but it did provoke the selection of viral genetic variants carrying changes in immunogenic epitopes, indicating immune evasion [35]. These cases, rare and atypical for hepatitis A, nevertheless suggest that the combination of waning post-vaccination immunity and a high dose of the virus may lead to an outbreak of hepatitis A infection and the emergence of mutant virus variants. In this regard, the consequences of the accumulation of individuals with low levels of anti-HAV antibodies in the population as a result of single-dose immunization during childhood are not entirely clear. Nevertheless, these potential risks do not outweigh the obvious advantages of mass vaccination programs against hepatitis A with single-dose immunization: the ability to quickly control the incidence of hepatitis A, as well as the economic and logistical efficiency of such an approach.
Conclusion
Mass vaccination programs against hepatitis A, based on the standard two-dose immunization schedule, have long proven their effectiveness, the ability to induce long-lasting immunity lasting at least 15 years, and have led to the control of hepatitis A in many countries. Significantly less data is available on the immunological and epidemiological effectiveness of universal vaccination programs against hepatitis A using a single dose of inactivated vaccine. Data from recent years, obtained in various regions of the world, including Russia, confirm the effectiveness of such a vaccination strategy against hepatitis A both in terms of the immunological response and in terms of its impact on the levels of reported morbidity. However, to assess the duration of protection and the need for revaccination at a later stage in life, further studies on the long-term effectiveness of vaccination strategies with single-dose immunization, as well as continuous surveillance of hepatitis A, are necessary.
About the authors
Mariya A. Lopatukhina
Central Research Institute of Epidemiology; Mechnikov Research Institute for Vaccines and Sera
Author for correspondence.
Email: lopatukhina@cmd.su
ORCID iD: 0000-0001-6853-4154
researcher, Laboratory of molecular epidemiology of viral hepatitis, Central Research Institute of Epidemiology; researcher, Laboratory of viral hepatitis, I.I. Mechnikov Research Institute for Vaccines and Sera
Russian Federation, Moscow; MoscowKaren K. Kyuregyan
Central Research Institute of Epidemiology; Mechnikov Research Institute for Vaccines and Sera; Russian Medical Academy of Continuous Professional Education
Email: kyuregyan@yandex.ru
ORCID iD: 0000-0002-3599-117X
Dr. Sci. (Biol.), Professor of the RAS, Head, Laboratory of molecular epidemiology of viral hepatitis, Central Research Institute of Epidemiology; leading researcher at the Laboratory of viral hepatitis, I.I. Mechnikov Research Institute for Vaccines and Sera
Russian Federation, Moscow; Moscow; MoscowMikhail I. Mikhailov
Central Research Institute of Epidemiology; Mechnikov Research Institute for Vaccines and Sera; Belgorod National Research University
Email: michmich2@yandex.ru
ORCID iD: 0000-0002-6636-6801
Dr. Sci. (Med,), Full Member of the RAS, chief researcher, Laboratory of molecular epidemiology of viral hepatitis, Central Research Institute of Epidemiology; Head, Laboratory of viral hepatitis, I.I. Mechnikov Research Institute for Vaccines and Sera; Professor, Department of epidemiology, Belgorod State National Research University
Russian Federation, Moscow; Moscow; BelgorodReferences
- Guo Y., Zhang L., Feng D., et al. The impact of universal live attenuated hepatitis A vaccines in Henan, China, 2005–2018. Int. J. Infect. Dis. 2020;93:163–7. DOI: https://doi.org/10.1016/j.ijid.2020.02.001
- Stuurman A.L., Marano C., Bunge E.M., et al. Impact of universal mass vaccination with monovalent inactivated hepatitis A vaccines — A systematic review. Hum. Vaccin. Immunother. 2017;13(3):724–36. DOI: https://doi.org/10.1080/21645515.2016.1242539
- Lemon S.M., Ott J.J., Van Damme P., Shouval D. Type A viral hepatitis: A summary and update on the molecular virology, epidemiology, pathogenesis and prevention. J. Hepatol. 2017:S0168-8278(17)32278-X. DOI: https://doi.org/10.1016/j.jhep.2017.08.034
- Andani A., van Damme P., Bunge E.M., et al. One or two doses of hepatitis A vaccine in universal vaccination programs in children in 2020: A systematic review. Vaccine. 2022;40(2):196–205. DOI: https://doi.org/10.1016/j.vaccine.2021.01.038
- Theeten H., Van Herck K., Van Der Meeren O., et al. Long-term antibody persistence after vaccination with a 2-dose Havrix (inactivated hepatitis A vaccine): 20 years of observed data, and long-term model-based predictions. Vaccine. 2015;33(42):5723–7. DOI: https://doi.org/10.1016/j.vaccine.2015.07.008
- Espul C., Benedetti L., Cuello H., et al. Persistence of immunity from 1 year of age after one or two doses of hepatitis A vaccine given to children in Argentina. Hepat. Med. 2012;4:53–60. DOI: https://doi.org/10.2147/HMER.S33847
- Im J.H., Woo H.T., Ha B., Jung J. Effectiveness of single‐dose administration of inactivated hepatitis A virus vaccination in the Republic of Korea armed forces, 2013‐2016. J. Viral. Hepat. 2020;27(5):537–9. https://doi.org/10.1111/jvh.13249
- Souto F.J.D., de Brito W.I., Fontes C.J.F. Impact of the single-dose universal mass vaccination strategy against hepatitis A in Brazil. Vaccine. 2019;37(6):771–5. DOI: https://doi.org/10.1016/j.vaccine.2018.12.054
- Mikhailov M.I., Lopatukhina M.A., Asadi Mobarhan F.A., et al. Universal single-dose vaccination against hepatitis A in children in a region of high endemicity. Vaccines (Basel). 2020;8(4):780. DOI: https://doi.org/10.3390/vaccines8040780
- Schmidtke P., Habermehl P., Knuf M., et al. Cell mediated and antibody immune response to inactivated hepatitis A vaccine. Vaccine. 2005;23(44):5127–32. DOI: https://doi.org/10.1016/j.vaccine.2005.06.022
- Zamir C., Rishpon S., Zamir D., et al. Control of a community-wide outbreak of hepatitis A by mass vaccination with inactivated hepatitis A vaccine. Eur. J. Clin. Microbiol. Infect. Dis. 2001;20(3):185–7. DOI: https://doi.org/10.1007/s100960100461
- Iwarson S., Lindh M., Widerström L. Excellent booster response 4 to 8 years after a single primary dose of an inactivated hepatitis A vaccine. J. Travel. Med. 2004;11(2):120–1. DOI: https://doi.org/10.2310/7060.2004.17079
- Mayorga Pérez O., Herzog C., Zellmeyer M., et al. Efficacy of virosome hepatitis A vaccine in young children in Nicaragua: randomized placebo-controlled trial. J. Infect. Dis. 2003;188(5):671–7. DOI: https://doi.org/10.1086/377309
- Lolekha S., Pratuangtham S., Punpanich W., et al. Immunogenicity and safety of two doses of a paediatric hepatitis A vaccine in Thai children: comparison of three vaccination schedules. J. Trop. Pediatr. 2003;49(6):333–9. DOI: https://doi.org/10.1093/tropej/49.6.333
- Bravo C., Mege L., Vigne C., Thollot Y. Clinical experience with the inactivated hepatitis A vaccine, Avaxim 80U Pediatric. Expert. Rev. Vaccines. 2019;18(3):209–23. DOI: https://doi.org/10.1080/14760584.2019.1580578
- Herzog C., Van Herck K., Van Damme P. Hepatitis A vaccination and its immunological and epidemiological long-term effects – a review of the evidence. Hum. Vaccin. Immunother. 2021;17(5): 1496–519. DOI: https://doi.org/10.1080/21645515.2020.1819742
- Abadia I., Wong D., Rengifo A., et al. Eight years follow-up of the immune response in children after one or two doses of inactivated hepatitis A vaccine in Panama. In: International Pediatric Association (IPA 2019) Congress – 17 to 21 March 2019. Panama City, Panama; 2019.
- Espul C., Benedetti L., Linares M., et al. Seven-year follow-up of the immune response after one or 2 doses of inactivated hepatitis A vaccine given at 1 year of age in the Mendoza Province of Argentina. Hum. Vaccin. Immunother. 2017;13(11):2707–12. DOI: https://doi.org/10.1080/21645515.2017.1358326
- Vacchino M.N. Incidence of Hepatitis A in Argentina after vaccination. J. Viral. Hepat. 2008;15(Suppl. 2):47–50. DOI: https://doi.org/10.1111/j.1365-2893.2008.01029.x
- Vizzotti C., González J., Rearte A., et al. Single-dose universal hepatitis A immunization in Argentina: low viral circulation and high persistence of protective antibodies up to 4 years. J. Pediatric Infect. Dis. Soc. 2015;4(4):e62–e67. DOI: https://doi.org/10.1093/jpids/piu068
- Gentile A. The need for an evidence-based decision-making process with regard to control of hepatitis A. J. Viral. Hepat. 2008;15(Suppl. 2):16–21. DOI: https://doi.org/10.1111/j.1365-2893.2008.01023.x
- WHO position paper on hepatitis A vaccines – June 2012. Wkly Epidemiol. Rec. 2012;87(28/29):261–76.
- Urueña A., González J.E., Rearte A., et al. Single-dose universal hepatitis A immunization in one-year-old children in Argentina: High prevalence of protective antibodies up to 9 years after vaccination. Pediatr. Infect. Dis. J. 2016;35(12):1339–42. DOI: https://doi.org/10.1097/INF.0000000000001322
- Urueña A., Badano M.N., Baré P., et al. Humoral and cellular immune memory response 12 years following single dose vaccination against hepatitis A in Argentinian children. Vaccine. 2022;40(1):114–21. DOI: https://doi.org/10.1016/j.vaccine.2021.11.037
- de Brito W.I., de Oliveira R.M., Silva J., et al. Persistence of immunity against hepatitis A in Brazilian children vaccinated with a single dose of inactivated virus vaccine. J. Viral. Hepat. 2023;30(7):615–20. DOI: https://doi.org/10.1111/jvh.13819
- Brito W.I., Alves-Junior E.R., Oliveira R.M., Souto F.J.D. Initial evaluation of universal immunization with a single dose against hepatitis A virus in Central Brazil. Braz. J. Infect. Dis. 2018;22(3):166–70. DOI: https://doi.org/10.1016/j.bjid.2018.04.001
- Lopatukhina M.A., Kyuregyan K.K., Karlsen A.A., et al. The immunological and epidemiological effectiveness of pediatric single-dose vaccination against hepatitis A 9 to 11 years after its implementation in the Tyva Republic, the Russian Federation. Vaccines (Basel). 2024;12(8):907. DOI: https://doi.org/10.3390/vaccines12080907
- Raczniak G.A., Thomas T.K., Bulkow L.R., et al. Duration of protection against hepatitis A for the current two-dose vaccine compared to a three-dose vaccine schedule in children. Vaccine. 2013;31(17):2152–5. DOI: https://doi.org/10.1016/j.vaccine.2013.02.048
- Vizzotti C., González J., Gentile A., et al. Impact of the single-dose immunization strategy against hepatitis A in Argentina. Pediatr. Infect. Dis. J. 2014;33(1):84–8. DOI: https://doi.org/10.1097/INF.0000000000000042
- Попова О.Е., Кюрегян К.К., Ильченко Л.Ю. и др. Эпидемиологический и молекулярно-биологический анализ причин подъема заболеваемости гепатитом А в Республике Тыва в 2008 году. Журнал микробиологии, эпидемиологии и иммунобиологии. 2010;(3):23–6. Popova O.E., Kiuregian K.K., Il'chenko L.Iu., et al. Epidemiological and molecular biological analysis of causes of rise of hepatitis A incidence in Republic of Tyva in 2008. Journal of Microbiology, Epidemiology and Immunobiology. 2010;(3):23–6.
- Blanco Fernández M.D., Torres C., Riviello-López G., et al. Analysis of the circulation of hepatitis A virus in Argentina since vaccine introduction. Clin. Microbiol. Infect. 2012;18(12):E548–51. DOI: https://doi.org/10.1111/1469-0691.12034
- Yanez L.A., Lucero N.S., Barril P.A., et al. Evidence of hepatitis A virus circulation in central Argentina: seroprevalence and environmental surveillance. J. Clin. Virol. 2014;59(1):38–43. DOI: https://doi.org/10.1016/j.jcv.2013.11.005
- Fantilli A., Cola G.D., Castro G., et al. Hepatitis A virus monitoring in wastewater: a complementary tool to clinical surveillance. Water Res. 2023;241:120102. DOI: https://doi.org/10.1016/j.watres.2023.120102
- Jeong S.H., Lee H.S. Hepatitis A: clinical manifestations and management. Intervirology. 2010;53(1):15–9. DOI: https://doi.org/10.1159/000252779
- Sabrià A., Gregori J., Garcia-Cehic D., et al. Evidence for positive selection of hepatitis A virus antigenic variants in vaccinated men-having-sex-with men patients: implications for immunization policies. EBioMedicine. 2019;39:348–57. DOI: https://doi.org/10.1016/j.ebiom.2018.11.023
Supplementary files