Журнал микробиологии, эпидемиологии и иммунобиологии
Старейший в России научно-практический журнал издается с 1924 г.
Параллельные названия:
- Journal of Microbiology, Epidemiology and Immunobiology (основное название для ссылок и поиска в базах данных)
- ЖМЭИ
- Zhurnal mikrobiologii, èpidemiologii i immunobiologii
(не рекомендовано для использования в ссылках)
Журнал является органом Общероссийской общественной организации «Всероссийское научно-практическое общество эпидемиологов, микробиологов и паразитологов».
«Журнал микробиологии, эпидемиологии и иммунобиологии» — рецензируемый журнал открытого доступа, не берущий плату за публикацию научных статей.
Журнал рассматривает актуальные проблемы мировой науки в области эпидемиологии, микробиологии, вирусологии, иммунобиологии, в том числе иммунодиагностики и иммунопрофилактики, и обеспечивает синтез новейших результатов фундаментальных и прикладных научных исследований, направленных на обеспечение контроля, профилактики и лечения инфекционных заболеваний.
Журнал охватывает вопросы инфекционных заболеваний человека с точки зрения изучения патогенов – бактерий, вирусов и прионов во взаимосвязи с иммунным ответом организма человека, окружающей средой, внутри- и межвидовыми взаимодействиями, а также взаимосвязанными эволюционными процессами и общественным здоровьем.
ЖМЭИ относится к IV квартилю SJR (2022г.) по специальностям Epidemiology, Immunology, Immunology and Microbiology (miscellaneous), Virology и к III квартилю по специальности Medicine (miscellaneous), входит в международные библиографические системы и базы данных международного цитирования: SCOPUS, DOAJ, ULRICHS PERIODICAL DIRECT, EBSCO, OPENALEX, Fatcat, RSCI, RUSMED, ZEITSCHRIFTEN DATENBANK, GOOGLE SCHOLAR, CYBERLENINKA, RUCONT, в рекомендованный ВАК «Перечень рецензируемых научных изданий, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученой степени кандидата наук, на соискание ученой степени доктора наук» по специальностям:
- 1.5.10. Вирусология (медицинские и биологические науки),
- 1.5.11. Микробиология (медицинские и биологические науки),
- 3.2.2. Эпидемиология (медицинские и биологические науки),
- 3.2.7. Аллергология и иммунология (медицинские и биологические науки).
В соответствии с рекомендациями ВАК (Письмо ВАК от 06.12.2022 № 02-1198), журнал относится к категории К1 как издание, входящее в базы данных SCOPUS и RSCI.
Журнал предназначен для врачей, эпидемиологов, научных работников, преподавателей, аспирантов и студентов, чьи профессиональные интересы включают вопросы применения, разработки и внедрения технологий для поддержания инфекционной безопасности населения.
К публикации принимаются российские и зарубежные оригинальные статьи, обзоры, рецензии, лекции, а также методические материалы, законодательные документы и хроника событий по профилю журнала.
Журнал следует Рекомендациям ICMJE по ведению, отчетности, редактированию и публикации научных работ в медицинских журналах.
Журнал представлен в международных базах библиографических данных и информационно-справочных системах:
- SCOPUS,
- DOAJ,
- ULRICHS PERIODICAL DIRECT,
- RSCI
- Google Scholar,
- CYBERLENINKA,
- RUCONT.
Каждой статье журнала присваивается идентификатор цифрового объекта — DOI (Crossref). Наиболее значимые статьи по решению Редколлегии публикуются в полнотекстовом переводе на сайте журнала под единым c оригиналом DOI.
Контент журнала доступен под лицензией Creative Commons — Attribution 4.0 International, CC-BY.
![]()
Используется сервис CrossMark для поддержания контента журнала в актуальном состоянии и информирования читателей об изменениях в опубликованных статьях в случае, если они происходят.

Журнал использует Online First Pre-Publication – онлайн-публикацию окончательной версии статьи, прошедшей рецензирование и принятой к печати в журнале, не дожидаясь размещения в определенном выпуске. Статьям присваивается DOI, что дает возможность полноценного цитирования до выхода в свет выпуска Журнала.
В состав редколлегии входят 24 российских и 8 иностранных ученых, включая 11 академиков и 6 членов-корреспондентов РАН.
Журнал выходит 6 раз в год.
При регистрации на сайте Журнала читатели и авторы получают автоматические уведомления о содержании новых выпусков Журнала на адрес своей электронной почты с возможностью отписаться от рассылки.
Учредители:
- Федеральное бюджетное учреждение науки «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор).
- Общероссийская общественная организация «Всероссийское научно-практическое общество эпидемиологов, микробиологов и паразитологов».
Издатель:
- ЦНИИ Эпидемиологии Роспотребнадзора.
Текущий выпуск
Том 102, № 5 (2025)
- Год: 2025
- Выпуск опубликован: 05.11.2025
- Статей: 14
- URL: https://microbiol.crie.ru/jour/issue/view/192
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
ПОЭМА: ПОпуляционная Эпидемиологическая Модель Агентная для прогноза эффективности противоэпидемических мероприятий в Российской Федерации
Аннотация
Введение. Пандемия COVID-19 выявила целый комплекс проблем, связанных с математическим моделированием эпидемического процесса и оценкой эффекта от проводимых профилактических и противоэпидемических мероприятий в современном сложноорганизованном обществе. Вместе с этим накопление значительных массивов фактических данных дало импульс активному развитию агентных моделей, в которых каждый агент (условный человек) имеет уникальный набор характеристик и способов взаимодействия, определяемых на основе реальных социологических и демографических данных.
Цели и задачи. Разработка и демонстрация возможностей эпидемиологической агентной модели ПОЭМА (ПОпуляционная Эпидемиологическая Модель Агентная).
Материалы и методы. Платформа ПОЭМА разработана на исходном коде одной из наиболее широко используемых во всем мире агентной модели Covasim с учетом демографических и организационно-административных условий, характерных для Российской Федерации.
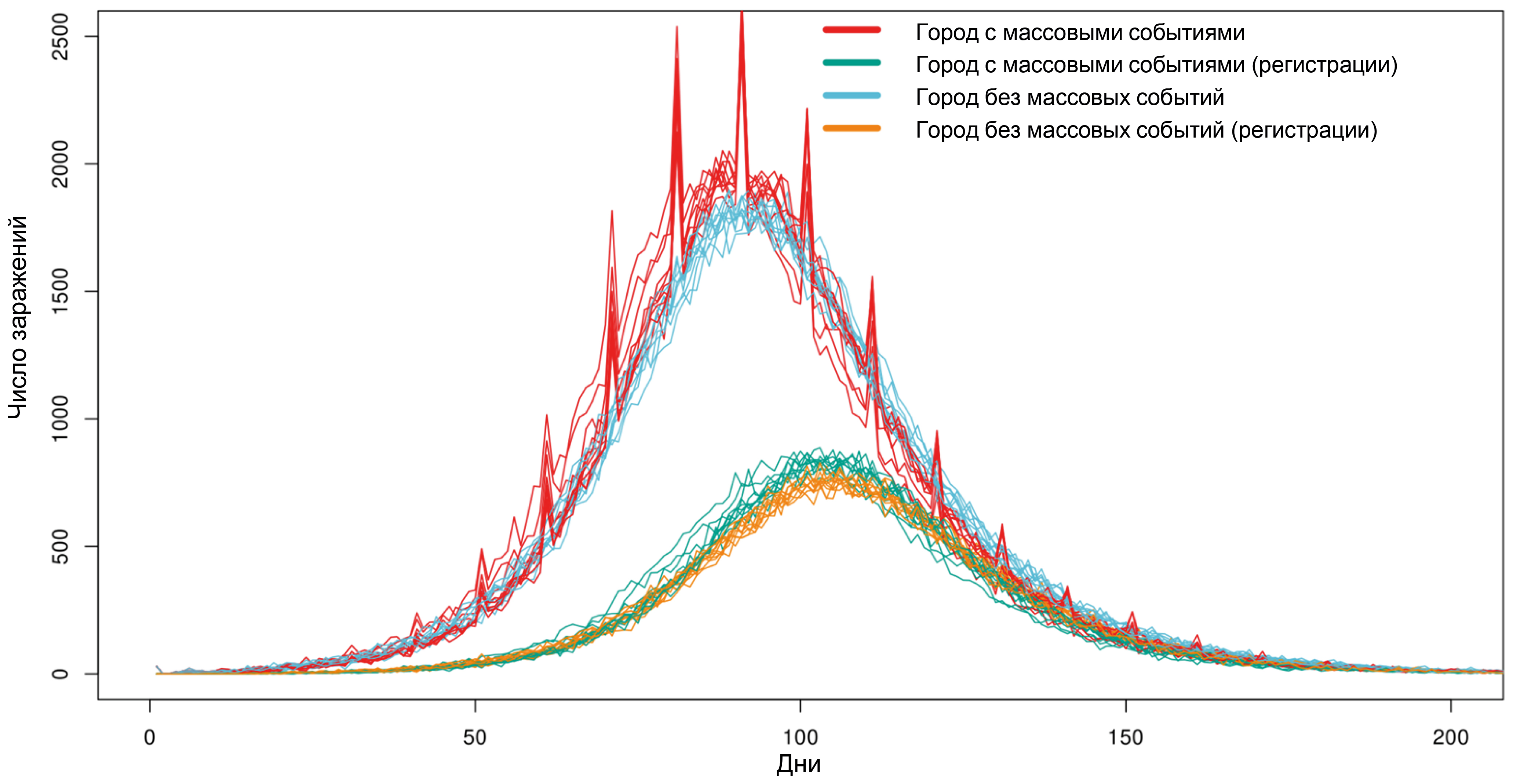
Результаты. Вычислительные эксперименты показали, что из-за индивидуальной вариабельности в динамике развития инфекции и особенностей регистрации заболеваемости даже массовые мероприятия хотя и приводят к фактическому увеличению числа инфицированных, но не оказывают существенного влияния на форму кривой регистрируемой заболеваемости. Показано, что транспортные потоки между городами на уровне 0,1% населения в день оказывают минимальный эффект на динамику развития эпидемии, в то время как эффект от перетока 1% населения в день резко снижает эффект от введения строгих противоэпидемических мероприятий, проводимых только в одном отдельно взятом городе. На примере Воронежской области проведено моделирование смены циркулирующего варианта SARS-CoV-2 с Дельта на Omicron в начале 2022 г. и показана высокая степень корреляции между модельной динамикой и наблюдаемым в реальности соотношением вариантов вируса.
Заключение. Модель реализована полностью в Российском контуре на сервере НИИ системной биологии и медицины Роспотребнадзора и может быть использована для проведения цифровых эпидемиологических экспериментов с целью прогноза эффективности предполагаемых к проведению противоэпидемических мероприятий.
 515-529
515-529


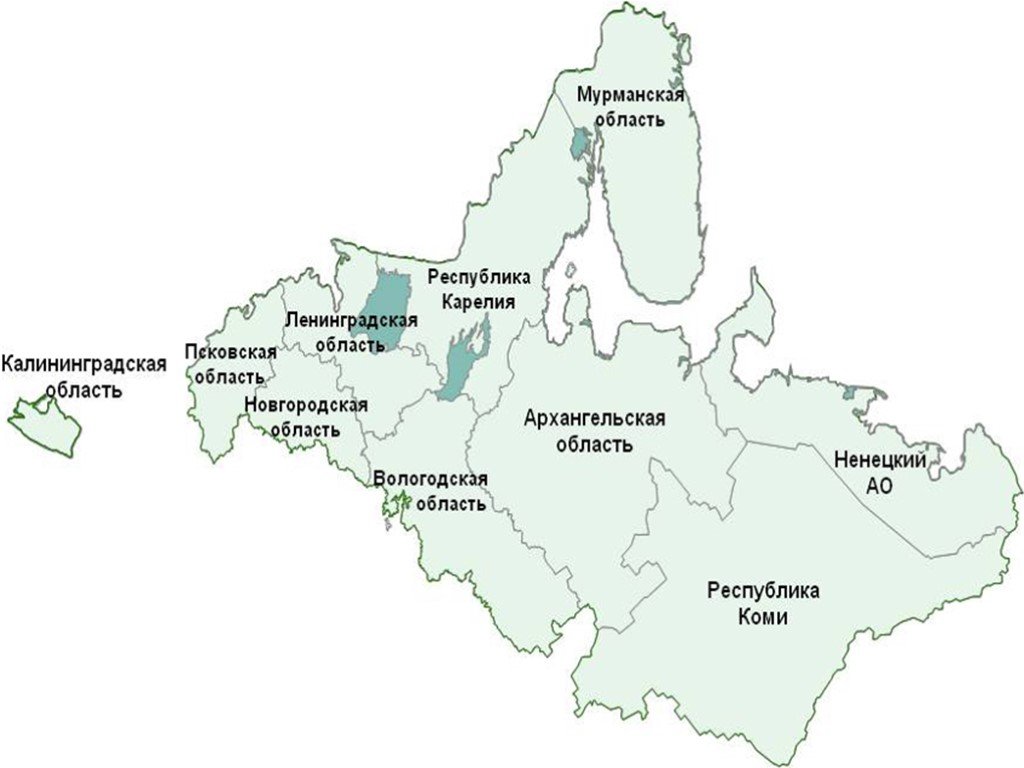
Ассоциация полиморфных вариантов гена TRIM22 (N155D и T242R) с ВИЧ-инфекцией в Северо-Западном федеральном округе России
Аннотация
Введение. Вирус иммунодефицита человека (ВИЧ) остается глобальной проблемой здравоохранения. Ген TRIM22, кодирующий белок с противовирусной активностью, является перспективным кандидатом для исследований, однако его роль в патогенезе ВИЧ-инфекции в популяциях Российской Федерации ранее не изучалась.
Целью работы был анализ полиморфных вариантов rs7935564 (N155D) и rs1063303 (T242R) гена TRIM22 у ВИЧ-инфицированных лиц в Северо-Западном федеральном округе.
Материалы и методы. Проведён анализ полиморфных вариантов rs7935564 (N155D) и rs1063303 (T242R) гена TRIM22 в группах ВИЧ-инфицированных лиц с вирусологической неэффективностью антиретровирусной терапии (n = 378) и практически здоровых лиц (n = 319). Генотипирование выполнено методом полимеразной цепной реакции с последующим секвенированием. Статистический анализ включал проверку соответствия распределения генотипов равновесию Харди–Вайнберга, оценку ассоциаций по 3 моделям наследования (доминантной, рецессивной, аддитивной) с расчётом отношения шансов (OШ) и 95% доверительного интервала (ДИ), анализ неравновесия сцепления и частот гаплотипов.
Результаты. Распределение генотипов для анализируемых полиморфных вариантов соответствовало равновесию Харди–Вайнберга (p > 0,05). Выявлена достоверная ассоциация аллеля G полиморфизма rs7935564 с наличием ВИЧ-инфекции в рецессивной (OШ = 1,76) и аддитивной (OШ = 1,37) моделях наследования. Для полиморфизма rs1063303 значимая ассоциация наблюдалась только в доминантной модели (OШ = 1,40). Обнаружено умеренное неравновесие сцепления между локусами (D’ = 0,4478; r² = 0,1572; p < 0,001). Гаплотип G-G (rs7935564_G — rs1063303_G) был ассоциирован с наличием инфекции (OШ = 1,57).
Заключение. В российской популяции полиморфный вариант rs7935564 (N155D) гена TRIM22 является значимым генетическим фактором ассоциации с ВИЧ-инфекцией, в то время как для rs1063303 (T242R) получены статистически неоднозначные результаты. Ассоциация гаплотипа G-G с наличием инфекции свидетельствует о потенциальном синергетическом эффекте данных аллелей. Полученные данные подчёркивают важность учёта популяционной специфики при оценке генетических детерминант взаимодействия ВИЧ и организма-хозяина.
 530-538
530-538


Генетическое типирование ДНК-изолятов Coxiella burnetii, выделенных от больных лихорадкой Ку в Ставропольском крае
Аннотация
Цель работы — генетическое типирование ДНК-изолятов Coxiella burnetii, выделенных на территории Ставропольского края (СК) в 2009–2023 гг., анализ генетической структуры популяции возбудителя лихорадки Ку в регионе.
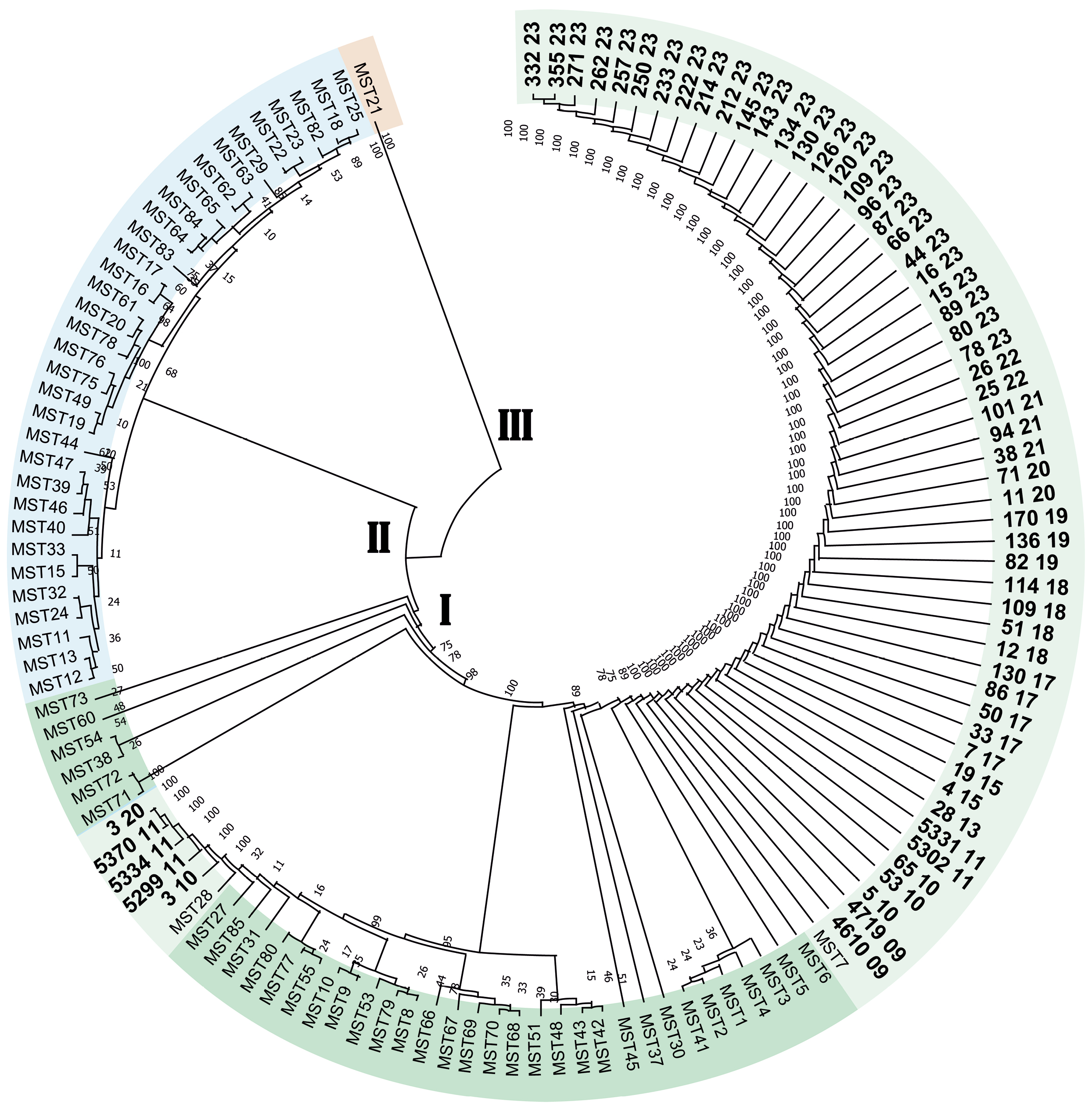
Материалы и методы. В работе использовали сыворотки крови от лихорадящих больных, полученные из Центра гигиены и эпидемиологии в Ставропольском крае в 2009–2023 гг. Проводили мультиспейсерное типирование (МST) C. burnetii, определяли принадлежность к MST-типу с помощью интернет-ресурса (http://ifr48.timone.univ-mrs.fr). Филогенетическое дерево строили в программе «MEGA». Плазмидное типирование осуществляли с использованием типоспецифичных праймеров к локусам плазмид QpH1, QpRS, QpDV, визуализацию полученных продуктов амплификации — путём проведения электрофореза в 2% агарозном геле. Территориальное распространение генетических вариантов анализировали с использованием программного обеспечения ArcGiS 10.1.
Результаты. В ходе молекулярно-генетического типирования C. burnetii установлено, что на территории СК циркулируют штаммы возбудителя коксиеллёза, относящиеся к двум генотипам: MST7 и MST28 монофилетической группы I. Доминирующим генотипом на территории восточных районов СК является MST7, северных районов — MST28. На территории СК циркулирует возбудитель лихорадки Ку с единственным плазмидным типом — QpH1.
Заключение. Определение плазмидного и MST-типа позволяет генотипировать ДНК изоляты C. burnetii без выделения чистой культуры, что может помочь при расследовании вспышек и формировании базы данных региональных ДНК изолятов.
 539-546
539-546


Подавление образования биоплёнок и выживания в эпителиальных клетках клинических изолятов уропатогенов при действии препарата Fluorothiazinone in vitro
Аннотация
Целью данного исследования было изучение влияния инновационного отечественного антибактериального препарата Fluorothiazinone, ингибитора системы секреции III типа и функционирования жгутика, на вирулентные свойства возбудителей инфекций мочевыводящих путей (ИМП).
Материалы и методы. Клинические изоляты видов Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa были получены от 4 пациентов с рецидивирующими инфекциями ИМП. Анализ цитотоксичности проводили на клетках HeLa с помощью набора «CytoTox 96». Жгутиковую подвижность бактерий оценивали в 0,25% агаре с измерением зоны подвижности. Биоплёнки культивировали в 96-луночных планшетах и окрашивали кристаллическим фиолетовым и Конго красным, оценивали структуру биоплёнок при микроскопировании и проводили количественную оценку бактериальной биоплёнки и экзополисахаридного матрикса при измерении оптической плотности связавшегося с биоплёнкой красителя. Внутриклеточное развитие изучали на клетках PC-3 при определении количества внутриклеточных бактерий методом высева лизатов клеток и иммунохимическим методом при окраске бактерий специфическими антителами.
Результаты. Препарат Fluorothiazinone специфически подавлял цитотоксичность и подвижность E. coli и P. aeruginosa. Для K. pneumoniae наблюдали чувствительность к препарату Fluorothiazinone, связанную с подавлением цитотоксичности. Для всех изученных изолятов было показано ингибирование образования биоплёнок на абиотической поверхности. Для E. coli и K. pneumoniae выявили достоверное снижение внутриклеточного размножения в клетках аденокарциномы простаты человека и подавление формирования внутриклеточных бактериальных сообществ.
Заключение. Препарат Fluorothiazinone нарушает механизмы, способствующие установлению персистенции патогенов при формировании хронических ИМП, среди которых образование биоплёнок на абиотических поверхностях, таких как катетеры, стенты, дренажи, и формирование внутриклеточных бактериальных сообществ и покоящихся внутриклеточных резервуаров.
 547-559
547-559


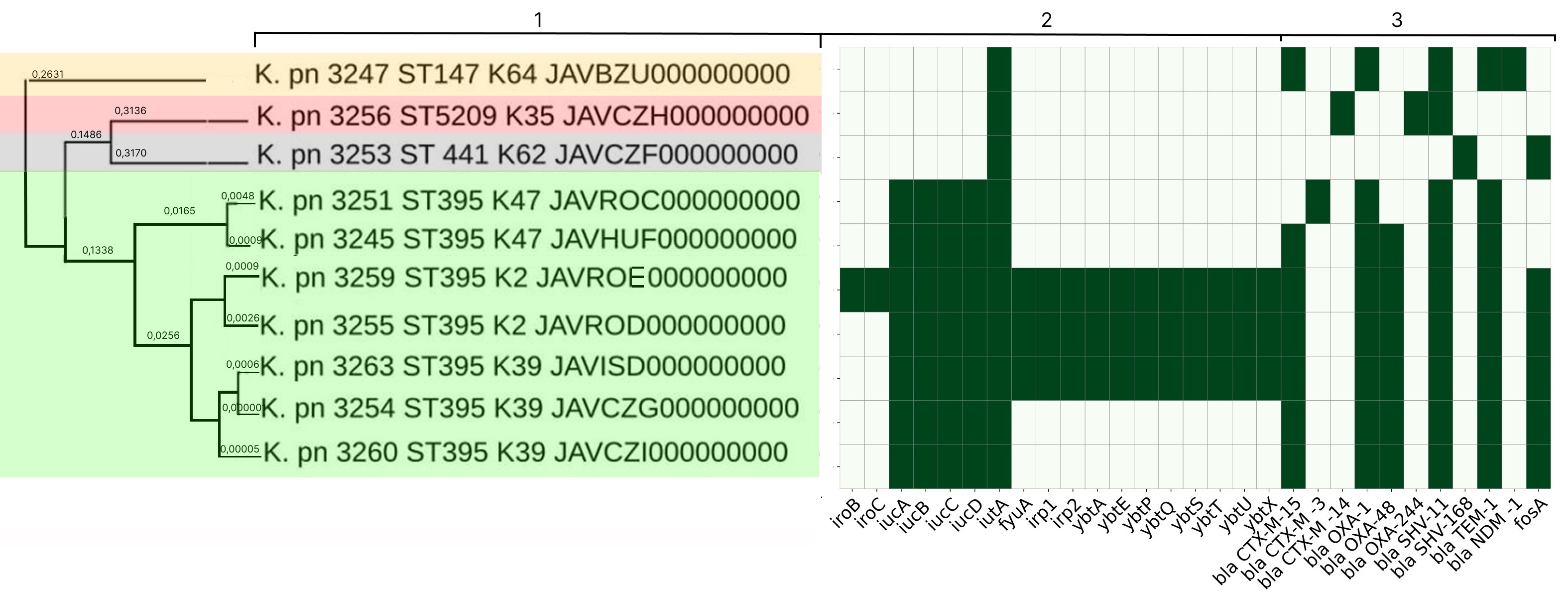
Характеристика молекулярно-генетических свойств эпидемических штаммов Klebsiella pneumoniae и Staphylococcus aureus — возбудителей инфекций, связанных с оказанием медицинской помощи, циркулирующих на территории Нижегородской области
Аннотация
Введение. Молекулярно-эпидемиологический мониторинг направлен на получение актуальной информации о генетических вариантах возбудителей инфекций, связанных с оказанием медицинской помощи (ИСМП), циркулирующих в регионе. В настоящее время особое внимание уделяется слежению за представителями группы ESKAPE, т. к. они являются частой причиной ИСМП, осложняют течение основного заболевания и становятся всё более серьёзной угрозой здоровью и жизни пациентов, поскольку обладают комплексом генов патогенности и разнообразными механизмами антибиотикорезистентности.
Цель работы — анализ результатов полногеномного секвенирования эпидемических штаммов возбудителей ИСМП — Klebsiella pneumoniae ssp. pneumoniae и Staphylococcus aureus, циркулирующих на территории Нижегородской области.
Материалы и методы. Использованы классические бактериологические методы, MALDI TOF масс-спектрометрия, полногеномное секвенирование, биоинформатические методы.
Результаты. Углублённый анализ показал циркуляцию в отделении новорождённых популяции классических штаммов K. pneumoniae сиквенс-типа (ST) 3-К-типа (К) 3, содержащих ряд генов патогенности и бета-лактамазу blaSHV-1. В многопрофильном стационаре обнаружена циркуляция популяции штаммов конвергентного патотипа K. pneumoniae ST395-К39, а также выявлены штаммы конвергентного патотипа K. pneumoniae ST395-К2, К47 и штаммы классического патотипа K. pneumoniae ST5209-К35, ST441-К62, ST147-К64, содержащие в геноме спектр генов патогенности и бета-лактамаз, в том числе Нью-Дели металло-бета-лактамазу blaNDM-1. Штаммы S. aureus, связанные с катетер-ассоциированными инфекциями кровотока, обладают выраженным патогенным потенциалом, относятся к 13 различным ST и 19 spa-типам (t). В гемодиализных центрах и отделениях гемодиализа выявлена циркуляция штаммов метициллин-резистентных (SCCmec IV, ST8, t008) и метициллин-чувствительных (ST1, t127) стафилококков.
Заключение. Полученные данные свидетельствуют о циркуляции в лечебно-профилактических медицинских организациях конвергентных и классических штаммов K. pneumoniae и вирулентных штаммов S. aureus, что обосновывает необходимость молекулярно-эпидемиологического мониторинга.
 560-570
560-570


Комбинированная ДНК-белковая вакцина, содержащая полиэпитопный Т-клеточный иммуноген и рецептор-связывающий домен белка S вируса SARS-CoV-2
Аннотация
Введение. В период пандемии COVID-19 стала чрезвычайно актуальной разработка профилактических вакцин, в том числе основанных на новых платформах. Одной из таких платформ являются комбинированные вакцины, сочетающие в одном препарате, например, ДНК и белковые компоненты.
Целью данной работы являлось исследование иммуногенности ДНК-вакцины, кодирующей полиэпитопный Т-клеточный иммуноген вируса SARS-CoV-2, в сочетании с рекомбинантным белком RBD (рецепторсвязывающий домен белка S вируса SARS-CoV-2, штамм Wuhan-Hu-1), конъюгированным с поликатионным носителем — полиглюкин-спермидином (PGS), а также оценка вклада отдельных компонентов в развитие иммунного ответа у мышей линии BALB/c.
Материалы и методы. Для создания ДНК-вакцины (pBSI-COV-Ub) мы воспользовались стратегией дизайна искусственного полиэпитопного иммуногена, состоящего из консервативных иммунодоминантных фрагментов различных структурных белков вируса SARS-CoV-2, содержащих большое количество эпитопов Т-лимфоцитов: хелперных и цитотоксических. Рекомбинантный белок RBD был конъюгирован с поликатионом PGS, в результате смешивания его с ДНК образовывал вакцинный комплекс CCV–BSI, иммуногенные свойства которого были исследованы в данной работе.
Результаты. Иммунизация мышей линии BALB/c комбинированной конструкцией CCV–BSI привела к индукции высоких титров антител, обладающих нейтрализующей активностью в отношении живого вируса SARS-CoV-2, а также к формированию вирус-специфического Т-клеточного ответа, что было показано с помощью иммуноферментного анализа, реакции нейтрализации и ELISpot. Показано, что вклад в гуморальный иммунный ответ вносит именно белковый компонент, а в клеточный — ДНК. Введение рекомбинантного белка RBD привело к индукции только антител, введение ДНК-вакцины — к индукции только Т-клеточного ответа, введение комбинированного препарата — к индукции и гуморального иммунного ответа, и специфических Т-клеток.
Выводы. Уникальная комбинация ДНК и белка в составе одной вакцинной конструкции позволяет преодолеть ограничения каждого из данных типов вакцин и приводит к индукции обоих звеньев иммунитета. Белковый компонент может быть заменён в соответствии с актуальным вирусным штаммом, а универсальный Т-клеточный иммуноген может обеспечить ответ на широкий спектр циркулирующих вариантов. Данная платформа в дальнейшем может быть использована для разработки вакцин против различных вирусов с высокой изменчивостью.
 571-582
571-582


Критерии оценки качества геномов Pseudomonas aeruginosa
Аннотация
Введение. С развитием технологий секвенирования растёт объём геномных данных, что требует разработки показателей для оценки качества сборок геномов. Современные инструменты (Plantagora, SQUAT, QUAST, BUSCO, CheckM2 и др.) являются унифицированными, но при этом не учитывают особенностей организации генома конкретных видов. Особенно остро стоит вопрос импортозамещения биоинформационных инструментов в условиях ограниченного доступа к зарубежным технологиям. Кроме того, отсутствуют специализированные методы оценки качества сборок генома Pseudomonas aeruginosa, что ограничивается общими метриками (N50, количество контигов).
Цель работы — разработка алгоритма и критериев на основе комплексного подхода для специфической оценки качества полногеномного секвенирования представителей вида P. aeruginosa.
Материалы и методы. Исследование проводили на 108 штаммах P. aeruginosa. Авторское программное обеспечение разработано на языках Java и Python.
Результаты. Разработан алгоритм оценки качества полногеномных данных P. aeruginosa на основе анализа ключевых генов жизнеобеспечения (fur, algU, dinB и др.), размера генома, GC-состава и показателя N50. Геномы с отсутствием ключевых генов или структурными ошибками классифицируются как плохие или средние, последние не рекомендуются для филогенетического анализа. Алгоритм предлагает простые и понятные параметры оценки качества полногеномных данных.
Заключение. На основе анализа генов жизнеобеспечения, размера генома, GC-состава и показателя N50 нами разработана классификация качества сборок геномов P. aeruginosa (хорошее, среднее, низкое). Созданы алгоритм и программа «Genomes Validator» для оперативной оценки.
 583-591
583-591


Генетическое разнообразие мутаций, влияющих на гемолитическую активность бактерий Bordetella pertussis при культивировании in vitro
Аннотация
Введение. Ключевую роль в патогенезе коклюша, антропонозного инфекционного заболевания, играет двухкомпонентная система BvgAS, регулирующая транскрипцию генов вирулентности возбудителя. Факторы, оказывающие воздействие на работу системы BvgAS бактерий Bordetella pertussis в организме человека, практически не изучены. Известно, что нарушение структуры оперона bvgAS приводит к фазовым переходам и изменению вирулентности. Перемещение IS-элементов в оперон bvgAS и другие гены вирулентности возбудителя коклюша является важным механизмом в регуляции их экспрессии, потенциально приводящим к длительной персистенции бактерий в организме человека.
Цель работы — поиск и характеристика спонтанных инсерционных мутантов бактерий B. pertussis по генам вирулентности bvgAS, cya и fhaB, ответственным за гемолитическую активность при культивировании бактерий in vitro.
Материалы и методы. Использованы штаммы B. pertussis из коллекции НИЦЭМ им. Н.Ф. Гамалеи: вирулентный штамм B. pertussis 475 и изогенный ему аттенуированный штамм B. pertussis 4МKS, вирулентный штамм B. pertussis Tohama I и его авирулентный мутант B. pertussis 347. Бактерии культивировали на казеиново-угольном агаре с добавлением крови. Формирование зон гемолиза оценивали визуально. Для молекулярно-генетической характеристики полученных инсерционных мутантов использовали методы ПЦР, ПЦР-РВ, секвенирования.
Результаты. In vitro выделены мутанты B. pertussis с нарушенной гемолитической активностью (фенотип Hly–) c инсерциями IS-элементов в генах fhaB и bvgAS, а также мутанты, сохранившие гемолитическую активность (фенотип Hly+), содержащие IS-элементы в ранее не описанной ориентации в гене bvgAS. Частота образования инсерционных мутантов зависела от условий культивирования и генотипа бактерий.
Заключение. Приведены аргументы, свидетельствующие о возможной роли IS-элементов в переходе бактерий B. pertussis в состояние пониженной вирулентности, что обеспечивает длительную персистенцию возбудителя коклюша в организме человека.
 592-604
592-604


Мониторинг Clostridioides difficile-ассоциированной инфекции в условиях стационара
Аннотация
Введение. Clostridioides difficile — вид анаэробных спорообразующих грамположительных бактерий — является составной частью нормальной микрофлоры кишечника. C. difficile-ассоциированная инфекция развивается при избыточной колонизации C. difficile, вегетативные формы которой способны продуцировать экзотоксины, вызывающие воспаление в стенке толстой кишки. Токсигенные штаммы C. difficile являются основным возбудителем инфекций, связанных с оказанием медицинской помощи в стационаре.
Целью исследования является изучение частоты выявления C. difficile (как токсигенных, так и нетоксигенных штаммов) у пациентов гастроэнтерологического отделения ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, госпитализированных в 2021–2023 гг. с синдромом диареи и другими установленными диагнозами.
Материалы и методы. В исследование были включены 547 пациентов в возрасте 19–88 лет (46,6% мужчин, 53,4% женщин). Для выявления ДНК C. difficile и генов её токсинов А и В применяли метод полимеразной цепной реакции в реальном времени, дополнительно проводили бактериологическое исследование кала. При обнаружении клинических признаков бактериальной инфекции проводили анализ на С-реактивный белок (СРБ).
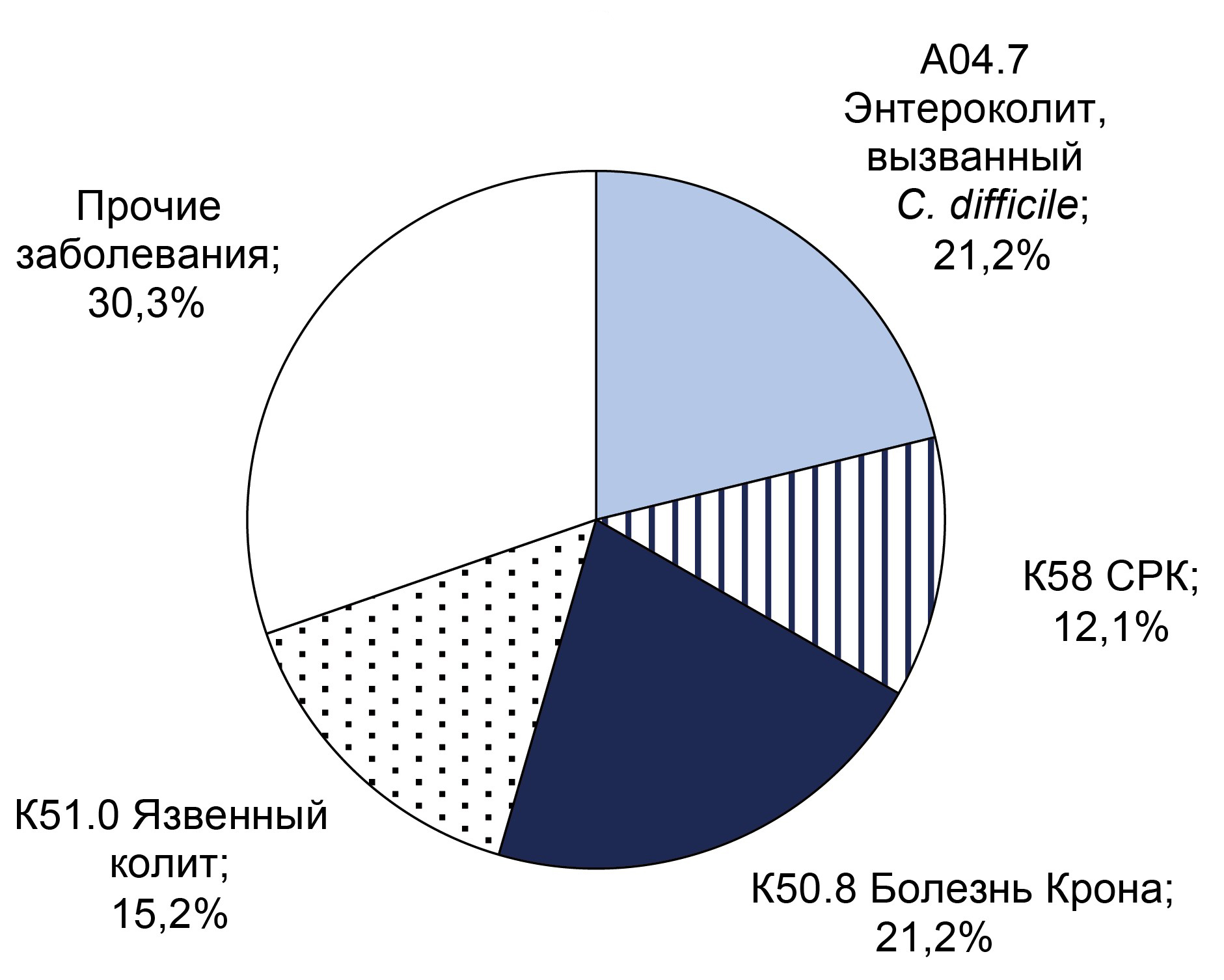
Результаты. ДНК C. difficile выявлена у 65 (11,9%) пациентов, гены токсинов А и В обнаружены у 32 (5,9%) пациентов. Нетоксигенные штаммы C. difficile чаще детектировались у мужчин (55%) в возрасте до 40 лет. Токсигенные штаммы C. difficile с одинаковой частотой встречались у мужчин и женщин в возрасте до 40 лет. Анализ на СРБ показал, что воспалительные процессы чаще развиваются у пациентов старше 40 лет. Преобладающее заболевание с высоким показателем СРБ у пациентов с токсигенным штаммом — энтероколит, вызванный C. difficile (кодирование по МКБ-10: А04.7), в группе с нетоксигенным штаммом — у пациентов с диагнозом: язвенный колит (кодирование по МКБ-10: К51). У всех пациентов наблюдались выраженные нарушения баланса кишечной микрофлоры согласно развёрнутому бактериологическому анализу кала.
Заключение. В результате трёхлетнего мониторинга установлено увеличение доли пациентов с C. difficile с 6,6 до 7,9%. Доля образцов, положительных на гены токсинов A/B C. difficile, также увеличилась с 5,2 до 7,9%. Таким образом, необходимо проводить профилактические мероприятия для уменьшения влияния факторов риска развития C. difficile-ассоциированной инфекции в стационаре.
 605-614
605-614


Совершенствование схемы MLVA-типирования штаммов Burkholderia mallei
Аннотация
Введение. Регистрация на территории России отдельных случаев сапа у лошадей, возбудителем которого является Burkholderia mallei, определяет важность разработки алгоритмов генотипирования этого патогена. Перспективным остается метод MLVA (multilocus-variable tandem repeat analysis), основанный на сравнительном анализе количества вариабельных тандемных повторов (VNTR — variable number tandem repeats). По мере увеличения числа полногеномных последовательностей в международных базах данных изменяется информативная ценность VNTR-локусов, что требует пересмотра существующих схем типирования.
Цель работы — оценить перспективность включения VNTR-локуса BPSS1974#I в схему MLVA-6 для внутривидовой дифференциации B. mallei.
Материалы и методы. Исследование 64 штаммов B. mallei проводили in silico и in vitro с помощью методов MLVA, амплификации дифференцирующих регионов, полногеномного секвенирования и биоинформатического анализа.
Результаты. Генотипирование B. mallei при использовании схемы MLVA-6 не позволило определить in silico VNTR-профили 13 штаммов из базы данных GenBank NCBI по одному или нескольким локусам ввиду низкого покрытия ридами соответствующих областей генома или их полного отсутствия (нуль-аллели). Эффективное число аллелей (ne) и индекс полиморфного информационного содержания (PIC) для локусов схемы MLVA-6 варьировали в диапазонах 3,842–8,103 и 0,740–0,877 соответственно. Перспективность включения в эту схему VNTR-локуса BPSS1974#I определена на основе молекулярной стабильности мотива в его составе и высоких показателей ne и PIC, составивших 4,299 и 0,767 соответственно. VNTR-профили коллекционных штаммов по локусу BPSS1974#I были идентичны соответствующим штаммам из базы данных GenBank. Результаты кластерного анализа при сочетанном использовании схемы MLVA-6 и локуса BPSS1974#I соответствовали филогенетическим реконструкциям, полученным с использованием других молекулярно-генетических методов.
Заключение. VNTR-локус BPSS1974#I можно расценивать как маркер, включение которого в схему MLVA-6 позволит повысить точность генотипирования и установления регионов происхождения вновь выделенных штаммов B. mallei.
 615-625
615-625


ОБЗОРЫ
Иммунологическая и эпидемиологическая эффективность вакцинации детей против гепатита А с применением одной дозы инактивированной вакцины
Аннотация
Гепатит А — это острое заболевание печени, вызываемое вирусом гепатита А, которое можно предотвратить с помощью вакцинации. Стандартная схема вакцинации против гепатита А предполагает введение двух доз инактивированной вакцины, однако по экономическим соображениям и для повышения уровня охвата вакцинацией в некоторых регионах мира внедрены программы массовой вакцинации детей с применением одной дозы вакцины.
Целью обзора является обобщение и анализ опубликованных данных о длительности сохранения протективных уровней антител после однократной иммунизации детей, а также о заболеваемости в странах, в которых проводится вакцинопрофилактика гепатита А с использованием одной дозы инактивированной вакцины.
Данные последних лет, полученные в разных регионах мира, в том числе в России, подтверждают эффективность стратегии вакцинации против гепатита А с применением одной дозы вакцины как с точки зрения длительности сохранения иммунологического ответа, так и с точки зрения влияния на уровни регистрируемой заболеваемости. Однако для оценки продолжительности защиты и необходимости ревакцинации на более позднем этапе жизни необходимы дальнейшие исследования по долгосрочной эффективности стратегий вакцинации с применением одной дозы инактивированной вакцины, а также непрерывный надзор за гепатитом А.
 626-634
626-634


Защитные перчатки нового поколения: актуальные тенденции технологических решений и перспективы применения (научный обзор)
Аннотация
Введение. Защитные перчатки широко используют в медицине, они обеспечивают уровень биологической защиты пациентов и медицинского персонала. Вместе с тем существует риск развития инфекций, связанных с оказанием медицинской помощи, у сотрудников и пациентов при их ненадлежащем применении. Значимой проблемой является рост медицинских отходов и их утилизация. В этой связи разработка новых подходов к обеспечению максимальной защиты персонала и пациентов, минимизации риска инфицирования, благодаря созданию защитных перчаток на основе биоразлагаемых полимерных материалов с антимикробным покрытием, является актуальной эпидемиологической и экологической задачей.
В статье обсуждаются современные технологии и возникающие проблемы при получении новых материалов для создания защитных перчаток с антимикробными свойствами при использовании производных гуанидина, четвертичных аммониевых соединений, хлорированных фенолов, эфирных масел, соединений йода, солей серебра, частиц и наночастиц металлов и их оксидов, экстрактов растительных масел, анилиновых красителей. Введение таких бионаполнителей, как крахмал и наноцеллюлоза, будет способствовать улучшению биоразлагаемых свойств при сохранении необходимых физико-химических характеристик. Разработка новых композитных материалов с улучшенными характеристиками биодеградации в форме термопластичных эластомеров, полилактида и поликапролактона позволит решить проблему утилизации отходов из синтетического каучука.
Заключение. Анализ современной научной литературы определил высокий интерес в мире к созданию защитных перчаток с антимикробными свойствами на основе биоразлагаемых материалов. Однако их применение, кроме непосредственного подавления роста патогенной микрофлоры, может дополнительно нести ряд проблем, связанных с влиянием на здоровье человека и экосистему. Для успешной реализации данного направления важно продолжать научные исследования по приданию перчаткам заявленных свойств с использованием эффективных, надёжных и безопасных технологий с разработкой унифицированных методик и протоколов оценки антимикробной активности для последующего широкого внедрения в практику. Создание биоразлагаемых защитных перчаток имеет большие перспективы, поскольку будет способствовать снижению риска распространения инфекций в медицинских организациях и внесёт существенный вклад в охрану окружающей среды.
 635-646
635-646


ЮБИЛЕИ
 647-648
647-648


ХРОНИКА
 649-651
649-651