Том 99, № 6 (2022)
- Год: 2022
- Выпуск опубликован: 15.12.2022
- Статей: 11
- URL: https://microbiol.crie.ru/jour/issue/view/53
Весь выпуск
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
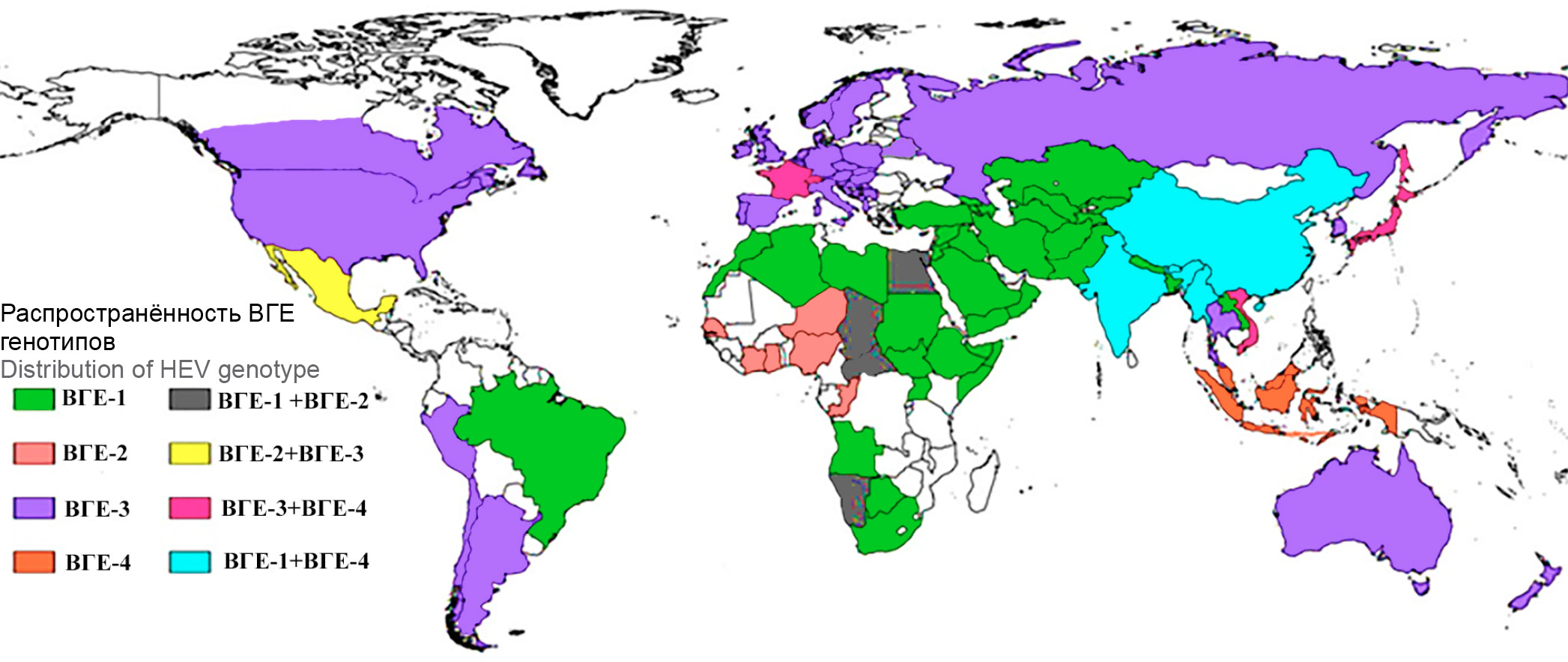
Молекулярно-эпидемиологическое исследование случаев острого гепатита Е в Беларуси
Аннотация
Актуальность. Частота встречаемости анамнестических антител к вирусу гепатита Е (ВГЕ) в общей популяции условно здорового населения Республики Беларусь составляет 7,3%, что явно не согласуется с низкими показателями заболеваемости гепатитом Е (ГЕ). Большинство первичных случаев ГЕ остаются недиагностированными. Интенсивный эпидемический процесс ГЕ в белорусской популяции носит скрытый характер. Проведение эпидемиологических исследований, включающих генотипирование последовательностей ВГЕ, выделенных на территории Беларуси, позволяют более точно характеризовать источники возбудителей ГЕ и механизмы их передачи.
Цель — молекулярно-эпидемиологическое исследование 2 случаев острого ГЕ, выявленных у пациентов из Беларуси.
Материалы и методы. В 2021–2022 гг. были получены образцы биологического материала от 2 пациентов, проходящих лечение с установленным диагнозом острого ГЕ. Образцы сыворотки крови использовали для обнаружения антител к ВГЕ при помощи иммуноферментного анализа, РНК ВГЕ выявляли из образцов фекалий при помощи метода гнездовой полимеразной цепной реакции с обратной транскриптазой. Нуклеотидную последовательность определяли на автоматическом секвенаторе по методу Сенгера. Анализ нуклеотидных последовательностей, их генотипирование и расчёт эволюционных расстояний выполняли с помощью программного обеспечения «MEGA X».
Результаты. Последовательность РНК ВГЕ, выделенная из организма беременной, имеющей в эпидемиологическом анамнезе эпизод алиментарного контакта с сырым свиным фаршем, кластеризуется в общую филогенетическую ветвь с последовательностью, полученной из организма пациента из Беларуси, имеющего в анамнезе трансплантацию почки, и последовательностями, выделенными из организма домашней свиньи. Последовательность РНК ВГЕ, выделенная из организма пациента, имеющего в анамнезе эпизод выезда в Пакистан, относится к первому генотипу ВГЕ и кластеризуется в общую филогенетическую ветвь с последовательностями ВГЕ, выделенными в Пакистане, Индии, Непале и Монголии.
 625-636
625-636


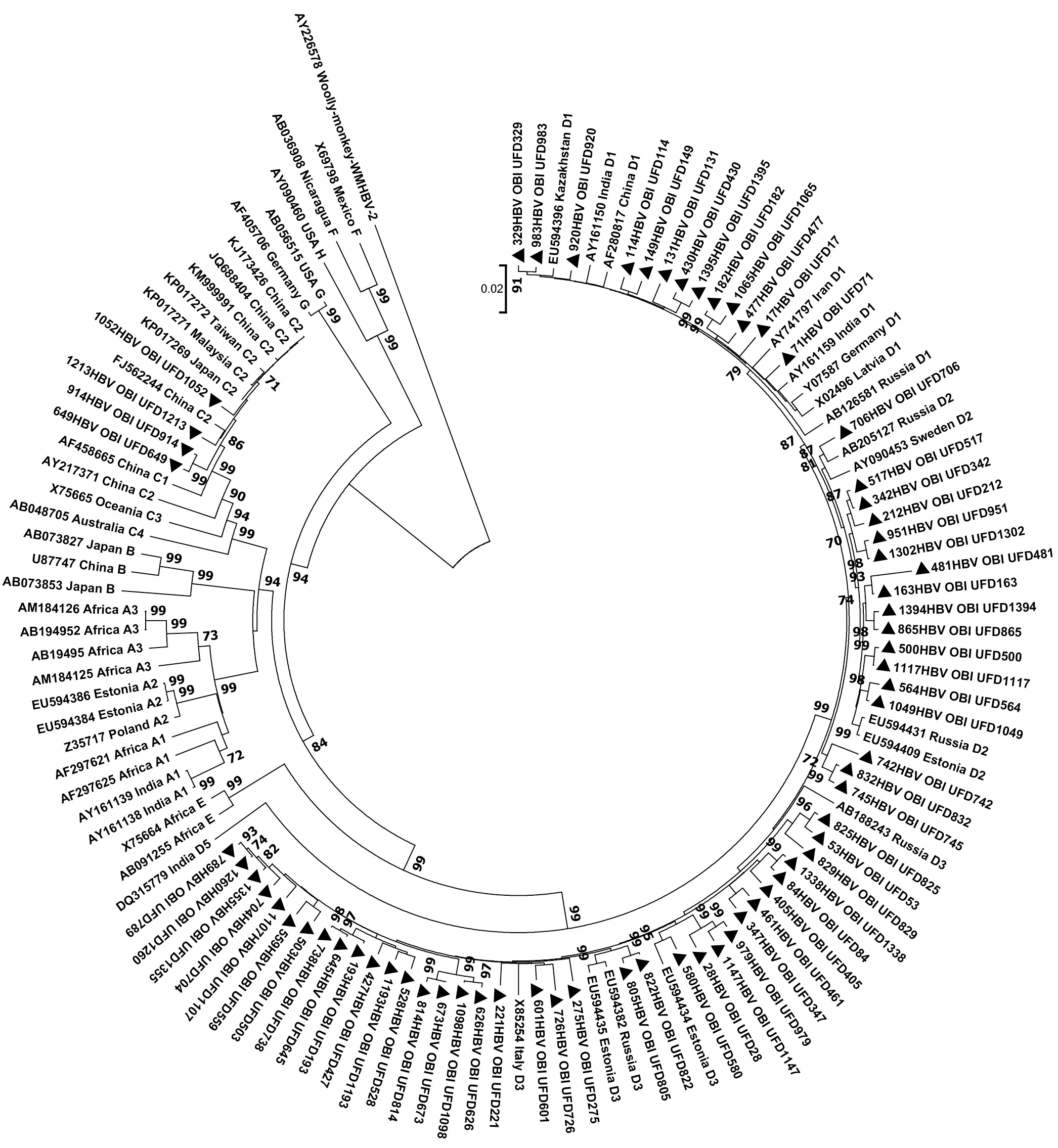
Молекулярно-генетическая характеристика полноразмерного генома вируса гепатита В у HBsAg-негативных доноров крови в Уральском федеральном округе
Аннотация
Актуальность. По оценкам Всемирной организации здравоохранения, на конец 2019 г. более чем у 296 млн человек в мире зарегистрирован хронический вирусный гепатит В (ВГВ). Распространённость HBsAg-негативной, скрытой формы течения заболевания у доноров крови варьирует в зависимости от региона мира и чувствительности используемых методов анализа. Поскольку генетическое разнообразие вирусов демонстрирует пространственно-временные вариации, а генетический профиль изолятов в ключевых группах, потенциально способных становиться источником распространения патогена, важен для прогнозирования эпидемиологической ситуации, представляется значимым определить циркулирующие среди доноров крови в регионах России генотипы ВГВ.
Цель работы — молекулярно-генетическая характеристика геномов ВГВ, выявленных у HBsAg-негативных доноров крови в Уральском федеральном округе.
Материалы и методы. Материалом исследования служили 1400 образцов плазмы, полученных от HBsAg-негативных доноров крови Уральского федерального округа. Исследование включало определение HBsAg, антител анти-HBs IgG, анти-HBcore IgG, ДНК ВГВ. Для всех выявленных образцов проводили секвенирование и анализ нуклеотидных последовательностей полных геномов ВГВ.
Результаты. Распространённость ДНК ВГВ составила 4,93%, в том числе 4 (0,28%) случая ложного скрытого гепатита В. Среди анти-HBcore IgG-позитивных образцов ДНК ВГВ обнаружили в 18,08% случаев, в то время как у лиц с выявленной ДНК ВГВ анти-HBcore IgG — в 46,38%. У 8,69% изолятов обнаружены одновременно антитела анти-HBs IgG и ДНК вируса при отсутствии анти-HBcore IgG. На основании филогенетического анализа показано, что у HBsAg-негативных доноров крови представлены субгенотипы ВГВ в следующих соотношениях: D3 — 53,62%, D2 — 21,74%, D1 — 18,84%, С2 — 5,8%. Показана высокая вариабельность регионов S, C, P генома вируса в обследованной группе. Во всех выявленных нами случаях HBsAg-негативного хронического ВГВ у доноров крови были представлены вирусы, по крайней мере, с одной аминокислотной заменой в положениях, мутации в которых действуют как ускользающие от вакцины. В регионе обратной транскриптазы гена P в 3 (4,35%) случаях определены мутации устойчивости вируса к лекарственным препаратам: ламивудину, телбивудину, энтекавиру. В регионах preCore/Core выявлены мутации, способствующие прогрессированию заболевания печени.
Заключение. Скрытый, HBsAg-негативный хронический ВГВ представляет собой угрозу передачи ВГВ при переливании крови и её компонентов за счёт крайне низкой вирусной нагрузки, не позволяющей определить вирус с помощью рутинно используемых диагностических наборов. Ситуацию может усугубить выявленное нами обилие и разнообразие аминокислотных замен вируса, включающих мутации иммунологического избегания, мутации фармакорезистентности и мутации, способствующие прогрессированию развития заболевания.
 637-650
637-650


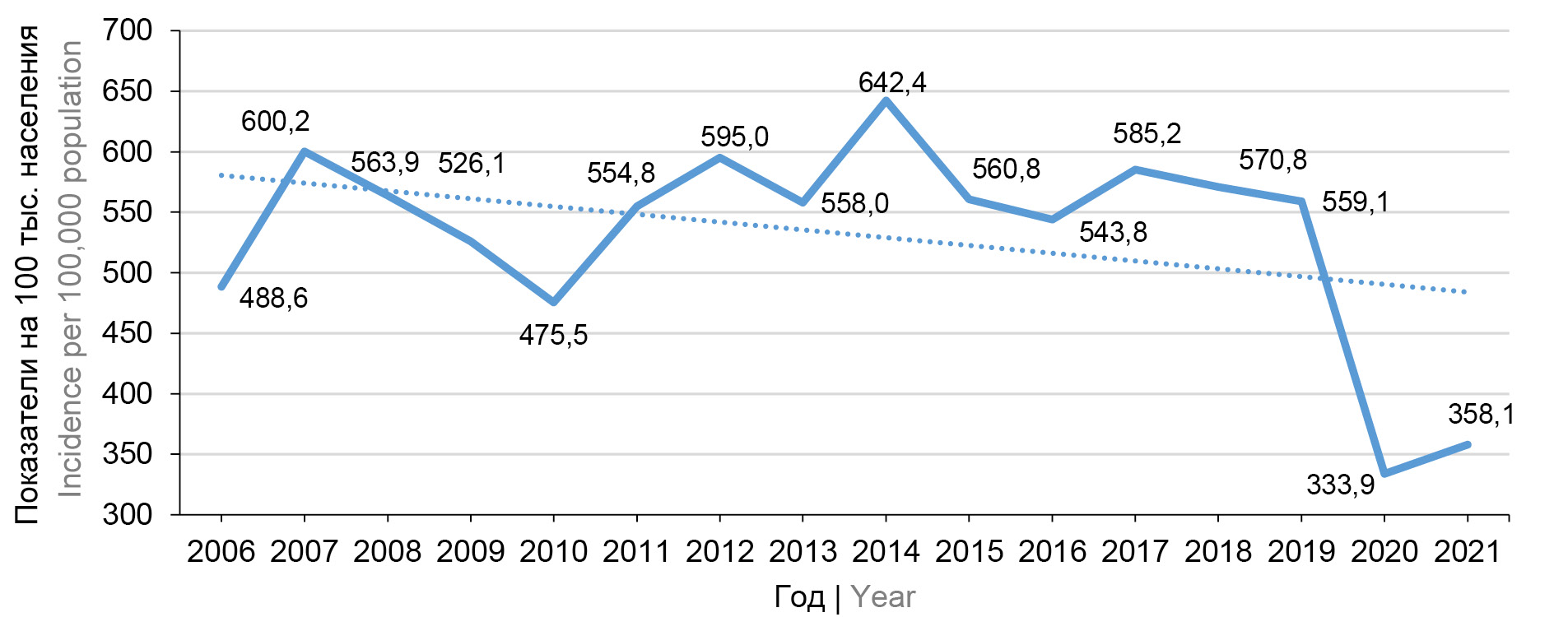
Влияние вакцинопрофилактики на заболеваемость ветряной оспой в России
Аннотация
Введение. Значимость проблемы ветряной оспы (ВО) для здравоохранения и экономики России обусловили внедрение вакцинации против ВО в региональные программы иммунизации некоторых субъектов Российской Федерации и календарь прививок по эпидемическим показаниям.
Цель исследования — оценка эффективности вакцинации против ВО для научного обоснования рекомендаций по расширению национального календаря профилактических прививок.
Материалы и методы. Оценка эффективности вакцинации проведена путём сопоставления объёма вакцинации с показателями заболеваемости ВО в 2006–2021 гг. по данным форм № 2 и № 5 Государственного статистического наблюдения в России в целом и на отдельных территориях.
Результаты и обсуждение. Вакцинация против ВО детей в некоторых субъектах РФ в рамках региональных программ иммунизации и групп риска в рамках календаря прививок по эпидемическим показаниям до 2019 г. практически не влияла на эпидемиологическую ситуацию. Длительное разобщение организованных коллективов в период распространения COVID-19 в 2020 г. привело к снижению заболеваемости и накоплению в популяции лиц, не иммунных к Varicella zoster, что в последующем обусловило подъём заболеваемости ВО в стране в целом. Однако в Центральном, Приволжском и Сибирском федеральных округах удалось избежать роста заболеваемости ВО благодаря значительному увеличению объёма вакцинации детей в 2020–2021 гг. При этом в большинстве субъектов РФ ежегодно вакцинировали менее 2% детей в возрасте 1–6 лет. Вследствие недостаточного охвата прививками против ВО в регионах, где имеется многолетний опыт плановой иммунизации детей, происходит сдвиг заболеваемости на старшие возрастные группы и повышение риска развития врождённых форм инфекции.
Заключение. Для повышения эффективности вакцинопрофилактики ВО рекомендуется внедрить в национальный календарь прививок двукратные прививки с охватом не менее 90% детей в возрасте 1 года, а также продолжить практику иммунизации лиц более старшего возраста из групп риска заболевания.
 651-660
651-660


Двуспиральные РНК — перспективные адъюванты для повышения иммуногенности вакцин
Аннотация
Введение. Наиболее эффективным способом предотвращения инфекционных заболеваний является вакцинопрофилактика. Оптимизировать уровень иммунного ответа вакцин призваны адъюванты. Одними из перспективных, но недостаточно изученных адъювантов являются двуспиральные рибонуклеиновые кислоты (дсРНК) из природных источников.
Цель исследования — изучение адъювантной активности дсРНК, полученной из киллерного штамма дрожжей Saccharomyces cerevisiae, с использованием двух моделей индукции специфического иммунного ответа.
Материалы и методы. В экспериментах использовали субстанцию препарата ридостин с содержанием дсРНК 21,72% (производство ИМБТ ГНЦ ВБ «Вектор» Роспотребнадзора). Специфическую иммунную реакцию моделировали с помощью овальбумина (ОВА) или субстанции вакцины «ЭпиВакКорона» (ЭВК). Эксперименты проведены на 200 самках мышей линии BALB/c. Мышам опытных групп вводили двукратно с интервалом 28 дней антиген (ОВА или ЭВК) и адъювант, мышам группы сравнения — только антиген. На 10-е сутки после 2-й иммунизации забирали образцы крови для определения уровня специфических антител методом иммуноферментного анализа. Результаты оценивали, рассчитывая среднегеометрические титры специфических антител к ОВА или ЭВК.
Результаты. Двукратное введение ОВА или ЭВК мышам приводило к появлению в крови животных специфических антител в титрах, зависящих от дозы вводимого антигена. Совместное введение антигена и дсРНК вызывало увеличение интенсивности иммунного ответа. Наиболее высокий стимулирующий эффект дсРНК наблюдался в дозе 100 мкг/мышь при введении мышам, иммунизированным ОВА (1 мкг/мышь), и в дозе 50 мкг/мышь — при иммунизации субстанцией ЭВК (0,25 человеческой дозы).
Заключение. Полученные данные свидетельствуют о наличии у субстанции дсРНК адъювантных свойств, что даёт основание рассматривать дсРНК в качестве перспективного адъюванта для пептидных вакцин.
 661-668
661-668


Физиолого-биохимическая и генетическая характеристика конкурентных свойств штаммов Escherichia coli в кишечной микрофлоре пациентов с болезнью Крона и здоровых добровольцев
Аннотация
Введение. Болезнь Крона (БК) характеризуется хроническим воспалением различных отделов желудочно-кишечного тракта и сопровождается увеличением доли Escherichia coli. Однако роль E. coli в развитии заболевания остаётся невыясненной.
Цель работы — оценить конкурентные свойства штаммов E. coli, выделенных из кишечника пациентов с БК и здоровых добровольцев, и выявить биохимические и генетические детерминанты, лежащие в их основе.
Материалы и методы. Антагонистическую активность оценивали путём совместного культивирования 11 клинических штаммов E. coli, способных ингибировать рост штамма K-12, с Enterobacter cloacae, Klebsiella pneumonia и Salmonella enterica. Для выяснения механизма антагонистической активности проводили оценку биохимических свойств штаммов и сравнительный геномный анализ.
Результаты и обсуждение. В геномах 11 штаммов от пациентов с БК и здоровых добровольцев, проявивших антагонистическую активность в отношении штамма E. coli K-12, выявлены гены систем продукции бактериоцинов. Выявлены 3 штамма от здоровых добровольцев, ингибирующие рост нескольких представителей семейства Enterobacteriaceae. Биохимические возможности данных штаммов характерны для типичных представителей вида E. coli. Штаммы 1_34_12, активный в отношении E. cloacae, и 1_45_11, способный подавлять рост всех протестированных энтеробактерий, филогенетически родственны лабораторному штамму K-12. Штамм 1_39_1, активный в отношении K. pneumonia и S. enterica, филогенетически близок пробиотическому штамму Nissle 1917 и содержит кластер генов биосинтеза колибактина и вариант гена fimH, повышающий адгезивную способность бактерий.
Заключение. Выявленные штаммы E. coli способны вытеснять энтеробактерии в экспериментах in vitro и могут быть использованы для дальнейшего изучения особенностей взаимодействия комменсалов друг с другом и с организмом хозяина, а также для понимания их роли в поддержании гомеостаза и развитии воспалительных реакций кишечника.
 669-681
669-681


Сравнительный анализ структуры и экспрессии регуляторного гена vasH системы секреции 6-го типа токсигенных и нетоксигенных штаммов Vibrio cholerae
Аннотация
Цель работы — сравнительный анализ структуры регуляторного гена vasH системы секреции 6-го типа и его экспрессии в токсигенных и нетоксигенных штаммах Vibriо cholerae О1 серогруппы El Tor биовара.
Материалы и методы. В работе использовали 35 штаммов, выделенных от больных и из внешней среды с 1970 по 2017 г. на территории России и Украины. Анализ структуры гена vasH и аминокислотной последовательности белка проводили с применением программ UGENE 1.32, MEGA X, BioEdit v. 7.0.9.0. Относительный уровень экспрессии vasH изучали методом 2–ΔΔCt.
Результаты. Установлено, что у токсигенных типичных штаммов и геновариантов V. cholerae О1 El Tor биовара (генотип ctxA+tcpA+) структура гена vasH и аминокислотная последовательность белка VasH идентична референс-штамму V. cholerae N16961 О1 El Tor биовара. У изолятов, не имеющих гены ctxA и tcpA (ctxA–tcpA–), последовательность vasH является вариабельной, у ctxA–tcpА+ (за исключением одного штамма) — не отличается от референсного. Изученные токсигенные типичные штаммы и геноварианты имеют схожий относительный уровень экспрессии гена vasH. У изолятов, не содержащих гены ctxA и tcpA, экспрессия данного гена сопоставима с токсигенными, а у ctxA–tcpА+ штаммов в среднем в 3,1 раза выше, чем у ctxA–tcpA–, и в 2,14–2,60 раза больше, чем у токсигенных.
Заключение. На модели токсигенных и нетоксигенных штаммов V. cholerae О1 El Тor биовара, изолированных в разные периоды текущей пандемии холеры на территории России и Украины, подтверждены данные зарубежных исследователей о наличии интактного гена vasH у токсигенных и вариабельного у изолятов, не имеющих гены ctxA и tcpA. В то же время показано, что у 99% изученных ctxA–tcpA+ штаммов структура vasH идентична токсигенным. Экспрессия гена vasH обнаружена у всех изученных штаммов, при этом наибольшей она была у ctxA–tcpА+. Выявлено всего два нетоксигенных штамма, предположительно синтезирующих функционально неактивный белок VasH.
 682-691
682-691


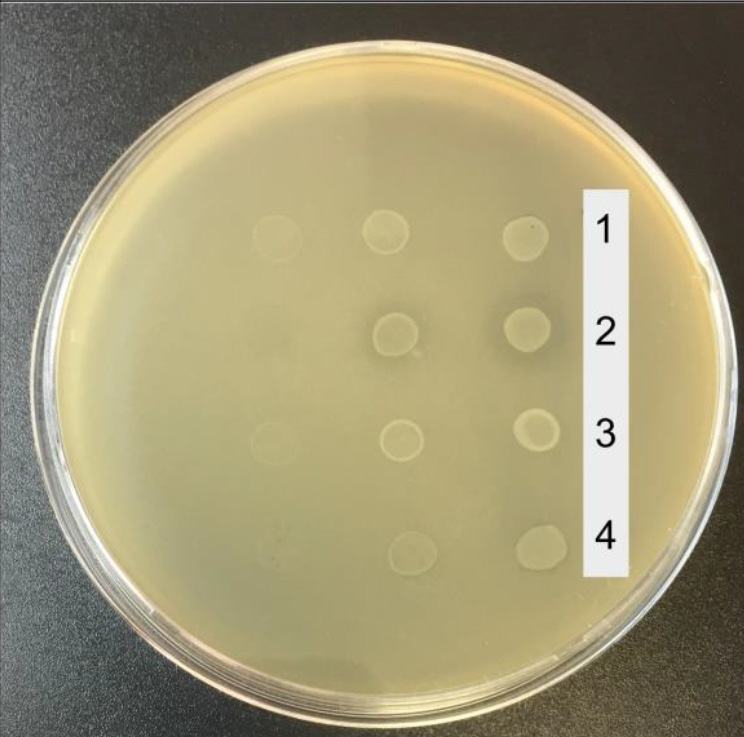
Влияние эфирного масла чабера горного на рост культур условно-патогенных микроорганизмов
Аннотация
Введение. Эфирные масла содержат противомикробные компоненты, которые высокоактивны против широкого спектра микроорганизмов. Эфирные масла являются натуральными, экологически безопасными, низкотоксичными веществами, к ним не формируется резистентность микроорганизмов, они обладают минимальным перечнем побочных эффектов.
Целью исследований было изучение влияния эфирного масла чабера горного (Satureja montana L.) — МЧГ, растущего в Крыму, на рост культур условно-патогенных микроорганизмов.
Материалы и методы. Кратковременное действие МЧГ на рост референтных штаммов микроорганизмов исследовали в соответствии с Европейским стандартом определения скорости инактивации микроорганизмов исследуемым веществом (1997). Для изучения длительного воздействия МЧГ на клинические изоляты Staphylococcus aureus использовали метод разведений в жидкой среде с последующим измерением оптической плотности нарастания биомассы суспензионной культуры. Исследовали также влияние МЧГ на образование биоплёнок клиническими изолятами S. аureus.
Результаты. Цельное МЧГ и его разведения 1 : 10 и 1 : 100 при кратковременном действии (10–60 мин) полностью подавляли рост референтных штаммов условно-патогенных бактерий; рост референтного штамма Candida аlbicans ССМ 885 ингибировался только цельным МЧГ и разведением 1 : 10, а разведение МЧГ 1 : 100 оказывало бактериостатический эффект. Разведения МЧГ 1 : 100 и 1 : 1000 оказывали выраженное антибактериальное действие на суспензионную культуру клинических изолятов S. aureus. МЧГ подавляло образование биоплёнок 11 изолятами S. aureus.
Заключение. МЧГ проявляет выраженное антимикробное действие в отношении референтных штаммов S. aureus АТСС 25923, Escherichia coli АТСС 25922 и грибов C. albicans ССМ 885. Антибактериальное действие МЧГ на клинические изоляты S. aureus позволяет предлагать его в качестве компонента комбинированных препаратов для лечения инфекций, вызванных антибиотикоустойчивыми штаммами стафилококка.
 701-707
701-707


Детерминанты вирулентности и генотипы клинических изолятов Helicobacter pylori
Аннотация
Введение. Helicobacter pylori — основной возбудитель гастродуоденальных заболеваний человека, развитие и степень тяжесть которых зависят от вирулентности штаммов H. pylori.
Цель — выявление детерминант вирулентности и сравнительный анализ генотипов H. pylori у пациентов с хроническим гастритом (ХГ) и язвенной болезнью двенадцатиперстной кишки (ЯБДК).
Материалы и методы. Изучены 53 штамма H. pylori, выделенные в Санкт-Петербурге от пациентов с H. pylori-ассоциированными заболеваниями: 34 — с ХГ, 19 — с ЯБДК. Стандартным методом ПЦР определены генетические детерминанты вирулентности cagA, iceA, vacA и генотипы H. pylori у пациентов с ХГ и ЯБДК.
Результаты. Ген cagA обнаружен у 64,1% штаммов H. pylori. У пациентов с ХГ и ЯБДК доля cagA+ штаммов H. pylori составляла 55,8 и 78,9 соответственно (р > 0,05). Аллельный вариант iceA1 H. pylori выявлен у 47,4% пациентов с ЯБДК, iceA2 — у 47,1% пациентов с ХГ (р > 0,05); аллель vacAs1 доминировал у штаммов, выделенных от больных ЯБДК (94,7% против 70,6% при ХГ; p < 0,05). Существенной разницы в распределении аллельных вариантов m1 и m2 гена vacA H. pylori между группами пациентов не выявлено. Доля штаммов H. pylori генотипа s1/m2 у пациентов с ЯБДК (52,6%) значимо превышала таковую у пациентов с ХГ (20,6%); р = 0,02. Все cagA+ штаммы являлись носителями аллеля vacAs1. Подавляющее большинство штаммов (10 из 11) генотипа cagA-/vacAs2 выделены от больных ХГ.
Заключение. Установлена статистически значимая ассоциация аллельных вариантов vacAs1 и vacAs2, а также генотипов vacA s1/m2 и vacA s2/m2 возбудителя с тяжестью клинических проявлений инфекции H. pylori. Генотипы vacAs1 и vacA s1/m2 возбудителя ассоциированы с язвой двенадцатиперстной кишки.
 692-700
692-700


ОБЗОРЫ
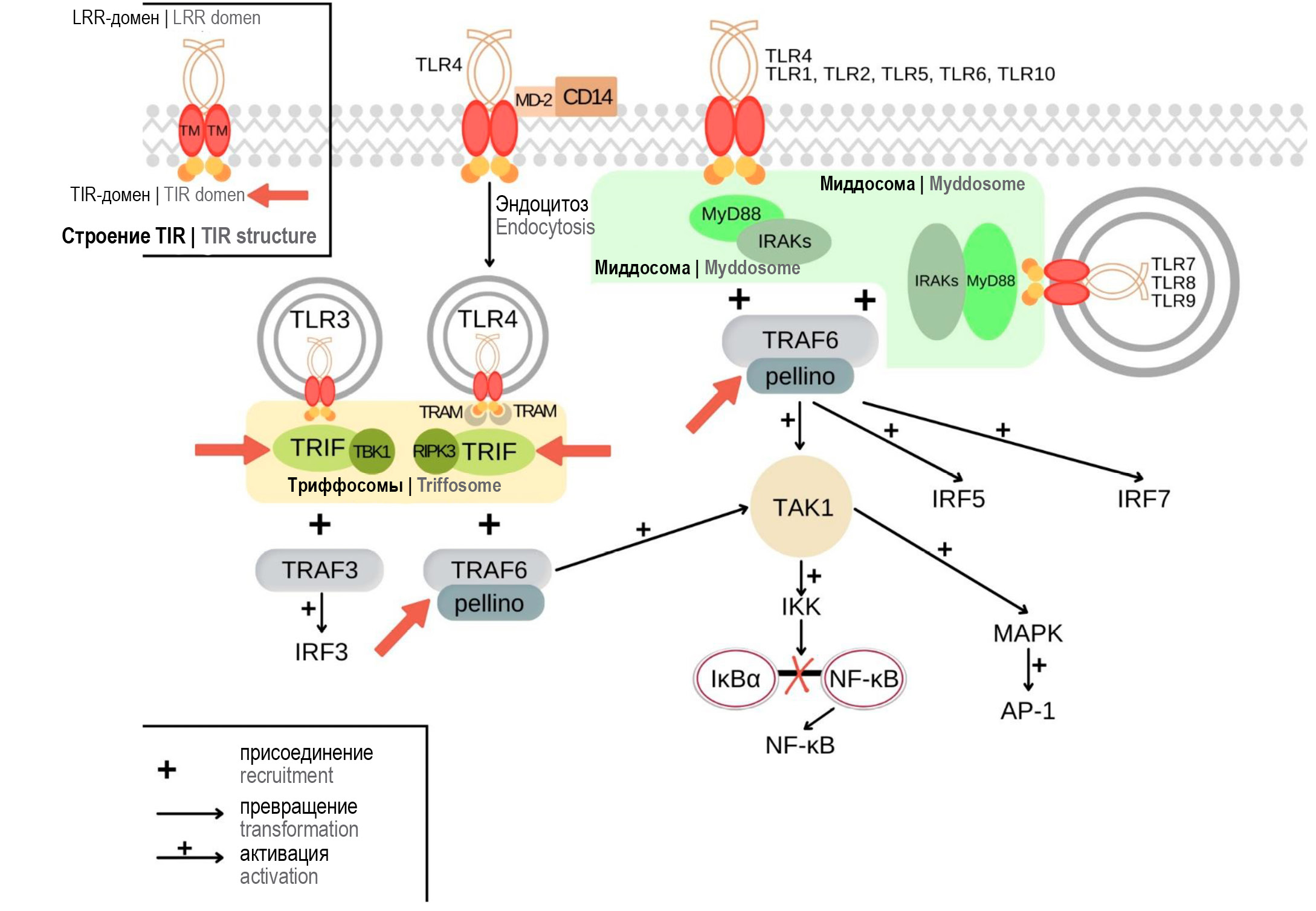
Механизмы формирования толерантности Toll-подобных рецепторов под действием микробных лигандов
Аннотация
Некоторые микроорганизмы способны формировать толерантность. С одной стороны, это позволяет патогенным микробам ускользать от иммунного надзора, с другой стороны — даёт возможность представителям микробиоты колонизировать различные биотопы и выстраивать симбиотические отношения с макроорганизмом. Сложные регуляторные взаимодействия врождённого и адаптивного иммунитета, а также стимуляция антигенами позволяют микробам управлять состоянием иммунологической толерантности. Важную роль в этом процессе играют клетки врождённого иммунитета, которые распознают компоненты микробов при помощи паттерн-распознающих рецепторов. Основным классом этих рецепторов являются Toll-подобные рецепторы (TLRs). При этом, несмотря на универсальность активируемых сигнальных путей, можно наблюдать различные клеточные ответы при взаимодействии TLRs с представителями микробиоты и патогенными микробами, они также будут различаться при острой и хронической инфекции. Изучение механизмов формирования толерантности TLRs имеет большую ценность, поскольку эти рецепторы вовлечены в широкий спектр инфекционных и неинфекционных заболеваний, а также играют важную роль в развитии аллергических, аутоиммунных патологий и онкологических заболеваний. Понимание механизмов формирования толерантности TLRs может также внести существенный вклад в разработку препаратов на основе лигандов этих рецепторов для лечения и профилактики многих заболеваний.
 708-721
708-721


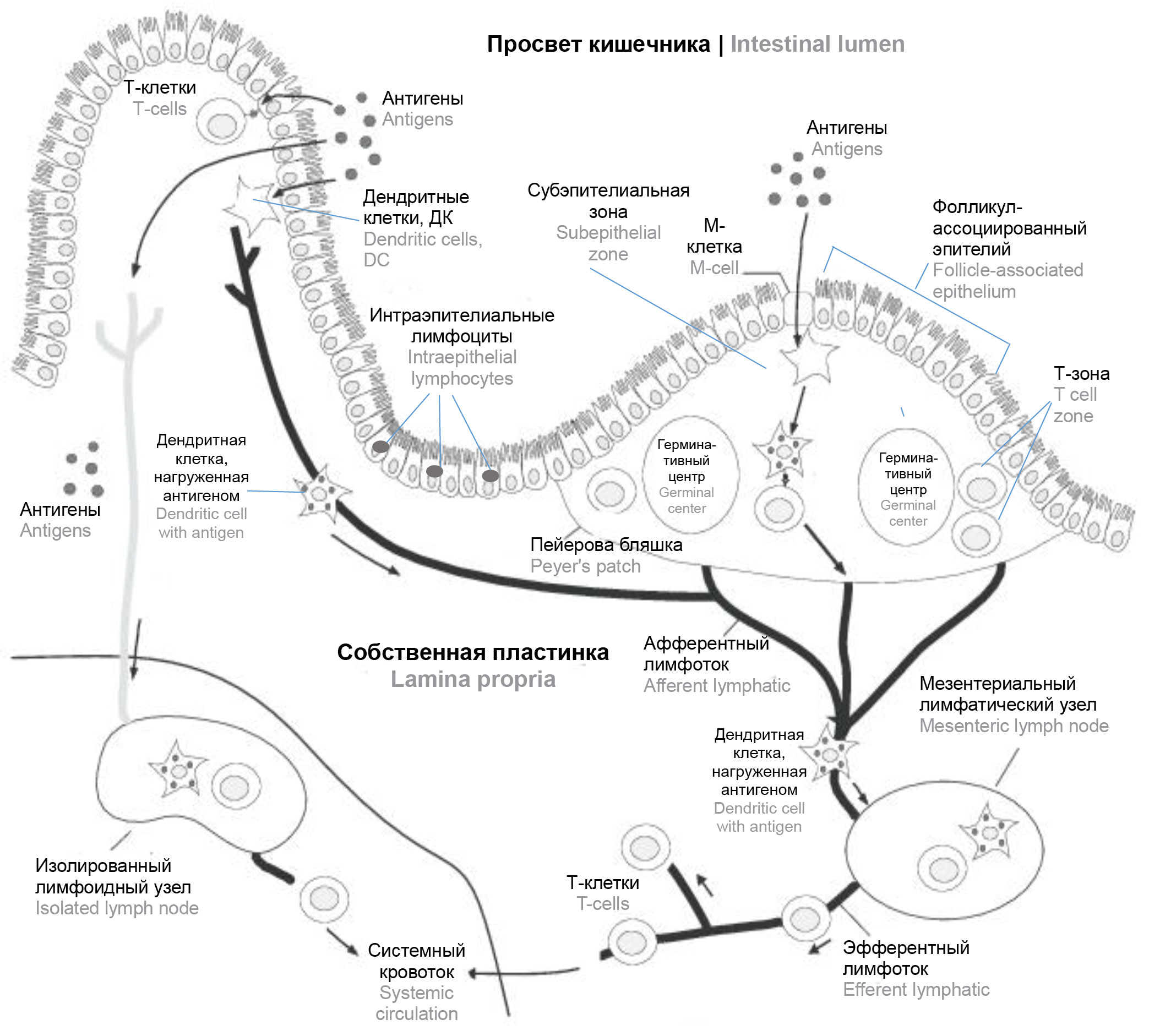
Роль кишечной микробиоты в регуляции иммунных реакций в иммунной системе кишечника в условиях стресса и при модуляции её состава путём введения антибиотиков и пробиотиков
Аннотация
Интенсивное изучение в течение последних двух десятилетий микробной экосистемы желудочно-кишечного тракта (ЖКТ) организма хозяина привело к тому, что кишечный микробиом был признан фундаментальным «игроком», который несет огромную иммунную нагрузку и отвечает как за течение физиологических процессов, так и за развитие патологических состояний человека и животных. Огромное количество бактерий, обитающих в ЖКТ человека, рассматривается как «функционирующий в диалоге орган» в формировании иммунологической толерантности, регуляции нормальной функциональной активности иммунной системы и поддержании гомеостаза слизистой оболочки кишечника. Нарушение взаимодействия между этими физиологическими системами тесно связано с патогенезом различных иммуноопосредованных заболеваний. В свою очередь, всё чаще хронический социальный стресс, наряду с приёмом антибиотиков, пре- и пробиотиков, признаётся одним из ведущих факторов, модулирующих состав микроорганизмов, обитающих в ЖКТ. Настоящий обзор посвящён изучению роли кишечного микробиома в регуляции иммунных реакций кишечно-ассоциированной лимфоидной ткани в условиях стресса и при модуляции её состава путём введения антибиотиков и пробиотиков.
 722-733
722-733


ХРОНИКА
Резолюция XII Съезда Всероссийского научно-практического общества эпидемиологов, микробиологов и паразитологов (Москва, 26–28 октября 2022 г.)
 734-738
734-738