Role of intestinal microbiota in regulation of immune reactions of gut-associated lymphoid tissue under stress and following the modulation of its composition by antibiotics and probiotics administration
- Authors: Topol I.A.1, Polyakova I.S.1, Elykova A.V.1
-
Affiliations:
- Belgorod State National Research University
- Issue: Vol 99, No 6 (2022)
- Pages: 722-733
- Section: REVIEWS
- URL: https://microbiol.crie.ru/jour/article/view/1358
- DOI: https://doi.org/10.36233/0372-9311-270
- ID: 1358
Cite item
Full Text
Abstract
Over the past two decades, active study of the microbial ecosystem of the host organism gastrointestinal tract has led to the recognition of gut microbiome as a "key player" that carries a significant immune pressure and is responsible both for the course of physiological processes and for the development of pathological conditions in humans and animals. A vast number of bacteria living in the human gastrointestinal tract are considered as an “organ functioning in dialogue” in formation of immunological tolerance, the regulation of normal functional activity of the immune system and maintaining the intestinal mucosa homeostasis. However, disturbances in interaction between these physiological systems is closely related to the pathogenesis of different immune-mediated diseases. In turn, in a large number of works chronic social stress, along with the use of antibiotics, pre- and probiotics, is recognized as one of the leading factors modulating in the microbiota of the gastrointestinal tract. This review focuses on the role of the gut microbiome in the regulation of immune responses of GALT under stress and modulation of its composition by antibiotics and probiotics administration.
Keywords
Full Text
Актуальность темы
Согласно современным данным, микробиом кишечника представляет собой крупную симбиотическую экосистему, так называемый «микробный орган», который характеризуется генетической разнородностью и сложными скоординированными взаимоотношениями. Факторы, которые определяют структуру микробных сообществ в кишечнике, ещё мало изучены. Однако известно, что внутренние факторы (генетика организма хозяина и активность иммунной системы) и внешние факторы (антибиотики, пробиотики и рацион питания хозяина) играют важную роль в формировании структуры и функции этого микробного сообщества [1, 2]. За последнее десятилетие становится всё более очевидным тот факт, что кишечная микробиота имеет огромное значение в поддержании гомеостаза кишечника, регуляции нормальной функциональной активности иммунной системы слизистых оболочек желудочно-кишечного тракта (ЖКТ) организма хозяина. Нарушение взаимодействия между этими физиологическими системами связано с патогенезом иммуноопосредованных заболеваний: пищевой аллергии, воспалительных заболеваний кишечника, аутоиммунных и метаболических расстройств и др., и это в очередной раз подчёркивает важность изучения функции микробиоты при таких заболеваниях.
Неотъемлемой частью современной жизни является социальный стресс. Даже в условиях мирного времени около 80% населения живёт в условиях хронического социального стресса (ХСС) высокого и среднего уровня [3]. Несмотря на то что стресс — это важный физиологический адаптационный механизм, связанный с возможностью организма скорректировать свой гомеостаз и, таким образом, минимизировать потенциальное воздействие угрозы, ХСС способен не только вызвать значительные нарушения в нейроэндокринной системе и приводить к психосоматическим проявлениям, таким как тревога, депрессия, но и служить причиной изменений в функционировании врождённого и адаптивного иммунитета. Стресс-индуцированная иммунная дизрегуляция является триггером развития многих патологических состояний, включая аутоиммунные заболевания [4], воспалительные заболевания кишечника, например болезнь Крона и язвенный колит [5–7], инфекции [5] и опухоли [1, 8]. Кроме того, ХСС всё чаще признаётся одним из ведущих факторов, модулирующих состав микроорганизмов, обитающих в ЖКТ. В ряде исследований показано, что и сам ХСС, и применение антибиотиков на фоне ХСС резко изменяют состав кишечной микробиоты у людей и лабораторных животных [6, 7]. В свою очередь, кишечная микробиота является важным звеном в развитии патологического процесса при стрессе, тем самым выступая в качестве важного медиатора здоровья организма хозяина. Так, нарушения микробиоты кишечника были зарегистрированы у приматов с хроническим стрессом [9] и на моделях грызунов [10–13].
Цель настоящего обзора состоит в обобщении фактических данных о роли кишечной микробиоты в регуляции иммунных реакций кишечно-ассоциированной лимфоидной ткани (gut-associated lymphoid tissue — GALT) в условиях стресса и при модуляции её состава путём введения антибиотиков и пробиотиков. Работа выполнена на основе анализа публикаций, размещённых в электронных базах данных PubMed, Web of Science, Scopus. Глубина поиска составила 18 лет (2003–2021 гг.). Поиск публикаций проводился по следующим ключевым словам: «обзор», «хронический стресс», «кишечная микробиота», «антибиотики», «пробиотики», «иммунитет».
Основная часть
Самая большая коллекция лимфоидной ткани в организме — GALT — обеспечивает динамический иммунологический барьер по всему ЖКТ. Изменения в функциональной активности иммунных клеток, эпителиальных клеток, секреции антимикробных пептидов и других интегральных медиаторов в пределах этого иммунологического барьера могут напрямую изменять состав и функции кишечной микробиоты [14–16].
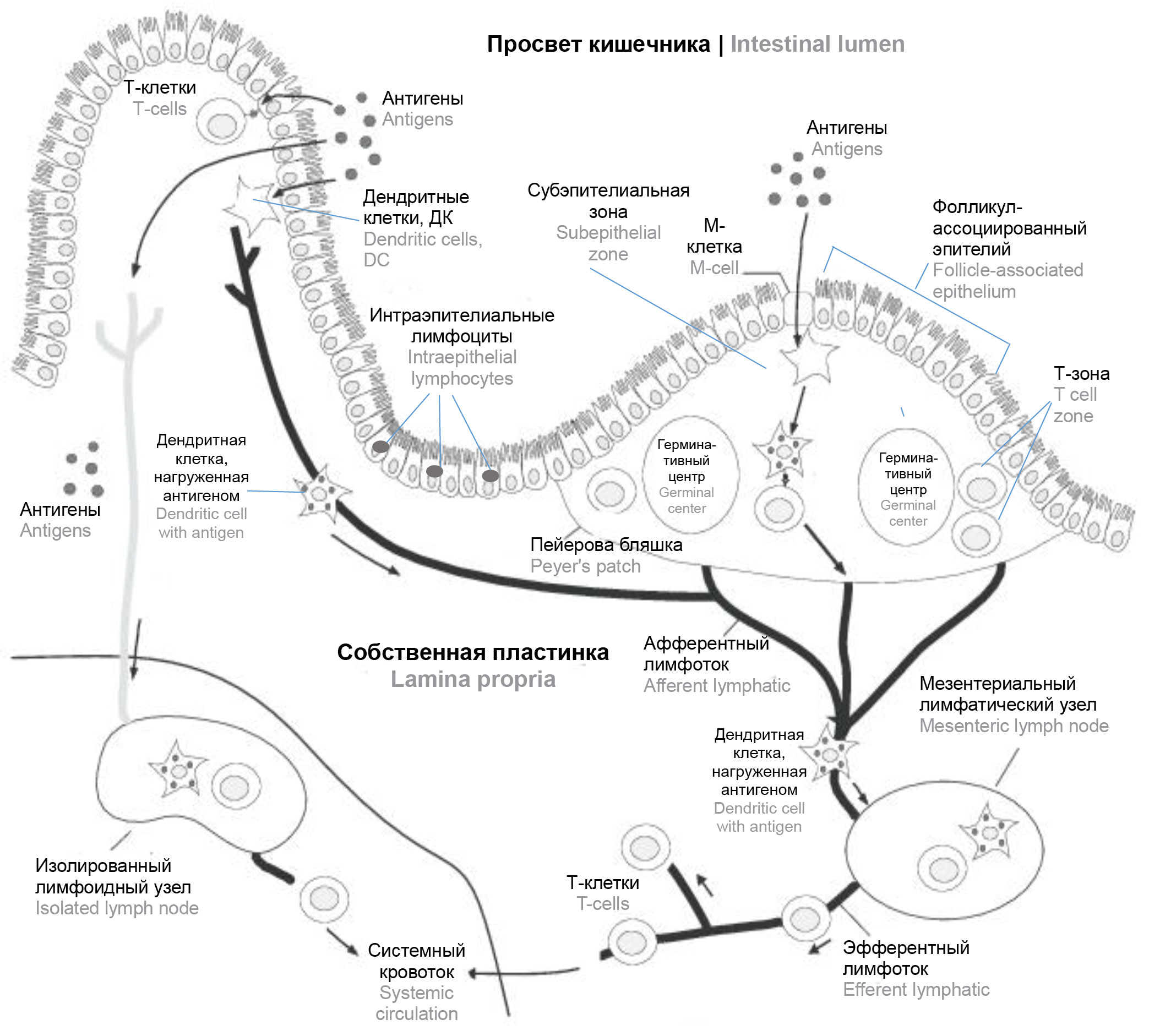
Морфологически в GALT выделяют индуктивную (где происходит стимуляция антигенами «наивных» лимфоцитов) и эффекторную зоны (иммунный ответ, продукция секреторного иммуноглобулина А), образованные диффузно расположенными или организованными лимфоидными образованиями, часть из которых к тому же являются видоспецифичными. К первым образованиям относят интраэпителиальные лимфоциты и лимфоциты в собственной пластинке слизистой оболочки, ко вторым — компактно размещённые скопления лимфоцитов в виде сгруппированных лимфоидных узелков (пейеровы бляшки), изолированных лимфоидных узелков и заполненных лимфоцитами ворсинок. Пейеровы бляшки располагаются в тонком кишечнике, главным образом в стенках подвздошной кишки в собственной пластинке слизистой и в её подслизистой основе [17]. Они являются лимфоэпителиальными образованиями с участием специализированного фолликуло-ассоциированного эпителия с М-клетками [17]. Важными функциональными зонами пейеровых бляшек являются субэпителиальная зона (купол), где происходят непосредственная индукция иммунного ответа, процессинг антигенов, праймирование антиген-специфических Т- и В-лимфоцитов [17], и лимфатические фолликулы с герминативными центрами, в которых осуществляются соматические гипермутации и рекомбинации. Данные процессы обеспечивают переключение синтеза антител разных классов и созревание активированных В-лимфоцитов (рисунок).
Общий план-схема строения иммунной системы кишечника (GALT). Источник | Source: Zgair A., Chi Man Wong J., Gershkovich P. Targeting Immunomodulatory Agents to the Gut-Associated Lymphoid Tissue // Neuro-Immuno-Gastroenterology. Cham; 2016. Р. 237–261. DOI: https://doi.org/10.1007/978-3-319-28609-9_14 / Schematic representation of the gut-associated lymphoid tissue (GALT). Источник | Source: Zgair A., Chi Man Wong J., Gershkovich P. Targeting Immunomodulatory Agents to the Gut-Associated Lymphoid Tissue // Neuro-Immuno-Gastroenterology. Cham; 2016. Р. 237–261. DOI: https://doi.org/10.1007/978-3-319-28609-9_14
В свою очередь, микробная экосистема ЖКТ представляет собой иммунологически сложный и метаболически активный орган [18–21]. Выступая в качестве ключевого фактора влияния на GALT, кишечный микробиом, по разным оценкам, содержащий более 1014 бактериальных клеток как комменсальной, так и патогенной микрофлоры [14, 18], несёт огромную иммунную нагрузку на ЖКТ и рассматривается как «функционирующий в диалоге орган» в формировании иммунологической толерантности и поддержании гомеостаза слизистой оболочки кишечника, особенно в условиях ХСС.
Врождённая иммунная система реагирует на повреждение клеток или патогенную транслокацию через паттерн-распознающие рецепторы, включающие трансмембранные Toll-подобные рецепторы (TLR), которые сканируют внешнюю среду кишечного просвета, внутриклеточные Nod-подобные рецепторы, «охраняющие» цитоплазматическое пространство [22–25], и RIG-подобные рецепторы, имеющие решающее значение для адекватного противовирусного ответа и распознавания различных вирусов [24]. Эти паттерн-распознающие рецепторы способны специфически распознавать и связывать различные микробные макромолекулярные лиганды, так называемые патоген-ассоциированные молекулярные паттерны, и запрограммированы для обнаружения структур, высвобождаемых повреждёнными клетками. В свою очередь, микробы также могут распознавать иммунные регуляторы, такие как хемокины, провоспалительные и противовоспалительные цитокины, через паттерн-распознающие рецепторы, и эти регуляторы играют важную роль в аутоиммунном и адаптивном иммунитете [25]. Все классы паттерн-распознающих рецепторов широко экспрессируются клетками GALT и играют ключевую роль в развитии воспаления и инициации адаптивного звена иммунной системы.
Наиболее полно охарактеризовано взаимодействие рецепторного комплекса TLR2 и TLR4 с патоген-ассоциированными молекулярными паттернами [25–27]. TLR2 функционально связаны с цитоплазматической мембраной клетки и распознают патоген-ассоциированные молекулярные паттерны бактерий, грибов, вирусов и паразитов, которые имеют в своём составе липопротеиды, липотейхоевые кислоты, пептидогликан, липоарабиноманан, зимозан, хитин, гемагглютинины, порины, гликоинозитол-фосфолипиды [26, 27]. TLR4 является первичным клеточным сенсором бактериального липополисахарида и ключевым медиатором адаптивного иммунного ответа на грамотрицательные бактерии [28–30]. Связывание лигандов с TLR2 и TLR4 инициирует каскад сигналов через ряд адаптерных молекул, прежде всего Myd88 (myeloid differentiation factor 88), а также активирует транскрипционные факторы: нуклеарный фактор κB и интерферон-чувствительный фактор-3, инфламмасому NLRP3, регулирующие экспрессию провоспалительные цитокины — интерлейкин (ИЛ)-1β, ИЛ-6, ИЛ-18, фактор некроза опухоли (ФНО)-α и интерферонов (ИФН) [25, 29, 31]. TLR активно экспрессируются Т- и В-лимфоцитами [26], а изменения уровня их экспрессии в GALT в условиях стресса может напрямую влиять на дифференцировку Т- и В-лимфоцитов [29–31].
Развитие и функциональное состояние GALT зависит от состава кишечной микробиоты. Так, у гнотобиотических (GF, Germ-Free) животных нарушается морфогенез и наблюдаются значительные дефекты как врождённого, так и адаптивного звеньев иммунной системы, т.е. кишечная микробиота формирует GALT и регулирует дифференцировку отдельных субпопуляций Т-клеток: Т-хелперов (Th)-1, Th2, Th17, Т-регуляторных (Treg) [21]. Колонизация GF-мышей смесью комменсальной микробиоты запускает генерацию Treg-клеток и ингибирует Th17-опосредованные иммунные ответы [21], и этот факт позволяет предположить, что микробиота играет жизненно важную роль в индукции Treg-клеток в кишечнике. В работах I. Ivanov и соавт. показано, что сегментарные нитевидные бактерии индуцируют в GALT ИЛ-23-опосредованную дифференцировку провоспалительных Th17- и Th1-клеток, а некоторые представители рода Clostridium (кластеры IV и XIVa) и полисахарид A Bacteroides fragilis стимулируют образование Treg-клеток и продукцию супрессорного цитокина ИЛ-10, который, в свою очередь, подавляет продукцию провоспалительных цитокинов (ИЛ-17, ИЛ-23 и ФНО-α) [32]. Кроме того, моноколонизация GF-мышей B. fragilis модулировала патогенный/регуляторный Т-клеточный баланс и, следовательно, защищала хозяина от индуцированного Helicobacter hepaticus воспаления кишечника. Микробиота кишечника также влияет на активацию и дифференцировку В-клеток. Эти процессы запускаются активацией ряда рецепторов, таких как рецептор В-клеток, CD40, TLR, NOD-подобных рецепторов, рецепторов цитокинов (например, ИЛ-21R) и/или рецепторов фактора активации В-клеток и индуцирующего пролиферацию лиганда (APRIL). C. Buchta и соавт. показано, что В-клетки экспрессируют TLR1, 2, 4, 6, 7 и 9 и активация этих TLR увеличивает выживаемость В-клеток, презентацию антигена и выработку антител [33]. Интересно, что кишечная микробиота также увеличивает количество регуляторных В-клеток (Breg), обладающих противовоспалительными эффектами. Колонизация кишечной микробиоты индуцирует выработку ИЛ-1β и ИЛ-6 дендритными клетками и эпителиальными клетками кишечника и, таким образом, способствует дифференцировке наивных B-клеток в Breg в брыжеечных лимфатических узлах [19]. Breg, в свою очередь, продуцируют ИЛ-10 для подавления провоспалительных субпопуляций Т-клеток. Таким образом, микробиота, помимо продукции антител, может оказывать различное влияние на В-клетки.
Биологическая важность изменений микробиоты, вызванных стрессом, недостаточно изучена. Тем не менее в ряде исследований показано, что повышение реактивности иммунной системы, вызванное социальным стрессом, зависит от микробиоты. M. Bailey и соавт. обнаружили, что ХСС значительно увеличивает уровни ИЛ-6 и моноцитарного хемоаттрактантного белка-1 в крови и повышает реактивность макрофагов селезёнки на микробную стимуляцию, а также наблюдали тенденцию к снижению уровня Lactobacillus spp. и Bacteroides spp. в кишечнике [28]. Однако эти эффекты не проявлялись у GF-мышей или мышей, экспериментально получавших антибиотики для уменьшения микробиоты в кишечнике [1, 28]. Индуцированное ХСС увеличение бактерицидной активности макрофагов не происходило у IL-1R1− /−-мышей [1, 2, 28]. Таким образом, изменения состава микрофлоры в условиях стресса способны как вызвать развитие воспалительных заболеваний, так и предупреждать их развитие.
Кроме этого, ХСС активирует врождённую иммунную систему [27, 34–36], стимулирует продукцию провоспалительных цитокинов ИЛ-6/STAT3 и ФНО-α [37] и вызывает бактериальную транслокацию в GALT [27, 36]. Одним из возможных механизмов такого стимулирующего воздействия ХСС может быть активация адреналин/норадреналиновой (AI-3) системы, которая получила название «Quorum Sensing» (QS), что можно перевести как «чувство кворума» [38–40]. AI-3-активность была обнаружена у многих представителей интестинальной микробиоты — как у комменсальной (Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae) [38, 40], так и у патогенной (E. coli O26: H11, Shigella sp., Salmonella sp.), что свидетельствует о вероятном участии этого медиатора в межвидовом «общении». Самым интригующим открытием стало обнаружение агонистических взаимодействий AI-3 QS-системы с адреналином и норадреналином человека [40, 41]. Данный факт позволяет предположить наличие у бактерий довольно специфических механизмов рецепции сигнальной информации организма хозяина. Возможно, катехоламины, которые синтезируются в условиях ХСС, выступают в роли лигандов для рецепторов QS-системы AI-3 бактерий, воспринимаются как сигнал, свидетельствующий о достаточной для атаки плотности бактериальной популяции, и вызывают их транслокацию в GALT с гиперактивацией сначала врождённой, а затем адаптивной иммунной системы.
Недавно высказано предположение, что состав кишечной микробиоты может быть изменён путём введения бактерий, бактериальных субстратов или антимикробных препаратов, и вполне вероятно, что это может привести к значительной модуляции иммунной системы [42]. Среди наиболее часто применяемых препаратов в качестве таких потенциальных модуляторов микробного сообщества кишечника, влияющих на уровень иммунного ответа, являются антибиотики и пробиотики. Известно, что приём антибиотиков является фактором риска развития в дальнейшем воспалительных и аутоиммунных заболеваний, в частности сахарного диабета 1-го и 2-го типов, воспаления кишечника и др. [43–46]. Эффекты, вызванные применением антибиотиков, включают изменения состава бактериальных лигандов и производимых микробиотой метаболитов, потерю специфических бактериальных сигналов. Так, пероральное введение канамицина стимулирует Th2-поляризацию наивных лимфоцитов у мышей линии BALB/c и повышает у них риск развития аллергических заболеваний [47]. Аминогликозиды через изменения микробной композиции кишечника, прежде всего уменьшение количества комменсальной микрофлоры, также способны влиять на уровень экспрессии TLR2 и TLR4 [30], молекул основного комплекса гистосовместимости класса II [45], уменьшать продукцию антимикробных пептидов [42], влиять на уровень провоспалительных Th17-клеток [32]. Кроме того, недавно было обнаружено, что данный класс антибиотиков способен стимулировать образование новых М-клеток, которые расположены не в зоне фолликул-ассоциированного эпителия, а на поверхности кишечных ворсинок (так называемых ворсинчатых М-клеток) [48]. Появление новых М-клеток является процессом индуцибельным, и одним из таких индукторов их образования являются именно аминогликозиды. Недавние работы на мышах показали, что антибиотики приводят к увеличению количества свободной сиаловой кислоты в кишечнике, которая затем может быть использована условно-патогенными микроорганизмами (Salmonella typhimurium и Clostridium difficile) для усиления роста микробной колонии [45].
В свою очередь, пробиотики, в частности лактобактерии, путём экспрессии молекулярных эффекторов способны оказывать положительное влияние на GALT через ряд механизмов: колонизационную резистентность, усиление продукции муцина, антимикробных пептидов, супрессорных цитокинов, регулирование плотных контактов между эпителиоцитами и др. Лактобактерии производят метаболиты: триптофан-индол, индол-3-ацетат, триптамин [45, 49], которые являются лигандами арил-гидрокарбоновых рецепторов, экспрессирующихся на Th17-клетках, врождённых лимфоцитах, моноцитах, макрофагах и дендритных клетках [45]. Изменения содержания лактобактерий влияют на экспрессию клетками GALT фермента индоламин-2,3-диоксигеназы, который индуцирует катаболизм триптофана в проапоптотические метаболиты (например, кинуренин), а они, в свою очередь, способны подавлять активацию эффекторных Т-клеток. Обнаружена способность экспрессирующих индоламин-2,3-диоксигеназы клеток управлять дифференцированием наивных CD4+-Т-лимфоцитов в Foxp3+-iTreg-клетки, а также изучена их способность непосредственно активировать созревание Treg-клеток и предупреждать индуцированную воспалением их конверсию в провоспалительные субпопуляции Т-хелперов: Th17- и Th1-клетки [47, 49].
Ещё один метаболит кишечной микрофлоры — короткоцепочечные жирные кислоты (short-chain fatty acids — SCFA), которые считаются важными сигнальными молекулами в многочисленных физиологических и патологических процессах [50]. SCFA служат лигандами рецепторов свободных жирных кислот-2 (GPR43-рецепторы) и -3 (GPR41-рецепторы), экспрессируются клетками иммунной и нервной систем, а также в ЖКТ, в частности колоноцитами и энтероцитами тонкого и толстого кишечника. Факт вовлечения рецепторов свободных жирных кислот-2 в воспалительный процесс одновременно подтвердился двумя группами ученых, установивших вклад этих рецепторов в активацию иммунных клеток [50]. Так, описана роль SCFA в дифференцировке T-клеток как в эффекторные, так и в Treg-лимфоциты [49, 51], а при воспалении SCFA будут способствовать дифференцировке наивных Т-клеток в Th1 и Th17 для усиления иммунного ответа. Кроме того, SCFA-сигналинг через регуляцию экспрессии ИЛ-10, ИЛ-18 способствует сдвигу Th1/Th17/Treg-клеток в сторону Treg-клеток посредством ингибирования гистоновых деацетилаз [51]. Эта функция также повышает экспрессию генов XBP1, Aicda, Prdm1, AVPR1B и OXTR, участвующих в дифференцировке В-клеток плазмы [19, 52, 53]. В иммунной системе рецепторы свободных жирных кислот-2 экспрессируются на эозинофилах, базофилах, нейтрофилах, моноцитах, дендритных и тучных клетках слизистых оболочек, что позволяет предположить важную роль SCFA в иммунных реакциях [54]. Так, SCFA могут косвенно регулировать В-лимфоциты, увеличивая выработку ИЛ-10 макрофагами и дендритными клетками посредством передачи сигналов SCFA-рецепторами или ингибирования гистоновых деацетилаз и, таким образом, способствовать выработке антител, особенно IgA [54, 55]. SCFA также активируют эпителиальные клетки кишечника через рецепторы GPR41 и GPR43, и эта активация делает эпителиальные клетки высокоэффективными в производстве медиаторов воспаления при активации TLR4 [54, 55].
Показано иммуномодулирующее действие L. рaracasei, частично опосредованное секретируемой протеазой лактоцепином, которая избирательно деградирует ИФН-γ-индуцибельный белок-10, регулирующий иммунные ответы путём рекрутирования лейкоцитов и активирующий TLR4, Th1-клетки, естественные клетки-киллеры и моноциты/макрофаги [56, 57]. Лактобактерии оказывают антидиабетогенное действие в условиях стрептозотоцин-индуцированного диабета [42] и у BB-DP (BioBreeding diabetes prone) крыс за счёт индукции CD4+CD25+Foxp3+-клеток [58, 59], уменьшают риск развития болезни Крона и язвенного колита [48]. Так, пробиотики Bifidobacterium breve и L. rhamnosus GG ингибируют активацию липополисахаридом экспрессии ИЛ-23 в клетках кишечника путём ингибирования ацетилирования гистонов и усиления метилирования ДНК [60, 61], играющего существенную роль в дифференцировке, пролиферации и выживании Th17. L. Chen и соавт. показали, что L. acidophilus ингибирует опосредованное колитом увеличение экспрессии ИЛ-6, ФНО-α и ИЛ-1b, а также подавляет колит-ассоциированный ответ ИЛ-23/Th17 в толстой кишке мыши [62]. Аналогично, пробиотический штамм L. plantarum TN8 снижал экспрессию провоспалительных цитокинов, регулировал иммунную систему кишечника крыс линии Вистар при тринитробензол-сернокислотном индуцированном колите [63].
Однако многие исследования по влиянию лактобактерий на иммунную систему лоббируются фирмами — производителями пробиотиков. Это подтверждается и некоторыми данными, которые свидетельствуют о возможности лактобактерий повышать риск развития аутоиммунных заболеваний, в частности ревматоидного артрита, экспериментального аутоиммунного энцефалита и др. [64–68]. Неконтролируемый приём пробиотиков способен оказывать иммуностимулирующее действие и быть одним из триггеров развития аутоиммунных заболеваний. Кроме того, лактобактерии способны влиять на количество основных регуляторов дифференцировки наивных Т-клеток в провоспалительные Th17-клетки — сегментарные нитевидные бактерии [32] и Bacteroides fragilis, которые стимулируют образование Тreg-клеток и продукцию супрессорного цитокина ИЛ-10 [69], т.е. являются важными регуляторами баланса Th17/Тreg в GALT.
S. Abdollahi-Roodsaz и соавт. продемонстрировали, что моноколонизация мышей с нокаутом антагониста рецептора ИЛ-1 (IL1rn–/–), у которых спонтанно развивается аутоиммунный Т-клеточно-опосредованный артрит, комменсальной L. bifidus привела к быстрому началу заболевания, сравнимому по тяжести и частоте встречаемости с артритом, наблюдаемым у мышей без микробов. Артрит, вызванный L. bifidus, у этой модели обусловлен дисбалансом гомеостаза клеток Treg/Th17 и опосредован передачей сигналов TLR2/TLR4 [65]. В других работах показано, что пероральное введение лактобактерий экспериментальным животным может активировать экспрессию TLR2 и TLR4, снижать уровень Treg-клеток и увеличивать количество провоспалительных Th17- и Th1-клеток, а также ИЛ-12 [27]. Так, очищенный LTA L. plantarum str. WCFS1, L. plantarum str. KCTC10887, L. casei str. YIT9029 и L. fermentum str. YIT0159, а также целые клетки L. acidophilus str. NCFM модулируют уровни ФНО-α через TLR2-зависимый механизм [61–63]. Согласно исследованиям Y. Chiba и соавт., в клетках селезёнки L. casei индуцировала продукцию ИЛ-12 клетками CD11b+ сильнее, чем патогенные грамположительные и грамотрицательные бактерии, и эффективно способствовала развитию Th1 с последующим высоким уровнем секреции ИФН-γ [66].
Кроме того, пробиотики способны изменять состав кишечной микрофлоры и таким образом влиять на Th1/Th2-баланс в GALT. В частности, приём L. reuteri меняет уровень экспрессии мРНК транскрипционных факторов Foxp3, GATA3 и Tbet в моноцитах крови новорождённых, снижает риск развития IgE-ассоциированной экземы [67]. L. acidophilus La5 и L. casei DN001 способны уменьшать уровень экспрессии Rorγt и T-bet в моноцитах периферической крови взрослых людей, повышать экспрессию Foxp3, однако не влияют на уровень GATA3 и продукцию цитокинов ФНО-α и трансформирующего фактора роста-β [62, 68]. Y. Chiba и соавт. показали, что L. rhamnosus CRL1505 повышает резистентность мышей линии BALB/c к респираторно-синцитиальным вирусам благодаря стимуляции генерации ИФН-γ-продуцирующих Th1-клеток и редукции Th2-ответа [66]. Способность увеличивать экспрессию цитокинов ИЛ-12 и ИФН-γ в пейеровых бляшках мышей была установлена для L. plantarum 06CC2 [58]. Приём мышами L. casei YIT9029, L. casei HY7201, L. brevis HY7401 или L. plantarum HY20301 преимущественно увеличивал продукцию ИЛ-12 и ИФН-γ, снижая при этом уровень Th2-зависимых цитокинов ИЛ-4 и ИЛ-5 [59, 66]. Возможность L. plantarum str. YU активировать Th1-ответ и продукцию ИЛ-12 мышиными перитонеальными макрофагами, а также стимулировать активность естественных клеток-киллеров и продукцию IgA клетками селезёнки и пробиотиками частично связывают с активацией TLR2 [69]. Анализ эффектов 7 видов лактобактерий на лимфоциты селезёнки показал их способность увеличивать баланс Th1/Th2-клеток в сторону Th1 из-за повышения соотношения секреции их цитокинов ИФН-γ/ИЛ-4. Y. Chiba и соавт. установили, что L. casei увеличивают продукцию ИЛ-12 клетками селезенки и пейеровых бляшек мышей даже сильнее, чем некоторые патогенные бактерии, что, в свою очередь, стимулирует образование Th1-клеток и продукцию провоспалительного ИФН-γ [66]. Похожие данные были получены K. Shida и соавт., которые показали, что способность L. casei стимулировать дифференцировку Th1 связана с некоторыми полисахаридами их клеточной стенки, в частности PS-1 и PS-2 [59]. Данные эффекты сопровождаются незначительным снижением продукции ИЛ-17, не влияя при этом на количество Th17-клеток, а также не увеличивают плотность Foxp3+-Treg-клеток и продукцию ими супрессорных цитокинов ИЛ-10 и трансформирующий фактор роста-β. Таким образом, в данных исследованиях, несомненно, превалируют провоспалительные эффекты пробиотиков.
Выводы
Проведённый анализ данных литературы показал, что кишечная микробиота — это сложно организованная динамическая «живая» система, которая постоянно находится в тесном контакте с организмом хозяина, имеет огромное значение в поддержании гомеостаза кишечника и играет ключевую роль в регуляции иммунных реакций слизистых оболочек ЖКТ. В свою очередь, реакция GALT на модуляцию состава кишечной микрофлоры, несмотря на общий эффект по снижению активации ее врождённых и адаптивных компонентов, может в отдельных случаях свидетельствовать и об усилении уровня провоспалительной сигнализации.
Несмотря на огромное количество работ в данной области, необходимы дальнейшие исследования для определения связи между микробиомом и изменениями функционального состояния иммунных структур, ассоциированных со слизистыми оболочками ЖКТ, особенно в условиях ХСС. Это, в свою очередь, будет способствовать расширению существующих представлений о генетическом разнообразии кишечной микробиоты, её участии в развитии патологических состояний человека и, возможно, станет перспективным инструментом профилактики и лечения иммуноопосредованных заболеваний.
About the authors
Inna A. Topol
Belgorod State National Research University
Author for correspondence.
Email: innatopol08@gmail.com
ORCID iD: 0000-0001-7729-1465
Cand. Sci. (Biol.), Associate Professor, Department of biomedical disciplines
Russian Federation, BelgorodIrina S. Polyakova
Belgorod State National Research University
Email: innatopol08@gmail.com
ORCID iD: 0000-0002-0228-3513
Cand. Sci. (Biol.), Associate Professor, Department of biomedical disciplines
Russian Federation, BelgorodAnna V. Elykova
Belgorod State National Research University
Email: innatopol08@gmail.com
ORCID iD: 0000-0002-9511-6895
Cand. Sci. (Biol.), Associate Professor, Department of biomedical disciplines
Russian Federation, BelgorodReferences
- Mackos A.R., Maltz R., Bailey M.T. The role of the commensal microbiota in adaptive and maladaptive stressor-induced immunomodulation. Horm. Behav. 2017; 88: 70–8. https://doi.org/10.1016/j.yhbeh.2016.10.006
- Mackos A.R., Varaljay V.A., Maltz R., Gur T.L., Bailey M.T. Role of the intestinal microbiota in host responses to stressor exposure. Int. Rev. Neurobiol. 2016; 131: 1–19. https://doi.org/10.1016/bs.irn.2016.08.002
- Powell N. Psychosocial stress and inflammation in cancer. Brain. Behav. Immun. 2013; 30(Suppl.): 41–7. https://doi.org/10.1016/j.bbi.2012.06.015
- Delévaux I. Stress and auto-immunity. Rev. Med. Interne. 2013; 34(8): 487–92. https://doi.org/10.1016/j.revmed.2012.10.366
- Wei L., Li Y., Tang W., Sun Q., Chen L., Wang X., et al. Chronic unpredictable mild stress in rats induces colonic inflammation. Front. Physiol. 2019; 10: 1228. https://doi.org/10.3389/fphys.2019.01228
- Nishida A., Inoue R., Inatomi O., Bamba S., Naito Y., Andoh A. Gut microbiota in the pathogenesis of inflammatory bowel disease. Clin. J. Gastroenterol. 2018; 11(1): 1–10. https://doi.org/10.1007/s12328-017-0813-5
- Reber S.O., Peters S., Slattery D.A., Hofmann C., Schölmerich J., Neumann I.D., et al. Mucosal immunosuppression and epithelial barrier defects are key events in murine psychosocial stress-induced colitis. Brain Behav. Immun. 2011; 25(6): 1153–61. https://doi.org/10.1016/j.bbi.2011.03.004
- Aadra P.B., Matthew R.R., Scott J.B. The role of the microbiome in cancer development and therapy CA. Cancer J. Clin. 2017; 67(4): 326–44. https://doi.org/10.3322/caac.21398
- Zheng P., Wu J., Zhang H., Perry S.W., Yin B., Tan X., et al. The gut microbiome modulates gut-brain axis glycerophospholipid metabolism in a region-specific manner in a nonhuman primate model of depression. Mol. Psychiatry. 2020; 26(6): 2380–92. https://doi.org/10.1038/s41380-020-0744-2
- Bharwani A., Mian M.F., Foster J.A., Surette M.G., Bienenstock J., Forsythe P. Structural & functional consequences of chronic psychosocial stress on the microbiome & host. Psychoneuroendocrinology. 2016; 63: 217–27. https://doi.org/10.1016/j.psyneuen.2015.10.001
- Ding F., Wu J., Liu C., Bian Q., Qiu W., Ma Q., et al. Effect of Xiaoyaosan on colon morphology and intestinal permeability in rats with chronic unpredictable mild stress. Front. Pharmacol. 2020; 11: 1069. https://doi.org/10.3389/fphar.2020.01069
- González-Torres M.L., Dos Santos C.V. Uncontrollable chronic stress affects eating behavior in rats. Stress. 2019; 22(4): 501–8. https://doi.org/10.1080/10253890.2019.1596079
- Gur T.L., Bailey M.T. Effects of stress on commensal microbes and immune system activity. Adv. Exp. Med. Biol. 2016; 874: 289–300. https://doi.org/10.1007/978-3-319-20215-0_14
- Karl J.P., Hatch A.M., Arcidiacono S.M., Pearce S.C., Pantoja-Feliciano I.G., Doherty L.A., et al. Effects of psychological, environmental and physical stressors on the gut microbiota. Front. Microbiol. 2018; 9: 2013. https://doi.org/10.3389/fmicb.2018.02013
- Molina-Torres G., Rodriguez-Arrastia M., Roman P., Sanchez-Labraca N., Cardona D. Stress and the Gut Microbiota-Brain axis. Behav. Pharmacol. 2019; 30(2 and 3 Spec. Issue): 187–200. https://doi.org/10.1097/FBP.0000000000000478
- Salonen A., Lahti L., Salojärvi J., Holtrop G., Korpela K., Duncan S.H., et al. Impact of diet and individual variation on intestinal microbiota composition and fermentation products in obese men. ISME J. 2014; 8(11): 2218–30. https://doi.org/10.1038/ismej.2014.63
- Jung C., Hugot J.P., Barreau F. Peyer’s patches: the immune sensors of the intestine. Int. J. Inflam. 2010; 2010: 823710. https://doi.org/10.4061/2010/823710
- Vitetta L., Coulson S., Linnane A.W., Butt H. The gastrointestinal microbiome and musculoskeletal diseases: a beneficial role for probiotics and prebiotics. Pathogens. 2013; 2(4): 606–26. https://doi.org/10.3390/pathogens2040606
- Kim M., Kim C.H. Regulation of humoral immunity by gut microbial products. Gut Microbes. 2017; 8(4): 392–9. https://doi.org/10.1080/19490976.2017.1299311
- Kim C.H. Immune regulation by microbiome metabolites. Immunology. 2018; 154(2): 220–9. https://doi.org/10.1111/imm.12930
- Zhao Q., Elson C.O. Adaptive immune education by gut microbiota antigens. Immunology. 2018; 154(1): 28–37. https://doi.org/10.1111/imm.12896
- Claes A.K., Zhou J.Y., Philpott D.J. NOD-like receptors: guardians of intestinal mucosal barriers. Physiology (Bethesda). 2015; 30(3): 241–50. https://doi.org/10.1152/physiol.00025.2014
- Sellge G., Kufer T.A. PRR-signaling pathways-learning from microbial tactics. Semin. Immunol. 2015; 27(2): 75–84. https://doi.org/10.1016/j.smim.2015.03.009
- Degen A.S., Kamyshnyy A.M. Expression of cytoplasmic NOD-2 and RIG-I receptors of innate immunity in intestine of rats in experimental diabetes mellitus. Rossiyskiy immunologicheskiy zhurnal. 2014; 8(3): 525–8. (in Russian)
- Shi N., Li N., Duan X., Niu H. Interaction between the gut microbiome and mucosal immune system. Mil. Med. Res. 2017; 4: 14. https://doi.org/10.1186/s40779-017-0122-9
- Zanin-Zhorov A., Cohen I.R. Signaling via TLR2 and TLR4 directly down-regulates T cell effector functions: the regulatory face of danger signals. Front. Immunol. 2013; 4: 211. https://doi.org/10.3389/fimmu.2013.00211
- Bailey M., Engler H., Powell N., Padgett D.A., Sheridan J.F. Repeated social defeat increases the bactericidal activity of splenic macrophages through a Toll-like receptor-dependent pathway. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2007; 293(3): 1180–90. https://doi.org/10.1152/AJPREGU.00307.2007
- Bailey M., Dowd S., Galley J. Exposure to a social stress or alters the structure of the intestinal microbiota: implications for stressor-induced immunomodulation. Brain Behav. Immun. 2011; 25: 397–407. https://doi.org/10.1016/j.bbi.2010.10.023
- Kamdar K., Nguyen V., DePaolo R.W. Toll-like receptor signaling and regulation of intestinal immunity. Virulence. 2013; 4(3): 207–12. https://doi.org/10.4161/viru.23354
- Liu G., Zhang L., Zhao Y. Modulation of immune responses through direct activation of Toll-like receptors to T cells. Clin. Exp. Immunol. 2010; 160(2): 168–75. https://doi.org/10.1111/j.1365-2249.2010.04091.x
- Yue Y., Chen Y., Liu H., Xu L., Zhou X., Ming H., et al. Shugan Hewei decoction alleviates cecum mucosal injury and improves depressive- and anxiety-like behaviors in chronic stress model rats by regulating cecal microbiota and inhibiting NLRP3 inflammasome. Front. Pharmacol. 2021; 12: 766474. https://doi.org/10.3389/fphar.2021.766474
- Ivanov I.I., Atarashi K., Manel N., Brodie E.L., Shima T., Karaoz U., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 2009; 139(3): 485–98. https://doi.org/10.1016/j.cell.2009.09.033
- Buchta C.M., Bishop G.A. Toll-like receptors and B cells: functions and mechanisms. Immunol. Res. 2014; 59(1-3): 12–22. https://doi.org/10.1007/s12026-014-8523-2
- Bailey M., Kierstein S., Sharma S., Spaits M., Kinsey S.G., Tliba O., et al. Social stress enhances allergen-induced airway inflammation in mice and inhibits corticosteroid responsiveness of cytokine production. J. Immunol. 2009; 182(12): 7888–96. https://doi.org/10.4049/jimmunol.0990062
- Powell N.D., Bailey M.T., Mays J.W., Stiner-Jones L.M., Hanke M.L., Padgett D.A., et al. Repeated social defeat activates dendritic cells and enhances Toll-like receptor dependent cytokine secretion. Brain Behav. Immun. 2009; 23(2): 225–31. https://doi.org/10.1016/j.bbi.2008.09.010
- Bailey M.T., Dowd S.E., Parry N.M., Galley J.D., Schauer D.B., Lyte M. Stressor exposure disrupts commensal microbial populations in the intestines and leads to increased colonization by Citrobacter rodentium. Infect. Immun. 2010; 78(4): 1509–19. https://doi.org/10.1128/IAI.00862-09
- Bartolomucci A. Social stress, immune functions and disease in rodents. Front. Neuroendocrinol. 2007; 28(1): 28–49. https://doi.org/10.1016/j.yfrne.2007.02.001
- Whiteley M., Diggle S.P., Greenberg E.P. Progress in and promise of bacterial quorum sensing research. Nature. 2017; 551(7680): 313–20. https://doi.org/10.1038/nature24624
- Schwab M., Bergonzi C., Sakkos J., Staley C., Zhang Q., Sadowsky M.J., et al. Corrigendum: signal disruption leads to changes in bacterial community population. Front. Microbiol. 2021; 12: 691552. https://doi.org/10.3389/fmicb.2021.691552
- Sperandio V., Torres A., Jarvis B., Kaper J.B. Bacteria-host communication: the language of hormones. Proc. Natl Acad. Sci. USA. 2003; 100(15): 8951–6. https://doi.org/10.1073/pnas.1537100100
- Wahlstrom A., Sayin S.I., Marschall H., Backhed F. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism. Cell Metab. 2016; 24(1): 41–50. https://doi.org/10.1016/j.cmet.2016.05.005
- Gareau M.G., Sherman P.M., Walker W.A. Рrobiotics and the gut microbiota in intestinal health and disease. Nat. Rev. Gastroenterol. Hepatol. 2010; 7(9): 503–14. https://doi.org/10.1038/nrgastro.2010.117
- Bosco N., Noti M. The aging gut microbiome and its impact on host immunity. Genes Immun. 2021; 22(5-6): 289–303. https://doi.org/10.1038/s41435-021-00126-8
- Francino M.P., Moya A. Effects of antibiotic use on the microbiota of the gut and associated alterations of immunity and metabolism. EMJ Gastroenterol. 2013; (1): 74–80. https://doi.org/10.3389/fmicb.2015.01543
- Robinson C., Young V. Antibiotic administration alters the community structure of the gastrointestinal microbiota. Gut Microbes. 2010; (1): 279–84. https://doi.org/10.4161/gmic.1.4.12614
- Willing B., Russell S., Finlay B. Shifting the balance: antibiotic effects on host — microbiota mutualism. Nat. Rev. Microbiol. 2011; 9(4): 233–43. https://doi.org/10.1038/nrmicro2536
- Sandra R.S., González Núñez L., García Del Barco Herrera D., Santos Febles E., Maza Ares D., Millares López R., et al. Role of epidermal growth factor and growth hormone-releasing peptide-6 in acceleration of renal tissue repair after kanamycin overdosing in rats. Iran J. Kidney. Dis. 2014; 8(5): 382–8.
- Tahoun A., Mahajan S., Paxton E., Malterer G., Donaldson D.S., Wang D., et al. Salmonella transforms follicle-associated epithelial cells into M cells to promote intestinal invasion. Cell Host Microbe. 2012; 12(5): 645–56. https://doi.org/10.1016/j.chom.2012.10.009
- Zelante T., Iannitti R.G., Cunha C., De Luca A., Giovannini G., Pieraccini G., et al. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via interleukin-22. Immunity. 2013; 39(2): 372–85. https://doi.org/10.1016/j.immuni.2013.08.003
- Wu W., Sun M., Chen F., Cao A.T., Liu H., Zhao Y., et al. Microbiota metabolite short-chain fatty acid acetate promotes intestinal IgA response to microbiota, which is mediated by GPR43. Mucosal. Immunol. 2017; 10(4): 946–56. https://doi.org/10.1038/mi.2016.114
- Park J., Kim M., Kang S.G., Jannasch A.H., Cooper B., Patterson J., et al. Short chain fatty acids induce both effector and regulatory T cells by suppression of histone deacetylases and regulation of the mTORS6K pathway. Mucosal. Immunol. 2015; 8(1): 80–93. https://doi.org/10.1038/mi.2014.44
- Kazantseva A.V., Davydova Y.D., Enikeeva R.F., Valinurov R.G., Gareeva A.E., Khusnutdinova N.N., et al. The association study of polymorphic variants of hypothalamic-pituitary-adrenal system genes (AVPR1B, OXTR) and aggressive behavior manifestation: a focus on social environment. Res. Results Biomed. 2021; 7(3): 232–44. https://doi.org/10.18413/2658-6533-2021-7-3-0-3
- Shi L.Z., Wang R., Huang G., Vogel P., Neale G., Green D.R., et al. HIF1alpha-dependent glycolytic pathway orchestrates a metabolic checkpoint for the differentiation of TH17 and Treg cells. J. Exp. Med. 2011; 208(7): 1367–76. https://doi.org/10.1084/jem.20110278
- Chang P.V., Hao L., Offermanns S., Medzhitov R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc. Natl Acad. Sci. USA. 2014; 111(6): 2247–52. https://doi.org/10.1073/pnas.1322269111
- Singh N., Gurav A., Sivaprakasam S., Brady E., Padia R., Shi H., et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis. Immunity. 2014; 40(1): 128–39. https://doi.org/10.1016/j.immuni.2013.12.007
- Lee E.Y., Lee Z.H., Song Y.W. CXCL10 and autoimmune diseases. Autoimmun. Rev. 2009; 8(5): 379–83. https://doi.org/10.1016/j.autrev.2008.12.002
- Avdeeva A.S. IFN-γ-induced protein 10 (IP-10) in rheumatoid arthritis: literature review and the authors own data. Nauchno-prakticheskaya revmatologiya. 2017; 55(6): 655–61. https://doi.org/10.14412/1995-4484-2017-655-661 (in Russian)
- Round J.L., Mazmanian S.K. Inducible Foxp3+regulatory T-cell development by a commensal bacterium of the intestinal microbiota. PNAS. 2010; 107(27): 12204–9. https://doi.org/10.1073/pnas.0909122107
- Shida K., Nanno M., Nagata S. Flexible cytokine production by macrophages and T cells in response to probiotic bacteria: a possible mechanism by which probiotics exert multifunctional immune regulatory activities. Gut Microbes. 2011; 2(2): 109–14. https://doi.org/10.4161/gmic.2.2.15661
- Verma R., Lee C., Jeun E., Yi J., Kim K.S., Ghosh A., et al. Cell surface polysaccharides of Bifidobacterium bifidum induce the generation of Foxp3(+) regulatory T cells. Sci. Immunol. 2018; 3(28): eaat6975. https://doi.org/10.1126/sciimmunol.aat6975
- Ghadimi D., Helwig U., Schrezenmeir J., Heller K.J., de Vrese M. Epigenetic imprinting by commensal probiotics inhibits the IL-23/IL-17 axis in an in vitro model of the intestinal mucosal immune system. J. Leukocyte Biol. 2012; 92(4): 895–911. https://doi.org/10.1189/jlb.0611286
- Chen L., Zou Y., Peng J., Lu F., Yin Y., Li F., et al. Lactobacillus acidophilus suppresses colitis-associated activation of the IL-23/Th17 axis. J. Immunol. Res. 2015; 2015: 909514. https://doi.org/10.1155/2015/909514
- Trabelsi I., Ktari N., Ben Slima S., Hamden K., Ben Salah R. Effect of the probiotic strain Lactobacillus plantarum TN8 on trinitrobenzenesulfonic acid induced colitis in rats. J. Anim. Physiol. Anim. Nutr. (Berl.). 2017; 101(2): 311–19. https://doi.org/10.1111 / jpn.12536
- Azad A.K., Sarker M., Li T., Yin J. Probiotic species in the modulation of gut microbiota: an overview. Biomed. Res. Int. 2018; 2018: 9478630. https://doi.org/10.1155/2018/9478630
- Abdollahi-Roodsaz S., Joosten L.A., Koenders M.I., Devesa I., Roelofs M.F., Radstake T.R., et al. Stimulation of TLR2 and TLR4 differentially skews the balance of T cells in a mouse model of arthritis. J. Clin. Invest. 2008; 118(1): 205–16. https://doi.org/10.1172/JCI32639
- Chiba Y., Shida K., Nagata S. Well-controlled pro-inflammatory cytokine responses of Peyer’s patch cells to probiotic Lactobacillus casei. Immunol. 2010; 130(3): 352–62. https://doi.org/10.1111/j.1365-2567.2009.03204.x
- Liu Y., Fatheree N., Mangalat N. Lactobacillus reuteri strains reduce incidence and severity of experimental necrotizing enterocolitis via modulation of TLR4 and NF-κB signaling in the intestine. Am. J. Physiol. Gastrointest. Liver Physiol. 2012; 15: 608–17. https://doi.org/10.1152/ajpgi.00266.2011
- Zarrati M., Shidfar F., Nourijelyani K. Lactobacillus acidophilus La5, Bifidobacterium BB12, and Lactobacillus casei DN001 modulate gene expression of subset specific transcription factors and cytokines in peripheral blood mononuclear cells of obese and overweight people. Biofactors. 2013; 39(6): 633–43. https://doi.org/10.1002/biof.1128
- Shimazu T., Villena J., Tohno M., Fujie H., Hosoya S., Shimosato T., et al. Immunobiotic Lactobacillus jensenii elicits anti-inflammatory activity in porcine intestinal epithelial cells by modulating negative regulators of the Toll-like receptor signaling pathway. Infect. Immun. 2012; 80(1): 276–88. https://doi.org/10.1128/IAI.05729-11
Supplementary files