Том 101, № 6 (2024)
- Год: 2024
- Выпуск опубликован: 14.12.2024
- Статей: 10
- URL: https://microbiol.crie.ru/jour/issue/view/187
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
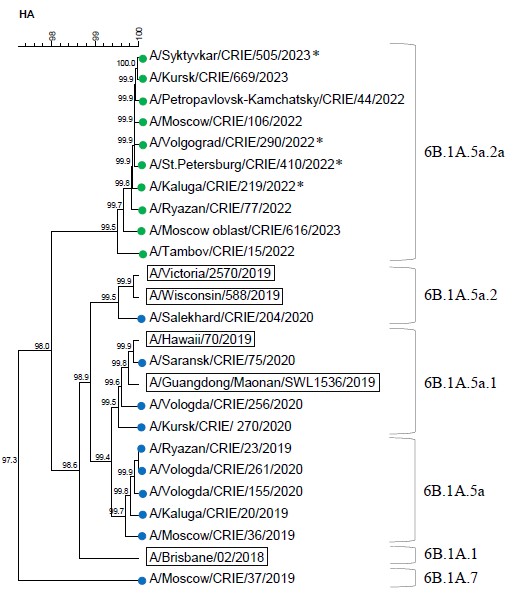
Генетическая характеристика вирусов гриппа A и B, циркулировавших в России в 2019–2023 годах
Аннотация
Актуальность. Вирусы гриппа обладают высоким потенциалом генетических изменений. Ежегодно по всему миру, в том числе в России, проводится мониторинг вирусов гриппа, чтобы определить доминирующие генетические группы и отобрать среди них штаммы, которые войдут в состав противогриппозных вакцин.
Цели исследования: анализ циркуляции вирусов гриппа в России в 2019–2023 гг., проведение филогенетического и молекулярного анализа последовательностей гемагглютинина (HA) вирусов гриппа, выявление мутаций резистентности к ингибиторам нейраминидазы (NA) и ингибиторам ионного канала М2-белка (M2).
Материалы и методы. Исследованы биологические образцы, содержащие РНК вирусов гриппа: 410 А(H1N1)pdm09, 147 А(H3N2) и 167 В(Виктория). Осуществляли секвенирование фрагментов сегментов HA, NA, M, проводили обработку и анализ данных.
Результаты. Исследованы нуклеотидные последовательности HA, NA, M вирусов гриппа А(H1N1)pdm09, А(H3N2) и B(Виктория), циркулировавших в 2019–2023 гг. Наибольшая вариабельность HA наблюдалась у вирусов А(H3N2). Все вирусы гриппа А(H1N1)pdm09 сезона 2022–2023 гг. имели не встречавшуюся ранее мутацию Е224А в HA, которая увеличивает его сродство к α-2,3-сиаловым кислотам — рецепторам, локализованным в лёгких человека, с которыми связывается вирус посредством HA. У 2 и 3% вирусов А(H1N1)pdm09 в сезонах 2019–2020 и 2022–2023 гг. соответственно в рецептор-связывающем сайте HA обнаружена мутация D222N, которая ассоциирована с более тяжёлым заболеванием. Мутация устойчивости к осельтамивиру и занамивиру H275Y в NA выявлена у 2,3% вирусов гриппа A(H1N1)pdm09 в 2022–2023 гг. Во всех исследованных вирусах гриппа A(H3N2) и B мутации устойчивости к осельтамивиру и занамивиру в NA не обнаружены. По данным секвенирования, во всех исследованных вирусах гриппа A(H1N1)pdm09 и A(H3N2) имелась мутация устойчивости к адамантанам S31N в M2.
Выводы. Обнаружение мутаций, затрагивающих антигенные и рецептор-связывающие сайты HA, а также мутаций резистентности в NA и M2 подтверждает необходимость постоянного генетического надзора за вирусами гриппа. Подавляющее большинство циркулирующих в настоящее время вирусов сохраняют чувствительность к ингибиторам NA.
 719-734
719-734


Разработка и исследование вируснейтрализующей активности рекомбинантного человеческого антитела к F-гликопротеину респираторно-синцитиального вируса
Аннотация
Введение. Респираторно-синцитиальный вирус (РСВ) является ведущим в структуре возбудителей инфекций нижних дыхательных путей у детей, а также представляет серьёзную угрозу для пожилых людей и пациентов с ослабленным иммунитетом. Разработка терапевтического препарата на основе рекомбинантных человеческих антител, направленных на блокирование F-гликопротеина РСВ, является актуальной задачей, поскольку позволит снизить заболеваемость РСВ-инфекцией и предотвратит развитие осложнений данной инфекции.
Цель исследования — конструирование плазмидных векторов для накопления высокоактивного рекомбинантного моноклонального антитела FM1 в эукариотической системе экспрессии, направленного против F-гликопротеина РСВ, и оценка специфической активности полученного антитела в отношении различных штаммов РСВ подтипов А и В in vitro.
Материалы и методы. Получение экспрессионных конструкций, кодирующих рекомбинантное антитело FM1, выполняли методами генной инженерии. Накопление антитела проводили в клеточной линии CHO-K1 путём транзиентной экспрессии. Препарат антитела очищали из культуральной жидкости методом аффинной хроматографии с использованием в качестве лиганда модифицированного белка А. Оценку вируснейтрализующей активности антитела оценивали в реакции микронейтрализации с несколькими штаммами РСВ на монослойной культуре клеток Vero.
Результаты. Создана двухплазмидная векторная система для экспрессии рекомбинантного антитела FM1 к F-гликопротеину РСВ, получен временный CHO-продуцент этого антитела. Антитело накоплено, очищено и охарактеризовано; доказана его биологическая активность. Продемонстрировано, что антитело обладает повышенной вируснейтрализующей активностью в отношении эталонных и сезонных штаммов РСВ подтипов А и В по сравнению с контрольным препаратом паливизумабом.
Заключение. Препарат на основе полученного рекомбинантного антитела FM1 позволит решить проблему импортозамещения средств защиты против РСВ-инфекции. В настоящее время коллектив авторов ведёт работу над получением стабильного клона-продуцента FM1 с высокой продуктивностью и жизнеспособностью, а также исследует терапевтическую эффективность этого антитела на модели сублетальной РСВ-инфекции у мышей.
 735-747
735-747


Патогенный потенциал орнитогенных штаммов Escherichia coli, выявленных в полярных регионах Земли
Аннотация
Введение. Патогенные штаммы Escherichia coli являются важным объектом мониторинга в природе, сельском хозяйстве и человеческом обществе в рамках концепции «Единого здоровья». Колонии мигрирующих птиц и птичьи базары в высоких широтах могут быть точками активных внутривидовых и межвидовых контактов между различными видами животных, сопровождающихся распространением микроорганизмов. В то же время филогеография E. coli в контексте наличия природных очагов колибактериозов в полярных регионах практически не изучалась.
Цель работы: оценка патогенного потенциала штаммов E. coli, распространённых в полярных регионах Земли, на основе анализа геномов данных бактерий из выборки, характеризующей типичные орнитогенные экосистемы Арктики и Антарктики.
Материалы и методы. В работе были использованы штаммы E. coli, выделенные из орнитогенного биологического материала в ходе экспедиций на высокоширотные территории Арктики (архипелаги Новая Земля, Земля Франца-Иосифа, Шпицберген) и Антарктики (архипелаг Хасуэлл). Из них 16 штаммов, ассоциированных с птицами (12 полярных штаммов и 4 штамма, выделенных в умеренных широтах), были отобраны для полногеномного секвенирования с использованием технологии BGI. Аннотирование геномов было сфокусировано на идентификации генов, кодирующих факторы патогенности и устойчивости к антимикробным препаратам, а также на определении принадлежности штаммов к отдельным серотипам и генетическим линиям, в том числе на основе использования метода cgMLST.
Результаты. Проведённое аннотирование геномов E. coli позволило установить их принадлежность к различным сиквенс-типам в схемах мультилокусного секвенирования-типирования и полногеномного секвенирования-типирования. Анализ географического распространения сиквенс-типов «полярных» штаммов E. coli, определённых методом cgMLST, продемонстрировал их глобальную представленность. Так, например, cgST 133718 был отмечен в Антарктиде (штамм 17_1myr) и ранее — в Великобритании, а сиквенс-тип 11903, к которому принадлежал штамм 32-1 из самой северной точки Новой Земли, был ранее выявлен в США. Все изученные штаммы характеризовались наличием обширного вирулома. В числе выявленных генов факторов патогенности обнаружены гены гемолизинов A, E, F, сидерофоры, включая иерсиниабактиновый кластер генов, ряд генов факторов адгезии, колонизации и инвазии, а также ген термостабильного энтеротоксина EAST-1 и гены, маркирующие энтероаггрегативные штаммы E. coli: ген регулятора вирулентности eilA и энтероаггрегативный белок (air). Один из «арктических» штаммов (33-1) характеризовался наличием детерминант устойчивости к антибиотикам, в частности, в его геноме был детектирован ген бета-лактамазы расширенного спектра TEM-1b и транспозон Tn1721, включающий гены устойчивости к тетрациклинам (tetA-tetR).
Заключение. Результаты исследования свидетельствуют о циркуляции в орнитогенных экосистемах высокоширотной Арктики и Антарктики штаммов E. coli, обладающих выраженным патогенным потенциалом. Анализ геномных данных свидетельствует о распространении в этих регионах генетических линий, широко географически представленных, что обосновывает значимость мониторинга эпидемических клонов кишечной палочки, наряду с мониторингом других патогенов, в колониях массовых видов птиц на высокоширотных территориях.
 758-768
758-768


Протективный потенциал структурных белков вируса SARS-CoV-2 в защите от COVID-19
Аннотация
Введение. Множество различных вакцин для профилактики COVID-19 в кратчайшие сроки получили разрешение на экстренное применение. В связи с высоким уровнем изменчивости возбудителя, важно учитывать вариабельность структурных белков вируса SARS-CoV-2 и их протективный потенциал в защите животных от COVID-19.
Цель исследования — сравнить протективный потенциал структурных белов вируса SARS-CoV-2 в защите животных от COVID-19.
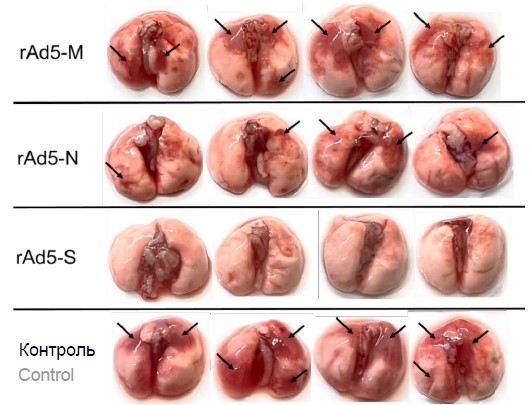
Материалы и методы. В качестве модельных животных при исследовании вируса SARS-CoV-2 служили трансгенные мыши B6.Cg-Tg(K18-ACE2)2Prlmn/J (F1). Для иммунизации животных использовали препараты рекомбинантных аденовирусных векторов: rAd5-S, rAd5-N, rAd5-M. В работе применяли различные генетические, вирусологические и иммунологические методы, а также методы работы с животными.
Результаты. Наибольшее количество аминокислотных замен в структурных белках разных вариантов SARS-CoV-2 было обнаружено в гликопротеине S, наименьшее — в нуклеопротеине N. На модели COVID-19 у животных показано, что только использование гликопротеина S в качестве антигена в составе вакцинного препарата позволяет сформировать протективный иммунитет, который защищает 100% животных от летальной инфекции, вызванной вирусом SARS-CoV-2, при этом использование белка N позволяет защитить 50% животных от летальной инфекции, а белок М не обладает протективным потенциалом.
Заключение. Полученные данные, а также анализ данных эпидемиологической эффективности разных мРНК- и векторных вакцин демонстрируют, что использование гликопротеина S вируса SARS-CoV-2 в качестве антигена позволяет сформировать наиболее высокий уровень защиты. Учитывая постоянную смену циркулирующих вариантов вируса SARS-CoV-2, снижение эффективности используемых вакцин с исходным антигенным составом в отношении новых вариантов вируса и сохраняющийся высокий уровень заболеваемости COVID-19, необходимо проводить непрерывный мониторинг эффективности вакцинных препаратов в отношении новых вариантов вируса и своевременно проводить актуализацию антигенного состава вакцин при выявлении снижения эффективности.
 769-778
769-778


Характеристики изолята вируса оспы обезьян, полученного от первого заболевшего в России, и его чувствительность к 7-[N-(4-трифторметилбензоил)-гидразинокарбонил]-трицикло-[3.2.2.0^2,4]нон-8-ен-6-карбоновой кислоте
Аннотация
Введение. С начала мая 2022 г. было зарегистрировано более 90 тыс. случаев заражения вирусом оспы обезьян (ВОО) в более чем 70 странах мира. Это самая крупная из зарегистрированных вспышек оспы обезьян, вышедшая за пределы Африки.
Цель работы — подтверждение первого случая оспы обезьян в России, выделение и секвенирование изолята ВОО, а также оценка его чувствительности к противооспенному препарату — 7-[N-(4-трифторметилбензоил)-гидразинокарбонил]-трицикло-[3.2.2.0^2,4]нон-8-ен-6-карбоновой кислоте (НИОХ-14).
Материалы и методы. В работе использовали биологические материалы, полученные из поражённого участка кожи (содержимое везикул), мазка из носоглотки, мокроты и венозной крови пациента с подозрением на оспу обезьян. Заболевание подтверждали методом полимеразной цепной реакции (ПЦР) с последующим определением нуклеотидной последовательности вирусной ДНК методом секвенирования. Штамм ВОО из клинических образцов выделяли в культуре клеток Vero E6. Противовирусную эффективность НИОХ-14 в отношении изолята ВОО оценивали с использованием адаптированного спектрофотометрического метода.
Результаты. Диагностическое исследование биологических образов пациента, вернувшегося из туристической поездки по европейским странам, с жалобами на кожную сыпь по всему телу выявило в них ДНК ВОО. Изолят ВОО был выделен из содержимого везикулы в культуре клеток, генетическая последовательность MPXV-pustule S45 была собрана по результатам проведения высокопроизводительного параллельного секвенирования.
Обсуждение. Эффективность противовирусного действия готовой лекарственной формы НИОХ-14 в отношении нового штамма ВОО по результатам определения 50% вирусингибирующей концентрации составила 0,02 мкг/мл, индекс селективности — > 15 000.
Заключение. В настоящем исследовании методами ПЦР в режиме реального времени, секвенирования и электронной микроскопии был выявлен и идентифицирован возбудитель оспы обезьян, из клинического образца (содержимое везикул) на культуре клеток Vero Е6 был выделен изолят ВОО и, таким образом, подтверждён первый завозной случай оспы обезьян в России. Было доказано, что препарат НИОХ-14 проявляет высокую противовирусную активность in vitro в отношении выделенного изолята ВОО.
 748-757
748-757


Селективное подавление репликации вируса гриппа A/H5N1 in vitro с помощью нанокомплексов, состоящих из siRNA и наночастиц аминопропилсиланола
Аннотация
Актуальность. Вирусы гриппа, относящиеся к семейству Orthomyxoviridae, широко распространены в природе и часто являются причиной возникновения пандемий. Появление новых штаммов вируса, устойчивых к лекарственным препаратам, вызывает потребность в разработке новых эффективных лекарственных форм, селективно действующих на вирусы гриппа А.
Цель работы — создание нанокомплексов, состоящих из наночастиц аминопропилсиланола (АПС) и малых интерферирующих РНК (siRNA), и исследование их воздействия на нуклеиновые кислоты-мишени на примере ингибирования репликации вируса гриппа А в клеточной системе.
Материалы и методы. В работе использовали клетки MDCK, вирус гриппа A/chicken/Kurgan/05/2005 (A/H5N1), наночастицы АПС, нативные и модифицированные молекулы siRNA.
Результаты и обсуждение. Созданы уникальные нанокомплексы Si~NH2/siRNA, состоящие из наночастиц АПС и иммобилизованных на них молекул siRNA, обеспечивающих соответственно проникновение в клетки и селективное взаимодействие с нуклеиновыми кислотами-мишенями. Противовирусную активность предложенных нанокомплексов исследовали на клетках MDCK, заражённых вирусом гриппа A/H5N1. Показано, что двухцепочечные молекулы siRNA в составе нанокомплексов, действующие по механизму РНК-интерференции, более эффективно подавляют репликацию вируса гриппа по сравнению с соответствующими одноцепочечными фрагментами РНК. Наиболее эффективный нанокомплекс, содержащий siRNA, нацеленную на выбранный участок 5-го сегмента мРНК вирусного генома, снижал репликацию вируса гриппа А в культуре клеток в 630 раз. Показано, что неагломерированные, растворимые в водных растворах наночастицы АПС являются малотоксичными, способными доставлять siRNA в клетки и защищать siRNA в составе нанокомплексов Si~NH2/siRNA от гидролиза клеточными нуклеазами.
Заключение. Продемонстрирована высокая биологическая активность созданных нанокомплексов на примере селективного и высокоэффективного подавления репликации вируса гриппа A/chicken/Kurgan/05/2005 в клеточной системе.
 794-802
794-802


Клиническое исследование иммуногенности и защитной активности живой рекомбинантной вакцины «ГамЖВК» интраназального применения для профилактики коклюша у взрослых добровольцев
Аннотация
Введение. Рост заболеваемости коклюшем в мире, недостаточная продолжительность, эффективность и неспособность иммунитета, индуцированного бесклеточной коклюшно-дифтерийно-столбнячной вакциной, обеспечить противобактерийную защиту и предотвратить передачу возбудителя от человека к человеку обосновывают необходимость разработки новых противококлюшных вакцин. Живая коклюшная вакцина «ГамЖВК» интраназального применения прошла доклинические исследования в экспериментах с низшими приматами и две стадии клинических исследований на взрослых добровольцах, доказавшие её безопасность, иммуногенность и защитную активность. Отработаны метод и схема введения препарата.
Цель работы — подтверждение иммуногенности и защитной противобактерийной активности «ГамЖВК» в рандомизированном многоцентровом клиническом исследовании на взрослых добровольцах.
Материалы и методы. В многоцентровом клиническом рандомизированном плацебо-контролируемом двойном слепом исследовании приняли участие 260 здоровых добровольцев в возрасте 18–65 лет. Из них 210 человек были рандомизированы в группу вакцинированных «ГамЖВК» и 50 человек — в группу плацебо. Препарат «ГамЖВК» вводили дважды в каждый носовой ход по 0,25 мл (5 × 109 КОЕ) с интервалом 60 дней. Методом иммуноферментного анализа и реакции агглютинации определяли уровни специфичных к Bordetella pertussis IgG-, IgA-антител в сыворотке крови и IgA в назальных аспиратах. Методом полимеразной цепной реакции в реальном времени измеряли число геном-эквивалентов B. pertussis в ротоглоточных смывах для оценки динамики элиминации аттенуированных бактерий B. pertussis после первого и повторного введения «ГамЖВК» добровольцам.
Результаты. Показаны достоверные сероконверсия по специфическим IgG и IgА в крови и рост уровня секреторных IgА в назальных аспиратах добровольцев. Динамика изменения содержания IgG и IgА указывает на бустерный эффект после повторной вакцинации. Аттенуированные бактерии B. pertussis персистируют в носо- и ротоглотке вакцинированных. Время выведения бактерий после 2-й вакцинации сокращается более чем в 2 раза в сравнении с 1-м введением, при этом количество персистирующих бактерий после 2-й вакцинации составляет менее 3% от значений после 1-й вакцинации.
Заключение. Доказаны высокая иммуногенность и формирование противобактерийной защиты после однократной и двукратной интраназальной вакцинации добровольцев «ГамЖВК».
 779-793
779-793


Анализ временны́х рядов заболеваемости денге в городе Бандунг, Индонезия, с использованием модели ARIMA
Аннотация
Введение. Вирус денге является проблемой общественного здравоохранения, которая приводит к смерти. Это заболевание необходимо контролировать, чтобы уменьшить его воздействие на общество.
Цель исследования — спрогнозировать заболеваемость денге в городе Бандунг, используя данные с 2014 по 2023 г.
Метод. В данном исследовании изучалась заболеваемость денге в городе Бандунг с 2014 по 2023 г., вторичные данные обрабатывали и анализировали с помощью модели авторегрессии скользящего среднего (ARIMA) для прогнозирования заболеваемости денге.
Результаты. Лучшей моделью является ARIMA (3,0,3), средняя абсолютная ошибка в процентах (MAPE = 33,3437) и информационный критерий Акаике (AIC = 0,1489). Исходя из модели, пик заболеваемости денге приходится на сентябрь 2024 г. (320 случаев).
Выводы. Пик заболеваемости денге в городе Бандунг придётся на сентябрь 2024 г. Отсюда следует, что необходимо проводить мероприятия по борьбе с переносчиками инфекции в нескольких подрайонах и наращивать усилия по профилактике и борьбе с денге.
 803-811
803-811


Выявление Streptococcus agalactiae молекулярными методами у беременных женщин и частота вертикальной передачи новорождённым в провинции Вавилон
Аннотация
Введение. Streptococcus agalactiae — грамположительные, неподвижные и инкапсулированные кокки. На кровяном агаре они образуют узкую зону бета-гемолиза. Этот возбудитель при передаче от инфицированных матерей вызывает инвазивные бактериальные заболевания у новорождённых, в том числе сепсис, менингит, септицемию и пневмонию. Streptococcus agalactiae является патогеном, вызывающим первоочередную озабоченность общественного здравоохранения.
Цель работы — провести объективное исследование по выделению и молекулярному выявлению гена вирулентности стрептококка группы B (СГВ) и оценить частоту передачи инфекции от матери новорождённому.
Материалы и методы. В проспективное когортное исследование вошли 300 беременных женщин со сроком беременности более 35 нед. У всех участниц исследования собирали вагинальные мазки, всех женщин с диагностированным СГВ обследовали после родов, чтобы взять мазки у их новорождённых. Для оценки выделенных бактерий использовали традиционные микробиологические и молекулярные подходы.
Результаты. В исследовании приняли участие 60 (20%) из 300 беременных женщин и 16 (26,6%) их новорождённых. СГB был обнаружен с помощью культуральных методов и подтверждён с помощью ПЦР с праймерами для выявления гена atr (гена домашнего хозяйства). Положительные изоляты были на 100% чувствительны к антибиотикам, таким как цефтриаксон, пенициллин и ванкомицин, 93% были чувствительны к хлорамфениколу, 83% — к эритромицину, 13% — к тетрациклину.
Заключение. Наши данные показали высокую частоту инфицирования СГВ у беременных женщин и их новорождённых. Необходимо проводить обязательный скрининг и профилактическое лечение, чтобы свести к минимуму потенциально смертельные последствия этого заболевания.
 812-819
812-819


НАУКА И ПРАКТИКА
Использование отечественного бульона Мюллера–Хинтон для исследования антибиотикочувствительности клинических штаммов микроорганизмов
Аннотация
Введение. Одна из причин распространения микроорганизмов, устойчивых к антимикробным препаратам (АМП), связана с бесконтрольным употреблением и неадекватным эмпирическим назначением антибиотиков, не основанным на результатах определения чувствительности возбудителя к ним. Метод разведений в бульоне и один из вариантов его исполнения — референтный метод микроразведений, в отличие от диско-диффузионного метода, позволяет тестировать практически все комбинации патоген–антибиотик. Для выполнения метода в рамках программы импортозамещения разработана технология производства отечественного бульона Мюллера–Хинтон (МХБ-Оболенск).
Цель исследования — оценить качество разработанного отечественного бульона МХБ-Оболенск в сравнительных испытаниях с импортным аналогом МХБ-BD («BD BBL») при тестировании клинических штаммов микроорганизмов, включая комбинации микроорганизм–АМП, которые нельзя достоверно исследовать диско-диффузионным методом.
Материалы и методы. В работе исследовали чувствительность 47 клинических штаммов грамположительных и грамотрицательных бактерий к АМП различных функциональных групп методом микроразведений в бульонах МХБ-Оболенск и МХБ-BD.
Результаты. Значения минимальных подавляющих концентраций (МПК) антибиотиков для клинических штаммов, полученные на разработанной и контрольной средах, между собой практически не отличались или отличались на +/– 1 разведение. Отличие на 2 двукратных разведения отмечено при тестировании комбинаций Enterococcus faecium–ампициллин, Klebsiella pneumoniae–меропенем, Pseudomonas aeruginosa–левофлоксацин и Staphylococcus aureus–ципрофлоксацин. Для двух первых комбинаций значения МПК на МХБ-Оболенск были ниже, а для двух последних — выше, чем на МХБ-BD. Полученные различия не отразились на клинических категориях чувствительности.
Заключение. На разработанном отечественном бульоне МХБ-Оболенск получены антибиотикограммы для клинических штаммов микроорганизмов, которые не отличались от их антибиотикограмм на контрольной среде. МХБ-Оболенск соответствует требованиям национальных и международных стандартов и с помощью него можно достоверно тестировать в том числе актуальные комбинации пар микроорганизм–АМП, которые нельзя исследовать диско-диффузионным методом.
 820-827
820-827












![Характеристики изолята вируса оспы обезьян, полученного от первого заболевшего в России, и его чувствительность к 7-[N-(4-трифторметилбензоил)-гидразинокарбонил]-трицикло-[3.2.2.0^2,4]нон-8-ен-6-карбоновой кислоте](https://microbiol.crie.ru/public/journals/1/cover_article_18661_ru_RU.jpg)