Том 99, № 3 (2022)
- Год: 2022
- Выпуск опубликован: 28.07.2022
- Статей: 10
- URL: https://microbiol.crie.ru/jour/issue/view/50
Весь выпуск
ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
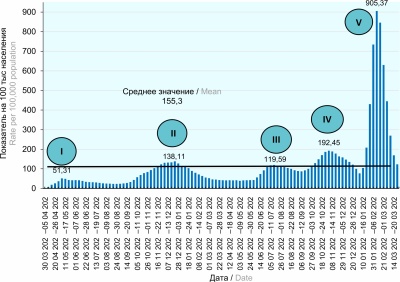
COVID-19: эволюция пандемии в России. Сообщение I: проявления эпидемического процесса COVID-19
Аннотация
Актуальность. Продолжающаяся пандемия новой коронавирусной инфекции (COVID-19) определяет актуальность анализа эпидемиологических закономерностей распространения SARS-CoV-2 среди населения России.
Цель данной статьи — изучение проявлений эпидемического процесса COVID-19 на территории РФ за 2020–2022 гг.
Материалы и методы. Проведён ретроспективный эпидемиологический анализ заболеваемости COVID-19 с 30.03.2020 по 24.04.2022 на территории РФ. Использованы материалы отчёта Роспотребнадзора № 970 «Информация о случаях инфекционных заболеваний у лиц с подозрением на новую коронавирусную инфекцию», информационного портала Стопкоронавирус.рф и др. Наличие РНК SARS-CoV-2 было подтверждено методом полимеразной цепной реакции в реальном времени с обратной транскрипцией.
Результаты и обсуждение. При анализе проявлений эпидемического процесса COVID-19 на территории РФ за 2020–2022 гг. выделены два этапа, различавшиеся влиянием биологического фактора и проводимыми противоэпидемическими мероприятиями. Прослеживается выраженная тенденция развития эпидемического процесса, начиная от мегаполисов (Москва, Московская область и Санкт-Петербург), являющихся крупными транспортными узлами и центрами миграционной активности населения, до регионов РФ. Установлено, что с каждым последующим циклом подъёма заболеваемости COVID-19 на фоне усиления контагиозности SARS-CoV-2 снижается его патогенность.
Заключение. Выявлены территории риска (города-мегаполисы), группы риска, факторы, влияющие на развитие эпидемического процесса. Определены закономерности распространения SARS-CoV-2 и оценена эффективность противоэпидемических мероприятий, направленных на разрыв механизма передачи возбудителя.
 269-286
269-286


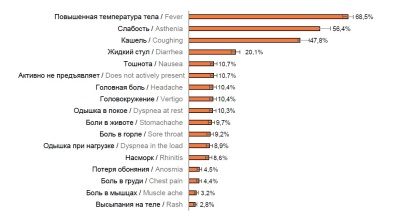
Клинико-эпидемиологические особенности пациентов, госпитализированных с COVID-19 в различные периоды пандемии в Москве
Аннотация
Актуальность. Динамика заболеваемости новой коронавирусной инфекцией (COVID-19) характеризуется волнообразным течением с периодами спадов и подъёмов. Регулярно появляются сообщения о мутациях и изменении свойств вируса, о новых штаммах.
Цель работы — дать сравнительную характеристику клиническо-эпидемиологических особенностей пациентов, госпитализированных с COVID-19 в различные периоды пандемии коронавирусной инфекции в Москве.
Материалы и методы. Проведено двуцентровое ретроспективное наблюдательное эпидемиологическое исследование. Материалом послужили истории болезни пациентов, госпитализированных в Москве в период с марта 2020 г. по март 2022 г. c подтверждённым диагнозом COVID-19 (34 354 наблюдения).
Результаты. На протяжении 2 лет пандемии имелись существенные различия в возрастной структуре госпитализированных. В начальный период (март–июнь 2020 г.) преобладали возрастные группы 18–45 и 46–65 лет. В дальнейшем (июль 2020 г. – февраль 2021 г.) вырос удельный вес более старших возрастных групп. Начиная с весны 2021 г. (появление штамма «дельта» коронавируса SARS-CoV-2) и по март 2022 г. (доминирование штамма «омикрон»), удельный вес госпитализированных трудоспособного возраста вновь увеличился.
Доля тяжёлых и крайне тяжёлых форм среди пациентов, госпитализированных в различные периоды, оставалась стабильной: 7,7% (6,6–8,8%) и 5,5% (4,4–6,6%) соответственно. Наиболее высокий уровень летальности наблюдался при штамме «дельта», низкий — при штамме «омикрон». Более старший возраст и наличие хронических заболеваний во все периоды пандемии оставались фактором риска более тяжёлого течения и неблагоприятного исхода заболевания.
Заключение. Смещение потребности госпитализации на более молодые возрастные группы при появлении новых вариантов SARS-CoV-2, сохранение существенного количества тяжёлых форм и уровня летальности среди лиц старше трудоспособного возраста требуют поддержания готовности к проведению профилактических и противоэпидемических мероприятий с акцентом на эти группы населения.
 287-299
287-299


Доклиническое изучение иммуногенности четырёхвалентной субъединичной противогриппозной вакцины, содержащей корпускулярный адъювант
Аннотация
Актуальность. Вакцинопрофилактика является важным стратегическим аспектом защиты населения от тяжёлых последствий эпидемий гриппа. Актуальна разработка эффективных тетравалентных вакцин, содержащих антигены двух линий гриппа А (H1N1, H3N2) и двух линий гриппа В (Виктория, Ямагата) с добавлением иммуноадъюванта.
Целью работы явилось доклиническое изучение иммуногенности и защитной эффективности инновационного препарата — тетравалентной субъединичной вакцины, содержащей антигены вирусов гриппа А и В, а также корпускулярный адъювант.
Материалы и методы. Исследования выполнены на мышах-самках линии BALB/c. Тетравалентную вакцину и моновалентные полуфабрикаты с бетулиновым адъювантом вводили внутрибрюшинно двукратно с интервалом 14 дней. Иммуногенную активность оценивали по реакции торможения гемагглютинации. Протективную активность вакцины оценивали по изменению вирусной нагрузки, массы тела и выживаемости животных на модели летальной инфекции, вызванной вирусом гриппа А подтипа H1N1.
Результаты. У мышей, вакцинированных четырёхвалентной субъединичной противогриппозной вакциной с корпускулярным адъювантом, наблюдалось образование антител в отношении всех четырех вирусов гриппа, входящих в состав вакцины, средние титры антител в реакции торможения гемагглютинации были выше 1 : 40. В результате второй вакцинации наблюдался выраженный прирост антител в отношении всех четырех вирусов гриппа. Доза четырёхвалентной субъединичной вакцины с корпускулярным адъювантом, содержащая по 5 мкг каждого антигена и 200 мкг адъюванта, обеспечивала 100% выживаемость мышей, а также во всех изученных дозах значительно снижала титр вируса в лёгких у животных (более 3 lg ТЦИД50) в модели гриппозной пневмонии.
Заключение. Четырёхвалентная субъединичная вакцина с корпускулярным адъювантом на основе бетулина демонстрирует высокую иммуногенность у лабораторных мышей и обеспечивает защиту от летальной пневмонии, вызванной вирусом гриппа А подтипа H1N1.
 300-308
300-308


Прогнозирование заболеваемости Крымской геморрагической лихорадкой на основе данных спутникового мониторинга (дистанционного зондирования Земли из космоса) на примере Ставропольского края
Аннотация
Введение. Сохранение напряжённой эпидемиологической ситуации по Крымской геморрагической лихорадке (КГЛ) во многих странах мира требует уделять особое внимание разработке и совершенствованию методов риск-ориентированного эпидемиологического прогнозирования.
Цель исследования — разработка прогнозной модели динамики заболеваемости КГЛ (на примере Ставропольского края) с использованием данных спутникового мониторинга (дистанционного зондирования Земли из космоса).
Материалы и методы. Проанализированы климатические данные Института космических исследований РАН и сведения официальной статистической отчётности по заболеваемости КГЛ с 2005 по 2021 г. Прогнозная модель была разработана на основе теоремы Байеса и последовательного статистического анализа Вальда. Информативность факторов оценивали по методу Кульбака.
Результаты. Прогнозы по каждому из 26 районов были составлены поэтапно (относительно пороговых уровней): будет хотя бы один больной КГЛ, превысит ли относительная заболеваемость на 100 тыс. населения уровень медианы (0,9 заболевших), среднее (3,5 заболевших) и третьего квартиля (4,7 заболевших). Наиболее высокие значения коэффициентов информативности были получены для температуры и влажности почвы (на глубине 10 и 40 см), нормализованного относительного вегетационного индекса, относительной влажности, максимальной и средней температуры воздуха, относительной влажности воздуха. При апробации модели в 2021 г. ложноотрицательный (ошибочный) прогноз был дан для 2 районов. Обсуждение. Наиболее эффективно модель позволяет прогнозировать наличие или отсутствие больных. Более точное количественное прогнозирование несколько затруднено в связи с наличием субъективных факторов (в том числе постановка больным КГЛ без геморрагических проявлений неверных диагнозов и оказание им помощи по поводу других заболеваний со сходными симптомами).
Заключение. Апробация модели свидетельствует о её перспективности. Внедрение прогноза в практику позволит повысить настороженность медицинских работников для улучшения выявляемости больных КГЛ.
 322-335
322-335


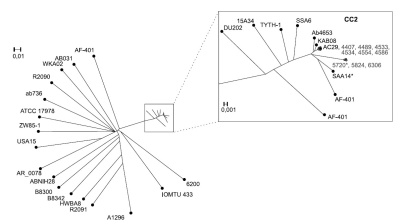
Результаты полногеномного секвенирования бактерий Acinetobacter baumannii, изолированных от пациентов стационаров северных регионов Тюменской области
Аннотация
Введение. Важной задачей нозокомиального инфекционного контроля является установление генетического родства группы изолятов, поиск источника, повлекшего возникновение инфекции. Наиболее распространённым возбудителем инфекций, связанных с оказанием медицинской помощи, является Acinetobacter baumannii.
Цель. Оценить результаты полногеномного секвенирования бактерий A. baumannii, изолированных из клинических образцов пациентов, находящихся на стационарном лечении в двух медицинских организациях северных регионов Тюменской области.
Материалы и методы. Исследовано 9 изолятов A. baumannii, выделенных из клинического материала пациентов. Бактериальные культуры идентифицировали с помощью масс-спектрометрии, проводили полногеномное секвенирование, мультилокусное сиквенс-типирование, поиск маркеров антибиотикорезистентности и генов, связанных с вирулентностью. Результаты. Исследованные штаммы принадлежат к сиквенс-типам ST2 и ST187 и относятся к международному клональному комплексу CC2. У всех изолятов A. baumannii обнаружены гены бета-лактамаз, гены резистентности к аминогликозидам, группе MLS-антибиотиков (макролиды, линкосамиды и стрептограмины) и тетрациклинам, кластер генов, связанных с вирулентностью (отвечающих за синтез ацинетобактина и связывания железа, поверхностный антиген 1 и порин).
Заключение. Изоляты A. baumannii, выделенные из клинического материала пациентов медицинской организации № 1, согласно анализу однонуклеотидного полиморфизма, относятся преимущественно к одному штамму бактерий. Изоляты A. baumannii, выделенные из клинического материала пациентов медицинской организации № 2, являются близкородственными. Способность различать клинические изоляты A. baumannii на уровне нескольких однонуклеотидных полиморфизмов в геноме позволит улучшить выявление источника инфекции, а данные полногеномного секвенирования могут способствовать рациональному назначению антибиотикотерапии и коррекции дезинфекционных и антисептических мероприятий.
 343-352
343-352


Характеристика Pseudomonas aeruginosa, выделенных из положительных проб гемокультур и ликвора у детей
Аннотация
Введение. Инфекции кровотока и центральной нервной системы (ЦНС), вызванные Pseudomonas aeruginosa, связаны с тяжёлым состоянием пациентов и нередко сопровождаются высокой летальностью.
Цель — молекулярно-генетическая характеристика P. aeruginosa, выделенных из положительных проб гемокультур и ликвора пациентов до 18 лет из отделений реанимации и интенсивной терапии стационаров.
Материалы и методы. Проведено ретроспективное исследование случаев бактериемии и инфекции ЦНС, связанных с P. aeruginosa, с 2014 по 2021 г. Изучены 24 клинических изолята P. aeruginosa из положительных гемокультур и ликвора. В структуре пациентов были 16 детей с хирургической патологией и 8 пациентов соматического профиля. Минимальную подавляющую концентрацию антибиотиков определяли методом серийных микроразведений в бульоне. Карбапенемазы выявляли в ПЦР в режиме реального времени. Гены вирулентности определяли методом ПЦР. Популяционное разнообразие оценивали методом мультилокусного сиквенс-типирования (МЛСТ).
Результаты. В 28% случаев при бактериемии и инфекции ЦНС, ассоциированной с P. aeruginosa, был летальный исход. Более 70% изолятов проявляли устойчивость к карбапенемным антибиотикам. Фенотипом множественной лекарственной устойчивости обладали 25% изолятов. Экстремальную резистентность проявляли 54% изолятов. Частота выявления металло-β-лактамаз составила 54%. При проведении ПЦР у 33% штаммов выявлен ExoU-тип, у 67% — ExoS-тип. По данным МЛСТ определено 16 генотипов. В структуре преобладали сиквенс-типы ST654 (29%) и ST235 (12,5%).
Заключение. Изоляты P. aeruginosa, выделенные из положительных гемокультур и проб ликвора, обладают высокой резистентностью к антибиотикам, гены вирулентности обнаружены у всех изолятов. Чаще в изученной выборке определялись штаммы высокого эпидемического риска. Более четверти описанных клинических случаев имели неблагоприятный исход.
 309-321
309-321


Исследование антибактериального действия гексабромоплатината винилтрифенилфосфония
Аннотация
Введение. Одним из биологических эффектов комплексов платины является антибактериальное действие в отношении грамположительных и грамотрицательных бактерий. Так, известно, что некоторые соединения платины способны ингибировать синтез ДНК, РНК и белка в бактериальных клетках кишечной палочки.
Цель — изучить антибактериальное действие гексабромоплатината винилтрифенилфосфония (ГВ) в отношении кишечной палочки и золотистого стафилококка с установлением минимальной подавляющей концентрации.
Материалы и методы. Антибактериальный эффект ГВ был изучен путём количественного учёта выросших колоний Escherichia coli штамм ATCC 25922 и Staphylococcus aureus штамм ATCC 6538 на плотной питательной среде в опыте (взвесь микроорганизмов, раствор исследуемого вещества) и контроле (взвесь микроорганизмов). Достоверность полученных результатов была оценена с помощью двустороннего точного критерия Фишера.
Результаты. Минимальная подавляющая концентрация раствора ГВ в отношении E. coli штамм ATCC 25922 составила 14,0625 мкг/мл, в отношении S. aureus штамм ATCC 6538 — 225 мкг/мл.
Заключение. ГВ проявляет антибактериальный эффект в большей степени по отношению к E. coli, чем к S. aureus — установленная для кишечной палочки минимальная подавляющая концентрация ГВ (14,0625 мкг/мл, 11,17 мкМ) оказалась сопоставимой с эффективными концентрациями противоопухолевых препаратов платины, поэтому проведение дальнейших исследований, в том числе in vivo, с участием данной бактерии является перспективным.
 336-342
336-342


ОБЗОРЫ
Генетические полиморфизмы, ассоциированные с раком шейки матки: систематический обзор
Аннотация
Введение. Рак шейки матки (РШМ) является одним из самых распространённых онкологических заболеваний у женщин. Этиологический агент РШМ — вирус папилломы человека высокого канцерогенного риска. При этом не у всех женщин, инфицированных этим вирусом, развивается рак, что позволяет предположить наличие генетической предрасположенности к РШМ.
Цель работы заключалась в анализе информации об однонуклеотидных полиморфизмах, ассоциированных с риском развития РШМ.
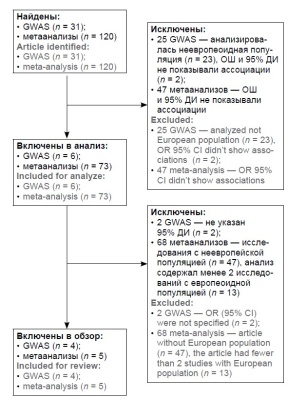
Материалы и методы. Выполнен поиск исследований по полногеномному скринингу ассоциаций (GWAS) и метаанализов за последние 10 лет, посвящённых генетическому риску РШМ в европеоидной популяции.
Результаты. Наиболее значимые ассоциации с РШМ были найдены у следующих однонуклеотидных полиморфизмов. По данным GWAS — с аллелями риска rs138446575-T (ОШ = 2,39) TTC34; rs73728618-T (ОШ = 1,48) HLA-DQA1; rs3130196-C (ОШ = 1,4) HLA-DPB1; rs2516448-T (ОШ = 1,39 и 1,44) MICA и протективными аллелями rs9271898-А (ОШ = 0,64) и 9272143-С (ОШ = 0,65) между HLA-DRB1 и HLA-DQA1, rs55986091-A HLA-DQB1 (ОШ = 0,66). Для метаанализов — с генотипом rs4646903-СС (ОШ = 4,65) CYP1A1 и протективными аллелями — rs1801133-Т (ОШ = 0,77) MTHFR, rs2333227-АА (ОШ = 0,57) MPO.
Заключение. Использование полученных данных является важным этапом создания лабораторных методик и наборов реагентов, направленных на персонализированный подход к определению групп риска с целью рекомендации таким пациенткам обязательной вакцинации и скрининга предраковых заболеваний шейки матки.
 353-361
353-361


Детерминанты устойчивости Francisella tularensis к стрессовым условиям окружающей среды
Аннотация
В обзоре обобщены современные данные литературы об основных структурах и антигенах туляремийного микроба, ответственных за адаптацию внутри теплокровного макроорганизма-хозяина (чувствительные животные, человек). Для успешного выживания Francisella tularensis в условиях стресса требуется взаимодействие всех клеточных структур микроба. Несмотря на активные исследования, проводимые в области изучения детерминант и механизмов устойчивости F. tularensis, причина высокой адаптационной способности при низкой изменчивости возбудителя туляремии не установлена. Эти исследования важны для понимания механизмов персистенции и вирулентности F. tularensis, а также для дальнейшей разработки вакцин и диагностических препаратов.
 362-371
362-371


ЮБИЛЕИ
 372-373
372-373