Pathogenetic role of cytokines in hemorrhagic fever with renal syndrome in dynamics and disease of various severity
- Authors: Ivanov M.F.1, Balmasova I.P.2
-
Affiliations:
- Samara State Medical University
- A.I. Evdokimov Moscow State University of Medicine and Dentistry
- Issue: Vol 100, No 3 (2023)
- Pages: 176-185
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/7265
- DOI: https://doi.org/10.36233/0372-9311-381
- EDN: https://elibrary.ru/ouwcxb
- ID: 7265
Cite item
Full Text
Abstract
The aim of the work is to determine the relationship between the levels of cytokines of proinflammatory and anti-inflammatory action during the clinical course of hemorrhagic fever with renal syndrome (HFRS) and the previously described characteristics of the phenotypic composition of blood lymphocytes in disease of various severity.
Materials and methods. 65 patients with a serologically verified diagnosis of HFRS were under observation. The control group included 15 conditionally healthy people. Determination of cytokines in the blood of patients with HFRS was carried out by the enzyme immunoassay method at the different stages of the disease. The phenotypic composition of blood lymphocytes was assessed by flow cytofluorimetry.
Results. At the different stages of the disease, there was a quantitatively different increase in the content of cytokines in the blood associated with cytotoxic immune reactions (IL-12, IFN, TNFa, TNFß), as well as IL-10 and IL-6 correlated with each other in severe cases, against the background of a drop in blood levels of IL-4 and IL-1ß. In the moderate course of HFRS, correlations of IL-12 and IL-4 with NKG2D+ CTL, the relationship of IL-12 with almost all other cytokines, and the correlation of CD8+ Treg with IL-6 and TNF levels were observed. In severe cases, the formation of a complex that included interconnected IL-6 and IL-10 correlating with the number of NKG2D+ CTL, CD8+ Treg, NKT was noted.
Conclusion. The pathogenetically significant mechanism of HFRS is realized with the predominant participation of cytokines of the cellular immune response and IL-6, correlatively associated with NKG2D+ CTL, CD8+ Treg, NKT, which, in case of a favorable outcome, contribute to the active formation of a pool of CD8+ memory cells, disrupted presumably by excessive secretion of IL-10.
Full Text
Введение
Геморрагическая лихорадка с почечным синдромом (ГЛПС) — острое вирусное природно-очаговое заболевание, проявляющееся геморрагическим синдромом, гемодинамическими расстройствами и поражением почек с развитием острой почечной недостаточности. Возбудитель ГЛПС относится к семейству Hantaviridae, роду Orthohantavirus. В настоящее время известно более 80 серологически и генетически отличающихся друг от друга типов хантавирусов, из них около 25 обладают патогенностью для человека. В качестве характерных особенностей ГЛПС, придающих ей медико-социальное значение, отмечаются наличие стойких природных очагов с инфицированием животных многих видов; возможность летального исхода; высокая частота длительно сохраняющихся резидуальных явлений; сложность ранней этиотропной диагностики; отсутствие тенденции к снижению заболеваемости, надежного этиотропного лечения и эффективных способов профилактики; попытки использовать возбудителей в качестве биологического оружия [1–4].
В течении ГЛПС клинически различают следующие периоды:
- инкубационный (в среднем 2–3 нед);
- лихорадочный (начальный, общетоксический от 3 до 7 дней);
- олигоурический, проявляющийся геморрагическим синдромом и острой почечной недостаточностью с резким снижением суточного количества мочи вплоть до анурии (в среднем 6–12 дней);
- полиурический со значительным нарастанием суточного количества мочи (в среднем 6–14 дней);
- период реконвалесценции (ранний — до 2 мес и поздний — до 2–3 лет) [5].
Поскольку ГЛПС проявляется системным воспалением, это заболевание сопровождается «цитокиновым штормом». Такие цитокины, как интерферон (ИФН) -α, интерлейкины (ИЛ) -6, -1, определяют развитие лихорадки, инфекционно-токсического шока, продукцию белков острой фазы, а фактор некроза опухоли (ФНО) -α, ИФН-β, ИЛ-6 повышают проницаемость сосудов и нарушают функции эндотелиальных клеток. ФНО-α и ИФН-γ влияют на тяжесть течения инфекционного процесса. Диагностически значимым является высокий уровень ИЛ-10 на протяжении всего заболевания [6, 7].
В наших предыдущих работах были описаны уникальные феномены, связанные с особенностями изменения фенотипического состава лимфоцитов на разных этапах развития ГЛПС:
- высокие уровни численного содержания в крови регуляторных Т-клеток (Трег) СD3+CD4+FoxP3+-, особенно CD3+CD8+FoxP3+-фенотипов, регистрируемых уже в первые дни заболевания, что было интерпретировано нами как иммуносупрессорный механизм, контролирующий развитие «цитокинового шторма»;
- рост c начального периода ГЛПС числа цитотоксических Т-лимфоцитов (ЦТЛ, CD3+CD8+), экспрессирующих активирующий рецептор лектинового типа NKG2D;
- начиная с конца олигоурического периода — нарастание представительства в крови подобных натуральным киллерам Т-лимфоцитов (НКТ) с фенотипом CD3+CD56+ [8].
Описанные в литературе экспериментальные модели позволили охарактеризовать патогенетическое значение всех этих явлений следующим образом. NKG2D-рецептор ЦТЛ является костимулирующей молекулой специфического Т-клеточного рецептора и проявляет своё костимулирующее действие только в активированных клетках. Установлено, что после преобразования костимулирующего сигнала с участием рецепторов Т-клеток (TCR) и активационного маркера — лектинового рецептора С-типа NKG2D ЦТЛ приобретают способность к цитолизу NKG2D-зависимым, но не TCR-зависимым способом. Дело в том, что лигандами для NKG2D, в отличие от TCR, служат не презентируемые инфицированной клеткой чужеродные антигены, а собственные молекулы, экспрессируемые повреждёнными клетками и относящиеся к категории MHC-I-подобных стресс-индуцированных молекул (MICA, MICB) и 4 категорий цитомегаловирус-индуцированных молекул (ULPB1-4) [9]. По мере развития этого механизма мишенями цитотоксического действия NKG2D+-ЦТЛ становятся не столько клетки, инфицированные возбудителем ГЛПС, сколько любые повреждённые клетки, что создаёт условия для частичного ускользания хантавируса от элиминации в ходе адаптивного иммунного ответа [10]. На других моделях показано, что это приводит к росту антигенной нагрузки на иммунную систему и увеличению представительства в крови CD8+-Трег [11], что наблюдалось и в наших исследованиях при ГЛПС [8].
NKG2D, экспрессируемые ЦТЛ, в присутствии ИЛ-15 играют ключевую роль в становлении пула CD8+-клеток памяти. Существованием этого механизма можно объяснить, в частности, тот факт, что ГЛПС — это всегда остро протекающая инфекция. В свою очередь, активация NKG2D+-клеток памяти приводит к трансформации этих клеток в цитокинпродуцирующие подобные натуральным клеткам-киллерам Т-клетки (НКТ), осуществляющие дальнейшую регуляцию иммунного процесса через цитокины, контролирующие соотношение различных субпопуляций Т-лимфоцитов [12]. Все описанные механизмы, базирующиеся на проведённых нами ранее исследованиях и требующие дальнейших научных изысканий в этом направлении, позволяют совершенно по-новому взглянуть на патогенез ГЛПС и наметить как новые способы лечения этого заболевания, так и инновационные подходы к стимуляции механизмов иммунологической памяти при разработке пока ещё ненадёжных способов вакцинопрофилактики этого тяжёлого заболевания.
В соответствии с этим целью данного исследования было определение взаимосвязи между уровнями цитокинов провоспалительного и противовоспалительного действия в динамике ГЛПС и зарегистрированными ранее особенностями фенотипического состава лимфоцитов крови при заболевании разной степени тяжести.
Материалы и методы
Работа выполнялась в г. Самаре, находящемся в Среднем Поволжье — территории, эндемичной по ГЛПС, вызываемой хантавирусами типа Puumala. Основным природным резервуаром вируса является грызун европейская рыжая полёвка. Исследование включало иммунологическое наблюдение 65 пациентов с серологически верифицированным (путём постановки реакции непрямой иммунофлуоресценции с парными сыворотками) диагнозом ГЛПС, находящихся на стационарном лечении в клиниках Самарского государственного медицинского университета. Контрольная группа включала 15 условно здоровых людей. В основной группе было 40 (62%) женщин, в группе контроля — 10 (67%), хотя в литературе гендерные различия среди больных ГЛПС не отмечены [14], средний возраст пациентов с ГЛПС составлял 41,9 ± 12,5 года, в контрольной группе — 38 ± 13,1 (р = 0,104). У 53 (81,5%) больных ГЛПС заболевание имело среднетяжёлое течение, у 12 (18,5%) — тяжёлое. Дизайн исследования утверждён межвузовским этическим комитетом (протокол № 204 от 11.12.2019). Все субъекты, находящиеся под клиническим наблюдением, в соответствии с принципами Хельсинкской декларации были предупреждены об участии в исследовании и подписали информированное добровольное согласие.
Уровень цитокинов в крови пациентов с ГЛПС определяли методом иммуноферментного анализа (ИФА) в каждый из периодов заболевания. ИФА осуществлялся из проб сыворотки крови с использованием комплекта аппаратуры, включающего планшетный фотометр «OPSYS MR» (ридер) («Thermolabsystems»), планшетный вошер ПП2-428 («Иммедтех»), принтер «Epson», и соответствующих моноклональных антител (МКА; «Вектор Бест»). Устанавливали содержание в крови провоспалительных (ИЛ-1β, -6, -12, ФНО-α, ФНО-β, ИФН-γ) и противовоспалительных цитокинов (ИЛ-4, -10).
Фенотипический состав лимфоцитов крови определяли методом проточной цитофлуориметрии с применением цитофлуориметра BD FACSCanto II («Becton Dickinson») и с помощью МКА («BD Biosciences») в соответствии с инструкцией по применению прибора и МКА. Использовали стандартизированный комплект МКА «BD Multitest 6-Color TBNK Reagent» («BD Biosciences»), включающий меченные PerCP-Cy5.5 anti-CD45 МКА, меченные FITC anti-CD3 МКА, меченные PE-Cy7 anti-CD4 МКА, меченные APC-Cy7 anti-CD8 МКА, меченные APC anti-CD19 МКА, меченные PE anti-CD16/anti-CD56 МКА. Содержание Трег, НКТ, лимфоцитов, экспрессирующих CD314 и FoxP3, определяли в отдельных пробах с применением МКА («IOTest», «Beckman Coulter»): меченные РЕ-Су5 anti-CD3 МКА, меченные РЕ-Су5 anti-CD56 МКА, меченные РЕ anti-CD314 МКА, меченные FITC anti-FoxP3 МКА с использованием пермеабилизирующих компонентов.
Статистическую обработку результатов проводили на основе пакета статистических программ «SPSS v. 23». Использовали методы непараметрической дискриптивной (определение медианы, минимума, максимума по каждому параметру) и сравнительной (по критерию Манна–Уитни) статистики, а также корреляционный анализ с определением коэффициента корреляции Спирмена и его достоверности.
Результаты
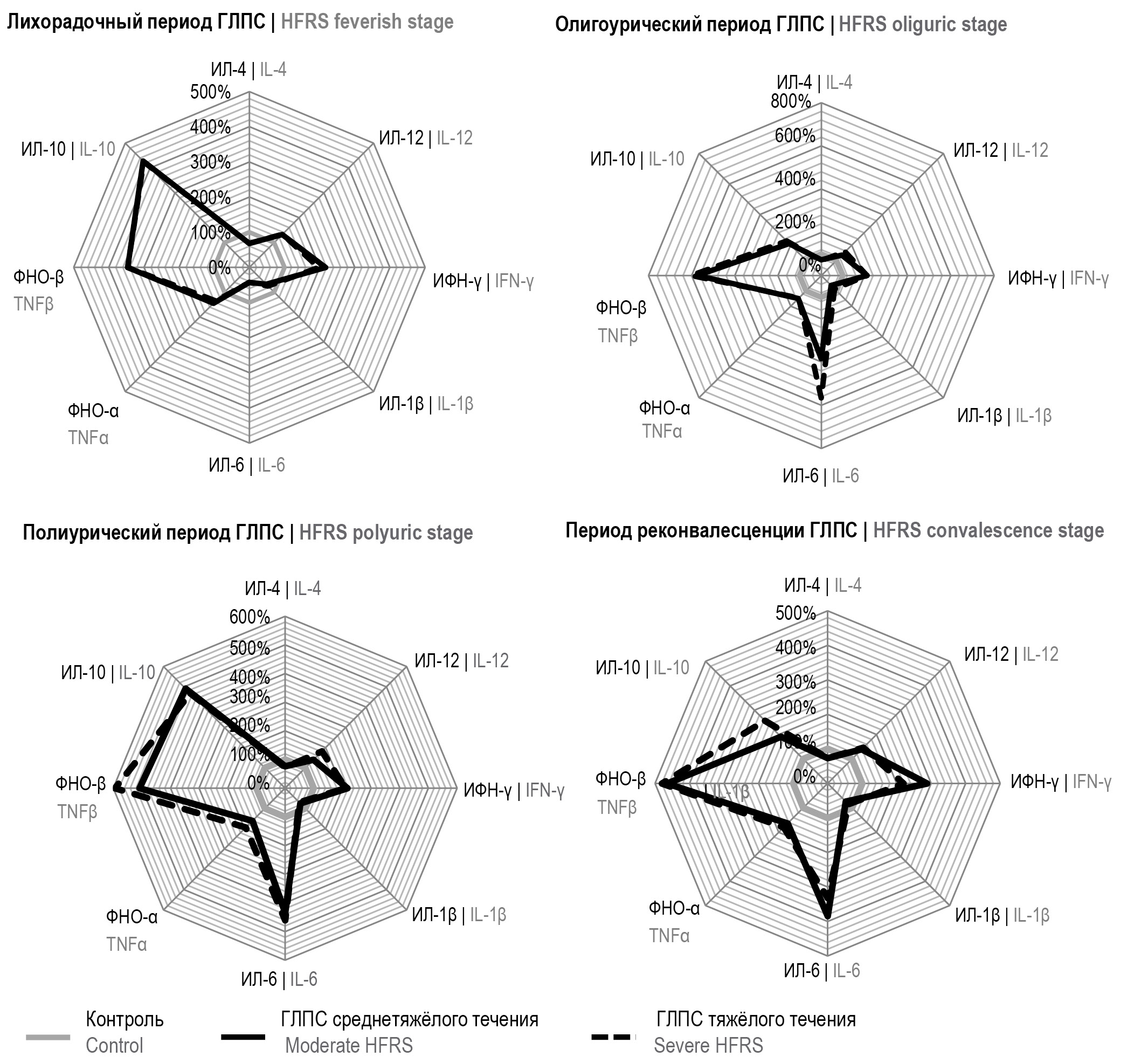
Результаты определения цитокинового профиля больных ГЛПС с разной степенью тяжести заболевания включали сравнение этих данных с группой контроля. Из полученных данных следует, что цитокиновые профили больных ГЛПС значительно различались в соответствии со стадиями инфекционного процесса (таблица; рис. 1). Достоверные отклонения от контроля демонстрировали практически все цитокины, при этом общие тенденции изменения показателей по сравнению с контрольными значениями для среднетяжёлого и тяжёлого течения заболевания полностью совпадают, хотя и регистрируются количественные различия.
Показатели цитокинового профиля в динамике у больных ГЛПС разной степени тяжести, медиана [минимум; максимум] / Indicators of the cytokine profile in patients with HFRS in the dynamics of varying severity, median [minimum; maximum]
Цитокины, пг/мл Cytokines, pg/ml | Больные ГЛПС среднетяжёлого течения Patients with moderate HFRS | Больные ГЛПС тяжёлого течения Patients with severe HFRS | Здоровые люди (контроль) Healthy people (control) | р1 | р2 | р3 |
Лихорадочный период ГЛПС | HFRS feverish stage | ||||||
n = 7 | n = 9 | n = 15 | ||||
ИЛ-4 | IL-4 | 0,999 | 0,011* | 0,011* | |||
ИЛ-12 | IL-12 | 0,513 | < 0,001* | < 0,001* | |||
ИФН-γ | IFNγ | 0,376 | < 0,001* | < 0,001* | |||
ИЛ-1β | IL-1β | 0,184 | 0,035* | 0,0,42* | |||
ИЛ-6 | IL-6 | 0,513 | < 0,001* | < 0,001* | |||
ФНО-α | TNFα | 0,513 | 0,258 | 0,198 | |||
ФНО-β | TNFβ | 0,487 | < 0,001* | < 0,001* | |||
ИЛ-10 | IL-10 | 0,827 | < 0,001* | < 0,001* | |||
Олигоурический период ГЛПС | HFRS oliguric stage | ||||||
n = 12 | n = 53 | n = 15 | ||||
ИЛ-4 | IL-4 | 0,834 | 0,010* | 0,012* | |||
ИЛ-12 | IL-12 | 0,049* | < 0,001* | < 0,001* | |||
ИФН-γ | IFNγ | 0,511 | < 0,001* | < 0,001* | |||
ИЛ-1β | IL-1β | 0,004* | 0,003* | < 0,001* | |||
ИЛ-6 | IL-6 | 0,006* | < 0,001* | < 0,001* | |||
ФНО-α | TNFα | 0,392 | < 0,001* | < 0,001* | |||
ФНО-β | TNFβ | 0,556 | < 0,001* | < 0,001* | |||
ИЛ-10 | IL-10 | 0,432 | < 0,001* | < 0,001* | |||
Полиурический период ГЛПС | HFRS polyuric stage | ||||||
n = 12 | n = 53 | n = 15 | ||||
ИЛ-4 | IL-4 | 0,102 | 0,012* | 0,015* | |||
ИЛ-12 | IL-12 | 0,020* | < 0,001* | < 0,001* | |||
ИФН-γ | IFNγ | 0,193 | < 0,001* | < 0,001* | |||
ИЛ-1β | IL-1β | 0,433 | 0,003* | < 0,001* | |||
ИЛ-6 | IL-6 | 0,998 | < 0,001* | < 0,001* | |||
ФНО-α | TNFα | 0,039* | < 0,001* | < 0,001* | |||
ФНО-β | TNFβ | 0,020* | < 0,001* | < 0,001* | |||
ИЛ-10 | IL-10 | 0,999 | < 0,001* | < 0,001* | |||
Период реконвалесценции ГЛПС | HFRS convalescence stage | ||||||
n = 12 | n = 53 | n = 15 | ||||
ИЛ-4 | IL-4 | 0,317 | 0,012* | 0,012* | |||
ИЛ-12 | IL-12 | 0,077 | < 0,001* | < 0,001* | |||
ИФН-γ | IFNγ | 117,5 [109; 287] | 0,275 | < 0,001* | < 0,001* | ||
ИЛ-1β | IL-1β | 0,053 | < 0,001* | < 0,001* | |||
ИЛ-6 | IL-6 | 0,513 | < 0,001* | < 0,001* | |||
ФНО-α | TNFα | 0,127 | < 0,001* | < 0,001* | |||
ФНО-β | TNFβ | 0,827 | < 0,001* | < 0,001* | |||
ИЛ-10 | IL-10 | 0,046* | < 0,001* | < 0,001* | |||
Примечание. р1 — вероятность различий в группах больных ГЛПС разной степени тяжести; р2 — вероятность различий в группах больных среднетяжёлого течения ГЛПС и контроля; р3 — вероятность различий в группах больных тяжёлого течения ГЛПС и контроля; *р < 0,05 по критерию Манна–Уитни.
Note. р1 — probability of differences in groups of patients with HFRS of various severity; р2 — probability of differences in groups of patients with moderate course of HFRS and control; р3 is the probability of differences in the groups of patients with severe HFRS and controls; *p < 0.05 according to the Mann–Whitney test.
Рис. 1. Отклонение от контроля цитокинового профиля крови пациентов с ГЛПС разной тяжести течения. / Fig. 1. Deviation from the control of the cytokine profile of the blood of patients with HFRS of various severity.
В лихорадочный период наблюдался рост содержания в крови цитокинов, сопряжённых с клеточными (цитотоксическими) иммунными реакциями: ИЛ-12, ИФН-γ, ФНО-α, ФНО-β. Кроме того, наиболее значительно возрастал уровень ИЛ-10 — цитокина с иммуносупрессорными и противовоспалительными свойствами. Уровни остальных цитокинов, в том числе провоспалительного действия (ИЛ-1β, ИЛ-6), достоверно снижались. При этом совсем не выявлялись различия между цитокиновыми профилями больных со среднетяжёлым и тяжёлым течением ГЛПС.
В олигоурический период отмечено примерно двукратное снижение уровня в крови ИЛ-10 при достоверном нарастании уровня ИЛ-6, особенно при тяжёлом течении ГЛПС.
В полиурический период опять значительно возрос уровень ИЛ-10, содержание ИЛ-6 в крови оставалось на прежнем высоком уровне, а у цитокинов, участвующих в развитии клеточных цитотоксических реакций (ИЛ-12, ФНО-α, ФНО-β), уровень содержания в крови при тяжёлом течении заболевания был достоверно выше, чем при среднетяжёлом течении.
Описанные тенденции изменения цитокинового профиля прослеживаются и в период реконвалесценции только с тем отличием, что достоверный характер различий между тяжёлым и среднетяжёлым течением ГЛПС на уровне цитокинового профиля выявлен только для ИЛ-10, уровень которого в первом случае был выше.
Соответствующие изменения в разные периоды ГЛПС разной степени тяжести со стороны клеток иммунной системы различных фенотипов были детально проанализированы нами ранее [8, 14]. В данном исследовании для интерпретации полученных данных между уровнями цитокинов и содержанием в крови больных ГЛПС лимфоцитов различных фенотипов, оценённым в процессе исследований, определяли корреляционные связи с использованием коэффициента корреляции Спирмена. Результаты корреляционного анализа по наличию достоверных (р < 0,05) корреляций показаны на рис. 2.
Рис. 2. Достоверные корреляционные связи между уровнями цитокинов и содержанием лимфоцитов различных фенотипов в крови при ГЛПС среднетяжёлого (а) и тяжёлого (б) течения. Сплошные стрелки — положительные корреляции; пунктирные — отрицательные корреляции. / Fig. 2. Significant correlations between the levels of cytokines and the content of lymphocytes of various phenotypes in the blood in patients with moderate (a) and severe (b) HFRS. Solid arrows — positive correlations; dotted lines — negative correlations.
При среднетяжёлом течении заболевания практически все тестированные показатели (кроме содержания в крови CD4+-Трег) оказались в той или иной степени связанными между собой с некоторым преобладанием прямых корреляционных связей. Отрицательные корреляции при этом наблюдались только для уровня ИЛ-10, что соответствует его иммуносупрессорной активности.
Наиболее активными участниками корреляционных пар при среднетяжёлом течении ГЛПС со стороны цитокинов являются ИЛ-12, ФНО-α и -β, ИФН-γ, т.е. цитокины, отражающие участие в иммунном процессе лимфоцитов цитотоксического действия, а также ИЛ-10 с противовоспалительным эффектом. Со стороны клеток иммунной системы в парные корреляции широко вовлечены Т-хелперы (CD3+CD4+), среди которых, судя по взаимосвязи с ИФН-γ, предположительно преобладают индуцирующие клеточные иммунные реакции Th1, ЦТЛ, особенно экспрессирующие NKG2D, НКТ и натуральные киллеры, а также клетки с выраженной иммуносупрессорной и противовоспалительной активностью — Трег как CD4+-, так и CD8+-фенотипов. Иными словами, как уже обсуждалось во введении, иммунный процесс имеет явную протективную направленность на элиминацию возбудителя из сосудистого русла и ограничение последствий «цитокинового шторма».
При тяжёлом течении ГЛПС число корреляционных пар резко уменьшалось — в 2,5 раза. При этом из состава корреляций выбыли некоторые основные популяции/субпопуляции лимфоцитов (Т-лимфоциты, Т-хелперы, ЦТЛ) при значительном уменьшении числа корреляционных связей для остальных клеток с преобладанием отрицательных корреляций и изменениями состава корреляционных пар.
С нашей точки зрения, особого внимания заслуживает преобладающее выраженное нарастание в крови корреляционно связанных между собой уровней ИЛ-6 и ИЛ-10 при участии ИЛ-10 в корреляционных связях с NKG2D+-ЦТЛ, НКТ и CD8+-Трег. При этом число НКТ, не отличаясь количественно от содержания в крови при среднетяжёлом течении, на фоне тяжёлого течения ГЛПС связано прямыми корреляционными связями не только с ИФН-γ, но и с ИЛ-10, а также ИЛ-4, т.е. с теми основными секреторными продуктами, что входят в спектр ключевых цитокинов НКТ с различными фенотипическими характеристиками.
Обсуждение
Особенностью данной работы является не столько характеристика цитокинового профиля крови у больных ГЛПС в динамике заболевания и в соответствии с его тяжестью течения, довольно хорошо изученная к настоящему времени, сколько исследование цитокинов провоспалительного и противовоспалительного действия как компонентов неизвестных ранее феноменов иммунопатогенеза ГЛПС. При этом особого обсуждения заслуживает значение изменений со стороны тестированных цитокинов в расшифровке механизмов участия в иммунопатогенезе ГЛПС NKG2D+-ЦТЛ, Трег, НКТ с учётом тяжести течения заболевания.
Как отмечено выше, NKG2D+-ЦТЛ при определённых цитокиновых воздействиях могут быть причастны к формированию пула CD8+-T-лимфоцитов памяти, но насколько этот важный механизм может реализоваться при ГЛПС, сведений в научной литературе нет. В данном исследовании при анализе цитокинового профиля, характерного для среднетяжёлого течения данного заболевания, были зарегистрированы, в частности, корреляционные взаимосвязи между численным представительством в крови NKG2D+-ЦТЛ и уровнями ИЛ-4, ИЛ-12. В литературе имеются сведения о том, что экспрессия NKG2D у ЦТЛ находится под контролем ИЛ-4 и ИЛ-12, при этом ИЛ-4 подавляет экспрессию NKG2D, а ИЛ-12 её усиливает [15]. Если учесть, что в наших исследованиях уровень ИЛ-4 в крови при ГЛПС падает, а уровень ИЛ-12 — достоверно возрастает, а между ними и процентным содержанием в крови в случаях среднетяжёлого течения заболевания существуют достоверные корреляционные связи, то есть основание предполагать, что при среднетяжёлом течении ГЛПС преобладают механизмы стимулирующих воздействий (с участием ИЛ-12) на экспрессию NKG2D ЦТЛ. При тяжёлом течении ГЛПС число NKG2D+-ЦТЛ ещё больше возрастает, но меняется характер взаимосвязи этого явления с цитокиновым профилем, при этом прямая корреляционная взаимосвязь установлена с уровнем только одного цитокина — ИЛ-10, который входит также в состав корреляционных пар c CD8+-Трег и НКТ.
Это лишний раз подтверждает высказанное нами ранее предположение о взаимосвязи тяжёлого течения ГЛПС с развитием в ходе инфекционного процесса уникального иммунопатогенетического механизма при ГЛПС, объединяющего функции клеток, показывающих наиболее высокий уровень в крови, — NKG2D+-ЦТЛ и CD8+-Трег с возможностью трансформации первых в НКТ. Это подтверждают и сведения, носящие разрозненный характер и полученные разными авторами на модели других патологических процессов, например, данные о способности ИФН-γ индуцировать Трег [16], ИЛ-6 и ФНО-α — активировать пролиферацию этих клеток [17], а ИЛ-6 — ещё и стимулировать продукцию ИЛ-10 на фоне нарушения миграционной способности этих клеток [18]. Все названные цитокины входят в единый комплекс корреляционных связей между цитокинами крови и лимфоцитами различных фенотипов, установленный нами при выполнении данных исследований.
Таким образом, в результате проведённых исследований появились реальные основания для формирования гипотезы о ряде иммунопатогенетических особенностей ГЛПС. Особую роль в данном инфекционном процессе, как и при других вирусных инфекциях, играют ЦТЛ, но при ГЛПС ключевое значение приобретает высокий уровень экспрессии этими клетками рецептора NKG2D, который на фоне инфекции, сопровождающейся тотальным функциональным повреждением клеток сосудистой стенки, выполняет функцию своеобразного мостика между реакциями адаптивного и врождённого иммунитета в пользу последнего. В регуляции этой функции, судя по результатам данного исследования, ведущую роль приобретает соотношение ИЛ-12 и ИЛ-4 при преобладании ИЛ-12. В литературе показано также, если такие NKG2D-индуцированные CD8+-Т-клетки памяти при определённых условиях подвергаются стимуляции цитокинами, то их активация может сопровождаться трансформацией этих клеток в НКТ, одновременно сочетающие цитокинпродуцирующие и цитотоксические свойства [12, 19], рост которых, судя по фенотипу CD3+CD56+, отмечен в полиурический период ГЛПС [8].
В механизмы действия этих клеток входит модуляция баланса регуляторные/эффекторные Т-клетки путём дифференцировки моноцитов в регуляторные макрофаги, которые, в свою очередь, могут индуцировать CD8+-Tрег через значительный рост экспрессии ИЛ-10 [20], что подтверждается и нашими данными. Исследованный нами цитокиновый профиль не противоречит тому факту, что индукция Трег и продукция ими ИЛ-10 может поддерживаться ИЛ-6 и ФНО-α [18, 17], однако, судя по анализу корреляционных связей, избыточная экспрессия ИЛ-10 может привести к тяжёлому течению ГЛПС, что требует в дальнейшем более детального подтверждения.
Заключение
Патогенетически значимый механизм ГЛПС реализуется с преимущественным участием цитокинов клеточного иммунного ответа (ИЛ-12, ИФН-γ, ФНО-α и -β) и ИЛ-6, корреляционно связанных с NKG2D+-ЦТЛ, СD8+-Трег, НКТ, способствующих в случае благоприятного исхода инфекции активному формированию пула CD8+-Т-клеток памяти, предположительно нарушаемому при избыточной секреции ИЛ-10.
Этическое утверждение. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен межвузовским Этическим комитетом (протокол № 204 от 11.12.2019).
Источник финансирования. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
About the authors
Mikhail F. Ivanov
Samara State Medical University
Author for correspondence.
Email: timerman_1972@mail.ru
ORCID iD: 0000-0002-2528-0091
Cand. Sci. (Med.), Associate Professor, Department of general and clinical microbiology, immunology and allergology
Russian Federation, SamaraIrina P. Balmasova
A.I. Evdokimov Moscow State University of Medicine and Dentistry
Email: iri.balm@mail.ru
ORCID iD: 0000-0001-8194-2419
D. Sci. (Med.), Prof., Head, Pathogenesis and treatment methods of infectious diseases laboratory
Russian Federation, MoscowReferences
- Иванова А.В., Попов Н.В., Куклев Е.В. и др. Обзор эпидемиологической обстановки по геморрагической лихорадке с почечным синдромом (ГЛПС) на территории Российской Федерации за 1990–2015 гг. Журнал микробиологии, эпидемиологии и иммунобиологии. 2017;94(2):16–21. Ivanova A.V., Popov N.V., Kuklev E.V., et al. Review of epidemiologic situation on hemorrhagic fever with renal syndrome (HERS) in Russian Federation in 1990–2015. Journal of Microbiology, Epidemiology and Immunobiology. 2017;94(2):16–21. DOI: https://doi.org/10.36233/0372-9311-2017-2-16-21 EDN: https://elibrary.ru/wtelru
- Марцев А.А., Рудакова В.М., Ильина А.В. Эпидемиологическая и эпизоотическая обстановка по природно-очаговым зоонозным инфекциям во Владимирской области. Журнал микробиологии, эпидемиологии и иммунобиологии. 2018;95(5):20–6. Martsev A.A., Rudakova V.M., Il'ina A.V. Epidemic and epizootic situation of natural-focal zoonotic infections in Vladimir region. Journal of Microbiology, Epidemiology and Immunobiology. 2018;95(5):20–6. DOI: https://doi.org/10.36233/0372-9311-2018-5-20-26 EDN: https://elibrary.ru/cambuy
- Нехаев С.Г., Мельник Л.В. Актуальные аспекты геморрагической лихорадки с почечным синдромом (обзор литературы). Вестник новых медицинских технологий. Электронное издание. 2018;(1):151–8. Nekhaev S.G., Mel'nik L.V. Relevant pathogenesis aspects of hemorrhagic fever with renal syndrome (literature review). Journal of New Medical Technologies, eEdition. 2018;(1):151–8. DOI: https://doi.org/10.24411/2075-4094-2018-15980 EDN: https://elibrary.ru/ypneon
- Golden J.W., Hammerbeck C.D., Mucker E.M., et al. Animal models for the study of rodent-borne hemorrhagic fever viruses: arenaviruses and hantaviruses. BioMed Res. Int. 2015;2015:793257. DOI: https://doi.org/10.1155/2015/793257
- Avsic-Zupanc T., Saksida A., Korva M. Hantavirus infections. Clin. Microbiol. Infect. 2019;21S:e6–16. DOI: https://doi.org/10.1111/1469-0691.12291
- Мартыненко А.Ю., Томилка Г.С., Обухова Г.Г. Динамика цитокинов при геморрагической лихорадке с почечным синдромом. Дальневосточный медицинский журнал. 2015;(4):47–50. Martynenko A.Yu., Tomilka G.S., Obukhova G.G. Cytokines dynamics in hemorrhagic fever with renal syndrome. Far East Medical Journal. 2015;(4):47–50. EDN: https://elibrary.ru/vbkvyh
- Garanina E., Martynova E., Davidyuk Y., et al. Cytokine storm combined with humoral immune response defect in fatal hemorrhagic fever with renal syndrome case, Tatarstan, Russia. Viruses. 2019;11(7):601. DOI: https://doi.org/10.3390/v11070601
- Иванов М.Ф., Балмасова И.П., Жестков А.В. и др. Экспрессия NKG2D цитотоксическими Т-лимфоцитами как возможный механизм иммунопатогенеза геморрагической лихорадки с почечным синдромом. Иммунология. 2023;44(1):93–102. Ivanov M.F., Balmasova I.P., Zhestkov A.V., et al. Expression of NKG2D by cytotoxic T lymphocytes as a possible mechanism of hemorrhagic fever with renal syndrome immunopathogenesis. Immunology. 2023;44(1):93–102. DOI: https://doi.org/10.33029/0206-4952-2023-44-1-93-102
- Verneris M.R., Karami M., Baker J., et al. Role of NKG2D signaling in the cytotoxicity of activated and expanded CD8+ T cells. Blood. 2004;103(8):3065–72. DOI: https://doi.org/10.1182/blood-2003-06-2125
- Raulet D.H., Gasser S., Gowen B.G., et al. Regulation of ligands for the NKG2D activating receptor. Annu. Rev. Immunol. 2013;31:413–41. DOI: https://doi.org/10.1146/annurev-immunol-032712-095951
- Ligocki A.J., Niederkorn J.Y. Advances on non-CD4+ Foxp3+ T regulatory cells: CD8+, type 1, and double negative T regulatory cells in organ transplantation. Transplantation. 2015;99(8):1553–9. DOI: https://doi.org/10.1097/tp.0000000000000813
- Perez C., Prajapati K., Burke B., et al. NKG2D signaling certifies effector CD8 T cells for memory formation. J. Immunother. Cancer. 2019;7(1):48. DOI: https://doi.org/10.1186/s40425-019-0531-2
- Krautkrämer E., Grouls S., Urban E., et al. No gender-related differences in the severity of nephropathia epidemica, Germany. BMC Infect. Dis. 2013;13:457. DOI: https://doi.org/10.1186/1471-2334-13-457
- Иванов М.Ф., Балмасова И.П., Жестков А.В. и др. Прогностическое значение фенотипических изменений лимфоцитов при геморрагической лихорадке с почечным синдромом. Иммунология. 2023;44(2):181–90. Ivanov M.F., Balmasova I.P., Zhestkov A.V., et al. Prognostic significance of phenotypic changes of lymphocytes in hemorrhagic fever with renal syndrome. Immunology. 2023;44(2):181–90. DOI: https://doi.org/10.33029/0206-4952-2023-44-2-181-190
- Corradi G., Bassani B., Simonetti G., et al. Release of IFNγ by acute myeloid leukemia cells remodels bone marrow immune microenvironment by inducing regulatory T cells. Clin. Cancer Res. 2022;28(14):3141–55. DOI: https://doi.org/10.1158/1078-0432.ccr-21-3594
- Kim Y.J., Han M.K., Broxmeyer H.E. 4-1BB regulates NKG2D costimulation in human cord blood CD8+ T cells. Blood. 2008;111(3):1378–86. DOI: https://doi.org/10.1182/blood-2007-01-069450
- Skartsis N., Peng Y., Ferreira L.M.R., et al. IL-6 and TNFα drive extensive proliferation of human Tregs without compromising their lineage stability or function. Front. Immunol. 2021;12:783282. DOI: https://doi.org/10.3389/fimmu.2021.783282
- He S.W., Xue M.H., Cai G. IL-6 alters migration capacity of CD4+Foxp3+ regulatory T cells in systemic lupus erythematosus. Scand. J. Immunol. 2021;94(5):e13099. DOI: https://doi.org/10.1111/sji.13099
- Prajapati K., Perez C., Rojas B.P., et al. Functions of NKG2D in CD8+ T cells: an opportunity for immunotherapy. Cell. Mol. Immunol. 2018;15(5):470–9. DOI: https://doi.org/10.1038/cmi.2017.161
- Liu Q., Zheng H., Chen X., et al. Human mesenchymal stromal cells enhance the immunomodulatory function of CD8(+)CD28(−) regulatory T cells. Cell. Mol. Immunol. 2015;12(6):708–18. DOI: https://doi.org/10.1038/cmi.2014.118
Supplementary files