Nanocomposites consisting of titanium dioxide nanoparticles, antisense oligonucleotides, and photoactive groups as agents for effective action on nucleic acids
- Authors: Levina A.S.1, Repkova M.N.1, Mazurkov O.Y.2, Makarevich E.V.2, Mazurkova N.A.2, Zarytova V.F.1
-
Affiliations:
- Institute of Chemical Biology and Fundamental Medicine
- State Research Center of Virology and Biotechnology “Vector"
- Issue: Vol 101, No 1 (2024)
- Pages: 127-132
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/17775
- DOI: https://doi.org/10.36233/0372-9311-456
- EDN: https://elibrary.ru/zopuhr
- ID: 17775
Cite item
Full Text
Abstract
Relevance. Studies on model systems have confirmed the effectiveness of antisense oligonucleotides, including those that contain photoactive groups, for the modification of nucleic acids. However, this strategy has not yet found wide application due to the lack of successful methods for the cellular delivery. The development of effective preparations capable of acting on target nucleic acids in cells is an urgent task.
The objective of the work is to create nanocomposites consisting of TiO2 nanoparticles, antisense oligonucleotides, and photoactive groups and to study their effect on target nucleic acids by the example of inhibition of influenza A virus replication in the cellular system.
Materials and methods. Influenza virus A/Aichi/2/68 (A/H3N2), N-succinimide ether of p-azidotetrafluorobenzoic acid, TiO2 nanoparticles, and oligodeoxyribonucleotides have been used in the work. The antiviral activity of the proposed nanocomposites has been studied on the MDCK cells infected with the A/H3N2 virus.
Results and discussion. Unique nanocomposites have been created, which consist of three functional components, i.e., titanium dioxide nanoparticles, antisense oligonucleotides, and the photoactive tetrafluoroarylazide group, respectively, providing penetration into cells, selective interaction with target nucleic acids, and photomodification of the targets. A significant antiviral site-specific action of the nanocomposites has been demonstrated against the influenza A virus in the cellular system, which exceeds the effect of the analogous samples that contain no photoactive groups.
Conclusion. The biological activity of the created nanocomposites has been demonstrated by the example of highly effective suppression of influenza A virus replication in the cellular system. The results indicate the prospects of using the proposed drugs to affect target nucleic acids inside cells.
Full Text
Введение
Реакционноспособные производные олигонуклеотидов (ON) широко используются для сайт-специфической модификации нуклеиновых кислот (НК). Этот подход, впервые предложенный Н.И. Гриневой и соавт. [1], основан на сохранении способности ON, несущих химически активные группы, образовывать комплементарные комплексы с НК-мишенью, что обеспечивает её направленную модификацию. ON играет роль адреса, обеспечивающего комплементарное связывание с фрагментом целевой НК. Реактивная группа модифицирует этот фрагмент и блокирует функцию НК. В последние годы эта стратегия, так называемый антисмысловой подход, получила широкое признание.
Для воздействия на НК широко используются производные ON, содержащие различные фотоактивируемые группы. Эти группы стабильны в физиологических условиях и инертны в темноте и реагируют только при облучении, поэтому можно инициировать реакцию в любой момент и легко контролировать процесс модификации. Ароматические азиды представляют особый интерес, поскольку они обладают высоким квантовым выходом, т.е. не требуют высокой интенсивности и длительного времени экспозиции для активации. Ранее показано, что производные ON, несущие перфторарилазидную группу, оказались высокоэффективными реагентами для модификации НК [2, 3].
Исследования на различных модельных системах подтвердили эффективность ON для модификации НК, однако эта стратегия пока не нашла широкого применения. Основным препятствием является отсутствие эффективных методов доставки ON и их реакционноспособных производных в клетки. Для этой цели часто используются неорганические наночастицы различной природы [4, 5]. Известно, что наночастицы оксида титана (TiO2) проникают в клетки [6]. В наших предыдущих работах показано, что ON-содержащие нанокомпозиты на основе наночастиц TiO2 способны проникать через клеточную мембрану [7, 8]. В работах [9–11] продемонстрирован противовирусный эффект нанокомпозитов на основе наночастиц TiO2, несущих нативные олигодезоксирибонуклеотиды, в отношении вируса гриппа А.
Целью данной работы было создание нанокомпозитов, состоящих из наночастиц TiO2 и ON с фотоактивируемыми группами, и исследование их воздействия на НК-мишени на примере ингибирования репликации вируса гриппа А в клеточной системе.
Материалы и методы
В работе использовали клетки MDCK, вирус гриппа A/Aichi/2/68 (A/H3N2) (ГНЦ ВБ «Вектор»); ON, синтезированные на ДНК-синтезаторе «ASM-800» («Biosset»). N-сукцинимидный эфир п-азидотетрафторбензойной кислоты (ArN3-SuIm) получен по методу [12].
Наночастицы TiO2 в кристаллической форме анатаза получали гидролизом изопропоксида титана Ti(O-iPr)4 [7, 8].
Нанокомпозиты первого типа TiO2/PL–ON с ковалентной связью между ON и полилизином (PL) получали с практически количественным выходом [8] при смешивании заранее полученного конъюгата PL–ON с наночастицами анатаза. Нанокомпозиты второго типа TiO2/PL▪ON с ионной связью между ON и PL получали при смешивании ON с TiO2-наночастицами с заранее иммобилизованным PL с ёмкостью по аминогруппам PL 1 мкмоль/мг [8]. Выход при получении обоих типов нанокомпозитов был практически количественный; ёмкость по ON — 20 нмоль/мг.
Все манипуляции с наночастицами и нанокомпозитами проводили после обработки ультразвуком в течение 30 с в ультразвуковой ванне («Сапфир»). Характеристика нанокомпозитов проведена с использованием физико-химических методов (просвечивающая электронная микроскопия высокого разрешения, сканирующая электронная микроскопия, малоугловое рентгеновское рассеяние) и описана ранее [7, 8]. Показано, что размер нанокомпозитов был больше на ~1 нм размера исходных наночастиц (~5 нм), что указывало на образование комплексов между фрагментами ДНК и наночастицами. Соотношение фосфата и титана (P/Ti) в нанокомпозитах показало хорошую корреляцию между расчётными и экспериментальными данными. Используя радиоактивно и флуоресцентно меченные ON, мы подтвердили их прикрепление к наночастицам и показали, что ON в обоих типах нанокомпозитов сохранили свою способность образовывать комплементарные комплексы и могут проникать в эукариотические клетки [7, 8, 11].
Введение фотоактивируемой арилазидной группы в ON проводили по методу [2] при обработке ON, содержащего концевую аминогруппу, с помощью ArN3-SuIm и получали ON*, содержащий арилазидную группу, который использовали для получения нанокомпозитов TiO2/PL▪ON*. Нанокомпозиты TiO2/PL*–ON получали при обработке нанокомпозитов TiO2/PL–ON с помощью ArN3-SuIm [13].
Противовирусную активность созданных нанокомпозитов исследовали на клетках MDCK, заражённых вирусом A/H3N2 [13]. Заражённые вирусом клетки MDCK, не обработанные нанокомпозитами, использовали в качестве контроля.
УФ-облучение зараженных клеток MDCK проводили в процессе инкубации с нанокомпозитами лампой «PL-S 9W/10» (350–400 нм, 10 мВ/см2, дистанция 1 см; «Philips»).
Результаты и обсуждение
Для создания нанокомпозитов использовали две стратегии [8]. Первый метод (1) состоит в электростатическом связывании ON с предварительно подготовленными наночастицами, покрытыми PL (TiO2/PL). Второй метод (2) состоит в иммобилизации PL-содержащих олигодезоксирибонуклеотидов (PL–ON) на TiO2-наночастицах.
TiO2/PL + ON → TiO2/PL▪ON; (1)
TiO2 + PL–ON → TiO2/PL–ON. (2)
Для получения фотоактивируемых нанокомпозитов в первом случае на наночастицах TiO2/PL иммобилизовали ON с предварительно введённой фотоактивируемой арилазидной группой [2] и получали нанокомпозиты TiO2/PL▪ON*. Во втором случае перфторарилазидную группу присоединяли к аминогруппам PL в сформированном нанокомпозите и получали TiO2/PL*–ON. Таким образом, получены два типа нанокомпозитов: с ионной (▪) или ковалентной (–) связью между ON и PL, причём фотоактивируемая группа введена либо в ON в первом случае, либо в остаток PL во втором случае.
В качестве ON в нанокомпозитах использовали 21-мерный олигодезоксирибонуклеотид 5’-GCAAAAGCAGGGTAGATAATCp (ODN), комплементарный 3’-концевой области (–)РНК 5-го сегмента вируса гриппа А, кодирующего белок NP, и 5’-GATCAACTCCATATGCCATGTp (SCR) со случайной последовательностью в качестве контроля.
В исследованиях противовирусной активности на клетках MDCK, заражённых вирусом A/H3N2, использовали нанокомпозиты в нетоксичной для клеток концентрации 100 мкг/мл. Ингибирование вируса в клетках MDCK выражали в виде логарифма индекса подавления продукции (ИПП) вируса. Значение log ИПП равняется разности логарифмов титра вируса в клетках в отсутствие (контроль) и в присутствии образцов. Таким образом, log ИПП означает, на сколько порядков происходит ингибирование вируса; чем выше log ИПП, тем более эффективно действует исследуемый препарат.
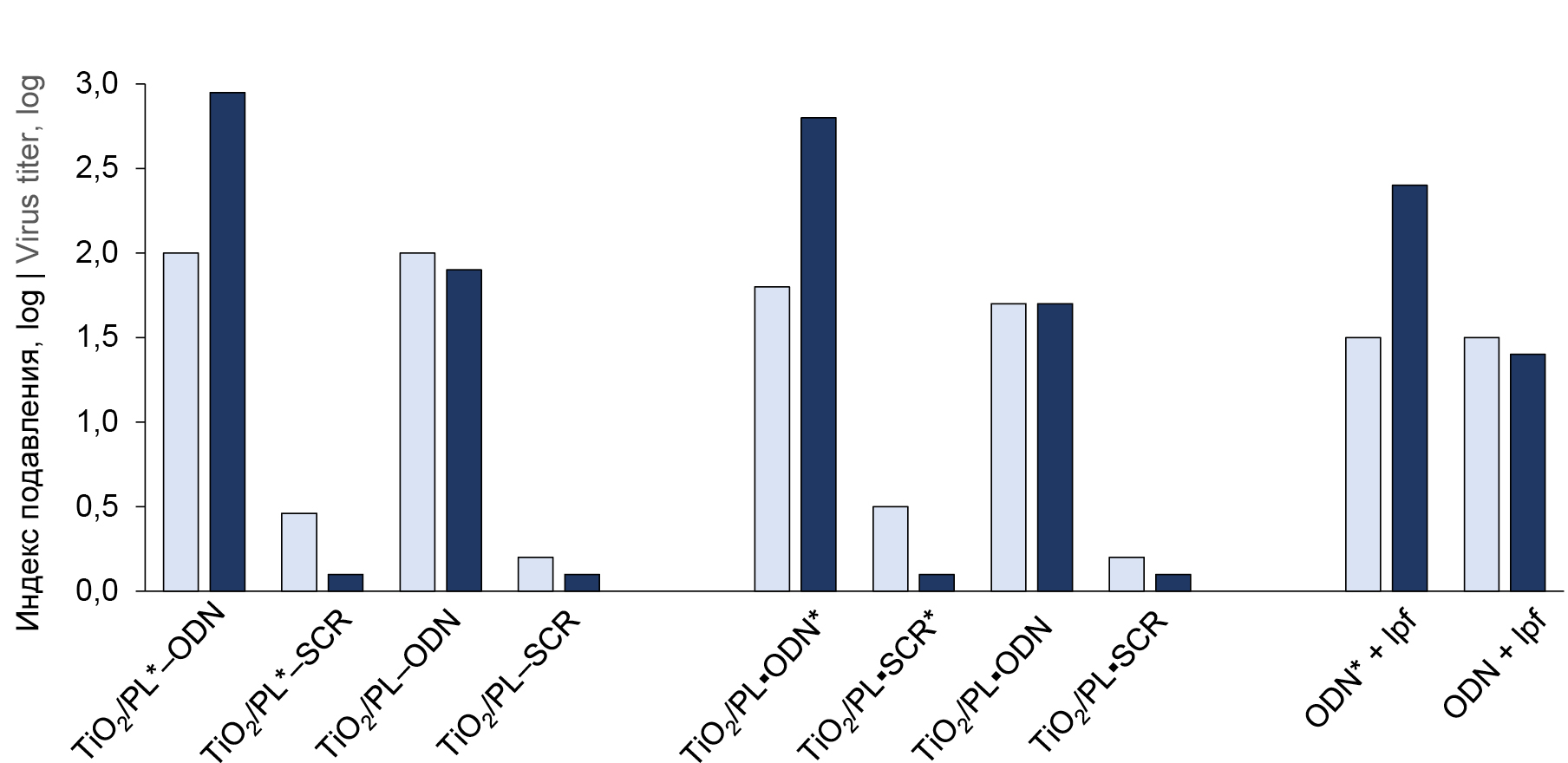
Прежде всего, следует отметить, что нанокомпозиты обладают сайт-специфическим действием, т.е. «комплементарные» нанокомпозиты, несущие ODN, комплементарный вирусной РНК, проявляют существенно бóльшую активность по сравнению с «некомплементарными» нанокомпозитами, несущими случайную последовательность SCR (рисунок). Разница составляет 1,5–2,0 порядка до облучения, после облучения этот эффект выражен даже в большей степени.
Противовирусная активность образцов нанокомпозитов на основе наночастиц TiO2, содержащих комплементарный (ODN) и некомплементарный (SCR) ON по отношению к вирусной РНК, а также содержащих или не содержащих фотоактивируемую арилазидную группу на остатке полилизина или ON (соответственно PL*, ODN*, SCR* и PL, ODN, SCR). Светлые столбики — до ультрафиолетового облучения культуры зараженных клеток с образцами, тёмные — после. lpf — липофектамин.
Antiviral activity of samples expressed as the logarithm of the virus production suppression index. TiO2-based nanocomposites contained complementary and non-complementary oligonucleotides to viral RNA (ODN and SCR, respectively); they contained the photoactive arylazide group on the polylysine residue or oligonucleotide (PL*, ODN*, or SCR*) or did not contain this group. The light and dark columns correspond to the results before and after UV irradiation of infected cell cultures with samples, respectively; lpf, lipofectamine.
ODN* проявляет примерно на порядок бóльшую активность после облучения независимо от того, в составе какого нанокомпозита он доставлен в клетки (рисунок). Как и следовало ожидать, «комплементарные» нанокомпозиты, не содержащие фотоактивируемую группу, не отличаются по своей активности до и после облучения. Противовирусная активность комплементарных ODN почти не зависит от наличия фотоактивируемой группы в составе нанокомпозита, если они не подвергаются облучению. Положение фотоактивируемой группы в нанокомпозите (на остатке полилизина или в ODN) практически не влияет на противовирусный эффект.
Интересно отметить, что «некомплементарные» нанокомпозиты, несущие фотоактивируемую группу, менее активны после облучения (рисунок). Возможно, этот эффект вызван автодеструкцией SCR при облучении в том случае, если он не находится во взаимодействии с комплементарной мишенью, что приводит к снижению противовирусной активности.
Как и в случае, когда ODN находится в составе нанокомпозитов, не связанный с наночастицами ODN, доставленный в клетки с помощью липофектамина (широко используемого трансфекционного агента), проявляет бόльшую активность после облучения, если он содержит арилазидную группу, а активность немеченого ODN не зависит от облучения (рисунок). Во всех случаях ODN в составе нанокомпозитов проявляет несколько бóльшую противовирусную активность по сравнению с тем, когда он доставлен в клетки в присутствии липофектамина.
Заключение
Таким образом, созданы уникальные нанокомпозиты, состоящие из трех функциональных компонентов: наночастиц TiO2, антисмыслового ODN и фотоактивируемой тетрафторарилазидогруппы, обеспечивающих, соответственно, проникновение в клетки, селективное взаимодействие с НК-мишенями и фотомодификацию этих мишеней. Продемонстрирован значительный противовирусный сайт-специфический эффект предложенных нанокомпозитов для воздействия на НК-мишени на примере ингибирования репликации вируса гриппа А в клеточной системе. Показано, что нанокомпозиты, содержащие фотоактивируемую группу, более эффективны по сравнению с немодифицированными аналогами. Полученные результаты свидетельствуют о перспективности использования предложенных препаратов для воздействия на НК-мишени внутри клеток.
About the authors
Asya S. Levina
Institute of Chemical Biology and Fundamental Medicine
Email: Levina@niboch.nsc.ru
ORCID iD: 0000-0003-2423-3805
Cand. Sci. (Chem.), senior researcher, Laboratory of nucleic acids, Institute of Chemical Biology and Fundamental Medicine
Russian Federation, NovosibirskMarina N. Repkova
Institute of Chemical Biology and Fundamental Medicine
Email: repk56@mail.ru
ORCID iD: 0000-0002-7108-9036
Cand. Sci. (Chem.), researcher, Laboratory of nucleic acids, Institute of Chemical Biology and Fundamental Medicine
Russian Federation, NovosibirskOleg Y. Mazurkov
State Research Center of Virology and Biotechnology “Vector"
Email: mazurkov_oyu@vector.nsc.ru
ORCID iD: 0000-0001-8164-4091
Cand. Sci. (Biol.), researcher, Department of prevention and treatment of especially dangerous infections, SRC VB «Vector»
Russian Federation, Koltsovo, Novosibirsk regionElena V. Makarevich
State Research Center of Virology and Biotechnology “Vector"
Email: makarevich_ev@vector.nsc.ru
ORCID iD: 0000-0002-5146-8979
researcher, Department of prevention and treatment of especially dangerous infections, SRC VB «Vector»
Russian Federation, Koltsovo, Novosibirsk regionNatalya A. Mazurkova
State Research Center of Virology and Biotechnology “Vector"
Email: mazurkova@vector.nsc.ru
ORCID iD: 0000-0002-1896-2684
D. Sci. (Biol.), leading researcher, Department of prevention and treatment of especially dangerous infections, SRC VB «Vector»
Russian Federation, Koltsovo, Novosibirsk regionValentina F. Zarytova
Institute of Chemical Biology and Fundamental Medicine
Author for correspondence.
Email: zarytova@niboch.ncs.ru
ORCID iD: 0000-0002-9579-9972
D. Sci. (Chem.), leading researcher, Laboratory of nucleic acids, Institute of Chemical Biology and Fundamental Medicine
Russian Federation, NovosibirskReferences
- Belikova A.M., Zarytova V.F., Grineva N.I. Synthesis of ribonucleosides and diribonucleoside phosphates containing 2-chloroethylamine and nitrogen mustard residues. Tetrahedron Lett. 1967;37:3557–62. DOI: https://doi.org/10.1016/s0040-4039(01)89794-x
- Levina A.S., Berezovskii M.V., Venjaminova A.G., et al. Photomodification of RNA and DNA fragments by oligonucleotide reagents bearing arylazide groups. Biochemie. 1993;75(1-2): 25–7. DOI: https://doi.org/10.1016/0300-9084(93)90020-s
- Levina A.S., Tabatadze D.R., Dobrikov M.I., et al. Site-specific photomodification of single-stranded DNA targets by arylazide and perfluoroarylazide derivatives of oligonucleotides. Antisense Nucleic Acids Drug Dev. 1996;6(2):119–26. DOI: https://doi.org/10.1089/oli.1.1996.6.119
- Kim T.H., Kim M., Eltohamy M., et al. Efficacy of mesoporous silica nanoparticles in delivering BMP-2 plasmid DNA for in vitro osteogenic stimulation of mesenchymal stem cells. J. Biomed. Mater. Res. A. 2013;101(6):1651–60. DOI: https://doi.org/10.1002/jbm.a.34466.
- Kovtun A., Neumann S., Neumeier M., et al. Nanoparticle-mediated gene transfer from electrophoretically coated metal surfaces. J. Phys. Chem. B. 2013;117(6):1550–5. DOI: https://doi.org/10.1021/jp303448v
- Thurn K.T., Arora H., Paunesku T., et al. Endocytosis of titanium dioxide nanoparticles in prostate cancer PC-3M cells. Nanomedicine. 2011;7(2):123–30. DOI: https://doi.org/10.1016/j.nano.2010.09.004
- Levina A., Ismagilov Z., Repkova M., et al. Nanocomposites consisting of titanium dioxide nanoparticles and oligonucleotides. J. Nanosci. Nanotech. 2012;12(3):1812–20. DOI: https://doi.org/10.1166/jnn.2012.5190
- Левина А.С., Исмагилов З.Р., Репкова М.Н. и др. Создание TiO2~DNA-нанокомпозитов, способных проникать в клетки. Биоорганическая химия. 2013;39(1):87–98. Levina A.S., Repkova M.N., Shatskaya N.V., et al. Design of TiO2~DNA nanocomposites for penetration into cells. Russian Journal of Bioorganic Chemistry. 2013;39(1):77–86. DOI: https://doi.org/10.1134/S1068162013010068 EDN: https://elibrary.ru/reyqpd
- Levina A.S., Repkova M.N., Bessudnova E.V., et al. High antiviral effect of TiO2·PL-DNA nanocomposites targeted to conservative regions of (–)RNA and (+)RNA of influenza A virus in cell culture. Beilstein J. Nanotechnol. 2016;7:1166–73. DOI: https://doi.org/10.3762/bjnano.7.108
- Levina A.S., Repkova M.N., Ismagilov Z.R., et al. High-performance method for specific effect on nucleic acids in cells using TiO2~DNA nanocomposites. Sci. Rep. 2012;2:756. DOI: https://doi.org/10.1038/srep00756
- Levina A.S., Repkova M.N., Mazurkova N.A., Zarytova V.F. Nanoparticle-mediated nonviral DNA delivery for effective inhibition of influenza A viruses in cells. IEEE Trans. Nanotechnol. 2016;15(2):248–54. DOI: https://doi.org/10.1109/TNANO.2016.2516561 EDN: https://elibrary.ru/wtfubh
- Добриков М.И., Приходько T.A., Сафронов И.В., Шишкин Г.В. Синтез и свойства светочувствительных капроновых мембран. Фотоиммобилизация ДНК. Сибирский химический журнал. 1992;(2):18–24. Dobrikov M.I., Prikhod'ko T.A., Safronov I.V., Shishkin G.V. Synthesis and properties of photosensitive nylon membranes. Photo immobilization of DNA. Siberian Chemical Journal. 1992;(2):18–24.
- Зарытова В.Ф., Исмагилов З.Р., Левина А.С. и др. Нанокомпозит с активным лигандом, способ его приготовления и способ адресной инактивации вируса гриппа внутри клетки. Патент РФ № 2496878;2012. Zarytova V.F., Ismagilov Z.R., Levina A.S., et al. A nanocomposite with an active ligand, a method for its preparation and a method for targeted inactivation of the influenza virus inside the cell. Patent RF № 2496878;2012.
Supplementary files