Genetic structure and drug resistance of Mycobacterium tuberculosis strains in the Kemerovo Region — Kuzbass
- Authors: Lebedeva I.B.1, Zhdanova S.N.2, Kondratov I.G.2, Sibil C.V.3, Ogarkov O.B.2, Brusina E.B.1
-
Affiliations:
- Kemerovo State Medical University
- Scientific Centre for Family Health and Human Reproduction Problems
- Kuzbass Clinical Phthisiopulmonological Medical Center named after I.F. Kopylova
- Issue: Vol 100, No 6 (2023)
- Pages: 428-441
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/17552
- DOI: https://doi.org/10.36233/0372-9311-449
- EDN: https://elibrary.ru/uwbzwm
- ID: 17552
Cite item
Full Text
Abstract
Background. Kemerovo Region has a high burden of tuberculosis (TB) with incidence rates twice the national average. The circulating variants of Mycobacterium tuberculosis significantly influence the TB epidemic process. Screening of epidemically significant variants of the pathogen in areas with a high burden of TB underlies epidemiological diagnosis and is necessary for the development of effective prevention measures. However, the population structure of M. tuberculosis in the Kemerovo Region — Kuzbass is poorly understood.
Aims: to study genetic heterogeneity and phenotypic resistance to anti-tuberculosis drugs of M. tuberculosis strains in the Kemerovo Region.
Materials and methods. The MIRU-VNTR genotyping of 163 M. tuberculosis strains isolated from TB patients in the Kemerovo Region in March–October 2022 was carried out. Cultivation of M. tuberculosis, drug susceptibility testing, and isolation of genomic DNA were carried out by standard methods. Genotypic identification was performed using MIRU-VNTR (24 loci) typing. In parallel, express genotyping was carried out: identification of isolates of the Beijing genotype (by RD105/207) and non-Beijing; subtyping Beijing using real-time PCR tests for detection of Central Asian Russian and B0/W148; identification of the non-Beijing group by real-tine PCR RT tests for LAM, S, Ural.
Results. The isolates of the Beijing genotype (67.5%) were found to dominate both among newly diagnosed (64.4%) and previously treated patients (88.5%). MIRU-VNTR typing revealed 75 profiles, of which 94-32 (35.3%) and 100-32 (15.7%) were the most abundant and belonged to the Beijing genotype. Overall, 39.9% and 20.9% of isolates, respectively, were assigned to the Beijing Central Asian Russian and B0/W148 epidemic clusters, which differed significantly in MDR levels (50.8% and 85.3%, respectively; p = 0.005). The second most common were strains of the genetic family of the Euro-American lineage (L4) (31.9%): LAM (6.7%) Ural (7.4%) Haarlem (4.9%) and L4-unclassified (12.9%), MDR among of these minor genotypes was significantly lower than among Beijing genotype strains, and amounted to 11.5% (p < 0.001). Strains from HIV-TB patients (56.4% of the total sample) carried an MDR profile more often (54.8%) compared to TB cases without HIV infection (35.2%) (p = 0.005), which may be due to higher proportion of Beijing genotype strains in the HIV-TB group (75.0% vs. 57.7%; p = 0.026). Complete comparability of the SNP analysis (in-house tests) to identify the main genotypes and epidemically significant Beijing subtypes was shown, which made it possible to characterize 75.5% of the sample by the express method.
Conclusions. The molecular genetic screening carried out in the Kemerovo Region revealed the heterogeneity of the M. tuberculosis population, which was dominated by strains of the Beijing genotype, with the frequency of subtypes comparable with other territories of the Siberian Federal District.
Full Text
Введение
Несмотря на то что заболеваемость туберкулёзом (ТБ) на территории Кемеровской области — Кузбасса, как и в целом по России, за последние годы снизилась [1], Кузбасс сохраняет позиции региона с высоким бременем этой инфекции [2]. В 2021 г. заболеваемость ТБ составила 70,3 на 100 тыс. населения, что более чем в 2 раза выше среднероссийского уровня (31,1 на 100 тыс. населения).
Среди причин сохранения неблагоприятной эпидемиологической обстановки по ТБ отмечают рост числа случаев ТБ с множественной лекарственной устойчивостью (МЛУ) и распространение сочетанной инфекции ВИЧ и ТБ. Кемеровская область по уровням МЛУ-ТБ и ВИЧ-ТБ входит в группу лидеров не только в Сибирском федеральном округе, но и в России [2]. Распространение МЛУ-ТБ в России связывают с широкой циркуляцией штаммов Mycobacterium tuberculosis (MБТ) генотипа Beijing, его основных субтипов — Beijing Central Asian Russian (Центральноазиатский российский) и Beijing В0/W148 [3, 4]. В азиатских регионах России доля генотипа Beijing варьирует от 45 до 70% [5–9]. По Кемеровской области системная информация о популяционной структуре возбудителя ТБ практически отсутствует, поскольку ранее проводимые в Западной Сибири скрининговые исследования MБТ включали лишь небольшое количество штаммов из этого региона [9, 10].
Цель исследования: изучить генетический полиморфизм и фенотипическую устойчивость к противотуберкулёзным препаратам (ПТП) штаммов MБТ в Кемеровской области — Кузбассе.
Материалы и методы
Дизайн исследования
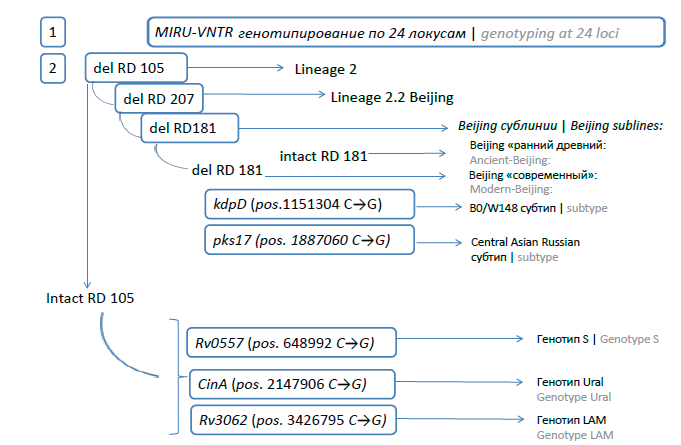
Выполнено MIRU-VNTR-генотипирование MБТ, схема которого представлена на рис. 1. Объект исследования — клинические культуры MБТ, полученные от больных ТБ, проживающих в Кемеровской области — Кузбассе и госпитализированных в Кузбасский клинический фтизиопульмонологический медицинский центр. Исследуемая коллекция включала сплошную выборку образцов (по одному от пациента) клинических культур МБТ со среды Левенштейна–Йенсена, собранных в марте–октябре 2022 г.
Рис. 1. Схема генотипирования MБТ.
Fig. 1. M. tuberculosis genotyping scheme.
Определение лекарственной чувствительности изолятов МБТ к ПТП проводили методом абсолютных концентраций на плотной питательной среде Левенштейна–Йенсена (в концентрациях для стрептомицина — 10 мкг/мл; изониазида — 1 мкг/мл; рифампицина — 40 мкг/мл; этамбутола — 2 мкг/мл; офлоксацина — 2 мкг/мл; канамицина — 30 мкг/мл; капреомицина — 30 мкг/мл; протионамида — 30 мкг/мл) и модифицированным методом пропорций на жидкой питательной среде Мидделбрука 7H9 с применением бактериологического анализатора с автоматизированной детекцией роста «Bactec MGIT 960» («Becton Dickinson») (в концентрациях для стрептомицина — 1,0 мкг/мл; изониазида — 0,1 мкг/мл; рифампицина — 0,5 мкг/мл; этамбутола — 5,0 мкг/мл; пиразинамида — 100 мкг/мл; амикацина — 1,0 мкг/мл; капреомицина — 2,5 мкг/мл; бедаквилина — 1,0 мкг/мл; протионамида — 2,5 мкг/мл; левофлоксацина — 1 мкг/мл; моксифлоксацина — 0,25 и 1 мкг/мл; линезолида — 1,0 мкг/мл) согласно Приказу МЗ РФ № 951 от 29.12.2014 и Клиническим рекомендациям «Туберкулёз у взрослых, 2022».
Экстракцию ДНК штаммов МБТ проводили из инактивированных кипячением культур MБТ. Перед выделением образцы центрифугировали, ДНК выделяли из осадка набором ДНК-сорб B («Интерлабсервис»). Генотипирование осуществляли по 24 локусам MIRU-VNTR (Mycobacterial Interspersed Repetitive Units — Variable Number of Tandem Repeats)1. Идентификацию и классификацию по MLVA MtbC 15-9 полученных по MIRU-VNTR-24-профилей проводили с помощью онлайн-инструментов MIRU-VNTRplus2.
Последовательность тестов включала делеционный анализ по RD в реакциях полимеразной цепной реакции с электрофоретической детекцией и анализ однонуклеотидных полиморфизмов (SNP) в ПЦР в реальном времени (ПЦР-РВ) (рис. 1): RD 105 и RD 207 с на выявление Линии 2, Линии 2.2 (Beijing) и группы non-Beijing согласно Reed [11]; дифференциацию генотипа Beijing на современную и раннедревнюю сублинии путём определения делеции RD181 согласно M.B. Reed [11]; осуществление двух ПЦР-РВ для всех представителей Beijing на выявление специфической динуклеотидной делеции в гене kdpD[3] и специфического SNP в гене pks17 [12] для идентификации российского эпидемического субтипа Beijing B0/W148 и Beijing Central Asian Russian субтипа; выполнение трех ПЦР-РВ для всей группы non-Beijing штаммов с целью установления принадлежности к генотипам евро-американской линии (для генотипа S — в Rv0557 [13, 14]; генотипа LAM в — Rv3062 [15]; Ural — в гене CinA [13]). Праймеры и зонды представлены в табл. 1.
Таблица 1. Структуры праймеров и зондов, разработанные для индикации субтипов генотипа Beijing и генотипов евро-американской линии (LAM, S, Ural)
Table 1. Primers and probes designed to identify Beijing genotype subtypes and Euro-American line genotypes (LAM, S, Ural)
Генотип, субтип (ген), позиция Genotype, subtype (gene) position | Праймеры Primers | ДНК-зонды DNA-probes | Температура отжига, oC Annealing temperature, oC | Источник структуры праймеров и зондов Source of primer and probe sequences |
Beijing, B0/W148 (kdpD) 1151304 | F 5'-GGCGGCACGATTTCG GCTAC-3' R 5'-TCGTCGTCAATCACCAAGACGA-3' | 5'-FAM-GGCGGGCTCA[LNA-C]AG[LNA-T]GGTGATC-3'-RTQ1) 5'-R6G-GGCGGG CTCA[LNA-G]TGGTGATCG[LNA-A]T-3'-BHQ2 | 64 | Eurasian Patent N 032489 |
Beijing, Central Asian Russian (pks17) 1887060 | F 5'-AGGTCGATGGGGCCTGGAATT-3', R 5'-GAAAACAACACAAACGCTGACAC-3' | 5'-FAM-ATGAGCTCAC(G-LNA)CGGC(A-LNA)CCTG-3'-RTQ1; 5'-R6G-ATGAGCTCAC(C-LNA)CGGC(A-LNA)CCTG-3'-BHQ2) | 62 | [23] |
S (Rv0557) 648992 | F 5'-GCATTCCGATGACAGCACG R 5'- GATTCCATTGTCGCTGTGGA | 5'-FAM-GGTTCCGCCACTTGCATCG (G-LNA)CT –BHQ1; 5'-R6G-GGTTCCGCCACTTGCATCG (C-LNA)CT –BHQ1 | 60 | Настоящее исследование This study |
Ural (CinA) 2147906 | F 5’-GACCTGATCGTCACCAGCG R 5’-CGTCCAGCACCAGCTCGC | 5’-FAM-GACCGCCGACGATATGA [T-LNA]CG-BHQ1; 5’-R6G-GACCGCCGACGATATGA [C-LNA]CG-BHQ1 | 62 | Настоящее исследование This study |
LAM (Rv3062) 3426795 | F 5’-TGGTGCTCGCGGTGGAATGG R 5’-CATCACGAATCCACCGGTAG | 5’-FAM-CGCGGCAAGCTCTC [C-LNA]AATAT- BHQ1; 5’-R6G -CGCGGCAAGCTCTC [G-LNA]AATAT- BHQ1 | 62 | Настоящее исследование This study |
Условия для проведения ПЦР: в течение 45 циклов с реактивами AmpliTaq Gold 360 Master Mix («Applied Biosystems») в присутствии 1× раствора энхансера из того же набора на амплификаторе «CFX-96 Touch» («BioRad»). Режимы ПЦР-РВ: 95ºС — 10 мин, активация полимеразы; 95ºС — 15 с; отжиг 60–64ºС (в зависимости от теста) — 10 с; 72ºС — 20 с. При отсутствии маркеров, использованных в SNP-анализе, штаммы считали как «Beijing другие» и «non-Beijing другие». Для сопоставления результатов типирования (MIRU-VNTR-24 и SNP-анализ) профили соотносили пo базам данных генотипов Beijing [16], LAM [17], Ural [18], S [19], Lineage 4 [20].
Критерии соответствия
Критериями включения в коллекцию штаммов были деперсонализированные данные о больных ТБ: проживание в Кемеровской области, лечение в противотуберкулёзных диспансерах, возраст старше 18 лет.
Критерии исключения: возраст менее 18 лет, отсутствие бактериовыделения.
Этическая экспертиза
Исследование одобрено Этическим комитетом Кемеровского государственного медицинского университета (протокол № 255/к от 11.11.2020) и Этическим комитетом Научного центра здоровья семьи и репродукции человека (протокол № 4 от 12.04.2023). Вся информация об образцах МБТ, использованных в этом ретроспективном исследовании, исключала личную информацию о пациентах.
Статистический анализ
Статистическую обработку данных проводили в редакторе электронных таблиц «MS Excel 14.0» и в программе «GraphPad Prism 7». После проведения теста на нормальность с помощью теста Шапиро–Уилка количественные показатели представляли в виде медианы (Ме) и интерквартильного диапазона [IQR]. Номинальные данные описывали с указанием абсолютных значений и процентных долей. Критерий χ2 был использован для обнаружения значимых различий между двумя группами. Скорректированные поправкой Йейтса значения χ2 и p были рассчитаны с 95% доверительным интервалом. Различия считали статистически значимыми при р ≤ 0,05.
Результаты
Участники исследования
В исследование были включены 163 клинических изолята, взятых от больных (126 мужчин и 47 женщин) ТБ, преимущественно впервые выявленных (83,9%). От пациентов с ВИЧ-инфекцией получены 84 (52,8%) образца. Клиническими формами ТБ были инфильтративный (38,5%), диссеминированный (41,6%), фиброзно-кавернозный (5,0%), казеозная пневмония (6,8%), туберкулёмы (4,3%) лёгких, 4 (2,5%) случая внелёгочных форм ТБ. Основная клиническая информация о пациентах, от которых получены исследуемые изоляты, представлена в табл. 2.
Таблица 2. Общая характеристика исследуемой выборки штаммов M. tuberculosis
Table 2. General characteristics of the studied sample of M. tuberculosis strains
Показатели Сharacteristics | Впервые выявленные случаи ТБа Newly identified cases of TBа | Ранее леченные случаи ТБb Previously treated TB casesb |
Мужчины, %; n (ДИ) | Men, %; n (CI) | 97; 71,9 (63,7–78,8) | 18; 69,2 (44,0–77,4) |
Позитивный ВИЧ-статусc, %; n (ДИ) Positive HIV statusc, %; n (CI) | 75; 56,4 (47,9–64,5) | 9; 40,9 (23,2–61,3) |
Средний возраст на момент выявления ТБ, Ме [IQR]: Mean age at TB detection, Ме [IQR]: | ||
мужчины | men | 41,3 (29,4–53,2) | 38,5 (28,1–48,9) |
женщины | women | 44,5 (31,1–57,9) | 40,0 (28,2–51,8) |
Клинические формы ТБ лёгких, %; n (ДИ): TB clinical forms, %; n (CI): | ||
инфильтративный | infiltrative | 58; 43,0 (34,9–51,4) | 4; 15,4 (5,5–31,1) |
диссеминированный | disseminate | 58; 43,0 (34,9–51,4) | 9; 34,6 (19,3–53,9) |
фиброзно-кавернозный | fibrous-cavernous | 5; 3,7 (1,4–8,6) | 3; 11,5 (3,2–29,8) |
очаговый | focal | 2; 1,5 (0,7–5,6) | 0 |
туберкулемы | tuberculoma | 2; 1,5 (0,7–5,6) | 5; 19,2 (8,1–38,3) |
казеозная пневмония | caseosis pneumonia | 6; 4,4 (1,9–9,6) | 5; 19,2 (8,1–38,3) |
Другие локализации ТБ, %; n (ДИ): Other TB locations, %; n (CI): | ||
ТБ внутригрудных лимфоузлов | TB of intrathoracic lymph nodes | 3; 2,2 (0,5–6,6) | 0 |
ТБ менингит | TB meningitis | 1; 0,7 (0,1–4,5) | 0 |
Лекарственная устойчивостьc, %; n (ДИ): Drug resistancec, %; n (CI): | ||
чувствительные | sensitive | 54; 40,0 (32,6–49,1) | 4; 15,4 (5,5–34,1) |
монорезистентные | monoresistant | 10; 7,4 (4,0–13,4) | 1; 3,8 (0–20,5) |
полирезистентные | polyresistant | 19; 14,1 (9,3–21,3) | 0 |
МЛУ | multidrug-resistant TB: | 52; 38,5 (31,2–47,6) | 21; 80,8 (61,7–92,0) |
из них пре-ШЛУd | of them pre-extensively drug-resistantd | 9; 17,3 (9,1–30,0) | 4; 19,0 (7,0–40,6) |
Примечание. аИнформация о группе диспансерного учёта, сведения о клинических формах ТБ была доступна для 161 пациента (135 впервые выявленных и 26 ранее леченных больных); данные ВИЧ-статуса — для 155 пациентов (соответственно для 133 и 22 больных); данные о лекарственной устойчивости изолятов МБТ — для 159 пациентов (соответственно 133 и 26 больных).
bРанее леченные случаи включали рецидив ТБ, лечение после неэффективного курса химиотерапии, лечение после прерывания курса химиотерапии, переведённый для продолжения лечения.
cРаспределение изолятов по лекарственной устойчивости имело значимые отличия среди впервые выявленных и ранее леченных случаев ТБ (χ2; df = 3; р = 0,002).
dРасчет произведён к общему количеству штаммов в MЛУ и пре-ШЛУ.
Note. aInformation on the dispensary group, data on clinical forms of TB was available for 161 patients (135 newly identified and 26 previously treated patients); HIV status data — for 155 patients (respectively for 133 and 22 patients); data on drug resistance of MBT isolates — for 159 patients (133 and 26 patients, respectively).
bPreviously treated cases included: relapse of tuberculosis, treatment after an ineffective course of chemotherapy, treatment after interruption of the course of chemotherapy, transferred to continue treatment.
cThe distribution of isolates by drug resistance had significant differences among newly identified and previously treated TB cases (χ2; df = 3; p = 0.002)
dСalculation was made for the total number of strains in MDR and pre-XDR.
Для определения генотипической структуры популяции МБТ использовали комбинацию молекулярных методов развёрнутой схемы генотипирования и экспресс-методы SNP-анализа — выявление маркеров генотипов по специфическим для них SNP. Первым этапом был проведён делеционный анализ по регионам различия RD 105 и 207 всех образцов, который разделил выборку на 2 группы, из них 110 (67,5%) из 163 изолятов принадлежали к Beijing-генотипу, остальные 52 определены как non-Beijing и 1 смешанный образец (Beijing/non-Beijing — mix). Все Beijing-штаммы имели делецию в регионе различий RD 181, они отнесены к современной подлинии этого генотипа.
Результаты MIRU-VNTR-типирования
MIRU-VNTR-24-локусное типирование 163 штаммов выявило 75 профилей, классифицированных по MLVA MtbC15-9 схеме (рис. 2), 29 из которых принадлежали Beijing и 46 — non-Beijing. По результатам генотипирования, кроме Beijing, были идентифицированы генотипы евро-американской генетической линии (L4): LAM (6,7%; 11/163), Ural (7,4%; 12/163), Haarlem (4,9%; 8/163) и группа штаммов, относящихся к L4, но не дающих однозначной принадлежности к определённому генотипу по 24-локусному профилю и условно называемая L4-unclassified (12,9%; 21/163) [20]. Смешанный образец нёс профили генотипов Beijing и Ural. К генотипу Beijing принадлежали 85 кластеризованных изолятов: типы 100-32 (29 изолятов) и 94-32 (50 изолятов), а также по 3 штамма с профилями 1065-32 и 1068-32. Группа non-Beijing имела 5 кластеров, каждый из которых содержал 2–3 изолята (LAM-генотипа — 121-496 и 1119-52; Ural — 163-15; и 4 профиля, принадлежащих L4 unclassified).
Рис. 2. UPGMA-дендрограмма MIRU-VNTR-профилей 163 штаммов M. tuberculosis из Кемеровской области.
Каждая строка содержит данные изолята с идентифицированным генотипом в жёлтом блоке с указанием количества в случае выявления идентичных профилей; идентификационного номера изолята; MLVA MtbC15-9 типа; числа повторов в каждом из 24 локусов.
Fig. 2. UPGMA dendrogram of MIRU-VNTR profiles of 163 M. tuberculosis strains from the Kemerovo Region.
Each line contains isolate data with an identified genotype in a yellow block indicating the number of isolates if identical profiles are detected; isolate identification number; MLVA type MtbC15-9; number of repeats at each of the 24 loci.
Результаты SNP-анализа и сопоставление с данными MIRU-VNTR-типирования
Штаммы Beijing были протестированы на наличие маркеров основных российских субтипов. Beijing Central Asian Russian выявлен в 39,9% (65/163) случаев общей выборки, Beijing B0/W148 — в 20,9% (34/163). Остальные 11 штаммов не имели SNP, специфических для вышеперечисленных субтипов. Beijing В0/W148, определяемый по наличию делеции в гене kdpD, состоял в большинстве случаев из штаммов 100-32 (85,3% — 29/34), а также разнообразной группы с профилями 100-387, 1048-499, 1075-32, 99-32, 9370-32. Субтип Central Asian Russian наиболее часто был представлен профилем 94-32 (76,9% 50/65), а также разнообразной группой индивидуальных профилей и 2 кластеризованных (1065-32 и 1068-32). Среди 52 non-Beijing-изолятов и 1 mix в тестировании на генотипы евро-американской линии были обнаружены представители LAM (6,7%; 11/163), Ural (7,4%; 12/163) и группа из 29 штаммов без специфических маркеров. В смешанном образце выявлен только маркер генотипа Ural.
Генотипы МБТ и их субтипы, классифицированные по MIRU-VNTR-24-профилям, полностью совпадали с результатами SNP-анализа (табл. 3). Beijing Central Asian Russian и Beijing B0/W148 включали изоляты с профилями, принадлежащими только к этим субтипам, согласно наиболее полному каталогу [16]. Группа «Beijing другие» не имела маркеров вышеперечисленных субтипов и характерных для них профилей.
Таблица 3. Сопоставление результатов MIRU-VNTR- и SNP-типирования
Table 3. Comparison of MIRU-VNTR results and SNP typing
Генотип, субтип (выявленные штаммы в SNP-анализе) Genotype, Subtype (strains identified in SNP analysis) | MIRU-VNTR-24-генотипирование | MIRU-VNTR 24 genotyping | |
число выявленных штаммов identified strains | MLVA MtbC15-9 тип* (n) MLVA MtbC15-9 type * (n) | |
Beijing Central Asian Russian (65) | 65 | 94-32 (50); 94-15 (1); 94-387 (1); 97-32 (1); 230-32 (1); 407-32 (1); 1065-32 (3); 1068-32 (3); 1718-32 (1); 7308-32 (1); 9125-32 (1); 9129-32 (1) |
Beijing B0/W148 (34) | 34 | 100-32 (29); 100-387 (1); 99-32 (1) 1048-439 (1); 1075-32 (1); 9370-32 (1) |
Beijing, другие other Beijing (11) | 11 | 1076-32 (1); 3365-15 (1); 5552-32 (1); 10520-32 (1); 10885-32 (1); 10513-32 (1);?-15 (2); ?-32 (3) |
LAM (11) | 11 | 121-496 (3); 1119-52 (1); 1270-52 (1); 8012-51 (1); 11567-52 (1); 15707-51 (1); ?-52 (2) |
Ural (12) | 12 | 163-15 (3); 13877-15 (1); ?-15 (7); ?-578 (1) |
S (0) | 0 | Отсутствовали | Absent |
non-Beijing другие (29) other non-Beijing | 29, в том числе | including Haarlem (8) | 89-15 (1); 290-15 (1); 3124-15 (1); 9110-15 (1); 13212-15 (1); ?-15 (18); ?-26 (1); ?-62 (1); ?-82 (1); ?-85 (1); ?-111 (1); ?-686 (1) |
Примечание. «?» — неклассифицированные по MLVA MtbC типы.
Note. «?» indicates the types unclassified by MLVA MtbC.
Изолятам с наличием маркеров LAM и Ural соответствовали профили этих же генотипов, охарактеризованных ранее [17, 18]. Ни один штамм из группы non-Beijing не имел профилей генотипа S [19] и его специфического маркера. У оставшихся 29 изолятов «non-Beijing другие» не было тестируемых замен, они относились к генотипу Haarlem и L4 unclassified по MIRU-VNTR-24.
Лекарственная устойчивость M. tuberculosis
Тестирование МБТ показало, что только 55 (34,6%) сохранили лекарственную чувствительность, в большей степени за счёт впервые выявленных случаев (40,0% против 15,4% ранее леченных). Остальные были устойчивы к препаратам 1-го ряда в различных комбинациях, таким как изониазид (59,1%), рифампицин (46,5%), стрептомицин (58,5%) и этамбутол (43,4%), и к препаратам 2-го ряда, включая этионамид (6,9%), офлоксацин (8,2%), канамицин (5,0%), капреомицин (3,1%), парааминосалициловую кислоту (1,9%). Учитывая недавние изменения в определениях широкой лекарственной устойчивости (ШЛУ) и пре-ШЛУ, структура лекарственно-устойчивых штаммов представлена в табл. 1 и табл. 4. МЛУ, определяемая как одновременная устойчивость к рифампицину и изониазиду, выявлена у 74 (46,5%) изолятов (в том числе у 46 из 84 штаммов, выделенных от ВИЧ-инфицированных пациентов), из них 13 — пре-ШЛУ (МЛУ с дополнительной устойчивостью к одному из фторхинолонов4). ШЛУ — МЛУ с резистентностью к любому фторхинолону и как минимум к одному дополнительному препарату 2-го ряда (бедаквилину и/или линезолиду) —не была выявлена ни в одном случае. В целом устойчивость к бедаквилину была определена у 3,1% (5/161) штаммов: 2 монорезистентных, 2 полирезистентных и 1 МЛУ-штамма. Присутствие фенотипической устойчивости к бедаквилину может быть связано с естественной резистентностью [21, 22], нельзя исключить и возможность технических ошибок. Ожидаемо, что в спектре лекарственной устойчивости M. tuberculosis от больных, ранее получавших ПТП, значимо чаще встречались случаи МЛУ (р = 0,004). Вместе с тем частоты выявления пре-ШЛУ-штаммов не имели значимых различий у пациентов с историей лечения и новых случаев ТБ (р = 0,283). Штаммы от ВИЧ-инфицированных с большей частотой показывали МЛУ-профиль (54,8%), чем МБТ от больных с ТБ без ВИЧ-инфекции (35,2%; р = 0,005).
Таблица 4. Лекарственная устойчивость штаммов M. tuberculosis от больных ТБ с различным ВИЧ-статусом
Table 4. Drug resistance of M. tuberculosis strains from TB patients with different HIV status
Показатели лекарственной устойчивости Drug resistance | ВИЧ-позитивные пациенты HIV positive patients (n = 84) | ВИЧ-негативные пациенты HIV negative patients (n = 71) | Общая выборка Total sample (n = 159) | |||
aбс. | abs. | % (ДИ | CI) | aбс. | abs. | % (ДИ | CI) | aбс. | abs. | % (ДИ | CI) | |
Чувствительные | Sensitive | 23 | 27,4 (18,9–37,8) | 31 | 43,7 (32,7–55,2) | 55 | 34,6 (27,6–42,3) |
Монорезистентные Monoresistant | 6 | 7,1 (3,0–15,1) | 5 | 7,0 (2,7–15,8) | 11 | 6,9 (3,8–12,1) |
Полирезистентные Polyresistant | 9 | 10,7 (5,5–19,3) | 10 | 14,1 (7,6–24,2) | 19 | 11,9 (7,7–18,0) |
МЛУ | MDR | 46 | 54,8 (44,1–65,0) | 25 | 35,2 (25,1–46,8) | 73 | 46,5 (38,4–53,7) |
из них, пре-ШЛУ of them pre-XDR | 9 | 10,7 (5,5–19,3) | 4 | 5,6 (1,8–14,0) | 13 | 8,2 (4,7–13,6) |
Примечание. Данные ВИЧ-статуса были доступны для 155 случаев; данные о лекарственной устойчивости — для 159.
Note. HIV status data were available for 155 cases; data on drug resistance — for 159.
Основные клинико-диагностические характеристики ТБ, вызванного различными генотипами и субтипами M. tuberculosis
Стратификация основных характеристик ТБ в соответствии с генотипом МБТ показала ряд закономерностей (табл. 5). Сходное распределение изолятов отмечается при различных клинических формах ТБ, которое отвечает общей генотипической структуре изучаемой выборки. Однако среди ранее леченных случаев ТБ частота генотипа Beijing выше, чем среди впервые выявленных (23/26 против 87/135; р = 0,029). Такое же значимое превышение обнаружено в случаях ТБ, вызванного Beijing B0/W148 (38,5% против 17,8%; р = 0,035) на фоне сравнимых уровней других субтипов Beijing (для Beijing Central Asian Russian: 38,5% против 40,7%; р = 0,828; Beijing другие: 11,5% против 5,9%; р = 0,539). ВИЧ-позитивные случаи ТБ чаще были вызваны штаммами генотипа Beijing (75,0% против 57,7%; р = 0,026), чем ТБ у ВИЧ-негативных больных, без значимой ассоциации с Beijing эпидемическими субтипами (для B0/W148: 26,2% против 14,1%; р = 0,063; для Beijing Central Asian Russian: 42,9% против 36,6%; р = 0,429).
Таблица 5. Клинические характеристики, вызванные разными генотипами
Table 5. Clinical characteristics depending on different genotypes
Клинические характеристики/генотипы Clinical characteristics/genotypes | n | Beijing B0/W148 (n = 32) | Beijing Central Asian Russian (n = 65) | Beijing, общее | total (n = 110) | Non-Beijing, общее | total (n = 52) | ||||
aбс. abs. | % (ДИ | CI) | aбс. abs. | % (ДИ | CI) | aбс. abs. | % (ДИ | CI) | aбс. abs. | % (ДИ | CI) | ||
Основные клинические формы ТБ лёгких: Major clinical forms of pulmonary TB: | |||||||||
инфильтративный | infiltrative | 62 | 12 | 19,4 (11,3–31,0) | 25 | 40,3 (29,0–52,8) | 42 | 67,7 (55,3–78,1) | 20 | 32,3 (21,9–44,7) |
диссеминированный | disseminate | 67 | 11 | 16,4 (9,3–27,2) | 29 | 43,3 (32,1–55,2) | 44 | 65,7 (53,7–75,9) | 22 | 32,8 (22,8–44,8) |
фиброзно-кавернозный | fibrous-cavernous | 8 | 2 | 25,0 (6,3–59,9) | 2 | 25,0 (6,3–59,9) | 4 | 50,0 (21,5–78,5) | 4 | 50,0 (21,5–78,5) |
КП | caseosis pneumonia | 11 | 2 | 18,2 (4,0–48,9) | 3 | 27,3 (9,2–57,1) | 6 | 54,5 (28,0–78,8) | 5 | 45,5 (21,3–72,0) |
Группа диспансерного учёта: Dispensary group: | |||||||||
впервые выявленные newly identified TB cases | 135 | 24 | 17,8 (12,2–25,2) | 55 | 40,7 (32,8–49,2) | 87 | 64,4 (56,1–72,0) | 47 | 34,8 (27,3–43,3) |
ранее леченные previously treated TB cases | 26 | 10 | 38,5 (22,4–57,5) | 10 | 38,5 (22,4–57,5) | 23 | 88,5 (70,2–96,8) | 5 | 19,2 (8,1–38,3) |
ВИЧ-статус: | HIV status: | |||||||||
позитивный | positive | 84 | 22 | 26,4 (16,9–35,6) | 36 | 42,9 (32,8–53,5) | 63 | 75,0 (64,7–83,1) | 20 | 23,8 (15,9–34,0) |
негативный | negative | 71 | 10 | 14,1 (7,6–24,2) | 26 | 36,6 (26,4–48,3) | 41 | 57,7 (46,1–68,6) | 30 | 42,3 (31,5–53,9) |
Примечание. % рассчитан на n штаммов в строке характеристики.
Note. % is calculated for n strains in the characteristic line.
Распределение генотипов с зависимости от статуса лекарственной устойчивости также имело свои особенности (табл. 6). Из 74 МЛУ-изолятов 68 принадлежали к Beijing-генотипу и 7 — к генетической евро-американской линии (L4), в том числе в смешанном образце. Уровень МЛУ среди генотипов Beijing (61,8%; 68/110) и non-Beijing (11,5%; 6/52) отличался (р < 0,001). Эпидемический субтип Beijing B0/W148 был в 85,3% случаев с МЛУ + преШЛУ, при этом изоляты с профилем 100-32 типа, как и остальные варианты В0/W148, имели близкие частоты (82,8 и 100% соответственно; р = 0,748). В штаммах субтипов Beijing Central Asian Russian МЛУ + пре-ШЛУ определена в 50,8% (33/65) случаев. Наиболее распространённый вариант этого субтипа — Beijing 94-32 типа — значимо чаще нёс МЛУ + пре-ШЛУ (62,0%), чем остальные его варианты (13,3%; р = 0,003). Изоляты non-Beijing были в основном лекарственно-чувствительными (59,6%; 31/52). Выявленные 6 случаев МЛУ среди non-Beijing включали представителей Haarlem, Ural и LAM. В разнообразной группе L4 unclassified присутствовали только чувствительные, моно- и полирезистентные штаммы.
Таблица 6. Генотипы и лекарственная устойчивость изолятов M. tuberculosis из Кемеровской области, % (ДИ)
Table 6. Genotypes and drug resistance of M. tuberculosis isolates from the Kemerovo Region, % (CI)
Генотип/субтип Genotype/Subtype | Чувствительные Sensitive | Монорезистентные Monoresistant | Полирезистентные Polyresistant | MЛУ MDR | Пре-ШЛУ Pre-XDR | Общая выборка General sample |
n | 58 | 11 | 19 | 60 | 13 | 163 |
Beijing общее Beijing total | 44,8 (32,8–57,6) | 36,4 (15,0–64,8) | 57,9 (36,2–76,9) | 91,7 (81,5–96,8) | 92,3 (64,6–100,0) | 67,5 (60,0–74,2) |
Beijing B0/W148* | 44,8 (0–10,3) | 9,1 (0–40,0) | 5,3 (0–26,5) | 40,0 (28,6–52,7) | 40,0 (28,6–52,7) | 20,9 (15,3–27,8) |
Beijing Central Asian Russian | 39,7 (28,1–52,5) | 18,2 (4,0–48,9) | 36,8 (19,1–59,1) | 43,3 (31,6–55,9) | 53,9 (29,1–76,8) | 39,9 (32,7–47,6) |
Beijing другие Beijing other | 3,5 (0,2–12,4) | 9,1 (0–40,0) | 15,8 (4,7–38,4) | 8,3 (3,2–18,5) | 0 | 6,8 (3,7–11,8) |
Non-Beijing общее Non-Beijing total | 53,5 (40,8–65,7) | 63,6 (35,2–85,0) | 42,1 (23,1–63,8) | 8,3 (3,2–18,5) | 7,7 (0–35,4) | 31,9 (25,2–39,4) |
LAM | 6,9 (2,2–16,9) | 27,3 (9,2–57,1) | 15,8 (4,7–38,4) | 0 | 7,7 (0–35,4) | 6,8 (3,7–11,8) |
Ural | 8,6 (3,3–19,1) | 9,1 (0–40,0) | 15,8 (4,7–38,4) | 5,0 (1,2–14,3) | 0 | 7,4 (4,2–12,5) |
Haarlem | 6,9 (2,2–16,9) | 9,1 (0–40,0) | 5,3 (0–26,5) | 3,3 (1,2–14,3) | 0 | 4,9 (2,4–9,5) |
L4 inclassified | 31,0 (20,6–43,9) | 18,2 (4,0–48,9) | 5,3 (0–26,5) | 0 | 0 | 12,9 (8,5–19,0) |
Mix (Beijing/Ural) | 1,8 (0–10,3) | 0 | 0 | 0 | 0 | 0,6 (0–3,7) |
Примечание. Чувствительные — лекарственная чувствительность сохранена ко всем ПТП; монорезистентные — к 1 ПТП; полирезистентные — к 2 и более ПТП, но не к рифампицину и изониазиду; МЛУ (не ШЛУ) — к рифампицину и изониазиду и другим ПТП, но не к фторхинолонам и бедаквилину и линезолиду. Beijing другие — изоляты генотипа Beijing, не имеющие маркеров B0/W148 и Central Asian Russian кластеров.
*Данные о лекарственной устойчивости доступны для 32 из 34 идентифицированных Beijing B0/W148.
Note. Sensitive — drug sensitivity is maintained to all anti-tuberculosis drugs; monoresistant — drug sensitivity to one anti-tuberculosis drug; polyresistant — drug sensitivity to 2 or more anti-tuberculosis drugs, but not to rifampicin and isoniazid; MDR (not XDR) — drug sensitivity to rifampicin and isoniazid and other anti-tuberculosis drug, but not to fluoroquinolones and bedaquiline and linezolid. Beijing, other — isolates of the Beijing genotype that do not have markers of B0/W148 and Central Asian Russian clusters.
*Drug resistance data are available for 32 of the 34 identified Beijing B0/W148 strains.
Обсуждение
В условиях ограниченных ресурсов наиболее перспективно направление приоритетного мониторинга штаммов МБТ высокого риска передачи в целевой популяции. Обязательным этапом такого динамического наблюдения является первичный скрининг циркулирующей популяции МБТ в конкретных условиях, что и было выполнено нами в настоящем исследовании на ранее малоизученной территории Кемеровской области. Совершенствование методологии мониторинга возбудителя ТБ путём комплексного использования классических методов типирования и легко воспроизводимых молекулярных тестов SNP-анализа обеспечивает преемственность результатов первичного и динамического наблюдения конкретных штаммов МБТ, ответственных за наиболее актуальные проблемы передачи возбудителя ТБ. Именно такой подход был реализован в настоящем исследовании, где, кроме развёрнутой схемы MIRU-VNTR-типирования, были применены уже ранее успешно используемые тесты на Beijing B0/W148 и Beijing Central Asian Russian [23–25] и апробированные впервые способы детекции генотипов S, LAM и Ural в формате ПЦР-РВ.
Результаты молекулярно-генетического скрининга популяции МБТ в Кемеровской области, показали, что, как и на многих территориях азиатской части России, преобладают штаммы генотипов Beijing (67,5%) и его эпидемически значимые кластеры Central Asian Russian (39,9%) и B0/W148 (20,9%) [3, 6, 7, 26]. Частоты обнаружения основных субтипов Beijing близки ранее опубликованным данным по Западной Сибири (Новосибирская, Томская и Омская области) [10, 20], однако значимо отличаются от представленных в недавнем исследовании [9], где доля Beijing составила 95% выборки, а доля B0/W148 превышала обнаруживаемые в Сибири частоты в 2 раза (46,4%). При этом количество включённых штаммов из Кемеровской области в этом исследовании не приведено и предполагать о каких-либо изменениях в динамике структуры пока не представляется возможным.
В настоящем исследовании группа non-Beijing также состояла из наиболее часто встречаемых генотипов LAM (6,7%), Ural (7,4%), Haarlem (4,9%) и L4-unclassified (12,9%). По частоте встречаемости LAM занимает 2-е место в большинстве азиатских регионов России (от 12,0 до 19,5%) [6–10]. Распространённость LAM в европейской части России и ряде стран бывшего СССР варьирует от 13,3% в Калининграде до 29,4% в Карелии [17]. Немаловажную роль среди non-Beijing-генотипов играет Ural, ранее считавшийся маловирулентным и лекарственно-чувствительным [18, 26], однако получившие недавно распространение новые его эпидемические кластеры с МЛУ [27] определяют актуальность его отслеживания в современной популяции МБТ. Штаммы Haarlem, обнаруженные в 4,9% случаев в сибирских регионах, являются минорными и по отношению к другим представителям евро-американской линии и часто являются лекарственно-чувствительными, в то время как в Южной Америке этот генотип сопровождает МЛУ в половине случаев (43,6%) [28]. Изоляты генотипа S не встречались в изучаемой выборке, что может быть естественным в ограниченных условиях проведения скрининга и при незначительной циркуляции этого генотипа в Сибири и на Дальнем Востоке (2–7% случаев), за исключением его эндемичного распространения в Республике Саха (Якутии) [6, 10, 25, 26, 29].
Кемеровская область — Кузбасс имеет один из самых высоких уровней первичной МЛУ (35,0%) в Сибирском федеральном округе после Республики Тывы и Новосибирской области [30]. Поэтому важным результатом этого исследования является обнаружение факта, что стабильно высокий уровень МЛУ в популяционной структуре (46,5%) обеспечивается преимущественно штаммами генотипа Beijijng (61,8%). Его эпидемический субтип — Beijing B0/W148 — был в 85,3% случаев с МЛУ и представлял пятую часть проанализированной нами выборки (20,9%). При этом штаммы Beijing B0/W148 с разными профилями MIRU-VNTR имели МЛУ со сходной частотой. Предыдущие исследования в Западной Сибири показали, что генотип Beijing также чаще встречался в образцах МЛУ-ТБ (71%) по сравнению с общими данными по ТБ (47%) [7, 10]. Сохранение стабильно высокого уровня МЛУ у гетерогенной группы Beijing B0/W148 также показано на других территориях, в частности в Восточной Сибири [6].
Напротив, в неоднородной группе Central Asian Russian кластера общий показатель МЛУ был ниже, чем у B0/W148 (50,8 и 85,3% соответственно), но штаммы одного профиля — 94-32 — имели значимо бóльшую долю МЛУ (62,0%) по сравнению с остальными профилями (13,3%). Это может быть связано с присутствием среди группы 94-32 штаммов Central Asia Outbreak, которые характеризуются тем же профилем, но несут значимо чаще МЛУ [31]. Учитывая близость к Кемеровской области Казахстана, где наблюдается градиент распространённости Central Asia Outbreak в Центральной Азии, а также обнаружение штаммов этого субтипа в соседних областях (Новосибирской, Томской), высока вероятность связи МЛУ именно с этим вариантом возбудителя ТБ. Однако на данном этапе скрининга выявленный факт только нацеливает на более углублённое исследование Central Asian Russian кластера в дальнейшем мониторинге Кемеровской области.
Высокий уровень коинфекции ВИЧ-ТБ в Кемеровской области [30] нашёл отражение в скрининговой выборке. Более половины образцов составили штаммы МБТ, полученные от больных ВИЧ-ТБ (56,4%). При этом ВИЧ-позитивные случаи ТБ чаще были вызваны штаммами генотипа Beijing (75,0% против 57,7%) и МЛУ (54,8% против 35,2%), чем ТБ у ВИЧ-негативных больных, без значимой ассоциации с Beijing эпидемическими кластерами. По данным других российских исследователей азиатской части России, ассоциация сочетанной ВИЧ-ТБ-инфекции с МЛУ является устойчивой, однако связь с отдельными генотипами и субтипами Beijing носит неоднозначный характер [10, 32, 33]. Для выяснения роли основных кластеров в развитии сочетанной ВИЧ-ТБ-инфекции на территории Кемеровской области необходимы динамические и более масштабные исследования репрезентативной выборки этой группы пациентов.
Результаты использования в настоящем исследовании комплексного подхода молекулярного анализа циркулирующих в Кемеровской области МБТ также показали, что расширенное генотипирование MIRU-VNTR-24 с набором разработанных нами ПЦР-РВ-тестов имеет полную идентификационную совместимость. Такой набор следует дополнить тестами на ещё один значимый кластер генотипа Beijing — Central Asia Outbreak — и ряд минорных генотипов евро-американской линии (Haarlem, T) и эндемичных субтипов генотипа Beijing (в частности, 1071-32 и 14717-15), чтобы охватить более 95% популяции МБТ, характерной для азиатских территорий России. В представленном наборе тесты могут быть уже рекомендованы для быстрого скрининга ретроспективных коллекций и для проспективного мониторинга штаммов МБТ.
Ограничения исследования. Настоящее исследование было ограничено выборкой штаммов МБТ, выявленных у больных, получавших преимущественно стационарное лечение в противотуберкулёзных диспансерах Кемеровской области, что отразилось в более высокой доле лекарственно-устойчивых изолятов МБТ по сравнению с популяционными исследованиями. Кроме того, мы не смогли использовать типирование MIRU-VNTR по 24 локусам для определения генотипа 21 изолятов, отнесённых к non-Beijing и сгруппированных в группу L4 unclassified.
Заключение
Выявлено доминирование изолятов группы Beijing (67,5%) и его эпидемических кластеров Beijing Central Asian Russian и В0/W148 (39,9 и 20,9% соответственно), которые значимо отличались по уровням МЛУ (50,8 и 85,3% соответственно; р = 0,005). Вторыми по распространённости были штаммы евро-американской линии (31,9%): LAM (6,7%), Ural (7,4%), Haarlem (4,9%) и L4-unclassified (12,9%). МЛУ среди этих минорных генотипов была значительно ниже, чем среди Beijing, и составляла 11,5% (р < 0.001) Штаммы от больных ВИЧ-ТБ (56,4% общей выборки) несли чаще МЛУ-профиль (54,8%), чем в случаях ТБ без ВИЧ-инфекции (35,2%; р = 0,005), что может быть связано с более высокими уровнями Beijing в группе больных ВИЧ-ТБ (75,0% против 57,7%; р = 0,026). Показана полная сопоставимость разработанных нами тестов SNP-анализа для выявления основных генотипов и эпидемически значимых субтипов Beijing, позволивших охарактеризовать 75,5% выборки экспресс-методом.
Использование 24-локусного VNTR-типирования и экспресс-методов позволило определить структуру различных генетических линий МБТ, включая доминирующий Beijing и его эпидемически значимые субтипы Central Asian Russian и B0/W148, генотипы LAM, Ural и Haarlem, распространённость которых в основном совпадает с другими регионами Западной и Восточной Сибири. Особенностью популяции МБТ на территории Кемеровской области является значительное распространение штаммов генотипа Beijing, обладающих МЛУ.
1 URL: http://www.miru-vntrplus.org/MIRU/miruinfo.faces;jsessionid=89112F274226E781C7B0B0D9118FDD70
2 URL: http://www.miru-vntrplus.org
3 Eurasian Patent № 032489. Oligonucleotide primers, fluorescent DNA probes and a method for detecting Mycobacterium tuberculosis clonal complex 2 — W148 of the Beijing genotype in clinical samples. 02.05.2023 URL: https://www.eapo.org/en/publications/publicat/viewpubl.php?id=032489
4 WHO. World Health Organization (2021). Meeting report of the WHO expert consultation on the definition of extensively drug-resistant tuberculosis, 27–29 October 2020. World Health Organization. 02.05.2023.
URL: https://apps.who.int/iris/handle/10665/338776
About the authors
Irina B. Lebedeva
Kemerovo State Medical University
Author for correspondence.
Email: lib_2008@mail.ru
ORCID iD: 0000-0002-3848-9206
SPIN-code: 1078-8337
postgraduate Student, Department of epidemiology, infectious diseases and dermatovenerology
Russian Federation, KemerovoSvetlana N. Zhdanova
Scientific Centre for Family Health and Human Reproduction Problems
Email: svetnii@mail.ru
ORCID iD: 0000-0001-7160-9700
SPIN-code: 6709-1505
D. Sci. (Med.), leading researcher, Department of epidemiology and microbiology
Russian Federation, IrkutskIlya G. Kondratov
Scientific Centre for Family Health and Human Reproduction Problems
Email: kondratovig@mail.ru
ORCID iD: 0000-0002-2631-4724
SPIN-code: 7993-1638
Cand. Sci. (Biol.), researcher, Department of epidemiology and microbiology
Russian Federation, IrkutskCyril V. Sibil
Kuzbass Clinical Phthisiopulmonological Medical Center named after I.F. Kopylova
Email: sibilkirill77@gmail.com
ORCID iD: 0009-0003-1993-3249
SPIN-code: 4641-9008
Cand. Sci. (Med.), Сhief doctor
Russian Federation, KemerovoOleg B. Ogarkov
Scientific Centre for Family Health and Human Reproduction Problems
Email: obogarkovi@mail.ru
ORCID iD: 0000-0002-3168-1983
SPIN-code: 1956-2888
Scopus Author ID: 6603264302
D. Sci. (Med.), Head, Department of epidemiology and microbiology
Russian Federation, IrkutskElena B. Brusina
Kemerovo State Medical University
Email: brusina@mail.ru
ORCID iD: 0000-0002-8616-3227
SPIN-code: 6976-2551
Scopus Author ID: 6508353714
D. Sci. (Med.), Professor, Head, Department of epidemiology, infectious diseases and dermatovenerology
Russian Federation, KemerovoReferences
- Васильева И.А., Тестов В.В., Стерликов С.А. Эпидемическая ситуация по туберкулезу в годы пандемии COVID-19 — 2020–2021 гг. Туберкулёз и болезни лёгких. 2022;100(3):6–12. Vasilyeva I.A., Testov V.V., Sterlikov S.A. Tuberculosis situation in the years of the COVID-19 pandemic – 2020–2021. Tuberculosis and Lung Diseases. 2022;100(3):6–12. DOI: https://doi.org/10.21292/2075-1230-2022-100-3-6-12 EDN: https://elibrary.ru/dpmdcf
- Ревякина О.В., Филиппова О.П., Фелькер И.Г. и др. Туберкулез в Сибирском и Дальневосточном федеральных округах: информационно-аналитический обзор. Новосибирск;2020. Revyakina O.V., Filippova O.P., Felker I.G., et al. Tuberculosis in the Siberian and Far Eastern federal Districts: Information and Analytical Review. Novosibirsk;2020. DOI: https://doi.org/10.13140/RG.2.2.36433.56169 EDN: https://elibrary.ru/cfgihh
- Mokrousov I., Narvskaya O., Vyazovaya A., et al. Russian ‘successful’ clone B0/W148 of Mycobacterium tuberculosis Beijing genotype: multiplex PCR assay for rapid detection and global screening. J. Clin. Microbiol. 2012;50(11):3757–9. DOI: https://doi.org/10.1128/JCM.02001-12
- Mokrousov I., Chernyaeva E., Vyazovaya A., et al. Rapid assay for detection of the epidemiologically important central Asian/Russian strain of the Mycobacterium tuberculosis Beijing genotype. J. Clin. Microbiol. 2018;56(2):e01551-17. DOI: https://doi.org/10.1128/JCM.01551-17
- Mokrousov I. Insights into the origin, emergence, and current spread of a successful Russian clone of Mycobacterium tuberculosis. Clin. Microbiol. Rev. 2013;26(2):342–60. DOI: https://doi.org/10.1128/CMR.00087-12
- Zhdanova S., Mokrousov I., Orlova E., et al. Transborder molecular analysis of drug-resistant tuberculosis in Mongolia and Eastern Siberia, Russia. Transbound. Emerg. Dis. 2022;69(5):e1800–14. DOI: https://doi.org/10.1111/tbed.14515
- Dymova M.A., Cherednichenko A.G., Alkhovik O.I., et al. Characterization of extensively drug-resistant Mycobacterium tuberculosis isolates circulating in Siberia. BMC Infect. Dis. 2014;14:478. DOI: https://doi.org/10.1186/1471-2334-14-478
- Umpeleva T., Belousova K., Golubeva L., et al. Molecular characteristics of Mycobacterium tuberculosis in the "closed" Russian town with limited population migration. Infect. Genet. Evol. 2020;79:104174. DOI: https://doi.org/10.1016/j.meegid.2020.104174
- Vyazovaya A., Felker I., Schwartz Y., Mokrousov I. Population structure of Mycobacterium tuberculosis from referral clinics in Western Siberia, Russia: Before and during the COVID-19 pandemic. Infect. Genet. Evol. 2022;103:105343. DOI: https://doi.org/10.1016/j.meegid.2022.105343
- Dymova M.A., Kinsht V.N., Cherednichenko A.G., et al. Highest prevalence of the Mycobacterium tuberculosis Beijing genotype isolates in patients newly diagnosed with tuberculosis in the Novosibirsk oblast, Russian Federation. J. Med. Microbiol. 2011;60(Pt. 7):1003–9. DOI: https://doi.org/10.1099/jmm.0.027995-0
- Reed M.B., Pichler V.K., McIntosh F., et al. Major Mycobacterium tuberculosis lineages associate with patient country of origin. J. Clin. Microbiol. 2009;47(4):1119–28. DOI: https://doi.org/10.1128/JCM.02142-08
- Shitikov E., Kolchenko S., Mokrousov I., et al. Evolutionary pathway analysis and unified classification of East Asian lineage of Mycobacterium tuberculosis. Sci. Rep. 2017;7(1):9227. DOI: https://doi.org/10.1038/s41598-017-10018-5
- Homolka S., Projahn M., Feuerriegel S., et al. High resolution discrimination of clinical Mycobacterium tuberculosis complex strains based on single nucleotide polymorphisms. PLoS One. 2012;7(7):e39855. DOI: https://doi.org/10.1371/journal.pone.0039855
- Mulholland C.V., Shockey A.C., Aung H.L., et al. Dispersal of Mycobacterium tuberculosis driven by historical european trade in the South Pacific. Front. Microbiol. 2019;10:2778. DOI: https://doi.org/10.3389/fmicb.2019.02778
- Mokrousov I., Vyazovaya A., Narvskaya O. Mycobacterium tuberculosis Latin American-Mediterranean family and its sublineages in the light of robust evolutionary markers. J. Bacteriol. 2014;196(10):1833–41. DOI: https://doi.org/10.1128/jb.01485-13
- Merker M., Blin C., Mona S., et al. Evolutionary history and global spread of the Mycobacterium tuberculosis Beijing lineage. Nat. Genet. 2015;47(3):242–9. DOI: https://doi.org/10.1038/ng.3195
- Mokrousov I., Vyazovaya A., Iwamoto T., et al. Latin-American-Mediterranean lineage of Mycobacterium tuberculosis: Human traces across pathogen's phylogeography. Mol. Phylogenet. Evol. 2016;99:133–43. DOI: https://doi.org/10.1016/j.ympev.2016.03.020
- Mokrousov I. Mycobacterium tuberculosis phylogeography in the context of human migration and pathogen's pathobiology: Insights from Beijing and Ural families. Tuberculosis (Edinb.). 2015;95(Suppl. 1):S167–76. DOI: https://doi.org/10.1016/j.tube.2015.02.031
- Жданова С.Н., Огарков О.Б., Алексеева Г.И. и др. Генетическое разнообразие изолятов микобактерий туберкулеза из Республики Саха (Якутия), Россия. Молекулярная генетика, микробиология и вирусология. 2016;34(2):43–8. DOI: https://doi.org/10.18821/0208-0613-2016-34-2-43-48 EDN: https://elibrary.ru/vzydoh. Zhdanova S.N., Ogarkov O.B., Sinkov V.V., et al. Genetic diversity of Mycobacterium tuberculosis isolates in the republic of Sakha (Yakutia), Russia. Molecular Genetics, Microbiology and Virology. 2016;31(2):51–7. DOI: https://doi.org/10.3103/S0891416816020105 EDN: https://elibrary.ru/xfjfst
- Mokrousov I. Ubiquitous and multifaceted: SIT53 spoligotype does not correlate with any particular family of Mycobacterium tuberculosis. Tuberculosis (Edinb.). 2021;126:102024. DOI: https://doi.org/10.1016/j.tube.2020.102024
- Villellas C., Coeck N., Meehan C.J., et al. Unexpected high prevalence of resistance-associated Rv0678 variants in MDR-TB patients without documented prior use of clofazimine or bedaquiline. J. Antimicrob. Chemother. 2017;72(3):684–90. DOI: https://doi.org/10.1093/jac/dkw502
- Peretokina I.V., Krylova L.Y., Antonova O.V., et al. Reduced susceptibility and resistance to bedaquiline in clinical M. tuberculosis isolates. J. Infect. 2020;80(5):527–35. DOI: https://doi.org/10.1016/j.jinf.2020.01.007
- Хромова П.А., Огарков О.Б., Жданова С.Н. и др. Выявление высокотрансмиссивных генотипов возбудителя в клиническом материале для прогноза неблагоприятного течения туберкулёза. Клиническая лабораторная диагностика. 2017;62(10):622–7. Khromova P.A., Ogarkov O.B., Zhdanova S.N., et al. The detection of highly-transmissible genotypes of agent in clinical samples for prognosis of unfavorable course of tuberculosis. Russian Clinical Laboratory Diagnostics. 2017;62(10):622–7. DOI: https://doi.org/10.18821/0869-2084-2017-62-10-622-627 EDN: https://elibrary.ru/zoladv
- Жданова С.Н., Огарков О.Б., Савилов Е.Д., Кондратов И.Г. Применение молекулярно-генетических инструментов для оценки трансграничной передачи туберкулеза в Иркутской области. Эпидемиология и вакцинопрофилактика. 2022; 21(2):59–65. Zhdanova S.N., Ogarkov O.B., Savilov E.D., Kondratov I.G. Application of new molecular genetic strategies for transborder transmission analysis of tuberculosis in Irkutsk region. Epidemiology and Vaccinal Prevention. 2022;21(2):59–65. DOI: https://doi.org/10.31631/2073-3046-2022-21-2-59-65 EDN: https://elibrary.ru/ymgdfc
- Pasechnik O., Dymova M.A., Stasenko V.L., et al. Molecular & genetic characteristics of Mycobacterium tuberculosis strains circulating in the southern part of West Siberia. Indian J. Med. Res. 2017;146(1):49–55. DOI: https://doi.org/10.4103/ijmr.IJMR_162_16
- Умпелева Т.В., Кравченко М.А., Еремеева Н.И. и др. Молекулярно-генетическая характеристика штаммов Мycobacterium tuberculosis, циркулирующих на территории уральского региона России. Инфекция и иммунитет. 2013;3(1):21–8. Umpeleva T.V., Kravchenko M.A., Eremeeva N.I., et al. Molecular characterization of Mycobacterium tuberculosis strains circulating in the Ural region, Russia. Russian Journal of Infection and Immunity. 2013;3(1):21–8. DOI: https://doi.org/10.15789/2220-7619-2013-1-21-28 EDN: https://elibrary.ru/qcubwd
- Sinkov V., Ogarkov O., Mokrousov I., et al. New epidemic cluster of pre-extensively drug resistant isolates of Mycobacterium tuberculosis Ural family emerging in Eastern Europe. BMC Genomics. 2018;19(1):762. DOI: https://doi.org/10.1186/s12864-018-5162-3
- Tarashi S., Fateh A., Jamnani F.R., et al. Prevalence of Beijing and Haarlem genotypes among multidrug-resistant Mycobacterium tuberculosis in Iran: systematic review and meta-analysis. Tuberculosis (Edinb.). 2017;107:31–7. DOI: https://doi.org/10.1016/j.tube.2017.03.005
- Zhdanova S., Heysell S.K., Ogarkov O., et al. Primary multidrug-resistant Mycobacterium tuberculosis in 2 regions, Eastern Siberia, Russian Federation. Emerg. Infect. Dis. 2013;19(10):1649–52. DOI: https://doi.org/10.3201/eid1910.121108
- Лебедева И.Б., Осинцева И.Ю., Бондаренко Т.Е. и др. COVID-19 в популяции больных туберкулёзом: эпидемиологическая и клиническая характеристика. Фундаментальная и клиническая медицина. 2021;6(3): 71–84. Lebedeva I.B., Osintseva I.Yu., Bondarenko T.E., et al. COVID-19 in patients with tuberculosis: epidemiological and clinical features. Fundamental and Clinical Medicine. 2021;6(3):71–84. DOI: https://doi.org/10.23946/2500-0764-2021-6-3-71-84 EDN: https://elibrary.ru/twfkna
- Филиппова О.П., Павленок И.В., Гордеева Е.И. и др. Основные показатели противотуберкулёзной деятельности в Сибирском и Дальневосточном федеральных округах: статистические материалы. Новосибирск;2021. Filippova O.P., Pavlenok I.V., Gordeeva E.I., et al. The main indicators of anti-tuberculosis activity in the Siberian and Far Eastern Federal Districts: statistical Materials. Novosibirsk;2021. EDN: https://elibrary.ru/fsxdks
- Микова О.Е., Жданова С.Н., Сергевнин В.И. и др. Высокая распространённость генотипа B0/W148 Mycobacterium tuberculosis у больных ВИЧ-инфекцией, сочетанной с туберкулёзом, в Пермском крае и Иркутской области. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской Академии медицинских наук. 2016;1(5):142–5. Mikova O.E., Zhdanova S.N., Sergevnin V.I., et al. High prevalence of genotype B0/W148 of Mycobacterium tuberculosis among HIV-TB patients in Perm Krai and Irkutsk region. Bulletin of the East Siberian Scientific Center of the Siberian Branch of the Russian Academy of Medical Sciences. 2016;1(5):142–5. DOI: https://doi.org/10.12737/23412 EDN: https://elibrary.ru/wxbrvf
- Вязовая А.А., Пасечник О.А., Герасимова А.А., Мокроусов И.В. Структура популяции генетического семейства Beijing Mycobacterium tuberculosis на территории Западной Сибири. Туберкулез и болезни легких. 2020;98(5):32–6. Vyazovaya A.A., Pasechnik O.A., Gerasimova A.A., Mokrousov I.V. The population structure of Beijing family of Mycobacterium tuberculosis in Western Siberia. Tuberculosis and Lung Diseases. 2020;98(5):32–6. DOI: https://doi.org/10.21292/2075-1230-2020-98-5-32-36 EDN: https://elibrary.ru/mmedwz
Supplementary files