Influence of povidone-yodine on the sensitivity of clinical isolates of Klebsiella pneumoniae to antibiotics
- Authors: Tsyrkunova Z.F.1, Emelyanova A.A.1, Gudkova E.I.1, Skorokhod G.A.1
-
Affiliations:
- Belarusian State Medical University
- Issue: Vol 100, No 2 (2023)
- Pages: 209-218
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/1324
- DOI: https://doi.org/10.36233/0372-9311-350
- EDN: https://elibrary.ru/qdaaci
- ID: 1324
Cite item
Full Text
Abstract
Introduction. Cross-resistance of microorganisms to antibiotics against the background of the use of biocides in subinhibitory concentrations is an urgent problem of modern health care.
The aim of the work is to study the effect of povidone-iodine on the sensitivity of clinical isolates of Klebsiella pneumoniae to antibiotics.
Materials and methods. The work analyzed the effect of povidone-iodine at subinhibitory concentrations on changes in the sensitivity of clinical isolates of K. pneumoniae (n = 9) to antibacterial agents (n = 15). Adaptation of bacteria to povidone-iodine was carried out using periodic cultivation of microorganisms, which was carried out in 96-well culture plates for suspension cultures (non-treated) without stirring. The sensitivity of bacteria to antibiotics was assessed using an automatic analyzer “Vitek2Compact” (“BioMerieux”) using AST-204 charts.
Results. During the adaptation of clinical isolates of K. pneumoniae to povidone-iodine, an increase in the sensitivity of bacteria to antibiotics was shown. The minimum inhibitory concentrations (MIC) of 11 antibacterial agents in relation to the studied cultures decreased by an average of 2.35–23.2 times compared with the control values. Under the experimental conditions, the sensitivity of the studied cultures increased to amoxicillin/clavulanic acid by ≥ 2 – ≥ 8 times, piperacillin/tazobactam — by ≥ 2 – ≥ 32 times, ceftazidime — by 4 – ≥ 16 times, ami-kacin — 2 – ≥ 16 times, ertapenem — 2.0–8.0 times, meropinem — 2–8 times, cefepim — ≥ 4 – ≥ 64 times, ciprofloxacin — 4 – ≥ 16 times, gentamicin — 2 – ≥ 8 times, norfloxacin — 2–8 times, nitrofurantoin — 2–4 times. An increase in the level of sensitivity to antibiotics was found in 50–100% of the studied clinical bacterial isolates. A similar effect has not been established for ampicillin, cefotaxime, imipenem, and trimethoprim/sulfamethoxazole. It should be noted that under the conditions of the experiment, intraspecific heterogeneity of clinical isolates of K. pneumoniae was revealed in terms of the level of acquired sensitivity to antibacterial agents.
Discussion. Our results are not described in the scientific literature and require further study and explanation.
Keywords
Full Text
Введение
В последние десятилетия отмечается значительный рост заболеваний, вызываемых условно-патогенными микроорганизмами, в том числе Klebsiella pneumoniae. Внутрибольничные инфекции, вызванные K. pneumoniae и другими грамотрицательными микроорганизмами, стали серьёзной проблемой для здоровья человека, особенно в отделениях реанимации и интенсивной терапии [1–3]. Описанные в научной литературе вспышки внутрибольничных инфекций были вызваны зачастую микроорганизмами, обладающими множественной устойчивостью к антимикробным средствам [4–6]. Ежегодно инфекции, вызванные резистентными бактериями, приводят к 68 000 смертей в странах европейской экономической зоны и США вместе взятых [7] и наносят экономический ущерб в размере 55 млрд евро в США и 1,6 млрд евро в странах европейской экономической зоны [6, 8].
Уменьшение частоты возникновения и развития внутрибольничных инфекций напрямую связано с эффективностью проводимых профилактических мероприятий. Однако активное и зачастую бесконтрольное применение антисептических и дезинфицирующих средств может привести к развитию устойчивости микроорганизмов как к ним самим, так и к антибиотикам [9–11]. Обзор научной литературы, посвящённой влиянию 13 биоцидных агентов в сублетальных концентрациях на развитие устойчивости к антибиотикам у грамотрицательных бактерий, продемонстрировал наличие перекрёстной устойчивости после воздействия на микроорганизмы хлоргексидина, бензалкония хлорида, триклозана, октенидина, гипохлорита натрия, хлорида дидецилдиметиламмония [12]. В 11 исследованиях, проведённых в разных странах в 2007–2017 гг., показано снижение чувствительности грамотрицательных бактерий к различным антибиотикам после воздействия на них бензалкония хлорида — увеличение минимальных ингибирующих концентраций (МИК) антибиотиков. Приобретённая резистентность чаще всего обнаруживалась к ампициллину, цефотаксиму и сульфаметоксазолу, реже — к цефтазидиму, триметоприм/сульфаметоксазолу, триметоприму, тетрациклину, имипенему, хлорамфениколу, амоксициллину и амоксициллин/клавулановой кислоте [12]. Ряд исследований демонстрируют корреляцию между приобретённой толерантностью к хлоргексидину и устойчивостью бактерий к цефтазидиму, сульфаметоксазолу, имипенему, цефотаксиму, карбапенему, аминогликозиду, тетрациклину и ципрофлоксацину [12]. Имеются данные, что воздействие субингибирующих концентраций хлоргексидина на клинические изоляты K. pneumoniae приводит к развитию устойчивости бактерий как к хлоргексидину, так и к колистину [13], который относится к группе полимиксинов и является антибиотиком группы резерва.
Особое место среди антимикробных веществ занимает широко используемый антисептик повидон-йод, который обычно применяется в клинической практике для обработки кожи и слизистых оболочек до и после операций, обработки кожи перед инъекциями, взятием крови, пункцией, биопсией, трансфузией, инфузией и другими инвазивными манипуляциями. Многочисленные исследования показали, что он обладает более широким спектром антимикробного действия, чем многие доступные антисептики, включая хлоргексидин и четвертичные аммониевые соединения [14, 15].
Подавляющее большинство исследований показывают, что развитие адаптивной и/или перекрёстной устойчивости микроорганизмов к антибиотикам не наблюдается после воздействия на них сублетальных концентраций повидон-йода [12, 14–18]. Однако есть единичные данные о снижении чувствительности бактерий в результате воздействия на них данного биоцида. Так, B. Merchel Piovesan Pereira и соавт. выделили клоны Escherichia coli с повышенной устойчивостью к повидон-йоду, которые были также менее чувствительны к ампициллину, хлорамфениколу и норфлоксацину [19]. Воздействие субингибирующих концентраций повидон-йода на Staphylococcus aureus ATCC 25923 в течение 10 последовательных пассажей приводило к двукратному увеличению МИК — с 5000 мкг/мл в отношении исходного штамма до 10 000 мкг/мл для адаптированного, однако после последовательного пассированиия адаптированного варианта на среде без биоцида значение МИК возвращалось к исходному значению [20].
Учитывая, что повидон-йод продолжает активно использоваться в клинической практике и быту, представляются интересными и актуальными исследования влияния низких концентраций (не приводящих к гибели бактериальных клеток) данного антисептика на микроорганизмы и их чувствительность к антибиотикам.
Цель работы — изучить влияние повидон-йода на чувствительность клинических изолятов K. pneumoniae к антибиотикам.
Материалы и методы
Объектами исследования явились клинические изоляты K. pneumoniae (n = 9) выделенные в 2021 г. от пациентов, находящихся на стационарном лечении в отделениях различного профиля г. Минска. Клинические изоляты были выделены из образцов крови; мочи; мокроты или лаважной жидкости; мазков или соскобов из полости рта, зева, глотки, уха, ануса; отделяемого из дренажей и ран при количественном посеве на питательные среды. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Этическим комитетом Белорусского государственного медицинского университета (протокол (протокол № 15 от 27.06.2019).
В качестве типовой тест-культуры использовали K. pneumoniae АТСС 700603. Бактерии культивировали на питательных средах: триптиказо-соевом бульоне («HiMedia», Индия), триптиказо-соевом агаре («HiMedia») при 35 ± 2оС.
Чувствительность бактерий к антибиотикам оценивали с помощью автоматического анализатора «Vitek2Compact» («BioMerieux») и карт AST-204.
Устойчивость клинических изолятов бактерий к повидон-йоду определяли методом серийных разведений в плотной питательной среде (агаре) и методом серийных микроразведений в жидкой питательной среде (бульоне), используя двукратное разведение каждого антибактериального вещества. Значения МИК, определённые методом серийных микроразведений в бульоне, были использованы для расчёта субингибирующих концентраций биоцида в жидкой питательной среде, на которой велась адаптация микроорганизмов. Более быстрый и менее трудоёмкий метод, а именно метод разведений в агаре, применяли для анализа динамики изменения уровней чувствительности бактерий в процессе их адаптации к биоцидам. В исследованиях использовали 10% раствор повидон-йода с концентрацией активного йода 1% (коммерческое название «Бетадин» («EGIS Pharmaceuticals PLC»). МИК выражали в % по повидон-йоду.
Влияние повидон-йода на изменение чувствительности K. pneumoniae к антибиотикам изучали в процессе адаптаций бактерий к субингибирующим концентрациям биоцида в условиях постоянного повышения его концентрации в питательной среде. Адаптацию проводили с использованием периодического культивирования микроорганизмов, которое осуществляли в 96-луночных культуральных планшетах для суспензионных культур (non-treated) без перемешивания. Концентрацию повидон-йода в питательной среде увеличивали постепенно, раз в неделю увеличивая количество биоцида, тем самым адаптируя бактерии к повышающейся концентрации антимикробного вещества. Начальная концентрация повидон-йода, с которой началась адаптация, — 1/16 МИК (определённая методом серийных микроразведений в бульоне), конечная концентрация — 1/2 МИК (определённая методом серийных микроразведений в бульоне).
Контрольные значения МИК антибиотиков определяли для клинических изолятов бактерий, подвергшихся многократному перепассированию на питательной среде, параллельно с опытными культурами, но без добавления повидон-йода в питательную среду (МИК1), опытные значения МИК антибиотиков определяли для бактерий после их адаптации к повидон-йоду (МИК2). Степень изменения чувствительности бактерий к антибиотикам оценивали по соотношению МИК1/МИК2. Если это соотношение было больше 1,0, делали вывод, что чувствительность бактерий к антибиотикам возросла, если меньше 1,0 — снизилась.
Перед определением чувствительности бактерий к антибиотикам каждую опытную и контрольную культуры K. pneumoniae пересевали на триптиказо-соевый агар без биоцида, отбирали по несколько морфологически схожих колоний чистой 18–24-часовой культуры бактерий, суспендировали их в стерильном изотоническом растворе и доводили оптическую плотность инокулюма до 0,50–0,63 по МакФарланду с использованием денситометра «Vitek2Compact» («BioMerieux»).
Ввод, статистическую обработку и анализ данных производили с помощью компьютерных программ «MS Excel v. 7.0» («Microsoft») и «Statistica v. 6.0» («StatSoft»).
Результаты
Полученные результаты по влиянию повидон-йода на изменение чувствительности 9 клинических изолятов и 1 типовой культуры K. pneumoniae представлены на рис. 1–4. При построении рисунков мы не учитывали знаки «≥» и «≤». Полные значения МИК антибиотиков представлены в табличных данных к рисункам.
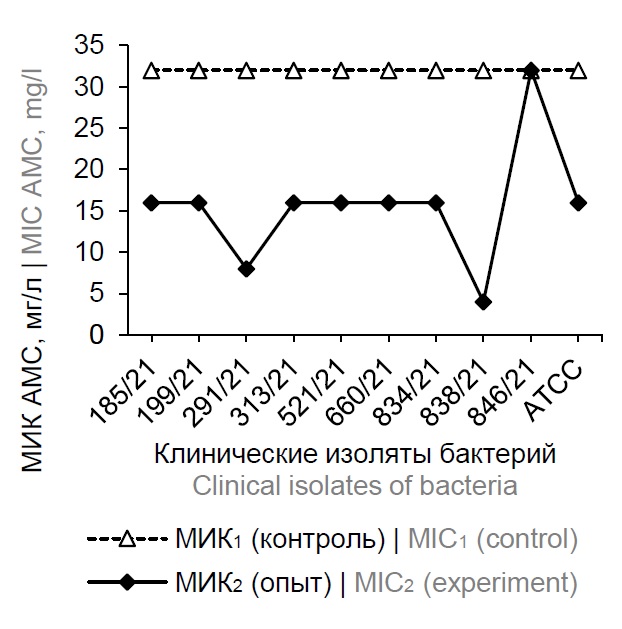
Рис. 1. Влияние повидон-йода на чувствительность клинических изолятов K. pneumoniae к амоксициллин/клавулановой кислоте (AMC), пиперациллину/тазобактаму (TZP) и цефтазидиму (CAZ).
Fig. 1. The effect of povidone-iodine on the sensitivity of clinical isolates K. pneumoniae to amoxicillin/clavulanic acid (AMC), piperacillin/tazobactam (TZP), and ceftazidime (CAZ).
Рис. 2. Влияние повидон-йода на чувствительность клинических изолятов K. pneumoniae к цефепиму (FEP), ципрофлоксацину (CIP) и гентамицину (GM).
Fig. 2. The effect of povidone-iodine on the sensitivity of clinical isolates K. pneumoniae to cefepime (FEP), ciprofloxacin (CIP), and gentamicin (GM).
Рис. 3. Влияние повидон-йода на чувствительность клинических изолятов K. pneumoniae к амикацину (AN), эртапенему (ETP) и меропенему (MEM).
Fig. 3. The effect of povidone-iodine on the sensitivity of clinical isolates K. pneumoniae to amikacin (AN), ertapenem (ETP), and meropenem (MEM).
Рис. 4. Влияние повидон-йода на чувствительность клинических изолятов K. pneumoniae к норфлоксацину (NOR) и нитрофурантоину (FT).
Fig. 4. Effect of povidone-iodine on the susceptibility of clinical isolates K. pneumoniae to norfloxacin (NOR) and nitrofurantoin (FT).
Культивирование и многократное перепассирование (54 пассажа) клинических изолятов K. pneumoniae на средах с сублетальными концентрациями повидон-йода приводило к повышению чувствительности бактерий к ряду антибиотиков.
МИК антибиотиков в отношении изученных культур снизились в среднем в 2,35–23,2 раза по сравнению с контрольными значениями. В условиях опыта чувствительность изученных культур возросла к амоксициллин/клавулановой кислоте в ≥ 2 – ≥ 8 раз, пиперациллин/тазобактаму — в ≥ 2 – ≥ 32 раза, цефтазидиму — в 4 – ≥ 16 раз, амикацину — в 2 – ≥ 16 раз, эртапенему — в 2–8 раз, меропинему — в 2–8 раз, цефепиму — в ≥ 4 – ≥ 64 раз, ципрофлоксацину — в 4 – ≥ 16 раз, гентамицину — в 2 – ≥ 8 раз, норфлоксацину — в 2–8 раз, нитрофурантоину — в 2–4 раза.
Из данных, представленных в таблицах к рисункам, видно, что повышение уровня чувствительности к антибиотикам варьировало от 50–60% взятых в опыт клинических изолятов K. pneumoniae (в отношении цефепима и эртапенема) до 90–100% (в отношении амоксициллин/клавулановой кислоты, ципрофлоксацина и гентамицина).
Подобное действие повидон-йода не было отмечено в отношении чувствительности изученных бактерий к ампициллину, цефотаксиму, имипенему, триметоприм/сульфаметоксазолу.
Для примера на рис. 5 представлены данные по определению чувствительности клинического изолята K. pneumoniae № 199/21 к антибиотикам до и после адаптации к повидон-йоду.
Рис. 5. Лабораторные отчёты по определению чувствительности клинического изолята K. pneumoniae № 199/21 к антибиотикам (завершено 26.01.2022, тип карты: AST-№ 204, прибор, используемый для тестирования, — 00000А69В991 («VITEK 2C»).
Fig. 5. Laboratory reports on the determination of the sensitivity of the clinical isolate K. pneumoniae № 199/21 to antibiotics (completed on 26.01.2022, card type: AST-№ 204, device used for testing 00000A69B991 ("VITEK 2C")).
Обсуждение
В настоящее время активно обсуждается способность микроорганизмов вырабатывать перекрёстную устойчивость к антибиотикам на фоне воздействия на них субингибирующих концентраций различных биоцидов [9–13]. Причины возникновения такой устойчивости бактерий к антибиотикам могут быть различными [9–13, 22–24].
В изученной нами научной литературе нет данных, что повидон-йод повышает чувствительность микроорганизмов к антибиотикам. Сложно сказать, чем может быть обусловлен установленный нами феномен. Повидон-йод — один из наиболее широко используемых антисептиков в настоящее время. Его бактерицидный эффект обусловлен тем, что молекулярный йод, высвобождающийся из комплекса с синтетическим полимерным поливинилпирролидоном (повидоном), повреждает клеточные стенки микроорганизмов за счёт окисления аминокислот, содержащих SH- и OH-группы. Также он окисляет бактериальные ферменты и трансмембранные белки, при этом изменяется их четвертичная структура и они теряют каталитическую и функциональную активность.
Представленные в работе результаты получены при выполнении научной темы по изучению влияния сублетальных концентраций биоцидов на формирование множественной устойчивости микроорганизмов к противомикробным средствам. В ходе исследований мы провели адаптацию клинических изолятов K. pneumoniae к 6 биоцидам (хлоргексидин, бензалкониум хлорид, полигексаметиленгуанидин гидрохлорида, гликолевая кислота, этанол и повидон-йод) с использованием метода адаптивной лабораторной эволюции [25] и установили, что только один изученный антисептик, а именно повидон-йод, приводил к повышению чувствительности изученных клинических изолятов к антибиотикам. Данные по влиянию хлоргексидина, бензалкония хлорида, полигексаметиленгуанидин гидрохлорида, гликолевой кислоты и этанола на селекцию устойчивости к антибиотикам отсутствуют в данной статье и будут опубликованы позже.
Достоверность полученных результатов может быть подтверждена тем, что представленные данные получены при одновременной постановке карт для контрольной (n = 10) и адаптированной (n = 10) групп микроорганизмов, в работе использовали одну партию карт, один автоматический анализатор, один набор питательных сред и растворов. Исследования проводил один оператор.
Заключение
Нет данных, каким образом низкие концентрации повидон-йода могут стимулировать повышение чувствительности бактерий к антибиотикам, но, безусловно, этот феномен требует дальнейшего изучения и объяснения.
Этическое утверждение. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Этическим комитетом Белорусского государственного медицинского университета (протокол № 15 от 27.06.2019).
Ethics approval. The study was conducted with the informed consent of the patients. The research protocol was approved by the Ethics Committee of the Belarusian State Medical University (protocol No. 15, June 27, 2019).
About the authors
Zhanna F. Tsyrkunova
Belarusian State Medical University
Author for correspondence.
Email: tsyrkunova@list.ru
ORCID iD: 0000-0003-2095-2378
SPIN-code: 2944-9248
Cand. Sci. (Biol.), Head, Laboratory of nosocomial infections
Belarus, MinskAlesya A. Emelyanova
Belarusian State Medical University
Email: tsyrkunova@list.ru
ORCID iD: 0000-0001-8354-6380
junior researcher, Laboratory of nosocomial infections
Belarus, MinskElena I. Gudkova
Belarusian State Medical University
Email: tsyrkunova@list.ru
ORCID iD: 0000-0002-4818-289X
Cand. Sci. (Med.), Associate Professor, Head, Research unit
Belarus, MinskGennady A. Skorokhod
Belarusian State Medical University
Email: tsyrkunova@list.ru
ORCID iD: 0000-0002-7896-1413
Cand. Sci. (Med.), Associate Professor, leading researcher, Laboratory of nosocomial infections
Belarus, MinskReferences
- Le T., Wang L., Zeng C., et al. Clinical and microbiological characteristics of nosocomial, healthcare-associated, and community-acquired Klebsiella pneumoniae infections in Guangzhou, China. Antimicrob. Resist. Infect. Control, 2021;10(1):41. DOI: https://doi.org/10.1186/s13756-021-00910-1
- Zhang H., Guo Z., Chai Y., et al. Risk factors for and clinical outcomes of carbapenem-resistant Klebsiella pneumoniae nosocomial infections: a retrospective study in a tertiary hospital in Beijing, China. Infect. Drug. Resist. 2021;14:1393–401. DOI: https://doi.org/10.2147/IDR.S298530
- Durdu B., Hakyemez I.N., Bolukcu S., et al. Mortality markers in nosocomial Klebsiella pneumoniae bloodstream infection. Springerplus. 2016;5(1):1892. DOI: https://doi.org/10.1186/s40064-016-3580-8
- Frasera J.L., Mwatondo A., Alimi Y.H., et al. Healthcare-associated outbreaks of bacterial infections in Africa, 2009–2018: A review. Int. J. Infect. Dis. 2021;103:469–77. DOI: https://doi.org/10.1016/j.ijid.2020.12.030
- Molton J.S., Tambyah P.A., Ang B.S., et al. The global spread of healthcare-associated multidrug-resistant bacteria: a perspective from Asia. Clin. Infect. Dis. 2013;56(9):1310–8. DOI: https://doi.org/10.1093/cid/cit020
- Avershina E., Shapovalova V., Shipulin G. Fighting antibiotic resistance in hospital-acquired infections: current state and emerging technologies in disease prevention, diagnostics and therapy. review article. Front. Microbiol. 2021;12:707330. DOI: https://doi.org/10.3389/fmicb.2021.707330
- Cassini A., Hogberg L.D., Plachouras D., et al. Attributable deaths and disability-adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect. Dis. 2019;19(1):56–66. DOI: https://doi.org/10.1016/S1473-3099(18)30605-4
- Ahmad M., Khan A.U. Global economic impact of antibiotic resistance: A review. J. Glob. Antimicrob. Resist. 2019;19:313–6. DOI: https://doi.org/10.1016/j.jgar.2019.05.024
- Singer A.C., Shaw H., Rhodes V., Hart A. Review of antimicrobial resistance in the environment and its relevance to environmental regulators. Front. Microbiol. 2016;7:1728. DOI: https://doi.org/10.3389/fmicb.2016.01728
- Zhang M., Wan K., Zeng J., et al. Co-selection and stability of bacterial antibiotic resistance by arsenic pollution accidents in source water. Environ. Int. 2020;135:105351. DOI: https://doi.org/10.1016/j.envint.2019.105351
- Zhang Y., Gu A.Z., Cen T., et al. Sub-inhibitory concentrations of heavy metals facilitate the horizontal transfer of plasmid-mediated antibiotic resistance genes in water environment. Environ. Pollut. 2018;237:74–82. DOI: https://doi.org/10.1016/j.envpol.2018.01.032
- Kampf G. Biocidal agents used for disinfection can enhance antibiotic resistance in gram-negative species. Antibiotics (Basel). 2018;7(4):110. DOI: https://doi.org/10.3390/antibiotics7040110
- Wand M.E., Bock L.J., Bonney L.C., Sutton J.M. Mechanisms of increased resistance to chlorhexidine and cross-resistance to colistin following exposure of Klebsiella pneumoniae clinical isolates to chlorhexidine. Antimicrob. Agents Chemother. 2016; 61(1):e01162-16. DOI: https://doi.org/10.1128/AAC.01162-16
- Eggers M. Infectious disease management and control with povidone iodine. Infect. Dis. Ther. 2019;8(4):581–93. DOI: https://doi.org/10.1007/s40121-019-00260-x
- Kramer A., Dissemond J., Kim S., et al. Consensus on wound antisepsis: update 2018. Skin Pharmacol. Physiol. 2018; 31(1): 28–58. DOI: https://doi.org/10.1159/000481545
- Grzybowski A., Kanclerz P., Myers W.G. The use of povidone-iodine in ophthalmology. Curr. Opin. Ophthalmol. 2018;29(1): 19–32. DOI: https://doi.org/10.1097/ICU.0000000000000437
- Williamson D.A., Carter G.P., Howden B.P. Current and emerging topical antibacterials and antiseptics: agents, action, and resistance patterns. Clin. Microbiol. Rev. 2017;30(3):827–60. DOI: https://doi.org/10.1128/CMR.00112-16
- Barreto R., Barrois B., Lambert J., et al. Addressing the challenges in antisepsis: focus on povidone iodine. Int. J. Antimicrob. Agents. 2020;56(3):106064. DOI: https://doi.org/10.1016/j.ijantimicag.2020.106064
- Merchel Piovesan Pereira B., Wang X., Tagkopoulos I. Biocide-induced emergence of antibiotic resistance in Escherichia coli. Front. Microbiol. 2021;12:640923. DOI: https://doi.org/10.3389/fmicb.2021.640923
- Barakat N.A., Rasmy S.A., Hosny A.E., Kashef M.T. Effect of povidone-iodine and propanol-based mecetronium ethyl sulphate on antimicrobial resistance and virulence in Staphylococcus aureus. Antimicrob. Resist. Infect. Control. 2022;11(1):139. DOI: https://doi.org/10.1186/s13756-022-01178-9
- Циркунова Ж.Ф., Емельянова А.А., Гудкова Е.И. и др. Влияние субингибирующих концентраций биоцидов на формирование адаптивной устойчивости клинических изолятов Klebsiella pneumoniae. Иммунопатология, аллергология, инфектология. 2022;(3):31–40. Tsirkunova Zh.F., Emel'yanova A.A., Gudkova E.I., et al. Effect of subinhibitory concentrations of biocides on formation of adaptive resistance of clinical isolates of Klebsiella pneumoniae. Immunopathology, Allergology, Infectology. 2022;(3):31–40. DOI: https://doi.org/10.14427/jipai.2022.3.30 EDN: https://www.elibrary.ru/ngcexg
- Jutkina J., Marathe N.P., Flach C.F., Larsson D.G.J. Antibiotics and common antibacterial biocides stimulate horizontal transfer of resistance at low concentrations. Sci. Total Environ. 2018;616-617:172–8. DOI: https://doi.org/10.1016/j.scitotenv.2017.10.312
- Fraud S., Campigotto A.J., Chen Z., Poole K. MexCD-OprJ multidrug efflux system of Pseudomonas aeruginosa: involvement in chlorhexidine resistance and induction by membrane-damaging agents dependent upon the AlgU stress response sigma factor. Antimicrob. Agents Chemother. 2008;52(12):4478–82. DOI: https://doi.org/10.1128/AAC.01072-08
- Di Cesare A., Fontaneto D., Doppelbauer J., Corno G. Fitness and recovery of bacterial communities and antibiotic resistance genes in urban wastewaters exposed to classical disinfection treatments. Environ. Sci. Technol. 2016;50(18):10153-61. DOI: https://doi.org/10.1021/acs.est.6b02268
- Mavrommatia M., Daskalakia A., Papanikolaou S., Aggelis G. Adaptive laboratory evolution principles and applications in industrial biotechnology. Biotechnol. Advances. 2022;54:107795. DOI: https://doi.org/10.1016/j.biotechadv.2021.107795
Supplementary files