The Yersinia pestis aggregation as a functional adaptation to the flea organism (review)
- Authors: Bazanova L.P.1, Nikitin A.Y.1, Tokmakova E.G.1
-
Affiliations:
- Irkutsk Antiplague Research Institute of Siberia and Far East
- Issue: Vol 100, No 2 (2023)
- Pages: 240-250
- Section: REVIEWS
- URL: https://microbiol.crie.ru/jour/article/view/11160
- DOI: https://doi.org/10.36233/0372-9311-198
- EDN: https://elibrary.ru/qggrvb
- ID: 11160
Cite item
Full Text
Abstract
The understanding of mechanisms and conditions of plague microbe aggregation in vectors’ (fleas) organisms has been of interest for a long time, and, with start of biofilm research in 1990s, it got a new perspectives.
With the aim to determine the characteristics of the plague microbe aggregation in the organism the main vector in Tuva natural plague focus’ — flea of Citellophilus tesquorum species, the data of many years of experimental studies focused on typical virulent strains of Yersinia pestis subsp. pestis were summarized and analyzed. Ectoparasites were infected and fed on long-tailed ground squirrel (Spermophilus undulatus), which is their natural host and main carrier of plague in Tuva natural plague focus. Interaction between Y. pestis and fleas were estimated using the rate of individuals with conglomerates “bacterial lumps”, formed during feeding, and “blocks” in the proventriculus foRmed during feeding and throughout the whole experiment registered in alive fleas after bloodsucking, and also using frequency of causative agent transmission to animals used for feeding.
The analysis identified factors influencing the frequency and dynamics of different Y. pestis aggregate types forming into C. tesquorum, and suggest that these processes are functional adaptation of microbe to the flea organism.
Keywords
Full Text
Способность возбудителя чумы к агрегированию в пищеварительном тракте блохи обеспечила становление в процессе эволюции трансмиссивного механизма его распространения [1–5]. Плотные агрегации, формируемые Yersinia pestis в средней кишке блохи и блокирующие преджелудок, окружены внеклеточной матрицей (биоплёнкой) [6]. Она защищает возбудителя от защитных реакций беспозвоночных [2] и начального воздействия иммунной системы теплокровных хозяев [3, 7].
Предметом большинства исследований адаптации Y. pestis к существованию в блохе-переносчике является «блок» преджелудка, а объектом или эталоном сравнения — блоха Xenopsylla cheopis. В организме данной блохи возбудитель чумы чаще проявляется в форме «блоков», а не свободно плавающих, неприкреплённых форм — «глыбок» [8]. В то же время известна точка зрения [9], что бактериальные «глыбки» в желудке блох не служат основой для «блокообразования» в отдалённые от заражения сроки. Такие блохи могут являться своеобразными хранителями микроба, участвовать в заражении шерсти грызуна и гнездовой камеры, обсеменяя окружающую среду живыми бактериями, защищёнными от воздействия неблагоприятных условий внешними мембранными образованиями [3, 10]. На примере блох-переносчиков из сибирских природных очагов чумы нами установлено, что формирование «глыбок» происходило у всех 12 взятых в исследование видов и подвидов этих эктопаразитов, причём различия между активными и неактивными переносчиками по частоте их образования в целом не достоверны [8].
С целью выявления особенностей и условий формирования агрегированных форм («глыбок» и «блоков») Y. pestis в организме Citellophilus tesquorum — основного переносчика в Тувинском природном очаге (ТПО) [11–14] — проведён анализ и обобщены данные собственных экспериментальных исследований с использованием параметрических критериев, без изучения распределения временны́х рядов. Результаты отдельных экспериментов ранее были опубликованы, однако более полная «расшифровка» механизмов приспособления (адаптации) возбудителя чумы к существованию в организме переносчика (на примере ТПО) стала возможной только при обобщении и анализе многолетних данных.
Динамика эпизоотического процесса в ТПО в основном определяется особенностями взаимодействия жизнедеятельности длиннохвостого суслика (Spermophilus undulatus) — основного носителя возбудителя чумы [14, 15] — и блохи C. tesquorum [16, 17], являющейся в данном очаге не только основным переносчиком, но и хранителем возбудителя [18]. В последние годы в очаге наблюдаются трансформация паразитоценозов и возрастание эпизоотической активности, связанные в том числе с ростом численности и миграционной активности C. tesquorum, происходящими на фоне аридизации климата [14, 19]. В многолетних экспериментах использованы типичные для очага вирулентные штаммы Y. pestis subsp. pestis. Отличительный признак тувинских изолятов Y. pestis — наличие у них в геноме дополнительной четвёртой плазмиды рТР33 с молекулярной массой 22 МДа (~33 т.п.н.) [20]. При анализе функциональных свойств плазмиды рТР33 высказано предположение о том, что она играет роль в процессе колонизации преджелудка блох, обеспечивая большую прочность экзополисахаридного матрикса биоплёнки [21]. Эктопаразитов инфицировали и проводили подкормки на S. undulatus. Частоту и динамику формирования агрегированных форм Y. pestis у блох оценивали по доле особей с «блоком» и «глыбками», отмечаемым визуально на фоне алой крови при просмотре под микроскопом живых имаго после каждой подкормки. Подробно методы проведения экспериментальных исследований отражены в опубликованных ранее работах [11, 22–24].
Сезонная динамика агрегирования Y. pestis
Во взаимоотношениях чумного микроба и блохи C. tesquorum в ТПО проявляется чётко выраженная сезонность, которая обусловлена, вероятнее всего, их длительной коадаптацией [22, 24]. Так, доля особей с «глыбками» осенью резко возрастает к концу эксперимента (3–4 октября): за две последние подкормки выявлены 64,5 и 67,7% таких особей (рис. 1, а). По сравнению со средним за весь опыт показателем (15,8 ± 4,6%), доля блох с «глыбками» к началу октября увеличилась более чем в 4 раза. В это время имаго заканчивают физиологическую перестройку для переживания зимнего периода в состоянии оцепенения, что, видимо, приводит к изменению взаимодействия микроба с организмом переносчика, возрастанию способности возбудителя к агрегированию. Три первые подкормки после выхода блох из диапаузы весной приходились на 228, 232 и 235-е сутки от заражения. Осенью за последние подкормки выявили в среднем 65,9 ± 1,43% особей с «глыбками», после перезимовки этих блох за три первых подкормки весной — 45,8 ± 1,16% (без учёта пола). Таким образом, регистрация агрегатов микроба у «перезимовавших» имаго в весенний период (рис. 1, б) ближе к данным, полученным у этих блох осенью предыдущего года (рис. 1, а). Этот факт позволил предположить, что именно в агрегированном состоянии Y. pestis находится в организме C. tesquorum весь холодный период года. Об этом может свидетельствовать и существенное различие доли блох, у которых выявляли конгломераты Y. pestis за три первые подкормки осенью после заражения (0) и весной после перезимовки (45,8 ± 1,16%; t = 19,78; р < 0,001).
Рис. 1. Сезонные особенности формирования конгломератов чумного микроба у молодых блох C. tesquorum altaicus выплода текущего года и перезимовавших в состоянии оцепенения.
а — осень, блохи выплода и заражения текущего года; б — весна, перезимовавшие имаго весной следующего года; в — весна, результаты параллельно проведённых опытов с имаго, заражёнными непосредственно перед началом эксперимента и перезимовавшими, инфицированными осенью предыдущего года. По осям абсцисс – подкормки, по осям ординат – доля блох с конгломератами чумного микроба за подкормку, %.
Fig. 1. Seasonal features of the formation of conglomerates of the plague microbe in young fleas C. tesquorum altaicus breeding this year and overwintered in a state of torpor.
a — autumn, breeding fleas and infestations of the current year; b — spring, overwintered adults in the spring of next year; c — spring, the results of parallel experiments with adults infected immediately before the start of the experiment, and overwintered, infected in the fall of the previous year. Abscissas — bloodfeedings, ordinates — proportion of fleas with plague microbe conglomerates per bloodfeeding, %.
Для подтверждения этого предположения проведён сравнительный анализ результатов весеннего (рис. 1, в) и летнего опытов с блохами двух календарных возрастов («перезимовавшими» и «молодыми»). К первым отнесены блохи, инфицированные осенью предыдущего года и перезимовавшие (после проведения 18 подкормок в сентябре–октябре) в состоянии оцепенения без прокормителя. Ко вторым — насекомые выплода и заражения текущего года. Весной у «молодых» блох при их 100% заражённости после 3 первых подкормок доля имаго с «глыбками» была существенно ниже (0,70 ± 0,34), чем среди «перезимовавших» (45,80 ± 1,17; t = 13,02; р < 0,001), а максимум (27,6%) «молодых» блох с «глыбками» зарегистрирован только на 28-е сутки после заражения (подкормки 7–9; рис. 1, в). Летом (в июне), более чем через 280 сут после заражающего кормления, доля блох с «глыбками» среди «перезимовавших» за первые три подкормки в среднем оставалась стабильно высокой — 45,90 ± 4,03%, а среди «молодых» за тот же период она была значительно ниже — 1,80 ± 1,82% [24]. Данные факты указывают на возможность сохранения Y. pestis в организме имаго C. tesquorum в «глыбках» не только на протяжении зимнего периода, но и до нового эпизоотического сезона.
Установлено наличие сезонных изменений частоты «блокообразования» у C. tesquorum в экспериментальных условиях [22]. В июле – начале августа, в период активизации эпизоотического процесса в очаге, она достигала максимума — 10,6 ± 2,4% «блокированных» особей за опыт. В то же время отмечен и минимальный срок (3 сут) от заражения имаго до формирования первого «блока». Осенью (сентябрь) процент «блокирующихся» особей заметно уменьшился и составил 6,00 ± 1,94%, что пришлось на время спада эпизоотии в очаге. Первые после заражения особи с «блоком» выявлены осенью на 7-е сутки. Зимний период значительная часть инфицированных осенью имаго переживает в состоянии оцепенения. Весной среди перезимовавших в экспериментальных условиях блох выявлено менее 2% (1,7 ± 0,9%) «блокированных». Передачи возбудителя зверькам с активным проявлением инфекционного процесса в этот период не зарегистрировано. В июне, с началом активизации эпизоотического процесса в очаге, в эксперименте возросла как доля особей с «блоком» среди перезимовавших блох — до 4,6 ± 1,6%, так и частота передачи возбудителя чумы, которая была установлена бактериологическим методом у 3 из 10 использованных для подкормок сусликов.
Анализ полученных данных показал, что у C. tesquorum наблюдается выраженная сезонная динамика не только частоты и сроков «блокообразования» [24], но и инфекциозности укусов «блокированных» особей, частоты передачи инфекции блохами и генерализации инфекционного процесса у заболевших носителей. Необходимо отметить, что максимальные значения всех перечисленных показателей в условиях эксперимента совпадали по времени с пиком активизации эпизоотического процесса в природном очаге.
Влияние пола блохи на агрегированность Y. pestis
Предполагалось, что выраженный половой диморфизм у блох должен отражаться на способности к сохранению и распространению Y. pestis самками и самцами. По результатам 3 опытов, проведённых в июле–августе (в разные годы), доля «блокированных» самцов C. tesquorum в этот период значительно превышала долю самок с «блоком» (рис. 2, а). Половые различия по данному признаку достоверны для показателей всех анализируемых летних опытов (для первого и второго — р < 0,05, для третьего — р < 0,001). Процесс «блокообразования» у самцов начинался и заканчивался раньше, чем у самок. При этом закономерных половых различий в формировании бактериальных «глыбок» в летний период не обнаружено (рис. 2, б). Первых самок с «глыбками» Y. pestis регистрировали в те же сроки, что и самцов.
Рис. 2. Различия в накоплении и сохранении чумного микроба в организме самок и самцов C. tesquorum altaicus
а — «блокообразование» у самок и самцов в июле–августе; б — формирование бактериальных глыбок у самок и самцов в июле–августе; в — накопление в организме самок и самцов бактериальных глыбок осенью и сохранение их до весны и лета следующего года.
а, б: по осям абсцисс –– номера опытов, по осям ординат –– доля блох с блоками или глыбками, %; в: по оси ординат –– доля блох с конгломератами (блоками и глыбками) за подкормку, %.
Fig. 2. Differences in the accumulation and preservation of the plague microbe in the body of females and males of C. tesquorum altaicus.
a — block formation in females and males in July–August; b — the formation of bacterial "lumps" in females and males in July–August; c — the accumulation of bacterial "lumps" in the body of females and males in the autumn and their preservation until the spring and summer of the next year. a, b: abscissas — numbers of experiments, ordinates — proportion of fleas with blocks or bacterial lumps per experiment, %; c: ordinate — the proportion of fleas with conglomerates (blocks and bacterial lumps) for bloodfeeding, %.
Экспериментальные данные показали, что самки лучше переживают неблагоприятный период года. Из всех заражённых осенью имаго до весны следующего года выжило 69,4% самок и 46,9% самцов (t = 3,5; р < 0,001) [24]. Также выявлены половые различия у блох в накоплении глыбок Y. pestis осенью и сохранении их до весны и лета следующего года (рис. 2, в). Так, из инфицированных осенью имаго перед закладкой на зимнее хранение отметили 67,9% самок и 48,1% самцов с глыбками возбудителя (t = 3,08; р < 0,01). К весне следующего года агрегаты Y. pestis содержали 50,0% самок и 23,7% самцов (t = 2,89; р < 0,01). Эти результаты свидетельствуют о том, что возбудитель чумы переживает неблагоприятный период в агрегированном состоянии в основном в самках C. tesquorum. Учитывая лучшую выживаемость самок по сравнению с самцами, следует признать их более значительную роль в сохранении Y. pestis в период зимней диапаузы.
Таким образом, экспериментально подтверждена способность чумного микроба к переживанию зимнего периода в блохах, находящихся в состоянии оцепенения без контакта с прокормителем. Более половины имаго сохраняли возбудителя чумы в течение 10–11 мес, а около 30% — 13–15 мес. В организме некоторых самок чумной микроб сохранялся до 22 мес, после чего блохи инфицировали здоровых сусликов при кровососании [24].
Влияние температуры на агрегированность Y. pestis
Температурные значения в проведённых нами опытах были приближены к наблюдаемым в природе в ТПО: от 5–6ºС в сентябре–октябре (модель периодически посещаемого в этот период летнего гнезда), до 22–25ºС в мае–июне (модель выводкового гнезда, в котором создаются оптимальные условия для преимагинальных стадий С. tesquorum). Режим подкормок для удобства сравнения унифицировали — через 1–2 сут.
Полученные данные показали, что среди заражённых осенью 150 блох, содержавшихся при 5–6ºС, на протяжении всех подкормок большинство составляли особи с глыбками, доля которых поступательно увеличивалась до максимума к концу опыта (4 октября). Другие визуализируемые разновидности агрегатов — полные и частичные блоки встречались по сравнению с ними в ничтожно малом количестве: у 0,3% имаго в среднем за подкормку.
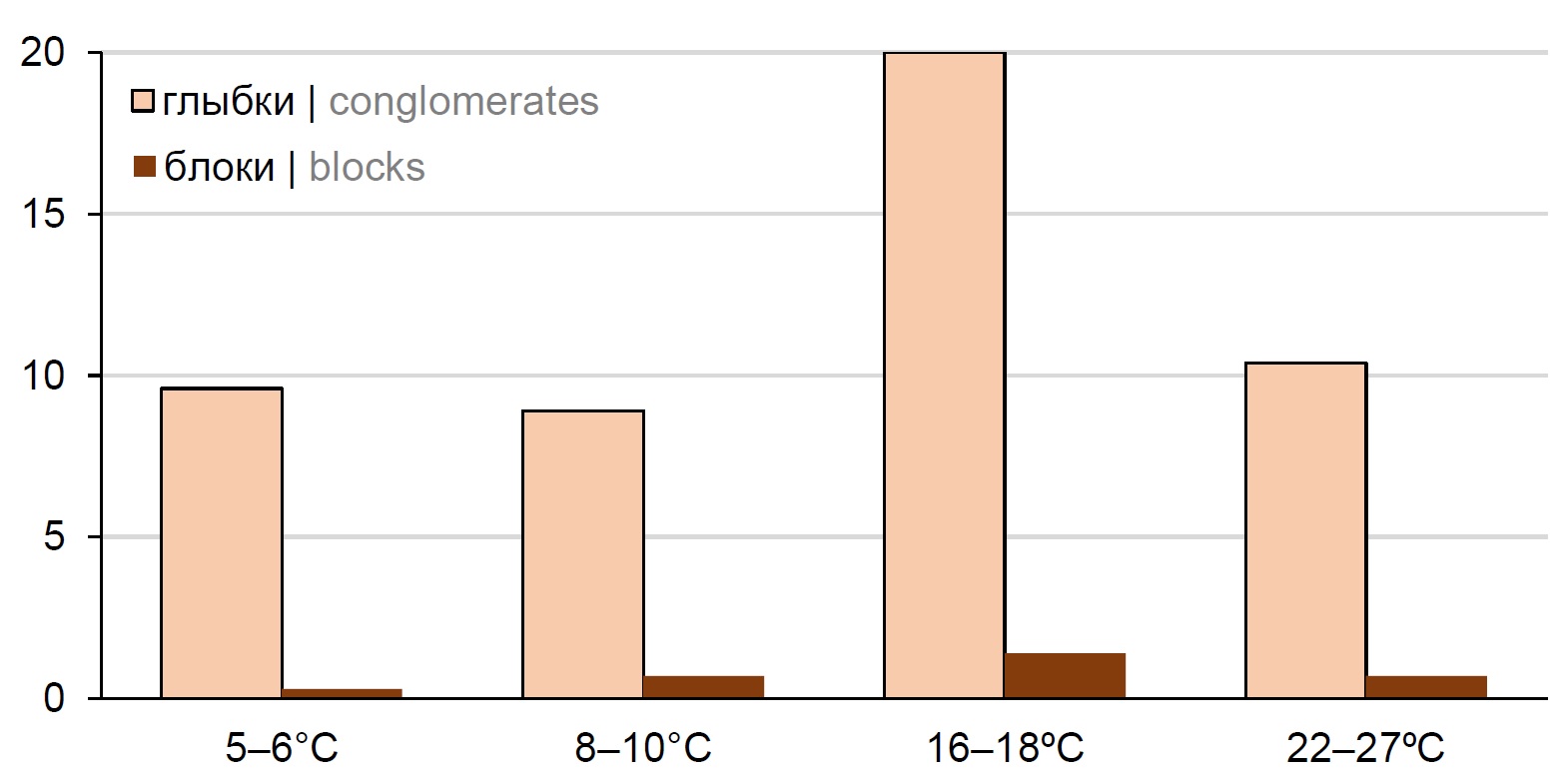
Значительно различалась динамика формирования чумным микробом глыбок и блоков в организме С. tesquorum при температуре 5–25ºС (рис. 3, а, б). Так, при 5–6ºС первые самки с «глыбками» отмечены только на 8–10-е сутки, а с «блоками» — на 18-е сутки. У самцов формирование глыбок и блоков началось одновременно с 13-х суток. Образование тех и других агрегированных форм продолжалось у обоих полов до конца опыта — по 32-е сутки. При 8–10ºС первые глыбки Y. pestis регистрировали как у самок, так и у самцов начиная с 8-х суток, и также до конца опыта (35-е сутки). Период «блокообразования» продолжался у самок с 16-х по 31-е сутки, у самцов — с 8-х по 34-е сутки. При 16–18ºС формирование агрегатов возбудителя — как глыбок, так и блоков — у С. tesquorum (без учёта пола) наблюдали с 3-х суток до конца опыта (26-е сутки). Дальнейшее повышение температуры до 22–25ºС существенно не повлияло на сроки формирования глыбок микроба. Их отмечали начиная с 3-х суток и до конца опыта (30-е сутки) у особей обоих полов. При этом период от заражения блох до начала формирования блоков увеличился по сравнению с показателями, полученными при содержании блох в температурных границах 16–18ºС. Так, первые блоки отмечены у самок на 12-е сутки, у самцов — на 7-е, а последние — на 24-е и 16-е сутки соответственно (рис. 3, а). По сравнению с опытом при 16–18ºС, сократился и период «блокообразования» (от начала до конца выявления «блокированных» особей) на 8–11 сут. Наибольшее число «блокированных» блох (рис. 3, б) отмечали в диапазоне температур от 8–10 до 16–18ºС.
Рис. 3. Формирование конгломератов чумного микроба у C. tesquorum altaicus при различных условиях содержания.
а — начало формирования глыбок при разной температуре; б — частота формирования конгломератов при разной температуре; в — начало формирования бактериальных глыбок в зависимости от периода между заражающим кормлением блох и периодическими подкормками (серые столбики — 3-и сутки, черные столбики — 16-е сутки).
По осям ординат — доля блох с конгломератами чумного микроба, %.
Fig. 3. Formation of conglomerates of the plague microbe in C. tesquorum altaicus under various conditions of keeping.
a — the beginning of the formation of lumps at different temperatures; b — the frequency of formation of conglomerates at different temperatures; c — the beginning of the formation of bacterial lumps depending on the period between the infectious feeding of fleas and periodic feedings (grey columns — 3rd day, black columns — 16th day).
Оrdinates — the proportion of fleas with plague microbe conglomerates per bloodfeeding, %.
Температура является одним из мощных факторов, воздействующих на взаимоотношения Y. pestis и блох. С повышением температуры окружающей среды активность имаго и, в частности, частота кровососания возрастает [25]. В этой связи при питании блохи могут вносить большее количество бактерий. Однако такая зависимость наблюдается только до определённой температуры. В опытах разных исследователей зарегистрированный процент особей X. cheopis с блоком при 4ºС не превышал 1%, достигал максимума при 13–20ºС [26], при более высоких значениях (27ºC и выше) снижался, а при 30ºС таких особей вообще не выявляли [6]. У C. tesquorum, заражённых высоковирулентным штаммом из Волго-Уральского междуречья и подкармливаемых на малом суслике, через 2 сут доля «блокированных» особей была выше, а минимальные и средние сроки образования блоков — короче при температуре опыта 16–18ºС по сравнению с содержавшимися при 8–10ºС [27]. Эксперименты, проведённые с той же периодичностью подкормок при трёх температурных режимах: 4, 13 и 20ºС, — показали наибольшее количество «блокированных» блох среди C. tesquorum, заражённых «диким» штаммом из Центрального Кавказа, при 13ºС, при 4ºС таких особей было меньше в 1,5 раза, а при 20ºС — в 3,5 раза. В качестве прокормителей в этих опытах были использованы морские свинки и белые мыши [26]. Проведённые ранее исследования с C. tesquorum из ТПО показали, что образование блока у блох чаще регистрировали при температуре содержания 10ºС, чем при 20ºС [28].
В наших опытах отмечено влияние температуры содержания блох как на процесс «блокообразования», так и на эффективность трансмиссии возбудителя. Так, имаго, содержащиеся при 22–25ºС, передали возбудителя 6 сусликам из 19 (у 2 зверьков выявлена генерализованная форма инфекции). Блохи, находившиеся между подкормками при 16–18ºС, инфицировали 5 (50%) сусликов из 10, а при 8–10ºС — 4 (52%) из 13, при этом у всех заболевших зверьков и в том и другом опытах отмечена генерализация инфекционного процесса [29].
Таким образом, оптимальной для процесса «блокообразования» у С. tesquorum и эффективной передачи Y. pestis является температура от 8–10ºС до 16–18ºС; более низкие или высокие её значения приводят к снижению активности блохи как переносчика. Так, минимальные сроки образования глыбок с ростом температуры сокращались от 8 сут при 5–10ºС до 3 сут при 16–25ºС [29]. Известно, что оптимум температуры при искусственном культивировании Y. pestis — 28ºС. Можно сделать вывод, что количество блох с биоплёнками определяется оптимумом температуры для блох, а период роста биоплёнки до её видимого (визуально регистрируемого) состояния имеет тенденцию к сокращению при приближении к оптимуму температуры для бактерии. Хотя условия внутри каждого макроорганизма характеризуются индивидуальностью, в целом можно предположить, что температурный оптимум для возбудителя чумы в блохе имеет более широкие пределы, чем в искусственной среде.
Влияние периодичности кровососания блох на агрегированность Y. pestis
Установлено влияние режима питания блох С. tesquorum на агрегированность Y. pestis в их организме [23]. Имаго после заражения возбудителем чумы осенью разделили на две группы. Насекомых 1-й группы (150 особей) периодически подкармливали на сусликах, между подкормками содержали при 5–6ºС: такие условия в осенний период обычны для редко посещаемого сусликом летнего гнезда. Вторую группу блох (более 600 особей) содержали с прокормителем постоянно, что имитировало имеющую место ситуацию, когда молодые суслики пытаются зимовать в летних гнёздах. В 1-й группе на 20-е сутки от заражения (после 18 подкормок) у 64 (66,0%) из 97 оставшихся в живых имаго отмечены глыбки микроба. Доля «блокированных» особей от взятых в опыт составила 6,0%. Во 2-й группе особи с глыбками составили 2,7% от 300 просмотренных блох, что достоверно ниже (t = 12,9; р < 0,001), чем в 1-й группе, особи с блоками — 1,7% [23]. По результатам осеннего опыта, условия постоянного содержания эктопаразитов с прокормителем не благоприятствовали агрегации Y. pestis, что указывает на необходимость хотя бы периодического отсутствия зверька для успешной сезонной перестройки микроба в организме блохи.
На следующем этапе проанализированы данные опыта с двумя группами «молодых» блох в летний (июль–август) период (рис. 3, в). Эктопаразитов обеих групп заразили одновременно 22 июля, исходная заражённость составляла 100%. Подкормки одной группы блох начали на 3-и сутки после заражающего кормления, второй — на 16-е сутки. В первой группе особи с глыбками ни при первой, ни при второй подкормке не выявлены. У блох, которых начали кормить на 16-е сутки, доля особей с глыбками при первой же подкормке составила 9,3% среди самок (t = 3,32; р < 0,001) и 14,8% среди самцов (t = 3,75; р < 0,001). Всего (без учёта пола) блохи с глыбками составили 11,6% (t = 4,99; р < 0,001). Представляет интерес, что при дальнейших регулярных подкормках межгрупповые различия нивелировались: средняя доля блох с глыбками в группах существенно не различалась: в первой группе — 15,9 ± 4,87, во второй — 15,2 ± 4,25%.
Впервые показано, что, несмотря на увеличение количества имаго с биоплёнками после 16-суточной голодовки среди молодых особей, этого оказалось недостаточно, чтобы приблизиться к показателям у перезимовавших блох. Среди последних доля особей с глыбками за 3 первые подкормки была достоверно выше (для самок F = 292,41; р < 0,001; для самцов F = 93,72; р < 0,001), чем у молодых имаго.
В естественных условиях C. tesquorum нападают на сусликов до 3 раз в сутки [16], и у них часто наблюдаются «прогон» и выделение непереваренной алой крови. Увеличение интервала между подкормками для часто питающихся в норме блох Ctenocephalides felis от 2 ч (практически постоянный доступ к прокормителю) до 2–3 сут приводило к повышению доли «блокированных» блох с 0 до 15,2% [30]. Повышение частоты «блокообразования» Y. pestis при недостатке питательных веществ связывают с усилением транскрипции в блохе гена ompF, продукт которого — белок-порин может обеспечивать, с одной стороны, приток в бактериальную клетку дополнительного питания, а с другой — экспорт молекул-компонентов внеклеточного матрикса биоплёнки [31]. В то же время в группах C. tesquorum, содержавшихся при 13ºС и разных режимах кормления — через 2–3 и 15–20 сут, количество «блокированных» блох практически не различалось, составив 14 и 12% соответственно. Первые блоки были отмечены на 18-е сутки у блох, подкармливаемых через 2–3 сут, и на 30-е сутки при подкормках через 15–20 сут [26], но на срок обнаружения во втором случае, очевидно, повлиял режим подкормок. Насколько он соответствовал реальному сроку образования закупорки преджелудка, неизвестно. В наших опытах двухнедельное голодание C. tesquorum после заражения также не привело к повышению доли «блокированных» особей, по сравнению с периодически подкармливаемыми, как среди самок — 3,7% против 5,4%, так и среди самцов — 24,7% против 13,9% (t = 1,85; р > 0,05). Однако необходимо подчеркнуть, что соотношение различных форм биоплёнки (глыбок и блоков) зависит от вида блох. У C. tesquorum первые всегда обнаруживали чаще, чем вторые [8], и на фоне отсутствия доступа блох к прокормителю после заражения имело место накопление именно особей с глыбками. В приведённых экспериментах частота питания блох регулировалась искусственно. В то же время, по наблюдениям, проведенным в ТПО, блохи C. tesquorum осенью перестают интенсивно питаться, их численность в шерсти зверьков падает, а в гнездах длиннохвостого суслика возрастает [16]. Возможно, естественное снижение частоты питания является дополнительным стимулом для формирования агрегатов чумного микроба.
Морфология бактерий Y. pestis в глыбках и блоках
B.J. Hinnebusch и соавт. наблюдали зависимость морфологии клеток в микроколониях, обнаруживаемых в средней кишке блох X. cheopis, от температуры: от палочковидной при 20ºС до коккоидной при 30ºС [6]. У C. tesquorum после перезимовки в разных агрегациях (блоки, глыбки) выявлено различие морфологических форм Y. pestis. В глыбках прослеживается полиморфизм клеток чумного микроба, отмечены палочковидные, гантелевидные и шаровидные формы. В блоках отмечены только шаровидные очень мелкие (0,2–0,5 мкм), бледно окрашенные формы бактерий, которые, по данным электронно-микроскопического анализа, отличались, кроме того, своеобразной ультраструктурой, включающей дополнительные мембранные образования [23]. Возможно, отличающаяся морфология микробных клеток в глыбках и блоках обусловлена работой различных генов через кодируемые ими ферменты. На то, что образование глыбок и образование блоков — это два разных процесса, указывают результаты оценки влияния разных факторов на формирование биоплёнки: первое регулируется условиями эксперимента (температурой, сезоном, режимом подкормок), второе — преимущественно полом блох [32]. Известно также, что контроль образования биоплёнки осуществляется двумя дигуанилатцилазами. Одна из них контролируется локусом hmsD и отвечает за бóльшую часть блоков (до 90%) in vivo, отсутствие второй, продукта hmsT, приводит к нарушению синтеза биоплёнки in vitro. Её изолированная способность в формировании блока у блох незначительна, но определённая усиливающая роль очевидна [33]. Последними исследованиями подтверждено, что вклад этих ферментов в «блокообразование» у штаммов, относящихся к разным биоварам, идентичен [34, 35].
Заключение
Таким образом, можно заключить, что формирование глыбок Y. pestis является не только начальной стадией «блокообразования», но и самостоятельным явлением [8, 32], отражающим адаптацию микроба к меняющимся условиям обитания в организме переносчика. Во-первых, данный вывод подтверждается анализом экспериментальных данных, свидетельствующих о том, что все изменения физиологического состояния блох (подготовка к зимней диапаузе, длительное голодание, изменение температуры содержания и режима подкормок) способствуют агрегированности чумного микроба и в этой связи приводят к повышению доли насекомых с бактериальными глыбками.
Во-вторых, возбудитель чумы в агрегированном состоянии может сохраняться в организме оцепеневших блох, в основном самок, не только до следующего эпизоотического сезона, но и более длительный период. Имеются данные о переживании заражёнными самками C. tesquorum двух зимних периодов [24]. Видимо, адаптация микроба к сохранению в самках блох обусловлена большей устойчивостью этого пола к неблагоприятным условиям окружающей среды и продолжительностью их индивидуальной жизни. Процессы распространения (трансмиссивной передачи) и сохранения (персистенции) Y. pestis блохами определяются полом насекомых: первый лучше осуществляется самцами, второй — самками. В период активизации эпизоотического процесса в очаге «блокообразование» происходит более интенсивно, чем весной и осенью. В то же время экспериментально доказано, что для сохранения Y. pestis в зимний период важно, чтобы размножение и агрегация микроба у C. tesquorum осенью не заканчивались массовым формированием блоков, а приводило к накоплению бактериальных глыбок.
В-третьих, различие морфологии Y. pestis в глыбках и блоках может обусловливать и разные функциональные особенности возбудителя в этих формированиях. «Блокированные» C. tesquorum имеют более существенное значение для распространения Y. pestis, т.к. их укусы чаще вызывают генерализованную форму инфекции у зверьков, что приводит к дальнейшей трансмиссии возбудителя [11]. Сформировавшиеся глыбки являются основной формой в сохранении чумного микроба в организме блох [23], а значит, в поддержании энзоотии чумы на территории ТПО.
About the authors
Lyubov’ P. Bazanova
Irkutsk Antiplague Research Institute of Siberia and Far East
Author for correspondence.
Email: adm@chumin.irkutsk.ru
ORCID iD: 0000-0002-8086-9886
D. Sci. (Biol.), leading researcher, Zoological and parasitological department
Russian Federation, IrkutskAleksey Ya. Nikitin
Irkutsk Antiplague Research Institute of Siberia and Far East
Email: adm@chumin.irkutsk.ru
ORCID iD: 0000-0002-3918-7832
leading researcher, Zoological and parasitological department
Russian Federation, IrkutskElena G. Tokmakova
Irkutsk Antiplague Research Institute of Siberia and Far East
Email: adm@chumin.irkutsk.ru
ORCID iD: 0000-0002-3416-6602
Cand. Sci. (Biol.), senior researcher, Zoological and parasitological department
Russian Federation, IrkutskReferences
- Брюханова Г.Д., Бейер А.П., Грижебовский Г.М. и др. Значение агрегированности чумного микроба в передаче его блохами. Медицинская паразитология и паразитарная болезнь. 1999;3:37–40. Bryukhanova G.D., Beyer A.P., Grizhebovskiy G.M., et al. Contribution of aggregation of plague microbe to its flea transmission. Medical Parasitology and Parasitic Diseases. 1999;3:37–40.
- Jarrett C.O., Deak E., Isherwood K.E., et al. Transmission of Yersinia pestis from an infectious biofilm in the flea vector. J. Infect. Dis. 2004;190(4):783–92. DOI: https://doi.org/10.1086/422695
- Кутырев В.В., Коннов Н.П., Волков Ю.П. Возбудитель чумы: ультраструктура и локализация в переносчике. М.; 2007. Kutyrev V.V., Konnov N.P., Volkov Yu.P. Plague Causative Agent: Ultrastructure and Localization in the Vector. Moscow; 2007. EDN: https://elibrary.ru/qlpmjv
- Hinnebusch B.J., Chouikha I., Sun Y.C. Ecological opportunity, evolution, and the emergence of flea-borne plague. Infect. Immun. 2016;84(7):1932–40. DOI: https://doi.org/10.1128/iai.00188-16
- Hinnebusch B.J., Jarrett C.O., Bland D.M. “Fleaing” the plague: adaptations of Yersinia pestis to its insect vector that lead to transmission. Annu. Rev. Microbiol. 2017;71:215–32. DOI: https://doi.org/10.1146/annurev-micro-090816-093521
- Hinnebusch B.J., Ficher E.R., Schwan T.G. Evaluation of the role Yersinia pestis plasminogen activator and other plasmid-encoded factors in temperature-dependent blockage of the flea. J. Infect. Diseases. 1998;178(5):1406–15. DOI: https://doi.org/10.1086/314456
- Donlan R.M., Costerton J.M. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 2002;15(2):167–93. DOI: https://doi.org/10.1128/cmr.15.2.167-193.2002
- Базанова Л.П., Никитин А.Я. Агрегированность чумного микроба в организме блох с различной векторной способностью. Проблемы особо опасных инфекций. 2012;(4):15–7. Bazanova L.P., Nikitin A.Ya. Plague microbe aggregation in the organism of fleas (Siphonaptera) with different vector ability. Problems of Particularly Dangerous Infections. 2012;(4):15–7. EDN: https://elibrary.ru/pmdkqd
- Кондрашкина К.И. Болеют ли блохи чумой? Проблемы особо опасных инфекций. 1969;5:212–22. Kondrashkhina K.I. Do fleas suffer from the plague? Problems of Particularly Dangerous Infections. 1969;5:212–22.
- Кутырев В.В., Ерошенко Г.А., Попов Н.В. и др. Молекулярные основы взаимодействия возбудителя чумы с беспозвоночными животными. Молекулярная генетика, микробиология и вирусология. 2009;4:6–13. Kutyrev V.V., Eroschenko G.A., Popov N.V., et al. Molecular mechanisms of the plague pathogenic agent interaction with invertebrates. Molecular Genetics, Microbiology and Virology. 2009;4:6–13. EDN: https://elibrary.ru/lajqip
- Базанова Л.П., Токмакова Е.Г., Маевский М.П. Значение блокированных и неблокированных блох Citellophilus tesquorum altaicus (Ioff, 1936) в передаче чумной инфекции. Проблемы особо опасных инфекций. 2003;86:14–20. Bazanova L.P., Tokmakova E.G., Maevskiy M.P. The role of blocked and unblocked fleas Citellophilus tesquorum altaicus (Ioff, 1936) in transmission of plague infection. Problems of Particularly Dangerous Infections. 2003;86:14–20.
- Вержуцкий Д.Б., Галацевич Н.Ф., Ковалева Н.И. и др. Аннотированный список видов блох, инфицированных возбудителем чумы в Тувинском природном очаге. Байкальский зоологический журнал. 2016;(2):121–5. Verzhutskiy D.B., Galatsevich N.F., Kovaleva N.I., et al. The annotated list of infected plague pathogen fleas species in the Tuva natural foci. Baikal Zoological Journal. 2016;(2):121–5. EDN: https://elibrary.ru/ynfjhl
- Воронова Г.А. Ceratophyllus tesquorum altaicus Ioff 1936 как основной переносчик и хранитель чумного микроба в Тувинском природном очаге. В кн.: Эпидемиология и профилактика особо опасных инфекций в МНР и СССР. Улан-Батор;1978:152–5. Voronova G.I. Ceratophyllus tesquorum altaicus Ioff 1936 as the main vector and keeper of the plague microbe in the Tuva natural focus. In: Epidemiology and prevention of particularly dangerous infections in the MPR and the USSR. Ulan-Bator;1978:152–5.
- Балахонов С.В., Вержуцкий Д.Б., ред. Тувинский природный очаг чумы. Иркутск; 2019. Balakhonov S.V., Verzhutsky D.B., eds. Tuva Natural Plague Focus. Irkutsk; 2019.
- Вержуцкий Д.Б., Базанова Л.П., Вержуцкая Ю.А. Эпизоотологическое значение массовых видов блох длиннохвостого суслика в природных очагах чумы. Байкальский зоологический журнал. 2020;(2):105–9. Verzhutskiy D.B., Bazanova L.P., Verzhutskaya Yu.A. Episootological significance of fleas — common parasites of longtailed ground squirrels in natural plague foci. Baikal Zoological Journal. 2020;(2):105–9. EDN: https://elibrary.ru/fyaafl
- Крюков И.Л. Взаимосвязь сезонной жизнедеятельности длиннохвостого суслика и блохи Ceratophyllus tesquorum. В кн.: Современные аспекты профилактики зоонозных инфекций. Irkutsk;1984:85–7. Kryukov I.L. The relationship between the seasonal activity of the long-tailed ground squirrel and the flea Ceratophyllus tesquorum. In: Current Aspects of the Prevention of Zoonotic Infections. Irkutsk;1984:85–7.
- Вержуцкий Д.Б., Зонов Г.Б., Попов В.В. Эпизоотологическое значение накопления блох в агрегациях самок длиннохвостого суслика в Тувинском природном очаге чумы. Паразитология. 1990;24(3):186–92. Verzhutskiy D.B., Zonov G.B., Popov V.V. Epizootological role of fleas accumulation in aggregations of females of long-tailed souslic in the Tuva plague focus. Parasitology. 1990;24(3):186–92. (in Russian)
- Вержуцкий Д.Б., Ткаченко В.А., Попов В.В., Колосов В.М. О сохранении возбудителя чумы в Тувинском природном очаге. Журнал инфекционной патологии. 2003;10(4):31–2.
- Verzhutskiy D.B., Tkachenko V.A., Popov V.V., Kolosov V.M. On the preservation of the causative agent of the plague in the Tuva natural focus. Journal of Infectious Pathology. 2003; 10(3):31–2.
- Вержуцкий Д.Б., Холин А.В., Климов В.Т. и др. Эпизоотическая активность Тувинского очага чумы и ее особенности на современном этапе. В кн.: Актуальные проблемы болезней, общих для человека и животных. Ставрополь;2017:14–6. Verzhutskiy D.B., Kholin A.V., Klimov V.T., et al. Epizootic activity of the Tuva plague focus and its features at the present stage. In: Actual Problems of Diseases Common to Humans and Animals: Materials of the All-Russian Scientific and Practical Conference. Stavropol';2017:14–6.
- Балахонов С.В. Результаты скрининга плазмид штаммов Yersinia pestis из разных очагов Центральноазиатской зоны природной очаговости. Молекулярная генетика, микробиология и вирусология. 1989;4:39–42. Balakhonov S.V. Results of plasmid screening of Yersinia pestis strains isolated from different focuses in central Asian zone of plague natural focality. Molecular Genetics, Microbiology and Virology. 1989;4:39–42.
- Афанасьев М.В., Балахонов С.В., Токмакова Е.Г. и др. Анализ нуклеотидной последовательности криптической плазмиды рТР33 Yersinia pestis из Тувинского природного очага чумы. Генетика. 2016; 52(9):1012–20. Afanas'ev M.V., Balakhonov S.V., Tokmakova E.G., et al. Analysis of Complete sequence of cryptic plasmid pTP33 from Yersinia pestis isolated in Tuva natural focus of plague. Russian Journal of Genetics. 2016;52(9):899–906. DOI: https://doi.org/10.1134/S1022795416090027 EDN: https://elibrary.ru/xfhuvn
- Базанова Л.П., Жовтый И.Ф., Маевский М.П., Климов В.Т., Попков А.Ф. Сезонная динамика блокообразования у блохи Citellophilus tesquorum altaicus из Тувинского природного очага чумы. Медицинская паразитология и паразитарные болезни. 1991;(1):24–6. Bazanova L.P., Zhovtyy I.F., Maevskiy M.P., Klimov V.T., Popkov A.F. The seasonal dynamics of blocking in the flea Citellophorus tesquorum altaicus from the Tuva natural plague focus. Medical Parasitology and Parasitic Diseases. 1991;(1):24–6.
- Маевский М.П., Базанова Л.П., Коннов Н.П. и др. Изменчивость Yersinia pestis в организме блохи. Журнал микробиологии, эпидемиологии и иммунобиологии. 1994;71(3):16–21. Maevskiy M.P., Bazanova L.P., Konnov N.P., et al. Variabilitiy of Yersinia pestis in the body of fleas. Journal of Microbiology, Epidemiology and Immunobiology. 1994;71(3):16–21.
- Базанова Л.П., Никитин А.Я., Маевский М.П. Сохранение возбудителя чумы в зимний период самками и самцами Citellophilus tesquorum altaicus. Медицинская паразитология и паразитарные болезни. 2007;4:34–6. Bazanova L.P., Nikitin A.Ya., Maeyevsky M.P. Conservation of Yersinia pestis in winter by Citellophilus tesquorum altaicus females and males. Medical Parasitology and Parasitic Diseases. 2007;4:34–6. EDN: https://elibrary.ru/iizrgf
- Бибикова В.А., Классовский Л.Н. Передача чумы блохами. М.; 1974. Bibikova V.A., Klassovskiy L.N. Plague Transmission by Fleas. Moscow; 1974.
- Осипова С.П., Ёлкин Ю.М., Розанова Г.Н. О роли Ceratophyllus tesquorum в поддержании энзоотии чумы на Кавказе. В кн.: Особо опасные инфекции на Кавказе: Тезисы докладов IV Краевой научно-практической конференции по природной очаговости, эпидемиологии и профилактике особо опасных инфекционных болезней. Ставрополь; 1978:247–50. Osipova S.P., Yolkin Yu.M., Pozanova G.N. On the role of Ceratophyllus tesquorum in the maintenance of plague enzootia in the Caucasus. In: Particularly Dangerous Infections in the Caucasus: Proceedings of the IV Regional Scientific-Practical Conference on Natural Focality, Epidemiology and Prevention of Especially Dangerous Infectious. Stavropol'; 1978:247–50.
- Гражданов А.К., Жаринова Л.К., Кожамкулов Е.У. О влиянии возбудителя чумы на продолжительность жизни блох Ceratophyllus tesquorum. В кн.: Материалы VII научной конференции противочумных учреждений Средней Азии и Казахстана. Алма-Ата; 1971:113–4. Grazhdanov A.K., Zharinova L.K., Kozhamkulov E.U. On the effect of the plague pathogen on the life expectancy of fleas Ceratophyllus tesquorum. In: Proceedings of the VII Scientific Conference of Anti-Plague Institutions of Central Asia and Kazakhstan. Alma-Ata; 1971:113–4.
- Воронова Г.А., Крюков И.Л. Влияние температуры и условий питания на блокообразование и сохранение чумного микроба в блохах Ceratophyllus tesquorum altaicus Ioff. В кн.: Международные и национальные аспекты эпиднадзора при чуме: материалы международной научной конференции. Часть 2. Иркутск; 1975:98–102. Voronova G.A., Kryukov I.L. The influence of temperature and food conditions on the block formation and preservation of the plague microbe in fleas Ceratophyllus tesquorum altaicus Ioff. In: International and National Aspects of Plague Surveillance: Proceedings of the International Scientific Conference. Part 2. Irkutsk; 1975:98–102
- Базанова Л.П., Никитин А.Я., Галацевич Н.Ф. Влияние температурного фактора на векторную способность блохи Citellophilus tesquorum altaicus. Медицинская паразитология и паразитарные болезни. 2003;(3):24–7. Bazanova L.P., Nikitin A.Ya., Galatsevich N.F. Influence of a temperature factor on the vector capacity of the flea Citellophilus tesquorum altaicus. Medical Parasitology and Parasitic Diseases. 2003;(3):24–7.
- Bland D.M., Hinnebusch B.J. Feeding behavior modulates biofilm-mediated transmission of Yersinia pestis by the cat flea, Ctenocephalides felis. PLoS Negl. Trop. Dis. 2016;10(2):e0004413. DOI: https://doi.org/10.1371/journal.pntd.0004413
- Bontemps-Gallo S., Fernandez M., Dewitte A., et al. Nutrient depletion may trigger the Yersinia pestis OmpR-EnvZ regulatory system to promote flea-borne plague transmission. Mol. Microbiol. 2019;112(5):1471–82. DOI: https://doi.org/10.1111/mmi.14372
- Базанова Л.П., Токмакова Е.Г. Влияние условий опыта на формирование биопленки у чумного микроба в организме блохи Citellophilus tesquorum altaicus. In: 21th International Scientific Conference "Current Issues on Zoonotic Diseases. Улан-Батор; 2015:85–91. Bazanova L.P., Tokmakova E.G. The impact of experimental conditions on plague microbe’s biofilm formation in organism of flea Citellophilus tesquorum altaicus. In: 21th International Scientific Conference "Current Issues on Zoonotic Diseases. Ulaanbaatar; 2015:85–91.
- Sun Y.C., Koumoutsi A., Jarrett C., et al. Differential control of Yersinia pestis biofilm formation in vitro and in the flea vector by two c-di-GMP diguanylate cyclases. PLoS One. 2011;6(4):e19267. DOI: https://doi.org/10.1371/journal.pone.0019267
- Lemon A., Sagawa J., Gravelle K., Vadyvaloo V. Biovar related differences apparent in the flea foregut colonization phenotype of distinct Yersinia pestis strains do not impact transmission efficiency. Parasit. Vectors. 2020;13(1):335. DOI: https://doi.org/10.1186/s13071-020-04207-x
Supplementary files