Assessment of changes in the phenotype, intensity of degranulation, death and lysis of neutrophils in ex vivo modeling of Staphylococcal bacteremia
- Authors: Kravtsov A.L.1, Bugorkova S.A.1, Klyueva S.N.1, Shmelkova T.P.1, Kozhevnikov V.A.1
-
Affiliations:
- Russian Research Anti-Plague Institute "Microbe"
- Issue: Vol 100, No 4 (2023)
- Pages: 293-305
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/7269
- DOI: https://doi.org/10.36233/0372-9311-384
- EDN: https://elibrary.ru/qgughr
- ID: 7269
Cite item
Full Text
Abstract
Introduction. At present, it is important to study the interaction of Staphylococcus aureus with human innate immunity cells under conditions of ex vivo bacteremia modeling, but not only in experiments with phagocytes previously isolated from the blood.
Purpose: comparative assessment of changes in the phenotype, intensity of aurophilic degranulation, death and lysis of neutrophils in whole blood samples from apparently healthy donors following the addition of live and killed microbial cells of S. aureus ATCC 6538 (209-P).
Materials and methods. Bacteremia was modeled by adding microbes to whole blood (with heparin) at doses ranging from 108 to 101 mc/ml. The bactericidal effect was determined at different time points of blood incubation at 37°C (for 6 hours) by the microbiological method. The blood leukocyte immunophenotyping was performed using flow cytometry according to the Lyse/No-Wash protocol to determine the expression of markers of azurophilic degranulation (CD63), early apoptosis (CD95) on the surface of neutrophilic granulocytes (NG) and cell adhesion (CD62L), as well as to assess the surface expression density of the molecular trigger of netosis FcᵧRIIIb (CD16) and tyrosine protein phosphatase (CD45), which is a regulator of FcR-mediated cell signaling during phagocytosis and netosis. The presence of degenerative changes in NG was confirmed by microscopy in the analysis of blood smears stained according to Romanovsky–Giemsa.
Results. Significant differences were revealed in the response of human blood NG to live and killed S. aureus cells according to the studied phenotypic parameters. Only live microbes triggered azurophilic degranulation in NCs and stimulated, starting from 2 h incubation, the appearance of a large number of NG with the CD95+ phenotype in the blood. In addition, live bacteria induced in phagocytes twice as much functional rearrangement in terms of CD45 expression. They induced a rapid decrease in the density of CD16 expression on NG and activated NG lysis in the blood with an intensity depending on the initial microbial concentration. Following 6 h incubation at concentrations of more than 105 mc/ml, flow cytometry detected the presence in the blood of a population of low density neutrophils characteristic of sepsis (Low Density Neutrophils — with the CD63+CD16low phenotype), whose cells are prone to spontaneous autolysis (netosis).
Conclusion. Under the conditions of ex vivo modeling of bacteremia, various strategies of human blood neutrophils in the implementation of the mechanisms of protection of the macroorganism from infection were evaluated, and the prospects of using the obtained information to identify individuals at high risk of developing staphylococcal sepsis were determined.
Full Text
Введение
Актуальной проблемой медицины по-прежнему является сепсис — тяжёлое патологическое состояние, сопровождающееся нахождением различного рода патогенов (бактерии, вирусы или грибы) в крови. При критически тяжёлой форме проявления сепсиса (септический шок) диссеминированное внутрисосудистое свёртывание крови приводит к смерти каждого второго пациента в результате формирования полиорганной недостаточности на фоне прогрессирующих нарушений в системе гемостаза [1]. Однако единой патофизиологической концепции септического шока не существует, что объясняют недостаточной изученностью сложных молекулярных механизмов развития синдрома системного воспалительного ответа [2, 3], в том числе различных механизмов программируемой клеточной гибели (апоптоз, нетоз, некроптоз и др.), используемых нейтрофильными гранулоцитами (НГ) периферической крови для защиты от патогенных микроорганизмов и имеющих первостепенное значение для разрешения воспаления [4].
Моделировать синдром системного воспалительного ответа можно «в стерильных условиях» путём введения животным гепарансульфата, который является мощным эндогенным триггером воспаления, высвобождаемым из внеклеточного матрикса эндотелия сосудов под влиянием протеолитического эффекта лейкоцитарной эластазы, или непосредственно лейкоцитарной эластазы [5]. С другой стороны, синдром системного воспалительного ответа индуцируют патогенные микроорганизмы и/или их структурные компоненты, способные запускать в организме процессы массивной секреторной дегрануляции, гибели и лизиса нейтрофилов периферической крови с высвобождением из первичных гранул этих клеток огромного количества молекул лейкоцитарной эластазы в плазму [6, 7], что при инфекциях может играть решающую роль в развитии синдрома диссеминированного внутрисосудистого свёртывания крови и септического шока [8, 9].
Циркуляция бактерий в кровяном русле без клинических симптомов обозначается как бактериемия, которая является вероятным, но не обязательным диагностическим признаком сепсиса [10, 11]. Однако в крови больных сепсисом обязательно отмечается специфическая реакция НГ в виде появления особой популяции НГ низкой плотности (low density neutrophils — LDNs) [12], клетки которой характеризуются сниженной степенью гранулярности цитоплазмы в результате развития в них интенсивной азурофильной дегрануляции, имеют провоспалительный (пронетотический) фенотип и склонны к спонтанному аутолизису (нетозу) [13, 14]. Присутствие LDNs, большого числа нейтрофильных внеклеточных ловушек (neutrophil extracellular traps — NETs) и молекул лейкоцитарной эластазы в периферической крови пациентов коррелирует с гиперкоагуляцией и развитием тяжёлых форм бактериального или вирусного сепсиса [7, 9, 12, 15].
Для прогнозирования инфекционных осложнений по появлению и увеличению количества в крови клеток популяции LDNs с изменёнными фенотипическими свойствами (экспрессия СD63 и как минимум вдвое сниженный уровень экспрессии CD16) в последние годы применяется технология импульсной проточной цитометрии [13, 14]. По нашим данным, при иммунофенотипировании лейкоцитов по протоколу Lyse/No Wash цитометрический анализ позволяет не только количественно оценивать в микрообъёмах цельной крови пациентов изменения фенотипа и дегрануляцию нейтрофилов, но и контролировать интенсивность процесса лейкоцитолиза [16]. Однако на модели бактериемии ex vivo с использованием живых инфекционных агентов, являющихся наиболее эффективными индукторами нетоза и защитной воспалительной реакции, такие исследования не проводились.
Целью настоящей работы явилась сравнительная оценка изменений фенотипа, а также интенсивности азурофильной дегрануляции, гибели и лизиса нейтрофилов, в образцах цельной крови от условно здоровых доноров при добавлении живых и убитых микробных клеток Staphylococcus aureus АТСС 6538 (209-P).
Материалы и методы
В исследованиях использовали тест-штамм S. aureus АТСС 6538 (209-P) из Государственной коллекции патогенных бактерий (Российский противочумный институт «Микроб»). Суточные культуры S. aureus выращивали на агаре Хоттингера (рН 7,2) и в стерильном фосфатно-солевом буфере (рН 7,4) с 0,9% NaCl готовили по стандартному образцу мутности ОСО 42-28-59-85П взвеси живых бактерий с концентрацией 109 м.к./мл, из которых путём последовательного разведения 0,9% NaCl получали микробные взвеси более низкой концентрации 108–102 м.к./мл. Для получения взвесей убитых бактерий живые микробы обеззараживали в течение 80 мин нагреванием на водяной бане при 60оС [17].
Для опытов ex vivo кровь получали из локтевой вены 10 условно здоровых добровольцев мужского и женского пола в возрасте 23–30 лет на основании оформленного добровольного информированного согласия. Кровь забирали в объёме 5–9 мл в пробирки с антикоагулянтом (гепарином) и использовали в течение 1–2 ч. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Этическим комитетом Российского научно-исследовательского противочумного института «Микроб» (протокол № 15 от 10.11.2021).
Для моделирования бактериемии на 1 мл крови, содержащий в среднем около 2 × 106 фагоцитов, добавляли 100 мкл исследуемой взвеси бактерий. Для взвесей с концентрацией от 109–102 м.к./мл 0,9% NaCl это соответствовало концентрациям 108–101 м.к./мл крови или исходным микробным нагрузкам (числу бактерий : фагоцит), равным в среднем около 50 : 1, 5 : 1, 1 : 2, 1 : 20, 1 : 200, 1 : 2000, 1 : 20 000, 1 : 200 000.
Сравнительную оценку исследуемых в работе показателей проводили в условиях добавления в кровь живых или убитых бактерий в основном при микробной нагрузке 50 : 1, обычно используемой для оценки in vitro фагоцитарной активности гранулоцитов крови человека по отношению к S. aureus [17]. Кровь с бактериями помещали в термостат с температурой 37оС и инкубировали при перемешивании на шуттель-аппарате в течение 6 ч. Контролем служили образцы, инкубируемые в течение 6 ч без бактерий, в которые добавляли по 100 мкл стерильного 0,9% NaCl на 1 мл крови [18].
Иммунофенотипирование лейкоцитов в исследуемых образцах крови для проточно-цитофлуориметрического анализа осуществляли по протоколу Lyse/No-Wash1 с использованием меченых мышиных моноклональных антител к антигенам лейкоцитов крови человека («Backman Coulter»): СD45-FITC, CD63-PE, CD62L-ECD, CD45-PC5, CD16-FITC, CD95-PE, CD38-APC. Гранулоциты идентифицировали по степени их внутриклеточной гранулярности (интенсивности бокового светорассеяния) и по экспрессии общего лейкоцитарного антигена (СD45). В гейте гранулоцитов НГ подсчитывали как фагоциты с высокой экспрессией FcᵧR IIIb (CD16) на клеточной поверхности [14]. Изменения в плотности экспрессии СD45 и CD16 на клетку регистрировали в неоднородных популяциях нейтрофилов крови как повышение (или снижение) среднего значения интенсивности клеточной флуоресценции (mean fluorescence intensity — MFI), количественно измеряемой в условных единицах (каналах цитометра) [16]. Кроме того, в крови определяли относительное содержание НГ, положительных по экспрессии поверхностных маркеров азурофильной дегрануляции (CD63+), раннего апоптоза (СD95+) и клеточной адгезии (СD62L+) [19]. Результаты иммунофенотипирования учитывали для каждого опытного и контрольного образца крови в динамике: через 30 мин, 1, 2, 4, 6 ч инкубации. В гейте лимфоцитов через 6 ч определяли долю активированных иммунокомпетентных клеток, имеющих фенотип CD38+.
Количество в крови живых клеток S. aureus устанавливали на каждый срок микробиологическим методом [17], основанным на смешивании 10 мкл крови с 1 мл дистиллированной воды для осмотического лизиса в течение 30 с лейкоцитов и эритроцитов. Из смеси готовили через 30 с последовательные десятикратные разведения в 0,9% NaCl клеточных лизатов, содержащих бактерии и разведённую водой плазму, для высева на чашки с агаром Хоттингера (рН 7,2) и подсчёта через сутки в каждом из этих высевов числа выросших колоний стафилококка (КОЕ). Определяли долю выживших в крови бактерий в различные сроки инкубации для оценки интенсивности и динамики развития ex vivo бактерицидного эффекта. Способность стафилококка выживать в крови в зависимости от исходной микробной концентрации оценивали по наличию (или отсутствию) КОЕ через 6 ч инкубации.
Активацию внутриклеточного кислородзависимого метаболизма в НГ регистрировали с использованием изначально нефлуоресцирующего красителя дихлорофлуоресцеина диацетата, который, пассивно проникая в клетки, превращается в накапливающееся в цитоплазме флуоресцирующее соединение под влиянием образующейся при «кислородном взрыве» перекиси водорода. Реакцию ставили в опытах с кровью, обсеменённой S. aureus, путём смешивания её с рабочим раствором дихлорофлуоресцеина диацетата (10 мкМ). Образцы инкубировали 30 мин при 37оС. По окончании инкубации проводили лизис эритроцитов и фиксацию лейкоцитов в FACS Lysing Solution («BD Biosciences»). Результат учитывали, измеряя методом проточной цитометрии в гейте гранулоцитов MFI в зелёной области спектра. Степень стимуляции фагоцитов по уровню генерации активных форм кислорода выражали в сравнении с контролем в виде коэффициента стимуляции [20]. Функциональную неоднородность популяции гранулоцитов по исследуемому показателю характеризовали значением коэффициента вариации (%).
Дегрануляцию нейтрофилов оценивали по поверхностной экспрессии клетками фенотипического маркера азурофильной дегрануляции CD63 [13] и по снижению показателя внутриклеточной гранулярности (бокового светорассеяния) [16]. Кроме того, с 30-минутным интервалом контролировали в течение 6 ч состояние мембран лизосомальных гранул фагоцитов с помощью суправитальной окраски клеток в образцах цельной крови флуорохромом акридиновым оранжевым [21]. Нарушение стабильности в НГ первичных (бактерицидных) гранул, несущих активность ферментов эластазы и миелопероксидазы, регистрировали методом проточной цитофлуориметрии как утрату способности этих гранул аккумулировать в цитоплазме большое количество молекул акридинового оранжевого, флуоресцирующих в красной области спектра [22, 23].
Интенсивность лизиса нейтрофилов количественно оценивали методом проточной цитометрии по снижению относительного количества гранулоцитов в образцах цельной периферической крови, а также по сопутствующему ему увеличению доли в суммарной лейкоцитарной популяции разрушенных фагоцитов, регистрируемых цитометром в области клеточного дебриса [16]. Данные об интенсивности лейкоцитолиза и содержании в крови через 6 ч инкубации LDNs с пронетотическим фенотипом (CD16low [13, 14]) сопоставляли при различных исходных микробных нагрузках с результатами микробиологического анализа.
Наличие в клетках дегенеративных изменений подтверждали путём исследования фиксированных 96% этанолом и окрашенных по Романовскому–Гимзе мазков крови на микроскопе «Olympus CX41» («Olympus») с цифровой камерой «VZ-C31S» («VideoZavr») в программе «VideoZavr v. 1.5». Индексы дегенерации нейтрофилов оценивали как долю НГ с морфологическими признаками нетоза и/или некроптоза при микроскопическом анализе около 200 отдельных лейкоцитов. Детекцию эритроцитов с изменённой клеточной морфологией проводили в 5 полях зрения, где учитывали результаты анализа не менее 600 клеточных элементов [24].
Для оценки показателей светорассеяния и MFI меченных CD-маркерами лейкоцитов крови в работе использовали проточный цитометр «DakoCytomation» с программным обеспечением «Summit v.4.3 Built 2445» [16]. Эксперименты с лейкоцитами, окрашенными в крови флуорохромом акридиновым оранжевым, проводили на двухканальном ламповом проточном цитофлуориметре «ICP22 PHYWE», не имеющем каналов светорассеяния [23].
Полученные экспериментальные данные статистически обрабатывали с использованием стандартного пакета программ «Microsoft Office Excel 2016», «Statistica 10.0» («StatSoft Inc.»). Их представляли в виде медианы (Me) и квартильных отклонений (Q25–Q75) с расчётом достоверности различий в исследуемых группах с использованием U-критерия Манна–Уитни. Связи между показателями оценивали с помощью коэффициента ранговой корреляции Спирмена. Значение р < 0,05 считали статистически значимым.
Результаты
При отсутствии в крови бактерий в среднем около 10% гранулоцитов спонтанно генерировало активные формы кислорода в системе НАДФН-оксидазы. Живые и убитые клетки исследуемого штамма S. aureus, попадая в кровь, стимулировали через 30 мин кислородзависимый метаболизм около 70 и 90% гранулоцитов соответственно. Вариация интенсивности функциональной активации отдельных фагоцитов по уровню продукции активных форм кислорода была при этом вдвое выше в ответ на живые, чем на убитые клетки S. aureus (табл. 1).
Таблица 1. Показатели индуцированного бактериями кислородзависимого метаболизма НГ в крови, обсеменённой живыми и убитыми клетками S. aureus, в сравнении с показателями спонтанной реакции в контроле, Ме (Q25–Q75)
Table 1. Indicators of neutrophilic granulocyte bacteria-induced oxygen-dependent metabolism in blood contaminated with live and dead Staphylococcus aureus cells in comparison with indicators of spontaneous reaction in control, Ме (Q25–Q75)
Группа Group | Тип реакции Type of reaction | Активность, % Activity, % | Интенсивность, усл. ед. Intensity, rel. units | Коэффициент вариации, % Сoefficient of variation, % | Индекс стимуляции, усл. ед. Index of stimulation, rel. units |
Контроль Control | Спонтанная Spontaneous | 9,8 (6–13) | 23 (18–26 ) | 19 (17–23) | – |
Живые клетки Live cells | Индуцированная Induced | 68 (61–75)*# | 97 (90–110)* | 47 (39–50)*# | 6,8 |
Убитые клетки Dead cells | Индуцированная Induced | 91 (85–94)* | 88 (83–102)* | 24 (18–30) | 9,1 |
Примечание. *р < 0,05 по сравнению с контролем; #р < 0,05 по сравнению с убитыми клетками.
Note. *р < 0.05 in comparison with the control; #р < 0.05 in comparison with dead cells.
При контакте в крови с живыми бактериями на поверхности НГ уже через 30 мин в 4,3 раза повышалась и сохранялась повышенной в течение 6 ч плотность экспрессии тирозиновой протеинфосфатазы (общего лейкоцитарного антигена СD45), в то время как убитые микробы индуцировали повышение поверхностной экспрессии CD45 только в 2,2 раза (табл. 2). Функциональная активация клеток врождённого иммунитета в опытных образцах крови по данному параметру выглядела в сравнении с контролем как смещение популяции гранулоцитов (региона R8 на цитограмме б; рис. 1) вправо по оси абсцисс — в область более высоких значений плотности экспрессии антигена CD45, характерных для лимфоцитов периферической крови. Кроме того, через 30 мин в крови, обсеменённой живыми и убитыми клетками S. aureus, увеличивалась на 15% плотность экспрессии FcᵧR IIIb (CD16) на НГ и снижалась доля нейтрофилов с фенотипом CD62L+ в среднем на 22% (табл. 2).
Таблица 2. Результаты оценки изменений фенотипа нейтрофилов при моделировании стафилококковой бактериемии в зависимости от срока инкубации крови и жизнеспособности бактерий, Ме (Q25–Q75)
Table 2. The results of neutrophils phenotype changes estimation in the modeling of staphylococcal bacteremia, depending on the duration of blood incubation and the bacterial viability, Ме (Q25–Q75)
Показатель Parameter | Группа Group | Значения в различные сроки инкубации (мин) Values at different time points of incubation (min) | ||||
30 | 60 | 120 | 240 | 360 | ||
Экспрессия | Expression | ||||||
СD45, MFI | Контроль | Control | 11,6 (10,2–13,4) | 12,4 (10,6–5,0) | 17,1 (14,5 –18,8) | 22 (20,2–24,4) | 23,4 (20,6–25) |
Живые клетки | Live cells | 50,4 (46–55,5)*# | 56 (52,4–8,7)*# | 48,3 (46,2–1,8)*# | 66 (61,2–71,4)*# | 67 (63,4–70)*# | |
Убитые клетки | Dead cells | 27 (21,3–32,0)* | 34 (30,3–37,4)* | 36 (32,5–40,2)* | 39 (37,8–41,6)* | 38 (36,8–40,3)* | |
CD16, MFI | Контроль | Control | 286 (263–296) | 292 (288–300) | 304 (286–318) | 324 (306–340) | 335 (322–350) |
Живые клетки | Live cells | 330 (316–344)* | 228 (201–67)*# | 148 (144–152)*# | 46 (41–50)*# | 37 (35–48)*# | |
Убитые клетки | Dead cells | 336 (323–342)* | 299 (288–315) | 296 (283–314) | 310 (292–326) | 300 (286–338) | |
Доля | Share | ||||||
CD62L+, % | Контроль | Control | 41 (40,4–41,5) | 41 (40,2–41,6) | 45 (43,7–46,6) | 34 (31,3–37,1) | 32 (30,2–34,6) |
Живые клетки | Live cells | 32 (30,8–33,6)* | 32 (31,1–33,4)* | 33 (31,3–33,8)* | 31 (30,2–32,4) | 32 (31,3–31,9) | |
Убитые клетки | Dead cells | 34 (33,4–34,5)* | 27 (26,6–27,7)* | 26 (24,2–27,3)* | 27 (26,3–27,8)* | 23 (21,5–26,6)* | |
CD63+, % | Контроль | Control | 10 (8,8–11,6) | 10 (9,2–13,8) | 14 (11,4– 16,3) | 17 (15,5–19,7) | 18 (16,3–21,4) |
Живые клетки | Live cells | 18 (17,2–19,0)*# | 35 (34,5–5,7)*# | 70 (67–72,4)*# | 83 (74,5–93)*# | 79 (68,4–90,2)*# | |
Убитые клетки | Dead cells | 12 (10,3–14,3) | 13 (10,6–14,1) | 15 (14,4–15,7) | 19 (18,3–19,8) | 19 (18,5–20,7) | |
CD95+, % | Контроль | Control | 4 (2,7–8,4) | 6 (5,5–6,6) | 29 (24,2–33,7) | 54 (48,4–60,4) | 57 (51,2–63,3) |
Живые клетки | Live cells | 18 (17,4–19,5)*# | 46 (43,4–1,1)*# | 80 (78,2–82,8)*# | 65 (63,3–66,5)*# | 66 (62–70)*# | |
Убитые клетки | Dead cells | 6 (4,3–9,7) | 10 (8,8–11,7)* | 32 (28,2–35,5) | 70 (68–72,2)* | 80 (78,5–81,7) | |
Примечание. *р < 0,05 по сравнению с контролем; #р < 0,05 по сравнению с убитыми клетками.
Note. *р < 0.05 in comparison with the control; #р < 0.05 in comparison with dead cells.
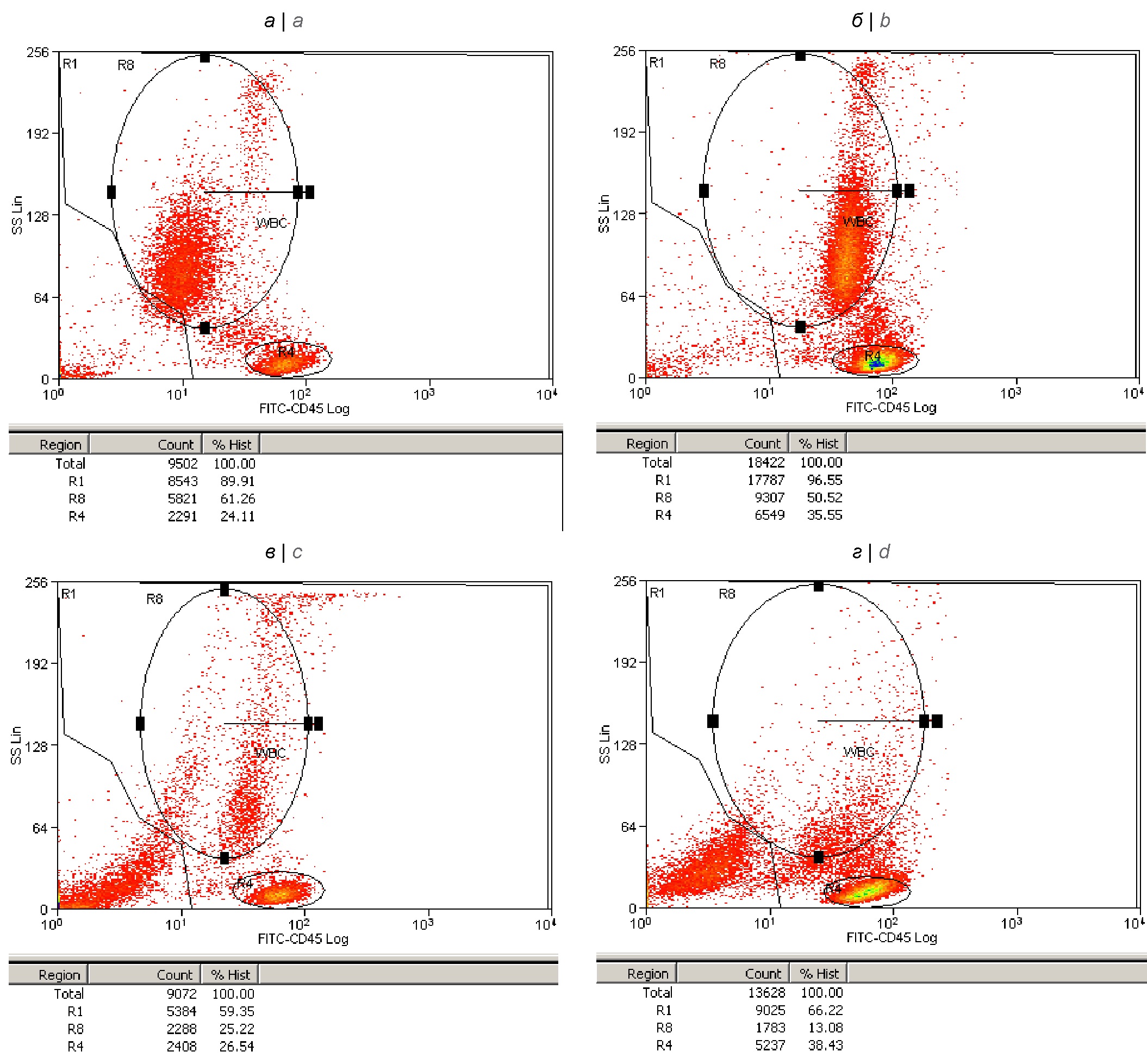
Рис. 1. Функциональная активация по экспрессии тирозиновой протеинфосфатазы (CD45), дегрануляция и лизис НГ в крови, обсеменённой живыми клетками S. aureus.
Цитограммы распределений лейкоцитов крови по степени гранулярности (боковому светорассеянию, SS) и уровню поверхностной экспрессии СD45 получены через 30 мин после добавления в кровь 0,9% NaCl — контроль (а), а также после добавления живых клеток S. aureus в дозе 108 м.к./мл — через 30 мин (б), 2 ч (в) и 4 ч (г).
В области R1 локализуются неповреждённые лимфоциты, моноциты и гранулоциты. В регионе R8 — гранулоциты, которые через 30 мин активированы по экспрессии CD45 (на цитограмме б), а затем переходят в состояния различной степени дегрануляции и аутолизиса (на цитограммах в и г). За пределами области R1 на каждой цитограмме учитываются сигналы от клеточного дебриса — лизированных нейтрофилов. Доля неповреждённых нейтрофилов снижалась в крови (в регионе R8) к 4 ч до 13% с исходного значения 61,3% в контроле.
Fig. 1. Functional activation by expression of tyrosine protein phosphatase (CD45), degranulation and lysis of neutrophilic granulocytes in blood contaminated with live S. aureus
Cytograms of distributions of blood leukocytes according to the degree of granularity (side light scattering, SS) and the level of surface expression of CD45 were obtained 30 minutes after the addition of PBS-control (a) to the blood, and also after addition of live S. aureus cells at a dose of 108 mc/ml: 30 minutes (b), 2 hours (c) and 4 hours (d).
In the R1 region, intact lymphocytes, monocytes and granulocytes are localized. In the R8 region, granulocytes are activated after 30 min by CD45 expression (on cytogram b), and then go into states with varying degrees of their degranulation and autolysis (on cytograms c and d). Outside the R1 region, each cytogram takes into account signals from cellular debris — lysed neutrophils. The proportion of neutrophils decreased in the blood (in R8 region) by 4 hours to 13% from the initial value of 61.3% in the control.
Убитый стафилококк не индуцировал в течение 6 ч развития азурофильной дегрануляции в нейтрофилах цельной крови человека, в то время как в крови тех же доноров, обсеменённой живыми микробами, доля функционально активированных НГ с фенотипом CD63+ увеличивалась в 1,8 раза через 30 мин, в 3 раза через 1 ч (до 35%) и достигала максимума к 4 ч инкубации (табл. 2), когда в 80% гранулоцитов полностью нарушалась стабильность мембран бактерицидных гранул с активностью эластазы и миелопероксидазы (рис. 2 и рис. 1, г).
Рис. 2. Динамика нарушения стабильности мембран бактерицидных гранул в НГ, осуществляющих киллинг в крови S. aureus.
На каждой из 6 гистограмм представлено частотное распределение 30 000 лейкоцитов цельной крови человека по интенсивности красной флуоресценции цитоплазматических лизосомальных гранул в условных единицах (каналах цитометра от 10 до 256 по оси абсцисс) после суправитальной окраски акридиновым оранжевым. По оси ординат — количество клеток на канал от 0 до 1000.
Два пика соответствуют лимфоцитам (слева) и гранулоцитам (справа). Краситель в большом количестве аккумулировался и удерживался гранулами фагоцитов в своей заряженной флуоресцирующей форме (АОН+) за счёт непрерывного перекачивания протонов Н+ через неповреждённые мембраны лизосом живых клеток, что позволяло дифференцировать гранулоциты (около 60% лейкоцитов крови) по их интенсивной красной флуоресценции от лимфоцитов [21]. К 4 ч в гранулоцитах крови, взаимодействующих только с живым стафилококком, нарушалась стабильность мембран бактерицидных гранул, и клетки утрачивали свою интенсивную флуоресценцию в красной области спектра.
Fig. 2. Dynamics of bactericidal granules membrane stability disturbance in neutrophilic granulocytes that carry out the killing of S. aureus in the blood.
Each of 6 histograms shows the frequency distribution of 30,000 human whole blood leukocytes according to the intensity of red fluorescence of cytoplasmic lysosomal granules after supravital staining with acridine orange in arbitrary units (cytometer channels from 10 to 256 along the abscissa axis). The y-axis shows the number of cells per channel from 0 to 1000. Two peaks correspond to lymphocytes (left) and granulocytes (right). The dye was accumulated in large quantities and retained in phagocyte granules in its charged fluorescent form (AOH+) due to the continuous pumping of H+ protons through intact lysosome membranes of living cells, which made it possible to differentiate granulocytes (about 60% of blood leukocytes) by their intense red fluorescence from lymphocytes [21]. By 4 h, in blood granulocytes interacting only with live staphylococcus, the stability of bactericidal granule membranes was disturbed, and these cells lost their intense fluorescence in the red region of the spectrum.
На фоне отсутствия реакции со стороны бактерицидных гранул нейтрофилов в крови, обсеменённой убитыми бактериями, плотность экспрессии CD16 на поверхности фагоцитов после 15% повышения через 30 мин фактически не менялась вплоть до 6 ч инкубации. При взаимодействии с живыми клетками S. aureus экспрессия FcᵧR IIIb (CD16) на НГ существенно снижались: на 30% через 1 ч, вдвое — через 2 ч, в 9 раз — к 6 ч инкубации. На поверхности около 80% нейтрофилов живой стафилококк индуцировал к 2 ч экспрессию фенотипического маркера раннего апоптоза, в то время как доля НГ с фенотипом CD95+ в контроле и пробах с убитыми бактериями была в этот срок около 30%. При дальнейшей инкубации крови, обсеменённой живыми микробами, доля НГ с фенотипом CD95+ снижалась (табл. 2). В интервале времени от 4 до 6 ч, когда в подавляющем числе НГ полностью завершался процесс азурофильной дегрануляции, активировался лизис этих клеток в условиях моделирования ex vivo стафилококковой бактериемии, что проявлялось в максимальном снижении относительного количества гранулоцитов и повышении содержания клеточного дебриса в образцах крови с живыми бактериями (рис. 1, г). В присутствии убитых клеток S. aureus лизиса НГ в крови не регистрировали с помощью как микроскопии, так и проточной цитометрии (табл. 3).
Таблица 3. Интенсивность фенотипических и дегенеративных изменений в гранулоцитах крови человека при моделировании ex vivo стафилококковой бактериемии в зависимости от исходной микробной концентрации
Table 3. The intensity of phenotype end degenerative changes in human blood granulocytes depending on the initial microbial concentration in ex vivo modeling of staphylococcal bacteremia
Число, м.к./мл Number, mc/ml | Наличие (+) или отсутствие (–) роста Presence (+) or absence (–) of growth | Микроскопия Microscopy | Проточная цитометрия | Flow cytometry | |||
индекс дегенерации, % degeneration index, % | LDNs с фенотипом CD16low, % LDNs with СD16low phenotype, % | CD63+-НГ, % CD63+-NG, % | интенсивность лизиса НГ, % NG lysis intensity, % | клеточный дебрис, % cellular debris, % | ||
108 | + | > 50 | 92,2 (88–96)* | 78,8 (68–90)* | 82 (77–85)* | 33 (28–40)* |
107 | + | < 50 | 36,4 (31–42)* | 40,6 (35–44)* | 37 (31–44)* | 21 (15–25)* |
106 | + | – | 21,4 (19–23)* | 28,2 (23–33)* | 24 (18–31)* | 12 (9–16)* |
105 | + | – | 9,1 (7,5–10,2)* | 20,4 (17–25) | 15 (11–21) | 9,3 (6–10) |
104 | + | – | 6,3 (5,5–7,8) | 18,3 (16–22) | 16 (12–20) | 7,7 (4–9) |
103 | + | – | 6,8 (4,4–8,6) | 19,4 (18–21) | 13 (9 –19) | 7,2 (5–10) |
102 | – | – | 5,9 (3,6–7,6) | 17,7 (15–24) | 15 (8–22) | 6,0 (3–11) |
10 | – | – | 5,6 (3,2–7,3) | 18,6 (16–23) | 12 (10–15) | 5,6 (2–11) |
Контроль Сontrol | – | – | 5,4 (3,3–6,7) | 19 (18,5–20,7) | 13 (8,3–16) | 8,5 (5–12) |
Примечание. СD16low — снижение плотности экспрессии FcᵧR IIIb на НГ до уровня, который более чем вдвое ниже исходного уровня экспрессии в контроле; *р < 0,05 по сравнению с контролем (показатели в крови через 6 ч инкубации без бактерий).
Note. CD16low — a decrease in the expression density of FcᵧR IIIb on NG to a level that is more than two times lower than the initial level of expression in the control. *р < 0.05 in comparison with control (indicators in the blood after 6 hours of incubation without bacteria).
По данным микроскопии, в крови c живыми бактериями присутствовали не только НГ с дегенеративными изменениями в ядрах и цитоплазме, но и морфологически изменённые эритроциты (рис. 3). Причём с момента активации процесса лейкоцитолиза образцы крови с живыми бактериями изменяли свой алый красный цвет на цвет, характерный для гемолиза, но в контроле и в крови с убитыми микробами такие изменения отсутствовали. При морфологическом исследовании выявляли различную интенсивность дегенеративных изменений в НГ при двух самых высоких исходных микробных концентрациях, при которых живых бактерий в крови было больше, чем фагоцитов (50 м.к. и 5 м.к. на фагоцит). Однако адекватной количественной оценки степени различий в образцах при визуальном исследовании мазков крови получено не было, т.к. невозможно было учесть число полностью разрушенных в условиях ex vivo клеточных элементов. Проточная цитометрия с точки зрения детекции дегенеративных изменений в НГ обладала более высокой чувствительностью и информативностью. Представленные в табл. 3 экспериментальные данные свидетельствуют, что при её использовании обеспечивается возможность количественной оценки интенсивности лейкоцитолиза при моделировании ex vivo стафилококковой бактериемии и подсчёта числа LDNs c пронетотическими (провоспалительными) свойствами.
Рис. 3. Дегенеративные изменения в нейтрофилах и эритроцитах, индуцированные в крови человека живыми клетками S. aureus.
Мазки крови (× 400), окрашенные по Романовскому–Гимзе, через 6 ч инкубации с убитыми (а) и живыми (б) клетками S. aureus.
а — сегментоядерный (1) и палочкоядерный (2) нейтрофилы с неповреждённой цитоплазматической мембраной и имеющие нормальную форму эритроциты (дискоциты); б: 1 — нейтрофил на стадии нетоза; 2 — трансформированные эритроциты (эхиноцит и овалоцит).
Fig. 3. Degenerative changes in neutrophils and erythrocytes induced in human blood by live S. aureus.
Blood smears (× 400), stained according to Romanovsky–Giemsa, after 6 hours of incubation with killed (а) and live (b) S. aureus.
a — segmented (1) and stab (2) neutrophils with an intact cytoplasmic membrane and normal shaped erythrocytes (discocytes); b: 1 — neutrophil at the stage of netosis; 2 — transformed erythrocytes (echinocyte and ovalocyte).
Выявлена сильная обратная корреляционная связь между интенсивностью азурофильной дегрануляции нейтрофилов, развивающейся в течение первых 2 ч при моделировании ex vivo стафилококковой бактериемии, и выживаемостью в крови человека клеток исследуемого штамма S. aureus (r = –0,96; p = 0,00001). В этот период времени число КОЕ снижалось в среднем на 70%, но затем, в интервале с 2 до 4 ч, рост S. aureus в крови активировался. После 4 ч число КОЕ в крови снова начинало снижаться и достигало через 6 ч уровня, соответствующего в среднем около 10% от исходного числа КОЕ (рис. 4). При концентрациях S. aureus выше 102 м.к./мл рост бактерий подавлялся в крови исследуемой группы лиц с 90% эффективностью, но полностью не прекращался. Основная масса микробов погибала в крови к 6 ч, не вызывая при нагрузках менее 1 м.к. на фагоцит видимых дегенеративных изменений в НГ условно здоровых доноров. Проточная цитометрия на модели бактериемии ex vivo регистрировала рост относительного содержания LDNs в суммарной популяции гранулоцитов только при увеличении исходной концентрации живых бактерий в крови до 105 м.к./мл и выше (табл. 3).
Рис. 4. Выживаемость S. aureus 209P в крови человека в зависимости от срока инкубации, Ме (Q25–Q75).
Fig. 4. Survival of S. aureus 209P in human blood as a function of incubation time, Ме (Q25–Q75).
Проявляя на модели бактериемии ex vivo свой выраженный активирующий и цитотоксический эффект по отношению к НГ периферической крови, живой стафилококк не оказывал повреждающего воздействия на лимфоциты в исследуемый период времени. Относительное содержание активированных лимфоцитов с фенотипом СD38+ через 6 ч не отличалось в крови, обсеменённой живыми микробами, от аналогичного показателя на этот срок в контроле. Однако оно было ниже, чем в образцах крови с убитыми клетками S. aureus — 19,6% (18,7–21,5%) и 23,3% (22,2–24,2%) соответственно (p < 0,05).
Обсуждение
В России ежегодно регистрируется 25–30 тыс. случаев инфекций кровотока, связанных с оказанием медицинской помощи, в которых этиологическим агентом выступает Staphylococcus spp. Причём условно-патогенный микроорганизм S. aureus является лидером среди приоритетных патогенов инфекций кровотока (15% из общего числа случаев в мире) [11]. Размножаясь в крови пожилых людей, новорождённых, а также лиц с различными иммунодепрессивными состояниями, S. aureus может индуцировать развитие тяжёлой формы бактериального сепсиса с гектической температурой и гнойными проявлениями [24].
Подходы к лечению бактериемии/сепсиса, вызванного S. aureus, имеют низкую доказательность и требуют оптимизации [25]. Недостаточно изучены факторы, влияющие на исход инфекционного процесса при стафилококковой бактериемии [26, 27]. Поскольку S. aureus в организме человека продуцирует ряд специфических факторов вирулентности, понимание, как этот микроорганизм манипулирует иммунной системой организма хозяина, требует детального изучения его взаимодействия с клетками врождённого иммунитета, причём на модели бактериемии ex vivo, а не только в опытах in vitro c предварительно выделенными из крови фагоцитами [18, 28].
Экспериментальные данные, полученные при выполнении настоящей работы, согласуются с выводами исследований Е.Е. Zwack и соавт. [18], в которых путём секвенирования РНК нейтрофилов были обнаружены на модели стафилококковой бактериемии ex vivo выраженные различия в способности живого и убитого нагреванием S. aureus влиять в крови человека на транскрипцию генов, связанных с врождённым иммунным ответом и передачей сигналов от цитокинов и хемокинов. Важно, что транскрипционная сигнатура нейтрофилов, характерная ex vivo для живых клеток S. aureus, полностью отсутствовала в крови с убитым S. aureus, а также при моделировании бактериемии живыми клетками штаммов S. epidermis, которые для человека являются значительно менее вирулентными. Наши исследования на модели стафилококковой бактериемии ex vivo впервые выявили выраженные различия в способности живых и убитых клеток S. aureus изменять экспрессию на поверхности НГ крови человека тирозиновой протеинфосфатазы (CD45), регулирующей FcR-опосредованную передачу сигналов при иммунном фагоцитозе, а также при антителозависимой цитотоксичности нейтрофилов, реализуемой этими клетками при нетозе (аутолизисе НГ) [29].
Только живые клетки S. aureus запускали ex vivo, по данным проведённого нами цитофлуориметрического анализа, секреторную азурофильную дегрануляцию НГ, необходимую для реализации бактерицидного эффекта по отношению к S. aureus и развития защитной воспалительной реакции на месте внедрения этого вида бактерий [30, 31], стимулировали снижение на НГ плотности экспрессии молекулярного триггера нетоза FcᵧRIIIb (CD16) [32], являющееся маркером IgG-зависимой анафилаксии [33], а также индуцировали в крови лизис НГ с интенсивностью, зависящей от исходной микробной концентрации и, как следствие, от микробной нагрузки на фагоцит в образцах цельной периферической крови. Всё это согласуется с выводами исследований В. МcDonald и соавт., в которых in vivo на модели бактериемии/сепсиса у лабораторных животных было экспериментально доказано, что решающую роль в предотвращении диссеминации бактерий (S. aureus и Escherichia coli) и развития инфекционных осложнений играет процесс захвата и обезвреживания микробных клеток в сосудистом русле с помощью ДНК-сетей NETs [27]. Нейтрофилы в большом количестве аккумулировались при бактериемии/сепсисе в микрокапиллярах печени, где кровь с высокой эффективностью очищалась от живых бактерий нейтрофилами и макрофагами (клетками Купфера). В интервале времени 4–6 ч после внутривенного введения животным живых бактерий в периферической крови активировался аутолизис НГ (нетоз), что в 4 раза повышало эффективность их захвата и киллинга в сосудистом русле в сравнении с базовым уровнем, обеспечиваемым только макрофагальным фагоцитозом. Бактерии, полностью или частично обезвреженные в NETs, быстро поглощались и переваривались макрофагами.
Динамика киллинга клеток S. aureus в наших исследованиях ex vivo и установленная в работе корреляционная связь между выживаемостью бактерий в крови и интенсивностью процесса дегрануляции подтверждают, что для обезвреживания этого вида бактерий в крови человека нейтрофилы используют не только фагоцитоз, но и другие антибактериальные стратегии (секреторную дегрануляцию и нетоз). В течение первых 2 ч в крови погибали, видимо, только те бактерии, которые подвергались действию продуктов секреторной дегрануляции НГ и поглощались активными фагоцитами. Устойчивые к фагоцитозу и внутриклеточному киллингу микробы (или микробные агломераты) обезвреживались после 4 ч инкубации, когда в фагоцитах завершалась азурофильная дегрануляция и активировался лизис НГ. Поскольку секреторная дегрануляция НГ и нетоз играют ключевую роль в повреждении тканей, обеспечивая цитотоксические функции [4], задержка этих процессов в условиях in vivo, cвязанная с нарушением фагоцитарной функции НГ при различных иммунодепрессивных состояниях, может приводить к генерализации воспалительного процесса с развитием характерных для сепсиса инфекционных осложнений [8, 15].
По результатам оценки стимуляции в гранулоцитах крови кислородного метаболизма эти клетки в отношении живых бактерий проявляли ex vivo более низкую фагоцитарную активность, чем по отношению к убитому стафилококку. Это можно объяснить агглютинацией коагулазоположительных штаммов S. aureus в образцах цельной периферической крови. Препятствуя фагоцитозу, агглютинация способствует развитию у пациентов c бактериемией тяжёлых инфекционных осложнений, характерных для стафилококкового сепсиса [26]. По данным L. Thomer и соавт., через 60 мин после добавления в кровь живых клеток S. aureus агглютинации подвергалось около 36% бактерий, и только около 64% из них поглощалось фагоцитами [34]. Для обезвреживания в крови устойчивых к фагоцитозу агломератов клеток S. aureus требовалось «включение» через FcR на клеточной поверхности не связанного с фагоцитозом механизма внеклеточной бактерицидности НГ присутствующими в плазме специфическими антителами к вызывающим агглютинацию продуктам секреции S. aureus.
«Выбирать» механизм бактерицидности для киллинга патогенных микроорганизмов (фагоцитоз или нетоз) позволяет наличие на поверхности НГ сенсоров, дифференцирующих по размеру отдельные мелкие бактерии от их крупных агломератов, образующихся в плазме в процессе агглютинации [35]. Живой S. aureus считается самым эффективным индуктором нетоза при взаимодействии с НГ крови человека, но убитые нагреванием клетки S. aureus такой способностью, как известно, не обладают. Ключевую роль в формировании NETs играет белок А, продуцируемый S. aureus во внеклеточное пространство, который препятствует фагоцитозу, связываясь с FcR клеток врождённого иммунитета [36]. Поскольку используемый нами штамм S. aureus имеет ген, кодирующий продукцию белка А [37], выраженные изменения в экспрессии CD16 на клеточной поверхности, зарегистрированные в наших исследованиях на модели бактериемии ex vivo, могут быть связаны с действием этого белка на FcᵧRIIIb клеток первой линии врождённой антибактериальной защиты.
Исследования, проведённые на НГ, предварительно выделенных из периферической крови с помощью градиентного центрифугирования, свидетельствуют, что при фагоцитозе S. aureus в этих клетках запускается механизм индуцируемой бактериями апоптотической гибели, и апоптотические клетки, поглотившие живые микробы, подвергаются к 6 ч инкубации в системе in vitro неизбежному аутолизису (вторичному постапоптотическому некрозу — некроптозу) [19] вследствие отсутствия in vitro макрофагов, необходимых для реализации функции эффероцитоза [8]. По данным, полученным нами на модели стафилококковой бактериемии ex vivo, в крови с живыми клетками S. aureus появлялись НГ с фенотипом CD95+, которые впоследствии подвергались аутолизису. Интенсивный лизис НГ в крови с живыми бактериями, вероятно, был связан как с нетозом, так и с вторичным некрозом активных фагоцитов.
Высокую степень тяжести заболевания и серьёзный прогноз при сепсисе клиницисты предполагают в случаях, когда индексы дегенерации нейтрофилов в крови пациентов более 50% [24]. Наши экспериментальные данные подтверждают вывод R. Sun и соавт. о том, что субъективный микроскопический метод не пригоден для раннего обнаружения и адекватного изучения LDNs в образцах цельной периферической крови человека [12]. В случаях, когда нейтрофилы выделяются из крови методом градиентного центрифугирования, популяция LDNs фактически теряется и, как следствие, не учитывается, поскольку клетки этой популяции аккумулируются в основном во фракции более низкой плотности вместе с лимфоцитами и моноцитами [13, 14]. Использование проточной цитометрии может повысить эффективность изучения популяции LDNs в крови не только на модели стафилококковой бактериемии ex vivo, но и бактериемии, моделируемой с использованием грамотрицательных бактерий. Для нас особый интерес представляют возбудители особо опасных бактериальных инфекций, которые, являясь факультативными внутриклеточными паразитами, могут длительно размножаться в периферической крови (микрокапиллярах печени и других органов), не вызывая развития в организме защитной воспалительной реакции [8]. В исследованиях с такими бактериями данные, полученные в опытах с клетками S. aureus, могут быть использованы в качестве положительного контроля высокой эффективности антибактериального реагирования нейтрофилов периферической крови человека.
Заключение
Таким образом, благодаря использованию проточной цитометрии и процедуры иммунофенотипирования лейкоцитов крови по протоколу Lyse/No-Wash, в работе получены экспериментальные данные, дополняющие современную информацию о различном воздействии живого и убитого S. aureus на функциональную активность НГ крови человека. В образцах крови условно здоровых доноров выявлены различия в реакции по фенотипическим маркерам CD45, CD63, CD62L, CD16, СD95 и способности стимулировать ex vivo лизис этих клеток. Полученные результаты могут быть перспективной основой для дальнейшего уточнения особенностей реакции НГ в условиях ex vivo с целью выявления лиц с высоким риском развития стафилококкового сепсиса.
Этическое утверждение. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Этическим комитетом Российского научно-исследовательского противочумного института «Микроб» (протокол № 15 от 10.11.2021).
Источник финансирования. Исследование выполнено при поддержке бюджетного финансирования в рамках темы НИР АААА-А21-121012090064-0.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Ethics approval. The study was conducted with the informed consent of the patients. The research protocol was approved by the Ethics Committee of the Russian Research Anti-Plague Institute “Microbe” (protocol No. 15, November 10, 2021).
Acknowledgments. The study was supported by budget funding within the framework of the research topic No АААА-А21-121012090064-0.
Conflict of interest. The authors declare no apparent or potential conflicts of interest related to the publication of this article.
Author contribution. Аll authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published.
1 BD Bioscience Resources and Tools. Stain Lyse No Wash. Direct Immunofluorescence Staining of Whole Blood using a Lyse/No-Wash Procedure. Available at: https://www.bdbiosciences.com/en-no/resources/protocols/stain-lyse-no-wash
About the authors
Aleksandr L. Kravtsov
Russian Research Anti-Plague Institute "Microbe"
Author for correspondence.
Email: kravzov195723@gmail.com
ORCID iD: 0000-0002-9016-6578
D. Sci. (Biol.), Leading Researcher, Department of Immunology
Russian Federation, SaratovSvetlana A. Bugorkova
Russian Research Anti-Plague Institute "Microbe"
Email: fake@neicon.ru
ORCID iD: 0000-0001-7548-4845
D. Sci. (Med.), Head, Department of Immunology
Russian Federation, SaratovSvetlana N. Klyueva
Russian Research Anti-Plague Institute "Microbe"
Email: fake@neicon.ru
ORCID iD: 0000-0002-5550-6063
Cand. Sci. (Biol.), Researcher, Department of Immunology
Russian Federation, SaratovTatyana P. Shmelkova
Russian Research Anti-Plague Institute "Microbe"
Email: kravzov195723@gmail.com
ORCID iD: 0000-0001-5891-6028
Cand. Sci. (Biol.), Senior Researcher, Department of Educational Programs and Specialist Training
Russian Federation, SaratovVitaly A. Kozhevnikov
Russian Research Anti-Plague Institute "Microbe"
Email: kravzov195723@gmail.com
ORCID iD: 0000-0001-7267-7027
Junior Researcher, Department of Immunology
Russian Federation, SaratovReferences
- Бицадзе В.О., Хизроева Д.Х., Макацария А.Д. и др. COVID-19, септический шок и синдром диссеминированного внутрисосудистого свертывания крови. Часть 1. Вестник Российской академии медицинских наук. 2020;75(2):118–28. Bitsadze V.O., Khizroeva D.Kh., Makatsariya A.D., et al. COVID-19, septic shock and syndrome of disseminated intravascular coagulation syndrome. Part 1. Annals of the Russian Academy of Medical Science. 2020;75(2):118–28. DOI: https://doi.org/10.15690/vramn1335 EDN: https://elibrary.ru/azzjtr
- Гоманова Л.И., Фокина М.А. Актуальные вопросы клинической картины и диагностики септического шока. Инфекция и иммунитет. 2022;12(2):239–52. Gomanova L.I., Fokina M.A. Topical issues of clinical symptoms and diagnostics of septic shock. Russian Journal of Infection and Immunity. 2022;12(2):239–52. DOI: https://doi.org/10.15789/2220-7619-TIO-1811 EDN: https://elibrary.ru/vfmepd
- Shen X., Cao K., Zhao Y., Du J. Targeting neutrophils in sepsis: from mechanism to translation. Front. Pharmacol. 2021;12: 644270. DOI: https://doi.org/10.3389/fphar.2021.644270
- Андрюков Б.Г., Сомова Л.М., Дробот Е.И., Матосова Е.В. Защитные стратегии нейтрофильных гранулоцитов от патогенных бактерий. Здоровье. Медицинская экология. Наука. 2017;(1):4–18. Andryukov B.G., Somova L.M., Drobot E.I., Matosova E.V. Defensive strategy of neutrophilic granulocytes against pathogenic bacteria. Health, Medical Ecology, Science. 2017;(1):4–18. DOI: https://doi.org/10.5281/zenodo.345606 EDN: https://elibrary.ru/ygtuuz
- Tang A.H., Brunn G.J., Cascalho M., Platt J.L. Pivotal advance: endogenous pathway to SIRS, sepsis and related conditions. J. Leukoc. Biol. 2007;82(2):282–5. DOI: https://doi.org/10.1189/jlb.1206752
- Aasen A.O., Ohlson R. Release of granulocyte elastase in lethal canine endotoxin shock. Hoppe Seylers Z. Physiol. Chem. 1978;359(6):683–90. DOI: https://doi.org/10.1515/bchm.1978.359.1.683
- Guéant J.L., Guéant-Rodrigues R.M., Fromonot J., et al. Elastase and exacerbation of neutrophil innate immunity are involved in multi-visceral manifestations of COVID-19. Allergy. 2021;76(6):1846–58. DOI: https://doi.org/10.1111/all.14746
- Silva M.T. Bacteria-induced phagocyte secondary necrosis as a pathogenicity mechanism. J. Leukoc. Biol. 2010;88(5):885–96. DOI: https://doi.org/10.1189/jlb.0410205
- Madoiwa S., Tanaka H., Nagahama Y., et al. Degradation of cross-linked fibrin by leukocyte elastase as alternative pathway for plasmin-mediated fibrinolysis in sepsis-induced disseminated intravascular coagulation. Thromb. Res. 2011;127(4): 349–55. DOI: https://doi.org/10.1016/j.thromres.2010.12.008
- Грувер К.П., Белобородов В.Б. Клиническое значение бактериемии у больных сепсисом. Клиническая микробиология и антимикробная химиотерапия. 2011;13(1):90–7. Gruver K.P., Beloborodov V.B. Clinical significance of bacteremia in patients with sepsis. Clinical Microbiology and Antimicrobial Chemotherapy. 2011;13(1):90–7. EDN: https://elibrary.ru/ndnrsz
- Каргальцева Н.М., Миронов А.Ю., Суранова Т.Г. и др. Эпидемиологическая характеристика инфекции кровотока у пациентов с соматическими заболеваниями. Эпидемиология и инфекционные болезни. 2021;26(5):238–47. Kargal’tseva N.M., Mironov A.Yu., Suranova T.G., et al. Epidemiological characteristics of bloodstream infection in patients with somatic diseases. Epidemiology and Infectious Diseases. 2021;26(5):238–47. DOI: https://doi.org/10.17816/EID108458. EDN: https://elibrary.ru/kzaedg
- Sun R., Huang J., Yang Y., et al. Dysfunction of low-density neutrophils in peripheral circulation in patients with sepsis. Sci. Rep. 2022;12(1):685. DOI: https://doi.org/10.1038/s41598-021-04682-x
- Cloke T., Munder M., Tayler J., et al. Characterization of a novel population of low-density granulocytes associated with disease severity in HIV-1 infection. PLoS One. 2012;7(11):e48939. DOI: https://doi.org/10.1371/journal.pone.0048939
- Morrissay S., Geller A.E., Hu X., et al. A specific low-density neutrophil population correlates with hypercoagulation and disease severity in hospitalized COVID-19 patients. JCI Insight. 2021;6(9):e148435. DOI: https://doi.org/10.1172/jci.insight.148435
- Camisia G., Pozner R., de Larrañaga G. Neutrophil extracellular traps in sepsis. Shock. 2014;42(4):286–94. DOI: https://doi.org/10.1097/shk.0000000000000221
- Кравцов А.Л., Бугоркова С.А., Клюева С.Н. и др. Оценка интенсивности дегрануляции и изменений фенотипа нейтрофилов по уровню экспрессии FcᵧRIIIb в крови больных COVID-19 и реконвалесцентов. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(2): 172–84. Kravtsov A.L., Bugorkova S.A., Klyueva S.N., et al. Assessment of neutrophil degranulation intensity and changes in neutrophil phenotype by FCᵧRIIIB expression level in blood of patients with COVID-19 and convalescents. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(2):172–84. DOI: https://doi.org/10.36233/0372-9311-225 EDN: https://elibrary.ru/gkyogg
- Bassøe C.F., Solberg C.O. Phagocytosis of Staphylococcus aureus by human leukocytes: quantitation by a flow cytometric and a microbiological method. Acta Pathol. Microbiol. Immunol. Scand. C. 1984;92(1):43–50. DOI: https://doi.org/10.1111/j.1699-0463.1984.tb00050.x
- Zwack E.E., Chen Z., Delvin J.C., Torres V. Staphylococcus aureus induces a muted host response in human blood that blunts the recruitment of neutrophils. Proc. Natl Acad. Sci. USA. 2022; 119(31): e2123017119
- Kobayashi S.D., Braughton R.R., Palazzolo-Ballance A.M., et al. Rapid neutrophil destruction following phagocytosis of Staphylococcus aureus. J. Innate Immun. 2010;2(6):560–75. DOI: https://doi.org/10.1159/000317134
- Долгушин И.И., Маркова В.А., Квятковская С.В. и др. Анализ функциональной активности нейтрофильных гранулоцитов периферической крови методом проточной цитофлюориметрии у здоровых доноров. Российский иммунологический журнал. 2014;8(3):305–7. Dolgushin I.I., Markova V.A., Kvyatkovskaya S.V., et al. Analysis the functional activity of peripheral blood neutrophils by flow cytometry in healthy donors. Russian Journal of Immunology. 2014;8(3):305–7. EDN: https://elibrary.ru/tffrlh
- Traganos F., Darzynkiewicz Z. Lysosomal proton pump activity: supravital cell staining with acridine orange differentiates leukocyte subpopulations. Methods Cell Biol. 1994;41:185–94. DOI: https://doi.org/10.1016/s0091-679x(08)61717-3
- Abrams W.R., Diamond L.W., Kane A.B. A flow cytometric assay of neutrophil degranulation. J. Histochem. Cytochem. 1983;31(6):737–44. DOI: https://doi.org/10.1177/31.6.6404983
- Kravtsov A.L., Grebenyukova T.P., Kuznetsov O.S., et al. Flow microfluorometric analysis of phagocyte degranulation in bacteria infected whole blood cell cultures. In: Proceedings SPIE – The International Society for Optical Engineering. Volume 4707. Saratov;2002:395–402. DOI: https://doi.org/10.1117/12.475607 EDN: https://elibrary.ru/mradhp
- Козинец Г.И., Высоцкий В.В. Погорелов В.М. и др. Кровь и инфекция. М.;2001. Kozinets G.I., Vysotskii V.V. Pogorelov V.M., et al. Blood and Infection. Moscow;2001.
- Белобородов В.Б. Новые возможности лечения бактериемии и сепсиса, вызванных стафилококками. Эпидемиология и инфекционные болезни. 2014;19(5):19–25. Beloborodov V.B. New therapeutic approach for the treatment for staphylococcal bacteremia and sepsis. Epidemiology and Infectious Diseases. 2014;19(5):19–25. EDN: https://elibrary.ru/syelph
- McAdow M., Kim H.K., Dedent A.C., et al. Preventing Staphylococcus aureus sepsis though the inhibition of its agglutination in blood. PLoS Pathog. 2011;7(10):e1002307. DOI: https://doi.org/10.1371/journal.ppat.1002307
- МсDonald B., Urrutia R., Yipp B.G., et al. Intravascular neutrophil extracellular traps capture bacteria from bloodstream during sepsis. Cell Host Microbe. 2012;12(3):324–33. DOI: https://doi.org/10.1016/j.chom.2012.06.011
- Guo H., Hall J.W., Yang J., Ji Y. The SaeRS two-component system controls survival of Staphylococcus aureus in human blood though regulation of coagulase. Front Cell. Infect. Microbiol. 2017;7:204. DOI: https://doi.org/10.3389/fcimb.2017.00204
- Guo H., Henderson A., Kenneth C., Solveig S., Gericson S. Effects of the protein tyrosine phosphatase CD45 on FcᵧRIIa signaling and neutrophil function. Exp. Hematology. 2000;28(9): 1062–70. DOI: https://doi.org/10.1016/s0301-472x(00)00513-0
- Reeves E.P., Lu H., Jacobs H.L., et al. Killing activity of neutrophils is mediated through activation of proteases by K+ flux. Nature. 2002;416(6878):291–7. DOI: https://doi.org/10.1038/416291a
- Shi J., Ganz T. The role of protegrins and other elastase-activated polypeptides in the bactericidal properties of porcine inflammatory fluids. Infect. Immun. 1998;66(8):3611–7. DOI: https://doi.org/10.1128/iai.66.8.3611-3617.1998
- Rosales C., Uribe-Querol E. Neutrophil activation by antibody receptors. In: Khajah M., et al. Neutrophils. London;2019. DOI: https://doi.org/10.5772/intechopen.80666
- Khodoun M.V., Strait R., Armstrong L., et al. Identification of markers that distinguish IgE-from IgG-mediated anaphylaxis. Proc. Natl Acad. Sci. USA. 2011;108(30):12413–8. DOI: https://doi.org/10.1073/pnas.1105695108
- Thomer L., Emolo C., Thammavongsa V., et al. Antibodies against a secreted products of Staphylococcus aureus trigger phagocytic killing. J. Exp. Med. 2016;213(3):293–301. DOI: https://doi.org/10.1084/jem.20150074
- Branzk N., Lubojemska A., Hardison S., et al. Neutrophils sense microbial size and selectively release neutrophil extracellular traps in response to large pathogens. Nat. Immunol. 2014;15(11):1017–25. DOI: https://doi.org/10.1038/ni.2987
- Hoppenbrouwers T., Sultan A.R., Abraham T.E., et al. Staphylococcal protein A is a key factor in neutrophil extracellular traps formation. Front. Immunology. 2018;9:165. DOI: https://doi.org/10.3389/fimmu.2018.00165
- Зурочка А.В., Зурочка В.А., Фомина Л.О. и др. Оценка цитокиноподобной активности Staphylococcus aureus в зависимости от наличия генетических детерминант стафилококкового белка А. Российский иммунологический журнал. 2019;13(3):1163–7. Zurochka A.V., Zurochka V.A., Fomina L.O., et al. Estimation of cytokin-like activity of Staphylococcus aureus depending on the availability of genetic determinant of staphylococcal protein A. Russian Journal of Immunology. 2019;13(3):1163–7. DOI: https://doi.org/10.31857/S102872210007247-6 EDN: https://elibrary.ru/ljuktg
Supplementary files