Characterisation of the COVID-19 epidemic process in Moscow and search for possible determinants of the trends of the observed changes
- Authors: Gushchin V.A.1,2, Pochtovyi A.A.1, Kustova D.D.1,2, Ogarkova D.A.1, Kleymenov D.A.1, Semenenko T.A.1, Logunov D.Y.1, Zlobin V.I.1, Gintsburg A.L.1,3
-
Affiliations:
- National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
- Lomonosov Moscow State University
- I.M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation (Sechenov University)
- Issue: Vol 100, No 4 (2023)
- Pages: 267-284
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/4890
- DOI: https://doi.org/10.36233/0372-9311-375
- EDN: https://elibrary.ru/pvnhvz
- ID: 4890
Cite item
Full Text
Abstract
Background. Constant assessment of the dynamics of the main characteristics of the epidemic process is the basic function of epidemiological surveillance of infectious diseases. The search for factors that determine changes in the characteristics of the epidemic process makes it possible to develop timely management decisions and reduce the risk of an increase in the scale of the pandemic. Moscow is the main centre of attraction for the population of other Russian regions with the most complex structure of social links and the highest population density.
The purpose of the study is to identify factors that potentially determine the trends of observed changes using a molecular epidemiological analysis of the main characteristics of the epidemic process of a new coronavirus infection (COVID-19).
Materials and methods. For the analysis, the data of Russian national genome sequence database of SARS-CoV-2 virus (VGARus) were combined with information on morbidity and mortality presented at the official internet resources “стопкоронавирус.рф” and Yandex DataLens, the dynamics of vaccination, COVID-19 disease incidence and hospitalization from the portal Gogov.ru. A multicentre retrospective observational epidemiological study was conducted to examine the sex and age structure of hospitalised patients. Anonymized case histories of patients with COVID-19 collected at different follow-up periods in the institutions of Moscow (41,561 cases) served as a source of data for the sex and age structure analysis.
Results. We identified 11 periods with significantly different complex epidemiological characteristics. A decrease in the incidence among young people of working age during the period of restrictive measures was revealed. In 3 out of 11 worsening of the epidemic situation coincided with the beginning of the circulation of a new genetic variant of the pathogen COVID-19 (variants Wuhan, Delta, Omicron). A decrease in the incidence in the summer period was noted, regardless of the circulating genetic variants.
Conclusion. A significant part of the observed dynamics of the characteristics of the epidemic process in Moscow can be explained by the properties of the pathogen, seasonality and dynamics of magnitude of the herd immunity. The influence of the dynamics of the herd immunity indicators on the course of the epidemic process is to be studied further.
Keywords
Full Text
Введение
За неполных 3 года пандемии в России было зарегистрировано более 21 млн случаев COVID-19, из которых более 381 тыс. окончились летальным исходом1. Таким образом, общая летальность составила порядка 1,8%. Россия находится в числе стран с наиболее высокими показателями заболеваемости и смертности, что подчёркивает важность поиска факторов, определяющих ухудшение эпидемической ситуации по COVID-19 на её территории. Отечественными эпидемиологами проведены исследования, позволяющие оценить характеристики эпидемического процесса COVID-19 в России, его закономерности и территориальные особенности. В.Г. Акимкиным и соавт. был сделан такой анализ с использованием всех основных источников эпидемиологически значимой информации и выделены пять основных волн заболеваемости COVID-19 в России, произошедших за первые 2 года пандемии [1]. Средняя заболеваемость по периодам составила 30,72, 73,92, 85,89, 141,28 и 442,31о/оооо в 1–5-м периодах соответственно. Интересно, что в Москве показатель заболеваемости, зафиксированный в первый период, превышал общероссийский в 6,4 раза. В целом в регионах России, по сравнению с Москвой, фиксировались запаздывающий характер роста заболеваемости и более смазанные пики, не достигающие значений, характерных для столицы. Авторы выделяют среди заболевших преобладание женщин и мужчин старше 50 лет. Наименьший удельный вес в структуре заболеваемости отмечен среди лиц в возрасте 18–29 лет с преобладанием в этой группе бессимптомных форм инфекции [2].
Данные клинико-эпидемиологических особенностей пациентов, госпитализированных с COVID-19 в различные периоды пандемии в Москве, представлены в работе Н.И. Брико и соавт. [3]. Для анализа авторы использовали информацию сайта стопкоронавирус.рф, оперативного штаба и собранную на базе двух столичных стационаров, включая Инфекционную клиническую больницу № 2 ДЗМ и Городскую клиническую больницу № 40 ДЗМ (подразделение в Коммунарке) в период с марта 2020 г. по март 2022 г. (всего 34 148 пациентов). Авторы выделили 7 близких по эпидемиологическим характеристикам периодов динамики заболеваемости COVID-19 в Москве, включая не только периоды подъёма заболеваемости, но и периоды стабилизации между периодами роста. Границы периодов определены на основании рассчитанных уровней заболеваемости, смертности, её темпов и скорости прироста/снижения. В результате проведённого исследования установлено, что заболеваемость по периодам составила 111,9, 38,0, 247,3, 120,2, 230,4, 210,4 и 1316,8о/оооо в 1–7-м периодах соответственно. Средний возраст госпитализированных пациентов за всё время наблюдения в Москве оценивается в 53 года. Гендерный состав пациентов: 55,8% — женщины, 44,2% — мужчины.
В более поздних исследованиях в период пандемии COVID-19 в России приводится анализ заболеваемости и динамики циркуляции генетических вариантов вируса SARS-CoV-2 [4]. Отмечается, что при появлении новых генетических вариантов возбудитель становится менее патогенным для человека, но более контагиозным. Доказательством этого, по мнению авторов, служат показатели динамики проявлений эпидемического процесса и тяжести течения заболевания. При этом данные по накоплению доли иммунных лиц и их роли в изменении динамики заболеваемости и тяжести течения COVID-19 не анализируются. Авторы отмечают, что в настоящее время молекулярно-генетический мониторинг циркуляции SARS-CoV-2 является ведущим направлением эпидемиологического надзора за COVID-19, позволяющим принимать решения по разработке и осуществлению противоэпидемических мероприятий. Учитывая, что Москва является крупнейшим мегаполисом России, в котором эпидемический процесс COVID-19 идёт с некоторым опережением и в наиболее активной форме, нами предпринята попытка проведения эпидемиологического анализа с использованием результатов молекулярно-генетического мониторинга с целью выявления основных факторов, определявших тенденции наблюдаемых изменений основных характеристик эпидемического процесса COVID-19 в 2020–2022 гг.
Материалы и методы
Выполнено описательное сплошное исследование, основным методом которого являлся ретроспективный эпидемиологический анализ, а также статистические методы. Динамику проявлений эпидемического процесса COVID-19 в Москве анализировали за период с марта 2020 г. по октябрь 2022 г. Данные о заболеваемости и смертности были получены c официального интернет-ресурса для информирования населения по вопросам COVID-19 стопкоронавирус.рф и Yandex DataLens, о динамике вакцинации, перенесённом заболевании COVID-19 и госпитализации — с портала Gogov.ru. Всего было проанализировано 3 216 457 случаев заболеваний, 724 284 случая госпитализации и 46 338 случаев смерти, обусловленных COVID-19. Выбранный временнóй отрезок был разделён на периоды динамики заболеваемости, смертности и госпитализации с COVID-19 в Москве. Их границы были определены на основании рассчитанных уровней заболеваемости — были выделены периоды роста и снижения, а также периоды стабилизации уровней заболеваемости (всего 11 периодов). Для полученного временнóго ряда рассчитывали средние значения ряда и ежемесячный темп прироста показателей. Выравнивание ряда проводили методом наименьших квадратов. График содержал динамику показателя, линию тенденции (теоретическая заболеваемость), доверительные границы теоретических показателей (95% доверительный интервал) для оценки тенденции, доверительные границы фактических показателей (95% доверительный интервал) в годы максимального подъёма и предыдущего спада заболеваемости для оценки выраженности колебаний показателей заболеваемости.
Проведённое нами ретроспективное описательное эпидемиологическое исследование включало анализ динамики показателей в целом, а также каждого из выделенных нами периодов с использованием общего количества заболеваний, госпитализаций и смертей за весь период и параметрического описания (среднее и 95% доверительный интервал) с последующей оценкой значимости различий в показателях заболеваемости, госпитализаций и смертности между каждыми двумя периодами с использованием критерия Геймса–Хоуэлла (не требует равенства дисперсий). Данный критерий используется для выявления групп, между которыми есть различия средних значений, как апостериорный после дисперсионного анализа. Использование данного критерия позволяет снизить вероятность отклонения нулевой гипотезы при том, что она верна. Значимость различий по наиболее характерным временны́м отрезкам внутри периода, включавшего 14 дней, определяли с использованием критерия χ2 Пирсона с поправкой на множественность Бонферрони.
Для анализа половозрастной структуры заболевших COVID-19 использовали истории болезни пациентов, давших информированное согласие, составленные в различные периоды наблюдения на базе медицинских учреждений Москвы: Инфекционной клинической больницы № 1 ДЗМ, Городской клинической больницы № 67 ДЗМ. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен локальным этическим комитетом Национального научно-исследовательского института эпидемиологии и микробиологии им. Н.Ф. Гамалеи (протокол № 14 от 29.09.2021).
Выборочный молекулярно-генетический мониторинг осуществлён на базе медицинских учреждений ДЗМ, из Российской национальной базы данных геномных последовательностей вируса SARS-CoV-2 VGARus получены сведения за период с марта 2020 г. по октябрь 2022 г. В исследование вошли пациенты от 0 до 104 лет с подтверждённым диагнозом COVID-19. Общий размер сформированной выборки составил 41 561 пациента. Статистически значимые различия между периодами по половому составу были рассчитаны с использованием критерия χ2 Пирсона.
Статистически достоверными различия признавали при значении p < 0,05.
Результаты
Общая характеристика эпидемического процесса COVID-19 в Москве
Для оценки эпидемического процесса в Москве и выявления причинных факторов, обусловливающих его волнообразный характер, нами был использован временной интервал с марта 2020 г. по октябрь 2022 г. В рамках указанного интервала первой задачей было определение отличающихся по эпидемиологическим характеристикам периодов на основании данных о заболеваемости и госпитализации и смертности.
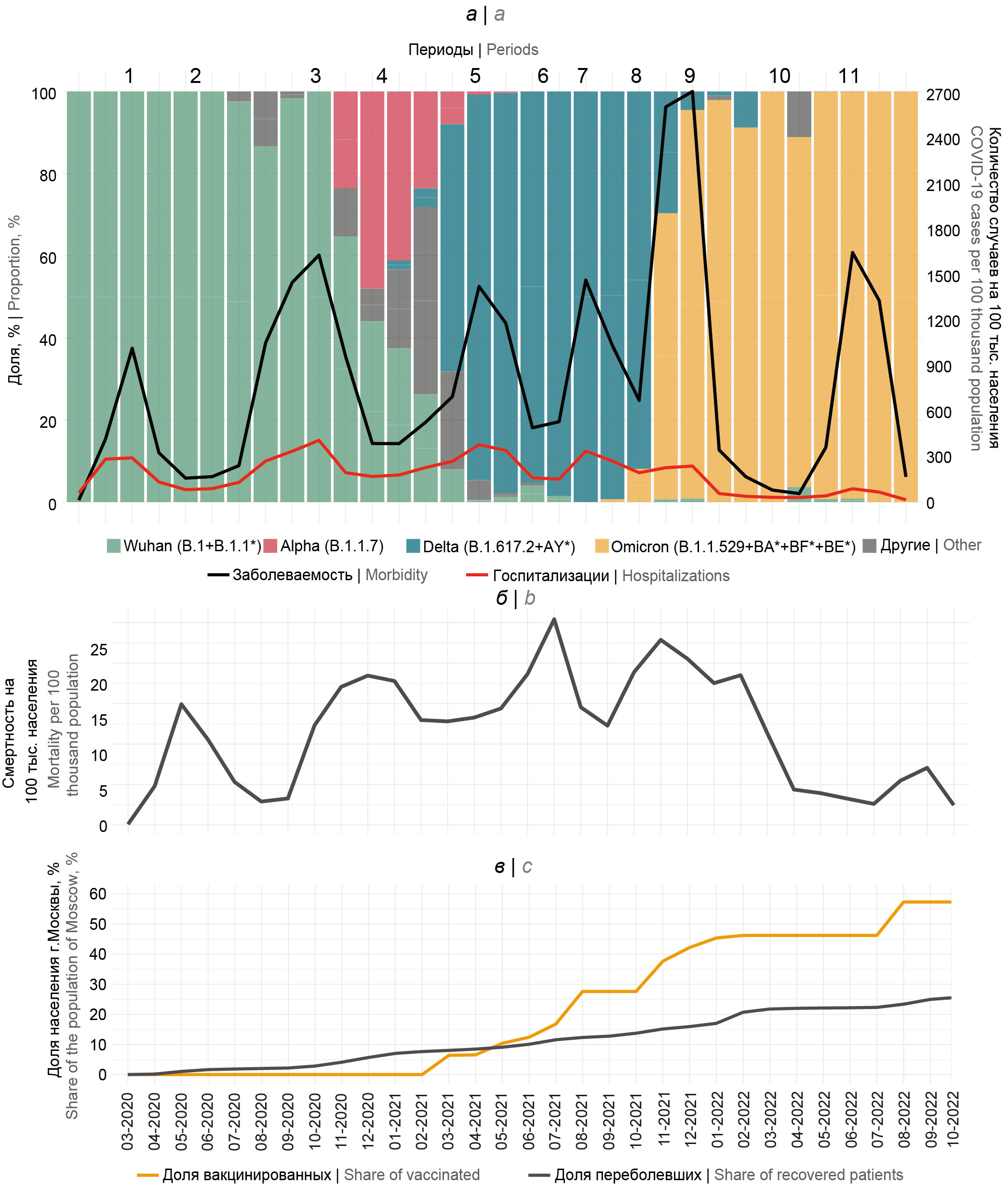
В указанный период можно выделить 6 классических циклов подъёма и спада заболеваемости, госпитализации и смертности (рис. 1), хотя полного прекращения циркуляции вируса между периодами не наблюдалось. Для углублённого изучения причин волнообразности выбранный временной отрезок был разделён нами на 11 периодов с учётом значений заболеваемости COVID-19 непосредственно граничащих между собой периодов с использованием критерия Геймса–Хоуэлла (не требует равенства дисперсий). Границы периодов позволили отделить периоды роста и снижения заболеваемости от периодов относительного благополучия и стабилизации и учитывали смену тенденции динамики заболеваемости. Отличие от ранее выделенных 6 периодов [3] заключается во включении двух дополнительных периодов снижения и роста заболеваемости в 2022 г., а также выделения всех межпиковых времены́х отрезков в самостоятельные периоды. Для каждого из выделенных нами периодов была проведена статистическая обработка достоверности отличий в показателях заболеваемости, госпитализаций и смертности по всему периоду с использованием критерия Геймса–Хоуэлла, а также по наиболее контрастным во временнóм отрезке внутри периода, включавшем фиксированный 14-дневный интервал с использованием критерия χ2 (таблица).
Рис. 1. Динамика основных показателей эпидемического процесса COVID-19 в Москве в периоды доминирования основных генетических вариантов возбудителя по месяцам.
а — доминирующие генетические варианты вируса SARS-CoV-2, заболеваемость и госпитализация; б — динамика смертности; в — динамика вакцинации и количество перенёсших COVID-19.
Fig. 1. Dynamics of the main indicators of the COVID-19 epidemic process in Moscow during periods of dominance of the main genetic variants of the pathogen by months.
а — dominant genetic variants of SARS-CoV-2 virus, morbidity and hospitalization; b — dynamics of mortality; c — dynamics of vaccination and number of people who had undergone COVID-19.
Анализ статистической достоверности различий характеристик эпидемического процесса по выбранным 11 периодам
Analysis of the statistical significance of differences in the characteristics of the epidemic process for the selected 11 periods
Период Period | Дата начала периода Period start date | Дата окончания периода Period end date | Продолжительность периода, дней Period duration, days | Всего случаев на 100 тыс. населения Total confirmed COVID-19 cases per 100 thousand population | Среднее число случаев в день на 100 тыс. населения (95% ДИ) Mean COVID-19 cases per day per 100,000 population (95% CI) | p (χ2) | p (критерий Геймса–Хоуэлла) p (Games–Howell test) |
Заболеваемость | Morbidity | |||||||
1 | 01.03.2020 | 30.06.2020 | 120 | 1771,87 | 15,96 (13,37–18,55) | Во всех попарных сравнениях p < 0,05 In all pairwise comparisons p < 0.05 | p1-4 = 0,553; p1–6 = 0,345; p1–8 = 0,99; p3–7 = 0,785; p3–9 = 0,297; p3–11 = 1,000; p4–6 = 0,999; p5–7 = 0,247; p5–11 = 0,069; p7–9 = 0,088; p7–11 = 0,986; p9–11 = 0,312. В остальных попарных сравнениях p < 0,001 In other pairwise comparisons p < 0.001 |
2 | 01.07.2020 | 13.09.2020 | 75 | 395,79 | 5,28 (5,21–5,35) | ||
3 | 14.09.2020 | 02.02.2021 | 142 | 5298,96 | 37,32 (34,76–39,88) | ||
4 | 03.02.2021 | 24.03.2021 | 50 | 653,36 | 13,07 (12,36–13,77) | ||
5 | 25.03.2021 | 18.08.2021 | 147 | 4251,58 | 28,92 (26,39–31,46) | ||
6 | 19.08.2021 | 14.09.2021 | 27 | 340,3 | 12,60 (11,75–13,46) | ||
7 | 15.09.2021 | 22.12.2021 | 99 | 3355,99 | 33,90 (31,11–36,69) | ||
8 | 23.12.2021 | 05.01.2022 | 14 | 248,9 | 17,78 (15,58–19,98) | ||
9 | 06.01.2022 | 23.04.2022 | 108 | 5726,54 | 53,02 (41,00–65,04) | ||
10 | 24.04.2022 | 11.07.2022 | 79 | 207,52 | 2,63 (2,39–2,87) | ||
11 | 12.07.2022 | 13.10.2022 | 94 | 3467,54 | 37,44 (33,09–41,80) | ||
Смертность | Mortality | |||||||
1 | 01.03.2020 | 30.06.2020 | 120 | 30,35 | 0,27 (0,23–0,31) | p1–4 = 0,700 p1–6 = 1,000 p2–11 = 1,000 p3–5 = 1,000 p3–7 = 1,000 p3–8 = 1,000 p3–9 = 1,000 p4–6 = 1,000 p5–7 = 0,193 p5–8 = 0,747 p5–9 = 1,000 p7–8 = 1,000 p7–9 = 1,000 p8–9 = 1,000 В остальных попарных сравнениях p < 0,001 In other pairwise comparisons p < 0.001 | p2–10 = 0,934; p3–4 = 0,116; p3–9 = 0,894; p4–9 = 1,000; p5–8 = 1,000; p6–9 = 0,541. Во всех попарных сравнениях p < 0,05 In other pairwise comparisons p < 0.05 |
2 | 01.07.2020 | 13.09.2020 | 75 | 9,48 | 0,13 (0,11–0,14) | ||
3 | 14.09.2020 | 02.02.2021 | 142 | 68,66 | 0,48 (0,44–0,50) | ||
4 | 03.02.2021 | 24.03.2021 | 50 | 21,74 | 0,43 (0,42–0,45) | ||
5 | 25.03.2021 | 18.08.2021 | 147 | 83,78 | 0,57 (0,54–0,60) | ||
6 | 19.08.2021 | 14.09.2021 | 27 | 10,75 | 0,40 (0,39–0,41) | ||
7 | 15.09.2021 | 22.12.2021 | 99 | 64,08 | 0,65 (0,62–0,67) | ||
8 | 23.12.2021 | 05.01.2022 | 14 | 7,92 | 0,57 (0,55–0,58) | ||
9 | 06.01.2022 | 23.04.2022 | 108 | 48,01 | 0,44 (0,40–0,49) | ||
10 | 24.04.2022 | 11.07.2022 | 79 | 9,16 | 0,12 (0,11–0,12) | ||
11 | 12.07.2022 | 13.10.2022 | 94 | 16,57 | 0,18 (0,16–0,19) | ||
Количество госпитализаций | Number of hospitalizations | |||||||
1 | 01.03.2020 | 30.06.2020 | 120 | 770,86 | 6,83 (6,08–7,58) | p1–3 = 1,000 p2–11 = 0,198 В остальных попарных сравнениях p < 0,05 In other pairwise comparisons p < 0.05 | p1–4 = 0,957; p1–8 = 0,481; p1–9 = 0,104; p3–5 = 0,611; p4–8 = 0,369; p4–9 = 0,193; p5–7 = 0,491; p6–9 = 0,610; p8–9 = 0,768. В остальных попарных сравнениях p < 0,01 In other pairwise comparisons p < 0.01 |
2 | 01.07.2020 | 13.09.2020 | 75 | 220,19 | 2,94 (2,83–3,04) | ||
3 | 14.09.2020 | 02.02.2021 | 142 | 1306,97 | 9,98 (9,47–10,48) | ||
4 | 03.02.2021 | 24.03.2021 | 50 | 295,19 | 5,90 (5,71–6,09) | ||
5 | 25.03.2021 | 18.08.2021 | 147 | 1363,83 | 9,28 (8,23–9,73) | ||
6 | 19.08.2021 | 14.09.2021 | 27 | 109,33 | 4,05 (3,85–4,24) | ||
7 | 15.09.2021 | 22.12.2021 | 99 | 843,37 | 8,52 (8,01–9,02) | ||
8 | 23.12.2021 | 05.01.2022 | 14 | 77,74 | 5,55 (5,32–5,79) | ||
9 | 06.01.2022 | 23.04.2022 | 108 | 523,15 | 4,84 (4,10–5,59) | ||
10 | 24.04.2022 | 11.07.2022 | 79 | 79,95 | 1,01 (0,98–1,05) | ||
11 | 12.07.2022 | 13.10.2022 | 94 | 200,7 | 2,18 (2,04–2,32) | ||
По уровню заболеваемости непосредственно граничащие между собой периоды достоверно отличались по обоим критериям. По смертности все периоды отличались друг от друга по критерию Геймса–Хоуэлла, тогда как по χ2 — все, кроме периодов 7–9. По количеству госпитализированных, наоборот, все периоды отличались по критерию χ2, тогда как по критерию Геймса–Хоуэлла не отличались периоды 8 и 9. Таким образом было подтверждено, что границы, определённые нами для дальнейшего анализа, действительно позволяют выделять статистически достоверно отличающиеся по набору эпидемиологических характеристик периоды времени, что позволяет использовать их для выявления основных факторов, определявших тенденции основных характеристик эпидемического процесса COVID-19 в 2020–2022 гг.
Период 1 (продолжительность периода составила 120 дней с момента первого подтверждённого случая в начале марта по 30.06.2020). Характеризуется весенним подъёмом заболеваемости, включающим события множественного завоза вируса из-за рубежа в течение марта на территорию Москвы, установлением активной локальной передачи, характеризующейся быстрым подъёмом заболеваемости в апреле и последующим её снижением в результате введения с 29.03.2020 жёстких ограничительных мероприятий («локдауна»). Заболеваемость в данный период составила 1771,87 на 100 тыс. населения (средний уровень — 15,96 на 100 тыс. населения в день). Госпитализация составила 770,86 на 100 тыс. населения (средний уровень 6,83 случая на 100 тыс. населения в день). Смертность в этот период составила 30,35 на 100 тыс. населения (средний уровень — 0,27 случаев на 100 тыс. населения в день). В этот период, вероятно, наблюдался недостаток тест-систем для этиологической диагностики, т.к. почти половина лиц из числа выявленных случаев была госпитализирована. Стоит отметить, что количество проведённых в России тестов по результатам второго полугодия 2020 г. увеличилось в 3,6 раза (19,852 млн тестов в 1-м полугодии против 71,271 млн тестов во 2-м полугодии2). Альтернативным объяснением может быть чрезмерная госпитализация пациентов с COVID-19 в начальный период пандемии в Москве ввиду неопределённости прогноза их состояния и отсутствия сформированной схемы лечения. Госпитальная летальность составила 3,89%, что указывает на то, что среди госпитализируемых наблюдался избыток пациентов с лёгким течением, т.к. в более поздние периоды отмечалась более высокая госпитальная летальность [3].
Период 2 (продолжительность периода составила 75 дней — с 01.07.2020 по 13.09.2020). Характеризуется летней стабилизацией показателей заболеваемости, которая находилась в пределах от 4,25 до 5,58 на 100 тыс. населения в день (средний уровень — 5,28 случая на 100 тыс. населения в день). Стоит отметить, что ограничения типа «локдаун» были сняты 09.06.2020, когда были отменены самоизоляция и пропускной режим. Всего же за данный период было зарегистрировано 395,79 случая COVID-19 на 100 тыс. населения. Было зафиксировано 220,19 случая госпитализации на 100 тыс. населения (средний уровень — 2,94 случая на 100 тыс. населения в день), смертность в этот период составила 9,48 случая на 100 тыс. населения (средний уровень — 0,13 случая на 100 тыс. населения в день). Летальность в этот период, несмотря на снижение показателей заболеваемости и смертности, была равна 2,4%. Снижение показателей заболеваемости и смертности во втором периоде с высокой вероятностью является результатом действия ограничительных и противоэпидемических мероприятий, введённых в 1-й половине 2020 г., а также может быть дополнительно обусловлена фактором сезонности (смена времени года и переход к летнему периоду), приводящим к снижению эффективности передачи.
Период 3 (продолжительность периода составила 142 дня — с 14.09.2020 по 02.02.2021). Характеризуется осенне-зимним подъёмом заболеваемости. Показатель ежедневной заболеваемости варьировал в пределах от 5,57 до 65,59 на 100 тыс. населения (в среднем — 37,32 случая на 100 тыс. населения в день). Всего за данный период было зарегистрировано 5298,96 случая COVID-19 на 100 тыс. населения. Уровень госпитализации составил 1306,97 случая на 100 тыс. населения (средний уровень — 9,20 случая на 100 тыс. населения в день), смертность в этот период составила 68,66 случая на 100 тыс. населения (средний уровень — 0,48 случая на 100 тыс. населения в день). Рост заболеваемости и смертности в этот период связан со снижением действия ограничительных мероприятий, а также, вероятно, действием сезонного фактора. Ограничительные мероприятия в этот период были не столь жёсткими, как весной 2020 г. Большая часть социальной активности была восстановлена из-за начала работы школ, институтов, выхода на работу людей. В связи с ростом показателей заболеваемости были введены дополнительные ограничительные мероприятия: 1) с 05.10.2020 на удалённую работу были переведены 30% сотрудников организаций; 2) с 09.10.2020 были заблокированы льготные проездные; 3) с 19.10.2020 школьники и студенты были переведены на дистанционный формат обучения. Между тем летальность в этот период составляла уже 1,28%, что указывает на повышение эффективности применяемых протоколов лечения госпитализированных пациентов в Москве.
Период 4 (продолжительность периода составила 50 дней — с 03.02.2021 по 24.03.2021). Характеризуется относительной стабилизацией эпидемического процесса с последующей тенденцией к росту. Заболеваемость в этот период находилась на уровне 13,07 случая на 100 тыс. населения в день. Всего за данный период было зарегистрировано 653,36 случая COVID-19 на 100 тыс. населения. Госпитализация была зарегистрирована на уровне 295,19 случая на 100 тыс. населения (средний уровень — 5,90 случая на 100 тыс. населения в день), смертность составила 21,74 случая на 100 тыс. населения (средний уровень — 0,43 случая на 100 тыс. населения в день). Этот период выглядит довольно парадоксальным, и его сложно объяснить чем-то, кроме влияния популяционного иммунитета, достигшего к этому времени определённого уровня среди населения города. Частичная отмена ограничительных мероприятий, введённых осенью 2020 г., и наличие факторов сезонности (смена времени года и переход к весеннему периоду) способствуют ухудшению эпидемической обстановки.
Период 5 (продолжительность периода составила 147 дней — с 25.03.2021 по 18.08.2021). Характеризуется весенне-летним подъёмом заболеваемости, вероятнее всего, связанным с появлением варианта Дельта. Период характеризовался более высокими темпами прироста и снижения заболеваемости. Заболеваемость в этот период в Москве находилась на уровне 28,92 случая на 100 тыс. населения в день. Всего за данный период зарегистрировано 4251,58 случая COVID-19 на 100 тыс. населения. Госпитализация была зарегистрирована на уровне 1363,83 случая на 100 тыс. населения (средний уровень — 9,28 случая на 100 тыс. населения в день), смертность в этот период составила 83,78 случая на 100 тыс. населения (средний уровень — 0,57 случая на 100 тыс. населения в день). Летальность поднялась до 1,97%, что в научной литературе также объясняется свойствами этиологического агента. Причины ухудшения эпидемической ситуации в этот период невозможно выявить с применением только эпидемиологических методов, особенно с учётом периода благополучия в течение периода 4. Необходимо привлечение иммунологических данных по динамике напряжённости популяционного иммунитета, вирусологическим особенностям появившегося генетического варианта Дельта, способных выявить механизмы, по которым стабилизированный процесс на фоне отсутствия жёстких ограничительных мероприятий снова вышел из-под контроля. Следует отметить, что в периоде 5 интенсивность вакцинации населения достигла максимальных значений, а доля вакцинированных составила 20% населения Москвы.
Период 6 (продолжительность периода составила 27 дней — с 19.08.2021 по 14.09.2021) можно охарактеризовать как короткий период сезонного перехода «лето–осень». Отмечены снижение заболеваемости и непродолжительная стабилизация с колебанием заболеваемости в пределах от 8,84 до 17,13 случая на 100 тыс. населения в день (средний уровень — 12,60 случая на 100 тыс. населения в день). Всего за данный период зарегистрировано 340,30 случаев COVID-19 на 100 тыс. населения. Госпитализация была зарегистрирована на уровне 109,33 случая на 100 тыс. населения (средний уровень — 4,05 случая на 100 тыс. населения в день), смертность в этот период составила 10,75 случая на 100 тыс. населения (средний уровень — 0,40 случая на 100 тыс. населения в день). Можно предположить, что, как и в период лета 2020 г., снижение заболеваемости в периоде 6 определяется сезонными факторами и более строгими ограничениями на фоне циркуляции варианта Дельта. Показатель общей летальности за этот период продолжал тенденцию к росту предыдущего и составил 3,17%, а доля госпитализированных среди заболевших достигла 10%.
Период 7 (продолжительность периода составила 99 дней — с 15.09.2021 по 22.12.2021). Характеризуется осенне-зимним подъёмом заболеваемости. Период характеризовался более высокими темпами прироста и снижения заболеваемости. Средний уровень заболеваемости составил 33,90 случая на 100 тыс. населения в день. Всего за данный период было зарегистрировано 3355,99 случая COVID-19 на 100 тыс. населения. Госпитализация составила 843,37 случая на 100 тыс. населения (средний уровень — 8,52 случая на 100 тыс. населения в день), смертность — 64,08 случая на 100 тыс. населения (средний уровень — 0,65 случая на 100 тыс. населения в день). Вероятно, в этом периоде к факторам, влияющим на развитие эпидемического процесса, добавилось влияние фактора сезонности (смена времени года и переход к осенне-зимнему периоду). Учитывая, что летальность в этот период снижается до 1,9%, можно предположить, что наблюдаемая ситуация отражала повышение степени адаптированности звеньев системы здравоохранения к заболеваемости, вызванной изменённым этиологическим агентом. Существенное снижение заболеваемости в этом периоде можно связать с достижением в популяции значимого уровня популяционного иммунитета, т.к., кроме формирования естественного иммунитета, к окончанию этого периода без малого 40% населения было вакцинировано препаратом «Спутник V». Фактор активной вакцинации в Москве в этот период оказывал обратное действие на проявления эпидемического процесса, обусловленные возбудителем, факторами сезонности. Начиная с 25.10.2021 были введены ограничительные мероприятия, направленные на 1) соблюдение домашнего режима для граждан из группы риска и старше 60 лет; 2) дистанционный режим работы для не менее 30% сотрудников организаций и всех работников старше 60 лет и страдающих хроническими заболеваниями; 3) повышение темпов вакцинации граждан, являющихся сотрудниками сферы услуг.
Период 8 является самым коротким в нашем анализе (продолжительность периода составила 14 дней — с 23.12.2021 по 05.01.2022). Вероятнее всего, этот короткий зимний период снижения заболеваемости объясняется влиянием достигнутого в Москве уровня коллективного иммунитета. Средний уровень заболеваемости составил 17,78 случая на 100 тыс. населения в день. Всего за данный период было зарегистрировано 248,90 случая COVID-19 на 100 тыс. населения. Госпитализация была зарегистрирована на уровне 77,74 случая на 100 тыс. населения (средний уровень — 5,55 случая на 100 тыс. населения в день), смертность в этот период составила 7,92 случая на 100 тыс. населения (средний уровень — 0,57 случая на 100 тыс. населения в день).
Период 9 (продолжительность периода составила 108 дней — с 06.01.2022 по 23.04.2022). Характеризуется зимне-весенним подъёмом заболеваемости, связанным с появлением варианта Омикрон вируса SARS-CoV-2. Наблюдался резкий подъём заболеваемости с последующим выраженным снижением. Подъём заболеваемости стал самым интенсивным с начала пандемии. В этот период был зафиксирован максимальный уровень заболеваемости за весь анализируемый период пандемии COVID-19. Всего было зарегистрировано 5726,54 случая COVID-19 на 100 тыс. населения (средней уровень — 53,02 случая на 100 тыс. населения в день). Госпитализация была зарегистрирована на уровне 523,15 случая на 100 тыс. населения (средний уровень — 4,84 случая на 100 тыс. населения в день), смертность в этот период составила 48,01 случая на 100 тыс. населения (средний уровень — 0,44 случая на 100 тыс. населения в день). Как и в случае с периодами 5 и 7, объяснение, почему реализовалось ухудшение эпидемической ситуации в этот период, невозможно получить с применением только эпидемиологических методов анализа. В данной ситуации необходимо привлечение иммунологических данных в части динамики напряжённости коллективного иммунитета, выявления вирусологических особенностей возбудителя. Можно отметить, что непосредственно до периода 9 интенсивность вакцинации населения достигла максимальных значений, что может объяснять снижение летальности до 0,83% на фоне рекордно высокой заболеваемости. Безусловно, это может быть связано и с особенностями этиологического агента, ответ на этот вопрос можно получить в рамках специальных экспериментов, в том числе по исследованию влияния вакцинации на снижение тяжести течения COVID-19.
Период 10 (продолжительность периода составила 79 дней — с 24.04.2022 по 11.07.2022) отмечен весенне-летним снижением заболеваемости, средний уровень которой составил 2,63 случая на 100 тыс. населения в день. Всего за данный период было зарегистрировано 207,52 случая COVID-19 на 100 тыс. населения. Госпитализация была зарегистрирована на уровне 79,95 случая на 100 тыс. населения (средний уровень — 1,01 случая на 100 тыс. населения в день), смертность в этот период составила 9,16 случая на 100 тыс. населения (средний уровень — 0,12 случая на 100 тыс. населения в день). Период выглядит максимально благополучным, однако в этот период, вероятнее всего, происходит существенный недоучёт количества случаев заболевания, т.к. расчетный уровень летальности достигает 4,56%. Объяснением этого может быть снижение активности этиологической диагностики COVID-19 у населения ввиду уменьшения тяжести течения заболевания COVID-19, вызванного вариантом Омикрон.
Период 11 (продолжительность периода составила 94 дня — с 12.07.2022 по 13.10.2022). Характеризуется летне-осенним подъёмом заболеваемости, связанным с появлением новых генетических линий варианта Омикрон. Наблюдался резкий подъём заболеваемости с последующим интенсивным снижением. Всего за данный период было зарегистрировано 3467,54 случая COVID-19 на 100 тыс. населения (средней уровень — 36,89 случая на 100 тыс. населения в день). Госпитализация была зарегистрирована на уровне 200,70 случая на 100 тыс. населения (средний уровень — 2,14 случая на 100 тыс. населения в день), смертность в этот период составила 16,57 случая на 100 тыс. населения (средний уровень — 0,18 случая на 100 тыс. населения в день). В данном периоде наблюдается рекордно низкая летальность — 0,48%. Вероятнее всего, сумма факторов, таких как изменение свойств этиологического агента, достижение в популяции высокого уровня напряжённости иммунитета и полная готовность госпитального звена системы здравоохранения, позволила достичь такого существенного снижения летальности, фактически приблизившись к показателю летальности от сезонного гриппа.
Анализ половой и возрастной структуры и влияние «локдауна» на первых этапах пандемии COVID-19
В результате анализа отмечены существенные различия в возрастной структуре заболевших COVID-19 в различные периоды пандемии, протекающей на территории города Москвы (рис. 2).
Рис. 2. Возрастная структура пациентов с COVID-19 в Москве с марта 2020 г. по октябрь 2022 г.
Fig. 2. Age structure of patients with COVID-19 in Moscow from March 2020 to October 2022.
В периоды 1 и 2 пандемии COVID-19 заболеваемость распределялась сравнительно равномерно среди всех возрастных групп старше 17 лет и составляла от 10% до почти 40 %. В периоды 3 и 4 (осень 2020 г. — весна 2021 г.) описанная ситуация со вкладом в заболеваемость различных возрастных групп в целом сохранялась, но среди пациентов в возрасте 0–17 лет доля заболевших достигла 5%, при этом достоверно уменьшался удельный вес старших возрастных групп (старше 66 лет). Самая высокая доля заболевших в периоде 3 отмечалась в группе 46–65 лет (p < 0,05). В последующие периоды наблюдались стабилизация динамики характеристик эпидемического процесса и отсутствие изменений в структуре заболеваемости возрастных групп за исключением периода 11, где, по сравнению с периодами 9 и 10, достоверно увеличился удельный вес групп 18–45, а для групп 66–79 и старше 80 лет он, наоборот, уменьшился. Данное распределение, вероятно, связано с окончательной реализацией высокого контагиозного потенциала варианта Омикрон, в том числе его новых генетических линий, среди лиц активного трудоспособного возраста.
Наблюдения за первыми четырьмя периодами в целом не выявили достоверных изменений во вкладе в заболеваемость различных возрастных групп. Это может являться отражением процесса внедрения действовавших до января 2021 г. ограничительных мероприятий, при которых большое количество лиц трудоспособного возраста и учащихся переводилось на режим удалённой работы/учёбы. В периоды 5 и 6 наметились изменения структуры заболевших со смещением в более молодые возрастные группы. Удельный вес заболевших трудоспособного возраста (18–45 лет) был максимальным. В ходе пандемии медианный возраст заболевших снизился до 44 лет (межквартильный интервал: 31,5–60,9 года). Данное смещение, возможно, связано с ослаблением ограничительных мероприятий, появлением нового варианта SARS-CoV-2 на фоне низкого уровня популяционного иммунитета, недостаточного для сдерживания распространения вируса. В период 11 также отмечается увеличение удельного веса пациентов младше 46 лет. Это, возможно, связано со снижением эффективности программы вакцинации лиц младше 65 лет, снижением уровня коллективного иммунитета, отсутствием ограничительных мер, что послужило преимущественному включению в эпидемический процесс лиц трудоспособного возраста как более активной части населения.
Среди заболевших пациентов начиная с периода 3 до конца наблюдения преобладали женщины — более 55% (p < 0,05; рис. 3).
Рис. 3. Половая структура пациентов с COVID-19 в Москве с марта 2020 г. по октябрь 2022 г.
Fig. 3. Sex structure of patients with COVID-19 in Moscow from March 2020 to October 2022.
В целом демографические характеристики больных являлись достаточно устойчивыми. Среди заболевших COVID-19 было несколько больше женщин и меньше мужчин, что во многом может быть отражением гендерного состава популяции Москвы с превалированием женщин, особенно в группах риска по возрасту.
Динамика основных показателей эпидемического процесса COVID-19 в Москве в условиях смены доминирующих генетических вариантов возбудителя
Как видно из проведённого анализа, на ряд вопросов не получено ответов. В частности, остаётся не до конца объяснённым цикличный характер эпидемического процесса COVID-19 в Москве. Действительно ли смена этиологического агента могла повлиять на наблюдаемые явления и, если это так, то какие именно вирусологические и иммунологические факторы этому способствовали? В случае с проведением программы массовой вакцинопрофилактики не ясно, было ли это действительно фактором, влияющим на динамику эпидемического процесса, и как менялась эффективность вакцинации в ходе пандемии COVID-19.
В указанный период в Москве доминировали три основных генетических варианта возбудителя COVID-19, включая Ухань, Дельта и Омикрон (рис. 1, а). Согласно полученным результатам, каждый из этих вариантов вызвал по 2 волны заболеваемости, которые были разделены интервалом относительного эпидемического благополучия. Наиболее короткий интервал между пиками заболеваемости был характерен для варианта Дельта, интродукция которого произошла весной 2021 г., тогда как наиболее длительный интервал благополучия был характерен на фоне циркуляции варианта Омикрон, получившего широкое распространение в начале 2022 г. (рис. 4).
Рис. 4. Интенсивные показатели эпидемического процесса в Москве (на 100 тыс. населения в месяц).
а — динамика показателей заболеваемости; б — динамика госпитализации больных; в — динамика смертности от COVID-19 за изучаемый период. Черным цветом обозначена общая линия тренда, красным — линия тренда для варианта Ухань, жёлтым — для Дельта, синим — для Омикрон.
Fig. 4. Intensive indicators of the epidemic process in Moscow (per 100 thousand population per month).
a — dynamics of morbidity rates; b — dynamics of hospitalization of patients; c — dynamics of mortality from COVID-19 during the study period. The general trend line is shown in black, the trend line for the Wuhan variant — in red, for Delta — in yellow, for Omicron — in blue.
За весь изучаемый период заболеваемость COVID-19 характеризовалась достоверной тенденцией к повышению заболеваемости и одновременно к снижению госпитализации и смертности (рис. 4). С учётом циклического характера динамики эпидемического процесса, а также неоднократной смены доминирующего варианта SARS-CoV-2 дополнительно были рассчитаны 3 линии тренда для диапазонов доминирования вариантов Ухань, Дельта и Омикрон. С самого начала пандемии на фоне этиологического агента COVID-19 варианта Ухань (январь 2020 г. — апрель 2021 г.) отмечалась достоверная тенденция к росту всех 3 изучаемых в работе эпидемиологических показателей. В период доминирования варианта Дельта (май 2021 г. — декабрь 2021 г.) сохранялся достоверный тренд к росту смертности на фоне стабилизации среднего уровня заболеваемости (нет достоверной тенденции к изменению заболеваемости) и достоверной смене направления тенденции случаев госпитализации населения. Во время доминирования варианта Омикрон (январь 2022 г. — ноябрь 2022 г.) динамика всех 3 показателей характеризовалась достоверной тенденцией к снижению.
Исследование динамики интенсивных показателей указывает на то, что наиболее высокой заболеваемость была в период циркуляции варианта Омикрон, которая в пике достигала 5 тыс. на 100 тыс. населения в месяц. В периоды доминирования вариантов Ухань и Дельта динамика госпитализаций в целом соответствовала динамике заболеваемости, хотя с существенно менее выраженными подъёмами и спадами. В период доминирования варианта Омикрон на фоне колоссального роста заболеваемости наблюдалось снижение количества госпитализируемых. Детальный анализ смертности указывает на то, что данный показатель повышался в период распространения варианта Дельта и понижался в период доминирования варианта Омикрон. В период прихода варианта Омикрон количество прошедших вакцинацию и перенесших COVID-19 достигало максимальных значений (рис. 1, в).
Результаты молекулярно-генетического анализа показывают, что в середине интервала доминирования варианта Ухань (сентябрь–октябрь 2020 г.) в Москве начали появляться субварианты, имеющие дополнительные мутации в составе рецептор-связывающего домена (receptor-binding domain, RBD) A522S, N501Y, S477N, E484K (рис. 5, а), что может быть одной из причин формирования второго подъёма заболеваемости (рассматриваемый нами период 3). Два цикла подъёма и спада динамики показателей в интервале доминирования варианта Дельта сложно объяснить изменчивостью вируса, т.к. весь этот период наблюдалось почти абсолютное распространение штаммов Дельта с заменами T478K и L452R (рис. 5, б). В свою очередь чрезвычайная изменчивость RBD варианта Омикрон (рис. 5, в) объясняет столь стремительное распространение и последовавший второй пик заболеваемости в интервале доминирования Омикрона.
Рис. 5. Помесячная динамика мутаций в рецептор-связывающем домене (RBD) Spike белка у различных вариантов SARS-CoV-2 Ухань (а), Дельта (б) и Омикрон (в). По оси ординат — основные мутации.
Fig. 5. Monthly dynamics of amino acid changes have been detected in the receptor-binding domain (RBD) spike protein of various SARS-CoV-2 variants Wuhan (a), Delta (b) and Omicron (c). The Y-axis denotes major mutations.
Обсуждение
Выбранные нами для анализа характеристик эпидемического процесса COVID-19 в Москве периоды с марта 2020 г. по октябрь 2022 г. в целом соответствуют данным литературы [1, 3] с тем лишь отличием, что мы выделили все временны́е отрезки между пиками заболеваемости в самостоятельные периоды, а также включили более поздние события весны–осени 2022 г. В связи с этим наш анализ включает 11 периодов, а не 7 или 5, как у других отечественных авторов. По основным характеристикам эпидемического процесса текущее исследование сходится с результатами исследования Н.И. Брико, проведённом на базе двух медицинских стационаров Москвы. Из 6 подъёмов заболеваемости 3 (включая 1, 5, 9) действительно объясняются распространением новых вариантов возбудителя COVID-19 Ухань, Дельта и Омикрон соответственно, тогда как летнее снижение заболеваемости в периодах 2, 6, 10 сложно объяснять без учёта дополнительных факторов сезонности или динамики напряжённости иммунитета популяции.
К возможному переходу эпидемического процесса к динамике заболеваемости с выраженной сезонностью склоняется ряд отечественных [1] и зарубежных авторов [5]. Вероятно, пока нельзя говорить о строгой сезонности, т.к. ни в одном из изучаемых нами периодов не прекращается циркуляция вируса, однако снижение заболеваемости в весенние, летние или осенние месяцы является достаточно выраженным и, возможно, со временем оно станет ещё более чётким. Так, в периоде 10 наблюдалось самое сильное падение заболеваемости в летний период. Дальнейший мониторинг позволит оценить истинное влияние сезонных факторов на характеристики эпидемического процесса.
Альтернативным объяснением летней динамики в периодах 2, 6, 10 может быть с самого начала заданная ограничительными мероприятиями и динамикой вакцинальной кампании неоднородность напряжённости иммунитета популяции в целом. Напряжённость иммунитета после вакцинации и ранее перенесённого заболевания изменяется во времени [6]. Оценка влияния напряжённости иммунитета во времени требует наличия качественно собранных и обработанных данных, полученных в рамках как кросс-секционных, так и постоянных мониторинговых исследований с применением банка сывороток [7]. Анализируя циклический характер динамики проявлений эпидемического процесса, нельзя не отметить их парадоксальность в некоторых периодах, выделенных в нашем исследовании. В период 4 наблюдается довольно благоприятная эпидемическая ситуация, несмотря на снятие по всей стране в январе 2021 г. противоэпидемических и ограничительных мероприятий, основанных на неспецифической профилактике [1, 8]. В этот период росту заболеваемости также должны способствовать сезонные факторы и отсутствие широкого охвата населения прививками. Наиболее вероятным объяснением парадокса в периоде 4 является достижение в популяции уровня иммунитета, способного естественным образом тормозить эпидемический процесс в результате естественного контакта популяции с SARS-CoV-2. К сожалению, существующих в открытом доступе научных данных недостаточно, чтобы с уверенностью говорить о формировании в этот период в Москве коллективного иммунитета такого уровня.
Имеются публикации, оценивающие уровень серопозитивности в отдельных регионах России. Согласно результатам, полученным для Санкт-Петербурга, итогом первой волны COVID-19 было то, что до 30% лиц приобрели иммунитет [9]. Если предположить, что по результатам первой и второй волн заболеваемости (периоды 1 и 3) в Москве иммунитет к SARS-CoV-2 приобрело сравнимое количество людей, то это может означать, что в этот период популяция приблизилась к уровню специфического иммунитета 60%, что в случае возбудителя с базовым репродуктивным числом 2 достаточно для естественного торможения эпидемического процесса вызываемой им инфекции [10]. Последующий рост заболеваемости объясняется необходимостью более высокого уровня популяционного иммунитета по отношению к вариантам Альфа [11] и Дельта [12]. В случае Дельта для достижения коллективного иммунитета с учётом эффективности вакцин требуется охват населения вакцинацией на уровне 90%. Между тем значение этого показателя на протяжении всего периода нельзя считать достаточным (рис. 4).
Вакцинация препаратом «Спутник V» с доказанной эпидемиологической эффективностью [13] в Москве достигает заметных темпов лишь в период 5, что совпало с появлением и началом циркуляции генетического варианта Дельта в популяции. Второй пик вакцинации и ревакцинации наблюдался осенью 2021 г. и совпал с четвертой волной в период 7, также вызванной продолжением циркуляции варианта Дельта. За 1,5 года вакцинальной компании было привито чуть более половины взрослого населения Москвы (рис. 4). Это означает, что на протяжении всего изучаемого периода с учётом реального охвата вакцинацией уровень иммунитета, формируемого вакцинацией, не достигал необходимого значения, требуемого для прекращения передачи вируса. Растянутость во времени вакцинации и контакта популяции с вирусом вызвали новые вопросы, связанные с динамикой формирования напряжённого иммунитета популяции и эффективностью применяемых вакцин в отношении сменяющих друг друга генетических вариантов возбудителя. Проведённые нами исследования указывают на существенное снижение вируснейтрализующей активности антител в отношении вариантов Дельта [14] и ещё более выраженное — в отношении варианта Омикрон [15]. Ранее нами было продемонстрировано, что успешность распространения варианта Дельта была связана с его способностью накапливаться на слизистых носа и горла, на 2–3 порядка выше такой характеристики для варианта Ухань [16], что повышает эффективность путей передачи и делает заболевших более выраженными источниками инфекции. В случае варианта Омикрон в существенной степени меняются антигенные характеристики возбудителя за счёт интенсивного накопления мутаций в составе RBD, участвующего во взаимодействии с рецептором и являющегося основным сайтом связывания нейтрализующих антител [17]. Это указывает на существование конкретных вирусологически обусловленных механизмов, благодаря которым свойства этиологического агента со временем постоянно повышали требования к значениям уровня специфического иммунитета популяции в отношении как размера иммунной прослойки, так и качества нейтрализующих антител. В промежуточных периодах снижение заболеваемости, вероятно, объясняется временным достижением необходимого уровня напряжённости иммунитета популяции для конкретного этиологического агента, доминировавшего в этот момент.
Динамика госпитализаций во всём изучаемом периоде в целом соответствовала динамике заболеваемости в Москве до периода 9 (до интродукции варианта Омикрон). По нашим оценкам, максимальный уровень числа новых случаев госпитализации в период 1 наблюдался раньше, чем пик заболеваемости, что совпадает с результатами других отечественных авторов [3]. Во время периодов 2 и 4, характеризующихся стабилизацией показателя заболеваемости, отмечается увеличение количества госпитализаций. Это может указывать на асинхронность динамики госпитализации и динамики заболеваемости, что может отражать особенности работы госпитального звена здравоохранения в Москве, включающие изменение размера коечного фонда стационаров и требований к госпитализации [3]. Периоды 9 и 11, сопровождавшиеся циркуляцией варианта Омикрон, в отличие от других периодов, характеризовались более выраженными подъёмами заболеваемости. Уровни заболеваемости были в несколько раз выше, чем ранее, однако число госпитализированных пациентов в периоды 9 и 11 существенно снизилось по сравнению с другими периодами. На снижение показателя госпитализации могло повлиять несколько факторов, в том числе свойства этиологического агента, а также достигнутый уровень иммунитета популяции. Согласно теории саморегуляции паразитарных систем В.Д. Белякова, появляющиеся новые варианты вируса SARS-CoV-2 становятся менее патогенными для человека, но более контагиозными. Именно к такому объяснению пришли В.Г. Акимкин и соавт. [1].
Стоит отметить, что к периоду распространения варианта Омикрон в мире не осталось популяций, иммунологически наивных в отношении антигенов SARS-CoV-2, в связи с чем исследование тяжести течения COVID-19, вызванного вариантом Омикрон, не представляется возможным. Некоторое усиление тяжести инфекционного процесса, вызванного отдельными сублиниями варианта Омикрон, недавно было показано сотрудниками НИЦЭМ им. Н.Ф. Гамалеи в исследовании с использованием животной модели [19]. Однако в рамках этой модели выявлено, что вирулентные свойства вируса все же сохраняются. В этой связи невозможно достоверно утверждать, что снижение тяжести течения в период доминирования Омикрон действительно связано только с вирусологическими особенностями данного варианта. Не следует игнорировать формирование напряжённого уровня иммунитета как фактора снижения тяжести течения болезни. Влияние вакцинации на снижение тяжести течения для различных групп населения Москвы неоднократно подтверждено результатами исследований в периоды циркуляции вариантов Ухань, Дельта и Омикрон [19–21].
Представленные в настоящем исследовании результаты указывают на высокую ценность комплексного анализа проявлений эпидемического процесса COVID-19 (заболеваемости, госпитализации, смертности) и молекулярно-генетических данных об изменчивости возбудителя, позволяющего своевременно оценивать вероятные риски ухудшения эпидемиологической ситуации. Полученные данные прямо указывают на то, что варианты вируса в существенной степени меняют характер эпидемического процесса. В период циркуляции исходного варианта Ухань (периоды 1–3) в отсутствие средств специфической вакцинопрофилактики снижение заболеваемости достигалось жёсткими немедикаментозными мерами, включая запрет на въезд в Россию иностранных граждан из наиболее поражённых инфекцией стран до полного закрытия государственных границ и прекращения международного авиасообщения [1, 22, 23]. Вводились существенные ограничения для снижения социальных контактов внутри страны, включавшие изоляцию заболевших COVID-19 и контактировавших с ними людей, введение пропускного режима, перевод на удалённую работу и учёбу и т.д. В период распространения варианта Дельта (периоды 5–8) стали доступны и применялись высокоэффективные вакцины «Спутник V» и «Спутник Лайт». К сожалению, к моменту интродукции варианта Дельта охват вакцинацией и иммунитет, сформированный в результате перенесённого COVID-19, не позволили достичь необходимого уровня иммунитета популяции. Между тем заболеваемость в период доминирования варианта Дельта уже не достигала уровней заболеваемости второго пика, вызванного вариантом Ухань, что указывает на действенность, хотя бы частично, иммунной прослойки, достигнутой в предыдущих периодах, в том числе с применением вакцинации. Это, вероятно, уберегло от летального исхода существенное количество людей, в том числе активно вакцинировавшихся летом 2021 г. Количество госпитализаций в период доминирования варианта Дельта не увеличилось, однако даже при сниженной заболеваемости в этот период смертность в оба пика была выше по сравнению с предыдущими этапами пандемии (рис. 4), что указывает на высокую вирулентность варианта Дельта по отношению к ранее циркулировавшему варианту вируса SARS-CoV-2. Активная политика Департамента здравоохранения Москвы в отношении вакцинации в период доминирования варианта Дельта также способствовала тому, что к приходу варианта Омикрон совокупная доля лиц, имеющих антитела, приблизилась к 100%. На это указывают результаты скрининговых исследований участников клинических испытаний, проводимых в НИЦЭМ им. Н.Ф. Гамалеи.
Заключение
Проведённый анализ указывает на то, что существенная часть динамики характеристик эпидемического процесса в Москве может объясняться свойствами возбудителя, сезонностью и динамикой напряжённости иммунитета. Проведённый молекулярно-эпидемиологического мониторинг COVID-19 позволил выявить меняющиеся свойства этиологического агента SARS-CoV-2 и их влияние на эпидемиологическое благополучие. Изменчивость вируса SARS-CoV-2, в том числе в RBD, оказывает влияние на эффективность существующих схем профилактики и терапии, поэтому имеется необходимость постоянной корректировки стратегии контроля за продолжающейся пандемией, в том числе для пересмотра применяющихся средств диагностики, вакцинопрофилактики и лечения [24].
В случае варианта Дельта произошло повышение роли заболевших как источника инфекции за счёт увеличения вирусной нагрузки на слизистых, более активного выделения вируса в окружающую среду и, как следствие, повышения активности путей передачи инфекции. В случае прихода варианта Омикрон наблюдается изменение антигенной специфичности RBD, что способствует уходу вируса от нейтрализующих антител, и, в итоге, снижение уровня защищённости. Влияние динамики показателей напряжённости коллективного иммунитета на ход эпидемического процесса предстоит изучить дополнительно. Выявление маркеров протективности существенно упростит данную задачу.
Между тем очевидно, что молекулярно-генетический мониторинг SARS-CoV-2 является важнейшим компонентом эпидемиологического надзора, способствующим более рациональному принятию управленческих решений по предотвращению дальнейшего распространения новой коронавирусной инфекции и снижению экономико-социальных последствий пандемии.
Этическое утверждение. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен локальным этическим комитетом Национального научно-исследовательского института эпидемиологии и микробиологии им. Н.Ф. Гамалеи (протокол № 14 от 29.09.2021).
Источник финансирования. Исследование выполнено при финансовой поддержке Министерства здравоохранения РФ в рамках реализации Государственное задание №123031400022-0 «Изучение изменчивости SARS-CoV-2 в контексте биологических рисков снижения эффективности применяемых средств терапии и профилактики в ходе пандемии COVID-19».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Гущин В.А., Почтовый A.A. — концепция и дизайн исследования, написание; Кустова Д.Д., Огаркова Д.А. — сбор и обработка материала, статистическая обработка; Клейменов Д.А., Семененко Т.А., Логунов Д.Ю., Злобин В.И. — написание и редактирование; Гинцбург А.Л. — концепция и дизайн исследования. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Ethics approval. The study was conducted with the informed consent of the patients. The research protocol was approved by the Local Ethics Committee of the National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya (protocol No. 14, September 29, 2021).
Funding source. The study was funded by the Ministry of Health of the Russian Federation (Project No. 123031400022-0, titled "Investigation of SARS-CoV-2 variability in relation to the biological risks associated with the reduced efficacy of therapy and prevention used during the COVID-19 pandemic").
Conflict of interest. The authors declare no apparent or potential conflicts of interest related to the publication of this article.
Author contribution. Gushchin V.A., Pochtovyi A.A. — research concept and design, editing; Kustova D.D., Ogarkova D.A. — collection and processing of material, statistical processing; Kleymenov D.A., Semenenko T.A., Logunov D.Y, Zlobin V.I. — writing and editing; Gintsburg A.L. — research concept and design. Аll authors made a substantial contribution to the conception of the work, acquisition, analysis, interpretation of data for the work, drafting and revising the work, final approval of the version to be published.
1 JHU.edu. COVID-19 Dashboard by the Center for Systems Science and Engineering (CSSE) at Johns Hopkins University (JHU). URL: https://coronavirus.jhu.edu/map.html
2 URL: https://www.statista.com/statistics/1109794/coronavirus-covid-19-diagnostics-in-russia
About the authors
Vladimir A. Gushchin
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; Lomonosov Moscow State University
Email: wowaniada@yandex.ru
ORCID iD: 0000-0002-9397-3762
Cand. Sci. (Biol.), Head, Laboratory of Mechanisms of Population Variability of Pathogenic Microorganisms, Reference Center for Coronavirus Infection, National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; Senior Researcher, Department of Virology, Biological Faculty, Lomonosov Moscow State University
Russian Federation, Moscow; MoscowAndrei A. Pochtovyi
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
Author for correspondence.
Email: a.pochtovyy@gamaleya.org
ORCID iD: 0000-0003-1107-9351
Cand. Sci. (Biol.), Senior Researcher, Laboratory of Mechanisms of Population Variability of Pathogenic Microorganisms
Russian Federation, MoscowDaria D. Kustova
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; Lomonosov Moscow State University
Email: kustovad70@gmail.com
ORCID iD: 0000-0002-8382-275X
Laboratory Assistant-Researcher, Laboratory of Mechanisms of Population Variability of Pathogenic Microorganisms, National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; Postgraduate Student, Department of Virology, Biological Faculty, Lomonosov Moscow State University
Russian Federation, Moscow; MoscowDarya A. Ogarkova
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
Email: dashadv1993@gmail.com
ORCID iD: 0000-0002-1152-4120
Junior Researcher, Laboratory of Mechanisms of Population Variability of Pathogenic Microorganisms
Russian Federation, MoscowDenis A. Kleymenov
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
Email: mne10000let@gmail.com
ORCID iD: 0000-0001-9422-7238
Cand. Sci. (Med.), Head, Laboratory of Translational Biomedicine
Russian Federation, MoscowTatyana A. Semenenko
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
Email: meddy@inbox.ru
ORCID iD: 0000-0002-6686-9011
Doct. Sci. (Med.), Prof., Head, Department of Epidemiology
Russian Federation, MoscowDenis Yu. Logunov
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
Email: ldenisy@gmail.com
ORCID iD: 0000-0003-4035-6581
Doct. Sci. (Biol.), Full Member of RAS, Head, Laboratory of Cell Microbiology
Russian Federation, MoscowVladimir I. Zlobin
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya
Email: vizlobin@mail.ru
ORCID iD: 0000-0002-1862-0609
Doct. Sci. (Med.), Full Member of RAS, Main Researcher, Laboratory of Mechanisms of Population Variability of Pathogenic Microorganisms
Russian Federation, MoscowAlexander L. Gintsburg
National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; I.M. Sechenov First Moscow State Medical University of the Ministry of Health of the Russian Federation (Sechenov University)
Email: gintsburg@gamaleya.org
ORCID iD: 0000-0003-1769-5059
Doct. Sci. (Biol.), Full Member of RAS, National Research Centre for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya; Head, Department of Infectiology and Virology, I.M. Sechenov First Moscow State Medical University (Sechenov University)
Russian Federation, Moscow; MoscowReferences
- Акимкин В.Г., Попова А.Ю., Плоскирева А.А. и др. COVID-19: эволюция пандемии в России. Сообщение I: проявления эпидемического процесса COVID-19. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(3):269–86. Akimkin V.G., Popova A.Yu., Ploskireva A.A., et al. COVID-19: the evolution of the pandemic in Russia. Report I: manifestations of the COVID-19 epidemic process. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(3):269–86. DOI: https://doi.org/10.36233/0372-9311-276 EDN: https://elibrary.ru/zxgtfd
- Акимкин В.Г., Кузин С.Н., Семененко Т.А. и др. Гендерно-возрастная характеристика пациентов с COVID-19 на разных этапах эпидемии в Москве. Проблемы особо опасных инфекций. 2020;(3):27–35. Akimkin V.G., Kuzin S.N., Semenenko T.A., et al. Gender-age distribution of patients with COVID-19 at different stages of epidemic in Moscow. Problems of Particularly Dangerous Infections. 2020;(3):27–35. DOI: https://doi.org/10.21055/0370-1069-2020-3-27-35 EDN: https://elibrary.ru/idsdet
- Брико Н.И., Коршунов В.А., Краснова С.В. и др. Клинико-эпидемиологические особенности пациентов, госпитализированных с COVID-19 в различные периоды пандемии в Москве. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(3):287–99. Briko N.I., Korshunov V.A., Krasnova S.V., et al. Clinical and epidemiological characteristics of hospitalized patients with COVID-19 during different pandemic periods in Moscow. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(3):287–99. DOI: https://doi.org/10.36233/0372-9311-272 EDN: https://elibrary.ru/iwbqxv
- Акимкин В.Г., Попова А.Ю., Хафизов К.Ф. и др. COVID-19: эволюция пандемии в России. Сообщение II: динамика циркуляции геновариантов вируса SARS-CoV-2. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(4):381–96. Akimkin V.G., Popova A.Yu., Khafizov K.F., et al. COVID-19: evolution of the pandemic in Russia. Report II: dynamics of the circulation of SARS-CoV-2 genetic variants. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(4):381–96. DOI: https://doi.org/10.36233/0372-9311-295 EDN: https://elibrary.ru/kvulas
- Fontal A., Bouma M.J., San-José A., et al. Climatic signatures in the different COVID-19 pandemic waves across both hemispheres. Nat. Comput. Sci. 2021;1:655–65. DOI: https://doi.org/10.1038/s43588-021-00136-6
- Комбарова С.Ю., Алешкин А.В., Новикова Л.И. и др. Особенности гуморального ответа на инфекцию, вакцинацию и ревакцинацию при COVID-19. Бюллетень экспериментальной биологии и медицины. 2022;173(6):719–725. Kombarova S.Yu., Aleshkin A.V., Novikova L.I., et al. Features of the humoral response to infection, vaccination, and revaccination during COVID-19. Bulletin of Experimental Biology and Medicine. 2022;173(6):734–9. DOI: https://doi.org/10.1007/s10517-022-05620-1 EDN: https://elibrary.ru/lickdm
- Гущин В.А., Мануйлов В.А., Мазунина Е.П. и др. Иммунологическая память как основа рациональной вакцинопрофилактики населения. Обоснование создания системы сероэпидемиологического мониторинга в России. Вестник Российского государственного медицинского университета. 2017;(5):5–28. Gushchin V.A., Manuilov V.A., Mazunina E.P., et al. Immunological memory as a basis for a wise vaccination strategy. a rationale for introducing a comprehensive seroepidemiological surveillance system in Russia. Bulletin of Russian State Medical University. 2017;(5):5–25. DOI: https://doi.org/10.24075/brsmu.2017-05-01 EDN: https://elibrary.ru/zwrdtx
- Акимкин В.Г., Кузин С.Н., Колосовская Е.Н. и др. Характеристика эпидемиологической ситуации по COVID-19 в Санкт-Петербурге. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(5):497–511. Akimkin V.G., Kuzin S.N., Kolosovskaya E.N., et al. Assessment of the COVID-19 epidemiological situation in St. Petersburg. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2021;98(5):497–511. DOI: https://doi.org/10.36233/0372-9311-154 EDN: https://elibrary.ru/dtmnhz
- Попова А.Ю., Ежлова Е.Б., Мельникова А.А. и др. Популяционный иммунитет к SARS-CoV-2 среди населения Санкт-Петербурга в период эпидемии COVID-19. Проблемы особо опасных инфекций. 2020;(3):124–30. Popova A.Yu., Ezhlova E.B., Mel'nikova A.A., et al. Herd immunity to SARS-CoV-2 among the population in Saint-Petersburg during the COVID-19 epidemic. Problems of Particularly Dangerous Infections. 2020;(3):124–30. DOI: https://doi.org/10.21055/0370-1069-2020-3-124-130 EDN: https://elibrary.ru/oxhool
- Liu Y., Gayle A.A., Wilder-Smith A., Rocklöv J. The reproductive number of COVID-19 is higher compared to SARS coronavirus. J. Travel Med. 2020;27(2):taaa021. DOI: https://doi.org/10.1093/jtm/taaa021
- Davies N.G., Abbott S., Barnard R.C., et al. Estimated transmissibility and impact of SARS-CoV-2 lineage B.1.1.7 in England. Science. 2021;372(6538):eabg3055. DOI: https://doi.org/10.1126/science.abg3055
- Liu Y., Rocklöv J. The reproductive number of the Delta variant of SARS-CoV-2 is far higher compared to the ancestral SARS-CoV-2 virus. J. Travel Med. 2021;28(7):taab124. DOI: https://doi.org/10.1093/jtm/taab124
- Logunov D.Y., Dolzhikova I.V., Shcheblyakov D.V., et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397(10275):671–81. DOI: https://doi.org/10.1016/s0140-6736(21)00234-8
- Gushchin V.A., Dolzhikova I.V., Shchetinin A.M., et al. Neutralizing activity of sera from Sputnik V-vaccinated people against variants of concern (VOC: B.1.1.7, B.1.351, P.1, B.1.617.2, B.1.617.3) and Moscow endemic SARS-CoV-2 variants. Vaccines (Basel). 2021;9(7):779. DOI: https://doi.org/10.3390/vaccines9070779
- Lapa D., Grousova D.M., Matusali G., et al. Retention of neutralizing response against SARS-CoV-2 Omicron variant in Sputnik V-vaccinated individuals. Vaccines (Basel). 2022;10(5):817. DOI: https://doi.org/10.3390/vaccines10050817
- Gushchin V.A., Pochtovyi A.A., Kustova D.D., et al. Dynamics of SARS-CoV-2 major genetic lineages in Moscow in the context of vaccine prophylaxis. Int. J. Mol. Sci. 2022;23(23):14670. DOI: https://doi.org/10.3390/ijms232314670
- Jung C., Kmiec D., Koepke L., et al. Omicron: What makes the latest SARS-CoV2 variant of concern so concerning? J. Virol. 2022;96(6):e0207721. DOI: https://doi.org/10.1128/jvi.02077-21
- Dolzhikova I., Grousova D., Zorkov I., et al. Pathogenicity of SARS-CoV-2 Omicron BA.5 and BE.1 variants in Syrian hamsters and ACE2-transgenic mice. Preprints. 2022;2022120202. DOI: https://doi.org/10.20944/preprints202212.0202.v1
- Gushchin V.A., Tsyganova E.V., Ogarkova D.A., et al. Sputnik V protection from COVID-19 in people living with HIV under antiretroviral therapy. EClinicalMedicine. 2022;46:101360. DOI: https://doi.org/10.1016/j.eclinm.2022.101360
- Sukhikh G.T., Priputnevich T.V., Ogarkova D.A., et al. Sputnik Light and Sputnik V vaccination is effective at protecting medical personnel from COVID-19 during the period of Delta variant dominance. Vaccines (Basel). 2022;10(11):1804. DOI: https://doi.org/10.3390/vaccines10111804
- Shkoda A.S., Gushchin V.A., Ogarkova D.A., et al. Sputnik V effectiveness against hospitalization with COVID-19 during Omicron dominance. Vaccines (Basel). 2022;10(6):938. DOI: https://doi.org/10.3390/vaccines10060938
- Кутырев В.В., Попова А.Ю., Смоленский В.Ю. и др. Эпидемиологические особенности новой коронавирусной инфекции (COVID-19). Сообщение 1: Модели реализации профилактических и противоэпидемических мероприятий. Проблемы особо опасных инфекций. 2020;(1):6–13. Kutyrev V.V., Popova A.Yu., Smolenskii V.Yu., et al. Epidemiological features of new coronavirus infection (COVID-19). Communication 1: modes of implementation of preventive and anti-epidemic measures. Problems of Particularly Dangerous Infections. 2020;(1): 6–13. DOI: https://doi.org/10.21055/0370-1069-2020-1-6-13 EDN: https://elibrary.ru/xgryta
- Кутырев В.В., Попова А.Ю., Смоленский В.Ю. и др. Эпидемиологические особенности новой коронавирусной инфекции (COVID-19). Сообщение 2: особенности течения эпидемического процесса COVID-19 во взаимосвязи с проводимыми противоэпидемическими мероприятиями в мире и Российской Федерации. Проблемы особо опасных инфекций. 2020;(2):6–12. Kutyrev V.V., Popova A.Yu., Smolenskii V Yu., et al. Epidemiological peculiarities of new coronavirus infection (COVID-2019). Communication 2: peculiarities of epidemic process development in conjunction with performed anti-epidemic measures around the world and in the Russian Federation. Problems of Particularly Dangerous Infections. 2020;(2):6–12. DOI: https://doi.org/10.21055/0370-1069-2020-2-6-12 EDN: https://elibrary.ru/yjypln
- Гущин В.А. Молекулярно-эпидемиологический мониторинг и оценка эффективности средств специфической диагностики и вакцинопрофилактики новой коронавирусной инфекции (COVID-19): Дисс. … д-ра биол. наук. М.;2023. Gushchin V.A. Molecular epidemiological monitoring and evaluation of the effectiveness of specific diagnostics and vaccination of new coronavirus infection (COVID-19): Diss. Moscow;2023.
Supplementary files