Gut microbiota and carcinogenesis in various human organs
- Authors: Kostin R.K.1, Malyugin D.A.2, Solenova L.G.3, Kulaeva E.D.4
-
Affiliations:
- I.M. Sechenov First Moscow State Medical University (Sechenov University)
- Voronezh State Medical University named after N.N. Burdenko
- Research Institute of Carcinogenesis, N.N. Blokhin National Medical Research Center for Oncology
- South Federal University
- Issue: Vol 100, No 1 (2023)
- Pages: 110-125
- Section: REVIEWS
- URL: https://microbiol.crie.ru/jour/article/view/4776
- DOI: https://doi.org/10.36233/0372-9311-310
- ID: 4776
Cite item
Full Text
Abstract
Scientific research in recent years has revealed a significant role of the human microbiome in carcinogenesis. These data served as a rationale for the inclusion of polymorphic microbiomes in the key characteristics of carcinogenesis as an important mechanistic determinant of cancer, in addition to other fundamental biological processes manifested during multi-stage carcinogenesis. The microbiome of the gastrointestinal tract is most actively involved in the pathogenesis of malignant neoplasms of the digestive system due to changes in the quantitative and qualitative composition of the microbiota, and increase in the production of genotoxic bacterial metabolites as factors of carcinogenesis. This review also addresses the changes in the microbiome in lung cancer, associated mainly with the production of short-chain fatty aicids, and in breast and endometrial cancers with specific changes in the composition of the bacterial community towar)ds species involved in the metabolism of estrogen precursors. The probable mechanisms of microorganisms’ participation in the development of prostate cancer (the effect of lipopolysaccharides, antibiotics and deconjugated estrogen) are considered.
Data on the relationship between the composition and metabolic characteristics of the microbiome in various cancer sites open up perspectives for its use in the diagnosis, treatment and prevention of malignant neoplasms and justify the need for further research in this area.
Full Text
Введение
Злокачественные новообразования входят в число ведущих социально значимых заболеваний. Ввиду высокой заболеваемости и смертности данные заболевания сопряжены с большими социальными потерями существенной нагрузкой на здравоохранение и высокими экономическими затратами [1]. Выявление факторов, влияющих на онкологические риски, не теряет своей актуальности и входит в число научных приоритетов. Наряду с большим перечнем физических и химических канцерогенов, этиологическими факторами в развитии онкопатологии признаны микроорганизмы (вирусы, бактерии, простейшие). В последние годы особое внимание научного сообщества привлекает изучение микроорганизмов, населяющих организм человека и способных модифицировать онкологические риски, обусловленные действием эндогенных и экзогенных канцерогенных факторов. Подавляющая масса этих микроорганизмов, по своей природе являющихся симбионтами, сосредоточена в желудочно-кишечном тракте (ЖКТ).
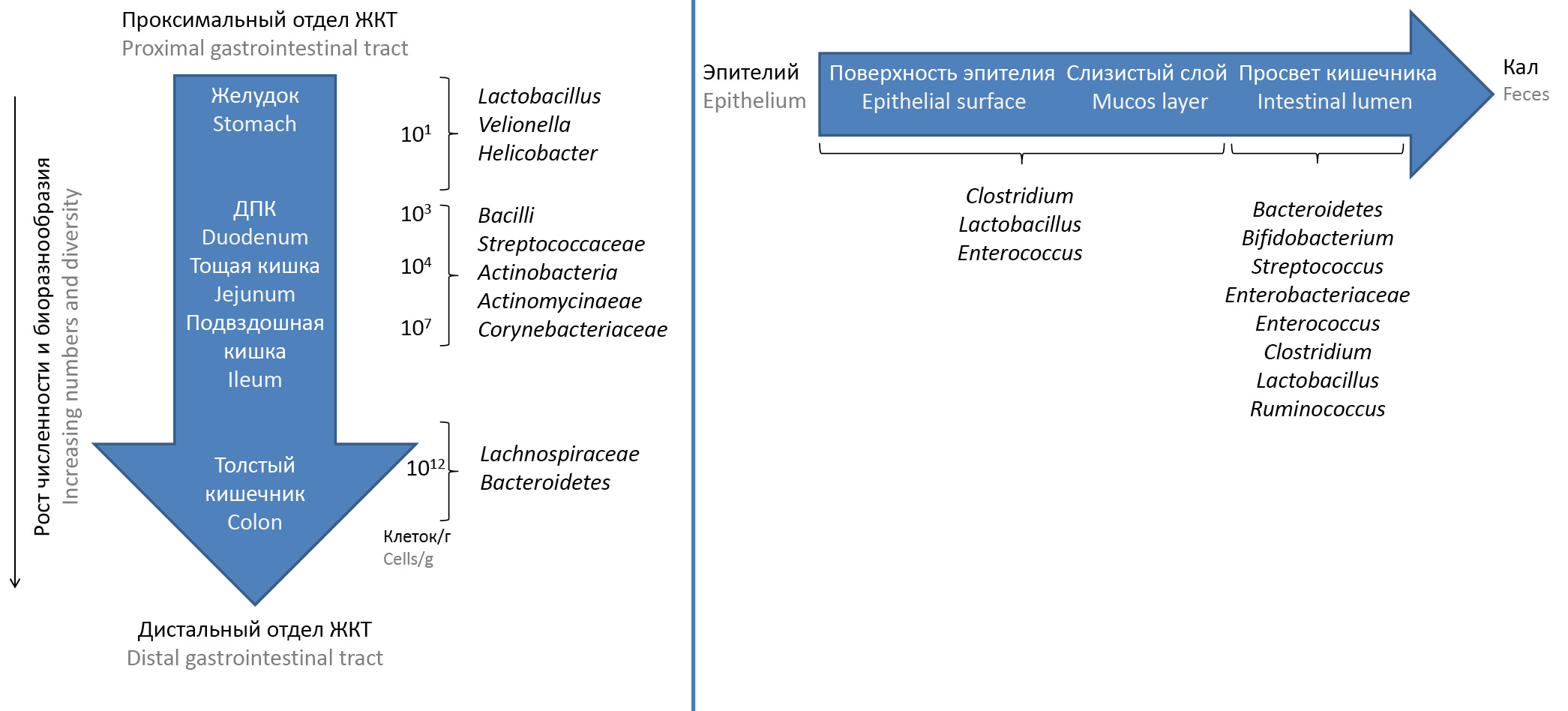
Микробиом ЖКТ человека — это большое, сложное, динамичное микробное сообщество, состоящее из 1014 микроорганизмов более чем 1000 видов, что эквивалентно 4 × 106 генам [1]. В ЖКТ человека чаще всего встречаются Firmicutes (≈ 51%) и Bacteroidetes (≈ 48%), далее следуют представители других типов бактерий, включая Actinobacteria, Cyanobacteria, Fusobacteria, Proteobacteria и Verrucomicrobia [2, 3]. В дистальных отделах ЖКТ увеличивается численность микробиоты, она становится более разнообразной (рис. 1).
Рис. 1. Микробиом различных отделов ЖКТ и его распределение в слоях кишечника (адаптировано из [3]).
Fig. 1. Microbiome of different parts of the gastrointestinal tract and its distribution in intestinal layers (adapted from [3]).
Микробиота ЖКТ влияет на иммунологические и метаболические процессы в организме человека различными путями, основными из которых являются:
1) стимуляция или, напротив, подавление выделения цитокинов: фактора некроза опухоли (ФНО), интерферона-γ, интерлейкинов (ИЛ) — провоспалительных (ИЛ-1, -2, -6, -8) или противовоспалительных (ИЛ-4, -10) [4];
2) индукция воспалительных реакций посредством образования токсинов и генотоксичных метаболитов (колибактин Escherichia coli, цитолетальный разрыхляющий токсин Compylobacter jejuni), а также нарушения нормальной функции слизистого барьера [4];
3) продукция короткоцепочечных жирных кислот (КЦЖК), которые необходимы для поддержания клеточного гомеостаза, поскольку они способствуют модуляции гистоновых деацетилаз, что приводит к прикреплению клеток бактерий к стенкам ЖКТ, миграции иммунных клеток, выработке цитокинов, хемотаксису и апоптозу [4];
4) канцерогенное действие липополисахаридов (ЛПС) клеточной стенки (для грамотрицательных бактерий);
5) изменение местного и системного иммунитета посредством нескольких механизмов:
- изменённую экспрессию генов, кодирующих белки, участвующие в воспалительной реакции;
- пролиферацию и апоптоз;
- через ряд иммунно-опосредованных изменений (аномальная экспрессия субпопуляций лейкоцитов, изменение секреции антител, цитокинов и иммуноглобулинов);
6) влияние на уровень циркулирующих эстрогенов и баланс в энергетическом обмене [1, 5] (рис. 2).
Рис. 2. Влияние кишечной микробиоты на развитие злокачественных новообразований (адаптировано из [6]).
Fig. 2. Influence of intestinal microflora on the malignant neoplasms development (adapted from [6]).
Понимание механизмов канцерогенеза, связанных с микроорганизмами, населяющими ЖКТ, а также разработка новых подходов к регулированию количественного и качественного состава микробиоты ЖКТ в дальнейшем важны при создании инновационных методов лечения и профилактики онкологических заболеваний. Постоянно пополняющийся объём экспериментальных и эпидемиологических исследований делает необходимым их обобщение, структурирование и анализ как основы их практического использования в онкологии.
Цель исследования — обобщение текущих данных о роли микробиоты ЖКТ в патогенезе онкологических заболеваний в различных органах человека с акцентом на молекулярные механизмы взаимодействия микробиоты и макроорганизма.
Проанализированы статьи базы данных MEDLINE (PubMed). Поиск выполнялся по расширенному перечню ключевых слов, включающему все рассматриваемые в обзоре локализации злокачественных новообразований. Мы создали строку поиска, используя логический оператор соединения (AND) и логический оператор дизъюнкции (OR). Поиск был основан на метаданных, включая название, аннотацию и ключевые слова. Были учтены следующие параметры: публикации за последние 10 лет, бесплатный полный доступ к тексту статьи, язык публикации — английский.
Всего было найдено 1233 статьи (клинические испытания, оригинальные исследования, метаанализы, рандомизированные контролируемые исследования, традиционные, систематические и зонтичные обзоры). Далее просматривались заголовки, аннотации, полнотекстовые версии статей. Были отобраны 30 соответствующих тематике статей. В процессе изучения исследований также просматривались другие источники, включённые в список литературы отобранных статей.
Микробиота при раке пищевода
Механизм аденокарциномы пищевода активно изучается в связи с воздействием генетических, средовых, поведенческих факторов [7]. Анализ микробиоты образцов ткани здорового пищевода, ткани при пищеводе Барретта и при эзофагите показал значительные различия в них бактериального состава. При эзофагите доля грамотрицательных анаэробов и микроаэрофилов была увеличена в 15,4 раза, при пищеводе Барретта — в 16,5 раза [7]. В исследовании, проведённом на 34 пациентах, обнаружено, что Streptococcus — наиболее распространённый таксон в нормальном пищеводе и при рефлюкс- эзофагите, но при пищеводе Барретта преобладают Veillonella (анаэробы), Prevotella (облигатные анаэробы), Haemophilus (факультативные анаэробы), Neisseria (аэробы) и Rothia [7]; род Fusobacterium (строгие анаэробы) был обнаружен только в пищеводе с рефлюкс-эзофагитом или пищеводе Барретта [8]. В другом исследовании в когорте пациентов с пищеводом Барретта выявлена связь между соотношением микроорганизмов родов Streptococcus и Prevotella и абдоминальным ожирением, а также длиной грыжи пищеводного отверстия диафрагмы, которые являются двумя известными факторами риска аденокарциномы [8].
Такие компоненты бактерий, как клеточная стенка и ДНК, могут выступать в качестве лигандов для некоторых рецепторов на эпителии пищевода. Микрофлора пищевода, в которой преобладают грамотрицательные бактерии (Proteobacteria, Bacteroidetes, Fusobacteria [9]), содержит большое количество ЛПС [10]. ЛПС же могут задерживать опорожнение желудка с помощью циклооксигеназы 1/2 или непосредственно влиять на функцию нижнего пищеводного сфинктера, повышая внутрижелудочное давление и способствуя возникновению гастроэзофагеальной рефлюксной болезни, что может приводить к развитию аденокарциномы [10]. ЛПС (а также пептидогликан и флагеллин) выступают в качестве лиганда для Толл-подобного рецептора 4 (TLR4), активируя его экспрессию [10]. Активация TLR4 запускает путь NF-κB, связанный с канцерогенезом [11]. Кроме того, после того как клетки пищевода Барретта взаимодействовали с ЛПС, увеличивались экспрессия NOD-подобного рецепторного белка 3, активность каспазы-1 и секреция ИЛ-1β и -18, что было связано с активацией активных форм кислорода под действием ЛПС и способствовало развитию рака [11].
При плоскоклеточном раке в тканях пищевода, содержащих Fusobacterium nucleatum, увеличено количество специфических генов хемокина CCL20, что указывает на то, что F. nucleatum может способствовать опухолевой инвазии путем стимуляции хемокинов [12]. Известно, что хемокины и их рецепторы участвуют в развитии и прогрессировании опухоли [11].
Белок, ассоциированный с цитотоксином А (CagA), и вакуолизирующий цитотоксин А (VacA), продуцируемые Helicobacter pylori, могут стимулировать канцерогенез. CagA индуцирует повреждение ДНК через опосредованную хозяином повышенную выработку активных форм кислорода [11]. VacA может изменять проницаемость мембран и увеличивать скорость апоптоза [11]. CagA1+ H. pylori может вызывать разрывы ДНК в эпителиальных клетках пищевода, что приводит к атипичной гиперплазии плоских эпителиальных клеток пищевода [13, 14].
Микробиота при раке желудка
В России в 2020 г. заболеваемость раком желудка составила 21,89 случая на 100 тыс. населения, а количество новых зарегистрированных случаев — 32 063 [15]. Высокая распространённость этой патологии во многом определяет интерес к факторам риска его развития, включая биологические факторы.
Желудочная микробиота больных раком желудка характеризуется снижением количества представителей Porphyromonas, Neisseria, Saccharibacteria, Prevotella pallens, Streptococcus sinensis и одновременным увеличением количества бактерий Lactobacillus coleohominis, Klebsiella pneumoniae, Acinetobacter baumannii и Lachnospiraceae [16]. В кишечнике больных раком желудка наблюдается повышение числа факультативных анаэробов — представителей семейства Streptococcaceae и семейства Enterobacteriaceae, рода Escherichia. В отношении облигатных анаэробов наблюдается обратная тенденция — в частности, содержание в кишечнике бактерий Faecalibacterium у онкологических больных ниже на 61,4% по сравнению с данными у людей, не страдающих онкологическими заболеваниями. Это свидетельствует о кислородзависимых изменениях кишечной микробиоты у пациентов с раком желудка. В стуле этих пациентов чаще встречаются представители типа Proteobacteria (p = 0,0155), а значимых отличий по содержанию представителей типов Bacteroidetes и Firmicutes между онкологическими больными и здоровыми не обнаружено [17]. Микробное сообщество у H. pylori-положительных лиц также характеризуется увеличением в микробиоме желудка доли Proteobacteria (аэробы и анаэробы), Spirochaetales (аэробы и анаэробы) и Acidobacteria (преимущественно аэробы), а также снижением доли Actinobacteria (преимущественно аэробы), Bacteroidetes (анаэробы) и Firmicutes (анаэробы) [9]. Наоборот, у H. pylori-отрицательных людей отмечается повышение количества Firmicutes, Bacteroidetes и Actinobacteria [18].
Известно, что рак желудка ассоциирован с воспалительными процессами слизистой оболочки, и важнейшая роль в воспалительном процессе принадлежит H. pylori. В желудке лиц, инфицированных H. pylori, отмечается повышенное накопление провоспалительных цитокинов, в том числе интерферона-γ, ФНО-α, ИЛ-1, -1β, -6, -7, -8, -10 и -18 [9]. Инфицирование CagA-положительными штаммами приводит к активации в желудке онкогенных сигнальных путей (ERK/MAPK, PI3K/Akt, NF-κB, Wnt/β-catenin, Ras, Sonic Hedgehog, STAT3) и возникновению мутаций гена P53 [19, 20]. VacA активирует фактор роста эндотелия сосудов и усиливает активность сигнального пути Wnt/β-катенин, необходимого для роста и дифференцировки клеток, а также ингибирует GSK3 через сигнальный путь PI3K/Akt [21–23].
Важно отметить, что эрадикационная терапия при инфицировании H. pylori может способствовать восстановлению микробиоты желудка, увеличивая количество таких бактерий, как Actinobacteria, Bacteroidetes и Firmicutes, а также бактерий рода Lactobacillus и Bifidobacterium [24]. Эффективная эрадикация H. pylori способствует снижению риска возникновения рака желудка (относительный риск (ОР) = 0,46; 95% ДИ 0,32–0,66) [25].
Роль микробиоты в развитии гепатоцеллюлярной карциномы
Среди опухолей печени гепатоцеллюлярная карцинома (ГЦК) диагностируется более чем в 80% случаев. ГЦК является агрессивной опухолью: при некоторых её формах от момента появления выраженной клинической картины до смерти пациента проходит всего несколько месяцев [25]. Часто регистрируются скрытые формы, когда симптомы проявляются уже при значительных размерах опухоли и наличии отдалённых метастазов. В связи с этим особенно актуально выявление факторов риска ГЦК, помимо уже хорошо известных: цирроза печени, инфицирования вирусом гепатита B и/или C, неалкогольной жировой болезни печени и связанной с алкоголем жировой болезни печени [25]. Для ГЦК характерно снижение в кишечнике количества Lactobacillus spp., Bifidobacterium spp. и Enterococcus spp., при этом наблюдается увеличение числа E. coli [26].
В печень посредством портальной вены попадают различные кишечные метаболиты, в том числе микробные, которые могут вызвать воспалительные изменения и оказаться гепатотоксическими, поэтому потенциально могут способствовать канцерогенезу. Например, микробы, принадлежащие к кластерам Clostridium XI и XIV, модифицируют первичные желчные кислоты, продуцируемые печенью, до вторичных желчных кислот, таких как дезоксихолевая кислота, которая вызывает повреждение ДНК гепатоцитов [27]. VacA и CagA, продуцируемые H. pylori, были обнаружены в тканях печени с ГЦК [9]. ЛПС из H. pylori непосредственно способствует росту и миграции клеток рака печени за счёт повышения уровней ИЛ-8 и трансформирующего фактора роста-β1 [9].
Кроме того, нарушение баланса первичных и вторичных желчных кислот изменяет аккумуляцию естественных клеток-киллеров в печени, которые могут предотвращать первичный и метастатический рост опухоли на моделях мышей (p < 0,05) [28]. Дисбиоз кишечника коррелирует с высоким уровнем желчных кислот, включая дезоксихолевую кислоту, что может ускорять прогрессию опухоли за счёт усиления экспрессии генов IL6 и TNFα, рекрутирования макрофагов в печень и активации TLR4, что было показано на мышиной модели. TLR4 усиливает активацию звездчатых клеток, которые опосредуют хемотаксис клеток Купфера и сенсибилизацию последних к сигналам трансформирующего фактора роста-β, что способствует фиброзу печени [29].
Микробиота при раке поджелудочной железы
Недавние исследования показали, что микробиота ЖКТ может влиять на канцерогенез поджелудочной железы [30]. H. pylori является значимым фактором риска аденокарциномы протоков поджелудочной железы, а также аутоиммунного, острого и хронического панкреатита [31]. Инфицирование H. pylori активирует транскрипционные факторы NF-κB и AP-1, вызывает повышение уровня ИЛ-8, что нарушает регуляцию клеточных процессов, вызывает воспаление и канцерогенез [19, 32]. ЛПС H. pylori вызывают мутации протоонкогена KRAS, которые наблюдаются в 85% случаев при аденокарциноме поджелудочной железы [33]. H. pylori активирует сигнальный белок STAT3, что усиливает экспрессию антиапоптотических и пролиферативных белков, таких как Bcl-xL, MCL-1, сурвивин, c-Myc и циклин D1 [34–36].
Активация Toll-подобных и Nod-подобных рецепторов микробными молекулярными паттернами поддерживает хроническое воспаление поджелудочной железы и вызывает активацию сигнальных путей NF-κB и MAPK, что способствует развитию панкреатита и канцерогенезу [37]. Механизмы, посредством которых кишечная микробиота влияет на развитие рака поджелудочной железы, представлены на рис. 3.
Рис. 3. Роль кишечной микробиоты в развитии рака поджелудочной железы [30].
Fig. 3. The role of the intestinal microbiota in the development of pancreatic cancer [30].
N-3-оксододеканоил-гомосерин, сигнальная молекула системы «чувства кворума» Pseudomonas aeruginosa, связываясь с экспрессируемым в клетках поджелудочной железы белком TAS2R38 (рецептор горького вкуса), повышает активность белка множественной лекарственной устойчивости 1 (ABCB1), способствуя инвазии бактерий и метастазированию рака [38]. Бактерии, колонизирующие ротовую полость, при переносе в поджелудочную железу могут способствовать онкогенезу. Например, Fusobacterium spp. была обнаружена в опухолевой ткани в 8,8% случаев рака поджелудочной железы [39].
Роль микробиоты в развитии колоректального рака
Колоректальный рак (КРР) — распространённое заболевание, доля которого в структуре онкологической заболеваемости населения составляет 12,3%. В 2020 г. в России было зарегистрировано 68 264 новых случая КРР, а заболеваемость составила 46,61 на 100 тыс. населения [15].
КРР — один из первых видов рака, при котором была выявлена связь микробиоты с канцерогенезом [40]. Микробиота, способствующая развитию опухолей, существенно отличается от микробиоты здоровой слизистой (p < 0,05) [41]. В метаанализе по оценке микробиоты кишечника пациентов с КРР было показано увеличение содержания таких бактерий, как Peptostreptococcus stomatis, Gemella morbillorum, Bacteroides fragilis, Parvimonas spp., F. nucleatum, Solobacterium moorei и Clostridium symbiosum, по сравнению с флорой здоровых лиц [42]. Более того, в эксперименте микробиом больных КРР способен вызывать предопухолевые изменения у здоровых животных и усиливать индуцированный канцерогенез, что было показано в опыте с добавлением фекалий от пациентов с КРР в корм стерильным и нестерильным мышам, которым для индукции опухолей кишечника вводили азоксиметан. У большинства стерильных животных наблюдалось усиление пролиферации в тканях толстой кишки (p < 0,05), а у нестерильных — увеличение дисплазии и числа макроскопических полипов (p < 0,01) по сравнению с долей мышей, которым вводилась биота здоровых лиц [43].
По экспериментальным и клиническим данным, фактором развития КРР является дисбактериоз кишечной биоты [43, 44], который возникает при приеме антибиотиков [45]. Было выявлено повышение риска КРР при приеме пенициллина более чем за 1 год до постановки диагноза. Риск возрастал с увеличением числа назначенных курсов антибиотиков (> 10 курсов; ОР = 1,2; 95% ДИ 1,1–1,3) [46].
Влияние антибиотиков на микробиоту даже при краткосрочном применении может иметь длительный эффект, который со временем может способствовать более активному проявлению действия канцерогенных факторов. Применение антибиотиков разных классов (бета-лактамов и фторхинолонов) статистически значимо (p < 0,001) увеличивает риск онкологических заболеваний кроветворной системы (множественной миеломы и лимфомы), пищеварительной системы (колоректального, гепатобилиарного рака, рака поджелудочной железы и желудка), а также лёгких и мочеполовой системы (рака предстательной железы (РПЖ), мочевого пузыря и почек) [47].
Ввиду того, что антибиотики изменяют состав и уменьшают общее разнообразие микробиоты человека, происходят индукция хронического воспаления, подавление дыхательной активности иммунных клеток и, следовательно, снижение их фагоцитарной активности [48], изменение тканеспецифического метаболизма [46].
Отдельные виды бактерий способны продуцировать токсины, которые провоцируют воспалительные реакции и повышают продукцию активных форм кислорода, например B. fragilis [49, 50], другие же (F. nucleatum) изменяют сигнальные пути или снижают эффективность противоопухолевых иммунных факторов [51]. Так, изоформы матриксных металлопротеаз (BFT-1, BFT-2) B. fragilis активируют внутриклеточные сигнальные пути Ras/mTOR и p38 митоген-активируемой протеинкиназы. Металлопротеазы B. fragilis индуцируют экспрессию ингибитора белка апоптоза-2, что приводит к усилению роста опухоли и ингибированию апоптоза [52]. Токсины B. fragilis также увеличивают пролиферацию и проницаемость клеток кишечника, индуцируя экспрессию c-myc после расщепления E-кадгерина и локализации β-катенина в ядре [52]. Более того, энтеротоксигенный B. fragilis способствует эпигенетическим изменениям и повреждению ДНК, индуцируя рекрутирование ДНК-метилтрансферазы 1, а также содержащую домен JmjC гистоновую деметилазу 2B в клетках КРР [52].
Связывание адгезина А F. nucleatum (FadA) с Е-кадгерином способствует активации пути β-catenin–Wnt и усиливает синтез аннексина А1, который стимулирует пролиферацию эпителиальных клеток. FadA также обладает амилоидоподобными свойствами, что усиливает адгезию F. nucleatum к раковым клеткам [52]. Белок-аутотранспортёр 2 F. nucleatum (Fap2) связывает d-галактозу-β(1-3)-N-ацетил-d-галактозамин на раковых клетках и рекрутирует F. nucleatum в опухоли. Fap2 также связывается с иммунорецептором Т-клеток с помощью доменов ингибирующего мотива на основе иммуноглобулина и иммунорецептора на основе тирозина и снижает цитотоксичность Т-клеток и естественных клеток-киллеров, способствуя их гибели, что приводит к выходу опухоли из-под иммунологического контроля [52]. ЛПС F. nucleatum индуцирует экспрессию микроРНК-21 в эпителиальных клетках толстой кишки TLR4-зависимым образом, что вызывает неконтролируемую клеточную пролиферацию и рост опухоли [52].
Штаммы E. coli, синтезирующие поликетидсинтазу (pks+), могут вырабатывать генотоксичные метаболиты [52]. Так, колибактин, связываясь с ДНК, образует поперечные связи ДНК и межцепочечные разрывы, которые нарушают регуляцию клеточного деления и усиливают мутагенез. Специфичная для колибактина мутационная сигнатура, характеризующаяся одноосновными заменами, делециями и вставками в Т-сайтах, характерна при КРР [52].
Роль микробиоты в развитии рака лёгкого
Рак трахеи, бронхов и лёгкого занимает 3-е место в структуре онкологической заболеваемости населения в целом (9,8%) и 1-е место у мужчин (16,5%). В 2020 г. в России заболеваемость составила 37,13 случая на 100 тыс. лиц мужского пола [15]. Основными факторами риска развития рака лёгкого являются курение, загрязнение окружающей среды, канцерогенные производственные воздействия. По последним данным, не исключено и воздействие кишечной микробиоты [53–55].
Между дыхательной и пищеварительной системами имеется взаимосвязь, образующая ось «кишечник–лёгкие». Перенос микробиоты ЖКТ в лёгкие возможен при аспирации желудочно-пищеводного содержимого (например, при рвоте), существует также связь лёгких и кишечника через кровеносную и лимфатическую системы.
При раке лёгкого существенно меняется состав кишечной микробиоты. По данным H. Zhuang и соавт., повышенное содержание бактерий рода Enterococcus в кишечной микробиоте ассоциировано с возникновением рака лёгких (p = 0,0187) [56]. У пациентов c раком лёгких более низкое содержание бактерий рода Kluyvera, Escherichia, Shigella и Enterobacter, а также фирмикутных бактерий рода Dialister и Faecalibacterium, в то время как количество бактерий рода Veillonella, Fusobacterium и Bacteroides значительно выше по сравнению со здоровыми людьми (p < 0,05) [57]. Снижение численности бутират-продуцирующих бактерий кишечной микробиоты (Clostridium leptum, Faecalibacterium prausnitzii, Ruminococcus) характерно для пациентов с немелкоклеточным раком лёгкого (p = 0,001) [58]. Высокое содержание бактерий Bacillus и Akkermansia muciniphila в кишечной микробиоте увеличивает риск возникновения рака лёгких (p < 0,05) [59]. Количество Prevotella, Lactobacillus, Rikenellaceae, Streptococcus, Enterobacteriaceae, Oscillospira и Bacteroides plebius значительно выше в кишечной биоте у пациентов с немелкоклеточным раком лёгкого, чем у здоровых людей (p < 0,05) [60].
Механизмы влияния кишечной микробиоты на онкогенез в лёгких разнообразны. КЦЖК, являясь продуктами метаболизма кишечной микробиоты и действуя в лёгких как сигнальные молекулы, регулируют функции иммунных клеток и снижают интенсивность воспалительных и аллергических реакций [31]. В то же время на мышиных моделях установлено, что некоторые бактерии, колонизирующие лёгкие, способны стимулировать продукцию ИЛ-1β и ИЛ-23 миелоидными клетками через MyD88-зависимый сигнальный путь. Это, в свою очередь, приводит к пролиферации и активации γδ-T-лимфоцитов с последующим повышением продукции эффекторных молекул, таких как ИЛ-17 и др., что приводит к воспалению и пролиферации клеток опухоли [61].
В опухолях лёгких мышей при культивировании были выделены представители рода Lactobacillus (L. murinus, L. reuteri), Streptococcus (S. acidominimus), а также Aneurinibacillus aneurinilyticus, Corynebacterium, Propionibacterium acnes, Brevibacterium massiliense, Microbacterium lacticum, Lactococcus, Bifidobacterium, Acinetobacter radioresistens, Staphylococcus [61].
Помимо воздействия на иммунные и воспалительные реакции, метаболиты бактерий в лёгких могут оказывать генотоксичный эффект [32]. Например, E. faecalis способствует повышенной секреции макрофагами 4-гидроксиноненаля, являющегося высокореактивным альдегидом, повреждающим ДНК [62]. Бактерии рода Fusobacterium оказывают генотоксичный эффект, образуя сероводород [63], а Bacteroides — за счёт генерации активных форм кислорода [64]. Бактериальные белковые токсины, такие как цитолетальный разрыхляющий токсин, цитотоксический некротизирующий фактор, вызывают двуцепочечные разрывы ДНК, а колибактин проявляет канцерогенный эффект за счёт алкилирования ДНК [65].
Таким образом, изменения кишечной микробиоты у пациентов с раком лёгких характеризуются снижением численности бактерий нормальной микробиоты, увеличением численности условно-патогенных бактерий, а также снижением соотношения Bacteroidetes/Firmicutes, что, в свою очередь, сокращает количество циркулирующих КЦЖК, индуцирующих апоптоз, и уменьшает интенсивность иммунных и воспалительных реакций [53].
Микробиота при раке молочной железы
В России рак молочной железы (РМЖ) занимает 1-е место в структуре онкологической заболеваемости у женщин (21,7%) при показателе заболеваемости 82,77 на 100 тыс. лиц женского пола [15]. Факторами риска РМЖ являются возраст 40–60 лет, наследственная предрасположенность (мутации в генах BRCA1 и BRCA2), поздние первые роды (после 30 лет), гормонально-активные опухоли яичников, лечение эстрогенами (70% случаев РМЖ относятся к эстроген-рецептор-положительному подтипу) [66], чрезмерное употребление алкоголя и жирной молочной продукции, курение.
Предполагается, что микробиота кишечника может влиять на развитие злокачественных новообразований молочной железы (или же препятствовать их возникновению), действуя:
1) на метаболизм стероидов, в частности, за счёт своей способности изменять профиль циркулирующих эстрогенов [67]. Бактерии кишечника, способные метаболизировать эстрогены (так называемый эстроболом), выделяют β-глюкуронидазу и β-глюкозидазу, которые деконъюгируют выделенные с желчью эстрогены и способствуют их реабсорбции в кровоток. После деконъюгации свободный эстроген транспортируется в дистальные участки (включая нижний отдел репродуктивной сферы), где он связывается с эстрогеновыми рецепторами и запускает внутриклеточную передачу сигналов [68]. Многие бактерии с β-глюкуронидазной активностью встречаются в 2 доминирующих подгруппах, а именно в кластерах Clostridium leptum и coccoides, которые принадлежат к филуму Firmicutes. Бактерии из родов Escherichia и Shigella, относящиеся к филуму Proteobacteria, также обладают ферментом β-глюкуронидазой [69]. Бактерии рода Bacteroides spp., Eubacterium spp., Roseburia spp., Bifidobacterium spp. обладают β-глюкозидазной активностью [69];
2) на энергетический обмен, замедление которого приводит к ожирению, повышающему риск злокачественных новообразований. Микробиота участвует в синтезе КЦЖК и вторичных солей желчных кислот, которые регулируют энергетический обмен [70];
3) на противоопухолевый иммунитет [19]. Например, КЦЖК бактерий бутират и пропионат способны ингибировать гистоновые деацетилазы опухолевых клеток хозяина. ЛПС, основной компонент наружной мембраны грамотрицательных бактерий, активирует TLR4 на поверхности клетки хозяина, таким образом, рекрутируя Т-клетки против опухолевых клеток. Более того, пиридоксин (витамин B6) бактериального происхождения может стимулировать противоопухолевый иммунный надзор хозяина (p < 0,05) [20].
Таким образом, микробиота кишечника оказывает разнонаправленное действие на риск возникновения РМЖ в зависимости от количественного и качественного её состава.
Участие микробиоты в развитии рака эндометрия
Уровни циркулирующего эстрогена в организме человека зависят от микробиоты кишечника [71], что позволяет вводить понятие оси «кишечник–влагалище», опосредованной эстрогеном [68]. Эстроболом деконъюгирует выделенные с желчью эстрогены и способствует их реабсорбции в кровоток [68]. В соответствии с фундаментальной ролью эстрогенов и прогестагенов в росте эндометрия фактором риска рака эндометрия является избыток эстрогенов или же более активная передача сигналов эстрогена, которой не противостоит передача сигналов прогестерона [72].
Циркулирующие неактивные стероиды также превращаются в биологически активные эстрогены с помощью печёночной сульфатазы [73]. Предположительно, кишечные бактерии B. fragilis и thetaiotaomicron, A. muciniphila [74–76], обладающие сульфатазной активностью, способны гидролизовать молекулы эстрогена, которые подверглись сульфатации в печени и выведению с жёлчью в ЖКТ, что тоже может влиять на системные уровни эстрогена [67].
Тем не менее уровень эстрогена у женщин в постменопаузе не зависит от микробиоты или активности глюкуронидазы [5]. Следует отметить, что дисбактериоз может привести к уменьшению количества бактерий, обладающих глюкуронидазной активностью, что приводит к меньшей деконъюгации эстрогенов и фитоэстрогенов до их активных форм. Снижение уровня эстрогена влияет на активацию рецепторов эстрогена, что может привести к гиперэстрогенным заболеваниям, отличным от онкологических: ожирению, метаболическому синдрому, сердечно-сосудистым заболеваниям и снижению когнитивных способностей [5].
Микробиота при раке предстательной железы
В онкологической заболеваемости мужчин РПЖ занимает 2-е место (14,8%) с показателем 56,22 случая на 100 тыс. мужчин [15]. Его этиология остаётся малопонятной. К числу идентифицированных факторов риска РПЖ относят пожилой возраст, наличие случаев РПЖ в семье и некоторые варианты генетической чувствительности, что в совокупности объясняет около трети случаев, связанных с семейными факторами.
Обнаружено, что количество видов Streptococcus и Bacteroides выше у мужчин с РПЖ [77]. Метагеномный анализ показал, что фолатные и аргининовые пути в микробиоме кишечника были значительно изменены. В исследовании, в котором анализировалась микробиота кишечника 20 мужчин (8 с доброкачественной гипертрофией предстательной железы и 12 с РПЖ высокого риска), был выявлен повышенный уровень Bacteroides massiliensis по сравнению с контрольной группой [78]. Анализ микробиома кишечника 152 японских мужчин, перенёсших биопсию предстательной железы, показал, что количество Rikenellaceae, Alistipes и Lachnospira, т.е. бактерий, продуцирующих КЦЖК, было значительно увеличено у больных РПЖ с высоким значением грейда по шкале Глисона [79].
При повышении уровней бактериальных ЛПС в крови они связываются с транспортной молекулой CD14 и в дальнейшем с основным рецептором ЛПС — TLR4. TLR4 экспрессируется в опухоли предстательной железы человека. На лабораторных моделях РПЖ показано, что активация TLR4 ЛПС способствует выживанию опухолевых клеток в условиях нехватки питательных веществ в сыворотке, а также индуцирует выработку фактора роста эндотелия сосудов и CCL2 (C-C motif ligand 2) [80]. Передача сигналов ЛПС через рецептор TLR4 активирует NF-κB, который опосредует транскрипцию различных соединений, связанных со стрессом, и усиливается при агрессивном РПЖ [81]. ЛПС E. coli вызывает более сильное воспаление, чем ЛПС других бактерий, а Bacteroidales spp. подавляют провоспалительную передачу сигналов ЛПС за счёт антагонистической формы ЛПС [80]. Для распознавания бактериальных ЛПС с помощью TLR4 необходим ко-рецептор MD2, имеющий разное строение у людей и мышей, что обусловливает разную реакцию (провоспалительную или противовоспалительную) на одни ЛПС. Однако на мышиных моделях ЛПС Bacteroides dorei, как и у людей, проявляет противовоспалительную активность, что даёт основания предположить отсутствие связи неиммуногенности B. dorei со строением MD2. Таким образом, точный механизм опосредованного ЛПС антагонизма ещё не установлен [82].
В ретроспективном исследовании были проанализированы данные 27 212 больных РПЖ и 105 940 контрольных лиц. Риск развития РПЖ статистически значимо повышался при применении пенициллина и хинолонов, сульфаниламидов и тетрациклинов (ОР = 1,2; 95% ДИ 1,1–1,3) [46]. Как уже говорилось выше, антибиотики не обладают прямым канцерогенным действием, но они влияют на состав микробиоты. Этим объясняется их опосредованный канцерогенный эффект, который реализуется при длительном повторном использовании в связи с изменением бактериального разнообразия.
C.S. Plottel и соавт. выдвинули гипотезу, согласно которой эстроболом связан с риском развития РПЖ [71] на основании того, что рецепторы эстрогена-α и -β присутствуют при некоторых видах РМЖ, РПЖ, рака эндометрия, костей и лёгких [83].
Заключение
Имеющиеся данные демонстрируют наличие определённой связи между количественным и качественным состоянием микробиоты ЖКТ и риском развития опухолевых заболеваний. Бактерии модулируют иммунные и воспалительные реакции, а также вырабатывают метаболиты, изменяющие биохимические процессы, что в конечном итоге влияет на канцерогенез. Нормальная микробиота тормозит альтерацию тканей, в то время как патогенные и условно-патогенные микроорганизмы нарушают нормально протекающие процессы и увеличивают риск возникновения злокачественных новообразований.
К настоящему времени наиболее изучены связи микробиоты ЖКТ и опухолей пищевода, желудка и кишечника, однако существуют данные, свидетельствующие о том, что микробиота ЖКТ может влиять на канцерогенез и в других органах. Несмотря на то что микробиота других органов представляет собой значительно меньшую биомассу, она также может воздействовать на развитие опухолей посредством модуляции физиологических и биохимических процессов, а также взаимодействия с кишечной микробиотой.
Особую роль в медицинской науке и практике приобретает превентивная медицина. В этом аспекте следует отметить, что скрининг состава микробиоты может помочь выявить пациентов с повышенным риском возникновения новообразований, а модуляция микробиоты у них позволит предотвратить возникновение опухоли.
Ещё многое предстоит узнать о механизмах, лежащих в основе взаимодействия кишечной микробиоты и макроорганизма, а также об оптимальных стратегиях модуляции микробиоты кишечника или других органов для разработки мероприятий по лечению и профилактике онкологических заболеваний. На сегодняшний день наука находится в начале непростого пути изучения сложного взаимодействия микробиоты и макроорганизма, но уже имеющиеся данные указывают на широкие перспективы использования результатов исследований в медицинской практике.
About the authors
Roman K. Kostin
I.M. Sechenov First Moscow State Medical University (Sechenov University)
Email: rkostin2000@mail.ru
ORCID iD: 0000-0002-4446-1357
student
Russian Federation, MoscowDmitriy A. Malyugin
Voronezh State Medical University named after N.N. Burdenko
Email: rkostin2000@mail.ru
ORCID iD: 0000-0002-5598-2094
student
Russian Federation, VoronezhLiya G. Solenova
Research Institute of Carcinogenesis, N.N. Blokhin National Medical Research Center for Oncology
Email: rkostin2000@mail.ru
ORCID iD: 0000-0002-4443-8376
D. Sci. (Biol.), scientific consultant, Research Institute of Carcinogenesis
Russian Federation, MoscowElizaveta D. Kulaeva
South Federal University
Author for correspondence.
Email: rkostin2000@mail.ru
ORCID iD: 0000-0001-5886-7975
research assistant, Biology of Development and Genome Organization Research Laboratory
Russian Federation, Rostov-on-DonReferences
- Dehhaghi M., Kazemi Shariat Panahi H., Heng B., Guillemin G.J. The gut microbiota, kynurenine pathway, and immune system interaction in the development of brain cancer. Front. Cell Dev. Biol. 2020; 8: 1–15. https://doi.org/10.3389/fcell.2020.562812
- Dehhaghi M., Kazemi Shariat Panahi H., Guillemin G.J. Microorganisms, tryptophan metabolism, and kynurenine pathway: a complex interconnected loop influencing human health status. Int. J. Tryptophan Res. 2019; 12: 1178646919852996. https://doi.org/10.1177/1178646919852996
- Sekirov I., Russell S.L., Antunes L.C.M., Finlay B.B. Gut microbiota in health and disease. Physiol. Rev. 2010; 90(3): 859–904. https://doi.org/10.1152/physrev.00045.2009
- Mirzaei R., Afaghi A., Babakhani S., Sohrabi M.R., Hosseini-Fard S.R., Babolhavaeji K., et al. Role of microbiota-derived short-chain fatty acids in cancer development and prevention. Biomed. Pharmacother. 2021; 139: 111619. https://doi.org/10.1016/j.biopha.2021.111619.
- Sobstyl M., Brecht P., Sobstyl A., Mertowska P., Grywalska E. The role of microbiota in the immunopathogenesis of endometrial cancer. Int. J. Mol. Sci. 2022; 23(10): 5756. https://doi.org/10.3390/ijms23105756
- Helmink B.A., Khan M.A.W., Hermann A., Gopalakrishnan V., Wargo J.A. The microbiome, cancer, and cancer therapy. Nat. Med. 2019; 25(3): 377–88. https://doi.org/10.1038/s41591-019-0377-7
- Yang L., Lu X., Nossa C.W., Francois F., Peek R.M., Pei Z. Inflammation and intestinal metaplasia of the distal esophagus are associated with alterations in the microbiome. Gastroenterology. 2009; 137(2): 588–97. https://doi.org/10.1053/j.gastro.2009.04.046
- Gall A., Fero J., McCoy C., Claywell B.C., Sanchez C.A., Blount P.L., et al. Bacterial composition of the human upper gastrointestinal tract microbiome is dynamic and associated with genomic instability in a Barrett’s esophagus cohort. PLoS One. 2015; 10(6): e0129055. https://doi.org/10.1371/journal.pone.0129055
- Meng C., Bai C., Brown T.D., Hood L.E., Tian Q. Human gut microbiota and gastrointestinal cancer. Genomics. Proteomics Bioinformatics. 2018; 16(1): 33–49. https://doi.org/10.1016/j.gpb.2017.06.002
- Yang L., Francois F., Pei Z. Molecular pathways: pathogenesis and clinical implications of microbiome alteration in esophagitis and Barrett esophagus. Clin. Cancer Res. 2012; 18(8): 2138–44. https://doi.org/10.1158/1078-0432.CCR-11-0934
- Zhou J., Sun S., Luan S., Xiao X., Yang Y., Mao C., et al. Gut microbiota for esophageal cancer: role in carcinogenesis and clinical implications. Front. Oncol. 2021; 11: 717242. https://doi.org/10.3389/fonc.2021.717242
- Yamamura K., Baba Y., Nakagawa S., Mima K., Miyake K., Nakamura K., et al. Human microbiome fusobacterium nucleatum in esophageal cancer tissue is associated with prognosis. Clin. Cancer Res. 2016; 22(22): 5574–81. https://doi.org/10.1158/1078-0432.CCR-16-1786
- Li K., Liu J., Qin X. Research progress of gut microbiota in hepatocellular carcinoma. J. Clin. Lab. Anal. 2022; 36(7): e24512. https://doi.org/10.1002/jcla.24512
- Shlapakova T.I., Kostin R.K., Tyagunova E.E. Reactive oxygen species: participation in cellular processes and progression of pathology. Russ. J. Bioorganic Chem. 2020; 46(5): 657–74. https://doi.org/10.1134/S1068162020050222
- Kaprin A.D., Starinskiy V.V., Shakhzadova A.O. Malignant Neoplasms in Russia in 2020 (Morbidity and Mortality) [Zlokachestvennye novoobrazovaniya v Rossii v 2020 godu (zabolevaemost' i smertnost')]. Moscow; 2021. (in Russian)
- Dias-Jácome E., Libânio D., Borges-Canha M., Galaghar A., Pimentel-Nunes P. Gastric microbiota and carcinogenesis: the role of non-Helicobacter pylori bacteria – A systematic review. Rev. Esp. Enferm. Dig. 2016; 108(9): 530–40. https://doi.org/10.17235/reed.2016.4261/2016
- Liu S., Dai J., Lan X., Fan B., Dong T., Zhang Y., et al. Intestinal bacteria are potential biomarkers and therapeutic targets for gastric cancer. Microb. Pathog. 2021; 151: 104747. https://doi.org/10.1016/j.micpath.2021.104747
- Bik E.M., Eckburg P.B., Gill S.R., Nelson K.E., Purdom E.A., Francois F., et al. Molecular analysis of the bacterial microbiota in the human stomach. Proc. Natl Acad. Sci. USA. 2006; 103(3): 732–7. https://doi.org/10.1073/pnas.0506655103
- Shapira I., Sultan K., Lee A., Taioli E. Evolving concepts: how diet and the intestinal microbiome act as modulators of breast malignancy. ISRN Oncol. 2013; 2013: 693920. https://doi.org/10.1155/2013/693920
- Vivarelli S., Salemi R., Candido S., Falzone L., Santagati M., et al. Gut microbiota and cancer: from pathogenesis to therapy. Cancers (Basel). 2019; 11(1): 38. https://doi.org/10.3390/cancers11010038
- Liu N., Zhou N., Chai N., Liu X., Jiang H., Wu Q., et al. Helicobacter pylori promotes angiogenesis depending on Wnt/beta-catenin-mediated vascular endothelial growth factor via the cyclooxygenase-2 pathway in gastric cancer. BMC Cancer. 2016; 16: 321. https://doi.org/10.1186/s12885-016-2351-9
- Song X., Xin N., Wang W., Zhao C. Wnt/β-catenin, an oncogenic pathway targeted by H. pylori in gastric carcinogenesis. Oncotarget. 2015; 6(34): 35579–88. https://doi.org/10.18632/oncotarget.5758
- Nakayama M., Hisatsune J., Yamasaki E., Isomoto H., Kurazono H., Hatakeyama M., et al. Helicobacter pylori VacA-induced inhibition of GSK3 through the PI3K/Akt signaling pathway. J. Biol. Chem. 2009; 284(3): 1612–9. https://doi.org/10.1074/jbc.M806981200
- Tao Z.H., Han J.X., Fang J.Y. Helicobacter pylori infection and eradication: Exploring their impacts on the gastrointestinal microbiota. Helicobacter. 2020; 25(6): e12754. https://doi.org/10.1111/hel.12754
- Doorakkers E., Lagergren J., Engstrand L., Brusselaers N. Eradication of Helicobacter pylori and gastric cancer: a systematic review and meta-analysis of cohort studies. J. Natl. Cancer Inst. 2016; 108(9): djw132. https://doi.org/10.1093/jnci/djw132
- Milosevic I., Vujovic A., Barac A., Djelic M., Korac M., Radovanovic Spurnic A., et al. Gut-liver axis, gut microbiota, and its modulation in the management of liver diseases: a review of the literature. Int. J. Mol. Sci. 2019; 20(2): 395. https://doi.org/10.3390/ijms20020395
- Yoshimoto S., Loo T.M., Atarashi K., Kanda H., Sato S., Oyadomari S., et al. Obesity-induced gut microbial metabolite promotes liver cancer through senescence secretome. Nature. 2013; 499(7456): 97–101. https://doi.org/10.1038/nature12347
- Ma C., Han M., Heinrich B., Fu Q., Zhang Q., Sandhu M., et al. Gut microbiome-mediated bile acid metabolism regulates liver cancer via NKT cells. Science. 2018; 360(6391): eaan5931. https://doi.org/10.1126/science.aan5931
- Seki E., De Minicis S., Osterreicher C.H., Kluwe J., Osawa Y., Brenner D.A., et al. TLR4 enhances TGF-beta signaling and hepatic fibrosis. Nat. Med. 2007; 13(11): 1324–32. https://doi.org/10.1038/nm1663
- Li Q., Jin M., Liu Y., Jin L. Gut microbiota: its potential roles in pancreatic cancer. Front. Cell. Infect. Microbiol. 2020; 10: 572492. https://doi.org/10.3389/fcimb.2020.572492
- Cait A., Hughes M.R., Antignano F., Cait J., Dimitriu P.A., Maas K.R., et al. Microbiome-driven allergic lung inflammation is ameliorated by short-chain fatty acids. Mucosal Immunol. 2018. 11(3): 785–95. https://doi.org/10.1038/mi.2017.75
- Wilson M.R., Jiang Y., Villalta P.W., Stornetta A., Boudreau P.D., Carrá A., et al. The human gut bacterial genotoxin colibactin alkylates DNA. Science. 2019; 363(6428): eaar7785. https://doi.org/10.1126/science.aar7785
- di Magliano M.P., Logsdon C.D.. Roles for KRAS in pancreatic tumor development and progression. Gastroenterology. 2013; 144(6): 1220–9. https://doi.org/10.1053/j.gastro.2013.01.071
- Lesina M., Kurkowski M.U., Ludes K., Rose-John S., Treiber M., Klöppel G., et al. Stat3/Socs3 activation by IL-6 transsignaling promotes progression of pancreatic intraepithelial neoplasia and development of pancreatic cancer. Cancer Cell. 2011; 19(4): 456–69. https://doi.org/10.1016/j.ccr.2011.03.009
- Yu H., Pardoll D., Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3. Nat. Rev. Cancer. 2009; 9(11): 798–809. https://doi.org/10.1038/nrc2734
- Fukuda A., Wang S.C., Morris J.P. 4th, Folias A.E., Liou A., Kim G.E., et al. Stat3 and MMP7 contribute to pancreatic ductal adenocarcinoma initiation and progression. Cancer Cell. 2011; 19(4): 441–55. https://doi.org/10.1016/j.ccr.2011.03.002
- Moyat M., Velin D. Immune responses to Helicobacter pylori infection. World J. Gastroenterol. 2014; 20(19): 5583–93. https://doi.org/10.3748/wjg.v20.i19.5583
- Gaida M.M., Mayer C., Dapunt U., Stegmaier S., Schirmacher P., Wabnitz G.H., et al. Expression of the bitter receptor T2R38 in pancreatic cancer: localization in lipid droplets and activation by a bacteria-derived quorum-sensing molecule. Oncotarget. 2016; 7(11): 12623–32. https://doi.org/10.18632/oncotarget.7206
- Mitsuhashi K., Nosho K., Sukawa Y., Matsunaga Y., Ito M., Kurihara H., et al. Association of Fusobacterium species in pancreatic cancer tissues with molecular features and prognosis. Oncotarget. 2015; 6(9): 7209–20. https://doi.org/10.18632/oncotarget.3109
- Yang Y., Jobin C. Novel insights into microbiome in colitis and colorectal cancer. Curr. Opin. Gastroenterol. 2017; 33(6): 422–7. https://doi.org/10.1097/MOG.0000000000000399
- Lu Y., Chen J., Zheng J., Hu G., Wang J., Huang C., et al. Mucosal adherent bacterial dysbiosis in patients with colorectal adenomas. Sci. Rep. 2016; 6: 26337. https://doi.org/10.1038/srep26337
- Avuthu N., Guda C. Meta-analysis of altered gut microbiota reveals microbial and metabolic biomarkers for colorectal cancer. Microbiol. Spectr. 2022; 10(4): e0001322. https://doi.org/10.1128/spectrum.00013-22
- Wong S.H., Zhao L., Zhang X., Nakatsu G., Han J., et al. Gavage of fecal samples from patients with colorectal cancer promotes intestinal carcinogenesis in germ-free and conventional mice. Gastroenterology. 2017; 153(6): 1621–33.e6.https://doi.org/10.1053/j.gastro.2017.08.022
- Gao Z., Guo B., Gao R., Zhu Q., Qin H. Microbiota disbiosis is associated with colorectal cancer. Front. Microbiol. 2015; 6: 20. https://doi.org/10.3389/fmicb.2015.00020
- Ternák G., Berényi K., Sümegi A., Szenczi Á., Fodor B., Németh B., et al. Antibiotic consumption patterns in european countries may be associated with the incidence of major carcinomas. Antibiotics (Basel). 2020; 9(10): 643. https://doi.org/10.3390/antibiotics9100643
- Boursi B., Mamtani R., Haynes K., Yang Y.X. Recurrent antibiotic exposure may promote cancer formation – Another step in understanding the role of the human microbiota? Eur. J. Cancer. 2015. 51(17): 2655–64. https://doi.org/10.1016/j.ejca.2015.08.015
- Petrelli F., Ghidini M., Ghidini A., Perego G., Cabiddu M., Khakoo S., et al. Use of antibiotics and risk of cancer: a systematic review and meta-analysis of observational studies. Cancers (Basel). 2019; 11(8): 1174. https://doi.org/10.3390/cancers11081174
- Yang J.H., Bhargava P., McCloskey D., Mao N., Palsson B.O., Collins J.J. Antibiotic-induced changes to the host metabolic environment inhibit drug efficacy and alter immune function. Cell Host Microbe. 2017; 22(6): 757–65.e3.https://doi.org/10.1016/j.chom.2017.10.020
- Purcell R.V., Pearson J., Aitchison A., Dixon L., Frizelle F.A., Keenan J.I. Colonization with enterotoxigenic Bacteroides fragilis is associated with early-stage colorectal neoplasia. PLoS One. 2017; 12(2): e0171602. https://doi.org/10.1371/journal.pone.0171602
- Mangerich A., Knutson C.G., Parry N.M., Muthupalani S., Ye W., Prestwich E., et al. Infection-induced colitis in mice causes dynamic and tissue-specific changes in stress response and DNA damage leading to colon cancer. Proc. Natl Acad. Sci. USA. 2012; 109(27): E1820-9. https://doi.org/10.1073/pnas.1207829109
- Rubinstein M.R., Baik J.E., Lagana S.M., Han R.P., Raab W.J., Sahoo D., et al. Fusobacterium nucleatum promotes colorectal cancer by inducing Wnt/β-catenin modulator Annexin A1. EMBO Rep. 2019; 20(4): e47638. https://doi.org/10.15252/embr.201847638
- Clay S.L., Fonseca-Pereira D., Garrett W.S. Colorectal cancer: the facts in the case of the microbiota. J. Clin. Invest. 2022; 132(4): e155101. https://doi.org/10.1172/JCI155101
- Liu X., Cheng Y., Zang D., Zhang M., Li X., Liu D., et al. The role of gut microbiota in lung cancer: from carcinogenesis to immunotherapy. Front. Oncol. 2021; 11: 720842. https://doi.org/10.3389/fonc.2021.720842
- Zhao Y., Liu Y., Li S., Peng Z., Liu X., Chen J., et al. Role of lung and gut microbiota on lung cancer pathogenesis. J. Cancer Res. Clin. Oncol. 2021; 147(8): 2177–186. https://doi.org/10.1007/s00432-021-03644-0
- Georgiou K., Marinov B., Farooqi A.A., Gazouli M. Gut microbiota in lung cancer: where do we stand? Int. J. Mol. Sci. 2021; 22(19): 10429. https://doi.org/10.3390/ijms221910429
- Zhuang H., Cheng L., Wang Y., Zhang Y.K., Zhao M.F., Liang G.D., et al. Dysbiosis of the gut microbiome in lung cancer. Front. Cell. Infect. Microbiol. 2019; 9: 112. https://doi.org/10.3389/fcimb.2019.00112
- Zhang W.Q., Zhao S.K., Luo J.W., Dong X.P., Hao Y.T., Li H., et al. Alterations of fecal bacterial communities in patients with lung cancer. Am. J. Transl. Res. 2018; 10(10): 3171–85.
- Gui Q., Li H., Wang A., Zhao X., Tan Z., Chen L., et al. The association between gut butyrate-producing bacteria and non-small-cell lung cancer. J. Clin. Lab. Anal. 2020; 34(8): e23318. https://doi.org/10.1002/jcla.23318
- Zheng Y., Fang Z., Xue Y., Zhang J., Zhu J., Gao R., et al. Specific gut microbiome signature predicts the early-stage lung cancer. Gut Microbes. 2020; 11(4): 1030–42. https://doi.org/10.1080/19490976.2020.1737487
- Botticelli A., Putignani L., Zizzari I., Del Chierico F., Reddel S., Di Pietro F., et al. Changes of microbiome profile during nivolumab treatment in NSCLC patients. J. Clin. Oncol. 2018; 36(15 Suppl.): e15020. https://doi.org/10.1200/JCO.2018.36.15_suppl.e15020
- Jin C., Lagoudas G.K., Zhao C., Bullman S., Bhutkar A., Hu B., et al. Commensal microbiota promote lung cancer development via γδ T cells. Cell. 2019; 176(5): 998–1013.e16.https://doi.org/10.1016/j.cell.2018.12.040
- Yang Y., Wang X., Huycke T., Moore D.R., Lightfoot S.A., Huycke M.M. Colon macrophages polarized by commensal bacteria cause colitis and cancer through the bystander effect. Transl. Oncol. 2013; 6(5): 596–606. https://doi.org/10.1593/tlo.13412
- Ridlon J.M., Wolf P.G., Gaskins H.R. Taurocholic acid metabolism by gut microbes and colon cancer. Gut Microbes. 2016; 7(3): 201–15. https://doi.org/10.1080/19490976.2016.1150414
- Goodwin A.C., Destefano Shields C.E., Wu S., Huso D.L., Wu X., Murray-Stewart T.R., et al. Polyamine catabolism contributes to enterotoxigenic Bacteroides fragilis-induced colon tumorigenesis. Proc. Natl Acad. Sci. USA. 2011; 108(37): 15354–9. https://doi.org/10.1073/pnas.1010203108
- Zhang Z., Aung K.M., Uhlin B.E., Wai S.N. Reversible senescence of human colon cancer cells after blockage of mitosis/cytokinesis caused by the CNF1 cyclomodulin from Escherichia coli. Sci. Rep. 2018; 8(1): 17780. https://doi.org/10.1038/s41598-018-36036-5
- Parida S., Sharma D. The microbiome-estrogen connection and breast cancer risk. Cells. 2019; 8(12): 1642. https://doi.org/10.3390/cells8121642
- Kwa M., Plottel C.S., Blaser M.J., Adams S. The intestinal microbiome and estrogen receptor-positive female breast cancer. J. Natl. Cancer Inst. 2016; 108(8): djw029. https://doi.org/10.1093/jnci/djw029.
- Flores R., Shi J., Fuhrman B., Xu X., Veenstra T.D., Gail M.H., et al. Fecal microbial determinants of fecal and systemic estrogens and estrogen metabolites: a cross-sectional study. J. Transl. Med. 2012; 10: 253. https://doi.org/10.1186/1479-5876-10-253
- Dabek M., McCrae S.I., Stevens V.J., Duncan S.H., Louis P. Distribution of beta-glucosidase and beta-glucuronidase activity and of beta-glucuronidase gene gus in human colonic bacteria. FEMS Microbiol. Ecol. 2008; 66(3): 487–95. https://doi.org/10.1111/j.1574-6941.2008.00520.x
- Duarte L., Gasaly N., Poblete-Aro C., Uribe D., Echeverria F., Gotteland M., et al. Polyphenols and their anti-obesity role mediated by the gut microbiota: a comprehensive review. Rev. Endocr. Metab. Disord. 2021; 22(2): 367–88. https://doi.org/10.1007/s11154-020-09622-0
- Plottel C.S., Blaser M.J. Microbiome and malignancy. Cell Host Microbe. 2011; 10(4): 324–35. https://doi.org/10.1016/j.chom.2011.10.003
- Rodriguez A.C., Blanchard Z., Maurer K.A., Gertz J. Estrogen signaling in endometrial cancer: a key oncogenic pathway with several open questions. Horm. Cancer. 2019; 10(2–3): 51–63. https://doi.org/10.1007/s12672-019-0358-9
- Raftogianis R., Creveling C., Weinshilboum R., Weisz J. Estrogen metabolism by conjugation. J. Natl Cancer Inst. Monogr. 2000; (27): 113–24. https://doi.org/10.1093/oxfordjournals.jncimonographs.a024234
- Luis A.S., Jin C., Pereira G.V., Glowacki R.W.P., Gugel S.R., Singh S., et al. A single sulfatase is required to access colonic mucin by a gut bacterium. Nature. 2021; 598(7880): 332–7. https://doi.org/10.1038/s41586-021-03967-5
- Li C.C., Tang X.Y., Zhu Y.B., Song Y.J., Zhao N.L., Huang Q., et al. Structural analysis of the sulfatase AmAS from Akkermansia muciniphila. Acta Crystallogr. D Struct. Biol. 2021; 77(Pt. 12): 1614–23. https://doi.org/10.1107/S2059798321010317
- Praharaj A.B., Dehury B., Mahapatra N., Kar S.K., Behera S.K. Molecular dynamics insights into the structure, function, and substrate binding mechanism of mucin desulfating sulfatase of gut microbe Bacteroides fragilis. J. Cell. Biochem. 2018; 119(4): 3618–31. https://doi.org/10.1002/jcb.26569
- Liss M.A., White J.R., Goros M., Gelfond J., Leach R., Johnson-Pais T., et al. Metabolic biosynthesis pathways identified from fecal microbiome associated with prostate cancer. Eur. Urol. 2018; 74(5): 575–82. https://doi.org/10.1016/j.eururo.2018.06.033
- Golombos D.M., Ayangbesan A., O’Malley P., Lewicki P., Barlow L., Barbieri C.E., et al. The role of gut microbiome in the pathogenesis of prostate cancer: a prospective, pilot study. Urology. 2018; 111: 122–8. https://doi.org/10.1016/j.urology.2017.08.039
- Fujita K., Matsushita M., Banno E., De Velasco M.A., Hatano K., Nonomura N., et al. Gut microbiome and prostate cancer. Int. J. Urol. 2022; 29(8): 793–8. https://doi.org/10.1111/iju.14894
- Wheeler K.M., Liss M.A. The microbiome and prostate cancer risk. Curr. Urol. Rep. 2019; 20(10): 66. https://doi.org/10.1007/s11934-019-0922-4
- Jain S., Suklabaidya S., Das B., Raghav S.K., Batra S.K., Senapati S. TLR4 activation by lipopolysaccharide confers survival advantage to growth factor deprived prostate cancer cells. Prostate. 2015; 75(10): 1020–33. https://doi.org/10.1002/pros.22983
- Vatanen T., Kostic A.D., d’Hennezel E., Siljander H., Franzosa E.A., Yassour M., et al. Variation in microbiome lps immunogenicity contributes to autoimmunity in humans. Cell. 2016; 165(4): 842–53. https://doi.org/10.1016/j.cell.2016.04.007
- Kuiper G.G., Enmark E., Pelto-Huikko M., Nilsson S., Gustafsson J.A. Cloning of a novel receptor expressed in rat prostate and ovary. Proc. Natl Acad. Sci. USA. 1996; 93(12): 5925–30. https://doi.org/10.1073/pnas.93.12.5925
- Pinato D.J., Howlett S., Ottaviani D., Urus H., Patel A., Mineo T., et al. Association of prior antibiotic treatment with survival and response to immune checkpoint inhibitor therapy in patients with cancer. JAMA Oncol. 2019; 5(12): 1774–8. https://doi.org/10.1001/jamaoncol.2019.2785
- Pushalkar S., Hundeyin M., Daley D., Zambirinis C.P., Kurz E., Mishra A., et al. The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression. Cancer Discov. 2018; 8(4): 403–16. https://doi.org/10.1158/2159-8290.CD-17-1134
- Li Y., Elmén L., Segota I., Xian Y., Tinoco R., Feng Y., et al. Prebiotic-induced anti-tumor immunity attenuates tumor growth. Cell Rep. 2020; 30(6): 1753–66.e6. https://doi.org/10.1016/j.celrep.2020.01.035
- Arthur J.C., Gharaibeh R.Z., Uronis J.M., Perez-Chanona E., Sha W., Tomkovich S., et al. VSL#3 probiotic modifies mucosal microbial composition but does not reduce colitis-associated colorectal cancer. Sci. Rep. 2013; 3: 2868. https://doi.org/10.1038/srep02868
- McQuade J.L., Daniel C.R., Helmink B.A., Wargo J.A. Modulating the microbiome to improve therapeutic response in cancer. Lancet. Oncol. 2019; 20(2): e77–e91. https://doi.org/10.1016/S1470-2045(18)30952-5
- Matson V., Fessler J., Bao R., Chongsuwat T., Zha Y., Alegre M.L., et al. The commensal microbiome is associated with anti-PD-1 efficacy in metastatic melanoma patients. Science. 2018; 359(6371): 104–8. https://doi.org/10.1126/science.aao3290
Supplementary files