Effect of Enterococcus faecium strain 18 on fungi of the genus Candida
- Authors: Pashinina O.A.1, Pashkova T.M.1, Sycheva M.V.1, Popova L.P.1, Kartashova O.L.1
-
Affiliations:
- Orenburg Federal Research Center
- Issue: Vol 102, No 1 (2025)
- Pages: 72-79
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/18630
- DOI: https://doi.org/10.36233/0372-9311-569
- EDN: https://elibrary.ru/zvdoso
- ID: 18630
Cite item
Full Text
Abstract
Introduction. Enterococcus spp. which are representatives of the intestinal normal microbiota, play an important role in ensuring colonization resistance of mucous membranes, producing antimicrobial compounds, and therefore are widely used as the basis of probiotic drugs. In the last decade, infections caused by Candida fungi have become a serious clinical problem. In this regard, it is relevant to evaluate the probiotic characteristics of the E. faecium strain 18 and study its antifungal activity.
The aim is to investigate the effect of the E. faecium strain 18 on the growth and mature biofilm of Candida spp., as well as to characterize its agregation and coagregation abilities.
Materials and methods. The effect on fungal growth was determined by the dynamics of the optical density of broth cultures; the effect of enterococcus supernatant on formed biofilms was studied in sterile polystyrene 96-well plates. The probiotic potential of E. faecium strain 18 was assessed by its ability to autoagregate and coagregate interaction with 20 strains of Candida of different species — C. albicans, C. krusei, C. kefir, C. glabrata. The scanning electron microscopy was used to obtain images.
Results. The inhibitory effect of the supernatant of E. faecium strain 18 has been shown to affect the growth of Candida of all studied species, as well as their mature biofilms. The level of inhibition of the growth of formed biofilms in non-albicans species was 58.6–72.9% and 51.4% for C. albicans. The autoagregation rates of E. faecium strain 18 were 57.6% after 2 hours of incubation and 60.4% after 5 hours. E. faecium strain 18 demonstrated different levels of coagregation with the studied species of Candida, with the index values observed after 5 hours of cultivation being higher in non-albicans species, and the maximum value recorded for C. glabrata (85.6%).
Conclusion. The experimental data obtained allow us to consider the studied strain as the basis for a probiotic that has an anti-candidiasis effect.
Full Text
Введение
В последнее десятилетие инфекции, вызванные грибами рода Candida, стали серьёзной клинической проблемой [1]. Рост числа грибковых инфекций требует разработки новых противогрибковых средств. Весьма перспективным является использование пробиотических микроорганизмов и/или продуцируемых ими соединений для контроля распространения патогенных видов рода Candida [2]. Клинические наблюдения показывают, что пробиотические препараты могут уменьшить колонизацию Candida spp. на поверхности слизистых оболочек человека, облегчить признаки и симптомы грибковой инфекции и усилить противогрибковый эффект традиционной терапии [3].
Опубликован ряд исследований, в которых пробиотики рассматриваются не только как возможное средство лечения больных кандидозом [4], но и как препараты для борьбы с биоплёнками Candida spp. [5].
Энтерококки, являющиеся представителями нормобиоты кишечника, играют важную роль в обеспечении колонизационной резистентности слизистых оболочек, характеризуются наличием спектра антимикробных субстанций, в частности, продуцируют энтероцины — антимикробные пептиды, обладающие активностью против патогенов [6], и поэтому широко используются в качестве основы пробиотических препаратов [7].
Поиск и отбор штаммов энтерококков, обладающих антифунгальной активностью, ведутся среди представителей этого рода ещё и потому, что условно-патогенные дрожжи Candida spp. часто выделяются совместно с бактериями рода Enterococcus из различных биотопов и очагов инфекции в организме человека, что свидетельствует об их межклеточном взаимодействии [8, 9].
Ранее нами изучено влияние разных штаммов E. faecium, выделенных из кишечника человека, на способность грибов рода Candida снижать образование биоплёнок и отобран штамм E. faecium 18 с максимальной активностью [10], который может быть использован в качестве основы пробиотика, оказывающего антикандидозное действие.
Цель данной работы — исследовать влияние штамма E. faecium 18 на рост и зрелую биоплёнку грибов рода Candida, а также его агрегационную и коагрегационную способности, являющиеся важными свойствами перспективных пробиотических штаммов [11].
Материалы и методы
Для проведения исследований использовали штамм E. faecium 18 из коллекции кафедры микробиологии и заразных болезней Оренбургского государственного аграрного университета, который депонирован в Государственной коллекции микроорганизмов нормальной микрофлоры Московского научно-исследовательского института эпидемиологии и микробиологии им. Г.Н. Габричевского под коллекционным номером 1252. Энтерококк выращивали в Schaedler-бульоне («Conda») в течение 24 ч при 37ºС. Бактериальные клетки удаляли центрифугированием при ускорении 9000g под охлаждением до 4ºC в течение 15 мин. Полученный супернатант фильтровали через 0,22-мкм фильтр («Millipore Nihon») и сразу использовали в экспериментах. Антикандидозную активность E. faecium 18 исследовали на 4 видах дрожжеподобных грибов рода Candida, полученных из кишечника условно здоровых людей (C. albicans, C. krusei, C. kefir, C. glabrata), всего 20 штаммов (коллекция лаборатории персистенции и симбиоза Института клеточного и внутриклеточного симбиоза). Культуры грибов выращивали аэробно на среде Сабуро с декстрозой («Hi Media») при 35ºC в течение 24 ч.
Для определения антикандидозной активности использовали метод микротитрования в питательной среде на стерильных полистироловых 96-луночных планшетах («Sigma-Aldrich Chemie») согласно S. Wang и соавт. [12] с изменениями. В лунки стерильного микропланшета вносили 100 мкл бульона Сабуро, содержащего 2 × 105 КОЕ/лунку Candida и 100 мкл супернатанта энтерококка. Каждую пробу испытывали параллельно в 4 лунках. В качестве положительного контроля использовали суспензию клеток грибов на питательной среде без супернатанта, в качестве отрицательного контроля — Schaedler-бульон. После аэробной инкубации при 37ºC в течение 24 ч рост грибов определяли по оптической плотности (ОП) при длине волны 492 нм с использованием полуавтоматического планшетного спектрофотометра «Stat Fax 2100» («Awareness Technology»).
При изучении влияния супернатанта энтерококка на грибную сформированную биоплёнку культуры Candida культивировали в течение 48 ч при 37ºC, после удаления взвеси и отмывания лунок добавляли супернатант E. faecium 18 в объёме 100 мкл. Планшеты помещали в термостат при 37ºС на 24 ч, затем замеряли ОП на полуавтоматическом планшетном спектрофотометре «Stat Fax 2100» («Awareness Technology»). Контролем служили штаммы грибов рода Candida, не подвергавшиеся влиянию супернатанта энтерококка. Эксперимент проводили в 3 повторах с интервалом 24 ч.
Способность штамма E. faecium 18 к аутоагрегации оценивали в соответствии с методом K.M.O. dos Santos и соавт. [13] с небольшими изменениями. Культуру энтерококка, полученную в Schaedler-бульоне после 24-часовой инкубации при 37ºC, собирали центрифугированием при 9000g в течение 10 мин при 4ºC. Клетки дважды промывали в физиологическом растворе, обогащённом фосфатом (PBS; pH 7,2 перед стерилизацией), и суспендировали в PBS при начальной ОП, измеренной при длине волны 630 нм. Затем бактериальную суспензию (2 мл) перемешивали в течение 10 мин с помощью «SPINIX Vortex» («Parsons») и инкубировали при 37ºC в течение 5 ч без перемешивания. Для замера ОП образца в начале инкубации и через 2 и 5 ч культивирования использовали 1 мл верхнего слоя для измерения при 630 нм. Определяли аутоагрегацию (АА) по формуле:
AA = [(OП начальная − время ОП/ОП начальное] × 100%. (1)
Коагрегационный анализ взвесей энтерококков с дрожжеподобными грибами проводили по модифицированному методу K.M.O. dos Santos и соавт. [13].
Культуры энтерококков выращивали в 3 мл Schaedler-бульона, а грибов рода Candida — в 3 мл бульона Сабуро при 37ºС в течение 24 ч, после чего культуры центрифугировали 10 мин в центрифуге «Microspin 12» («Biosan») с охлаждением (4ºC) при ускорении 9000g и промывали в PBS (pH 7,2 перед стерилизацией), данные манипуляции повторяли дважды, затем суспендировали взвеси в PBS.
На следующем этапе равные объёмы (по 750 мкл) взвеси культуры E. faecium 18 и взвеси тест-штаммов грибов рода Candida spp. попарно смешивали встряхиванием в течение 10 с и замеряли ОП каждой взвеси при длине волны 630 нм (начальное значение OП — 0 ч). Пробирки инкубировали при 37ºС без перемешивания в течение 5 ч, замеряя OП через 2 и 5 ч инкубации в 1 мл верхнего слоя проб при длине волны 630 нм (время OП).
Коагрегацию (А) рассчитывали по формуле:
A = [(начальная OП − время ОП/начальная ОП] × 100%. (2)
Подготовку образцов для сканирующей электронной микроскопии (СЭМ) проводили следующим образом: взвеси культуры энтерококка и взвеси культуры энтерококка с тест-штаммами грибов в физиологическом растворе в концентрации 109 КОЕ/мл трижды отмывали 0,1 М фосфатно-буферным раствором Соренсена («ЛидерМед Групп») и добавляли 400 мкл 2,5% глутарового альдегида к последнему осадку. Образцы инкубировали в течение 24 ч при 4ºС и вновь отмывали 0,1 М фосфатно-буферным раствором, обезвоживали водно-этанольными растворами с возрастающими концентрациями (20, 40, 60, 80 и 90% и 2 цикла 100%) и наносили на покровные стекла. Время инкубации в каждом растворе составляло15 мин при комнатной температуре. Покровные стекла с образцами высушивали в критической точке «Quorum K850 Critical Point Dryer» («Quorum Technologies Ltd.»), прикрепляли двусторонним скотчем к столику СЭМ и напыляли золотом с помощью установки ионно-плазменного напыления «Quorum Q150R S plus» («Quorum Technologies Ltd.»). СЭМ проводили на сканирующем электронном микроскопе «Tescan Mira 3» («Tescan Brno») Центра коллективного пользования образовательного Центра выявления и поддержки одарённых детей «Гагарин» (Оренбург).
Полученные данные статистически обработаны с помощью критерия Стьюдента в программе «Statistica 6.0» («StatSoft, Inc.»). Результаты представлены в виде средних значений и ошибок средних (М ± m), полученных не менее чем в 3 независимых экспериментах. Значимыми считали различия при p < 0,05.
Результаты
Установлено ингибирующее действие супернатанта E. faecium 18 на рост грибов рода Candida всех исследуемых видов. В положительном контроле уровень ОП суточной бульонной культуры грибов у C. albicans составлял 0,73 ± 0,02; у C. glabrata — 0,41 ± 0,01; у C. kefir — 0,32 ± 0,01; у C. krusei — 0,69 ± 0,02, а при добавлении супернатанта снижался до 0,37 ± 0,01; 0,25 ± 0,01; 0,15 ± 0,01; 0,35 ± 0,02 КОЕ/мл соответственно (рис. 1, а).
Рис. 1. Влияние супернатанта E. faecium 18 на рост (а) и сформированные биоплёнки (б) грибов рода Candida.
*p < 0,05; **p < 0,001.
Fig. 1. The effect of the supernatant of E. faecium strain 18 on the growth (a) and formed biofilms (b) of fungi of the genus Candida.
*p < 0.05; **p < 0.001.
Наиболее высокий уровень ингибиции отмечен для C. kefir — в 2,1 раза. Несколько ниже была степень ингибирования C. albicans и C. krusei, у которых уровень роста снижался в 2 раза, а у C. glabrata — в 1,6 раза.
В следующей серии экспериментов изучали влияние супернатанта E. faecium 18 на сформированные грибами рода Candida биоплёнки. В контроле среднее значение коэффициента биоплёнкообразования (КБО) у C. albicans составляло 3,50 ± 0,01 усл. ед., C. glabrata — 3,70 ± 0,02 усл. ед., C. kefir — 2,90 ± 0,02 усл. ед., C. krusei — 2,80 ± 0,02 усл. ед.
Установлена способность супернатанта энтерококка разрушать зрелые биоплёнки изученных видов грибов (рис. 1, б). Так, он достоверно ингибировал рост сформированных биоплёнок C. albicans на 51,4% (КБО 1,70 ± 0,01 усл. ед.; p < 0,05), C. glabrata — на 72,9% (КБО 1,00 ± 0,01 усл. ед.; p < 0,05), C. kefir — на 58,6% (КБО 1,20 ± 0,01 усл. ед.; p < 0,05), C. krusei — на 62,5% (1,05 ± 0,01 усл. ед.; p < 0,05).
Таким образом, проведённые исследования свидетельствуют о том, что супернатант E. faecium 18 способен не только ингибировать рост штаммов разных видов грибов рода Candida, но и разрушать сформированные ими биоплёнки.
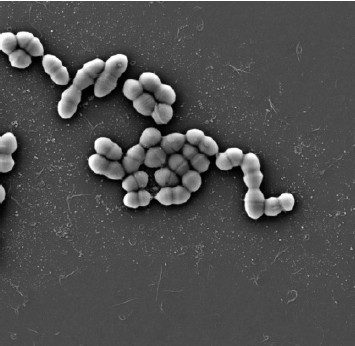
Далее нами изучены агрегационная и коагрегационная способности культуры E. faecium 18, являющиеся важными свойствами перспективных пробиотических штаммов. Показано, что значения ауто-агрегации E. faecium 18 увеличивались в зависимости от продолжительности инкубационного периода: от 57,6% (2 ч) до 60,4% (5 ч). Результаты аутоагрегации энтерококка проиллюстрированы на рис. 2.
Рис. 2. Аутоагрегация E. faecium 18.
Fig. 2. Аutoagregation of E. faecium strain 18.
Вместе с тем штамм E. faecium 18 проявлял различные уровни коагрегации у 4 исследованных видов грибов (таблица). Индекс коагрегации увеличивался с ростом инкубационного периода. После 5-часовой инкубации самый высокий уровень коагрегации наблюдался с изолятами C. glabrata (85,6%), далее следовали C. krusei (55,9%), C. kefir (45,9%), C. albicans (37,2%). Результаты коагрегации E. faecium со штаммами C. albicans представлены на рис. 3.
Коагрегация E. faecium 18 с Candida spp.
- faecium strain18 coagregation with Candida spp.
Candida spp. | Индекс коагрегации с E. faecium 18, % Coagregation index with E. faecium 18, % | |
2 ч | 2 h | 5 ч | 5 h | |
C. albicans | 29,7 ± 0,04 | 37,2 ± 0,03 |
C. glabrata | 56,2 ± 0,07 | 85,6 ± 0,05 |
C. kefir | 22,7 ± 0,03 | 45,9 ± 0,03 |
C. krusei | 26,8 ± 0,04 | 55,9 ± 0,04 |
Рис. 3. Коагрегация E. faecium 18 с C. albicans.
Fig. 3. Coaggregation of E. faecium strain 18 with C. albicans.
Обсуждение
Проведённые исследования показали, что супернатант E. faecium 18 обладает выраженной антимикробной активностью в отношении грибов рода Candida и способностью разрушать сформированную биоплёнку исследованных видов грибов.
Полученные данные представляют интерес для клинической практики, т. к. известна способность грибов функционировать в составе многоклеточных сообществ (биоплёнок) [14, 15], которые препятствуют проникновению лекарственных средств, что повышает устойчивость микроорганизмов к антимикотикам [16, 17], а также являются одной из основных стратегий выживания этих микроорганизмов в организме человека [18].
Поэтому в настоящее время важной задачей является поиск средств борьбы с биоплёнками грибов рода Candida; в частности, пробиотических микроорганизмов, способных разрушать биоплёнки грибов и/или ингибировать их рост [19].
Проведённые нами исследования иллюстрируют in vitro эффект бесклеточного супернатанта энтерококка, который обладает чётко выраженным ингибирующим действием на сформированную биоплёнку грибов рода Сandida. Полученные результаты не противоречат исследованиям ряда авторов, изучавших антибиоплёночную активность молочнокислых бактерий на изолятах Candida spp. [20]. Несмотря на то что основным механизмом ингибирования образования биоплёнки Candida spp. является конкуренция за адгезию, M. Kıvanç и соавт. пришли к выводу о том, что вещества, содержащиеся в бесклеточных фильтратах молочнокислых бактерий, также важны [21]. Так, в ряде работ показан ингибирующий эффект молочнокислых микроорганизмов в отношении биоплёнкообразующей способности патогенов, что, по мнению авторов, является результатом выработки органических кислот, включая молочную [22, 23].
Принимая во внимание тот факт, что, по результатам полногеномного секвенирования, включённый в исследование штамм энтерококка не способен к продукции бактериоцинов [24], можно предположить, что разрушение зрелых биоплёнок Сandida spp. не связано с продукцией энтероцинов. Последнее предположение находит подтверждение в работе X. Pang и соавт. (2022), которые доказали, что бактериоцины могут эффективно ингибировать образование биоплёнок дозозависимым образом, но им трудно разрушить предварительно сформированные биоплёнки [25].
Эффективность пробиотика во многом зависит от адгезивной способности пробиотического штамма и отсутствия конкурентных отношений с индигенной микрофлорой. Аутоагрегация является первым этапом в процессе адгезии, позволяя бактериям формировать барьер против колонизации патогенов [26]. Взаимосвязь между образованием биоплёнки и агрегацией у непатогенных штаммов энтерококков впервые показана K. Veljovic и соавт. [27].
Высокая аутоагрегация и способность прилипать к эпителиальным клеткам и поверхностям слизистых оболочек является важным свойством многих штаммов бактерий, используемых в качестве пробиотиков [28, 29]. В нашем исследовании штамм энтерококка показал высокий уровень аутоагрегации уже через 2 ч, что свидетельствует о его конкурентных, исключающих патоген, свойствах. Сильная агрегация пробиотического штамма способствует достижению им достаточной массы для формирования биоплёнок и усилению его способности к коагрегации с потенциальным патогеном. В результате коагрегативных взаимодействий пробиотические штаммы микроорганизмов оказывают антагонистическое действие против патогенов [30].
Проведёнными нами исследованиями показана способность штамма энтерококка к коагрегации с разными видами грибов рода Candida, при этом индекс показателя через 5 ч культивирования оказался выше с non-albicans-видами, а максимальное значение достигнуто с C. glabrata.
Заключение
Полученные экспериментальные данные свидетельствуют о том, что противокандидозный эффект E. faecium 18 включает различные механизмы, что в совокупности отражает сложность взаимодействия между грибами рода Candida и E. faecium, расширяя представления о механизмах межмикробного взаимодействия и открывая перспективы дальнейшего изучения энтерококка в качестве основы пробиотика, оказывающего антикандидозное действие. Чтобы использовать этот штамм в пробиотических препаратах, необходимо провести его дальнейшие испытания на животных моделях и оценить лечебный потенциал.
About the authors
Olga A. Pashinina
Orenburg Federal Research Center
Author for correspondence.
Email: olga25mikro@mail.ru
ORCID iD: 0000-0001-9944-3095
Cand. Sci. (Biol.), senior researcher, Laboratory of microbial persistence and symbiosis, Institute of Cellular and Intracellular Symbiosis
Russian Federation, OrenburgTatiana M. Pashkova
Orenburg Federal Research Center
Email: pashkova070782@mail.ru
ORCID iD: 0000-0001-8075-8249
D. Sci. (Biol.), leading researcher, Laboratory of microbial persistence and symbiosis, Institute of Cellular and Intracellular Symbiosis
Russian Federation, OrenburgMaria V. Sycheva
Orenburg Federal Research Center
Email: sycheva_maria@mail.ru
ORCID iD: 0000-0003-1455-1631
D. Sci. (Biol.), Professor, senior researcher, Laboratory of microbial persistence and symbiosis, Institute of Cellular and Intracellular Symbiosis
Russian Federation, OrenburgLidia P. Popova
Orenburg Federal Research Center
Email: labpersist@mail.ru
ORCID iD: 0000-0002-3766-6020
Cand. Sci. (Med.), senior researcher, Laboratory of microbial persistence and symbiosis, Institute of Cellular and Intracellular Symbiosis
Russian Federation, OrenburgOlga L. Kartashova
Orenburg Federal Research Center
Email: labpersist@mail.ru
ORCID iD: 0000-0002-1487-7546
D. Sci. (Biol.), Associate Professor, leading researcher, Laboratory of microbial persistence and symbiosis, Institute of Cellular and Intracellular Symbiosis
Russian Federation, OrenburgReferences
- Акимкин В.Г., Тутельян А.В., Шулакова Н.И. Микологический айсберг: современные сдвиги в эпидемиологии микозов. Инфекционные болезни. 2022;20(1):120–6. Akimkin V.G., Tutelyan A.V., Shulakova N.I. Medical mycological iceberg: recent trends in the epidemiology of mycoses. Infectious Diseases. 2022;20(1):120–6. DOI: https://doi.org/10.20953/1729-9225-2022-1-120-126 EDN: https://elibrary.ru/kxiyal
- Gladysheva I.V., Chertkov K.L., Cherkasov S.V., et al. Probiotic potential, safety properties, and antifungal activities of Corynebacterium amycolatum ICIS 9 and Corynebacterium amycolatum ICIS 53 strains. Probiotics Antimicrob. Proteins. 2023;15(3):588–600. DOI: https://doi.org/10.1007/s12602-021-09876-3
- Matsubara V.H., Bandara H.M., Mayer M.P., Samaranayake L.P. Probiotics as antifungals in mucosal candidiasis. Clin. Infect. Dis. 2016;62(9):1143–53. DOI: https://doi.org/10.1093/cid/ciw038
- Ohshima T., Kojima Y., Seneviratne C.J., Maeda N. Therapeutic application of synbiotics, a fusion of probiotics and prebiotics, and biogenics as a new concept for oral candida infections: a mini review. Front. Microbiol. 2016;7:10. DOI: https://doi.org/10.3389/fmicb.2016.00010
- Barzegari A., Kheyrolahzadeh K., Hosseiniyan Khatibi S.M., et al. The battle of probiotics and their derivatives against biofilms. Infect. Drug Resist. 2020;13:659–72. DOI: https://doi.org/10.2147/idr.s232982
- Wu Y., Pang X., Wu Y., et al. Enterocins: classification, synthesis, antibacterial mechanisms and food applications. Molecules. 2022;27(7):2258. DOI: https://doi.org/10.3390/molecules27072258
- Rahmani M., Saffari F., Domann E., et al. Enterococci as intestinal microbiota: investigation of characteristics and probiotic potential in isolates from adults and breast-fed infants. Probiotics Antimicrob. Proteins. 2022;14(6):1139–50. DOI: https://doi.org/10.1007/s12602-022-09951-3
- Alshanta O.A., Albashaireh K., McKloud E., et al. Candida albicans and Enterococcus faecalis biofilm frenemies: when the relationship sours. Biofilm. 2022;4:100072. DOI: https://doi.org/10.1016/j.bioflm.2022.100072
- Kart D., Yabanoğlu Çiftçi S., Nemutlu E. Metabolomics-driven approaches on interactions between Enterococcus faecalis and Candida albicans biofilms. Turk J. Pharm. Sci. 2021;18(5):557–64. DOI: https://doi.org/10.4274/tjps.galenos.2021.71235
- Сычева М.В., Пашинина О.А., Карташова О.Л. и др. Штамм бактерий Enterococcus faecium, обладающий способностью снижать образование биопленок грибами рода Сandida. Патент РФ № 2576008; 2016. Sycheva M.V., Pashinina O.A., Kartashova O.L., et al. Strain of bacteria enterococcus faecium with ability to reduce formation of biofilms by Сandida fungus. Patent RF № 2576008; 2016. EDN: https://elibrary.ru/zmhurf
- Binda S., Hill C., Johansen E., et al. Criteria to qualify microorganisms as "probiotic" in foods and dietary supplements. Front. Microbiol. 2020;11:1662. DOI: https://doi.org/10.3389/fmicb.2020.01662
- Wang S., Wang Q., Yang E., et al. Antimicrobial compounds produced by vaginal Lactobacillus crispatus are able to strongly inhibit Candida albicans growth, hyphal formation and regulate virulence-related gene expressions. Front. Microbiol. 2017;8:564. DOI: https://doi.org/10.3389/fmicb.2017.00564
- dos Santos K.M.O., Vieira A.D.S., Buriti F.C.A., et al. Artisanal Coalho cheeses as source of beneficial Lactobacillus plantarum and Lactobacillus rhamnosus strains. Dairy Sci. Technol. 2015;95(2):209–30. DOI: https://doi.org/10.1007/s13594-014-0201-6
- Кольцов И.П., Стрельникова Н.В., Витько Е.В. и др. Микробиологические свойства условно-патогенных сахаромицетов рода Candida при хронических, рецидивирующих инфекционно-воспалительных процессах (обзор литературы). Тихоокеанский медицинский журнал. 2023;(1):19–26. Koltsov I.P., Strelnikova N.V., Vitko E.V., et al. Microbiological properties of opportunistic saccharomycetes of the genus Candida in chronic, recurrent infectious inflammatory processes (literature review). The Pacific Medical Journal. 2023;(1):19–26. DOI: https://doi.org/10.34215/1609-1175-2023-1-19-26 EDN: https://elibrary.ru/txfejs
- Ponde N.O., Lortal L., Ramage G., et al. Candida albicans biofilms and polymicrobial interactions. Crit. Rev. Microbiol. 2021;47(1):91–111. DOI: https://doi.org/10.1080/1040841x.2020.1843400
- Demin K.A., Refeld A.G., Bogdanova A.A., et al. Mechanisms of Candida resistance to antimycotics and promising ways to overcome it: the role of probiotics. Probiotics Antimicrob. Proteins. 2021;13(4):926–48. DOI: https://doi.org/10.1007/s12602-021-09776-6
- Kaur J., Nobile C.J. Antifungal drug-resistance mechanisms in Candida biofilms. Curr. Opin. Microbiol. 2023;71:102237. DOI: https://doi.org/10.1016/j.mib.2022.102237
- Roy S., Gow N.A.R. The role of the Candida biofilm matrix in drug and immune protection. Cell Surf. 2023;10:100111. DOI: https://doi.org/10.1016/j.tcsw.2023.100111
- Пашинина О.А., Сычева М.В., Марисова Е.В. Эффект влияния бактериоцинсодержащей культуральной жидкости Enterococcus faecium EF79OSAU на способность к биопленкообразованию Candida albicans. Проблемы медицинской микологии. 2023;25(2):158. Pashinina O.A., Sycheva M.V., Marisova E.V. The effect of bacteriocin-containing cultural liquid Еnterococcus faecium EF79OSAU on the biofilm formation ability of Сandida albicans. Problems in Medical Mycology. 2023;25(2):158. EDN: https://elibrary.ru/wrttxh
- Vilela S.F., Barbosa J.O., Rossoni R.D., et al. Lactobacillus acidophilus ATCC 4356 inhibits biofilm formation by C. albicans and attenuates the experimental candidiasis in Galleria mellonella. Virulence. 2015;6(1):29–39. DOI: https://doi.org/10.4161/21505594.2014.981486
- Kıvanç M., Er S. Biofilm formation of Candida spp. isolated from the vagina and antibiofilm activities of lactic acid bacteria on the these Candida isolates. Afr. Health Sci. 2020;20(2):641–8. DOI: https://doi.org/10.4314/ahs.v20i2.12
- Shokri D., Khorasgani M.R., Mohkam M., et al. The inhibition effect of lactobacilli against growth and biofilm formation of Pseudomonas aeruginosa. Probiotics Antimicrob. Proteins. 2018;10(1):34–42. DOI: https://doi.org/10.1007/s12602-017-9267-9
- Liu Y., Wu L., Yan Y., et al. Lactic acid and peroxyacetic acid inhibit biofilm of Escherichia coli O157:H7 formed in beef extract. Foodborne Pathog Dis. 2021;18(10):744–51. DOI: https://doi.org/10.1089/fpd.2021.0012
- Sycheva M.V., Popova L.P., Pashkova T.M., et al. Genomic sequence of the strain Enterococcus faecium ICIS 18. Microbiol. Resour. Announc. 2020;9(2):e01349–19. DOI: https://doi.org/10.1128/mra.01349-19
- Pang X., Song X., Chen M., et al. Combating biofilms of foodborne pathogens with bacteriocins by lactic acid bacteria in the food industry. Compr. Rev. Food Sci. Food Saf. 2022;21(2): 1657–76. DOI: https://doi.org/10.1111/1541-4337.12922
- Nwoko E.Q.A., Okeke I.N. Bacteria autoaggregation: how and why bacteria stick together. Biochem. Soc. Trans. 2021;49(3): 1147–57. DOI: https://doi.org/10.1042/bst20200718
- Veljović K., Popović N., Miljković M., et al. Novel aggregation promoting factor AggE contributes to the probiotic properties of Enterococcus faecium BGGO9-28. Front. Microbiol. 2017;8:1843. DOI: https://doi.org/10.3389/fmicb.2017.01843
- Леонова М.В. Пробиотики в лечении вагинальных инфекций: эффективность с позиции доказательной медицины. Медицинский совет. 2020;(13):148–54. Leonova M.V. Probiotics in the treatment of vaginal infections: efficacy from the perspective of evidence-based medicine. Medical Council. 2020;(13):148–54. DOI: https://doi.org/10.21518/2079-701X-2020-13-148-154 EDN: https://elibrary.ru/cocsob
- Хакимова Л.Р., Потапова С.М., Ахметова Л.Р., Гимранова И.А. Изучение биологических свойств аутоштаммов Lactobacillus spp. для создания пробиотиков. Клиническая лабораторная диагностика. 2023;68(8):480–8. Khakimova L.R., Potapova S.M., Ahmetova L.R., Gimranova I.A. Study of biological properties of lactobacillus spp. To create probiotics. Clinical Laboratory Diagnostics. 2023;68(8):480–8. DOI: https://doi.org/10.51620/0869-2084-2023-68-8-480-488 EDN: https://elibrary.ru/ppirvw
- Prakash V., Madhavan A., Veedu A.P., et al. Harnessing the probiotic properties and immunomodulatory effects of fermented food-derived Limosilactobacillus fermentum strains: implications for environmental enteropathy. Front. Nutr. 2023; 10:1200926. DOI: https://doi.org/10.3389/fnut.2023.1200926
Supplementary files