Standard definition of a clinical case of mumps and diagnostic effectiveness of the test systems used in the modern period
- Authors: Semerikov V.V.1, Sofronova L.V.1, Postanogova N.O.1, Yuminova N.V.2, Dolgova E.I.2, Vorobyova N.N.1
-
Affiliations:
- Perm State Medical University named after academician E.A. Wagner
- Research Institute of Vaccines and Sera named after I.I. Mechnikov
- Issue: Vol 100, No 1 (2023)
- Pages: 65-73
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/1320
- DOI: https://doi.org/10.36233/0372-9311-340
- ID: 1320
Cite item
Full Text
Abstract
Introduction. Registration of regular epidemic outbreaks of mumps infection among young people, difficulties in the clinical diagnosis of the disease, the presence of specific clinical manifestations in adults with a severe course of infection make it necessary the improvement of the quality of diagnosis of the disease.
The aim of the work is to develop a standard definition of a clinical case of mumps and to conduct a comparative assessment of the effectiveness of the diagnostic test systems used for mumps diagnostics based on the determination of their sensitivity and specificity.
Materials and methods. To develop a standard definition of a clinical case of mumps based on ten combined clinical and laboratory parameters, a mathematical model was built using the logistic regression method. The study included 84 patients with mumps infection (main group) and 66 patients with non-epidemic sialoadenitis (comparison group). For a comparative evaluation of the diagnostic systems VectoParotitis-IgM, VectoParotitis-IgG, ELISA-Mumps-IgM, ELISA-Mumps-IgG, Anti-Mumps Virus ELISA-IgM, and Anti-Mumps Virus ELISA-IgG, a blood serum samples from patients (n = 41) with a diagnosis “mumps?” were tested in dynamics to assess their sensitivity, specificity, and diagnostic effectiveness.
Results. The clinical symptom “dry mouth” increased the chance of diagnosing mumps by 13.7 times, the presence of bilateral lesions of the salivary glands — by 6.5 times, the increase in the level of diastase in the urine — by 3.2 times. The coefficient of determination R2 was 61.1; the sensitivity was 93% and the specificity — 67%; p < 0.001. Diagnostic effectiveness of “Anti-Mumps Virus ELISA-IgG” test system was 84.4%, ELISA-Mumps-IgG — 87.2%, and "VectoParotitis-IgG" — 88.5%.
Conclusions. Based on the combination of following clinical symptoms observed simultaneously in patient, of the general weakness, dry mouth, bilateral lesions of the salivary glands, an increase in the level of diastase in the urine, it is possible to establish a clinical diagnosis of mumps with a probability of 81%. The highest diagnostic effectiveness of domestically manufactured test systems for quantitation of IgG antibodies to mumps virus in sick people has been demonstrted.
Full Text
Введение
Несмотря на многолетнюю практику вакцинопрофилактики эпидемического паротита (ЭП) в мире и нашей стране, по-прежнему имеет место повсеместное и неравномерное его распространение на различных территориях. В ряде зарубежных стран в настоящее время зарегистрированы эпидемические вспышки паротитной инфекции с большим числом пострадавших [1–12]. В 2015–2020 гг. крупные вспышки имели место в США (в 2016–2017 гг. официально зарегистрировано 150 вспышек с 9200 случаями заболевания), Ирландии (в 2018–2020 гг. — вспышка с общим числом заболевших 3700), Канаде (в 2016–2018 гг. — 24 вспышки, 881 случай заболевания), Австралии (2015–2016 гг. — вспышка среди аборигенов, 893 случая)1.
В России заболеваемость ЭП в последние годы за счёт высокого охвата вакцинацией детей (не ниже 95%) характеризуется устойчивым спорадическим уровнем — показатель заболеваемости колеблется от 0,13 до 3,03 на 100 тыс. населения. На фоне спорадического уровня заболеваемости, как и за рубежом, регистрируются эпидемические вспышки. При этом территорией риска по заболеваемости является Северо-Кавказский федеральный округ, в котором в 2021 г. показатель заболеваемости составил 2,24 на 100 тыс. населения. В Республике Дагестан зарегистрирована вспышечная заболеваемость среди лиц молодого возраста с числом пострадавших 212 человек — показатель составил 6,79 на 100 тыс. населения. В Москве также имела место эпидемическая вспышка среди лиц молодого возраста с числом пострадавших 23 человека2,3.
Регистрация периодических эпидемических вспышек ЭП среди лиц молодого возраста на фоне многолетней практики вакцинопрофилактики, затруднения в клинической диагностике заболевания в связи с выявлением атипичных и стёртых форм, а также наличие особенностей в клинических проявлениях у взрослых с преобладанием тяжёлого течения инфекции обусловливают необходимость улучшения качества диагностики ЭП [13–15].
В существующих клинических рекомендациях (протоколе лечения) оказания медицинской помощи детям, больным ЭП, утверждённых 09.10.2015 на заседании профильной комиссии ФГБУ НИИДИ ФМБА России, и требованиях действующих санитарно-эпидемиологических правил СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» отсутствует стандартное клиническое определение случая ЭП.
Цель исследования — разработать стандартное определение клинического случая ЭП и провести сравнительную оценку эффективности применяемых диагностических тест-систем с определением их чувствительности и специфичности.
Материалы и методы
Материалом для анализа клинико-лабораторных показателей в аналитическом эпидемиологическом исследовании «случай–контроль» послужили «Медицинские карты стационарного больного» (форма № 003/у) 150 пациентов, госпитализированных в ГБУЗ ПК «Пермская краевая клиническая инфекционная больница» в 2014–2019 гг. В исследование включены 84 пациента с подтверждённым диагнозом (МКБ-10) «В26. Эпидемический паротит» — основная группа и 66 человек с диагнозом «К11. Неэпидемический сиалоаденит» (НСА) — группа сравнения. Сформированные группы были сопоставимы по возрасту (4–52 года), заболевшие имели среднюю степень тяжести инфекции и поступили в инфекционный стационар своевременно — в первые 4 дня развития заболевания с наличием одинаковых клинических осложнений.
Среди выявленных клинико-лабораторных показателей определён перечень признаков, статистически достоверно чаще отмечавшихся у пациентов с ЭП в сравнении с больными НСА: общая слабость, повышение температуры до фебрильных цифр, припухлость околоушных слюнных желёз с обеих сторон, боль в околоушной области, сухость во рту, орхит, повышение уровня амилазы в крови, лейкопения, лимфоцитоз, повышение уровня диастазы в моче. Перечисленные клинико-лабораторные признаки были закодированы бинарно: наличие либо отсутствие патологического клинического симптома или лабораторного показателя (для каждого пациента относительно его возрастной физиологической нормы). При этом проводили расчёт чувствительности и специфичности для каждого клинического признака. Чувствительность показателей варьировала от 19 до 100%, специфичность — от 15 до 100%. Сочетание приоритетных клинико-лабораторных показателей, имеющих наибольшую связь с диагностической вероятностью наличия у пациента ЭП, использовали при расчёте вероятности наличия ЭП с помощью уравнения логистической регрессии, описываемого формулой:
, (1)
где р — вероятность у пациента ЭП, а z рассчитывали по формуле:
z = –5,65 + 4,7a + 1,8b + 2,6c + 1,18d, (2)
где: a — наличие у пациента слабости (1 — есть, 0 — нет);
b — наличие у пациента двустороннего поражения околоушных слюнных желёз в виде припухлости (1 — есть, 0 — нет);
c — наличие у пациента сухости слизистой полости рта (1 — есть, 0 — нет);
d — наличие у пациента повышения уровня диастазы мочи относительно физиологической нормы (1 — есть, 0 — нет).
Для каждого пациента с подозрением на ЭП осуществляли сбор анамнестических данных для выявления астенического синдрома, объективный осмотр и пальпацию околоушной области как наиболее часто вовлекающейся в инфекционный процесс с целью обнаружения признаков двустороннего воспаления околоушных слюнных желёз, осмотр полости рта для выявления сухости слизистых оболочек и исследование уровня диастазы в моче кинетическим колориметрическим методом. Каждому из определяемых показателей присваивали балл, указывающий на наличие симптома (1 балл) или его отсутствие (0 баллов). Затем производили расчёт вероятности ЭП с помощью уравнения логистической регрессии. При значении р ≥ 50% у пациента диагностировали ЭП, при р < 50% этот диагноз исключали.
Окончательный диагноз ЭП устанавливали на основании клинических данных и лабораторного подтверждения диагноза4. Для верификации предварительного диагноза ЭП применяли иммунологический метод. С помощью иммуноферментного анализа (ИФА) определяли специфические иммуноглобулины класса М (IgM) к вирусу ЭП или четырёхкратное и более увеличение уровня специфических иммуноглобулинов класса G (IgG) к вирусу ЭП. Лабораторные исследования 82 сывороток крови заболевших лиц и 66 здоровых проведены в лаборатории детских вирусных инфекций НИИ вакцин и сывороток им. И.И. Мечникова.
Для сравнительной оценки чувствительности и специфичности диагностических систем в исследование была взята 41 парная сыворотка от пациентов, прошедших проверку точности клинического диагноза по разработанной модели стандартного определения клинического случая ЭП, взятая при поступлении заболевшего в стационар и через 10–11 дней в динамике болезни, включая сыворотки крови 12 заболевших из эпидемического очага. Группу сравнения составили сыворотки крови детей в возрасте 2 лет, ранее не привитых и не болевших ЭП (n = 33). Сыворотки крови заболевших были заморожены, промаркированы и исследовались одномоментно.
Для проведения ИФА использовали отечественные и зарубежные тест-системы «ВектоПаротит-IgM», «ВектоПаротит-IgG» (АО «Вектор-Бест»), «ИФА-Паротит-IgM», «ИФА-Паротит-IgG» (ЗАО «ЭКОлаб»), «Anti-Mumps Virus ELISA-IgM», «Anti-Mumps Virus ELISA-IgG» («Euroimmun AG»), а также следующие компоненты: планшеты для ИФА с лунками, покрытыми антигенами вируса паротита (иммуносорбент), ферментный конъюгат (антитела к иммуноглобулинам человека, меченные пероксидазой), положительный контрольный образец (на основе инактивированной сыворотки крови человека, содержащий иммуноглобулины к вирусу паротита), отрицательный контрольный образец (на основе инактивированной сыворотки крови человека, не содержащий иммуноглобулины к вирусу паротита), раствор хромогена, раствор для разведения образцов, стоп-реагент, калибратор для полуколичественных и количественных систем, анализируемые сыворотки крови. Учёт и измерение результатов проводили на спектрофотометре при двух длинах волн — 450 и 620–655 нм. При качественном исследовании с помощью диагностических систем «ИФА-Паротит-IgM», «Векто-Паротит-IgM», «ВектоПаротит-IgG» измеряли оптическую плотность (ОП) растворов сывороток крови исследуемых лиц в лунках. На основании полученных данных вычисляли критическое значение ОП, которое сравнивали с ОП образца и делали заключение о наличии в сыворотке крови специфических антител к вирусу ЭП.
При полуколичественном учёте результатов (определение титра IgG в исследуемых сыворотках) в системе «ИФА-Паротит-IgG» строилась калибровочная кривая, на которой значениям ОП образца соответствовал определённый титр специфических антител к вирусу ЭП. Результаты системы «Anti-Mumps Virus ELISA-IgM» рассчитывали отношением (Ratio) ОП образца к ОП калибратора. При Ratio менее 0,8 результат отмечался как отрицательный, более 1,1 — положительный, промежуточное значение — сомнительный результат. При количественном учёте результатов в системе «Anti-Mumps Virus ELISA-IgG» использовали 3 калибровочные сыворотки с Ig человека крови против ЭП (200, 20 и 2 отн. ед./мл), строили калибровочную кривую, на которой значениям ОП образца соответствовал уровень специфических антител к вирусу ЭП: отрицательный результат, если уровень антител составил < 16 отн. ед./мл, сомнительный — ОП от 16 до < 22 отн. ед./мл, положительный — ОП ≥ 22 отн. ед./мл. Конечное разведение образцов сыворотки для каждой тест-системы составило 1 : 100.
Кроме того, исследовали диагностическую чувствительность — долю истинно положительных результатов лабораторного теста в группе больных; диагностическую специфичность — долю истинно отрицательных результатов лабораторного теста в группе здоровых лиц; диагностическую эффективность — долю (в %) истинно отрицательных и положительных результатов лабораторного теста среди всех результатов теста.
Статистический анализ выполнен с применением программного пакета «Statistics v. 26» («IBM SPSS»). Сравнение частоты клинико-лабораторных показателей проводили с использованием таблиц сопряжённости по критерию χ2. Достоверными считали данные при р ˂ 0,05.
Результаты
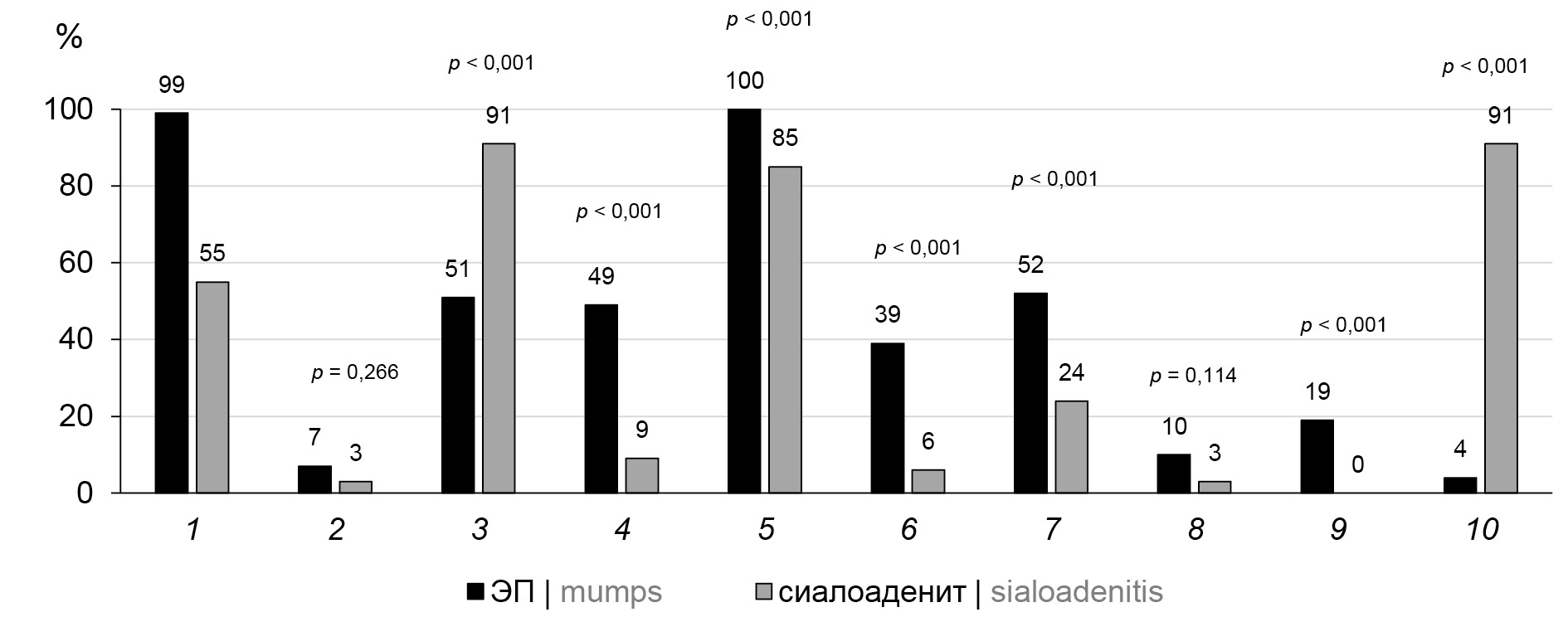
Наиболее характерные клинические проявления ЭП и НСА представлены на рис. 1. При ЭП достоверно чаще в сравнении с НСА имели место ярко выраженные клинические симптомы: слабость (χ2 = 44,2; р < 0,001), поражение околоушных слюнных желёз с обеих сторон (χ2 = 27,1; р < 0,001), боль в околоушных областях (χ2 = 13,6; р < 0,001), сухость во рту (χ2 = 21,9; р < 0,001), фебрильная температура (χ2 = 12,2; р < 0,001), орхит (χ2 = 14,1; р < 0,001).
Рис. 1. Частота встречаемости основных клинических симптомов среди заболевших. 1 — слабость; 2 — головная боль; 3 — припухлость одной слюнной железы; 4 — припухлость обеих слюнных желёз; 5 — боль в околоушной области; 6 — сухость во рту; 7 — фебрильная температура; 8 — боли в животе; 9 — орхит; 10 — катаральные явления верхних дыхательных путей.
Fig. 1. Frequency of occurrence of the main clinical symptoms among the patients (%)
1 — weakness; 2 — headache; 3 — swelling of one salivary gland; 4 — swelling of both salivary glands; 5 — pain in the parotid region; 6 — dry mouth; 7 — febrile temperature; 8 — abdominal pain; 9 — orchitis; 10 — catarrhal upper respiratory tract phenomena.
Наиболее характерные лабораторные изменения, отмечающиеся при ЭП и НСА, представлены на рис. 2. Достоверно чаще при ЭП в сравнении с НСА отмечались повышение уровня амилазы в крови (χ2 = 6,9; р = 0,009), лейкопения (χ2 = 8,7; р = 0,004), лимфоцитоз (χ2 = 10,5; р = 0,002), повышение уровня диастазы в моче (χ2 = 13,4; р < 0,001).
Рис. 2. Частота встречаемости основных лабораторных отклонений среди пациентов, %. 1 — повышение диастазы в моче; 2 — повышение амилазы в крови; 3 — лейкоцитоз; 4 — лейкопения; 5 — нейтрофилёз; 6 — лимфоцитоз; 7 — увеличенная СОЭ.
Fig. 2. Frequency of occurrence of major laboratory abnormalities among patients, %.
1 — increased diastase in urine; 2 — increased amylase in blood; 3 — leukocytosis; 4 — leukopenia; 5 — neutrophilosis; 6 — lymphocytosis; 7 — increased ESR.
Следовательно, наиболее частыми клинико-лабораторными признаками, в данной модели — бинарными классификаторами, имеющими прямую достоверную связь с вероятностью установления диагноза ЭП, на основании которых построена математическая модель (1), оказались следующие: слабость, поражение околоушных слюнных желёз с обеих сторон, боль в околоушных областях, сухость во рту, фебрильная температура, явления орхита, повышение уровня амилазы в крови, лейкопения, лимфоцитоз, повышение уровня диастазы в моче. Чувствительность признаков варьировала от 19 до 99%, специфичность — от 15 до 100% (табл. 1).
Таблица 1. Чувствительность и специфичность клинико-лабораторных показателей в обеих группах наблюдения, %
Table 1. Sensitivity and specificity of clinical and laboratory parameters in both study groups, %
Клинические признаки Clinical signs | Чувствительность Sensitivity | Специфичность Specificity |
Слабость | Weakness | 99 | 45 |
Поражение околоушных слюнных желёз с обеих сторон Damage to the parotid salivary glands on both sides | 49 | 91 |
Боль в околоушных областях | Pain in the parotid areas | 100 | 15 |
Сухость во рту | Dry mouth | 39 | 94 |
Фебрильная температура | Febrile temperature | 52 | 76 |
Явления орхита | Orchitis | 19 | 100 |
Повышение уровня амилазы в крови | Increased amylase levels in the blood | 83 | 33 |
Лейкопения | Leukopenia | 24 | 94 |
Лимфоцитоз | Lymphocytosis | 54 | 73 |
Повышение уровня диастазы в моче | Increased diastase levels in the urine | 80 | 49 |
Исходя из значений регрессионных коэффициентов полученной математической модели (1), такие клинико-лабораторные симптомы, как наличие у пациента общей слабости, сухости во рту, двустороннего поражения околоушных слюнных желёз и повышение уровня диастазы в моче, имели прямую связь с диагностической вероятностью наличия ЭП.
Сухость во рту как клинический симптом увеличивает шансы установления диагноза ЭП в 13,7 раза, двустороннее поражение слюнных желёз — в 6,5 раза, повышение уровня диастазы (500–4300 ЕД/л) — в 3,2 раза. Полученная диагностическая модель характеризовалась коэффициентом детерминации R2 = 61,1; чувствительностью 93% и специфичностью 67% при p < 0,001. Выявленный показатель диагностической эффективности 81% позволяет с наибольшей вероятностью верифицировать диагноз ЭП.
В ходе проведённых сравнительных лабораторных исследований сывороток крови пациентов, заболевших ЭП, получены данные чувствительности, специфичности и диагностической эффективности (табл. 2, табл. 3).
Таблица 2. Результаты сравнительной диагностической эффективности систем в ходе ИФА при выявлении специфических IgМ к вирусу ЭП в сыворотках крови пациентов
Table 2. Results on the comparison of the diagnostic effectiveness of ELISA test systems for detection of IgM antibodies to mumps virus in patients' blood sera
Исследуемые сыворотки крови Tested blood serum samples | «ВектоПаротит-IgM» («Вектор-Бест») «Vectoparotite-IgM» («Vector-Best») | «ИФА-Паротит-IgM» («ЭКОлаб») «ELISA-Mumps-IgM» («EcoLab») | «Anti-Mumps Virus ELISA-IgM» («Euroimmun») | |||
«+» | «–» | «+» | «–» | «+» | «–» | |
Больные | Patients (n = 41) | 15 | 26 | 11 | 30 | 22 | 19 |
Здоровые | Healthy participants (n = 33) | 0 | 33 | 0 | 33 | 0 | 33 |
Диагностическая чувствительность, % | Diagnostic sensitivity, % | 36,6 | 26,8 | 53,7 | |||
Диагностическая специфичность, % | Diagnostic specificity, % | 100,0 | 100,0 | 100,0 | |||
Диагностическая эффективность, % | Diagnostic effectivenes, % | 65,8 | 59,4 | 74,3
| |||
Таблица 3. Данные сравнительной диагностической эффективности систем в ходе ИФА при выявлении специфических IgG к вирусу ЭП в сыворотке крови пациентов, исследованных в динамике заболевания
Table 3. Results on the comparison of the diagnostic effectiveness of ELISA test systems for detection of IgG antibodies to mumps virus in patients' blood sera tested in dynamics
Исследуемые сыворотки крови Tested blood serum samples | «ВектоПаротит-IgG» («Вектор-Бест») «VectoParotite-IgG» («Vector-Best») | «ВектоПаротит-IgG» («Вектор-Бест») «VectoParotite-IgG» («Vector-Best») | «Anti-Mumps Virus ELISA-IgG» («Euroimmun») | |||
«+» | «–» | «+» | «–» | «+» | «–» | |
Больные | Patients (n = 82) | 65 | 17 | 63 | 19 | 59 | 23 |
Здоровые | Healthy participants (n = 66) | 0 | 66 | 0 | 66 | 0 | 66 |
Диагностическая чувствительность, % | Diagnostic sensitivity, % | 79,3 | 76,8 | 71,9 | |||
Диагностическая специфичность, % | Diagnostic specificity, % | 100,0 | 100,0 | 100,0 | |||
Диагностическая эффективность, % | Diagnostic effectiveness, % | 88,5 | 87,2 | 84,4 | |||
Проведённая сравнительная оценка используемых диагностических систем позволила установить наибольшую диагностическую эффективность системы «Anti-Mumps Virus ELISA-IgM» для определения уровня специфических антител-IgM к вирусу ЭП (74,3%) по сравнению с «ВектоПаротит-IgM» (65,8%) и «ИФА-Паротит-IgM» (59,4%) (χ2 = 2,413 при р = 0,121; χ2 = 6,136 при p = 0,014 соответственно; табл. 2). При определении специфических IgG-антител к вирусу ЭП наибольшую диагностическую эффективность продемонстрировали системы «ВектоПаротит-IgG» и «ИФА-Паротит-IgG» по сравнению с «Anti-Mumps Virus ELISA-IgG» (p > 0,05; табл. 3).
Обсуждение
В клинической практике ЭП регистрируется преимущественно в виде железистых клинических форм. Нередко среди заболевших лиц молодого возраста встречаются атипичные формы инфекции с увеличением одной околоушной слюнной железы либо со слабовыраженными симптомами болезни и инаппарантные, диагностируемые в эпидемических очагах инфекции [16–18]. Регистрация периодических эпидемических вспышек паротитной инфекции среди лиц молодого возраста на фоне многолетней практики вакцинопрофилактики, затруднения в клинической диагностике заболевания в связи с выявлением атипичных и стёртых форм, а также наличие особенностей клинических проявлений у взрослых с преобладанием тяжёлого течения инфекции определили необходимость разработки диагностического стандарта ЭП, который отсутствует в клинических рекомендациях (протоколе лечения) оказания медицинской помощи детям, больным ЭП, и требованиях действующих санитарно-эпидемиологических правил СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней». Разработанное стандартное определение клинического случая ЭП (патент на изобретение № 2785486 «Способ диагностики эпидемического паротита») позволит повысить точность и качество диагностики ЭП за короткий промежуток времени, что отвечает задачам национальной программы «Элиминация кори и краснухи, достижение спорадической заболеваемости эпидемическим паротитом в Российской Федерации» (2021–2025 гг.)».
Как демонстрируют настоящее и ранее проведённые исследования, на текущий момент в субъектах Российской Федерации в клинической практике используются отечественные диагностические системы «Вектор-Бест», «ЭКОлаб», БТК «Биосервис», чувствительность и специфичность которых приведена в инструкциях по их применению. Вместе с тем сравнительную оценку диагностической специфичности, чувствительности и эффективности тест-систем, зарегистрированных и применяемых на территории России для лабораторного подтверждения предварительного диагноза ЭП у заболевших, в имеющейся отечественной и зарубежной литературе мы не встретили.
Заключение
Детальный анализ клинических проявлений ЭП позволил отметить, что наличие таких клинических симптомов, как сухость во рту, увеличивает шансы установления диагноза ЭП в 13,7 раза, двустороннее поражение слюнных желёз — в 6,5 раза, повышение уровня диастазы в моче (в диапазоне 500–4300 ЕД/л) — в 3,2 раза. Полученная диагностическая математическая модель характеризовалась коэффициентом детерминации R2 = 61,1; чувствительностью 93% и специфичностью 67% при p < 0,001. Выявленный высокий показатель диагностической эффективности (81%) позволяет с наибольшей вероятностью устанавливать диагноз ЭП с помощью стандартного определения клинического случая. При проведении дифференциальной диагностики ЭП в условиях спорадического уровня заболеваемости с острым НСА при одновременном сочетании у пациента клинических симптомов общей слабости, сухости во рту, двустороннего поражения слюнных желёз, повышения уровня диастазы в моче позволило своевременно верифицировать диагноз ЭП.
Выявленная наибольшая диагностическая эффективность отечественных тест-систем в ходе динамического определения уровня специфических IgG-антител к вирусу ЭП, прошедших проверку точности с помощью разработанного стандартного определения клинического случая ЭП, позволяет рекомендовать их широкое применение для лабораторного подтверждения случаев ЭП и исключения предполагаемого пропущенного случая инфекции, установления потенциального источника возбудителя инфекции и вероятного места заражения.
1 Национальный план мероприятий по реализации программы «Элиминация кори и краснухи, достижение спорадической заболеваемости эпидемическим паротитом в Российской Федерации» (2021–2025 гг.), утверждённым Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека и Министром здравоохранения Российской Федерации.
2 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 году».
3 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2019 году».
4 Постановление Главного государственного санитарного врача РФ от 28.01.2021 № 4 «Об утверждении санитарных правил и норм СанПиН 3.3686-21 "Санитарно-эпидемиологические требования по профилактике инфекционных болезней"».
About the authors
Vadislav V. Semerikov
Perm State Medical University named after academician E.A. Wagner
Email: metodkkib1@yandex.ru
ORCID iD: 0000-0002-5346-8104
D. Sci. (Med.), Professor, Department of epidemiology and hygiene
Russian Federation, PermLyudmila V. Sofronova
Perm State Medical University named after academician E.A. Wagner
Email: pediatr-17@mail.ru
ORCID iD: 0000-0001-5524-8191
D. Sci. (Med.), Professor, Department of pediatrics with a course of outpatient pediatrics
Russian Federation, PermNina O. Postanogova
Perm State Medical University named after academician E.A. Wagner
Email: nina40000@yandex.ru
ORCID iD: 0000-0003-0559-1914
assistant, Department of Pediatrics with a course of outpatient pediatrics
Russian Federation, PermNadezhda V. Yuminova
Research Institute of Vaccines and Sera named after I.I. Mechnikov
Email: yuminova@mail.ru
ORCID iD: 0000-0002-7723-4038
D. Sci. (Biol.), Professor, Deputy Head, Department of virology named after O.G. Anjaparidze
MoscowEkaterina I. Dolgova
Research Institute of Vaccines and Sera named after I.I. Mechnikov
Email: doc.ekaterina.dolgova@yandex.ru
ORCID iD: 0000-0001-8985-7569
junior researcher, Laboratory of children's viral infections
Russian Federation, MoscowNatalia N. Vorobyova
Perm State Medical University named after academician E.A. Wagner
Author for correspondence.
Email: infect-perm@mail.ru
ORCID iD: 0000-0001-5384-5910
D. Sci. (Med.), Professor, Head, Department of infectious diseases
Russian Federation, PermReferences
- Gorelov A.V., ed. Clinical Guidelines for Infectious Diseases [Klinicheskoe rukovodstvo po infektsionnym boleznyam]. Moscow: Medkongress; 2020. (in Russian)
- Bodewes R., van Rooijen K., Cremer J., van Binnendijk R. Optimizing molecular surveillance of mumps genotype G viruses. Infect. Genet. Evol. 2019; 69: 230–4. https://doi.org/10.1016/j.meegid.2019.02.005
- Zengel J., Phan S.I., Pickar A., Xu P., He B. Immunogenicity of mumps virus vaccine candidates matching circulating genotypes in the United States and China. Vaccine. 2017; 35(32): 3988–994. https://doi.org/10.1016/j.vaccine.2017.05.084
- Liu W., Deng L., Lin X., Wang X., Ma Y., Deng Q., et al. Importation of mumps virus genotype K to China from Vietnam. Emerg. Infect. Dis. 2018; 24(4): 774–8. https://doi.org/10.3201/eid2404.170591
- Li D., Chen Z.F., Yang X.H., Pan W.Y., Wang Q., Zhang S.H., et al. Epidemiological and pathogenic characteristics of mumps in Fujian province, 2005-2017. Zhonghua Liu Xing Bing Xue Za Zhi. 2018; 39(10): 1356–61. https://doi.org/10.3760/cma.j.issn.0254-450.2018.10.013 (in Chinese)
- Cui A., Zhu Z., Mao N., Si Y., Ma Y., Hu Y., et al. Assessment of one-dose mumps-containing vaccine effectiveness on wild-type genotype F mumps viruses circulating in mainland China. Vaccine. 2018; 36(38): 5725–31. https://doi.org/10.1016/j.vaccine.2018.08.028
- Vaidya S.R., Tilavat S.M., Hamde V.S., Bhattad D.R. Outbreak of mumps virus genotype G infection in tribal individuals during 2016-17 in India. Microbiol. Immunol. 2018; 62(8): 517–23. https://doi.org/10.1111/1348-0421.12606
- Willocks L.J., Guerendiain D., Austin H.I., Morrison K.E., Cameron R.L., Templeton K.E., et al. An outbreak of mumps with genetic strain variation in a highly vaccinated student population in Scotland. Epidemiol. Infect. 2017; 145(15): 3219–25. https://doi.org/10.1017/S0950268817002102
- Park S.H. Resurgence of mumps in Korea. Infect. Chemother. 2015; 47(1): 1–11. https://doi.org/10.3947/ic.2015.47.1.1
- Maillet M., Bouvat E., Robert N., Baccard-Longère M., Morel-Baccard C., Morand P., et al. Mumps outbreak and laboratory diagnosis. J. Clin. Virol. 2015; 62: 14–9. https://doi.org/10.1016/j.jcv.2014.11.004
- Liang Y., Che Y., Yang B., Zhan F., Li H., Guan X., et al. Immunogenicity and safety of an F-genotype attenuated mumps vaccine in healthy 8- to 24-month-old children. J. Infect. Dis. 2019; 219(1): 50–8. https://doi.org/10.1093/infdis/jiy469
- L'Huillier A.G., Eshaghi A., Racey C.S., Ogbulafor K., Lombos E., Higgins R.R., et al. Laboratory testing and phylogenetic analysis during a mumps outbreak in Ontario, Canada. Virol. J. 2018; 15(1): 98. https://doi.org/10.1186/s12985-018-0996-5
- Westphal D.W., Eastwood A., Levy A., Davies J., Huppatz C., Gilles M., et al. A protracted mumps outbreak in Western Australia despite high vaccine coverage: a population-based surveillance study. Lancet Infect. Dis. 2019; 19(2): 177–84. https://doi.org/10.1016/S1473-3099(18)30498-5
- Fields V.S., Safi H., Waters C., Dillaha J., Capelle L., Riklon S., et al. Mumps in a highly vaccinated Marshallese community in Arkansas, USA: an outbreak report. Lancet Infect. Dis. 2019; 19(2): 185–92. https://doi.org/10.1016/S1473-3099(18)30607-8
- Postanogova N.O., Semerikov V.V., Sofronova L.V., Vol'dshmidt N.B. Cases of mumps development in outbreak incidence: clinical and epidemiological observation. Permskiy meditsinskiy zhurnal. 2020; 37(2): 24–32. https://doi.org/10.17816/pmj37224-32 (in Russian)
- Kruglov I.V., Yuminova N.V., eds. Topical Issues of Modern Virology: A Collective Monograph [Aktual'nye voprosy sovremennoy virusologii: kollektivnaya monografiya]. Orekhovo-Zuevo: GGTU; 2021. (in Russian)
- Grishunina Yu.B., Kontarov N.A., Arkharova G.V., Yuminova N.V. Statistical analysis of the model parameters of the epidemic situation. Epidemiologiya i vaktsinoprofilaktika. 2015; 14(5): 13–20. (in Russian)
- Clinical recommendations (treatment protocol) for providing medical care to children with mumps. St. Petersburg; 2015. (in Russian)
Supplementary files