On the assesment of the etiological significance of bacteria detected in the male genital tract
- Authors: Godovalov A.P.1, Nikolaeva N.V.1, Karpunina T.I.1, Oborin D.A.2
-
Affiliations:
- E.A. Vagner Perm State Medical University
- Perm Regional Center for the Prevention and Control of AIDS and Infectious Diseases
- Issue: Vol 99, No 4 (2022)
- Pages: 428-435
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/1311
- DOI: https://doi.org/10.36233/0372-9311-257
- ID: 1311
Cite item
Full Text
Abstract
Introduction. Currently, there is an increasing importance of microbial associations in the pathogenesis of genital inflammatory diseases. However, the issues of deciphering the taxonomic affiliation and the diagnostic significance of the bacteria detected in this case remain unresolved.
The aim of the study was to review the diagnostic significance of the quantitative approach in determining the etiological role of microorganisms in andrology.
Materials and methods. For the study, samples of ejaculate and/or discharge from the urethra from 15 men who were in infertile marriages, 12 with a confirmed diagnosis of "acute genital gonococcal infection" were used. The testing included a classic bacteriological study and the metagenomic analysis of 16S ribosomal RNA samples carried out at the Department of Collection Cultures of the State Research Center for Applied Microbiology (Obolensk). To standardize the distribution of samples into groups based on the indicators of alpha diversity and the concentration of putrescine, the range of variation and the average linear deviation were used. Statistical analysis of the obtained data was carried out using Excel software (MS Office package).
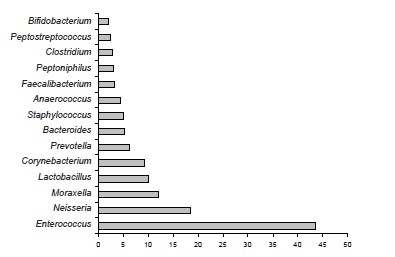
Results. The microbial landscape of the ejaculate was characterized by the predominance of representatives of the genera Enterococcus, Neisseria, Lactobacillus, Corynebacterium, Prevotella, Bacteroides. Stable associations of E. faecalis and M. osloensis were detected in the ejaculate. When using the cultural method, representatives of the genus Moraxella were not isolated in any sample. It was shown that discrepancies can affect not only quantitative indicators, but also reveal inconsistencies between the qualitative assessment of detected genetic markers and the results of identification in a bacteriological study of individual representatives of similar or phenotypically similar taxa.
Discussion. The results of this study indicate that the lesser diversity of opportunistic pathogens gives them more opportunities to realize their pathogenic potential. On the other hand, in a complex community with greater alpha diversity, its realization is hindered by a complex intermicrobial relationships and the need to survive.
Conclusion. As a result, it seems that the most promising approach is the integrated use of cultural methods and metagenomics with a comparative statistical analysis of the obtained qualitative and quantitative indicators.
Keywords
Full Text
ВВЕДЕНИЕ
При возникновении и развитии патологических процессов различной локализации возрастает роль неспецифических инфекций. Исследователи акцентируют внимание на этиологической значимости условно-патогенных представителей индигенной микрофлоры, отмечая возрастающее значение микробных ассоциаций в патогенезе таких состояний. На фоне накопления информации о микробном разнообразии в генитальном тракте мужчин в норме и при патологии зачастую нерешёнными остаются вопросы расшифровки таксономической принадлежности и диагностической значимости детектируемых при этом бактерий. Классические бактериологические методы нередко оказываются диагностически несостоятельными, а внедрение в широкую практику новых технологий молекулярно-генетического анализа, исследования белковых профилей возбудителей, хотя и расширило наши представления о видовом спектре бактерий, населяющих организм человека, существенно усложнило понимание как его клинической значимости в целом, так и этиопатогенетического потенциала отдельных представителей. Присутствующие в урогенитальном тракте мужчин многочисленные микроорганизмы, персистируя зачастую длительное время, могут не вызывать никаких клинических проявлений либо обусловливать вялотекущее малосимптомное воспаление, которое имеет тенденцию распространяться и развиваться не только в уретрит, простатит, эпидидимит, орхит, но и приводить к нарушению процесса сперматогенеза. К тому же условно патогенные «аборигены» этого биотопа способны, с одной стороны, маскироваться под специфических возбудителей, а с другой — влиять на клинические проявления инфекций, передающихся половым путём, а также на течение и результаты лечения, к примеру, генитальной гонококковой инфекции [1][2]. В качестве регуляторов такого сложного микробного сообщества можно рассматривать полиамины, синтез которых в очаге воспаления существенно усиливается [3]. Эти соединения могут опосредовать свои эффекты без взаимодействия со специфическими рецепторами [4], инактивировать свободные радикалы и регулировать жизнедеятельность не только отдельных бактериальных клеток, но и сообщества в целом [5].
Современный уровень развития лабораторных технологий предлагает широкие возможности для идентификации таксонов, локализованных в биотопах. Складывается впечатление, что могут быть преодолены основные трудности бактериологического метода, обусловленные ауксотрофностью микроорганизмов, наличием анаэробных и некультивируемых форм и др. Так, в качестве альтернативы комплексу традиционных способов идентификации бактерий можно рассматривать метод исследования белковых профилей — времяпролетную масс-спектрометрию с матричной лазерной десорбцией / ионизацией (MALDI-TOF MS). Молекулярно-генетические исследования, основанные на методе амплификации нуклеиновых кислот (полимеразной цепной реакции), рекомендованы для диагностики инфекций, передающихся половым путём [6], и обладают рядом преимуществ по сравнению с традиционными культуральными и микроскопическими методами. ПЦР-тестирование позволяет получить результат за достаточно короткое время, обладает высокой специфичностью и чувствительностью, что особенно важно для выявления хронической инфекции, когда патоген персистирует в низкой концентрации [7]. Кроме того, метод позволяет проводить исследование в количественном формате, что имеет значение для мониторинга эффективности лечения [8]. Однако и MALDI-TOF MS, и молекулярно-генетические технологии не дают ответа на вопрос о жизнеспособности детектируемых микроорганизмов. Кроме того, затруднено получение сведений о чувствительности микроорганизмов к антибиотикам и антисептикам, особенно при проведении массовых исследований, а самая главная проблема клинической микробиологии — оценка этиологической значимости условно-патогенных бактерий и их ассоциаций — в силу колоссального количества детектируемого генетического материала остаётся нерешённой.
Цель исследования — пересмотр диагностической значимости количественного подхода при определении этиологической роли условно-патогенных микроорганизмов в андрологии с учётом результатов молекулярно-генетического и традиционного бактериологического анализа.
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования использовали пробы эякулята и/или отделяемого из уретры 15 мужчин, проходивших обследование по поводу бесплодия в браке, 12 — с подтверждённым в клинической лаборатории диагнозом «острая генитальная гонококковая инфекция» (ОГГИ). Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Этическим комитетом ПГМУ им. акад. Е.А. Вагнера (протокол № 11 от 11.01.2021).
Концентрацию путресцина в спермальной жидкости определяли методом тонкослойной хроматографии [9][10].
Для бактериологического анализа исследуемых образцов готовили десятикратное разведение исходного материала. Стрепто- и энтерококки изолировали на кровяном агаре, стафилококки выделяли на желточно-солевом агаре, грибы рода Candida — на среде Сабуро, энтеробактерии определяли при высеве на агар Эндо, гонококки — на ГНК агаре (гонококковая среда), анаэробы — на обогащённой среде для контроля стерильности, разлитой по пробиркам «высоким столбиком». Все среды отечественного производства (Махачкала, Оболенск, Пермь). Количество выделенных микроорганизмов выражали в виде lg КОЕ/мл биологического материала.
Метагеномное исследование 16S рибосомальной РНК образцов осуществлено в отделе коллекционных культур ФБУН ГНЦ ПМБ на платформе «IlluminaMiSeq» с использованием набора «MiSeqReagentKits v3» («600-Cycle Kit») согласно рекомендациям производителя. Библиотеки для секвенирования участков V3–V4 гена 16S рибосомной РНК были приготовлены согласно 16S Metagenomic Sequencing Library Preparation Illumina. При биоинформационной оценке применяли программное обеспечение для метагеномного анализа — «Kraken Metagenomics v.2.0.0» (классификатор ридов — коротких нуклеотидных последовательностей), используя стандартную базу данных. При анализе данных встречаемость ридов менее 1% считали малочисленной, что не позволяет сформировать отдельный кластер, и поэтому в статистический анализ эти данные не вошли.
Для стандартизации распределения образцов по группам с учётом показателей альфа-разнообразия и концентрации путресцина использовали размах вариации и среднее линейное отклонение. Статистическую обработку полученных данных проводили с использованием «MS Excel» и пакета «Statistica 7.0». Для проверки нормальности распределения использовали критерий Шапиро– Уилка. В случае распределения, приближенного к нормальному, использовали t-критерий Стьюдента, в остальных случаях — критерий Манна–Уитни для оценки значимости различий. За пороговый уровень значимости принимали величину p < 0,05.
РЕЗУЛЬТАТЫ
При проведении анализа метагеномных данных установлено, что среднее содержание эукариотической ДНК в образцах — 28,0 ± 7,4%. Коэффициент альфа-разнообразия варьировал от 3 до 82 (среднее арифметическое 19,1; стандартное отклонение 22,0). Микробный пейзаж характеризовался преобладанием представителей родов Enterococcus, Neisseria, Lactobacillus, Corynebacterium, Prevotella, Bacteroides и др. (рисунок). Среди генетического материала прокариотических клеток во всех образцах детектировали фрагменты генома Enterococcus faecalis в значительном количестве. Неожиданной находкой явились детектируемые с постоянством генетические маркеры Moraxella spp., доля которых в метагеноме превышала 10%. M. osloensis занимали среди них лидирующие позиции (11,7 ± 9,3%).
Представительство бактерий отдельных родов в эякуляте по результатам метагеномного анализа. По оси ординат — относительное содержание геномовариантов в образцах (%), по оси абсцисс — доминирующие таксоны микроорганизмов.
При этом в эякуляте детектировали устойчивые ассоциации E. faecalis и M. osloensis. В трети таких ассоциаций доминирующее положение занимали M. osloensis, а более чем в половине — E. faecalis. При использовании культурального метода представители рода Moraxella не были выделены ни в одной пробе. В посевах образцов зачастую регистрировали представителей одного вида, реже — ассоциации 2, менее чем в десятой доле проб — совокупность 3 микроорганизмов. В то же время при молекулярно-генетическом исследовании обнаружен значительно более широкий видовой спектр в каждой пробе. Примечательно, что те виды, которые высевали при культивировании, детектированы и при метагеномном исследовании, но в минимальных количествах, и наоборот, что с трудом поддаётся логическому объяснению.
Среди мужчин с бесплодием из 3 образцов с относительно низким содержанием бактериальной ДНК (менее 30%) в 2 образцах бактерии не были обнаружены культуральным методом, а при метагеномном исследовании детектированы M. osloensis, Lactobacillus spp., Gardnerella vaginalis, M. morganii, E. faecalis и ряд других таксонов, представленность которых была менее 0,1% от общей ДНК прокариот. В 8 образцах количество ДНК бактерий, выявленных в бактериологическом исследовании, составляло менее 0,1% метагенома. Содержание ДНК бактерий, выявленных в оставшихся 4 пробах, составило по метагеному 4–17%. О совпадении результатов можно говорить только в 4 случаях из 15.
Рассмотрим некоторые примеры. В образце № 123 при культуральном исследовании обнаружены Staphylococcus aureus (105 КОЕ/мл) и Escherichia coli (106 КОЕ/мл). Метагеномный анализ того же образца показал, что ДНК прокариот представлена на 54% E. faecalis, 6% — M. osloensis, 4% — Corynebacterium spp., 2% — Lactobacillus spp. и 11% генетического материала принадлежали совокупности микроорганизмов, каждый из которых детектирован менее чем в1% ридов. Доля S. aureus в метагеноме — 0,05%, E. coli — 0,07%. Можно полагать, что в данном примере отсутствие роста энтерококков на питательных средах связано с формированием «малых», некультивируемых форм, что, вероятно, обусловлено действием таких внешних факторов, как иммунная система организма-хозяина или антагонистическими взаимоотношениями между микроорганизмами в биотопе. С другой стороны, ростовые свойства S. aureus и E. coli на традиционно используемых питательных средах существенно выше, чем таковые у энтерококков и, тем более, моракселл, лактобактерий и коринебактерий.
В образце №93 на питательных средах изолированы только Enterobacter cloacae (106 КОЕ/мл). При проведении метагеномного исследования установлено, что 75% генетического материала принадлежало эукариотическим клеткам, а среди прокариот 7% — представителям семейства Enterobacteriaceae (4% — E. cloacae), 6% — E. faecalis, 5% — M. osloensis, 1% — M. morganii, 0,8% — Lactobacillus spp. Оставшиеся 5% представляли совокупность микроорганизмов, доля каждого составляла менее 0,5%. В данном примере прослеживается проблема сопоставления количественных данных культурального и метагеномного исследований: как соотнести 4% обнаруженных ридов, принадлежащих E. cloacae, и 106 КОЕ/мл в культуральном исследовании?
При исследовании материала от пациентов с ОГГИ, подтверждённой бактериологическим исследованием, генетический материал Neisseria gonorrhoeae обнаружен в метагеномном анализе лишь 5 образцов, но в очень незначительном количестве (0,200–0,008%).
Из образца № 15 культуральным методом были изолированы N. gonorrhoeae, кроме того в материале обнаружены Enterobacteriaceae (103 КОЕ/мл) и Lactobacillus spp. При проведении метагеномного анализа установлено, что на долю эукариот приходится 76% совокупного генетического материала, что может свидетельствовать об остроте воспалительного процесса, при котором фрагменты генома N. gonorrhoeae составили лишь 0,2%, а фрагменты сопутствующих Lactobacillus spp. — 3% и Enterobacteriaceae — 0,5%. В то же время 29,8% генетического материала бактерий принадлежало другим представителям рода Neisseria, в том числе N. meningitidis, а также близким по морфологии и культуральным свойствам Moraxella spp., не распознанным при бактериологическом анализе.
В образце № 21 традиционным методом обнаружены N. gonorrhoeae, Enterobacteriaceae (104 КОЕ/мл), Staphylococcus spp. (104 КОЕ/мл) и Streptococcus spp. (104 КОЕ/мл). При метагеномном исследовании установлено, что доля генетического материала эукариот составляет 70%, среди прокариот доля Streptococcus spp. составила 2%, а генетический материал N. gonorrhoeae и Staphylococcus spp. не обнаружен. Таким образом, в данном образце результаты традиционного и метагеномного исследований по существу противоречили друг другу.
Таким образом, параллельно выполненное исследование образцов материала от пациентов с диагнозом ОГГИ показало, что разночтения могут не только затрагивать количественные показатели, но и выявлять несоответствия качественной оценки детектированных генетических маркеров с результатами идентификации в бактериологическом исследовании отдельных представителей соимённых и фенотипически сходных таксонов.
На диаграмме рассеивания значений, согласно [11], в зависимости от положения относительно линии тренда показателей коэффициента альфа-разнообразия микроорганизмов и количества путресцина обозначились три группы образцов (таблица). В 1-й группе с низким альфа-разнообразием простатит, установленный по данным УЗИ, встречался у 90% лиц, а во 2-й — у 25% (p < 0,05). Третью группу с более высоким показателем альфа-разнообразия составили пациенты с острым воспалительным процессом. Различия между группами статистически значимы, при этом в каждой из них отмечена сильная корреляция между коэффициентом альфа-разнообразия и концентрацией путресцина в спермальной жидкости.
Средние показатели альфа-разнообразия и количества путресцина в группах образцов
Mean values of alpha diversity and amount of putrescine in groups of samples
Примечание. * — коэффициент корреляции между показателями альфа-разнообразия и количеством путресцина.Note. * — the correlation coefficient between the alpha-diversity index and the amount of putrescine.
ОБСУЖДЕНИЕ
Наличие достаточно противоречивых результатов при применении традиционного бактериологического и, бесспорно, перспективного молекулярно-генетического методов лабораторного исследования заставляет критически переоценивать диагностическую значимость каждого из них. Не вызывает сомнений, что внедрение в микробиологическую диагностику метагеномного секвенирования 16S рибосомальной РНК существенно расширило наши представления о микробном сообществе организма человека [12]. Установлено, что, к примеру, 80% микроорганизмов кишечника — не культивируемые [13]. В то же время существует проблема оценки этиологической значимости изолированных микроорганизмов. Так, в исследовании [14] сообщается, что методы, основанные на изучении генома, могут «пропускать» клинически значимые таксоны, что было показано для Salmonella typhi иYersinia enterocolitica. Эти микроорганизмы, присутствуя в микробном сообществе в меньшинстве, способны обусловливать клинически значимые состояния. Обобщая вклад минорных (по количеству) популяций микроорганизмов, авторы подчёркивают, что они могут оказывать существенное влияние на экологию биотопа и здоровье человека. J.C. Lagier и соавт. ещё 10 лет назад указывали на то, что и без применения геномных технологий путём расширения возможностей культурального метода за счёт использования селективных добавок, антибиотиков, бактериофагов и т.п. удаётся значительно повышать его эффективность [14]. Так, элиминация только одного вида E. coli позволила исследователям идентифицировать в образцах фекалий новый вид энтеробактеров — Enterobacter massiliensis. Использование рубцовой жидкости или предварительной инкубации образцов в средах с кровью позволило выделить на 17 культур больше, чем без применения таких процедур [15][16].
Ранее нами установлено, что в микрофлоре эякулята мужчин доминируют, как правило, антагонистические взаимоотношения между отдельными видами [17]. При этом часть микроорганизмов, находящихся в меньшей численности, но обладающих более выраженным антагонистическим потенциалом, может подавлять патогенетическую активность более вирулентных ассоциантов и менять клиническую картину заболевания, снижая выраженность его острой фазы. Кроме этого, такие взаимоотношения не могут не отразиться на результатах культурального метода исследования. В подобных условиях микроорганизмы изменяют свой фенотип, формируя так называемые «малые формы колоний» [18]. Показано, что при неблагоприятных условиях переход в состояние «малых форм» обеспечивает выживаемость микроорганизмов [19]. Приводятся доказательства, что такая форма является переходной к некультивируемому состоянию [20]. Именно поэтому в настоящем исследовании с помощью культурального метода не удалось детектировать, например, E. faecalis, которые, вероятно, находились в таком переходном состоянии.
Результаты настоящего исследования указывают на то, что при меньшем разнообразии у условно-патогенных микроорганизмов больше возможностей для реализации своего патогенного потенциала. С другой стороны, в составе сложного сообщества, когда альфа-разнообразие больше, его реализация затруднена из-за сложных межмикробных отношений, с одной стороны, и необходимостью выживать ‒ с другой. Можно предположить, что, не проявив свои патогенные свойства, микроорганизмы, под давлением со стороны поликомпонентного сообщества, переходят к особому персистентному состоянию, когда их жизнеспособность не нарушается, а влияние на эукариотические клетки нивелировано. Логично и наблюдаемое при большом разнообразии повышение уровня путресцина, который оказывает на микроорганизмы благоприятное действие, способствуя их выживанию, и, таким образом, обеспечивает персистенцию антагонистических видов в одном биотопе. Кроме этого, выступая как «скавенджер» свободных радикалов, путресцин обусловливает снижение реактивности лейкоцитов, вероятно, обеспечивая таким образом формирование хронического воспалительного процесса при отсутствии острой фазы.
ЗАКЛЮЧЕНИЕ
В целом внедрение молекулярно-генетических методов в медицинскую микробиологию существенно расширяет представления о микробиоте биотопов человека. Тем не менее отказаться от культурального метода невозможно в силу того, что он позволяет получить информацию о клинически значимых штаммах, оценить их чувствительность к антимикробным средствам, а также косвенно судить о взаимоотношениях между микроорганизмами. Требуется совершенствование культурального метода, расширение его возможностей. Однако общепринятая тактика безоговорочного признания этиопатогеном изолята, количественно преобладающего в образце при культуральном исследовании, выглядит, по меньшей мере, сомнительной. Представляется, что наиболее перспективным следует признать комплексное использование культуромики и метагеномики с учётом сравнительного статистического анализа получаемых качественных и количественных показателей, в том числе с использованием предлагаемого методического подхода.
Проявление симптомов заболевания зависит от микробного разнообразия биотопа. Логично предположить, что при ограниченном видовом спектре в сложившихся условиях в микробиоте преобладают синергичные взаимоотношения, когда даже при малой численности совокупный патогенный потенциал условно-патогенных бактерий может обусловить выраженный воспалительный процесс. С другой стороны, при большом разнообразии сложные, чаще антагонистические межмикробные отношения препятствуют оппортунистическим видам реализации в полной мере своего патогенного потенциала, даже при высокой их численности, что, вероятно, и становится причиной развития асимптомной вялотекущей инфекции или «здорового» бактерионосительства.
About the authors
Anatoliy P. Godovalov
E.A. Vagner Perm State Medical University
Author for correspondence.
Email: agodovalov@gmail.com
ORCID iD: 0000-0002-5112-2003
Cand. Sci. (Med.), leading researcher, Central scientific research laboratory, Assoc. Prof., Microbiology and virology department
Russian Federation, PermNina V. Nikolaeva
E.A. Vagner Perm State Medical University
Email: agodovalov@gmail.com
ORCID iD: 0000-0002-6799-5503
Cand. Sci. (Biol.), Assoc. Prof., Microbiology and virology department
Russian Federation, PermTamara I. Karpunina
E.A. Vagner Perm State Medical University
Email: agodovalov@gmail.com
ORCID iD: 0000-0003-2511-4656
D. Sci. (Biol.), Professor, Microbiology and virology department
Russian Federation, PermDenis A. Oborin
Perm Regional Center for the Prevention and Control of AIDS and Infectious Diseases
Email: agodovalov@gmail.com
ORCID iD: 0000-0001-6426-5217
bacteriologist
Russian Federation, PermReferences
- Кубанова А.А., Рахматулина М.Р. Урогенитальные инфекционные заболевания, вызванные генитальными микоплазмами. Клинические рекомендации. Вестник дерматологии и венерологии. 2009; (3): 78-82.
- Рахматулина М.Р. Урогенитальные заболевания, вызванные генитальными микоплазмами (Mycoplasma genitalium, Ureaplasma spp., Mycoplasma hominis). Дерматология. Приложение к журналу Consilium Medicum. 2012; (2): 22-5.
- Hesterberg R.S., Cleveland J.L., Epling-Burnette P.K. Role of polyamines in immune cell functions. Med. Sci. (Basel). 2018; 6(1): 22. https://doi.org/10.3390/medsci6010022
- Годовалов А.П., Карпунина Т.И. Микроэкологический подход к оценке особенностей микробиоты эякулята в профилактике снижения фертильности. Профилактическая медицина. 2020; 23(3): 108-12. https://doi.org/10.17116/profmed202023031108
- Fujisawa S., Kadoma Y. Kinetic evaluation of polyamines as radical scavengers. Anticancer Res. 2005; 25(2A): 965-9.
- Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. М.: Деловой экспресс; 2016.
- Гомберг М.А., Гущин А.Е. Хламидийная инфекция в современной гинекологии: основные аспекты профилактики и лечения воспалительных заболеваний органов малого таза. Гинекология. 2012; 14(4): 19-22.
- Muralidhar S. Molecular methods in the laboratory diagnosis of sexually transmitted infections. Indian J. Sex. Transm. Dis. AIDS. 2015; 36(1): 9-17. https://doi.org/10.4103/0253-7184.156686
- Ткаченко А.Г., Шумков М.С., Ахова А.В. Путресцин как модулятор содержания σS-субъединицы РНК-полимеразы в клетках Escherichia coli при кислотном стрессе. Биохимия. 2006; 71(2): 237-46.
- Богданов Ю.А., Карпунина Т.И., Нестерова Л.Ю., Ахова А.В. О диагностической значимости содержания полиаминов в эякуляте инфертильных мужчин при асимптомных воспалительных процессах. Андрология и генитальная хирургия. 2013; 14(3): 19-22.
- Демин С.Е., Демина Е.Л. Математическая статистика. Нижний Тагил; 2016.
- Browne H.P., Forster S.C., Anonye B.O., Kumar N., Neville B.A., Stares M.D., et al. Culturing of “unculturable”' human microbiota reveals novel taxa and extensive sporulation. Nature. 2016; 533(7604): 543-6. https://doi.org/10.1038/nature17645
- Turnbaugh P.J., Ley R.E., Hamady M., Fraser-Liggett C.M., Knight R., Gordon J.I. The human microbiome project. Nature. 2007; 449(7164): 804-10. https://doi.org/10.1038/nature06244
- Lagier J.C., Armougom F., Million M., Hugon P., Pagnier I., Robert C., et al. Microbial culturomics: paradigm shift in the human gut microbiome study. Clin. Microbiol. Infect. 2012; 18(12): 1185-93. https://doi.org/10.1111/1469-0691.12023
- Goodman A.L., Kallstrom G., Faith J.J., Reyes A., Moore A., Dantas G., et al. Extensive personal human gut microbiota culture collections characterized and manipulated in gnotobiotic mice. Proc. Natl Acad. Sci. USA. 2011; 108(15): 6252-7. https://doi.org/10.1073/pnas.1102938108
- Pagnier I., Raoult D., La Scola B. Isolation and identification of amoeba-resisting bacteria from water in human environment by using an Acanthamoeba polyphaga co-culture procedure. Environ. Microbiol. 2008; 10(5): 1135-44. https://doi.org/10.1111/j.1462-2920.2007.01530.x
- Годовалов А.П., Гущин М.О., Карпунина Т.И. Особенности межмикробных отношений в микробиоте влагалища инфертильных женщин. Медицинский вестник Северного Кавказа. 2019; 14(1-1): 40-44. https://doi.org/10.14300/mnnc.2019.14045
- Fugère A., Lalonde Séguin D., Mitchell G., Déziel E., Dekimpe V., Cantin A.M., et al. Interspecific small molecule interactions between clinical isolates of Pseudomonas aeruginosa and Staphylococcus aureus from adult cystic fibrosis patients. PLoS One. 2014; 9(1): e86705. https://doi.org/10.1371/journal.pone.0086705
- Atalla H., Gyles C., Mallard B. Staphylococcus aureus small colony variants (SCVs) and their role in disease. Anim. Health Res. Rev. 2011; 12(1): 33-45. https://doi.org/10.1017/S1466252311000065
- Trizna E.Y., Yarullina M.N., Baidamshina D.R., Mironova A.V., Akhatova F.S., Rozhina E.V., et al. Bidirectional alterations in antibiotics susceptibility in Staphylococcus aureus - Pseudomonas aeruginosa dual-species biofilm. Sci. Rep. 2020; 10(1): 14849. https://doi.org/10.1038/s41598-020-71834-w
Supplementary files