Biological properties of domestic strain vRub-Ant of rubella virus
- Authors: Nagieva F.G.1, Barkova E.P.1, Stroeva A.D.1, Ammur Y.I.1, Sidorov A.V.1, Kharchenko O.S.1, Bukhtoyarov G.N.1, Svitich O.A.1, Zverev V.V.1
-
Affiliations:
- Mechnikov Research Institute for Vaccines and Sera
- Issue: Vol 99, No 5 (2022)
- Pages: 505-513
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/1254
- DOI: https://doi.org/10.36233/0372-9311-320
- ID: 1254
Cite item
Full Text
Abstract
Introduction. Rubella is a mild infectious disease affecting mainly children and is caused by the rubella virus, part of the Matonoviridae family, genus Rubivirus. Rubella causes congenital rubella syndrome (CRS) and is the main cause of developmental abnormalities, especially blindness and deafness.
There is no specific treatment for rubella and CRS. In order to avoid possible complications from rubella infection, a live attenuated rubella vaccine based on the foreign strain of Wistar RA 27/3 rubella virus is used. However, the actual, more effective and preferred vaccine strain the rubella virus for the Russian Federation is considered to be a viral strain of rubella circulating on its territory.
The aim of the study was to study the biological properties of the developed domestic cold-adapted strain vRub-Ant circulating in the territory of the Russian Federation.
Materials and methods. Following cell cultures were used in the study — human embryo lung diploid cell strain LECH-3, transferable cell line from embryonic kidney cells of green monkeys Vero CCL-81 and Vero ECC, human mesenchymal stem cells, human peripheral blood mononuclear cells (PBMC). Cell cultures were grown on a DMEM/F12 nutrient medium with the addition of 5% fetal bovine serum. Swabs from the pharynx and nasal passages from a child with rubella were used as clinical virus-containing material. Monoclonal anti-idiotypic antibodies m(anti-ID)Ab were used to assess the expression level of alpha/beta and gamma interferon receptors (α/β and γIFN-R)Ab, imitating the biological effects of alpha/beta and gamma interferons (α/β and γIFN) of humans. The cultural, virological, immunochemical and serological research methods were applied in the study.
Results. Attenuation of the vRub-Ant clinical isolate of rubella virus was carried out for 20 consecutive passages on LECH-3 diploid cells at a reduced temperature of 30°C. The main biological markers of attenuation were determined to be ts and ca phenotypes. The avirulence of the attenuated viral strain (att-phenotype) was assessed by the level of expression of α/β and γIFN-R. A lower level of α/β and γIFN-R expression was found on the membranes of human PBMC induced by the vaccine strain vRub-Ant in comparison with the parent wild variant of the rubella virus. This trait,the att phenotype, is characteristic of attenuated viral strains. It has been shown that the vaccine strain vRub-Ant has lost neurotropism and was unable to bind to the membrane receptors of the brain (MRB) of guinea pig embryos, unlike its parent rubella virus strain. The high immunogenicity of the domestic cold-adapted strain vRub-Ant was confirmed by high titers of neutralizing rubella antibodies observed in guinea pigs immunized subcutaneously with one vaccination dose of the virus.
Conclusion. A domestic attenuated vaccine strain vRub-Ant of the rubella virus that has the main biological markers of attenuation (ts-ca and att phenotypes) has been developed. The vaccine strain vRub-Ant induces a high levels of neutralizing antibodies in guinea pigs following the immunization with a single vaccination dose of the vaccine. The viral strain vRub-Ant has lost its tropism to the MRB of guinea pig embryos, unlike its parent variant.
Full Text
Введение
Краснуха — это лёгкое инфекционное заболевание, которое поражает преимущественно детей и вызывается вирусом краснухи (Rubella virus — RV), входящим в семейство Matonoviridae, род Rubivirus [1]. Краснуха остаётся социально-экономическим бременем из-за высокой заболеваемости синдромом врождённой краснухи (СВК). Если инфекция возникает у женщины в I триместре беременности, RV способен установить инфекцию у плода в 90% случаев в виде развития СВК. Специфического лечения краснухи и СВК не существует. В США в 1950-х гг. у 8–13% детей с СВК развился аутизм во время рубеолярной эпидемии. Считают, что СВК, вызванный в ранние сроки беременности, возникает вследствие дисфункции материнской печени, приводящей к гипервитаминозу А, который воздействует на развивающийся зародыш [2]. СВК, вызванный краснушной инфекцией, является основной причиной аномалий развития, особенно слепоты и глухоты. Системные осложнения включают сыпь при рождении, малый вес, сердечно-сосудистые дефекты, микроцефалию, психомоторное торможение, гепатит и др. Реже возникает фатальное нейродегенеративное расстройство, названное прогрессивным краснушным панэнцефалитом. Инсулинзависимый сахарный диабет как осложнение СВК обнаруживается поздно [3–6].
Для предотвращения осложнений краснушной инфекции существует живая аттенуированная вакцина против краснухи. Большинство лицензированных вакцин против краснухи основаны на штаммах генотипа 1А, таких как Wistar RA 27/3. Другие вакцинные штаммы краснухи генотипа 1А включают штаммы Matsuura, Takahashi и ТО-336, используемые главным образом в Японии [7]. Штаммы RV группируются в 2 клада и далее делятся на 13 генотипов (клада 1: 1а, 1В, 1С, 1D, 1E, 1F, 1G, 1H, 1I и 1J; клада 2: 2А, 2В и 2С) на основе 739 нуклеотидных последовательностей в гене Е1.
Краснушная вакцина обеспечивает защиту от инфекции RV любого генотипа, за исключением лиц с ослабленным иммунитетом.
Разработана 4-компонентная вакцина на основе отечественных штаммов вирусов кори, эпидемического паротита и ветряной оспы и зарубежного штамма RV Wistar RA 27/3 [8]. Однако более актуальным, эффективным и предпочтительным вакцинным штаммом RV для России считается вирусный штамм краснухи, циркулирующий на её территории. Кроме того, известно, что зарубежный штамм RV Wistar RA 27/3, на основе которого изготавливается краснушная вакцина, обладает побочным эффектом, заключающимся в поражении суставов. Этот эффект может встречаться у 70% привитых женщин после полового созревания. Симптомы могут варьировать по степени тяжести от преходящей скованности суставов до артрита с болью, отёком и ограничением движения [9].
Целью исследования являлось изучение биологических свойств созданного отечественного холодоадаптированного (ха) вакцинного штамма RV vRub-Ant, циркулирующего на территории России.
Материалы и методы
При выполнении работы были использованы культуральные, вирусологические, иммунохимические и серологические методы исследования.
Культура клеток
Штамм диплоидных клеток лёгких эмбриона человека (ЛЭЧ-3) — основной клеточный субстрат для размножения и накопления штаммов RV. Для приготовления антигена RV для серологических реакций использовали Vero CCL-81 и Vero ЕCC — перевиваемые клеточные линии почки зелёных мартышек американской и европейской коллекций клеточных культур соответственно, для приготовления антигена RV для серологических реакций — мезенхимальные стволовые клетки костного мозга человека поздних пассажей и мононуклеарные клетки периферической крови человека (МКПК).
Питательные среды
Культуры клеток выращивали в ростовой питательной среде DМЕМ/F12 с 5% эмбриональной телячьей сывороткой (ЭТС), 2 мМ глутамина, 10 мМ НЕРЕS, 40 мкг/мл гентамицина. Поддерживающей средой для репродукции вируса была среда DМЕМ с повышенным содержанием глюкозы и 40 мкг/мл гентамицина.
Моноклональные антиидиотипические антитела с подобными α/β- и γ-интерферону (ИФН) человека свойствами получали из мышиных лимфоцитарных гибридом.
Вирусы
Клинический материал для выделения вируса получен в 2008 г. во время эпидемической вспышки краснушной инфекции в г. Ивантеевке Московской области от здорового мальчика 7 лет, заболевшего краснухой. Законные представители ребёнка дали информированное добровольное согласие на участие в научных исследованиях. Клинический образец хранили в транспортной среде при –70°С до марта 2020 г. в виде мазков из зева, правой и левой ноздрей. Клинические образцы раздельно перенесли на монослой штамма диплоидных клеток ЛЭЧ-3 и культивировали в инкубаторе при 30°С и 5% СО2. На 4-е сутки культивирования на монослое клеток ЛЭЧ-3 все 3 изолята вызвали цитопатическое действие в виде цитолиза клеток. Аттенуацию клинического изолята проводили в течение 20 пассажей на штамме диплоидных клеток ЛЭЧ-3, выращенных в культуральных флаконах с ростовой поверхностью 175 см2. Пассирование клинического изолята продолжали при 30°С. Интервалы между пассажами составляли 7–9 сут.
В качестве референс-штамма RV использовали вакцинный штамм Wistar RA 27/3 RV, выделенный в 1965 г. S.A. Plotkin в США от ребёнка с СВК [10].
Оценка вирулентности вирусов
МКПК выделяли из венозной гепаринизированной (20 ЕД/мл) крови человека 0 группы, резус плюс, в градиенте плотности фиколла 1,077 г/см3 («PanEco») при центрифугировании в течение 25 мин при 1500 об/мин. Клеточную фракцию дважды промывали холодным фосфатно-буферным раствором (ФБР), осадок клеток ресуспендировали в питательной среде DМЕМ/F12 с 2% ЭТС с таким расчётом, чтобы в 1 мл было не менее 1 млн клеток. Лимфоциты по 1 мл распределяли в лунки 12-луночных планшет. В лунки планшет с лимфоцитами вносили по 0,1 мл вируссодержащей жидкости разных пассажных уровней (3-й и 20-й пассажи) штаммов Rub-Ant. В определённые интервалы из лунок планшет извлекали по 20 мкл суспензии лимфоцитов и наносили равномерно на предметные стекла с окнами, образцы клеток высушивали при комнатной температуре в течение ночи. Образцы фиксировали дважды фильтрованным 3% параформальдегидом с 0,2% бычьим сывороточным альбумином в течение 1 ч при комнатной температуре. Фиксатор дважды промывали ФБР, образцы слегка подсушивали и проводили блокировку 10% нормальной козлиной сывороткой в течение 1 ч. Затем на образцы наносили мышиные асцитические жидкости, содержащие моноклональные антиидиотипические антитела с «внутренним образом» α/β- и γ-ИФН, т.е. антирецепторные антитела для ИФН. После 1 ч контакта образцов с антителами во влажной камере при 37°С предметные стекла с образцами дважды промывали ФБР, слегка подсушивали и на окна с образцами наносили анти-мышиный ФИТЦ-конъюгат («Bio-Rad») в рабочем разведении на 1 ч во влажной камере при 37°С. По завершении контакта с ФИТЦ-конъюгатом предметные стекла промывали в ФБР и подсушивали.
Экспрессию α- и γ-ИФН-Р на МКПК оценивали под люминесцентным микроскопом «Optica» при увеличении 1000 по процентному соотношению светящихся лимфоцитов на 200 анализируемых клеток.
Иммуноферментный анализ
В качестве антигенов для твёрдой фазы на 96-луночные планшеты сорбировали лизаты мезенхимальных стволовых клеток, инфицированных вакцинным штаммом RV Wistar RA 27/3 или концентраты вируссодержащей жидкости с клеток Vero-CCL-81, инфицированных вакцинным холодоактивированным (ха) штаммом vRub-Ant RV на 20-м пассажном уровне. Остальные этапы иммуноферментного анализа (ИФА) проводили общепринятым методом. Концентрацию вируссодержащей жидкости проводили на ультрацентрифуге ротор SW32 Ti при 25 или 26 тыс об/мин (75,0–87,5 тыс. G) в течение 6 ч.
Иммунизация морских свинок
Морским свинкам массой 300–400 г вводили подкожно в холку по 0,5 мл одну прививочную дозу вакцинных штаммов vRub-Ant и Wistar RA 27/3. Через 2 мес после иммунизации делали кардиальную пункцию. Полученные иммунные сыворотки были обработаны препаратом RDE 2 («Seiken») для удаления термолабильных и термостабильных ингибиторов для постановки реакции нейтрализации на клеточной культуре и ИФА.
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с «Consensus Author Guidelines for Animal Use» (IAVES, 23.07.2010). Протокол исследования одобрен Этическим комитетом НИИВС им. И.И. Мечникова (протокол № 6 от 07.06.2021).
Постановка перекрёстной реакции нейтрализации
Реакция нейтрализации поставлена на клеточной культуре Vero-ЕCC, выращенной на 24-луночных планшетах («Costar») в ростовой питательной среде. Приготовлены двукратные разведения иммунных вирусспецифических сывороток морских свинок к вакцинным штаммам vRub-Ant и Wistar RA 27/3, а также разведения моноклональных антител (МКА) к штамму Chendehill-C 74 [11] RV. В каждое разведение иммунных сывороток и МКА-С-74 в объёме 0,1 или 0,2 мл вносили равный объём 1000 доз RV, смесь вортексировали и оставляли на контакт на 1,5 ч при 36,5°С в инкубаторе с 5% СО2, периодически вортексируя каждые 15 мин. В 24-луночные планшеты с выросшими клетками и с предварительно удалённой ростовой средой вносили в каждые 2 лунки по 0,1 мл разведений смеси вируса и сыворотки и вируса с МКА и оставляли на контакт на 1,5 ч в инкубаторе. После завершения контакта в лунки вносили по 0,9 или 0,8 мл поддерживающей среды. На планшете в 2 лунках ставили контроль дозы вируса и контроль клеток, культивирование продолжали в течение 7 сут. Результат реакции нейтрализации учитывали при 100% защите клеток.
Получение мембранного рецептора мозга
Иссекали мозги 5 эмбрионов морских свинок, определяли вес, ткань мозга промывали ФБР от крови, добавляли к мозговой ткани 50 мМ трис-буфера рН 7,6 и гомогенизировали в гомогенизаторе Даунса. Гомогенат центрифугировали при 14 000 об/мин при 4°С в настольной центрифуге. Соотношение мозговой ткани масса : объём составляло 1 : 7. Надосадок декантировали, добавляли в него аналогичный объём буфера, и этот процесс повторяли дважды. Между 2-м и 3-м центрифугированием гомогенат инкубировали при 37°С в течение 10 мин. Конечный осадок ресуспендировали в питательной среде DМЕМ с 2% ЭТС, и влажный мозг хранили при –70°С до использования. Концентрация белка в эксперименте была 40 мг/мл препарата мембранного рецептора мозга (МРМ) эмбрионов морских свинок.
Определение остаточной инфекционной активности
К 100 мл вируссодержащей жидкости дикого варианта RV рRub-Ant (3-й пассаж), вакцинного ха-штамма vRub-Ant (20-й пассаж) RV, референс-штамма RA 27/3 RV и Трис-буфера добавляли по 900 мкл нейрорецепторов мозга морских свинок. Все вышеперечисленные образцы инкубировали при 37°С в течение 30 мин с периодическим встряхиванием каждые 5 мин. Затем все образцы центрифугировали при 14 000 об/мин в течение 15 мин для удаления мембранного материала и связанного с ним вируса. Определяли остаточную вирусную инфекционность образцов в супернатанте путём титрования методом предельных разведений на чувствительных к RV клеточных культурах. Инфекционную активность оценивали по реакции гемадсорбции с 0,25% взвесью эритроцитов морских свинок.
Анализ результатов проводили с использованием статистического пакета «Prism-GfaphPad».
Результаты
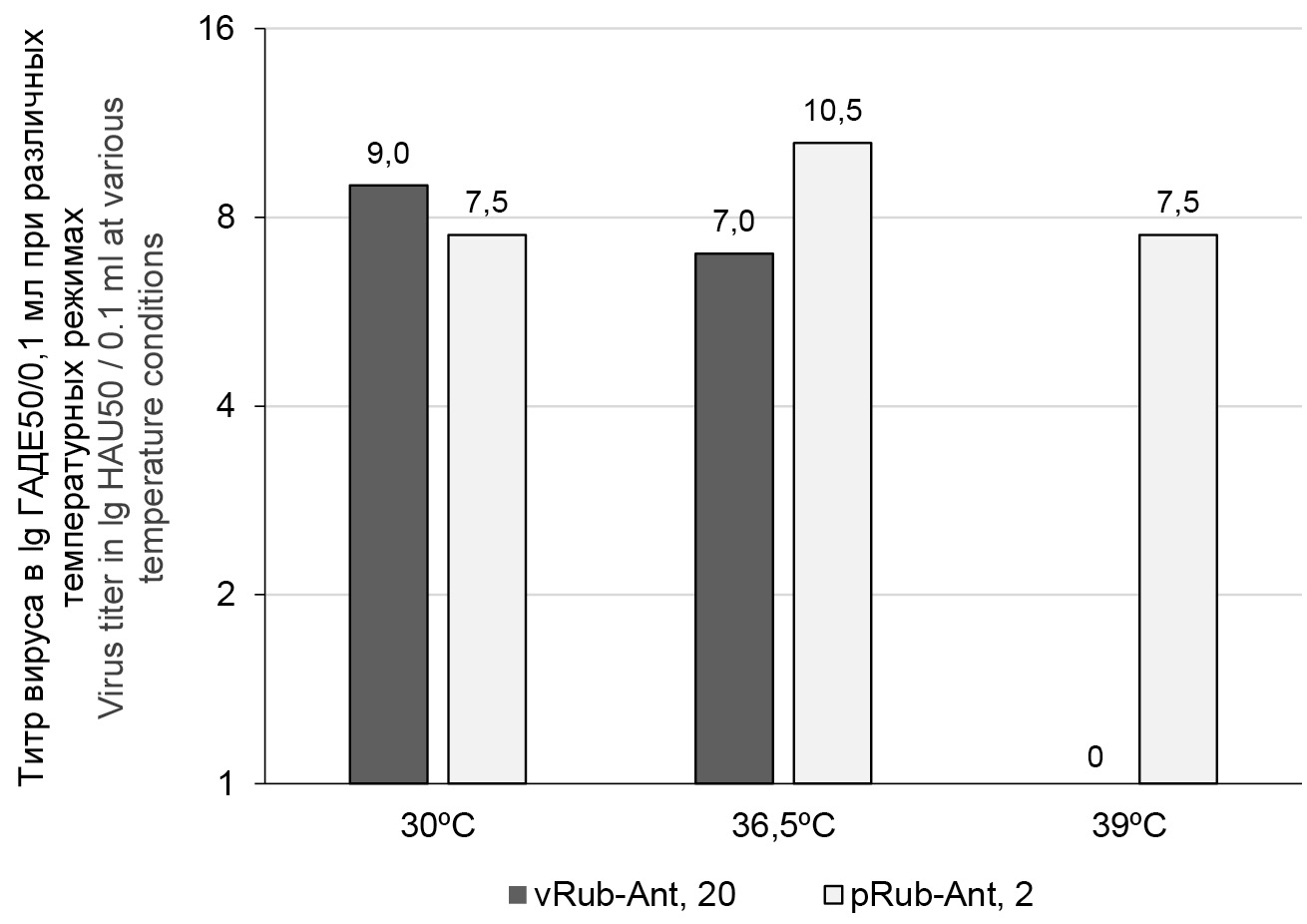
На рис. 1 представлены результаты оценки феноменов температурочувствительности (ts-мутация) и холодоадаптированности (ха-мутация) аттенуированного вирусного штамма vRub-Ant на 20-м пассажном уровне в сравнении с диким родительским вариантом pRub-Ant на 2-м пассажном уровне. Аттенуированный ха-штамм не размножался при высокой температуре, в отличие от родительского дикого варианта, т.е. этот штамм обладает ts-мутацией. Репродуктивная активность аттенуированного вакцинного штамма была на 2 lg выше при 30°С, чем при 36,5°С, что свидетельствует о ха-мутации.
Рис. 1. Оценка маркеров биологической аттенуации (ха- и ts-фенотипы) вакцинного штамма vRub-Ant и дикого варианта RV.
В табл. 1 представлены результаты сравнительной оценки уровней экспрессии α/β- и γ-ИФН-Р на МКПК человека, индуцированных диким вариантом RV рRub-Ant (3-й пассажный уровень) и вакцинный ха-штамм vRub-Ant (20-й пассажный уровень).
Таблица 1. Уровень экспрессии α/β- и γ-ИФН-Р на МКПК человека, индуцированных различными вариантами RV
Table 1. The level of expression of α/β and γ IFN-P on human PBMC induced by various variants of the RV
Временные интервалы, ч Time intervals, hours | Уровень экспрессии α/β- и γ-ИФН-Р, % | Expression level of α/β- and γ-IFN-R, % | |||||
α/β-ИФН-Р | α/β-IFN-R | % снижения α/β-ИФН-Р % decrease of α/β-IFN-P | γ-ИФН -Р | γ-IFN-R | % снижения γ-ИФН-Р % decrease of γ-IFN-P | |||
рRub-Ant, 3-й пассаж 3rd passage | vRub-Ant, 20-й пассаж 20th passage | рRub-Ant, 3-й пассаж 3rd passage | vRub-Ant, 20-й пассаж 20th passage | |||
0 | 0,2 ± 0,01 | 0,3 ± 0,01 | 0 | 0,4 ± 0,02 | 0,5 ± 0,03 | 0 |
3 | 1,6 ± 0,07 | 1,4 ± 0,05 | 12,5 | 1,6 ± 0,07 | 1,2 ± 0,03 | 25 |
6 | 4,0 ± 0,09 | 2,5 ± 0,07 | 37,5 | 5,0 ± 0,04 | 3,0 ± 0,07 | 40 |
21 | 5,9 ± 0,07 | 4,1 ± 0,03 | 30,5 | 6,3 ± 0,06 | 4,1 ± 0,05 | 34,9 |
24 | 5,2 ± 0,05 | 3,25 ± 0,01 | 37,5 | 5,6 ± 0,07 | 3,7 ± 0,04 | 33,9 |
27 | 6,0 ± 0,09 | 3,0 ± 0,05 | 50 | 5,0 ± 0,05 | 2,3 ± 0,06 | 54 |
30 | 4,0 ± 0,03 | 2,3 ± 0,07 | 42,5 | 3,5 ± 0,07 | 2,2 ± 0,03 | 37,1 |
Ранее нами был предложен новый биологический маркер аттенуации кандидатных вирусных штаммов [8]. В эксперименте по сравнительной оценке показателей экспрессии α/β- и γ-ИФН-Р на МКПК человека, индуцированных дикими вариантами RV и их аттенуированными вакцинными ха-штаммами, было чётко продемонстрировано, что дикие варианты родительских вирусов вызывали более высокую экспрессию α/β- и γ-ИФН-Р, чем их аттенуированные вирусные штаммы. Этот признак характеризует вирулентность (att-фенотип) диких вариантов вирусов в отличие от аттенуированных вирусных штаммов.
В табл. 1 показано, что начиная с 3 ч с момента индукции на МКПК диким вариантом рRub-Ant RV и аттенуированным ха-штаммом vRub-Ant снижается уровень экспрессии α/β- и γ-ИФН-Р аттенуированным ха-штаммом vRub-Ant. Максимальное снижение уровня экспрессии α/β- и γ-ИФН-Р аттенуированным вирусным штаммом наблюдается с 24 ч и позже с момента начала индукции.
Для оценки сравнительной иммуногенности аттенуированных штаммов RV поставлена перекрёстная реакция нейтрализации указанных штаммов RV с сыворотками морских свинок, иммунизированных подкожно одной прививочной дозой, смесью 2 МКА к штамму Chendehill (C-74) RV. Высокая иммуногенность отечественного вакцинного ха-штамма vRub-Ant подтверждается высокими титрами иммунных сывороток морской свинки в РН со 100% защитой против 1000 доз RV штаммов vRub-Ant и штамма Wistar RA 27/3, а также МКА к штамму С-74 RV (рис. 2).
Рис. 2. Перекрёстная реакция нейтрализации аттенуированных штаммов RV.
Антигенная активность сравниваемых вакцинных штаммов устанавливалась в ИФА (рис. 3). Оба вакцинных штамма обладают высокой антигенной активностью.
Рис. 3. Значения оптической плотности при длине волны 450 нм (ОП450) специфических сывороток морских свинок на 60-е сутки после иммунизации штаммами vRub-Ant и Wistar RA 27/3 RV.
Специфичность связывания RV с МРМ мозга эмбрионов морских свинок определяли с помощью сравнения вирусов дикого типа и аттенуированных вакцинных вирусных штаммов [12]. При сравнении ха-штамма vRub-Ant вируса краснухи на 20-м пассажном уровне с его диким родительским вариантом на 3-м пассажном уровне выявлено, что дикий вариант связывается с препаратом нейрорецепторов мозга эмбрионов морской свинки с индексом связывания 1,0 lg ГАДЕ50/0,1 мл, процент связывания составляет 10,5, в то время как вакцинный ха-штамм vRub-Ant полностью утратил тропизм к нервной ткани (табл. 2). Такая же картина наблюдается и со сравниваемым зарубежным вакцинным штаммом RV Wistar RA 27/3.
Таблица 2. Сравнительная оценка связывания штаммов вируса краснухи с препаратами МРB эмбрионов морских свинок
Table 2. Comparative evaluation of binding of rubella virus strains with MRM preparations of guinea pig embryos
Вирусный штамм Viral strain | Инфекционность, lg ГАДЕ50/0,1 мл Infectivity, lg НAU50/0,1 ml | p | Индекс связывания, lg ГАДЕ50/0,1 мл The binding index, lg НAU50/0,1 ml | Связывание, % Binding, % | |
RV + буфер RV + buffer (n = 5) | RV + МРМ RV + MRM (n = 5) | ||||
vRub-Ant | 8,5 ± 0,08 | 8,5 ± 0,1 | < 0,001 | 0 | 0 |
pRub-Ant | 9,5 ± 0,1 | 8,5 ± 0,09 | < 0,001 | 1,0 | 10,5 |
Wistar RA 27/3 | 6,5 ± 0,08 | 6,5 ± 0,06 | < 0,001 | 0 | 0 |
Контроль (трис-буфер) Control (Tris buffer) | 0 | 0 | 0 | 0 | |
Обсуждение
В НИИВС им. И.И. Мечникова создана 4-компонентная живая культуральная вакцина vRub-Ant на основе 3 отечественных вакцинных штаммов вируса кори, эпидемического паротита и ветряной оспы [13, 14] и зарубежного вакцинного штамма Wistar RA 27/3 RV. Вакцинный штамм RV получен в СШA S.A. Plotkin от ребёнка с СВК [10].
Целью нашего исследования являлось создать отечественный вакцинный штамм RV, циркулирующий на территории России. Основными биологическими маркерами аттенуации являются температурочувствительность и холодоадаптированность вируса. Вакцинный штамм vRub-Ant обладает ts- и ха-фенотипами.
Как правило, вирулентность вирусов оценивается на животной модели. Однако для RV такой модели для оценки вирулентности вирусного штамма не существует, кроме обезьян.
Ранее нами на мембранах МКПК человека установлено, что уровень экспресии α/β- и γ-ИФН-Р дикого варианта RV выше, чем аттенуированного штамма vRub-Ant, т.е. вирулентность вакцинного штамма значительно ослаблена.
Основным свойством вакцины является её иммуногенность. Вирус-специфические сыворотки морских свинок в реакции нейтрализации с 1000 дозой гомологичных и гетерологичных RV показали высокие титры при 100% защите чувствительной клеточной культуры.
Другим важным свойством вакцинных штаммов является отсутствие нейротропности. Мы сравнили нейротропность вакцинного штамма vRub-Ant и дикого родительского варианта рRub-Ant с использованием МРМ эмбрионов морских свинок и установили, что родительский вариант RV связывается с МРМ эмбрионов морских свинок, а вакцинный ха-штамм утратил эту способность.
Заключение
Создан отечественный вакцинный штамм RV vRub-Ant, обладающий основными биологическими маркерами аттенуации. Вакцинный штамм RV vRub-Ant вызывает высокий уровень нейтрализующих антител в организме морских свинок при однократной иммунизации прививочной дозой. В процессе холодовой адаптации на диплоидных клетках лёгких эмбриона человека показано, что вакцинный штамм RV vRub-Ant утратил тропизм к рецепторам мозга эмбрионов морских свинок в отличие от своего родительского дикого варианта. Детально охарактеризованный отечественный вакцинный штамм vRub-Ant может быть использован при изготовлении краснушной моновакцины и включён в качестве компонента в тривакцину (корь, эпидемический паротит, краснуха) и в тетравакцину (корь, эпидемический паротит, краснуха и ветряная оспа).
About the authors
Firaya G. Nagieva
Mechnikov Research Institute for Vaccines and Sera
Author for correspondence.
Email: fgn42@mail.ru
ORCID iD: 0000-0001-8204-4899
D. Sci. (Med.), Assoc. Prof., Head, Laboratory of hybrid cell cultures, Department of virology
Russian Federation, MoscowElena P. Barkova
Mechnikov Research Institute for Vaccines and Sera
Email: e.barkova2012@yandex.ru
ORCID iD: 0000-0002-3369-8869
PhD (Biol.), leading researcher, Laboratory of hybrid cell cultures, Department of virology
Russian Federation, MoscowAlexandra D. Stroeva
Mechnikov Research Institute for Vaccines and Sera
Email: aleksandra.26@mail.ru
ORCID iD: 0000-0002-4179-931X
junior researcher, Laboratory of hybrid cell cultures, Department of virology
Russian Federation, MoscowYulia I. Ammur
Mechnikov Research Institute for Vaccines and Sera
Email: yulia.ammour@yahoo.fr
ORCID iD: 0000-0003-0223-5738
Cand. Sci. (Biol.), Head, Laboratory of experimental immunology, Department of virology
Russian Federation, MoscowAlexander V. Sidorov
Mechnikov Research Institute for Vaccines and Sera
Email: sashasidorov@googlemail.com
ORCID iD: 0000-0002-3561-8295
Cand. Sci. (Biol.), Head, Laboratory of genetics of DNA-containing viruses, Department of virology
Russian Federation, MoscowOlga S. Kharchenko
Mechnikov Research Institute for Vaccines and Sera
Email: bio139@yandex.ru
ORCID iD: 0000-0002-2169-9610
researcher, Laboratory of DNA viruses, Department of virology
Russian Federation, MoscowGeorgy N. Bukhtoyarov
Mechnikov Research Institute for Vaccines and Sera
Email: Bah.234@mail.ru
ORCID iD: 0000-0987-6885-3210
Cand. Sci. (Biol.), researcher, Laboratory of genetics of DNA-containing viruses, Department of virology
Russian Federation, MoscowOksana A. Svitich
Mechnikov Research Institute for Vaccines and Sera
Email: svitich_o_a@staff.sechenov.ru
ORCID iD: 0000-0003-1757-8389
D. Sci. (Med.), Corresponding Member of the Russian Academy of Sciences, Director
Russian Federation, MoscowVitaly V. Zverev
Mechnikov Research Institute for Vaccines and Sera
Email: vitalyzverev@outlook.com
ORCID iD: 0000-0001-5808-2246
D. Sci. (Biol.), Professor, RAS Full Member, Head, Laboratory of molecular biotechnology
Russian Federation, MoscowReferences
- Gershon A.A. Rubella virus (German Meales). In: Mandell, Douglas, and Bennet´s Principles and Practice. Volume 2. Elsevier; 2015: 1875–80. https://doi.org/10.1016/B978-1-4557-4801-3.00154-5
- Mawson A.R., Croft A.M. Rubella virus infection, the congenital rubella syndrome, and link to autism. Int. J. Environ. Res. Public Health. 2019; 16(19): 3543–71. https://doi.org/10.3390/ijerph16193543
- Banatvala J.E., Brown D.W.G. Rubella. Lancet. 2004; 363(9415): 1127–37. https://doi.org/10.1016/S0140-6736(04)15897-2
- George S.R., Viswanathan R., Sarkal G.N. Molecular aspects of the teratogenesis of rubella virus. Biol. Res. 2019; 52(1): 47. https://doi.org/10.1186/s40659-019-0254-3
- Lambert N., Strebel P., Orenstein W., Icenogle J., Poland G.A. Rubella. Lancet. 2015; 385(9984): 2297–307. https://doi.org/10.1016/S0140-6736(14)60539-0
- Lee J.Y., Bowden D.S. Rubella virus replication and links to teratogenicity. Clin. Microbiol. Rev. 2000; 13(4): 571–87. https://doi.org/10.1128/cmr.13.4.571-587.2000
- Shishido A., Ohtawara V. Development of attenuated rubella virus vaccines in Japan. Jpn J. Med. Sci. Biol. 1976; 29(5): 227–53. https://doi.org/10.7883/yoken 952.29/227
- Nagieva F.G., Barkova E.P., Stroeva A.D., Sidorov A.V., Lotte V.D., Zverev V.V., et al. Characterization of binding of Varicella zoster virus vaccine strains to preparations of mouse brain membrane receptors. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2020; 97(2): 125–33. https://doi.org/10.36233/0372-9311-2020-97-2-125-133 (in Russian)
- Best L.M., Banatvala J.E. Congenital virus infections. BMJ. 1990; 300(6733): 1151–2. https://doi.org/10.1136/bmj.300.6733.1151
- Plotkin S.A. The history of rubella and rubella vaccination leading to elimination. Clin. Infect. Dis. 2006; 43(Suppl. 3): S164–68. https://doi.org/10.1086/505950
- Nagieva F.G., Nikulina V.G., Barkova E.P., Zubkov A.V., Kuz'mina N.S., Desyatkova R.G., et al. Monoclonal antibodies to rubella virus glycoprotein E1. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2011; 88(1): 61–7. (in Russian)
- Barrett F., Ryman K., Ni H. Method of attenuating viruses. Patent US EPO922092B1; 1999.
- Osokina O.V., Barkova E.P., Nagieva F.G., Zverev V.V. The vFiraVax strain for producing an attenuated live culture vaccine for the prevention of chickenpox. Patent RF № 2693440; 2019. (in Russian)
- Zverev V.V., Nagieva F.G., Barkova E.P., Osokina O.V. Method of obtaining a four-component cultured live vaccine against measles, chickenpox, mumps, rubella (NT). Patent RF 2693440; 2019. (in Russian)
- Nagieva F.G., Barkova E.P., Stroeva A.D., Sidorov A.V., Zverev V.V. Characterization of markers of cold-adapted candidate virus strains for live attenuated vaccines against chickenpox and shingles. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2020; 97(4): 303–11. https://doi.org/10.36233/0372-9311-2020-97-4-2 (in Russian)
Supplementary files