Получение и характеристика химерных Bst-подобных полимераз и их применение в изотермической амплификации в сочетании с экспресс-методами выделения РНК на примере вируса эпидемического паротита
- Авторы: Замотаева Т.Л.1, Дедяева Е.А.1, Михеева О.О.1, Пика М.И.1, Черкашин Е.А.1, Черкашина А.С.1, Акимкин В.Г.1
-
Учреждения:
- Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
- Выпуск: Том 102, № 4 (2025)
- Страницы: 391-403
- Раздел: НАУКА И ПРАКТИКА
- URL: https://microbiol.crie.ru/jour/article/view/18909
- DOI: https://doi.org/10.36233/0372-9311-604
- EDN: https://elibrary.ru/TRVYOB
- ID: 18909
Цитировать
Аннотация
Введение. Bst-полимераза играет ключевую роль в экспресс-диагностике инфекционных заболеваний благодаря своим уникальным биохимическим свойствам и возможности применения в петлевой изотермической амплификации (LAMP). В литературе описано несколько аналогов Bst-полимеразы, однако данные ферменты не получили широкого применения в молекулярной диагностике.
Цель работы — получение рекомбинантных Bst- и Btlv-полимераз с Sso7d-доменом и тестирование новых возможностей для их применения.
Материалы и методы. Экспрессионные конструкции, несущие ген полимеразы, получали стандартными методами генетической инженерии. Целевой фермент был наработан в клетках Escherichia coli. Очистку проводили методами металл-аффинной хроматографии с последующим диализом и концентрированием. РНК-зависимую ДНК-полимеразную (ревертазную) и ДНК-полимеразную активности ферментов определяли с помощью нерадиоактивных методик с флуоресцентной детекцией. Функциональные свойства ферментов оценивали в наборе реагентов «АмплиСенс SARS-CoV-2-IT» и в методике, предназначенной для определения в биологическом материале РНК вируса эпидемического паротита в формате LAMP, совмещённой с обратной транскрипцией.
Результаты. В системе экспрессии на основе клеток E. coli получены рекомбинантные химерные ферменты с вытесняющей активностью: Bst_Sso7d, Bst_Sso7d_mut4 и Btlv_Sso7d. Разработанные протоколы культивирования и очистки позволяют получать ферменты в растворимой форме с выходом до 25% от собранной клеточной массы. Функциональное тестирование показало, что в LAMP химерные полимеразы демонстрировали сходную активность с Bst-полимеразой без Sso7d-домена. Вместе с тем полимераза Btlv_Sso7d имела повышенную ревертазную активность и устойчивость к ингибиторам.
Заключение. Полученная химерная полимераза Btlv_Sso7d, благодаря своим улучшенным свойствам, может быть использована в наборах реагентов для диагностики инфекционных заболеваний методом LAMP при использовании методов экспресс-экстракции нуклеиновых кислот.
Полный текст
Введение
Сокращение времени исследования за счёт применения быстрых тестов является одной из ключевых тенденций в лабораторной диагностике. Этот подход особенно актуален для повышения пропускной способности лаборатории в условиях проведения массовых скринингов и позволяет медицинскому персоналу или эпидемиологам осуществлять диагностику в условиях ограниченности ресурсов, что способствует оказанию своевременной помощи пациентам, быстрому выявлению инфицированных лиц, оперативному расследованию инфекционных вспышек и принятию адекватных эпидемиологических мер, а также предотвращает избыточное назначение профилактических и терапевтических средств. Такие быстрые тесты должны соответствовать определённым требованиям — высокой точности и скорости, простоте и доступности, а также обладать высокой стабильностью при хранении и транспортировке [1, 2].
Пандемия коронавируса дала толчок развитию изотермических методов амплификации. Метод петлевой изотермической амплификации (LAMP) [3–5] обладает высокой чувствительностью и специфичностью, важным преимуществом является то, что реакция амплификации проходит при постоянной температуре (без термоциклирования). Это позволяет проводить исследования как в оборудованных клинико-диагностических лабораториях, так и в полевых условиях, где отсутствует специальное лабораторное оборудование. Ключевая роль в дальнейшем развитии наборов реагентов для экспресс-диагностики инфекционных заболеваний методом LAMP принадлежит Bst-полимеразе [6, 7] и её модификациям. Bst-полимераза является большим фрагментом ДНК-полимеразы I (Bst-LF), выделенной из термофильной бактерии Geobacillus stearothermophilus (ранее Bacillus stearothermophilus) [8] и имеющей температурный оптимум 60–70°С. Фермент был выделен J. Stenesh и соавт. в 1972 г. [9], за 4 года до открытия Taq-полимеразы [10, 11]. В дальнейшем как для исследовательских целей, так и в производственных решениях, как правило, стали использоваться рекомбинантные ферменты, в частности Bst-полимераза, клонированная и экспрессированная в клетках бактерий Escherichia coli. Бактериальная система на основе клеток E. coli отличается простотой и невысокой стоимостью культивирования, высокой скоростью роста микроорганизмов, для неё разработан широкий спектр различных векторов для экспрессии рекомбинантных белков. Для Bst-полимеразы и аналогичных полимераз с вытесняющей активностью из других организмов описаны подходы к клонированию и получению рекомбинантных ферментов в бактериальной системе экспрессии на основе клеток E. coli [12–14]. Поскольку на удельную каталитическую активность фермента влияют в том числе особенности нуклеотидной последовательности гена, условия экспрессии, протокол выделения и очистки, все эти этапы требуют оптимизации при получении любого фермента.
Основными подходами к изменению физико-химических характеристик фермента в соответствии с практическими задачами пользователя являются направленный мутагенез и добавление белковых доменов с заданными свойствами [15, 16]. Подобные модификации позволяют повысить выход растворимого фермента при экспрессии в клетках E. coli, упростить процесс очистки, а также получить ферменты с улучшенными свойствами: повышенной активностью и термостабильностью, устойчивостью к солям и ингибиторам. Немодифицированная Bst-полимераза обладает недостаточно высокой процессивностью, поскольку в нативном организме участвует в основном в репарации ДНК [17]. Модифицированный фермент обладает гораздо большей процессивностью, которая обусловлена наличием в клетках вспомогательных белков, повышающих стабильность комплекса полимераза–ДНК. Белок Sso7d относится к семейству ДНК-связывающих белков, выделенных из археи рода Sulfolobus, стабилен в широком диапазоне температуры и рН. Ряд авторов описывают стратегию слияния полимераз с белком Sso7d или подобными белками (Sto7d, SSB, TBD, DBD) для получения химерных ферментов, обладающих повышенной процессивностью, вытесняющей активностью, термостабильностью и толерантностью к ингибиторам, включая мочевину, цельную кровь и NaCl [18–22].
Термофильные бактерии родственных видов могут вырабатывать разные стратегии выживания, что обусловливается в том числе отличиями в свойствах их ферментов. В этой связи потенциально интересными направлениями становятся клонирование и получение рекомбинантных ДНК-полимераз из новых источников, например, из родственного организма и ближайшего гомолога — термофильной бактерии Geobacillus thermoleovorans (ранее Bacillus thermoleovorans) [23, 24].
Целью настоящей работы было получение химерных Bst-подобных полимераз из G. stearothermophilus, а также их сравнение с гомологом — Btlv-полимеразой из G. thermoleovorans для оценки возможности их применения в реакции изотермической амплификации в сочетании с экспресс-методами выделения РНК.
Материалы и методы
Получение генов Bst_Sso7d, Bst_Sso7d_mut4, Btlv_Sso7d
Нуклеотидную последовательность, кодирующую аминокислотную последовательность Btlv-полимеразы из G. thermoleovorans, получали методом сборки из длинных перекрывающихся праймеров — «методом лесенки» [25]. На концах нуклеотидной последовательности были введены сайты рестрикции: Ndel — на 5'-конце и XhoI — на 3'-конце для последующего переклонирования в экспрессионный вектор рЕТ16b+. В результате был получен экспрессионный вектор pET16-Btlv-Nhis. Правильность нуклеотидной последовательности клонированного гена подтверждали методом секвенирования.
В качестве источников генов Bst и Bst_mut4 использовали плазмиды, полученные ранее в лаборатории: рЕТ16_Bst и рЕТ16_Bst_NHis_m4 соответственно [7, 26]. Матрицей для амплификации гена Sso7d также служила ранее полученная конструкция pPSS, содержащая ген Sso7d дикого типа.
Для получения генов химерных ферментов проводили амплификацию гена целевого фермента и гена ДНК-связывающего домена Sso7d. Полученные ампликоны были выделены и очищены из геля и лигированы между собой с использованием фланкирующих праймеров (табл. 1).
Таблица 1. Последовательности праймеров, использованные для клонирования генов
Матрица | Имя | Последовательность 5’-3’ | ПЦР2 |
Bst_Sso7d | |||
рЕТ16_Bst | BstF | gaaaggaggaggagctctaacatctgcggaaggcgaaaaaccg | |
BstR | agtctcgagttatttcgcatcataccagg | ˅ | |
pPSS | SsoF | tcgtcatatggcgaccgtgaagttcaagtataaag | ˅ |
SsoR | agatgttagagctcctcctcctttcttctgtttttccag | ||
Bst_Sso7d_mut4 | |||
рЕТ16_Bst_NHis_m4 | BstF | gaaaggaggaggagctctaacatctgcggaaggcgaaaaaccg | |
BstR | agtctcgagttatttcgcatcataccagg | ˅ | |
pPSS | SsoF | tcgtcatatggcgaccgtgaagttcaagtataaag | ˅ |
SsoR | agatgttagagctcctcctcctttcttctgtttttccag | ||
Btlv_Sso7d | |||
pET16-Btlv-Nhis | BtlvF | gaaaggaggaggagctctaacatctccgtcttctgaggaagaaaagcc | |
BtlvR | aagtctcgagttatttcgcatcataccaagtagaaccgtagtg | ˅ | |
pPSS | SsoF | tcgtcatatggcgaccgtgaagttcaagtataaag | ˅ |
SsoR | agatgttagagctcctcctcctttcttctgtttttccag | ||
Для получения выступающих А-концов очищенный ампликон инкубировали 30 мин при 72°С в присутствии Taq-полимеразы и смеси дезоксинуклеотидов dNTPs. Целевой продукт затем был клонирован в вектор pGEM-T («Promega»). Наличие целевой последовательности и её корректность подтверждали с помощью секвенирования методом Сэнгера.
Получение экспрессионных плазмидных векторов, содержащих гены Bst_Sso7d, Bst_Sso7d_mut4, Btlv_Sso7d
Плазмидную ДНК, содержащую ген химерного фермента, обрабатывали эндонуклеазами рестрикции NdeI и XhoI и полученный продукт рестрикции клонировали в плазмидный вектор pET16b+, предварительно обработанный теми же эндонуклеазами рестрикции. В результате были получены экспрессионные векторы, содержащие гены, которые кодируют следующие гибридные белки: Bst_Sso7d с молекулярной массой 75 кДа, Bst_Sso7d_mut4 с молекулярной массой 75,2 кДа и Btlv_Sso7d с молекулярной массой 75 кДа. Правильность нуклеотидной последовательности клонированных генов была подтверждена секвенированием.
Подбор штаммов E. coli для экспрессии генов Bst_Sso7d, Bst_Sso7d_mut4 и Btlv_Sso7d
В качестве штаммов-носителей для созданных экспрессионных векторов pET16-Bst_Sso7d, pET16-Bst_Sso7d_mut4 и pET16-Btlv_Sso7d использовали штаммы E. coli ER2566, BL21de3 pLys и Rosetta De3. Трансформированные клетки высевали на среду LB (1% бакто-триптон, 0,5% дрожжевой экстракт, 1% NaCl) с агаром, содержащим 100 мкг/мл ампициллина для клеток ER2566 и 20 мкг/мл хлорамфеникола для клеток BL21 (DE3) pLys и Rosetta (DE3), и выращивали в течение 16 ч при 37°С для получения отдельных колоний. Затем 7–8 колоний переносили в 100 мл среды LB с 100 мкг/мл ампициллина и выращивали 18 ч при 37°С на шейкере при перемешивании со скоростью 180 об/мин для получения ночной культуры. Полученные ночные культуры штаммов-продуцентов E. coli переносили в среду LB с 100 мкг/мл ампициллина в культуральных колбах Эрленмейера (процент засева составлял 2%) и выращивали при 37°С при перемешивании со скоростью 160 об/мин. При достижении оптической плотности культуры бактерий 0,8 опт. ед. вносили изопропил-β-D1-тиогалактопиранозид до концентрации 0,4 мМ и выращивали при 23°С и 37°С в течение 4 и 24 ч. Оптическую плотность измеряли спектрофотометрически при длине волны 595 нм. Клеточную биомассу получали центрифугированием в течение 20 мин при 4°С и 4000 об/мин на центрифуге «Avanti JXN-30» («Beckman Coulter»).
Выделение Bst_Sso7d, Bst_Sso7d_mut4 и Btlv_Sso7d
Клеточную биомассу (2 г) штаммов-продуцентов E. coli BL21 (DE3)pLys/pET16-Bst_Sso7d, BL21 (DE3)pLys/pET16-Bst_Sso7d_mut4 и BL21 (DE3)pLys/pET16-Btlv_Sso7d ресуспендировали в буферном растворе 50 мМ Трис-HCl, 100 мМ NaCl, pH 8,5 с 1 мМ PMSF в соотношении 1 : 10 (w/v) и разрушали с помощью ультразвукового дезинтегратора «Branson sonifier 250» («Branson Ultrasonics») в течение 20 мин при 4°С (цикл — 0,5 с, амплитуда — 50%). Затем центрифугировали при 8000 об/мин в течение 30 мин на центрифуге «Allegra X-30R» («Beckman Coulter»). После центрифугирования супернатант разбавляли в 2 раза буферным раствором 50 мМ Трис-HCl, 100 мМ NaCl pH 8,5 и наносили на хроматографический сорбент IMAC FF, предварительно уравновешенный буферным раствором 50 мМ Трис-HCl, 100 мМ NaCl pH 8,5 (буферный раствор А). Очистку от балластных белков проводили буферным раствором А. Целевой белок элюировали линейным градиентом буферного раствора А с 500 мМ имидазолом.
После металл-хелатной хроматографии фракции, содержащие целевой белок, диализовали против буферного раствора 20 мМ Трис, 100 мМ NaCl, 0,5% Tween-20, 0,1 мМ ЭДТА, pH 8,3. После проведения диализа к раствору белка добавляли глицерин до 50%.
Определение активности ферментов
РНК-зависимую ДНК-полимеразную (ревертазную) активность ферментов определяли с помощью нерадиоактивной методики с флуоресцентной детекцией, основанной на образовании дуплекса полиадениловой РНК и олигонуклеотидного праймера dT18, в который встраивался интеркалирующий краситель GelStar («Lonza»). ДНК-полимеразную активность ферментов определяли с помощью нерадиоактивной методики [27]. В качестве матрицы использовали олигонуклеотид, содержащий на 3’-конце шпилечную структуру. В присутствии ионов Mg2+ полимеразы катализировали включение дезоксинуклеотидов, тем самым удлиняя матрицу. Описанные нерадиоактивные методики позволяют определять активности ферментов с помощью амплификаторов с оптическим модулем для детекции флуоресценции в режиме реального времени.
Устойчивость ферментов к температурному воздействию оценивали с помощью дифференциальной сканирующей флуориметрии в диапазоне 55–85°С по 1°С на шаг, продолжительность шага составляла 50 с, кривые плавления детектировались по каналу Fam на приборе «CFX 96» («Bio-Rad Laboratories»).
Оптимальные концентрации ионов в реакционной смеси подбирали аналогично анализу полимеразной активности с использованием концентраций KCl в диапазоне 50–500 мМ.
Аналитические методы
Концентрацию белка определяли с помощью набора «QuDye Protein» (ООО «Люмипроб РУС») на флуориметре «Qubit 4» («Thermo Scientific»), чистоту белка — с помощью ДСН-ПААГ-электрофореза в денатурирующих условиях [28]. При проведении ДСН-ПААГ-электрофореза в денатурирующих условиях использовали маркер длин белков — маркер молекулярных масс («ThermoScientific»).
Петлевая изотермическая амплификация, совмещённая с обратной транскрипцией
Для оценки потенциальной возможности использования полученных химерных ферментов в составе новых наборов реагентов для диагностики инфекционных заболеваний, проводили тестирование на наборе реагентов «АмплиСенс SARS-CoV-2-IT» (РУ № РЗН 2021/14599). В качестве образцов использовали генетическую конструкцию, представляющую собой бактериофаг MS2 со специфической вставкой гена ORF1ab коронавируса. Реакционные смеси содержали 0,8 мкл тестируемых ферментов в концентрации 0,288 ЕД/мкл или такое же количество Bst-полимеразы без Sso7d-домена, а также ревертазу (MMLv). Каждый образец амплифицировали в 3 повторах на приборе «Rotor-Gene Q» («Qiagen»).
Функциональные свойства ферментов также тестировали в лабораторной методике, предназначенной для определения в биологическом материале РНК вируса эпидемического паротита в формате LAMP с совмещённой обратной транскрипцией. Амплифицировали фрагмент гена фосфопротеина вируса эпидемического паротита (размер ампликона 225 пар оснований, GC-состав 54%). В качестве образцов использовали мочу и мазки со слизистой оболочки ротоглотки, содержание РНК вируса эпидемического паротита (Mumps virus) подтверждали секвенированием по методу Сэнгера с помощью набора «BigDye Terminator v. 1.1 Cycle Sequencing Kit» («Thermo Fisher Scientific») на секвенаторе «3500xL Genetic Analyzer» («Thermo Fisher Scientific»).
Экстракцию нуклеиновых кислот проводили с помощью экспресс-комплекта «ЭДЭМ» (РУ № 2010/07828), а также лизирующего раствора, содержащего гуанидин гидрохлорид. В качестве контрольного метода экстракции использовали комплект реагентов «РИБО-преп» (РУ № ФСР 2008/03147). Реакционные смеси содержали олигонуклеотиды, комплементарные участкам амплифицируемых мишеней, а также интеркалирующий краситель, что позволило регистрировать накопление специфического продукта амплификации путём измерения интенсивности флуоресцентного сигнала в режиме «реального времени»; а также смесь глицерина с тиоглицеролом, солями и поверхностно-активными веществами (все использованные дополнительные реагенты разработаны и производятся в ЦНИИ Эпидемиологии Роспотребнадзора). В качестве контрольного лота использовали немутированную форму Bst-полимеразы без Sso7d-домена в концентрации по белку, равной концентрации тестируемых ферментов. Реакцию проводили по программе: 37°С — 5 мин, 65°С — 30 с, 40 циклов с детекцией по каналу FAM (общая продолжительность 25 мин).
Оценка устойчивости ферментов к ингибиторам LAMP
Для оценки устойчивости ферментов к ингибиторам LAMP использовали муцин («Sigma-Aldrich»), а также предварительно охарактеризованные остаточные образцы биологического материала человека (моча, мазки со слизистой оболочки ротоглотки, плазма и цельная кровь). Мазки со слизистой оболочки ротоглотки содержались в транспортной среде для хранения и транспортировки респираторных мазков (РУ № ФСР 2009/05011; ЦНИИ Эпидемиологии Роспотребнадзора).
Ингибиторы добавляли в реакционную смесь для LAMP. Реакцию проводили по программе: 37°С — 5 мин, 65°С — 30 с, 40 циклов с детекцией по каналу FAM (общая продолжительность 25 мин). Результаты оценивали по наличию/отсутствию флуоресцентного сигнала (обнаружено/не обнаружено) и величине значений пороговых циклов (Ct), что является достаточным для диагностических систем с качественным определением.
Результаты
Семейство Sso7d включает в себя небольшие многочисленные неспецифические ДНК-связывающие белки, впервые обнаруженные в гипертермофильной бактерии Archaea sulfolobus. Они имеют массу 7–10 кДа и обладают различными видами функциональной активности: стабилизация двойной спирали, отжиг ДНК при температуре выше температуры её плавления и предотвращение агрегирования белков. Кроме того, такие белки изменяют конформацию ДНК, вызывая расплетение двойной спирали ДНК [29].
Для получения рекомбинантной Bst-mut4- и Btlv-полимеразы были разработаны уникальные синтетические последовательности с учётом оптимизации частоты встречаемости кодонов для экспрессии в E. coli. Далее к генам Bst- и Btlv-полимеразы был присоединён ген Sso7d, и такие конструкты были клонированы в экспрессионный вектор pET16b+ для прокариотической экспрессии в клетках E. coli. В ходе подбора штаммов-носителей для экспрессии генов Bst_Sso7d, Bst_Sso7d_mut4 и Btlv_Sso7d была исследована динамика накопления ферментов при разных температурах (23 и 37°С) и времени индукции белкового биосинтеза (4 и 24 ч). В результате было показано, что все ферменты эффективно нарабатывались в растворимой форме при 23°С в течение 24 ч в клетках E. coli BL21 (DE3)pLys (табл. 2–4).
Таблица 2. Подбор штаммов-носителей для экспрессии генов Bst-Sso7d
Штамм-носитель E. coli | Условия культивирования | Содержание белка, % | Съём клеточной биомассы, г/л |
ER2566 | 23°С, 4 ч | 10 | 2,1 |
23°С, 24 ч | 15 | 2,3 | |
37°С, 4 ч | 12 | 2,3 | |
37°С, 24 ч | 12 | 2,5 | |
Rosetta De3 | 23°С, 4 ч | 23 | 2,4 |
23°С, 24 ч | 23 | 2,6 | |
37°С, 4 ч | 21 | 2,5 | |
37°С, 24 ч | 24 | 2,9 | |
BL21 De3 pLys | 23°С, 4 ч | 23 | 2,7 |
23°С, 24 ч | 25 | 3,14 | |
37°С, 4 ч | 24 | 2,9 | |
37°С, 24 ч | 21 | 3,2 |
Таблица 3. Подбор штаммов-носителей для экспрессии генов Bst_Sso7d_mut4
Штамм-носитель E. coli | Условия культивирования | Содержание белка, % | Съём клеточной биомассы, г/л |
ER2566 | 23°С, 4 ч | 10 | 2,1 |
23°С, 24 ч | 11 | 2,5 | |
37°С, 4 ч | 14 | 2,5 | |
37°С, 24 ч | 16 | 1,7 | |
Rosetta De3 | 23°С, 4 ч | 19 | 2,2 |
23°С, 24 ч | 21 | 2,4 | |
37°С, 4 ч | 21 | 2,3 | |
37°С, 24 ч | 22 | 2,5 | |
BL21 De3 pLys | 23°С, 4 ч | 21 | 2,1 |
23°С, 24 ч | 23 | 2,6 | |
37°С, 4 ч | 21 | 2,5 | |
37°С, 24 ч | 20 | 2,7 |
Таблица 4. Подбор штаммов-носителей для экспрессии генов Btlv_Sso7d
Штамм-носитель E. coli | Условия культивирования | Содержание белка, % | Съём клеточной биомассы, г/л |
ER2566 | 23°С, 4 ч | 18 | 2,0 |
23°С, 24 ч | 16 | 2,5 | |
37°С, 4 ч | 16 | 2,4 | |
37°С, 24 ч | 14 | 2,8 | |
Rosetta De3 | 23°С, 4 ч | 18 | 2,3 |
23°С, 24 ч | 17 | 2,4 | |
37°С, 4 ч | 19 | 2,5 | |
37°С, 24 ч | 19 | 2,7 | |
BL21 De3 pLys | 23°С, 4 ч | 21 | 2,4 |
23°С, 24 ч | 23 | 2,5 | |
37°С, 4 ч | 23 | 2,5 | |
37°С, 24 ч | 21 | 2,7 |
Для очистки ферментов от клеточных белков использовали металл-аффинную хроматографию в линейном градиенте имидазола (рис. 1).
Рис. 1. Электрофореграмма очистки ферментов Bst_Sso7d (а), Bst_Sso7d_mut4 (б) и Btlv_Sso7d (в).
М — маркер молекулярных масс; 1 — осветлённый клеточный лизат; 2 — проскок с металл-хелатного сорбента; далее — фракции после аффинной хроматографии.
Фракции с чистотой более 90% объединяли и проводили диализ против буферного раствора 20 мМ Трис, 100 мМ NaCl, 0,5% Tвин-20, 0,1 мМ ЭДТА pH 8,3 с последующим концентрированием. По данным электрофоретического анализа чистота фермента составила не менее 90% (рис. 2) с концентрацией не менее 2 мг/мл.
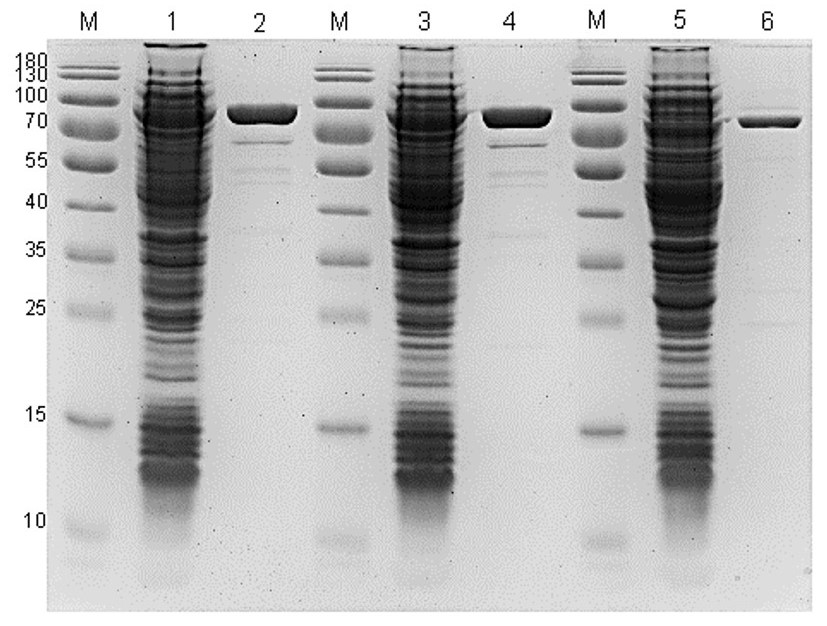
Рис. 2. Электрофореграмма очистки ферментов Bst_Sso7d_mut4, Bst_old_Sso7d и Btlv_Sso7d.
М — маркер молекулярных масс; 1, 3, 5 — осветлённый клеточный лизат Bst_Sso7d_mut4, Bst_Sso7d и Btlv_Sso7d соответственно; 2, 4, 6 — конечный очищенный препарат ферментов Bst_Sso7d_mut4, Bst_Sso7d и Btlv_Sso7d соответственно.
Стоит отметить, что, несмотря на более высокий процент содержания белка от общей массы влажных клеток: в случае экспрессии Bst_Sso7d — 25% против 23% для Bst_Sso7d_mut4 и Btlv_Sso7d, после очистки более высокие выходы демонстрировали последние два фермента. Это связано с тем, что оптимизация состава кодонов кодирующей последовательности приводит к увеличению выхода белка в растворимой форме.
Тестирование полимеразной активности выделенных ферментов Bst_Sso7d, Bst_Sso7d_mut4 и Btlv_Sso7d проводили на образцах РНК бактериофага MS2 со специфической вставкой, содержащей фрагмент генома SARS-CoV-2, методом LAMP с обратной транскрипцией с использованием реагентов, входящих в состав набора «АмплиСенс SARS-CoV-2-IT». Концентрация матрицы составляла 105 копий в реакцию. Все новые ферменты проявляли полимеразную активность, однако средние значения пороговых циклов отличались от контрольного лота Bst-полимеразы без Sso7d-домена в сторону увеличения значений в среднем на 3,73 для Bst_Sso7d, на 3,42 для Bst_Sso7d_mut4 и 2,88 для Btlv_Sso7d (рис. 3), что может свидетельствовать о неоптимальных условиях реакции для новых ферментов.
Рис. 3. Оценка активности полученных полимераз в наборе реагентов «АмплиСенс SARS-CoV-2-IT» (средние значения порогового цикла).
Все исследуемые ферменты показали сопоставимые результаты в экспериментах по оценке их устойчивости к температурному воздействию (рис. 4).
Рис. 4. Термостабильность химерных полимераз.
а — профили термической денатурации; б — производные величины флуоресценции от температуры.
Выделенные ферменты Bst_Sso7d, Bst_mut4_Sso7d и фермент сравнения проявляли слабую РНК-зависимую ДНК-полимеразную (ревертазную) активность как в методике [7], так и при тестировании в наборе «АмплиСенс SARS-CoV-2-IT» без использования фермента ревертазы. Вместе с тем Btlv_Sso7d-полимераза проявляла ревертазную активность, сравнимую с активностью ревертазы (MMLv), но только в присутствии KCl и (NH4)2SO4, что позволяет использовать фермент не только для амплификации ДНК/кДНК, но и для обратной транскрипции РНК. Изменение состава реакционной смеси (главным образом, добавление KCl) позволило добиться увеличения полимеразной активности всех химерных ферментов, оптимальная концентрация KCl в буфере для LAMP составила 200 мМ (рис. 5).
Рис. 5. Оптимальная концентрация KCl для химерных полимераз.
Наборы реагентов на основе LAMP позволяют сократить время амплификации с 1,5–2,5 ч (метод ПЦР) до 25–40 мин, при этом имеют высокую специфичность за счёт использования 4–6 олигонуклеотидов. Однако процесс экстракции нуклеиновых кислот из биологического материала по-прежнему является достаточно длительным. Исследуемые образцы обрабатываются лизирующим раствором, вследствие чего происходит разрушение клеточных стенок бактерий и вирусных оболочек с последующим высвобождением в раствор компонентов клетки и нуклеиновых кислот. Применение в протоколе экстракции последующих отмывок приводит к удалению из раствора веществ и компонентов клетки, которые ингибируют ПЦР. Экспресс-методы отличаются отсутствием этапа отмывки либо наличием всего одной отмывки: клинический материал, взятый в специальную транспортную среду (например, «ТС-ЭДЭМ»), подвергается термической обработке и центрифугированию, в результате чего нерастворимые компоненты осаждаются, а нуклеиновые кислоты, остающиеся в надосадочной жидкости, используются для проведения ПЦР. Однако после обеззараживания без экстракции или после экспресс-экстракции образцы РНК/ДНК содержат примеси, которые могут служить ингибиторами ПЦР, например, компоненты транспортных сред, лизирующего раствора, крови, мазков, мочи и других биоматериалов.
Функциональные свойства полученных в работе полимераз были проверены на устойчивость к наиболее часто встречающимся ингибиторам (компонентам цельной крови, плазмы крови, мочи, муцину) в реакции LAMP в модельной системе с использованием положительных контрольных образцов. Ингибиторы добавляли в реакционную смесь, содержащую праймеры из набора реагентов «АмплиСенс SARS-CoV-2-IT» и выделенную РНК бактериофага MS2 со специфической вставкой, содержащей фрагмент генома SARS-CoV-2. Результаты оценивали по наличию/отсутствию флуоресцентного сигнала («обнаружено»/«не обнаружено»), что является достаточным для диагностических систем с качественным определением (табл. 5).
Таблица 5. Сравнение влияния ингибиторов на обнаружение РНК вируса эпидемического паротита при использовании тестируемых ферментов
Ингибиторы | Обнаружение РНК вируса эпидемического паротита | ||||
название | концентрация | Bst-полимераза (контроль) | Bst_Sso7d | Bst_Sso7d_mut4 | Btlv_Sso7d |
Цельная кровь, об. % | 0 | + | + | + | + |
0,5 | + | + | + | + | |
1,0 | + | + | + | + | |
2,5 | + | – | – | + | |
5,0 | + | – | – | + | |
10,0 | – | – | – | + | |
Плазма крови, об. % | 0 | + | + | + | + |
1 | – | – | – | + | |
Муцин, мг/мл | 0 | + | + | + | + |
0,2 | + | + | + | + | |
0,5 | + | + | + | + | |
Моча, об. % | 0 | + | + | + | + |
5 | + | – | – | + | |
10 | – | – | – | + | |
Модифицированные ферменты на основе Bst-полимеразы, содержащие ДНК-связывающий домен Sso7D: Bst_Sso7d и Bst_Sso7d_mut4, продемонстрировали сниженную устойчивость к присутствию в реакционной смеси цельной крови и мочи по сравнению с контрольным ферментом. В то же время фермент Btlv_Sso7d характеризуется более высокой устойчивостью к присутствию цельной крови (10 об. %), плазмы (1 об. %), мочи (10 об. %). Все ферменты сохраняют свою активность в присутствии муцина до 0,5 мг/мл.
Дальнейшие эксперименты по определению влияния ингибиторов на эффективность реакции LAMP проводились только с использованием фермента Btlv_Sso7d. Устойчивость полимеразы Btlv_Sso7d к ингибиторам из биоматериала (слизь из ротоглоточных мазков, соли из мочи), компонентам транспортной среды (транспортная среда для хранения и транспортировки респираторных мазков (РУ № ФСР 2009/05011)) и лизирующего раствора (1М гуанидина гидрохлорида) была также протестирована на 12 клинических образцах мочи и 12 образцах мазков со слизистой оболочки ротоглотки, содержащих РНК вируса эпидемического паротита в концентрации 105–108 копий/мл, выделенных тремя различными методами: методом, основанным на преципитации с использованием набора «РИБО-преп»; экспресс-методом «ЭДЭМ»; обработкой раствором 1М гуанидина гидрохлорида (для обеззараживания биоматериала) без последующих отмывок. Далее все выделенные образцы сравнивали в методике LAMP без добавления ревертазы (MMLv) (рис. 6).
Рис. 6. Выявление вируса эпидемического паротита в биологических образцах с помощью LAMP с использованием различных полимераз без добавления ревертазы.
При использовании Btlv_Sso7d-полимеразы, в отличие от контрольного фермента, реакция LAMP сохраняет свою эффективность во всех изученных условиях, а все биологические образцы, содержащие РНК вируса эпидемического паротита использованные в работе, идентифицируются как положительные. Наблюдается также не такое значительное повышение значений Ct при анализе образцов после выделения нуклеиновых кислот экспресс-методом «ЭДЭМ», как в случае контрольного фермента. Всё это показывает, что полимераза Btlv_Sso7d обладает достаточной ревертазной активностью и повышенной толерантностью к ингибиторам для качественного обнаружения РНК вируса эпидемического паротита (рис. 6).
За счёт более высокой толерантности к ингибиторам применение новой Btlv_Sso7d-полимеразы в реакциях изотермической амплификации на основе метода LAMP в сочетании с экспресс-методами экстракции нуклеиновых кислот, которые включают только этап лизиса, позволит вывести молекулярную диагностику на новый уровень скорости и сделать возможным применение тестов на основе LAMP в полевых условиях или «у постели больного».
Обсуждение
Метод LAMP является перспективным направлением в молекулярной диагностике инфекционных заболеваний. Основное достоинство метода — это более короткое время анализа: этап амплификации занимает всего 25–40 мин, а чувствительность и специфичность метода при этом сопоставимы с методом ПЦР [1, 2]. Изотермический режим проведения реакции позволяет использовать более простое оборудование для проведения реакции: термостат с модулем детекции флуоресценции вместо амплификатора.
Кроме этапа собственно амплификации, любой анализ чаще всего включает этап выделения нуклеиновых кислот. Выделение нуклеиновых кислот проводится с целью избавления от основных ингибиторов амплификации, которые могут присутствовать в биологических образцах. В среднем, в зависимости от используемого метода, этап выделения может занимать от 1 до 3 ч. Сокращение этой стадии за счёт применения экспресс-методов выделения нуклеиновых кислот (10–30 мин) позволит существенно снизить общее время исследования. Для успешной реализации такой стратегии необходимы разработка и применение ферментов, устойчивых к основным ингибиторам амплификации.
Полученные в работе Bst-полимеразы, содержащие ДНК-связывающий домен Sso7D: Bst_Sso7d и Bst_Sso7d_mut4 продемонстрировали сниженную устойчивость к присутствию в реакционной смеси цельной крови и мочи по сравнению с контрольным ферментом, не содержащим дополнительных доменов. В то же время фермент Btlv_Sso7d характеризуется более высокой устойчивостью к присутствию цельной крови (10 об. %), плазмы (1 об. %), мочи (10 об. %). Все ферменты сохраняют свою активность в присутствии муцина до 0,5 мг/мл. Эти данные демонстрируют, что добавление ДНК-связывающего домена не привело к повышению устойчивости к ингибирующему эффекту мочи и цельной крови в случае Bst-полимеразы. В литературе опубликованы подобные работы, свидетельствующие об обратном эффекте при использовании различных Bst-подобных полимераз [17, 18, 30, 31]. Однако родственный химерный фермент Btlv_Sso7d, полученный в данной работе, демонстрирует высокую устойчивость к ингибирующему эффекту компонентов цельной крови, плазмы и мочи на реакцию LAMP. Такая разница результатов может объясняться особенностями генно-инженерных конструкций, наличием или отсутствием дополнительных спейсеров между ДНК-связывающим доменом и полимеразой, структурой этих спейсеров, условиями культивирования и очистки рекомбинантных белков. Полученные данные демонстрируют необходимость дальнейших детальных исследований в данной области для определения влияния ДНК-связывающих доменов на свойства химерных ферментов в каждом конкретном случае и определения взаимосвязей между структурой и функциями химерных ферментов.
Заключение
В бактериальной системе экспрессии на основе клеток E. coli получены рекомбинантные химерные ферменты с вытесняющей активностью: Bst_Sso7d, Bst_Sso7d_mut4 и Btlv_Sso7d. Разработанные протоколы получения и очистки позволяют получать ферменты в растворимой форме с выходом до 25% от всей собранной клеточной массы. В реакциях LAMP химерные полимеразы продемонстрировали сходную активность с Bst-полимеразой без Sso7d-домена. Вместе с тем Btlv_Sso7d-полимераза характеризуется повышенной ревертазной активностью и устойчивостью к ингибиторам, что позволяет использовать её в наборах реагентов для диагностики инфекционных заболеваний методом LAMP в сочетании с экспресс-экстракцией нуклеиновых кислот путём термоинактивации или лизиса в присутствии гуанидина хлорида без последующих отмывок от компонентов биоматериала и лизирующего раствора. Это позволяет существенно сократить время проведения анализа.
По мере роста потребности в быстрой и точной диагностике инфекционных заболеваний использование методов LAMP, а следовательно, и аналогов Bst-полимеразы с улучшенными свойствами, будет только увеличиваться.
Об авторах
Татьяна Львовна Замотаева
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: sazonova@pcr.ms
ORCID iD: 0009-0003-9799-3749
н. с., Центр разработки, развития продукции и инноваций
Россия, МоскваЕкатерина Александровна Дедяева
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: safronova.e@cmd.su
ORCID iD: 0000-0002-2501-0956
старший технолог-разработчик, Центр разработки, развития продукции и инноваций
Россия, МоскваОльга Олеговна Михеева
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: olga.mikheeva.92@mail.ru
ORCID iD: 0000-0002-1721-5134
н. с., научная группа генной инженерии и биотехнологии отдела молекулярной диагностики и эпидемиологии
Россия, МоскваМария Игоревна Пика
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Автор, ответственный за переписку.
Email: m.zotova@cmd.su
ORCID iD: 0000-0002-3279-6811
м. н. с., научная группа генной инженерии и биотехнологии отдела молекулярной диагностики и эпидемиологии
Россия, МоскваЕвгений Александрович Черкашин
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: e.cherkashin@pcr.ms
ORCID iD: 0000-0002-3627-6047
канд. хим. наук, рук. Центра разработки, развития продукции и инноваций
Россия, МоскваАнна Сергеевна Черкашина
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: cherkashina@pcr.ms
ORCID iD: 0000-0001-7970-7495
канд. хим. наук, рук. научной группы генной инженерии и биотехнологии отдела молекулярной диагностики и эпидемиологии
Россия, МоскваВасилий Геннадьевич Акимкин
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: v.akimkin@cmd.su
ORCID iD: 0000-0003-4228-9044
д-р мед. наук, проф., академик РАН, директор
Россия, МоскваСписок литературы
- Рубель М.С., Дубровина И.А., Мясников В.А. и др. Сравнительная характеристика современных экспресс-методов диагностики инфекционных заболеваний, основанных на методе изотермической полимеразной цепной реакции. Вестник Российской Военно-медицинской академии. 2018;(1):160–3. Rubel M.S., Dubrovina I.A., Miasnikov V.A., et al. Comparative characteristics of modern express methods of diagnosing infectious diseases base on isothermal PCR technology. Bulletin of the Russian Military Medical Academy. 2018;(1):160–3. EDN: https://elibrary.ru/emrzyi
- Чемисова О.С., Цырулина О.А., Трухачев А.Л., Носков А.К. Сравнительный анализ методов изотермической амплификации нуклеиновых кислот. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(1):126–38. Chemisova O.S., Tsyrulina O.A., Trukhachev A.L., Noskov A.K. Comparative analysis of methods for isothermal amplification of nucleic acids. Journal Of Microbiology, Epidemiology and Immunobiology. 2022;99(1):126–38. DOI: https://doi.org/10.36233/0372-9311-176 EDN: https://elibrary.ru/qbqrwj
- Notomi T., Okayama H., Masubuchi H., et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Res. 2000;28(12):E63. DOI: https://doi.org/10.1093/nar/28.12.e63
- Смирнова Д.И., Петруша О.А., Грачёва А.В. и др. Быстрая диагностика генитального герпеса методом петлевой изотермической амплификации ДНК с флуоресцентной детекцией. Журнал микробиологии, эпидемиологии и иммунобиологии. 2019;96(6):40–6. Smirnova D.I., Petrusha O.A., Gracheva A.V., et al. Rapid diagnostics of genital herpes by loop-mediated isothermal amplification method with fluorescent detection. Journal of Microbiology, Epidemiology and Immunobiology. 2019;96(6):40–6. DOI: https://doi.org/10.36233/0372-9311-2019-6-40-46 EDN: https://elibrary.ru/yskkec
- Акимкин В.Г., Петров В.В., Красовитов К.В. и др. Молекулярные методы диагностики новой коронавирусной инфекции: сравнение петлевой изотермической амплификации и полимеразной цепной реакции. Вопросы вирусологии. 2021; 66(6):417–24. Akimkin V.G., Petrov V.V., Krasovitov K.V., et al. Molecular methods for diagnosing novel coronavirus infection: comparison of loop-mediated isothermal amplification and polymerase chain reaction. Problems of Virology. 2022;66(6): 417–24. DOI: https://doi.org/10.36233/0507-4088-86 EDN: https://elibrary.ru/bsgdlo
- Shirshikov F.V., Bespyatykh J.A. Loop-mediated isothermal amplification: from theory to practice. Russ. J. Bioorg. Chem. 2022;48(6):1159–74. DOI: https://doi.org/10.1134/S106816202206022X
- Пика М.И., Михеева О.О., Соловьева Е.Д. и др. Получение Bst-полимеразы для диагностики различных инфекций методом петлевой изотермической амплификации. Журнал микробиологии, эпидемиологии и иммунобиологии. 2023;100(3):210–8. Pika M.I., Mikheeva O.O., Solovyova E.D., et al. Production of Bst polymerase for diagnosis of different infections using loop-mediated isothermal amplification. Journal of Microbiology, Epidemiology and Immunobiology. 2023;100(3):210–8. DOI: https://doi.org/10.36233/0372-9311-364 EDN: https://elibrary.ru/phcmoq
- Wada K., Suzuki H. Biotechnological platforms of the moderate thermophiles, Geobacillus species: notable properties and genetic tools. In: Salwan R., Sharma V., eds. Physiological and Biotechnological Aspects of Extremophiles. Academic Press; 2020:195–218. DOI: https://doi.org/10.1016/C2018-0-03860-8
- Stenesh J., McGowan G.R. DNA polymerase from mesophilic and thermophilic bacteria. III. Lack of fidelity in the replication of synthetic polydeoxyribonucleotides by DNA polymerase from Bacillus licheniformis and Bacillus stearothermophilus. Biochim. Biophys. Acta. 1977;475(1):32–41. DOI: https://doi.org/10.1016/0005-2787(77)90336-7
- Chien A., Edgar D.B., Trela J.M. Deoxyribonucleic acid polymerase from the extreme thermophile Thermus aquaticus. J. Bacteriol. 1976;127(3):1550–7. DOI: https://doi.org/10.1128/jb.127.3.1550-1557.1976
- Oscorbin I., Filipenko M. Bst polymerase – a humble relative of Taq polymerase. Comput. Struct. Biotechnol. J. 2023;21:4519–35. DOI: https://doi.org/10.1016/j.csbj.2023.09.008
- Li P., Amenov A., Kalendar R., et al. Cloning and purification of large fragment of DNA polymerase I from geobacillus stearothermophilus and application in isothermal DNA amplification. Eurasian J. Appl. Biotechnol. 2017;(1):50–8. EDN: https://elibrary.ru/zbenmt
- Oscorbin I.P., Boyarskikh U.A., Filipenko M.L. Large fragment of DNA polymerase I from Geobacillus sp. 777: сloning and comparison with DNA polymerases I in practical applications. Mol. Biotechnol. 2015;57(10):947–59. DOI: https://doi.org/10.1007/s12033-015-9886-x
- Chander Y., Koelbl J., Puckett J., et al. A novel thermostable polymerase for RNA and DNA loop-mediated isothermal amplification (LAMP). Front. Microbiol. 2014;5:395. DOI: https://doi.org/10.3389/fmicb.2014.00395
- Wang Y., Prosen D.E., Mei L., et al. A novel strategy to engineer DNA polymerases for enhanced processivity and improved performance in vitro. Nucleic Acids Res. 2004;32(3):1197–207. DOI: https://doi.org/10.1093/nar/gkh271
- Sidstedt M., Rådström P., Hedman J. PCR inhibition in qPCR, dPCR and MPS-mechanisms and solutions. Anal. Bioanal. Chem. 2020;412(9):2009–23. DOI: https://doi.org/10.1007/s00216-020-02490-2
- Oscorbin I.P., Belousova E.A., Boyarskikh U.A., et al. Derivatives of Bst-like Gss-polymerase with improved processivity and inhibitor tolerance. Nucleic Acids Res. 2017;45(16):9595–610. DOI: https://doi.org/10.1093/nar/gkx645
- Li J., Li Y., Li Y., et al. An enhanced activity and thermostability of chimeric Bst DNA polymerase for isothermal amplification applications. Appl. Microbiol. Biotechnol. 2023;107(21):6527–40. DOI: https://doi.org/10.1007/s00253-023-12751-6
- Yu Z., Wang J. Strategies and procedures to generate chimeric DNA polymerases for improved applications. Appl. Microbiol. Biotechnol. 2024;108(1):445. DOI: https://doi.org/10.1007/s00253-024-13276-2
- Paik I., Bhadra S., Ellington A.D. Charge engineering improves the performance of Bst DNA polymerase fusions. ACS Synth. Biol. 2022;11(4):1488–96. DOI: https://doi.org/10.1021/acssynbio.1c00559
- Ordóñez C.D., Lechuga A., Salas M., Redrejo-Rodríguez M. Engineered viral DNA polymerase with enhanced DNA amplification capacity: a proof-of-concept of isothermal amplification of damaged DNA. Sci. Rep. 2020;10(1):15046. DOI: https://doi.org/10.1038/s41598-020-71773-6
- Coulther T.A., Stern H.R., Beuning P.J. Engineering polymerases for new functions. Trends Biotechnol. 2019;37(10):1091–103. DOI: https://doi.org/10.1016/j.tibtech.2019.03.011
- Lischer K., Tansil K.P., Ginting M.J., et al. Cloning of DNA Polymerase I Geobacillus thermoleovorans SGAir0734 from a Batu Kuwung Hot Spring in Escherichia coli. Int. J. Technol. 2020;11(5):921–30. DOI: https://doi.org/10.14716/ijtech.v11i5.4311
- Gaultier N.E., Junqueira A.C.M., Uchida A., et al. Genome sequence of Geobacillus thermoleovorans SGAir0734, isolated from Singapore air. Genome Announc. 2018;6(27):e00636–18. DOI: https://doi.org/10.1128/genomea.00636-18
- Xiong A.S., Yao Q.H., Peng R.H., et al. A simple, rapid, high-fidelity and cost-effective PCR-based two-step DNA synthesis method for long gene sequences. Nucleic Acids Res. 2004;32(12):e98. DOI: https://doi.org/10.1093/nar/gnh094
- Черкашина А.С., Михеева О.О., Пика М.И. и др. Способ получения большого фрагмента Bst-полимеразы (варианты). Патент РФ № 2 809 366;2023. Cherkashina A.S., Mikheeva O.O., Pika M.I., et al. Method for obtaining a large fragment of Bst polymerase (variants). Patent RF № 2 809 366;2023.
- Брагин А.Г., Глушков С.А., Иванов М.К. и др. Определение ДНК-полимеразной и нуклеазной активностей ДНК-зависимых полимераз с использованием флуоресцентной детекции в режиме реального времени. Биохимия. 2008;73(9)1252–64. EDN: https://elibrary.ru/jubdgz Bragin A.G., Glushkov S.A., Ivanov M.K., et al. Determination of DNA polymerase and nuclease activities of DNA-dependent polymerases using real-time fluorescent detection. Biochemistry. 2008;73(9):1007–17. DOI: https://doi.org/10.1134/S0006297908090083 EDN: https://elibrary.ru/lliwvl
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227(5259):680–5. DOI: https://doi.org/10.1038/227680a0
- Napoli A., Zivanovic Y., Bocs C., et al. DNA bending, compaction and negative supercoiling by the architectural protein Sso7d of Sulfolobus solfataricus. Nucleic Acids Res. 2002;30(12):2656–62. DOI: https://doi.org/10.1093/nar/gkf377
- Xiang R., Liu G.Y., Hou Y., et al. Double domain fusion improves the reverse transcriptase activity and inhibitor tolerance of Bst DNA polymerase. Int. J. Biol. Macromol. 2024;274(Pt. 1):133243. DOI: https://doi.org/10.1016/j.ijbiomac.2024.133243
- Hernández-Rollán C., Ehrmann A.K., Vlassis A., et al. Neq2X7: a multi-purpose and open-source fusion DNA polymerase for advanced DNA engineering and diagnostics PCR. BMC Biotechnol. 2024;24(1):17. DOI: https://doi.org/10.1186/s12896-024-00844-7
Дополнительные файлы