Современное состояние разработок в области создания вакцин против респираторно-синцитиального вируса
- Авторы: Котомина Т.С.1
-
Учреждения:
- Институт экспериментальной медицины
- Выпуск: Том 102, № 2 (2025)
- Страницы: 239-264
- Раздел: ОБЗОРЫ
- URL: https://microbiol.crie.ru/jour/article/view/18831
- DOI: https://doi.org/10.36233/0372-9311-675
- EDN: https://elibrary.ru/LFGPNA
- ID: 18831
Цитировать
Аннотация
Респираторно-синцитиальный вирус (РСВ) является основной причиной инфекций верхних дыхательных путей у детей и пожилых. В отношении РСВ одобрено единственное специфическое средство лечения — препарат моноклональных антител паливизумаб для пассивной иммунопрофилактики у младенцев из группы высокого риска. Спустя 60 лет с момента обнаружения вируса были лицензированы несколько безопасных вакцинных кандидатов против РСВ. Этому способствовали исследования по выявлению структуры РСВ, изучению основных функций компонентов РСВ, механизмов врождённого и приобретённого иммунного ответов на инфекцию. Был учтён отрицательный опыт клинического испытания формалининактивированной вакцины против РСВ на детях, закончившийся смертью нескольких вакцинированных.
Цель исследования — обобщить данные исследований вакцинных кандидатов против РСВ на лабораторных животных и в клинических испытаниях на различных возрастных группах.
Поиск статей для анализа доклинических и клинических испытаний вакцин против РСВ осуществляли с использованием электронно-поискового ресурса PubMed по ключевым словам «respiratory syncytial virus and vaccine». В качестве критериев отбора указывали, что оригинальные статьи должны содержать сведения о доклинических и клинических исследованиях, причём последние включали в себя I–IV фазы рандомизированных контролируемых испытаний. За 1967–2025 гг. обнаружено 296 статей, обобщающих данные по исследованию вакцинных кандидатов против РСВ, и 1788 статей, в которых суммированы данные об испытаниях вакцинных кандидатов на животных. В обзоре суммированы данные доклинических исследований вакцинных кандидатов с указанием разработчиков, состава вакцинных препаратов, животных моделей, на которых проводились исследования, с кратким описанием основных результатов. Представлены данные о клинических испытаниях вакцинных кандидатов с указанием целевых групп населения, номера клинического исследования и источников, где опубликованы результаты этих исследований.
Полный текст
Введение
Среди тяжёлых острых респираторных заболеваний человека на долю респираторно-синцитиального вируса (РСВ) приходится примерно 22% случаев. При этом количество смертельных исходов ежегодно варьирует в промежутке примерно от 55 000 до 199 000, в том числе 50 000–75 000 среди детей в возрасте до 5 лет [1, 2]. После заболевания РСВ не формируется стойкого иммунитета, из-за чего не обеспечивается устойчивость организма к последующим заражениям [3, 4]. Причины, по которым так происходит, до сих пор не установлены. В 2023 г. компаниями «GlaxoSmithKline» (Великобритания) и «Pfizer» (США) были лицензированы субъединичные вакцины для профилактики инфекции, вызванной РСВ (РСИ), у людей старше 60 лет. Разработчик «Moderna» (США) представил матричную (мРНК) вакцину для профилактики РСИ у пожилых. Многие альтернативные вакцинные кандидаты находятся на разных стадиях клинических испытаний.
Цель обзора — суммировать данные о разработках вакцин против РСВ с использованием различных платформ и методических подходов, результаты их доклинических исследований на различных животных моделях и клинических испытаний на разных возрастных группах.
Общая характеристика респираторно-синцитиального вируса
РСВ принадлежит к порядку Mononegavirales, семейству Pneumoviridae (пневмовирусов), роду Orthopneumovirus. До 2016 г. вирус относили к семейству Paramyxoviridae [5]. Другим представителем семейства пневмовирусов является метапневмовирус человека. Оба пневмовируса занимают лидирующее положение в структуре заболеваемости детей с рождения до года, пожилых людей и лиц с ослабленным иммунитетом [6]. РСИ сопровождается тяжёлыми пневмониями и бронхиолитами. По экспертным оценкам, в 2019 г. в мире по причине РСИ было около 3,6 млн случаев госпитализаций людей и 101 400 смертельных случаев, связанных с РСИ, среди детей в возрасте 0–60 мес [7].
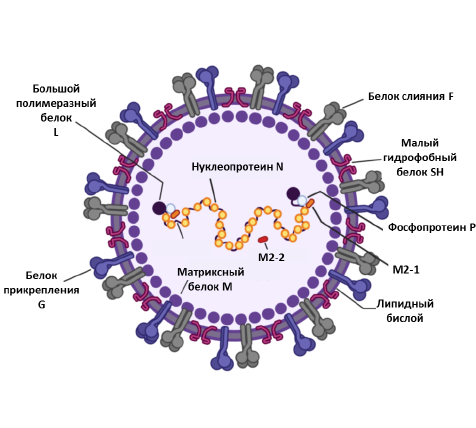
Вирионы РСВ плеоморфны: различают сферические формы с диаметром 100–350 нм и нитевидные длиной до 10 мкм и диаметром 60–200 нм [8, 9]. Генетический материал РСВ представлен одноцепочечной РНК с отрицательной полярностью размером 15,2 т. н. Геном РСВ несегментирован и содержит 10 открытых рамок считывания, кодирующих 9 структурных и 2 неструктурных белка. Ген M2 содержит 2 открытые рамки считывания и кодирует 2 белка: M2-1 и M2-2. Вирусная РНК упакована внутрь нуклеокапсида спирального типа симметрии, представляющего собой рибонуклеопротеиновый комплекс (РНП) (рисунок).
Структура РСВ.
Геном РСВ несегментирован, с отрицательной полярностью размером 15,2 т. н., кодирует 11 вирусных белков. Вирусная оболочка РСВ содержит 3 трансмембранных гликопротеина: белок прикрепления G, белок слияния F и малый гидрофобный белок SH. С внутренней стороны вирусной оболочки расположен матриксный белок M. Вирусная РНК инкапсулирована нуклеопротеином (N) и большим белком (L). Фосфопротеины P и M2-1 опосредуют транскрипцию вирусной РНК. M2-2 регулирует синтез вирусной РНК. Рисунок адаптирован из [16].
Репликация происходит с участием РНК-зависимой РНК-полимеразы, состоящей из большого L-белка и фосфопротеина P (кофактор L). В процессе транскрипции принимают участие P-, L- и M2-1-белки [10, 11]. РСВ относится к оболочечным вирусам, генетический материал которых окружён белковой оболочкой и липидным бислоем, приобретённым от клетки-хозяина в процессе сборки вируса и его отпочковывания. Матриксный белок M располагается между капсидом и внешним липидным бислоем. Во внешний липидный бислой встроены интегральный мембранный белок-слияния F, белок прикрепления G и малый гидрофобный SH белок. Белок F относится к гликопротеинам I класса. Его основная функция — обеспечение проникновения вируса в клетку-мишень. До взаимодействия с клеткой-мишенью белок F находится на поверхности РСВ в конформации «до слияния» (pre-F) и приобретает конформацию «после слияния» (post-F) вследствие слияния вирусной и клеточной мембран [12].
Белок M2-2 участвует в процессах репликации и транскрипции [13]. Белки NS1 и NS2 не входят в состав вириона, их основная роль заключается в том, что они выступают в качестве антагонистов α-/β-интерферонов, которые вырабатываются организмом человека в ответ на вирусную инфекцию [14, 15].
Прототипы вакцин против РСВ
Впервые РСВ был обнаружен в 1956 г. [17], и уже более 60 лет ведутся работы по созданию вакцины против РСИ. Успешный опыт по созданию формалин-инактивированных вакцин против полиомиелита, кори и парагриппа был применён и для создания первых вакцин против РСВ, однако попытки оказались неудачными и требовались новые подходы к этой проблеме.
Большинство вакцин против РСВ разрабатываются на основе одного из самых консервативных белков РСВ — F, поскольку именно этот поверхностный белок является антигенной мишенью для вируснейтрализующих антител [18]. Получили развитие подходы, в которых F-белок стабилизирован в форме pre-F либо в форме post-F [19, 20]. Однако чаще разработчики выбирают pre-F, поскольку вируснейтрализующие антитела индуцируются в большем количестве именно к этой форме F-белка в условиях естественной инфекции или иммунизации [21].
История создания вакцин против РСВ
В 1950-х гг. одним из успешных приёмов было признано получение вакцин путём инактивации вируса формалином [22]. В США в 1960-х гг. были проведены сначала пилотные испытания формалин-инактивированной вакцины против РСВ (ФИ-РСВ) на младенцах, а затем крупномасштабные клинические испытания этой вакцины в группе детей разных возрастов. Самая молодая когорта включала детей в возрасте 2–7 мес. В опытной группе дети (в возрасте от 4 мес до 10 лет) получали 2 дозы ФИ-РСВ внутримышечно, а в контрольных группах — трёхвалентную вакцину против парагриппа [23]. У 68% вакцинированных ФИ-РСВ наблюдали 4-кратное увеличение уровня антител к РСВ по сравнению с контрольными группами [23]. В сезон циркуляции РСВ дети, получавшие ФИ-РСВ, болели тяжелее (7,9%), чем в группе контроля (4,7%) [23]. Усиление протекания заболевания наблюдали у детей младше 2 лет [23]. В другом исследовании участвовали дети в возрасте 2–7 мес; после вакцинации ФИ-РСВ наблюдали прирост нейтрализующих антител в 6 раз по сравнению с группой контроля [24]. В последующий за вакцинацией зимний период (1966/1967 гг.) в группе вакцинированных ФИ-РСВ детей заболел 21 ребёнок из 30 при естественном столкновении с РСВ, тогда как в группе контроля — в 5% случаев. Шестнадцати детям из группы ФИ-РСВ потребовалась госпитализация, 2 младенца погибли [24]. При сравнении результатов испытаний среди разных возрастных групп установлено, что дети из самой младшей группы в наибольшей степени подвержены риску тяжёлого протекания заболевания при иммунизации ФИ-РСВ в случае естественного заражении РСВ. Установлено, что развитие вакцин-индуцированного усиления протекания заболевания было вызвано тем, что детей первично иммунизировали ФИ-РСВ. Один из аргументов заключался в том, что у детей, ранее болевших РСВ, после иммунизации ФИ-РСВ не развивалось состояние иммунопатологии после заражения РСВ. Согласно другому аргументу, при внутримышечном введении живого РСВ РСВ-наивному ребёнку не наблюдается защитный эффект от вакцинации, однако и не развивается состояние иммунопатологии. Таким образом, при разработке вакцинных кандидатов против РСВ следует подробно охарактеризовать фенотип формирующихся Т-клеток памяти, а также В-клеток памяти с определённой антигенной специфичностью.
После неудачных клинических испытаний ФИ-РСВ начались попытки создания живой аттенуированной вакцины. Логика данной стратегии состоит в том, что при иммунизации РСВ будет реплицироваться исключительно в верхних дыхательных путях, в результате чего синтезированный вирусный антиген будет подвержен внутриклеточному процессингу и презентации на поверхности антигенпрезентирующих клеток, что будет способствовать формированию сбалансированного Т- и B-клеточного иммунного ответа. При вакцинации младенцев иммунный ответ будет формироваться локально в слизистой оболочке дыхательных путей, где наблюдается низкий уровень материнских IgG-антител [25]. Основное преимущество использования такой технологии — способ введения путём распыления в нос, рекомендованный к применению в педиатрии.
На начальных этапах возникли определённые трудности при создании живых аттенуированных вакцин, связанные с особенностями культивирования РСВ, термолабильностью и его низкой жизнеспособностью. Живой аттенуированный РСВ может быть получен несколькими способами: с помощью многократного пассирования вируса при пониженной температуре, либо с помощью мутагенеза, который предполагает обработку вирусов специальными мутагенами, либо путём введения мутаций в «дикий» вирус. Для ослабления РСВ обычно проводят манипуляции в белках SH или G [26]. Однако клинические испытания вакцинных кандидатов, полученных с помощью мутагенеза, показали, что не удаётся достигнуть баланса между достаточной жизнеспособностью вакцинного штамма и его иммуногенностью. В 1980-х гг. под руководством Н.П. Лещинской был модифицирован низкотемпературный штамм, полученный от профессора П.М. Чанок (США), путём проведения дополнительных 16 последовательных пассажей при пониженной температуре. При интраназальной иммунизации данным вакцинным кандидатом детей в возрасте 1–2 лет наблюдали клинические реакции средней тяжести, которые коррелировали с 4-кратным приростом специфических РСВ-антител. Высокие титры антител сохранялись лишь в течение 6–8 нед после вакцинации, а затем снижались до исходного уровня [27]. Таким образом, благодаря механизмам аттенуации не удалось получить готовый вакцинный препарат, обеспечивающий поддержание длительного защитного иммунитета. При этом не было показано развития вакцин-индуцированной патологии при применении живых аттенуированных вакцин. В связи с неудачей классических методов начали разрабатываться альтернативные методы получения вакцин против РСВ.
Современные подходы к разработке вакцин против РСВ
После неудачного клинического испытания ФИ-РСВ разработка вакцин в этом направлении замедлилась, поскольку новые кандидаты проходили тщательную проверку на безопасность. С другой стороны, привлечение новых подходов и технологий для борьбы с РСИ привели к заметным достижениям в области вакцинопрофилактики.
Сведения о вакцинных кандидатах против РСВ, прошедших клинические испытания, подробно представлены во многих обзорах [28–31]. Отметим, что подобные обзоры следует обновлять каждый год в связи с актуальностью и важностью вопроса охвата вакцинацией групп населения, которым требуется вакцина против РСВ. Для доклинических испытаний по проверке эффективности и безопасности вакцин важно выбирать релевантные виды животных. В случае вакцин против РСВ необходимо целенаправленно изучать модель вакцин-индуцированного усиления протекания заболевания. Эта проблема подробно рассмотрена в обзоре G. Zhang и соавт. [32]. Совокупность ряда показателей, характеризующих врождённый и приобретённый иммунитет, которые связаны с тяжестью протекания РСИ у разных животных, представлена в обзоре S.B. Drysdale и соавт. [33]. В нашем обзоре собраны данные по испытаниям вакцинных кандидатов против РСВ на лабораторных животных, которые впоследствии тестировались на людях.
мРНК-вакцины
Альтернативой традиционным вакцинам служат вакцины на основе нуклеиновых кислот, в частности, мРНК-вакцины. В их состав входят синтетические молекулы мРНК со структурой, позволяющей синтезировать целевой белок антигена при попадании в клетку-мишень. При разработке мРНК-вакцин особое значение придаётся системам доставки мРНК, поскольку молекулы мРНК являются нестабильными и подвергаются разрушению внеклеточными рибонуклеазами. Чаще применяют липидные наночастицы, но в настоящее время развиваются другие направления стратегии доставки. Например, технология клеточно-проникающих пептидов, позволяющая доставлять мРНК прицельно в антигенпрезентирующие клетки для индукции эффективного иммунного ответа [34].
Вакцинный кандидат mRNA-1345 («Moderna Inc.», США) кодирует поверхностный антиген F в конформации pre-F, который доставляется с помощью липидных наночастиц (LNP) [35]. Вакцина Spikevax («Moderna Inc.», США), используемая для иммунизации пациентов от 12 лет и старше против COVID-19, была разработана на основании результатов, полученных при исследований mRNA-1345 [36]. В 2024 г. вакцинный кандидат mRNA-1345 с названием mResvia был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) для иммунизации пациентов старше 60 лет. Изначально разработчик создал несколько вакцинных кандидатов, содержащих мРНК, необходимых для получения экспрессии белка F в конформации pre-F (mRNA-1777 и mRNA-1172) [37, 38]. Вакцинный кандидат mRNA-1345 был получен в результате генетической модификации мРНК в составе mRNA-1172, проведённой для повышения экспрессии F-белка и изменения его распределения в инфицированных клетках [39, 40]. В 2023 г. были объявлены результаты III фазы клинических испытаний (ConquerRSV, NCT05127434) mRNA-1345 (впоследствии mResvia), согласно которым эффективность данной вакцины составила 83,7%. В исследовании оценивали клинический эффект от иммунизации в отношении двух симптомов, связанных с заболеваниями нижнего респираторного тракта у людей, вызванными РСИ [41]. В настоящее время ведутся клинические испытания вакцинного кандидата mRNA-1345 на детях в возрасте от 5 мес до 2 лет (NCT05743881). Проводятся клинические испытания на безопасность и эффективность mRNA-1345 у иммунизированных беременных и рождённых ими младенцев (NCT06143046).
В 2024 г. начались исследования I фазы клинических испытаний первой в мире двухвалентной мРНК-вакцины IN006 («InnoRNA», Китай), одобренной не только Национальным управлением по контролю за лекарственными средствами Китая, но и FDA. Данная мРНК-вакцина нацелена на экспрессию F-белка в конформации pre-F обоих серотипов РСВ — А и B. В качестве системы доставки используются липидные наночастицы1.
В настоящее время проводятся исследования I и II фаз клинических испытаний вакцинных кандидатов мРНК-вакцины LNP CL-0059 и LNP CL-0137 против РСВ («Sanofi», Франция). В описании исследования сообщается, что тестируются две разные липидные наночастицы для доставки мРНК (NCT05639894).
Векторные вакцины
Основу векторных вакцин составляют векторы-носители для доставки антигенов РСВ в клетки-мишени и индукции иммунного ответа в отношении антигенов вируса, находящихся во вставке. В настоящий момент клинические испытания проходят вакцины против РСВ, в которых в качестве вектора используются модифицированные вирусы осповакцины Анкара (MVA), аденовирусы, вирусы парагриппа крупного рогатого скота, вирус Сендай и вирусы гриппа.
В исследованиях Института экспериментальной медицины (Россия) в качестве вектора выступает живая гриппозная вакцина (ЖГВ). Три полиэпитопные кассеты РСВ отобраны для интегрирования в геном аттенуированного вируса гриппа [42]. Первая кассета содержит фрагмент F243–294, с антигенным сайтом II F-белка РСВ, с которым связываются моноклональные антитела Паливизумаб. Две другие кассеты нацелены преимущественно на активацию цитотоксических Т-лимфоцитов при вакцинации и представлены эпитопами в составе белка М2-1 РСВ.
В экспериментах на лабораторных мышах выявлено, что рекомбинантные вакцинные штаммы ЖГВ, кодирующие полиэпитопную Т-клеточную кассету, индуцируют развитие устойчивого, полностью функционального РСВ-специфического системного и локального CD8+-Т-клеточного иммунного ответа, обеспечивающего защиту иммунизированных животных от размножения РСВ в лёгких. Доказано, что иммунизация Т-клеточной векторной вакциной вызывает образование тканерезидентных Т-клеток памяти к встроенному иммунодоминантному CD8+-Т-клеточному эпитопу [43]. В то же время обнаружено, что встраивание фрагмента РСВ F243–294 в молекулу HA вируса гриппа является недостаточным для индукции защитных уровней РСВ-специфических антител у мышей. Однако иммунизация таким химерным вирусом препятствует развитию РС-индуцированной лёгочной патологии [44].
В НИИ гриппа им. А.А. Смородинцева (Россия) разработчики используют в качестве вектора для доставки трансгена F-белка РСВ, содержащего антигенные сайты II и IV, модифицированный вирус гриппа A/PR/8/34, ослабленный за счёт укорочения NS1-белка до 124 аминокислотных остатков [45]. Полученный вакцинный кандидат RSV/Flu-01E прошёл I фазу клинических испытаний (NCT05970744) на добровольцах двух возрастных групп — 18–59 лет и пожилых старше 60 лет и II фазу клинических испытаний на добровольцах старше 60 лет.
Вакцинный кандидат MVA-BN-RSV («Bavarian Nordic A/S», Дания) сконструирован на основе модифицированного вируса осповакцины Ankara (MVA). Рекомбинантный вацинный штамм MVA экспрессирует F- и G-белки обоих подтипов (A и B) РСВ, а также N- и M2-белки РСВ. Результаты фазы I клинических испытаний показали, что иммунизация MVA-BN-RSV индуцировала выработку гуморального и клеточного иммунного ответа против РСВ у людей в возрасте 18–65 лет [46]. Во II фазе клинических испытаний (NCT02873286) установлено, что MVA-BN-RSV хорошо переносилась иммунизированными людьми старше 55 лет и приводила к формированию стойкого иммунного ответа, сохраняющегося в течение как минимум 6 мес после однократного введения вакцины. По результатам второй иммунизации, проведённой через год после первой, выявлено, что уровень Т-клеточного иммунного ответа выше или схож с тем, который наблюдался после первой иммунизации [47]. Однако в ходе III фазы клинических испытаний эффективности у лиц старше 60 лет было признано, что иммунизация MVA-BN-RSV не достигла конечной точки исследования и неэффективна2.
В исследовании RSV001 (NCT01805921) были изучены две рекомбинантные вакцины: PanAd3-RSV и MVA-RSV («ReiThera», Италия). PanAd3-RSV была разработана на основе аденовируса обезьян, MVA-RSV — на основе модифицированного вируса коровьей оспы Ankara [48, 49]. В качестве антигенов РСВ использовали белки: F (F0 ΔTM — полноразмерный, F — без трансмембранного домена), N и M2-1, которые доставляются в клетку-мишень аденовирусным вектором обезьян с дефектом репликации (PanAd3) либо MVA-вектором [50]. Вакцинные кандидаты PanAd3-РСВ и MVA-РСВ, вводимые в разных комбинациях разными способами (внутримышечное и интраназальное введение PanAd3, внутримышечное — MVA), хорошо переносились и были иммуногенны у взрослых людей (18–50 лет) [51]. В исследовании RSV001 (NCT01805921) у пожилых лиц (60–75 лет) фиксировалась индукция гуморального и клеточного иммунного ответа после иммунизации [52].
Вакцинный кандидат VXA-RSV-f («Vaxart», США) разработан на основе аденовируса 5-го подтипа, экспрессирующего F-белок РСВ и молекулярный адъювант в виде двухцепочечной РНК [53]. I фаза клинических испытаний (NCT02830932) была проведена на людях в возрасте 18–49 лет и закончилась в 2018 г.3 Результаты до настоящего времени не опубликованы.
Вакцинный кандидат Ad26.RSV.Pre-F («Janssen», Бельгия) сконструирован на основе аденовируса 26-го типа, экспрессирующего F-белок в конформации pre-F [54]. В I и II фазах клинических испытаний (NCT03502707) на пожилых (старше 60 лет) были опробованы разные схемы введения вакцины, в том числе в сочетании с рекомбинантным F-белком. У иммунизированных по комбинированной схеме людей наблюдалась более интенсивная выработка гуморального и клеточного иммунного ответа по сравнению с группой, которой вводили только Ad26.RSV.preF [55]. Во II фазе (NCT03339713) клинических испытаний оценивали сочетанное введение Ad26.RSV.preF и вакцины против сезонного гриппа («Fluarix», GSK). Показано, что у пожилых людей (старше 60 лет) вакцина продемонстрировала приемлемый профиль безопасности и отсутствие признаков иммунной интерференции [56]. В ходе I/a фазы (NCT03303625) клинических испытаний Ad26.RSV.Pre-F показано, что благодаря иммунизации у РСВ-серопозитивных детей в возрасте 12–24 мес и взрослых (18–50 лет) вырабатываются РСВ-специфические нейтрализующие антитела, сохраняющиеся в течение 7 мес. Кроме того, иммунизированные Ad26.RSV.Pre-F были менее подвержены заражению РСВ в естественных условиях [57].
ChAd155-RSV («GlaxoSmithKline», Великобритания) разработана на основе аденовируса-155 шимпанзе и кодирует белки РСВ F, N и М2-1 [58]. Вакцинный кандидат был предварительно протестирован на телятах, у которых механизмы иммунного ответа на РСИ наиболее приближены к детям. После вакцинации телят индуцировались нейтрализующие антитела к РСВ, отсутствовали признаки вакцин-индуцированного усиления заболевания и была продемонстрирована защита против бычьего РСВ [59]. В ходе I/II фазы клинических испытаний (NCT02927873) РСВ-серопозитивных детей в возрасте 12–23 мес иммунизировали ChAd155-RSV и наблюдали в течение 2 лет после вакцинации. В результате отмечалось дозозависимое увеличение титров нейтрализующих антител к РСВ [60].
По опубликованным результатам I/II фазы клинических испытаний (NCT03636906) ChAd155-RSV на детях в возрасте 6–7 мес показано, что иммунизация вызывала индукцию гуморального иммунного ответа у иммунизированных, при этом не развивались признаки вакцин-индуцированного усиления заболевания [61].
Вакцинный кандидат MEDI-534 («MedImmune», в данный момент «AstraZeneca», США) разработан на основе химерного вируса парагриппа для крупного рогатого скота и человека третьего типа (PIV3), экспрессирующего F-белок РСВ [62]. В I фазе клинических испытаний (NCT00345670) с участием детей, ранее болевших РСВ, эта живая аттенуированная интраназальная вакцина была безопасной, но иммуногенность была очень низкой [63]. Однако при тестировании на младенцах, серонегативных к РСВ, являющихся целевой популяцией для этой вакцины, MEDI-534 хорошо переносилась иммунизированными и индуцировала иммунный ответ против РСВ примерно в 50% случаев, а против вектора PIV3 — во всех случаях [64].
Вакцинный кандидат SeVRSV (NIAID, США) представляет собой способный к репликации вирус Сендай, штамм мышиного парагриппа первого типа (PIV-1), который экспрессирует F-белок РСВ. На основании I фазы клинических испытаний (NCT03473002) выявлено, что иммунизация SeVRSV людей в возрасте 18–45 лет приводит к формированию низкого уровня иммунного ответа к РСВ. Этот факт объясняется наличием предсуществующего иммунитета в этой возрастной группе к вектору [65].
Живая аттенуированная вакцина
Существует несколько подходов к созданию живых аттенуированных вакцин против РСВ. В основе традиционного подхода лежит чувствительность вируса к определённым температурам репродукции или к воздействию химических агентов. Альтернативный подход базируется на использовании методов обратной генетики для получения ослабленного репликационно-компетентного вируса. Вакцины, разработанные при помощи методов обратной генетики, тестировались на младенцах в возрасте от 4 нед [66, 67]. Живые аттенуированные вакцины рассматриваются как безопасные для детей, ранее не болевших РСВ, поскольку их использование не вызывает вакцининдуцированного усиления протекания заболевания после инфицирования РСВ [24, 68]. Кроме этого, живые аттенуированные вакцины обычно выпускают в виде назальных капель. Попадая в дыхательные пути, они реплицируются в них, независимо от наличия материнских антител, обеспечивая формирование как гуморального, так и клеточного иммунного ответа [69, 70].
Одним из способов получения аттенуированного штамма РСВ является делеция гена SH. Таким образом были разработаны несколько вариантов вакцин.
Вакцинный кандидат rA2cp248/404/1030∆SH сконструирован с несколькими температурочувствительными мутациями, с мутациями, полученными при пассировании вируса при низкой температуре, и с делецией гена SH. При исследовании иммуногенности rA2cp248/404/1030∆SH на РСВ-серонегативных детях в возрасте 1–2 мес отмечена высокая иммуногенность вакцины. Вакцинный кандидат был слабо иммуногенным у РСВ-серопозитивных детей и взрослых [67].
Вакцинный кандидат MEDI-559 («MedImmune», в данный момент «AstraZeneca», США) отличается от предыдущего кандидата наличием 39 молчащих нуклеотидных замен [71]. Оба вакцинных кандидата — rA2cp248/404/1030∆SH и MEDI-559 — были протестированы на здоровых детях в возрасте 5–24 мес, ранее не болевших РСВ. Однако по результатам исследований была обнаружена недостаточная генетическая стабильность обоих кандидатов, склонность к реверсии отдельных точечных мутаций, приводящих к снижению температурной чувствительности, которая наблюдалась у более трети изолятов вакцинного вируса [71, 72].
Вакцинный кандидат RSVcps2 (NIAID, NIH/Wyeth, США) представляет собой стабилизированную версию вакцины MEDI-559. Согласно результатам I фазы клинических испытаний (NCT01852266 и NCT01968083) на детях в возрасте 6–24 мес, RSVcps2 хорошо переносится и обладает умеренной иммуногенностью [73].
Аттенуированного фенотипа живой вакцины можно добиться с помощью делеции гена M2-2 РСВ. Делеция M2-2 приводит к сдвигу в программе синтеза вирусной РНК, что увеличивает уровень транскрипции вирусной РНК и экспрессию вирусного антигена, но снижает репликацию вирусного генома [74].
Оценивали два вакцинных кандидата MEDI/ΔM2-2 (NIAID, США) и LID/ΔM2-2 (NIAID, США) [75, 76]. Оба варианта содержат делецию M2-2, оба получены из разных производных кДНК РСВ одного подтипа A2, отличающихся на 21 нуклеотидную последовательность, расположенную в разных местах генома. У вакцинного кандидата LID/ΔM2-2 удалены нетранслируемые области гена SH и добавлены молчащие замены (сайлент мутации) в SH-белок РСВ. Внесённые мутации не влияют на фенотип собранного вируса, что подтверждается экспериментами на мышах [77]. Вакцинация обоими кандидатами стимулировала выработку РСВ-нейтрализующих антител, при этом LID/ΔM2-2 считалась более эффективной, поскольку обеспечивала небольшое увеличение репликации. В среднем пиковое значение титра вируса, выделяемого вакцинированными, было в 100 раз выше у тех, кто получил LID/ΔM2-2 [75, 76]. В связи с этим было предложено модифицировать вакцинный кандидат LID/ΔM2-2 путём внесения либо дополнительной мутации в L-белок, вызывающей температурочувствительность, либо 5 точечных мутаций в белки N, F и L, которые ранее были обнаружены в аттенуированном штамме РСВ и связаны с адаптацией к пониженной температуре. Из-за активной репликации кандидат LID/ΔM2-2 был модифицирован. Однако впоследствии вакцинный кандидат LID/cp/ΔM2-2 оказался гиператтенуированным, имел низкий инфекционный титр и стимулировал выработку антител лишь у части участников клинических испытаний [76].
Вакцинный кандидат LID/ΔM2-2/1030s был создан путём добавления генетически стабилизированной мутации 1030s. По результатам I фазы клинических испытаний (NCT02237209, NCT02040831) на детях в возрасте 6–24 мес был установлен высокий титр нейтрализующих антител у иммунизированных, который, по экспертным оценкам, был клинически эквивалентным титру антител, образующихся при натуральной РСИ [78].
Модифицированный вакцинный кандидат на основе LID — D46/NS2/N/ΔM2-2-HindIII был сконструирован так, чтобы добиться сходного фенотипа с кандидатом MEDI/ΔM2-2. В целом он оказался более аттенуированным по сравнению с LID/ΔM2-2, но демонстрировал высокие значения вирусных титров [76].
В исследованиях, проведённых С.С. Stobart и соавт., показано, что рекомбинантный штамм РСВ OE4 (RSV-A2-dNS1-dNS2-ΔSH-dGm-Gsnull-line19F) с повышенным уровнем антигена F в конформации pre-F демонстрирует термостабильность и иммуногенность, несмотря на сильную аттенуацию в дыхательных путях хлопковых крыс [79].
Другая многообещающая стратегия заключается в делециях NS1 и NS2, которые нарушают TGFβ-сигнальный путь клетки хозяина, преобразуя иммунный ответ с целью повышения репликации вируса [80, 81].
В результате I фазы клинических испытаний фазы (NCT03227029 и NCT03422237) вакцинного кандидата RSV/ΔNS2/Δ1313/I1314L («Sanofi», Франция) установлены иммуногенность и защитная эффективность вакцины у РСВ-серонегативных детей в возрасте 6–24 мес [82]. В настоящее время проходит III фаза клинических испытаний (NCT06252285) вакцинного кандидата RSV/ΔNS2/Δ1313/I1314L, в которой принимают участие 6300 детей в возрасте 6–22 мес.
Субъединичные вакцины
Большинство разрабатываемых субъединичных вакцин против РСВ содержат поверхностный F-белок в конформации pre-F [83]. Повышение иммуногенности таких вакцин достигается использованием адъювантов либо проведением многократных иммунизаций [84]. Принимая во внимание состав субъединичных вакцин и учитывая неудачу клинических испытаний ФИ-РСВ, особое внимание уделяют безопасности. Установлено, что иммунизация ФИ-РСВ приводит к недостаточной выработке антител с нейтрализующей активностью. Последующие признаки вакцин-индуцированного усиления заболевания объясняются в том числе слабой стимуляцией Toll-подобных рецепторов в B-клетках, что влечёт за собой отсутствие процесса аффинного созревания антител [85]. Таким образом, созревание аффинности вследствие стимуляции Toll-подобных рецепторов является ключевым фактором, помогающим предотвратить состояние вакцин-индуцированного усиления заболевания. В настоящее время субъединичные вакцины разрабатываются для беременных, пожилых и подростков, которые ранее болели РСВ, чтобы снизить риск развития вакцин-индуцированного заболевания [30, 86].
Вакцинный кандидат DS-Cav1 (NIAID, США) создан на основе F-белка в конформации pre-F [87]. В ходе I фазы клинических испытаний DS-Cav1 на взрослых в возрасте 18–50 лет (NCT03049488) обнаружено, что у иммунизированных наблюдался прирост РСВ-F-специфических антител с нейтрализующей активностью. При этом уровень нейтрализующих антител был выше базового уровня на протяжении 10 мес после иммунизации [88]. В данном исследовании в качестве адъюванта использовали гидроксид алюминия.
Вакцинный кандидат DepoVax-RSV или DPX-RSV («ImmunoVaccine Technologies Inc.», Канада) разработан на основе эктодомена белка SH (SHe) РСВ. Этот пептид вводится с адъювантом DepoVax, благодаря которому обеспечивается длительное воздействие антигена на иммунную систему. Согласно результатам I фазы клинических испытаний (NCT02472548), после введения DPX-RSV у иммунизированных людей в возрасте 50–64 лет был зафиксирован прирост анти-SHe-специфических антител [89].
В мае 2023 г. FDA одобрило первую вакцину Arexvy («GlaxoSmithKline», Великобритания) для людей старше 60 лет. Эта вакцина содержит F-белок РСВ в конформации pre-F и вводится вместе с адъювантом AS01E для обеспечения защитного эффекта в отношении РСВ подтипов A и B. По результатам I фазы клинических испытаний (NCT03814590 и NCT04090658) Arexvy на людях в возрасте 60–80 лет установлено, что иммунизация способствовала образованию РСВ-специфических IgG-антител, нейтрализующих антител и CD4+-Т-клеток. которые обнаруживались у иммунизированных спустя год [90, 91]. По результатам II фазы клинических испытаний (NCT04657198) зафиксировано повышение эффективности иммунизации после ревакцинации участников исследования спустя 1,5 года после первой иммунизации [92]. В период с 2023 г. по июнь 2025 г. было анонсировано 2b рандомизированное открытое исследование эффективности и безопасности Arexvy. Участниками исследования стали люди в возрасте 18 лет и старше, перенёсшие трансплантацию лёгких или почек, а также подверженные повышенному риску заболеваний нижних дыхательных путей в сравнении со здоровыми людьми в возрасте 50 лет и старше (NCT05921903). В одном из исследований в рамках III фазы клинических испытаний (NCT04732871) сообщалось об увеличении титра нейтрализующих антител к РСВ и о случаях нежелательных явлений, вызванных иммунизацией [93]. По последним опубликованным данным III фазы клинических испытаний (NCT04886596) оценена эффективность иммунизации Arexvy у 24 967 участников в течение 2 эпидемиологических сезонов циркуляции РСВ. Эффективность иммунизации Arexvy составила около 67,2% в отношении заболеваний нижнего респираторного тракта и около 78,8% в отношении тяжёлой формы протекания заболеваний нижних дыхательных путей, вызванных РСВ [94].
На основании промежуточных результатов III фазы клинических испытаний (NCT05035212) была одобрена ещё одна субъединичная вакцина для профилактики РСИ у пожилых — Abyrsvo («Pfizer», США), в состав которой входит F-белок РСВ в конформации pre-F. По результатам I фазы клинических испытаний Abyrsvo у иммунизированных вырабатывались РСВ-специфические IgG-антитела к A- и B-штаммам РСВ [95]. Во II фазе клинических испытаний Abyrsvo тестировалась на небеременных и беременных женщинах (NCT04071158 и NCT04032093). Недавно завершилось клиническое исследование III фазы (NCT04424316) у беременных женщин. Установлено, что РСВ-ассоциированные заболевания у младенцев, рождённых у иммунизированных во время беременности матерей, выявлялись реже, чем у неиммунизированных [96]. В рамках III фазы клинического исследования RENOIR (NCT05035212) определено, что эффективность профилактики заболеваний нижних дыхательных путей, вызванных РСВ, составляет около 66,7% [97]. В рамках клинического исследования III фазы MONET (NCT05842967) иммунизировали людей в возрасте 18–59 лет с хроническими заболеваниями, подверженных риску развития РСИ в тяжёлой форме. Вакцина хорошо переносилась, была безопасной и иммуногенной [98]. В целом, показатели РСВ-специфических нейтрализующих антител у иммунизированных из исследования MONET были не ниже, чем у иммунизированных пожилых старше 60 лет из исследования RENOIR (NCT05035212).
Вакцины на основе вирусоподобных частиц
Вакцины на основе вирусоподобных частиц принято считать одним из подклассов субъединичных вакцин. Эти вакцины синтезируются путём самосборки наночастиц, которые экспонируют на своей поверхности множественные копии выбранного вирусного антигена. Высокий уровень гуморального и клеточного иммунного ответа достигается благодаря не только многократному повторению участков антигена, но и иммуностимулирующим свойствам матрицы для иммобилизации наночастиц [99]. Отсутствие вирусного генома в составе этих вакцинных кандидатов делает их безопасными ввиду неспособности воспроизводить жизнеспособные вирионы.
Вакцинный кандидат ResVax («Novavax», США) создан на основе F-белка РСВ и представляет собой вакцину на основе вирусоподобных частиц. Вакцина разрабатывается для защиты младенцев путём вакцинации будущих матерей, детей в возрасте от 6 мес до 5 лет и пожилых лиц старше 60 лет. В результате II фазы клинических испытаний (NCT02247726) установлено, что иммунизация здоровых беременных женщин вызывала выработку нейтрализующих антител к РСВ, которые эффективно передавались новорождённым [100]. Успехи этого этапа исследований позволили включить вакцинный кандидат ResVax в программу исследований PREPARE (многоцентровое, рандомизированное, плацебо-контролируемое исследование III фазы, NCT02624947). В рамках клинического исследования велись наблюдения за младенцами, рождёнными в самом начале эпидемического сезона циркуляции РСВ от матерей, иммунизированных ResVax в III триместре [101]. Оказалось, что иммунизация ResVax не была эффективной. Несмотря на это, было заявлено, что благодаря использованию ResVax удалось снизить на 44% случаи госпитализаций у детей, связанных с инфекциями нижних дыхательных путей, вызванными РСВ. Кроме того, было зафиксировано снижение РСВ-специфических заболеваний нижних отделов респираторного тракта на 39,4% и снижение РСВ-ассоциированной гипоксемичной дыхательной недостаточности у младенцев младше 3 мес на 58,8% [101].
Вакцинный кандидат SynGEM («Virtuvax», Нидерланды) представляет собой мукозальную вакцину, содержащую F-белок в конформации pre-F, связанный с бактериоподобными частицами, полученными из Lactococcus lactis. Благодаря бактериоподобным частицам вакцинный антиген РСВ предстает в более естественной конформации, а также наблюдается усиленный иммунный ответ в отношении РСВ [102]. Клинические испытания вакцины без адъюванта были неэффективны в группе пожилых. Вакцинация способствовала снижению на 61% случаев госпитализации пожилых с хронической обструктивной болезнью лёгких. По результатам I фазы клинических испытаний у иммунизированных лиц не наблюдался прирост нейтрализующих антител в сыворотках крови, которые распознают эпитопы в составе уникального Ø сайта F-белка [103, 104]. Тем не менее вакцина индуцировала выработку паливизумаб-подобных антител. В настоящее время клинические испытания данной вакцины приостановлены.
Вакцинный кандидат V-306 («Virometrix», Швейцария) содержит пептид, состоящий из миметиков F-белка РСВ, имитирующих антигенный сайт II. Пептид конъюгирован с синтетическими наночастицами, изготовленными из самоорганизующихся липопептидов. В ходе I фазы клинических испытаний (NCT04519073) установлено, что вакцина V-306 безопасна и иммуногенна для здоровых женщин в возрасте 18–45 лет [105].
Заключение
РСВ является причиной тяжёлых респираторных заболеваний у детей 1-го года жизни, людей с ослабленным иммунитетом и пожилых лиц [106, 107]. Клиническая картина протекания РСИ проявляется по-разному — от лёгких инфекций верхних и нижних дыхательных путей до пневмоний и бронхиолитов у детей.
На настоящий момент FDA одобрило использование 3 вакцин для профилактики РСИ у людей. Двухвалентная субъединичная вакцина Abrysvo («Pfizer», США) одобрена для использования у беременных и пожилых людей. Субъединичная вакцина Arexvy («GlaxoSmithKline», Великобритания) и мРНК-вакцина mRESVIA («Moderna», США) разрешены для применения у людей старше 60 лет.
Продолжаются разработки и исследования эффективности вакцин против РСВ для детей, представляющих основную целевую группу. В данном случае к основным проблемам относят необходимость вакцинировать младенцев на раннем этапе (2–4 мес), выявленный эффект усиления протекания заболевания, связанный с введением ФИ-РСВ с адъювантом квасцов, трудности в достижении требуемых показателей профилактической эффективности. Долгое время единственным специфическим средством лечения РСИ являлся препарат моноклональных антител Паливизумаб, обычно назначаемый лицам, подверженным высокому риску развития тяжёлых форм заболевания. В данном случае значимым фактором является высокая стоимость курса лечения этим препаратом, что делает его недоступным в странах с наибольшим ущербом от РСВ [108].
В 2022–2023 гг. был одобрен препарат моноклональных антител Нирсевимаб («AstraZeneca», Великобритания; «Sanofi», Франция), рекомендованный для назначения детям в случаях тяжёлого протекания РСИ и её осложнениях [109].
На данный момент разрабатываются вакцины для женщин репродуктивного возраста и беременных с целью защиты когорты наивных младенцев, а также для защиты пожилых лиц и детей. На разных фазах клинических испытаний находятся вакцины на основе вирусоподобных частиц, векторные, субъединичные и живые аттенуированные вакцины.
Актуальные сведения о вакцинных кандидатах, находящихся на стадии доклинических исследований, представлены в табл. 1. Сведения о кандидатах, изученных в разных фазах клинических испытаний, суммированы в табл. 2.
Таблица 1. Результаты доклинических испытаний вакцинных кандидатов против РСВ
Вакцина (разработчик) | Состав вакцины (адъювант) | Животные (путь введения) | Исследование и результаты | Источник |
Живые аттенуированные вакцины | ||||
RSV-MinL4•0 («Codagenix», | RSV-Min L — вакцинный кандидат, полученный при помощи внесения «молчащих» мутаций (кодонная деоптимизация) (без адъюванта) | Африканские зелёные мартышки (и.н. + и.т.) | RSV-MinL4•0 более аттенуирован, чем РСВ A2, при введении 2 × 106 БОЕ (по 106 и.н. и и.т.): значение пиковых вирусных титров в мазках из трахеи в группе иммунизированных RSV-MinL4 в 100 раз меньше, чем в группе wt РСВ. При заражении РСВ А2 в дозе 2 × 106 БОЕ на 104-й день эксперимента выявили защитный потенциал RSV-MinL4•0: пиковые значения по выделению вируса на 6-й день в мазках из трахеи и из ротоглотки были в 1000 и в 100 раз меньше, чем в группе наивных мартышек соответственно | [110] |
IT-RSVΔG | Изолят РСВ штамм 98-25147-X (pРСВ-X), у которого удалён ген, кодирующий G-белок (ΔG) (без адъюванта) | Хлопковые крысы (и.н.) | рРСВ-X ΔG был более аттенуирован по сравнению с вектором рРСВ-X при введении 105 ТЦИД50: значение пиковых титров в лёгких и носах было в 4–5 раз ниже, чем в группе рРСВ-X. Однократная вакцинация рРСВ-X ΔG защитила крыс от заражения вирусом РСВ-X в дозе 106 ТЦИД50: на 5-й день после челленджа вирус не обнаруживали в лёгких иммунизированных животных, тогда как в группе плацебо вирус размножался до 5 log10 ТЦИД50 в лёгких. Вакцинация рРСВ-X ΔG не приводила к развитию бронхолёгочной патологии, а гистопатологические признаки поражения были значительно снижены по сравнению с группой наивного контроля | [111] |
MV-012–968 | RSV-A2-dNS1-dNS2-ΔSH-dGmGsnull-line19F кодонная деоптимизация генов NS1, NS2; удалён ген SH (ΔSH). F-белок в конформации «до слияния». В ген G введена точечная мутация (M48I) для подавления экспрессии секретируемой формы белка G (Gsnull). Мембраносвязывающая форма Gm подвергнута кодонной оптимизации (dGm) (без адъюванта) | Мыши BALB/c (и.н.) | При введении MV-012–968 в дозе 106 фокус-формирующих единиц (FFU) вирусная нагрузка в легких была достоверно ниже, чем у мышей, зараженных РСВ A2 и РСВ A2-19F. Вакцинация MV-012–968 обеспечивала защиту мышей от заражения РСВ A2-line19F в дозе 105 БОЕ: в группе MV-012–968 вирус не выделялся спустя 5 дней после челленджа. Продукция слизи в легких у кандидата MV-012–968 была достоверно ниже, чем у РСВ A2-line 19F и RSV A2-del-M2 на 5 сутки после челленджа | [79] |
Хлопковые крысы (и.н.) | Репликация MV-012–968 (OE4), введённого в дозе 105 FFU, отсутствовала в носах и лёгких хлопковых крыс. MV-012–968 (OE4) полностью защищала крыс от заражения РСВ-A2-line19F в дозе 106 FFU на 42-й день после вакцинации. В отличие от ФИ-РСВ, вакцинация MV-012–968 (OE4) не вызывала гистопатологических изменений в лёгких после заражения РСВ | [19] | ||
RSV ΔNS2/Δ1313 | Кандидат с ts-мутациями в L-белке (делеция в 1313-м положении, компенсаторная мутация I1314L, которая появляется в результате пассирования вируса при постепенно повышающихся температурах); делеция NS2 (ΔNS2) (без адъюванта) | Мыши BALB/c (и.н.) | Кандидат RSV ΔNS2/Δ1313/I1314L гиператтенуирован для мышей. Вариант RSV/Δ1313 при введении в дозе 106 БОЕ размножался в дыхательных путях мышей значительно слабее по сравнению с wt РСВ. Эта животная модель не подходит для оценки иммуногенности и защитной эффективности гиператтенуированных вакцинных кандидатов | |
Ювенильные шимпанзе (и.н. + и.т.) | При иммунизации шимпанзе RSV ΔNS2/Δ1313/I1314L в дозе по 106 БОЕ (и.н. + и.т.) пиковые значения вирусной нагрузки были в 3–25 раз ниже по сравнению с высокоаттенуированными кандидатами MEDI-559 (rA2 cp248/404/1030ΔSH) и cps2 (генетически стабилизированная версия MEDI-559) в носовых смывах. Титр вируса RSV ΔNS2/Δ1313/I1314L в бронхоальвеолярном лаваже (БАЛ) и смывах из трахеи, наоборот, был в 20 раз выше, чем в группах сравнения. Вакцина индуцировала высокие уровни РСВ вируснейтрализующих антител, однако экспериментов по защите от РСИ в данной работе не проводились | [113] | ||
|
| Телята (2–4 нед) (и.н., в.м.) | PanAd3-RSV (5 × 1010 вирусных частиц) и MVA (2 × 107 БОЕ) вводили телятам в разных комбинациях с интервалом 4 нед. На 6-й день после челленджа РСВ, введённый в дозе 104 БОЕ, не реплицировался в дыхательных путях телят из групп PanAd3-RSV/MVA (в.м.), PanAd3-RSV (в.м.)/PanAd3-RSV (в.м.), PanAd3-RSV/PanAd3-RSV (в.м.), PanAd3-RSV (в.м.)/MVA (в.м.). В группе PanAd3-RSV/PanAd3-RSV вирус размножался в лёгких. В группе PanAd3-RSV/MVA (в.м.) вирус не обнаруживали в носах и не обнаруживали макроскопических поражений лёгких. У телят, иммунизированных по схеме гетерологичного прайм-буста, после челленджа в меньшей степени развивалась массивная инфильтрация полиморфноядерных нейтрофилов в лёгких и БАЛ по сравнению с телятами из групп гомологичного прайм-буста | [115] |
Макаки (и.н., в.м.) | PanAd3-RSV (5 × 1010 вирусных частиц) и MVA (2 × 107 БОЕ) вводили макакам в разных комбинациях с интервалом 8 нед. Продукция интерферона-γ и интерлейкина-4 в мононуклеарных клетках периферической крови усиливалась в 6 раз после буста. Продукция интерлейкина-4 в мононуклеарных клетках была выше в группе PanAd3-RSV/MVA (в.м.) по сравнению с PanAd3-RSV (в.м.)/MVA (в.м.). Спустя 1 нед после 2-й иммунизации в мононуклеарных клетках преобладала популяция CD4+-Т-клеток. Только у макак, иммунизированных PanAd3-RSV, вырабатывались РСВ-специфические IgA. У макак, иммунизированных PanAd3-RSV (в.м.), в 40 раз был выше титр нейтрализующих антител по сравнению с PanAd3-RSV. Защитный эффект иммунизации не оценивали | [50] | ||
Ad26.RSV.F и Ad35.RSV.F | Аденовирусы 26-го и 35-го типов, в состав которых входит ген, кодирующий F, в конформации pre-F (нет адъюванта) | Мыши BALB/c (в.м.) | Двукратная иммунизация мышей с интервалом 4 нед кандидатами Ad26.RSV.F и Ad.35.RSV.F в разных комбинациях в дозе 1010 вирусных частиц стимулировала выработку РСВ F-специфического Т-клеточного иммунного ответа на 12-й неделе: высокие уровни продукции интерферона-γ, фактора некроза опухоли-α и интерлейкина-2 CD8+-Т-клетками были в группе Ad.35.RSV.F/Ad26.RSV.F и Ad.26.RSV.F/Ad35.RSV.F. Иммунный ответ у мышей во всех группах развивался по типу Th1: фиксировались высокие соотношения IgG2a/IgG1 по сравнению с группой ФИ-РСВ. Высокий уровень нейтрализующих антител в группах Ad.35.RSV.F/Ad26.RSV.F и Ad.26.RSV.F/Ad35.RSV.F | [54] |
Хлопковые крысы (в.м.) | Двукратная иммунизация вариантами Ad26.RSV.F и Ad.35.RSV.F по схеме гомологичного и гетерологичного прайм-буста в дозе 1010 вирусных частиц индуцировала высокие уровни вируснейтрализующих антител и полностью защищала животных от репликации РСВ в респираторном тракте, не вызывая патологических изменений в тканях лёгких после челленджа. Была оценена возможность снижения дозы вакцины, для чего животных однократно иммунизировали Ad26.RSV.F и Ad.35.RSV.F в дозах 106–108 вирусных частиц и подвергали заражению РСВ А2 спустя 7 нед. Все иммунизированные животные были полностью защищены от размножения вируса в лёгких, а репликация в носах была значительно снижена во всех группах по сравнению с контролем. Баллы гистопатологии в обеих группах были одинаковы и не отличались от группы наивного контроля. Длительность и кросс-протективный потенциал вакцины оценивали путём двукратной иммунизации крыс по схеме гомологичного и гетерологичного прайм-буста кандидатами, взятыми в дозах 108 и 1010 вирусных частиц, и заражением животных РСВ A2 либо РСВ B15/9 через 30-й неделе после иммунизации. Челлендж-вирусы не реплицировались в лёгких во всех вакцинных группах, при этом комбинация Ad26.RSV.F/Ad.35.RSV.F (1010 вирусных частиц) лучше защищала животных от репликации РСВ B15/9 в носах. В отличие от ФИ-РСВ, исследуемые вакцины не вызывали гистопатологических изменений в тканях лёгких после челленджа | [54] | ||
Хлопковые крысы (в.м.) | Сравнивали защитную эффективность однократной иммунизации Ad26.RSV.preF в дозе 105–108 вирусных частиц и двукратной иммунизации белком RSV.preF. На 49-й день крысам вводили РСВ А2 в дозе 105 БОЕ. В группе Ad26.RSV.preF челлендж-вирус не размножался в носах и лёгких в отличие от группы RSV.preF. Была установлена корреляция между выработкой нейтрализующих антител и защитой животных от заражения РСВ | [116] | ||
VXA-RSV f | Ad-RSVF — аденовирус 5-го типа, который содержит ген, кодирующий полноразмерный F белок (нет адъюванта) | Хлопковые крысы (п.о.) | Двукратная иммунизация крыс Ad-RSVF в разных дозах (108–1010 БОЕ) защитила крыс от заражения РСВ А2 в дозе 1 × 105 БОЕ на 70-й день: вирус не размножался в носах и лёгких в группе, где доза вакцины была больше (дозозависимый защитный эффект иммунизации). Уровень гистопатологии в группе Ad-RSVF был намного ниже, чем в группе ФИ-РСВ. В группе Ad-RSVF уровень индукции провоспалительных цитокинов был минимальным | [117] |
ChAd155-RSV GS | Аденовирус шимпанзе, содержащий гены, кодирующие F-белок (делеция трансмембранной области), N, M2-1 (нет адъюванта) | Телята (в.м.) | Телят иммунизировали ChAd155-RSV в дозе 5 × 1010. Челлендж проводили спустя короткий (4 нед) или длинный (16 нед) период после иммунизации. В отличие от иммунизированных ChAd155-RSV, у неиммунизированных телят наблюдались лихорадка, высокая температура, респираторный дистресс-синдром, высокий уровень лёгочной консолидации и гистопатологические изменения в лёгочной ткани после челленджа. Когда челлендж проводили спустя 4 нед, репликация вируса в БАЛ и назофарингеальных смывах у неиммунизированных была в 500–1000 раз и в 10 раз выше соответственно, чем в группе ChAd155-RSV. В случае, когда челлендж проводили на 16-й неделе, в группах ChAd155-RSV и PBS пиковые значения вирусного титра в БАЛ и носовых смывах были примерно одинаковыми, но вирусный клиренс наступал раньше. Для установления роли предсуществующего иммунитета к РСВ телят кормили молозивом с содержанием антител к РСВ до иммунизации ChAd155-RSV или PBS. В группе ChAd155-RSV у телят с антителами к РСВ отсутствовали признаки РСИ (недомогание, лихорадка, учащение дыхания) в отличие от группы PBS, где у телят были антитела к РСВ. В группах ChAd155-RSV с антителами к РСВ челлендж-вирус размножался в 100 и 10 раз меньше в БАЛ и носовой полости, чем в группе PBS |
|
SeV/RSV | Вирус Сендай (вирус парагриппа 1-го типа), который содержит ген, кодирующий полноразмерный F (РСВ) (нет адъюванта) | Африканские зелёные мартышки (и.н. + и.т.) | SeV/RSV был аттенуированным при введении в дозе 2 × 106 ЭИД50. Вирус не выделялся в носовых смывах, был в 1000 раз более ослабленным, чем b/h PIV-3 RSV F2. На 28-й день мартышек заражали RSV A2 в дозе 1,4 × 106 БОЕ. Челлендж-вирус выделялся в верхних дыхательных путях в группе SeV/RSV в меньшей степени по сравнению с контролем и не выделялся из БАЛ. В группе SeV/RSV после челленджа не наблюдались побочные эффекты. В срезах лёгких были обнаружены небольшие очаги лимфогистиоцитарного воспаления вокруг терминальных и респираторных бронхиол |
|
rBCG-N-hRSV | Бактерия Bacillus Calmette-Guerin (BCG), которая содержит ген, кодирующий N-белок РСВ (нет адъюванта) | Мыши BALB/c (п.к.) | Мышам вводили rBCG-N-hRSV либо BCG-WT в дозе 3 × 105 БОЕ. Через 3 нед мышей заражали РСВ в дозе 1 × 107 БОЕ. В группах BCG-WT и неиммунизированных мышей потеря веса составила примерно 10%, тогда как в группе rBCG-N-hRSV потеря веса была незначительной. В группе rBCG-N-hRSV вирусная нагрузка в БАЛ была меньше в 7 и 300 раз, чем в группах BCG-WT и неиммунизированных мышей соответственно. В гистологических срезах лёгких в группе rBCG-N-hRSV воспаление было выражено в меньшей степени, чем в группах неиммунизированных мышей и BCG-WT. В исследовании долговременной защиты челлендж проводили спустя 50 дней после иммунизации. В группе rBCG-N-hRSV мыши меньше теряли вес по сравнению с другими группами, количество инфильтрующих клеток в БАЛ и вирусная нагрузка были ниже, чем в группах неиммунизированных мышей и BCG-WT. BCG-N и BCG-M2 стимулирует прежде всего Т-клеточный иммунитет: активируются Т-клетки с Th1-подобным паттерном секреции цитокинов |
|
|
| Мыши BALB/c (с дефицитом RAG-1) (п.к.) | Мышей иммунизировали 2 раза с интервалом 10 дней BCG-N, BCG-M2, BCG-WT в дозе 1 × 108 БОЕ. Через 21 день мышей заражали РСВ в дозе 1 × 107 БОЕ. Мыши из группы BCG-N активно теряли вес (наравне с неиммунизированными мышами, заражёнными РСВ). После заражения РСВ в группах BCG-N и BCG-WT в БАЛ было большое количество инфильтрующих клеток — нейтрофилов и эозинофилов. На 6-й день после челленджа вирусная нагрузка в лёгких во всех группах была практически одинаковая. На 12-й день снижение РС вирусной нагрузки наблюдали в группе мышей BALB/c (не RAG-1). Эти результаты свидетельствуют о том, что для РСВ клиренса необходимы Т-клетки, а механизмов врождённого иммунитета недостаточно для защиты от РСИ | [122] |
|
| Телята голштинской породы (п.к.) | Телятам вводили rBCG-N-hRSV либо WT-BCG в дозе 106 БОЕ 2 раза с интервалом 2 нед. Через 2 нед телят заражали РСВ в дозе 104 ТЦИД50. У всех телят развивались признаки РСИ (лихорадка, вялость, выделения из носа и глаз, лёгкая одышка), однако баллы по оценке клинического состояния в группах rBCG-N-hRSV и WT-BCG были ниже, чем у неиммунизированных. Не было различий в баллах по степени поражения лёгочной ткани в группах rBCG-N-hRSV, WT-BCG и неиммунизированных телят после челленджа и отсутствовали признаки вакцин-индуцированного усиления заболевания | [123] |
MVA-F и MVA-G | Вектор MVA, несущий гены, кодирующие F- и G-белки РСВ | Мыши BALB/c (и.п.) | Двукратная иммунизация мышей вариантами MVA-F и MVA-G в дозе 108 инфекционных единиц приводила к образованию выраженного гуморального и Т-клеточного иммунитета к РСВ. Заражение иммунизированных мышей РСВ в дозе 1,2 × 106 БОЕ показало ускоренную элиминацию вируса в группах MVA-F и MVA-G по сравнению с группой мышей, иммунизированных вектором MVA. Признаки эозинофилии после челленджа отсутствовали в группах MVA-F и wtMVA и были небольшими в группе MVA-G. Тем не менее в группе MVA-F был выражен лимфоцитоз (~50%) по сравнению с MVA-G (~20%). В группе MVA-G было больше полиморфноядерных клеток, что сопоставимо с группой ФИ-РСВ. После челленджа мыши активно теряли вес в группах MVA-G (до 15%), MVA-F (~12%) и ФИ-РСВ (~10%) по сравнению с группой контрольных животных после РСВ-челленджа, что свидетельствует об обострении протекания заболевания после иммунизации и заражения РСВ | [124] |
rVV-G и rVV-F | Вирусы коровьей оспы, содержащие гены, кодирующие F- или G-белок в разных формах: rVVGsol (растворимая, секретируемая форма), rVVGmem (форма, заякоренная в мембране), rVVG (обе формы) | Мыши BALB/c (в.б., скар.) | Иммунизация мышей rVVF, rVVG и rVVGmem приводила к индукции высоких уровней антител, независимо от способа введения. В группе rVVGsol уровень РСВ-специфических антител был в ~550 раз выше при в.б. введении, чем при иммунизации посредством скарификации. При заражении иммунизированных мышей штаммом РСВ А2 вирус не выделялся из лёгких в группах rVVF, rVVG, rVVGmem и rVVGsol. При иммунизации посредством скарификации в группах rVVG и rVVGsol наблюдали повышение количества эозинофилов в БАЛ после челленджа. В группе rVVGmem эозинофилов было в 10 раз, чем в группах rVVG и rVVGsol. При в.б. введении эозинофилы в БАЛ не обнаруживались. Способ введения вакцины влиял на развитие лёгочной патологии | [125] |
LAIV + NA/RSV и LAIV | Рекомбинантные вакцинные штаммы ЖГВ, кодирующие полиэпитопную Т-клеточную кассету РСВ M2-1 (70-101+114-146) | Мыши BALB/c (и.н.) | Мышей иммунизировали 2 раза с интервалом 3 нед вакцинными вариантами LAIV + NA/RSV или LAIV + NS1/RSV в дозе 106 ЭИД50 на мышь. Спустя 3 нед после 2-й иммунизации мышей заражали интраназально РСВ штаммом А2 в дозе в дозе 2 × 105 БОЕ/особь. Обнаружено, что РСВ детектировался на незначительном уровне в группах LAIV + NA/RSV и LAIV + NS1/RSV, в отличие от группы PBS и LAIV в лёгких, собранных на 5-е сутки. В отличие от группы ФИ-РСВ, вакцинные варианты LAIV + NA/RSV и LAIV + NS1/RSV не вызывали лёгочную эозинофилию и лёгочную патологию после заражения РСВ | [126] |
LAIV + NA/RSV и LAIV | Рекомбинантные вакцинные штаммы ЖГВ, кодирующие полиэпитопную Т-клеточную кассету РСВ M2-1 (70-101+114-146) | Мыши BALB/c (и.н.) | Мышей иммунизировали 2 раза с интервалом 3 нед вакцинными вариантами LAIV + NA/RSV или LAIV + NS1/RSV в дозе 106 ЭИД50. Спустя 7 дней после 2-й иммунизации у мышей собирали лёгкие для идентификации субпопуляций резидентных Т-клеток. Обнаружено, что иммунизация LAIV + NA/RSV или LAIV + NS1/RSV приводит к выработке высоких уровней тканерезидентных Т-клеток памяти к встроенному иммунодоминантному CD8+-Т-клеточному эпитопу. При этом уровни грипп-специфических Т-клеток памяти CD8+-Т-клеток в группах ЖГВ + NA/РСВ и ЖГВ + NS1/РСВ были выше, чем в группе ЖГВ | [43] |
LAIV-HA + G-RSV и | Встраивание целевого фрагмента F243–294 РСВ в молекулу HA, который является целевым фрагментом ЖГВ | Мыши BALB/c (и.н.) | Векторные вакцинные кандидаты отличались составом химерного гена НА + РСВ: РСВ-вставка соединялась с субъединицей НА1 с помощью линкера AAAPGAA (A) либо G4SG4S (G). Мышей иммунизировали 2 раза с интервалом 3 нед вакцинными вариантами LAIV-HA + G-RSV или LAIV-HA + A-RSV в дозе 106 ЭИД50. Спустя 3 нед после 2-й иммунизации мышей заражали интраназально РСВ штаммом А2 в дозе в дозе 5 × 105 БОЕ/особь. На 5-е сутки после заражения оценивали степень репликации РСВ в лёгочной ткани. Иммунизация LAIV-HA + G-RSV и LAIV-HA + A-RSV не смогла предотвратить развитие РСИ. Тем не менее была зафиксирована достоверная разница между значениями титра вируса в группе ЖГВ-HA + G-РСВ по сравнению с PBS. Оценка состояния эпителия бронхов мышей выявила, что в группе ЖГВ-HA + G-РСВ степень повреждения была достоверно ниже по сравнению с группой ЖГВ, тогда как для вакцинного варианта ЖГВ-HA + А-РСВ достоверной разницы не выявлено. Гистопатологическая оценка сегментов лёгких мышей после заражения РСВ показала высокую степень защиты в группах, иммунизированных векторными вакцинами ЖГВ-HA + A-РСВ и ЖГВ-HA + G-РСВ, в отличие от ФИ-РСВ | [45] |
PR8-NS-F, PR8-sF-NS | Вирус гриппа A/PR/8/34 c усечённым до 124-й аминокислоты (NS124) в состав которой включена иммуногенная кассета F-белка (фрагмент F248-290 и F409-451) с добавлением или без сигнального пептида IgGκ (для внеклеточной доставки) | Мыши BALB/c (и.н.) | Мышей однократно иммунизировали вакцинными кандидатами NS-2AF (содержит сайт 2A на N-конце РСВ-вставки), NS-2AsF (NS-2AF, который содержит IgGκ), NS-F (укороченный NS1), sF-NS (NS-F, который содержит IgGκ) в дозе 6 log10 ТЦИД50. На 28-й день заражали РСВ А2 в дозе 6 log10 БОЕ. После челленджа уровни вирусной нагрузки у иммунизированных мышей были на 1,5 log10 БОЕ/мл и 2,26 log10 БОЕ/мл меньше в группах NS-2AsF и NS-2AF соответственно по сравнению с группой неиммунизированных мышей. Во 2-м эксперименте в группе sF-NS вирусная нагрузка после челленджа была на 2 log10 БОЕ/мл меньше, чем в группе неиммунизированных мышей. В группе NS-F репродукция челлендж-вируса была сопоставима с группой неиммунизированных мышей. У мышей из группы NS-2AsF наблюдались низкие показатели воспаления и минимальная лимфоцитарная инфильтрация. Минимальные изменения в морфологии лёгочной ткани наблюдались в группе sF-NS | [46] |
Субъединичные вакцины | ||||
DS-Cav1 | Растворимая версия F-белка в конформации pre-F с антигенным сайтом Ø (poly I:C) | Мыши CB6F1/J (♀BALB/cJ + ♂ C57BL/6J (в.м.) | Мышам вводили РСВ pre-F в разных вариантах (DS, Cav1, TriC, DS-Cav1) в дозе 10 мкг с интервалом 3 нед. Во всех группах в сыворотках крови титр нейтрализующих антител против РСВ был в 4 раза выше, чем в группе РСВ post-F, и в 20 раз выше установленного защитного порога | [127] |
| Растворимая версия F-белка в конформации рre-F с антигенным сайтом Ø (poly I:C) | Макаки резус (в.м.) | Макакам вводили РСВ pre-F в разных вариантах (DS, DS-Cav1) в дозе 50 мкг с интервалом 4 нед. В группах DS и DS-Cav1 титр нейтрализующих антител был в 5–10 раз больше в сыворотках, чем в группе РСВ post-F. К 8-й неделе в группе DS-Cav1 титр нейтрализующих антител был выше, чем в группе DS, и в 60 раз выше, чем в группе РСВ post-F | [127] |
| Растворимая версия F-белка в конформа- | Африканские мартышки | Мартышек иммунизировали трижды DS-Cav1 (125 мкг) в разных объёмах с разными адъювантами. На 70-й день животных заражали РСВ в дозе 2 × 5,5 lоg10 БОЕ. В группе DS-Cav1 (введён в объёме 0,25 мл) значение пиковых РСВ титров было на 3 log10 | [128] |
| ции рre-F с антигенным сайтом Ø (наноэмульсия, Adju-Phos) |
| и 2 log10 ниже в лёгких и носовой полости, чем в контрольной группе. Была обнаружена корреляция между защитным эффектом в носовой полости и стимуляцией IgA, а также защитой в лёгких и Fc-опосредованной антительной активностью |
|
| Растворимая версия F-белка в конформации рre-F с антигенным сайтом Ø (Алюм, Poly I :C, Poly (IC:LC), MPLA, SAS, Alum + MPLA, SAS + Carbopol, Adjuplex, AddaVax) | Мыши CB6F1/J (в.м.) | Мышам вводили RSV F DS-Cav1 в комбинации с разными адъювантами 2 раза с интервалом 3 нед в дозе 10 мкг. Во всех группах не наблюдали побочные эффекты. В группах RSV F DS-Cav1 с адъювантами SAS + Carbopol наблюдались самые высокие титры нейтрализующих антител, которые были в 15 раз выше, чем в группах Алюм + MPLA и Alum, и в 5 раз выше, чем в Poly (I:C). В группах с MPLA, Alum + MPLA, AddaVax и Adjuplex фиксировали IgG1-иммунный ответ в сыворотках. Вакцинация в группах с комбинацией адъювантов SAS, SAS + Carbopol, Poly (I:C) и Poly (IC:LC) индуцировала IgG1- и IgG2a-иммунный ответ. Титр нейтрализующих антител в группе RSV F DS-Cav1 без адъюванта был ниже защитного порогового значения | [129] |
| Растворимая версия F-белка в конформации рre-F с антигенным сайтом Ø (ISA 71 VG, либо ISA 71 VG + Карбопол)) | Телята (в.м.) | Телятам вводили bRSV F DS-Cav1 с разными адъювантами 2 раза с интервалом на 4-й неделе в дозе 50 мкг. Разницы между нейтрализующими титрами в группах с адъювантом ISA 71 VG и ISA 71 VG + Carbopol не наблюдали. Эта комбинация адъювантов незначительно усиливает иммунный ответ у крупного рогатого скота | |
DPX-RSV | Внеклеточный домен SH белка РСВ (подтип А) — SHe, включённый в платформу на маслянной основе DepoVax (Pam3CSK4 и алюм) | Мыши CD-1 (в.м.) | Мышам вводили SHe в дозе 25 мкл, смешанный с алюмом (Алюм-SHe), либо в составе DPX (DPX-SHe) один либо 2 раза (с интервалом 3 нед). У мышей, иммунизированных 1 или 2 дозами DPX-SHe, титр IgG-антител был выше, чем в группе Алюм-SHe, и сохранялся в течение 20 нед после иммунизации. Иммунизация Алюм-SHe не приводила к развитию побочных реакций (снижение активности, цианоз, снижение температуры тела, сгорбленность), в отличие от группы DPX-SHe. В группе Алюм-SHe наблюдалось снижение белков комплимента (С3 и С4) и проявление реакций гиперчувствительности, в отличие от DPX-SHe | [130] |
BARS13 (Advaccine) | BARS13 (или CSA+G состоит из CSA — циклоспорин А (может индуцировать Treg) и рекомбинантного G-РСВ (укороченный) | Мыши BALB/c (в.м.) | Мышам вводили BARS13 в дозе 10 мкг 2 раза с интервалом 2 нед. Через 2 нед мышей заражали РСВ А2 в дозе 5 × 107 БОЕ. В группе BARS13 вирусная нагрузка в лёгких после челленджа была в 10 раз ниже, чем в группах ФИ-РСВ и G-белка. В группе BARS13 динамика изменения веса у мышей была сопоставима с группой мышей, которых не заражали РСВ. В лёгких мышей из группы BARS13 отсутствовали признаки гистопатологии. Защитный эффект в группе BARS13 объясняли вкладом Treg-клеток, которые был высок в БАЛ и лимфоузлах после челленджа | [131] |
BARS13 модифицировали включением в состав вакцины, вводили с РСВ pre-F. Мышей иммунизировали по 10 мкг BARS13 либо BARS13 + pre-F 2 раза с интервалом 2 нед. Через 2 нед мышей заражали РСВ в дозе 2 × 106 БОЕ. Уровни сывороточных IgG-антител были выше в группе BARS13 + pre-F, чем BARS13. В группе BARS13 + pre-F были высокие уровни Treg-клеток по сравнению с группами ФИ-РСВ и pre-F. В группе BARS13 + pre-F уровень нейтрализующих антител был выше в 6 раз, чем в группе BARS13. После челленджа РС нагрузка в лёгочной ткани в группе BARS13 + pre-F была на 10% меньше, чем в группе BARS13. Степень лёгочного воспаления в группе BARS13 + pre-F была минимальной | [132] | |||
RSVPre-F3/ | Пептид F, стабилизи рованный в конформации «до слияния» (AS01) | Кролики (в.м.) | Кроликам вводили RSVPre-F3 в одиночку либо в комбинации с вакциной Boostrix трижды. В группах RSVPreF3, RSVPreF3/AS01, RSVPreF3 +Boostrix титры IgG-антител к RSVPre-F3 были высокими. Иммунизация RSVPre-F3 не оказывала влияния на массу тела, зрение, кожные покровы, аппетит и температуру тела. Клинико-патологические изменения (увеличение лейкоцитов, нейтрофилов, фибриногена и концентрации C-реактивного белка, | [133] |
|
|
| снижение альбумина) фиксировались на следующий день после введения вакцины, и показатели приходили в норму в течение 4 нед. Кроликам вводили RSVPre-F3 за несколько недель до спаривания, во время беременности и во время лактации. Наблюдался пассивный перенос антител от иммунизированных самок крольчатам |
|
Крысы (в.м.) | Крысам вводили RSVPre-F3 за несколько недель до спаривания, во время беременности и лактации. У большинства крыс IgG к RSVPre-F3 обнаруживались перед спариванием (31/48), во время беременности (14/31) и в период лактации (16/31), и антитела передавались потомству. Иммунизация самок RSVPre-F3 не влияла на фертильность, беременность, лактацию, выживаемость и к изменениям внешних признаков висцерального и скелетного развития у потомства |
| ||
РСВ-F (NIAID, | Очищенный F-белок РСВ | Хлопковые крысы (в.м.) | Двукратная иммунизация белком в дозах 0,05–5,00 мкг приводила к образованию высоких уровней РСВ F-специфических антител, которые циркулировали в течение 6 мес после вакцинации, однако их нейтрализующая активность была низкой. Заражение крыс РСВ через 3 мес после иммунизации показало снижение вирусной нагрузки в лёгких в группе РСВ-F в 100 раз по сравнению с контрольной группой. Через 6 мес после иммунизации защита от РСВ практически отсутствовала — в группах ФИ-РСВ и РСВ-F. В группе РСВ F (5 мкг) наблюдалось состояние вакцин-индуцированного усиления заболевания после РСВ челленджа, сопоставимое с ФИ-РСВ | [134] |
Примечание. и.н. — интраназально; и.т. — интратрахеально; в.м. — внутримышечно; п.к. — подкожно; п.о. — перорально; в.б. — внутрибрюшинно; скар. — скарификация.
Таблица 2. Обзор вакцин, находящихся на разных стадиях клинических испытаний
Вакцина (разработчик) | Фаза клинических | Период | № испытания | Источник |
Рекомбинантные векторные вакцины | ||||
RSV001 (PanAd3-RSV и MVA-RSV) | Фаза I (В.; П.) | 2013–2015 | NCT01805921 | |
VXA-RSV f («Vaxart», США) | Фаза I (В.) | 2016–2018 | NCT02830932 | Нет |
ChAd155-RSV GS («GSK», Великобритания) | Фаза I (В.) Фаза I/II (141) Фаза I/II (Д) Фаза II (В. ♀) | 2016–2017 2016–2021 2018–2022 2015–2018 | NCT02491463 NCT02927873 NCT03636906 NCT02360475 | Да [58] Да [60] Нет Да [138] |
MVA-BN RSV («Bavarian Nordic BN», Дания) | Фаза I (В. П.) Фаза I (В.) Фаза II (П.) Фаза 2a (В.) Фаза III (П.) | 2015–2016 2016–2018 2016–2018 2021–2021 2022–2024 | NCT02419391 NCT02864628 NCT02873286 NCT04752644 NCT05238025 | Да [46] Да [46] Да [47] Да [139] Да [140] |
SeV/RSV (NIAID, США) | Фаза I (В.) | 2018–2019 | NCT03473002 | Да [65] |
Ad26.RSV.preF («Janssen Vaccines & | Фаза I (В.; П.) Фаза I (Д) Фаза I/2a (В.; Д) | 2016–2019 2022 2017–2022 | NCT02926430 NCT03606512 NCT03303625 | Да [141] Да [57] Да [57] |
Ad26.RSV.preF («Janssen Vaccines & | Фаза II (П.) Фаза II (В.; П.) | 2017–2021 2017–2021 | NCT03339713 NCT03334695 | Да [56] Да [142] |
rBCG-N-hRSV (Католический | Фаза I (В. ♂) | 2017–2018 | NCT03213405 | Да [143] |
RSV/Flu-01E (НИИ гриппа | Фаза I (В.; П.) Фаза II (П.) | 2022–2023 2023–2024 | РКИ 736 (NCT05970744) РКИ 694 | Нет Нет |
Ad26.RSV.FA2, Ad35.RSV.FA2 («Crucell Holland BV», Нидерланды) | Фаза I (В.) Фаза I (В.) | 2015–2016 2015–2016 | NCT02561871 NCT02440035 | Нет Нет |
Живые аттенуированные вакцины | ||||
MV-012–968 («Meissa», США) | Фаза I (В.) Фаза I (141) | 2020–2020 2021–2023 | NCT04227210 NCT04909021 | Нет Нет |
RSV MEDI ∆M2-2 (NIAID/NIH, | Фаза I (141) | 2011–2015 | NCT01459198 | Да [75] |
RSV cps2 (NIAID/NIH, MedImmune | Фаза I (141) Фаза I (141) | 2013–2015 2013–2016 | NCT01968083 NCT01852266 | Да [73] |
RSV LID ∆M2-2, | Фаза I (141) Фаза I (141) | 2014–2016 2014–2015 | NCT02040831 NCT02237209 | [76] [76] |
RSV LID/ΔM2-2/1030s | Фаза I (141) Фаза I (141) Фаза I (141) | 2020–2023 2016–2018 2015–2017 | NCT04520659 NCT02952339 NCT02794870 | Нет Да [78] Да [78] |
RSV LID cp ∆M2-2 (NIAID, США) | Фаза I (141) Фаза I (141) | 2015–2018 2015–2018 | NCT02890381 NCT02948127 | Да [144] Да [144] |
RSV D46/NS2/N/∆M2-2-HindIII | Фаза I (141) Фаза I (141) | 2017–2018 2017–2018 | NCT03102034 NCT03099291 | Да [145] Да [145] |
RSV ΔNS2/Δ1313/I1314L | Фаза I (141) Фаза I (141) | 2013–2018 2017–2022 | NCT01893554 NCT03227029 | Да [82] Да [146] |
RSV 6120/∆NS2/1030s | Фаза I (141) | 2017–2022 | NCT03387137 | Нет |
RSV 6120/∆NS1 и | Фаза I (141) | 2018–2023 | NCT03596801 | Нет |
RSV ∆NS2/∆1313/I1314L; | Фаза I и II (141) | 2019–2022 | NCT03916185 | Нет |
RSV ∆NS2/∆1313/I1314L; | Фаза I и II (141) | 2017–2020 | NCT03422237 | Да [146] |
RSV D46 cp∆M2-2, | Фаза I (141) | 2015–2019 | NCT02601612 | Нет |
MEDI-559, (MedImmune) | Фаза I и II (141) | 2008–2011 | NCT00767416 | Да [72] |
Субъединичные рекомбинантные вакцины | ||||
GSK3888550A RSVPreF3 | Фаза I (В. ♀) Фаза II (В. ♀) Фаза II (В. ♀) Фаза III (В. ♀) | 2018–2019 2019–2022 2019–2020 2020–2023 | NCT03674177 NCT04126213 NCT04138056 NCT04605159 | Да [147] Да [148] Нет Нет |
GSK3844766A RSVPreF3, | Фаза I/II (В., П.) Фаза I (П.) Фаза II (П.) Фаза III (П.) Фаза III (В., П.) Фаза III (П.) Фаза III (П.) Фаза III (П.) Фаза III (П.) Фаза III (П.) Фаза III (П.) Фаза III (П.) | 2019–2021 2019–2022 2020–2021 2021–2024 2023–наст. вр. 2021–наст. вр. 2021–2022 2021–2022 2022–2023 2022–2023 2023–2024 2023–2024 | NCT03814590 NCT04090658 NCT04657198 NCT04886596 NCT05921903 NCT04732871 NCT04841577 NCT05059301 NCT05559476 NCT05568797 NCT05590403 NCT05879107 | Да [91] Да [90] Да [92] Нет Да [93] Да [150] Да [151] Да [152] Да [153] Да [154] Нет |
RSVPreF3 («GSK», Великобритания) | Фаза I (В.) | 2014–2018 | NCT02298179 | Да [155] |
DPX-RSV(A)(Immunovaccine, США и | Фаза I (В.) | 2015–2017 | NCT02472548 | Да [89] |
RSV F DS-Cav1 | Фаза I (В.) | 2017–2020 | NCT03049488 | Да [86] |
RSVpreF Abrysvo | Фаза II (В. ♀) Фаза I/II (В., П.) Фаза 2b (В. ♀) Фаза II (П.) Фаза III (Д., В. ♀) Фаза Ib (П.) Фаза II (В. ♀) Фаза II (В.) Фаза III (П.) Фаза III (В.) Фаза III (П.) Фаза III (В., П.) | 2019–2019 2018–2021 2019–2022 2018–2021 2020–наст. вр. 2023–2023 2019–2019 2020–2021 2021–наст. вр. 2021–2022 2022–2022 2023–2024 | NCT04071158 NCT03529773 NCT04032093 NCT03572062 NCT04424316 NCT05788237 NCT04071158 NCT04785612 NCT05035212 NCT05096208 NCT05301322 NCT05842967 | Да [156] Да [158] Да [159] Да [160] Нет Да [156] Да [161] Нет Да [162] Да [163] Нет |
RSV F vaccine (RSVpreF) | Фаза I/II (П.) | 2018–2020 | NCT03572062 | Да [159] |
BARS13, (Advaccine) (Suzhou) | Фаза I (В.) Фаза II (В., П.) Фаза II (В.) | 2019–2019 2020–2023 2018–2019 | NCT04851977 NCT04681833 ACTRN12618000948291 | Да [164] Нет Нет |
Вакцины на основе вирусоподобных частиц | ||||
V306-SVLP («Virometix AG», | Фаза I (В. ♀) | 2020–2022 | NCT04519073 | Да [105] |
SynGEM («Mucosis B.V.», | Фаза I (В. ♀♂) | 2016–2017 | NCT02958540 | Да [104] |
RSV F (ResVax) | Фаза I (В.) Фаза II (В. ♀) Фаза II (В. ♀) Фаза II (В. ♀) Фаза III (В. ♀) | 2010–2011 2012–2013 2013–2014 2014–2016 2015–2020 | NCT01290419 NCT01704365 NCT01960686 NCT02247726 NCT02624947 | Да [165] Да [166] Да [167] Да [100] Да [102] |
RSV F наночастица, | Фаза I (П.) Фаза II (П.) Фаза II (П.) Фаза III (П.) Фаза II (П.) Фаза I (141) | 2012–2014 2014–2016 2015–2016 2015–2016 2017–2018 2014–2016 | NCT01709019 NCT02266628 NCT02593071 NCT02608502 NCT03026348 NCT02296463 | Да [168] Нет Нет Нет Нет Нет |
Вакцины на основе матричной РНК | ||||
mRNA-1345 | Фаза I (Д.) Фаза I (Д., В., П.) Фаза II (В. ♀) Фаза II–III (П.) | 2023–наст. вр. 2020–2024 2023–наст. вр. 2021–наст. вр. | NCT05743881 NCT04528719 NCT06143046 NCT05127434 | Нет Да [35] Нет |
RSV mRNA LNP CL-0059; LNP CL-0137 | Фаза I–II (В., П.) | 2022–наст. вр. | NCT05639894 | Нет |
Примечание. Д. — дети; П. — люди старше 50 лет; В. — взрослые (от 18 лет, верхний порог различный).
1 Innorna Announces First Participant Dosed in Phase 1 Clinical Trial of Investigational Bivalent RSV mRNA Vaccine IN006; 2024. Available at: https://innorna.com/news/330.html
2 Bavarian Nordic. Bavarian Nordic Provides Update on RSV Vaccine Program. URL: https://www.bavarian-nordic.com/ investor/news/news.aspx?news=6808
3 ClinicalTrials.gov. Dose-Ranging Trial of Safety & Immuno- genicity of an Oral Adenoviral-Vector Based RSV Vaccine (VXA- RSV-f). URL: https://clinicaltrials.gov/study/NCT02830932
Об авторах
Татьяна Сергеевна Котомина
Институт экспериментальной медицины
Автор, ответственный за переписку.
Email: kotomina@iemspb.ru
ORCID iD: 0000-0001-9999-089X
кандидат биол. наук, старший научный сотрудник лаб. иммунологии и профилактики вирусных инфекций отдела вирусологии им. А.А. Смородинцева
Россия, Санкт-ПетербургСписок литературы
- Shi T., McAllister D.A., O'Brien K.L., et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study. Lancet. 2017;390(10098):946–58. DOI: https://doi.org/10.1016/S0140-6736(17)30938-8
- Nair H., Nokes D.J., Gessner B.D., et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. Lancet. 2010;375(9725):1545–55. DOI: https://doi.org/10.1016/S0140-6736(10)60206-1
- Walsh E.E., Falsey A.R. Respiratory syncytial virus infection in adult populations. Infect. Disord. Drug Targets. 2012;12(2):98–102. DOI: https://doi.org/10.2174/187152612800100116
- Hall C.B., Walsh E.E., Long C.E., Schnabel K.C. Immunity to and frequency of reinfection with respiratory syncytial virus. J. Infect. Dis. 1991;163(4):693–8. DOI: https://doi.org/10.1093/infdis/163.4.693
- Rima B., Collins P., Easton A., et al. ICTV virus taxonomy profile: Pneumoviridae. J. Gen. Virol. 2017;98(12):2912–3. DOI: https://doi.org/10.1099/jgv.0.000959
- Kinder J.T., Moncman C.L., Barrett C., et al. Respiratory syncytial virus and human metapneumovirus infections in three-dimensional human airway tissues expose an interesting dichotomy in viral replication, spread, and inhibition by neutralizing antibodies. J. Virol. 2020;94(20):e01068-20. DOI: https://doi.org/10.1128/JVI.01068-20
- Li Y., Wang X., Blau D.M., et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic analysis. Lancet. 2022;399(10340):2047–64. DOI: https://doi.org/10.1016/S0140-6736(22)00478-0
- Cao D., Gao Y., Liang B. Structural insights into the respiratory syncytial virus RNA synthesis complexes. Viruses. 2021;13(5):834. DOI: https://doi.org/10.3390/v13050834
- Jeffree C.E., Rixon H.W., Brown G., et al. Distribution of the attachment (G) glycoprotein and GM1 within the envelope of mature respiratory syncytial virus filaments revealed using field emission scanning electron microscopy. Virology. 2003;306(2):254–67. DOI: https://doi.org/10.1016/s0042-6822(02)00016-8
- Rincheval V., Lelek M., Gault E., et al. Functional organization of cytoplasmic inclusion bodies in cells infected by respiratory syncytial virus. Nat. Commun. 2017;8(1):563. DOI: https://doi.org/10.1038/s41467-017-00655-9
- Shahriari S., Gordon J., Ghildyal R. Host cytoskeleton in respiratory syncytial virus assembly and budding. Virol. J. 2016;13(1):161. DOI: https://doi.org/10.1186/s12985-016-0618-z
- McLellan J.S., Ray W.C., Peeples M.E. Structure and function of RSV surface glycoproteins. Curr. Top. Microbiol. Immunol. 2013;372:83–104. DOI: https://doi.org/10.1007/978-3-642-38919-1_4
- Scudero O.B., Santiago V.F., Palmisano G., et al. The respiratory syncytial virus M2-2 protein is targeted for proteasome degradation and inhibits translation and stress granules assembly. PLoS One. 2023;18(7):e0289100. DOI: https://doi.org/10.1371/journal.pone.0289100
- Fontana J.M., Bankamp B., Rota P.A. Inhibition of interferon induction and signaling by paramyxoviruses. Immunol. Rev. 2008;225:46–67. DOI: https://doi.org/10.1111/j.1600-065X.2008.00669.x
- Wu W., Tran K.C., Teng M.N., et al. The interactome of the human respiratory syncytial virus NS1 protein highlights multiple effects on host cell biology. J. Virol. 2012;86(15):7777–89. DOI: https://doi.org/10.1128/JVI.00460-12
- Jung H.E., Kim T.H., Lee H.K. Contribution of dendritic cells in protective immunity against respiratory syncytial virus infection. Viruses. 2020;12(1):102. DOI: https://doi.org/10.3390/v12010102
- Chanock R., Finberg L. Recovery from infants with respiratory illness of a virus related to chimpanzee coryza agent (CCA). II. Epidemiologic aspects of infection in infants and young children. Am. J. Hyg. 1957;66(3):291–300. DOI: https://doi.org/10.1093/oxfordjournals.aje.a119902
- Connors M., Collins P.L., Firestone C.Y., Murphy B.R. Respiratory syncytial virus (RSV) F, G, M2 (22K), and N proteins each induce resistance to RSV challenge, but resistance induced by M2 and N proteins is relatively short-lived. J. Virol. 1991;65(3):1634–7. DOI: https://doi.org/10.1128/JVI.65.3.1634-1637.1991
- Graham B.S. Immunological goals for respiratory syncytial virus vaccine development. Curr. Opin. Immunol. 2019;59:57–64. DOI: https://doi.org/10.1016/j.coi.2019.03.005
- Swanson K.A., Settembre E.C., Shaw C.A., et al. Structural basis for immunization with postfusion respiratory syncytial virus fusion F glycoprotein (RSV F) to elicit high neutralizing antibody titers. Proc. Natl. Acad. Sci. USA. 2011;108(23):9619–24. DOI: https://doi.org/10.1073/pnas.1106536108
- Andreano E., Paciello I., Bardelli M., et al. The respiratory syncytial virus (RSV) prefusion F-protein functional antibody repertoire in adult healthy donors. EMBO Mol. Med. 2021;13(6):e14035. DOI: https://doi.org/10.15252/emmm.202114035
- Salk J.E. Studies in human subjects on active immunization against poliomyelitis. I. A preliminary report of experiments in progress. J. Am. Med. Assoc. 1953;151(13):1081–98.
- Chin J., Magoffin R.L., Shearer L.A., et al. Field evaluation of a respiratory syncytial virus vaccine and a trivalent parainfluenza virus vaccine in a pediatric population. Am. J. Epidemiol. 1969;89(4):449–63. DOI: https://doi.org/10.1093/oxfordjournals.aje.a120957
- Kim H.W., Canchola J.G., Brandt C.D., et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am. J. Epidemiol. 1969;89(4):422–34. DOI: https://doi.org/10.1093/oxfordjournals.aje.a120955
- Vissers M., Ahout I.M., de Jonge M.I., Ferwerda G. Mucosal IgG levels correlate better with respiratory syncytial virus load and inflammation than plasma IgG levels. Clin. Vaccine Immunol. 2015;23(3):243–5. DOI: https://doi.org/10.1128/CVI.00590-15
- Karron R.A., Buonagurio D.A., Georgiu A.F., et al. Respiratory syncytial virus (RSV) SH and G proteins are not essential for viral replication in vitro: clinical evaluation and molecular characterization of a cold-passaged, attenuated RSV subgroup B mutant. Proc. Natl. Acad. Sci. USA. 1997;94(25):13961–6. DOI: https://doi.org/10.1073/pnas.94.25.13961
- Лещинская Н.П. СЕА. Клиника и лечение гриппа и других ОРЗ. В кн.: Сборник научных трудов ВНИИ гриппа МЗ СССР. Ленинград;1982:172–7. Leshchinskaya N.P. CEA. Clinic and treatment of influenza and other acute respiratory infections. In: Collection of Scientific Papers of the All-Russian Research Institute of Influenza of the Ministry of Health of the USSR. Leningrad;1982:172–7.
- Topalidou X., Kalergis A.M., Papazisis G. Respiratory syncytial virus vaccines: A review of the candidates and the approved vaccines. Pathogens. 2023;12(10):1259. DOI: https://doi.org/10.3390/pathogens12101259
- Mazur N.I., Terstappen J., Baral R., et al. Respiratory syncytial virus prevention within reach: the vaccine and monoclonal antibody landscape. Lancet Infect. Dis. 2023;23(1):e2–21. DOI: https://doi.org/10.1016/S1473-3099(22)00291-2
- Mazur N.I., Higgins D., Nunes M.C., et al. The respiratory syncytial virus vaccine landscape: lessons from the graveyard and promising candidates. Lancet Infect. Dis. 2018;18(10):e295–311. DOI: https://doi.org/10.1016/S1473-3099(18)30292-5
- Kelleher K., Subramaniam N., Drysdale S.B. The recent landscape of RSV vaccine research. Ther. Adv. Vaccines Immunother. 2025;13:25151355241310601. DOI: https://doi.org/10.1177/25151355241310601
- Zhang G., Zhao B., Liu J. The development of animal models for respiratory syncytial virus (RSV) infection and enhanced RSV disease. Viruses. 2024;16(11):1701. DOI: https://doi.org/10.3390/v16111701
- Drysdale S.B., Thwaites R.S., Price J., et al. What have we learned from animal studies of immune responses to respiratory syncytial virus infection? J. Clin. Virol. 2024;175:105731. DOI: https://doi.org/10.1016/j.jcv.2024.105731
- Yuan M., Han Z., Liang Y., et al. mRNA nanodelivery systems: targeting strategies and administration routes. Biomater. Res. 2023;27(1):90. DOI: https://doi.org/10.1186/s40824-023-00425-3
- Shaw C.A., Mithani R., Kapoor A., et al. Safety, tolerability, and immunogenicity of an mRNA-based respiratory syncytial virus vaccine in healthy young adults in a phase 1 clinical trial. J. Infect. Dis. 2024;230(3):e637–46. DOI: https://doi.org/10.1093/infdis/jiae035
- Corbett K.S., Edwards D.K., Leist S.R., et al. SARS-CoV-2 mRNA vaccine design enabled by prototype pathogen preparedness. Nature. 2020;586(7830):567–71. DOI: https://doi.org/10.1038/s41586-020-2622-0
- Aliprantis A.O., Shaw C.A., Griffin P., et al. A phase 1, randomized, placebo-controlled study to evaluate the safety and immunogenicity of an mRNA-based RSV prefusion F protein vaccine in healthy younger and older adults. Hum. Vaccin. Immunother. 2021;17(5):1248–61. DOI: https://doi.org/10.1080/21645515.2020.1829899
- Nussbaum J., Cao X., Railkar R.A., et al. Evaluation of a stabilized RSV pre-fusion F mRNA vaccine: Preclinical studies and Phase 1 clinical testing in healthy adults. Vaccine. 2023;41(44):6488–501. DOI: https://doi.org/10.1016/j.vaccine.2023.05.062
- Oomens A.G., Bevis K.P., Wertz G.W. The cytoplasmic tail of the human respiratory syncytial virus F protein plays critical roles in cellular localization of the F protein and infectious progeny production. J. Virol. 2006;80(21):10465–77. DOI: https://doi.org/10.1128/JVI.01439-06
- Mauger D.M., Cabral B.J., Presnyak V., et al. mRNA structure regulates protein expression through changes in functional half-life. Proc. Natl. Acad. Sci. USA. 2019;116(48):24075–83. DOI: https://doi.org/10.1073/pnas.1908052116
- Wilson E., Goswami J., Baqui A.H., et al. Efficacy and safety of an mRNA-based RSV PreF vaccine in older adults. N. Engl. J. Med. 2023;389(24):2233–44. DOI: https://doi.org/10.1056/NEJMoa2307079
- Исакова-Сивак И.Н., Кореньков Д.А., Федорова Е.А. и др. Поиск иммунодоминантных эпитопов респираторно-синцитиального вируса для конструирования векторных вакцин на основе вирусов гриппа. Бюллетень экспериментальной биологии и медицины. 2016;161(4):523–7. EDN: https://elibrary.ru/vscven. Isakova-Sivak I.N., Korenkov D.A., Fedorova E.A., et al. Analysis of immune epitopes of respiratory syncytial virus for designing of vectored vaccines based on influenza virus platform. Bulletin of Experimental Biology and Medicine. 2016;161(4):533–7. DOI: https://doi.org/10.1007/s10517-016-3454-7, EDN: https://elibrary.ru/yuxboh
- Matyushenko V., Kotomina T., Kudryavtsev I., et al. Conserved T-cell epitopes of respiratory syncytial virus (RSV) delivered by recombinant live attenuated influenza vaccine viruses efficiently induce RSV-specific lung-localized memory T cells and augment influenza-specific resident memory T-cell responses. Antiviral Res. 2020;182:104864. DOI: https://doi.org/10.1016/j.antiviral.2020.104864
- Kotomina T., Isakova-Sivak I., Stepanova E., et al. Neutralizing epitope of the fusion protein of respiratory syncytial virus embedded in the HA molecule of LAIV virus is not sufficient to prevent RS virus pulmonary replication but ameliorates lung pathology following RSV infection in mice. Open Microbiol. J. 2020;14(1):147–56. DOI: https://doi.org/10.2174/1874285802014010147
- Pulkina A., Vasilyev K., Muzhikyan A., et al. IgGκ signal peptide enhances the efficacy of an influenza vector vaccine against respiratory syncytial virus infection in mice. Int. J. Mol. Sci. 2023;24(14):11445. DOI: https://doi.org/10.3390/ijms241411445
- Samy N., Reichhardt D., Schmidt D., et al. Safety and immunogenicity of novel modified vaccinia Ankara-vectored RSV vaccine: A randomized phase I clinical trial. Vaccine. 2020;38(11):2608–19. DOI: https://doi.org/10.1016/j.vaccine.2020.01.055
- Jordan E., Lawrence S.J., Meyer T.P.H., et al. Broad antibody and cellular immune response from a phase 2 clinical trial with a novel multivalent poxvirus-based respiratory syncytial virus vaccine. J. Infect. Dis. 2021;223(6):1062–72. DOI: https://doi.org/10.1093/infdis/jiaa460
- Green C.A., Scarselli E., Voysey M., et al. Safety and immunogenicity of novel respiratory syncytial virus (RSV) vaccines based on the RSV viral proteins F, N and M2-1 encoded by simian adenovirus (PanAd3-RSV) and MVA (MVA-RSV); protocol for an open-label, dose-escalation, single-centre, phase 1 clinical trial in healthy adults. BMJ Open. 2015;5(10):e008748. DOI: https://doi.org/10.1136/bmjopen-2015-008748
- Green C.A., Scarselli E., Sande C.J., et al. Chimpanzee adenovirus- and MVA-vectored respiratory syncytial virus vaccine is safe and immunogenic in adults. Sci. Transl. Med. 2015;7(300):300ra126. DOI: https://doi.org/10.1126/scitranslmed.aac5745
- Pierantoni A., Esposito M.L., Ammendola V., et al. Mucosal delivery of a vectored RSV vaccine is safe and elicits protective immunity in rodents and nonhuman primates. Mol. Ther. Methods Clin. Dev. 2015;2:15018. DOI: https://doi.org/10.1038/mtm.2015.18
- Shan J., Britton P.N., King C.L., Booy R. The immunogenicity and safety of respiratory syncytial virus vaccines in development: A systematic review. Influenza Other Respir. Viruses. 2021;15(4):539–51. DOI: https://doi.org/10.1111/irv.12850
- Green C.A., Sande C.J., Scarselli E., et al. Novel genetically-modified chimpanzee adenovirus and MVA-vectored respiratory syncytial virus vaccine safely boosts humoral and cellular immunity in healthy older adults. J. Infect. 2019;78(5):382–92. DOI: https://doi.org/10.1016/j.jinf.2019.02.003
- Rezaee F., Linfield D.T., Harford T.J., Piedimonte G. Ongoing developments in RSV prophylaxis: a clinician's analysis. Curr. Opin. Virol. 2017;24:70–8. DOI: https://doi.org/10.1016/j.coviro.2017.03.015
- Widjojoatmodjo M.N., Bogaert L., Meek B., et al. Recombinant low-seroprevalent adenoviral vectors Ad26 and Ad35 expressing the respiratory syncytial virus (RSV) fusion protein induce protective immunity against RSV infection in cotton rats. Vaccine. 2015;33(41):5406–14. DOI: https://doi.org/10.1016/j.vaccine.2015.08.056
- Comeaux C.A., Bart S., Bastian A.R., et al. Safety, immunogenicity, and regimen selection of Ad26.RSV.preF-based vaccine combinations: a randomized, double-blind, placebo-controlled, phase 1/2a study. J. Infect. Dis. 2024;229(1):19–29. DOI: https://doi.org/10.1093/infdis/jiad220
- Sadoff J., De Paepe E., Haazen W., et al. Safety and immunogenicity of the Ad26.RSV.preF investigational vaccine coadministered with an influenza vaccine in older adults. J. Infect. Dis. 2021;223(4):699–708. DOI: https://doi.org/10.1093/infdis/jiaa409
- Stuart A.S.V., Virta M., Williams K., et al. Phase 1/2a safety and immunogenicity of an adenovirus 26 vector respiratory syncytial virus (RSV) vaccine encoding prefusion F in adults 18–50 years and RSV-seropositive children 12–24 months. J. Infect. Dis. 2022;227(1):71–82. DOI: https://doi.org/10.1093/infdis/jiac407
- Cicconi P., Jones C., Sarkar E., et al. First-in-human randomized study to assess the safety and immunogenicity of an investigational respiratory syncytial virus (RSV) vaccine based on chimpanzee-adenovirus-155 viral vector-expressing RSV fusion, nucleocapsid, and antitermination viral proteins in healthy adults. Clin. Infect. Dis. 2020;70(10):2073–81. DOI: https://doi.org/10.1093/cid/ciz653
- Lee L.Y., Ha do L.A., Simmons C., et al. Memory T cells established by seasonal human influenza A infection cross-react with avian influenza A (H5N1) in healthy individuals. J. Clin. Invest. 2008;118(10):3478–90. DOI: https://doi.org/10.1172/JCI32460
- Díez-Domingo J., Sáez-Llorens X., Rodriguez-Weber M.A., et al. Safety and immunogenicity of a ChAd155-vectored respiratory syncytial virus (RSV) vaccine in healthy RSV-seropositive children 12–23 months of age. J. Infect. Dis. 2023;227(11):1293–302. DOI: https://doi.org/10.1093/infdis/jiac481
- Saez-Llorens X., Norero X., Mussi-Pinhata M.M., et al. Safety and immunogenicity of a ChAd155-vectored respiratory syncytial virus vaccine in infants 6-7 months of age: a phase 1/2 randomized trial. J. Infect. Dis. 2024;229(1):95–107. DOI: https://doi.org/10.1093/infdis/jiad271
- Haller A.A., Miller T., Mitiku M., Coelingh K. Expression of the surface glycoproteins of human parainfluenza virus type 3 by bovine parainfluenza virus type 3, a novel attenuated virus vaccine vector. J. Virol. 2000;74(24):11626–35. DOI: https://doi.org/10.1128/jvi.74.24.11626-11635.2000
- Gomez M., Mufson M.A., Dubovsky F., et al. Phase-I study MEDI-534, of a live, attenuated intranasal vaccine against respiratory syncytial virus and parainfluenza-3 virus in seropositive children. Pediatr. Infect. Dis. J. 2009;28(7):655–8. DOI: https://doi.org/10.1097/INF.0b013e318199c3b1
- Bernstein D.I., Malkin E., Abughali N., et al. Phase 1 study of the safety and immunogenicity of a live, attenuated respiratory syncytial virus and parainfluenza virus type 3 vaccine in seronegative children. Pediatr. Infect. Dis. J. 2012;31(2):109–14. DOI: https://doi.org/10.1097/INF.0b013e31823386f1
- Scaggs Huang F., Bernstein D.I., Slobod K.S., et al. Safety and immunogenicity of an intranasal sendai virus-based vaccine for human parainfluenza virus type I and respiratory syncytial virus (SeVRSV) in adults. Hum. Vaccin. Immunother. 2021;17(2):554–9. DOI: https://doi.org/10.1080/21645515.2020.1779517
- Wright P.F., Karron R.A., Belshe R.B., et al. Evaluation of a live, cold-passaged, temperature-sensitive, respiratory syncytial virus vaccine candidate in infancy. J. Infect. Dis. 2000; 182(5):1331–42. DOI: https://doi.org/10.1086/315859
- Karron R.A., Wright P.F., Belshe R.B., et al. Identification of a recombinant live attenuated respiratory syncytial virus vaccine candidate that is highly attenuated in infants. J. Infect. Dis. 2005;191(7):1093–104. DOI: https://doi.org/10.1086/427813
- Wright P.F., Karron R.A., Belshe R.B., et al. The absence of enhanced disease with wild type respiratory syncytial virus infection occurring after receipt of live, attenuated, respiratory syncytial virus vaccines. Vaccine. 2007;25(42):7372–8. DOI: https://doi.org/10.1016/j.vaccine.2007.08.014
- Soto J.A., Stephens L.M., Waldstein K.A., et al. Current insights in the development of efficacious vaccines against RSV. Front. Immunol. 2020;11:1507. DOI: https://doi.org/10.3389/fimmu.2020.01507
- Karron R.A., Buchholz U.J., Collins P.L. Live-attenuated respiratory syncytial virus vaccines. Curr. Top. Microbiol. Immunol. 2013;372:259–84. DOI: https://doi.org/10.1007/978-3-642-38919-1_13
- Schickli J.H., Kaur J., Tang R.S. Nonclinical phenotypic and genotypic analyses of a Phase 1 pediatric respiratory syncytial virus vaccine candidate MEDI-559 (rA2cp248/404/1030ΔSH) at permissive and non-permissive temperatures. Virus Res. 2012;169(1):38–47. DOI: https://doi.org/10.1016/j.virusres.2012.06.027
- Malkin E., Yogev R., Abughali N., et al. Safety and immunogenicity of a live attenuated RSV vaccine in healthy RSV-seronegative children 5 to 24 months of age. PLoS One. 2013;8(10):e77104. DOI: https://doi.org/10.1371/journal.pone.0077104
- Buchholz U.J., Cunningham C.K., Muresan P., et al. Live respiratory syncytial virus (RSV) vaccine candidate containing stabilized temperature-sensitivity mutations is highly attenuated in RSV-seronegative infants and children. J. Infect. Dis. 2018;217(9):1338–46. DOI: https://doi.org/10.1093/infdis/jiy066
- Bermingham A., Collins P.L. The M2-2 protein of human respiratory syncytial virus is a regulatory factor involved in the balance between RNA replication and transcription. Proc. Natl. Acad. Sci. USA. 1999;96(20):11259–64. DOI: https://doi.org/10.1073/pnas.96.20.11259
- Karron R.A., Luongo C., Thumar B., et al. A gene deletion that up-regulates viral gene expression yields an attenuated RSV vaccine with improved antibody responses in children. Sci. Transl. Med. 2015;7(312):312ra175. DOI: https://doi.org/10.1126/scitranslmed.aac8463
- McFarland E.J., Karron R.A., Muresan P., et al. Live-attenuated respiratory syncytial virus vaccine candidate with deletion of RNA synthesis regulatory protein M2-2 is highly immunogenic in children. J. Infect. Dis. 2018;217(9):1347–55. DOI: https://doi.org/10.1093/infdis/jiy040
- Bukreyev A., Belyakov I.M., Berzofsky J.A., et al. Granulocyte-macrophage colony-stimulating factor expressed by recombinant respiratory syncytial virus attenuates viral replication and increases the level of pulmonary antigen-presenting cells. J. Virol. 2001;75(24):12128–40. DOI: https://doi.org/10.1128/JVI.75.24.12128-12140.2001
- McFarland E.J., Karron R.A., Muresan P., et al. Live respiratory syncytial virus attenuated by M2-2 deletion and stabilized temperature sensitivity mutation 1030s is a promising vaccine candidate in children. J. Infect. Dis. 2020;221(4):534–43. DOI: https://doi.org/10.1093/infdis/jiz603
- Stobart C.C., Rostad C.A., Ke Z., et al. A live RSV vaccine with engineered thermostability is immunogenic in cotton rats despite high attenuation. Nat. Commun. 2016;7:13916. DOI: https://doi.org/10.1038/ncomms13916
- Mirzaei H., Faghihloo E. Viruses as key modulators of the TGF‐β pathway; a double‐edged sword involved in cancer. Rev. Med. Virol. 2018;28(2):e1967. DOI: https://doi.org/10.1002/rmv.1967
- Bakre A., Wu W., Hiscox J., et al. Human respiratory syncytial virus non-structural protein NS1 modifies miR-24 expression via transforming growth factor-β. J. Gen. Virol. 2015;96(11):3179–91. DOI: https://doi.org/10.1099/jgv.0.000261
- Karron R.A., Luongo C., Mateo J.S., et al. Safety and immunogenicity of the respiratory syncytial virus vaccine RSV/ΔNS2/Δ1313/I1314L in RSV-seronegative children. J. Infect. Dis. 2020;222(1):82–91. DOI: https://doi.org/10.1093/infdis/jiz408
- Rossey I., Saelens X. Vaccines against human respiratory syncytial virus in clinical trials, where are we now? Expert. Rev. Vaccines. 2019;18(10):1053–67. DOI: https://doi.org/10.1080/14760584.2019.1675520
- Brito L.A., O'Hagan D.T. Designing and building the next generation of improved vaccine adjuvants. J. Control Release. 2014;190:563–79. DOI: https://doi.org/10.1016/j.jconrel.2014.06.027
- Delgado M.F., Coviello S., Monsalvo A.C., et al. Lack of antibody affinity maturation due to poor Toll-like receptor stimulation leads to enhanced respiratory syncytial virus disease. Nat. Med. 2009;15(1):34–41. DOI: https://doi.org/10.1038/nm.1894
- Graham B.S. Biological challenges and technological opportunities for respiratory syncytial virus vaccine development. Immunol. Rev. 2011;239(1):149–66. DOI: https://doi.org/10.1111/j.1600-065X.2010.00972.x
- Crank M.C., Ruckwardt T.J., Chen M., et al. A proof of concept for structure-based vaccine design targeting RSV in humans. Science. 2019;365(6452):505–9. DOI: https://doi.org/10.1126/science.aav9033
- Ruckwardt T.J., Morabito K.M., Phung E., et al. Safety, tolerability, and immunogenicity of the respiratory syncytial virus prefusion F subunit vaccine DS-Cav1: a phase 1, randomised, open-label, dose-escalation clinical trial. Lancet Respir. Med. 2021;9(10):1111–20. DOI: https://doi.org/10.1016/S2213-2600(21)00098-9
- Langley J.M., MacDonald L.D., Weir G.M., et al. A respiratory syncytial virus vaccine based on the small hydrophobic protein ectodomain presented with a novel lipid-based formulation is highly immunogenic and safe in adults: a first-in-humans study. J. Infect. Dis. 2018;218(3):378–87. DOI: https://doi.org/10.1093/infdis/jiy177
- Kotb S., Haranaka M., Folschweiller N., et al. Safety and immunogenicity of a respiratory syncytial virus prefusion F protein (RSVPreF3) candidate vaccine in older Japanese adults: A phase I, randomized, observer-blind clinical trial. Respir. Investig. 2023;61(2):261–9. DOI: https://doi.org/10.1016/j.resinv.2022.11.003
- Leroux-Roels I., Davis M.G., Steenackers K., et al. Safety and immunogenicity of a respiratory syncytial virus prefusion F (RSVPreF3) candidate vaccine in older adults: phase 1/2 randomized clinical trial. J. Infect. Dis. 2023;227(6):761–72. DOI: https://doi.org/10.1093/infdis/jiac327
- Leroux-Roels I., Van Ranst M., Vandermeulen C., et al. Safety and immunogenicity of a revaccination with a respiratory syncytial virus prefusion F vaccine in older adults: a phase 2b study. J. Infect. Dis. 2024;229(2):355–66. DOI: https://doi.org/10.1093/infdis/jiad321
- Schwarz T.F., Hwang S.J., Ylisastigui P., et al. Immunogenicity and safety following 1 dose of AS01E-adjuvanted respiratory syncytial virus prefusion F protein vaccine in older adults: a phase 3 trial. J. Infect. Dis. 2024;230(1):e102–10. DOI: https://doi.org/10.1093/infdis/jiad546
- Ison M.G., Papi A., Athan E., et al. Efficacy and safety of respiratory syncytial virus (RSV) prefusion F protein vaccine (RSVPreF3 OA) in older adults over 2 RSV seasons. Clin. Infect. Dis. 2024;78(6):1732–44. DOI: https://doi.org/10.1093/cid/ciae010
- Walsh E.E., Falsey A.R., Scott D.A., et al. A Randomized phase 1/2 study of a respiratory syncytial virus prefusion F vaccine. J. Infect. Dis. 2022;225(8):1357–66. DOI: https://doi.org/10.1093/infdis/jiab612
- Kampmann B., Madhi S.A., Munjal I., et al. Bivalent prefusion F vaccine in pregnancy to prevent RSV illness in infants. N. Engl. J. Med. 2023;388(16):1451–64. DOI: https://doi.org/10.1056/NEJMoa2216480
- Walsh E.E., Perez Marc G., Zareba A.M., et al. Efficacy and safety of a bivalent RSV prefusion F vaccine in older adults. N. Engl. J. Med. 2023;388(16):1465–77. DOI: https://doi.org/10.1056/NEJMoa2213836
- Davis M., Towner W., DeHaan E., et al. Bivalent RSVpreF vaccine in adults 18 to <60 years old with high-risk conditions. Clin. Infect. Dis. 2024;ciae550. DOI: https://doi.org/10.1093/cid/ciae550
- Jeong H., Seong B.L. Exploiting virus-like particles as innovative vaccines against emerging viral infections. J. Microbiol. 2017;55(3):220–30. DOI: https://doi.org/10.1007/s12275-017-7058-3
- Muňoz F.M., Swamy G.K., Hickman S.P., et al. Safety and immunogenicity of a respiratory syncytial virus fusion (F) protein nanoparticle vaccine in healthy third-trimester pregnant women and their infants. J. Infect. Dis. 2019;220(11):1802–15. DOI: https://doi.org/10.1093/infdis/jiz390
- Madhi S.A., Polack F.P., Piedra P.A., et al. Respiratory syncytial virus vaccination during pregnancy and effects in infants. N. Engl. J. Med. 2020;383(5):426–39. DOI: https://doi.org/10.1056/NEJMoa1908380
- Van Braeckel-Budimir N., Haijema B.J., Leenhouts K. Bacterium-like particles for efficient immune stimulation of existing vaccines and new subunit vaccines in mucosal applications. Front. Immunol. 2013;4:282. DOI: https://doi.org/10.3389/fimmu.2013.00282
- Rigter A., Widjaja I., Versantvoort H., et al. A protective and safe intranasal RSV vaccine based on a recombinant prefusion-like form of the F protein bound to bacterium-like particles. PLoS One. 2013;8(8):e71072. DOI: https://doi.org/10.1371/journal.pone.0071072
- Ascough S., Vlachantoni I., Kalyan M., et al. Local and systemic immunity against respiratory syncytial virus induced by a novel intranasal vaccine. A randomized, double-blind, placebo-controlled clinical trial. Am. J. Respir. Crit. Care Med. 2019;200(4):481–92. DOI: https://doi.org/10.1164/rccm.201810-1921OC
- Leroux-Roels I., Bruhwyler J., Stergiou L., et al. Double-blind, placebo-controlled, dose-escalating study evaluating the safety and immunogenicity of an epitope-specific chemically defined nanoparticle RSV vaccine. Vaccines (Basel). 2023;11(2):367. DOI: https://doi.org/10.3390/vaccines11020367
- Noble M., Khan R.A., Walker B., et al. Respiratory syncytial virus-associated hospitalisation in children aged https://doi.org/10.1183/23120541.00593-2021
- Coultas J.A., Smyth R., Openshaw P.J. Respiratory syncytial virus (RSV): a scourge from infancy to old age. Thorax. 2019;74(10):986–93. DOI: https://doi.org/10.1136/thoraxjnl-2018-212212
- Shahabi A., Peneva D., Incerti D., et al. Assessing variation in the cost of palivizumab for respiratory syncytial virus prevention in preterm infants. Pharmacoecon. Open. 2018;2(1):53–61. DOI: https://doi.org/10.1007/s41669-017-0042-3
- Keam S.J. Nirsevimab: first approval. Drugs. 2023;83(2):181–7. DOI: https://doi.org/10.1007/s40265-022-01829-6
- Mueller S., Stauft C.B., Kalkeri R., et al. A codon-pair deoptimized live-attenuated vaccine against respiratory syncytial virus is immunogenic and efficacious in non-human primates. Vaccine. 2020;38(14):2943–8. DOI: https://doi.org/10.1016/j.vaccine.2020.02.056
- Widjojoatmodjo M.N., Boes J., van Bers M., et al. A highly attenuated recombinant human respiratory syncytial virus lacking the G protein induces long-lasting protection in cotton rats. Virol. J. 2010;7:114. DOI: https://doi.org/10.1186/1743-422X-7-114
- Luongo C., Winter C.C., Collins P.L., Buchholz U.J. Increased genetic and phenotypic stability of a promising live-attenuated respiratory syncytial virus vaccine candidate by reverse genetics. J. Virol. 2012;86(19):10792–804. DOI: https://doi.org/10.1128/JVI.01227-12
- Luongo C., Winter C.C., Collins P.L., Buchholz U.J. Respiratory syncytial virus modified by deletions of the NS2 gene and amino acid S1313 of the L polymerase protein is a temperature-sensitive, live-attenuated vaccine candidate that is phenotypically stable at physiological temperature. J. Virol. 2013;87(4):1985–96. DOI: https://doi.org/10.1128/JVI.02769-12
- Endt K., Wollmann Y., Haug J., et al. A recombinant MVA-based RSV vaccine induces T-cell and antibody responses that cooperate in the protection against RSV infection. Front. Immunol. 2022;13:841471. DOI: https://doi.org/10.3389/fimmu.2022.841471
- Taylor G., Thom M., Capone S., et al. Efficacy of a virus-vectored vaccine against human and bovine respiratory syncytial virus infections. Sci. Transl. Med. 2015;7(300):300ra127. DOI: https://doi.org/10.1126/scitranslmed.aac5757
- Saeland E., van der Fits L., Bolder R., et al. Immunogenicity and protective efficacy of adenoviral and subunit RSV vaccines based on stabilized prefusion F protein in pre-clinical models. Vaccine. 2022;40(6):934–44. DOI: https://doi.org/10.1016/j.vaccine.2021.12.043
- Joyce C., Scallan C.D., Mateo R., et al. Orally administered adenoviral-based vaccine induces respiratory mucosal memory and protection against RSV infection in cotton rats. Vaccine. 2018;36(29):4265–77. DOI: https://doi.org/10.1016/j.vaccine.2018.05.112
- de Jong R., Stockhofe-Zurwieden N., Bonsing J., et al. ChAd155-RSV vaccine is immunogenic and efficacious against bovine RSV infection-induced disease in young calves. Nat. Commun. 2022;13(1):6142. DOI: https://doi.org/10.1038/s41467-022-33649-3
- Jones B.G., Sealy R.E., Rudraraju R., et al. Sendai virus-based RSV vaccine protects African green monkeys from RSV infection. Vaccine. 2012;30(5):959–68. DOI: https://doi.org/10.1016/j.vaccine.2011.11.046
- Cespedes P.F., Rey-Jurado E., Espinoza J.A., et al. A single, low dose of a cGMP recombinant BCG vaccine elicits protective T cell immunity against the human respiratory syncytial virus infection and prevents lung pathology in mice. Vaccine. 2017;35(5):757–66. DOI: https://doi.org/10.1016/j.vaccine.2016.12.048
- Bueno S.M., Gonzalez P.A., Cautivo K.M., et al. Protective T cell immunity against respiratory syncytial virus is efficiently induced by recombinant BCG. Proc. Natl. Acad. Sci. USA. 2008;105(52):20822–7. DOI: https://doi.org/10.1073/pnas.0806244105
- Cautivo K.M., Bueno S.M., Cortes C.M., et al. Efficient lung recruitment of respiratory syncytial virus-specific Th1 cells induced by recombinant bacillus Calmette-Guerin promotes virus clearance and protects from infection. J. Immunol. 2010;185(12):7633–45. DOI: https://doi.org/10.4049/jimmunol.0903452
- Diaz F.E., Guerra-Maupome M., McDonald P.O., et al. A recombinant BCG vaccine is safe and immunogenic in neonatal calves and reduces the clinical disease caused by the respiratory syncytial virus. Front. Immunol. 2021;12:664212. DOI: https://doi.org/10.3389/fimmu.2021.664212
- Olszewska W., Suezer Y., Sutter G., Openshaw P.J. Protective and disease-enhancing immune responses induced by recombinant modified vaccinia Ankara (MVA) expressing respiratory syncytial virus proteins. Vaccine. 2004;23(2):215–21. DOI: https://doi.org/10.1016/j.vaccine.2004.05.015
- Bembridge G.P., Garcia-Beato R., Lopez J.A., et al. Subcellular site of expression and route of vaccination influence pulmonary eosinophilia following respiratory syncytial virus challenge in BALB/c mice sensitized to the attachment G protein. J. Immunol. 1998;161(5):2473–80.
- Kotomina T., Isakova-Sivak I., Matyushenko V., et al. Recombinant live attenuated influenza vaccine viruses carrying CD8 T-cell epitopes of respiratory syncytial virus protect mice against both pathogens without inflammatory disease. Antiviral Res. 2019;168:9–17. DOI: https://doi.org/10.1016/j.antiviral.2019.05.001
- McLellan J.S., Chen M.., Joyce MG., et al. Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science. 2013;342(6158):592–8. DOI: https://doi.org/10.1126/science.1243283
- Zohar T., Hsiao J.C., Mehta N., et al. Upper and lower respiratory tract correlates of protection against respiratory syncytial virus following vaccination of nonhuman primates. Cell Host Microbe. 2022;30(1):41–52.e5. DOI: https://doi.org/10.1016/j.chom.2021.11.006
- Sastry M., Zhang B., Chen M., et al. Adjuvants and the vaccine response to the DS-Cav1-stabilized fusion glycoprotein of respiratory syncytial virus. PLoS One. 2017;12(10):e0186854. DOI: https://doi.org/10.1371/journal.pone.0186854
- MacDonald L.D., MacKay A., Kaliaperumal V., et al. Type III hypersensitivity reactions to a B cell epitope antigen are abrogated using a depot forming vaccine platform. Hum. Vaccin. Immunother. 2018;14(1):59–66. DOI: https://doi.org/10.1080/21645515.2017.1375637
- Li C., Zhou X., Zhong Y., et al. A recombinant G protein plus cyclosporine A-based respiratory syncytial virus vaccine elicits humoral and regulatory T cell responses against infection without vaccine-enhanced disease. J. Immunol. 2016;196(4):1721–31. DOI: https://doi.org/10.4049/jimmunol.1502103
- Su C., Zhong Y., Zhao G., et al. RSV pre-fusion F protein enhances the G protein antibody and anti-infectious responses. NPJ Vaccines. 2022;7(1):168. DOI: https://doi.org/10.1038/s41541-022-00591-w
- Stokes A.H., Franklin K., Fisher D.E., et al. Repeated dose toxicity study and developmental and reproductive toxicology studies of a respiratory syncytial virus candidate vaccine in rabbits and rats. Int. J. Toxicol. 2021;40(2):125–42. DOI: https://doi.org/10.1177/1091581820985782
- Murphy B.R., Sotnikov A.V., Lawrence L.A., et al. Enhanced pulmonary histopathology is observed in cotton rats immunized with formalin-inactivated respiratory syncytial virus (RSV) or purified F glycoprotein and challenged with RSV 3-6 months after immunization. Vaccine. 1990;8(5):497–502. DOI: https://doi.org/10.1016/0264-410x(90)90253-i
- Zuniga A., Rassek O., Vrohlings M., et al. An epitope-specific chemically defined nanoparticle vaccine for respiratory syncytial virus. NPJ Vaccines. 2021;6(1):85. DOI: https://doi.org/10.1038/s41541-021-00347-y
- Marcandalli J., Fiala B., Ols S., et al. Induction of potent neutralizing antibody responses by a designed protein nanoparticle vaccine for respiratory syncytial virus. Cell. 2019;176(6):1420-31.e17. DOI: https://doi.org/10.1016/j.cell.2019.01.046
- Петухова Г.Д., Найхин А.Н., Баранцева И.Б. и др. Локальный гумморальный и клеточный иммунный ответ мышей при гриппозной инфекции и вакцинации. Медицинская иммунология. 2006;8(4):511–6. Petukhova G.D., Naikhin A.N., Barantseva I.B., et al. Local antibody and cellular immune responses to influenza infection and vaccination. Medical Immunology (Russia). 2006;8(4):511–6. EDN: https://elibrary.ru/hspxqz
- Beran J., Lickliter J.D., Schwarz T.F., et al. Safety and immunogenicity of 3 formulations of an investigational respiratory syncytial virus vaccine in nonpregnant women: results from 2 phase 2 trials. J. Infect. Dis. 2018;217(10):1616–25. DOI: https://doi.org/10.1093/infdis/jiy065
- Jordan E., Kabir G., Schultz S., et al. Decreased viral load, symptom reduction, and prevention of respiratory syncytial virus infection with MVA-BN-RSV vaccine. 2022. medRxiv. Preprint. DOI: https://doi.org/10.1101/2022.12.02.22283030
- Jordan E., Kabir G., Schultz S., et al. Reduced respiratory syncytial virus load, symptoms, and infections: a human challenge trial of MVA-BN-RSV vaccine. J. Infect. Dis. 2023;228(8):999–1011. DOI: https://doi.org/10.1093/infdis/jiad108
- Williams K., Bastian A.R., Feldman R.A., et al. Phase 1 safety and immunogenicity study of a respiratory syncytial virus vaccine with an adenovirus 26 vector encoding prefusion F (Ad26.RSV.preF) in adults aged ≥60 years. J. Infect. Dis. 2020;222(6):979–88. DOI: https://doi.org/10.1093/infdis/jiaa193
- Sadoff J., De Paepe E., DeVincenzo J., et al. Prevention of respiratory syncytial virus infection in healthy adults by a single immunization of Ad26.RSV.preF in a human challenge study. J. Infect. Dis. 2022;226(3):396–406. DOI: https://doi.org/10.1093/infdis/jiab003
- Abarca K., Rey-Jurado E., Munoz-Durango N., et al. Safety and immunogenicity evaluation of recombinant BCG vaccine against respiratory syncytial virus in a randomized, double-blind, placebo-controlled phase I clinical trial. EClinicalMedicine. 2020;27:100517. DOI: https://doi.org/10.1016/j.eclinm.2020.100517
- Cunningham C.K., Karron R., Muresan P., et al. Live-attenuated respiratory syncytial virus vaccine with deletion of RNA synthesis regulatory protein M2-2 and cold passage mutations is overattenuated. Open Forum Infect. Dis. 2019;6(6):ofz212. DOI: https://doi.org/10.1093/ofid/ofz212
- McFarland E.J., Karron R.A., Muresan P., et al. Live-attenuated respiratory syncytial virus vaccine with M2-2 deletion and with small hydrophobic noncoding region is highly immunogenic in children. J. Infect. Dis. 2020;221(12):2050–9. DOI: https://doi.org/10.1093/infdis/jiaa049
- Cunningham C.K., Karron R.A., Muresan P., et al. Evaluation of recombinant live-attenuated respiratory syncytial virus (RSV) vaccines RSV/DeltaNS2/Delta1313/I1314L and RSV/276 in RSV-seronegative children. J. Infect. Dis. 2022;226(12):2069–78. DOI: https://doi.org/10.1093/infdis/jiac253
- Schwarz T.F., Johnson C., Grigat C., et al. Three dose levels of a maternal respiratory syncytial virus vaccine candidate are well tolerated and immunogenic in a randomized trial in nonpregnant women. J. Infect. Dis. 2022;225(12):2067–76. DOI: https://doi.org/10.1093/infdis/jiab317
- Bebia Z., Reyes O., Jeanfreau R., et al. Safety and immunogenicity of an investigational respiratory syncytial virus vaccine (RSVPreF3) in mothers and their infants: a phase 2 randomized trial. J. Infect. Dis. 2023;228(3):299–310. DOI: https://doi.org/10.1093/infdis/jiad024
- Papi A., Ison M.G., Langley J.M., et al. Respiratory syncytial virus prefusion F protein vaccine in older adults. N. Engl. J. Med. 2023;388(7):595–608. DOI: https://doi.org/10.1056/NEJMoa2209604
- Chandler R., Montenegro N., Llorach C., et al. Immunogenicity, reactogenicity, and safety of AS01E-adjuvanted RSV prefusion F protein-based candidate vaccine (RSVPreF3 OA) when co-administered with a seasonal quadrivalent influenza vaccine in older adults: results of a phase 3, open-label, randomized controlled trial. Clin. Infect. Dis. 2024;ciad786. DOI: https://doi.org/10.1093/cid/ciad786
- Ferguson M., Murray A., Pliamm L., et al. Lot-to-lot immunogenicity consistency of the respiratory syncytial virus prefusion F protein vaccine in older adults. Vaccine X. 2024;18:100494. DOI: https://doi.org/10.1016/j.jvacx.2024.100494
- Buynak R., Cannon K., DeAtkine D., et al. Randomized, open-label phase 3 study evaluating immunogenicity, safety, and reactogenicity of RSVPreF3 OA coadministered with FLU-QIV-HD in adults aged ≥65. Infect. Dis. Ther. 2024;13(8):1789–805. DOI: https://doi.org/10.1007/s40121-024-00985-4
- Clark R., Davies S., Labrador J., et al. Safety and immunogenicity of respiratory syncytial virus prefusion F protein vaccine when co-administered with adjuvanted seasonal quadrivalent influenza vaccine in older adults: a phase 3 randomized trial. Clin. Infect. Dis. 2024;79(4):1088–98. DOI: https://doi.org/10.1093/cid/ciae365
- Ferguson M., Schwarz T.F., Nunez S.A., et al. Noninferior immunogenicity and consistent safety of respiratory syncytial virus prefusion F protein vaccine in adults 50-59 years compared to ≥60 years of age. Clin. Infect. Dis. 2024;79(4):1074–84. DOI: https://doi.org/10.1093/cid/ciae364
- Leroux-Roels G., De Boever F., Maes C., et al. Safety and immunogenicity of a respiratory syncytial virus fusion glycoprotein F subunit vaccine in healthy adults: Results of a phase 1, randomized, observer-blind, controlled, dosage-escalation study. Vaccine. 2019;37(20):2694–703. DOI: https://doi.org/10.1016/j.vaccine.2019.04.011
- Peterson J.T., Zareba A.M., Fitz-Patrick D., et al. Safety and immunogenicity of a respiratory syncytial virus prefusion F vaccine when coadministered with a tetanus, diphtheria, and acellular pertussis vaccine. J. Infect. Dis. 2022;225(12):2077–86. DOI: https://doi.org/10.1093/infdis/jiab505
- Falsey A.R., Walsh E.E., Scott D.A., et al. Phase 1/2 randomized study of the immunogenicity, safety, and tolerability of a respiratory syncytial virus prefusion F vaccine in adults with concomitant inactivated influenza vaccine. J. Infect. Dis. 2022;225(12):2056–66. DOI: https://doi.org/10.1093/infdis/jiab611
- Simões E.A.F., Center K.J., Tita A.T.N., et al. Prefusion F protein-based respiratory syncytial virus immunization in pregnancy. N. Engl. J. Med. 2022;386(17):1615–26. DOI: https://doi.org/10.1056/NEJMoa2106062
- Baber J., Arya M., Moodley Y., et al. A phase 1/2 study of a respiratory syncytial virus prefusion F vaccine with and without adjuvant in healthy older adults. J. Infect. Dis. 2022;226(12):2054–63. DOI: https://doi.org/10.1093/infdis/jiac189
- Ginsburg A.S., Srikantiah P. Respiratory syncytial virus: promising progress against a leading cause of pneumonia. Lancet Glob. Health. 2021;9(12):e1644–5. DOI: https://doi.org/10.1016/S2214-109X(21)00455-1
- Schmoele-Thoma B., Zareba A.M., Jiang Q., et al. Vaccine efficacy in adults in a respiratory syncytial virus challenge study. N. Engl. J. Med. 2022;386(25):2377–86. DOI: https://doi.org/10.1056/NEJMoa2116154
- Baker J., Aliabadi N., Munjal I., et al. Equivalent immunogenicity across three RSVpreF vaccine lots in healthy adults 18-49 years of age: Results of a randomized phase 3 study. Vaccine. 2024;42(13):3172–9. DOI: https://doi.org/10.1016/j.vaccine.2024.03.070
- Athan E., Baber J., Quan K., et al. Safety and immunogenicity of bivalent RSVpreF vaccine coadministered with seasonal inactivated influenza vaccine in older adults. Clin. Infect. Dis. 2024;78(5):1360–8. DOI: https://doi.org/10.1093/cid/ciad707
- Cheng X., Zhao G., Dong A., et al. A First-in-Human Trial to Evaluate the Safety and Immunogenicity of a G Protein-Based Recombinant Respiratory Syncytial Virus Vaccine in Healthy Adults 18–45 Years of Age. Vaccines (Basel). 2023;11(5):999. DOI: https://doi.org/10.3390/vaccines11050999
- Glenn G.M., Smith G., Fries L., et al. Safety and immunogenicity of a Sf9 insect cell-derived respiratory syncytial virus fusion protein nanoparticle vaccine. Vaccine. 2013;31(3):524–32. DOI: https://doi.org/10.1016/j.vaccine.2012.11.009
- Glenn G.M., Fries L.F., Thomas D.N., et al. A randomized, blinded, controlled, dose-ranging study of a respiratory syncytial virus recombinant fusion (F) nanoparticle vaccine in healthy women of childbearing age. J. Infect. Dis. 2016;213(3):411–22. DOI: https://doi.org/10.1093/infdis/jiv406
- August A., Glenn G.M., Kpamegan E., et al. A phase 2 randomized, observer-blind, placebo-controlled, dose-ranging trial of aluminum-adjuvanted respiratory syncytial virus F particle vaccine formulations in healthy women of childbearing age. Vaccine. 2017;35(30):3749–59. DOI: https://doi.org/10.1016/j.vaccine.2017.05.045
- Fries L., Shinde V., Stoddard J.J., et al. Immunogenicity and safety of a respiratory syncytial virus fusion protein (RSV F) nanoparticle vaccine in older adults. Immun. Ageing. 2017;14:8. DOI: https://doi.org/10.1186/s12979-017-0090-7
- Goswami J., Baqui A.H., Doreski P.A., et al. Humoral immunogenicity of mRNA-1345 RSV vaccine in older adults. J. Infect. Dis. 2024;230(5):e996–1006. DOI: https://doi.org/10.1093/infdis/jiae316
Дополнительные файлы