Получение и очистка рекомбинантных белков VP2 и VP3 вируса Alongshan группы Jingmenvirus и оценка их иммунохимических свойств
- Авторы: Бондаренко Е.В.1, Ермолаева Е.А.1, Холодилов И.С.1, Литов А.Г.1
-
Учреждения:
- Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
- Выпуск: Том 102, № 2 (2025)
- Страницы: 213-222
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18829
- DOI: https://doi.org/10.36233/0372-9311-612
- EDN: https://elibrary.ru/ONPICA
- ID: 18829
Цитировать
Аннотация
Введение. Вирус Alongshan — представитель неклассифицированной группы Jingmenvirus (Flaviviridae), обнаружен в клещах Ixodes persulcatus, Ixodes ricinus и различных видах комаров в России, Китае, Финляндии и Франции. В отличие от классических ортофлавивирусов, геном вируса Alongshan представлен 4 сегментами РНК положительной полярности. Первый и третий сегменты генома кодируют белки, гомологичные белкам репликативной машинерии ортофлавивирусов, остальные сегменты кодируют предположительно структурные белки, не имеющие известных гомологов: сегмент 2 — VP1a (белок оболочки), VP1b и NuORF; сегмент 4 — VP2 (капсидный) и VP3 (мембранный). Описаны случаи заболевания людей, связанные с вирусом Alongshan.
Цель работы — разработка системы экспрессии и очистки рекомбинантных белков VP2 и гидрофильного участка VP3 для проверки их антигенных свойств.
Материалы и методы. Для получения гипериммунных сывороток мышей и рекомбинантных белков в бактериальной системе экспрессии был использован штамм Miass527 вируса Alongshan. Произведены биоинформатический анализ последовательностей, кодирующих целевые белки, генно-инженерное клонирование. Для контроля результатов осуществлены иммуноблотинг и иммуноферментный анализ.
Результаты. Рекомбинантные белки вируса Alongshan использованы в лабораторной диагностической тест-системе для определения наличия антител к вирусу. Полученный рекомбинантный белок VP2 способен выявлять антитела во всех исследованных сыворотках инфицированных мышей, а также антитела в сыворотках людей как в вестерн-блоттинге, так и в иммуноферментном анализе. При этом антитела к рекомбинантному участку белка VP3 в противовирусных иммунных сыворотках выявлялись нерегулярно.
Заключение. Выявление антител к вирусу Alongshan у пациентов подтверждает необходимость дальнейшего исследования данной группы вирусов.
Ключевые слова
Полный текст
Введение
Представители рода Orthoflavivirus (семейство Flaviviridae) инфицируют позвоночных и беспозвоночных животных. К этому роду принадлежат такие важные патогены человека, как вирус денге, вирус жёлтой лихорадки, вирус Западного Нила, вирус клещевого энцефалита (ВКЭ), вирус японского энцефалита и др. Недавно была охарактеризована новая группа вирусов, названная Jingmenvirus, которая имеет родство с родом Orthoflavivirus [1]. В отличие от классических ортофлавивирусов, Jingmenvirus имеют сегментированный РНК геном [2]. Первый и третий сегменты генома Jingmenvirus кодируют белки, гомологичные хеликазе и РНК-зависимой РНК-полимеразе ортофлавивирусов [3, 4]. Второй и четвертый сегменты кодируют уникальные белки: белки оболочки VP1a и VP1b, предположительно капсидный белок VP2 и мембранный белок VP3.
Группа Jingmenvirus включает в себя такие вирусы, как Jingmen tick virus, Alongshan virus (ALSV), Yanggou tick virus и Takachi virus [1, 5, 6]. Они имеют широкое географическое распространение и детектируются в кровососущих членистоногих (в особенности в клещах) и млекопитающих, в том числе найдены в сыворотках людей [3, 7–13]. Вирусы ALSV и Jingmen tick, по-видимому, могут вызывать острую инфекцию у людей, сопровождающуюся лихорадкой [1, 14–16]. ALSV был впервые обнаружен и выделен из крови больного с лихорадочным заболеванием в Китае [17]. Позднее ALSV был выявлен методом полимеразной цепной реакции (ПЦР) у других больных: было обследовано 86 человек с высокой температурой, головной болью и присасыванием клещей в анамнезе в период с мая по июль 2017 г. [17]. Также вирус был детектирован в клещах Iхоdes persulcatus и различных видах комаров (Anopheles yatsushiroensis, Aedes vexans, Culex pipiens pallens и Culex tritaeniorhynchus) в Китае.
В России в клещах вирус был обнаружен на территориях Калининградской, Челябинской, Ульяновской областей и в республиках Алтай, Татарстан, Карелия и Тыва [5, 18–20]. В связи с описанными случаями заболевания людей важной задачей являются эпидемиологические исследования представителей группы Jingmenvirus.
На данный момент не известно, к какому из белков вырабатываются антитела при инфекции, вызванной Jingmenvirus. Для определения ALSV-специфических антител у овец и крупного рогатого скота в Китае методом иммуноферментного анализа (ИФА) авторами был успешно использован рекомбинантный белок VP2 [17]. ALSV-специфические антитела были обнаружены у 9,2% (22/240) обследованных овец и 4,6% (11/240) обследованного крупного рогатого скота. В 2019 г. финскими учёными были использованы конструкции, кодирующие белки оболочки ALSV VP1a, VP1b, VP2 и VP3, транфицированные в клетки млекопитающих Vero E6. Эти клетки были использованы для выявления антител в сыворотках 900 пациентов методом иммунофлуоресценции [21].
Цель работы — получение рекомбинантных белков ALSV и использование их в лабораторной диагностической тест-системе для определения наличия антител к вирусу.
Материалы и методы
Вирусы и клетки
Для получения рекомбинантных белков был использован штамм Miass527 ALSV, изолированный из клещей I. persulcatus, собранных в 2014 г. в г. Миасс Челябинской области (код доступа NCBI: MN648770–MN648773) [1]. Рекомбинантный белок sE ВКЭ был любезно предоставлен В.С. Барышниковой [22].
Для клонирования были использованы клетки Escherichia coli, штамм TOP10 («Promega»), для экспрессии рекомбинантных белков — штаммы JM109 и BL21 («Promega»).
Получение гипериммунных сывороток крови
Для получения гипериммунных сывороток в работе использовали беспородных мышей ICR (Научный центр биотехнологии), которых иммунизировали под кожу ALSV (штамм Miass527) с адъювантом Фрейнда («BD») 3 раза (1 раз в неделю), через 10 дней после последней инъекции тотально забирали кровь (декапитация). Полученные сыворотки от 3 мышей к ALSV использовали в иммуноблотинге и ИФА. Сыворотка от 1 мыши к ВКЭ (штамм КЭ-328) была любезно предоставлена В.С. Барышниковой [22]. В качестве отрицательного контроля использовали сыворотку неиммунизированной мыши.
Протокол исследования одобрен Этическим комитетом Федерального научного центра исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН (Институт полиомиелита) (протокол № 200923-1 от 20.09.2023).
Сыворотки условно здорового населения
Сыворотки условно здоровых людей, имеющих антитела к ВКЭ, из Москвы и Московской области были любезно предоставлены Центром гигиены и эпидемиологии в Московской области.
Биоинформатический анализ
Для определения сигнальных пептидов, гидрофильных и гидрофобных учасиков белков использовали программу «SignalP 4.1 Server»1, для определения массы белков — программу DNA to Protein на сайте Zbio.net.
Клонирование генов белков VP2 и VP3 вируса Alongshan (штамм Miass527)
Обратную транскрипцию проводили c использованием обратной транскриптазы «Invitrogen SuperScript III» («Thermo Fisher Scientifiс»).
ПЦР проводили с помощью амплификатора «Veriti 96 Well Thermal Cycler» («Applied Biosystems»), используя полимеразу Platinum Super Fi II («Thermo Fisher Scientifiс»).
Состав смеси для ПЦР: буфер SuperFi 10 мкл, нуклеотиды 2,5 мМ 1 мкл, праймеры по 1 мкл, полимераза Platinum SuperFi II 1 мкл, кДНК 2 мкл, вода 32 мкл. Общий объём 50 мкл.
Программа ПЦР для полимеразы Platinum Super Fi II:
- 98ºС 30 с;
- 98ºС 10 с;
- 60ºС 10 с;
- 72ºС 30 с/30 циклов;
- 72ºС 5 мин.
В работе использовали эндонуклеазы рестрикции:
- BamHI и HindIII («Thermo Fisher Scientific») для плазмиды pQE32 («Qiagen») и ампликонов VP2 и VP3;
- BamHI и XhoI («Thermo Fisher Scientifiс») для плазмиды pet28a+ (коллекция плазмид ФНЦИРИП им. М.П. Чумакова РАН) и ампликона VP
После рестрикции полученные векторы и вставки наносили на 1% агарозный гель («ПанЭко») на основе 1хTBE буфера: 0,09 M Трис («ДиаМ»), 0,09 M H3BO3 («Пущинские лаборатории»), 2 мМ EDTA («ДиаМ») и очищали с помощью центрифужных колонок («Qiagen»).
Концентрацию ДНК измеряли по оптической плотности на приборе «NanoDrop One» («Thermo Fisher Scientifiс»). Реакцию лигирования проводили с помощью лигазы T4 DNA («Thermo Fisher Scientifiс»). Вектор и вставку брали в соотношении 5 : 1.
Таблица 1. Состав сред для индукции экспрессии целевого белка в клетках E. coli JM109 и Bl21
Среда | Ингредиенты | Концентрация, г/л |
LB | Триптон («ДиаМ») | 10 |
Дрожжевой экстракт («Sigma-Aldrich») | 5 | |
NaCl («Fluka») | 10 | |
SOB | Триптон | 20 |
Дрожжевой экстракт | 5 | |
NaCl | 0,585 | |
KCl («Fluka») | 0,185 | |
TB | Триптон | 12 |
Дрожжевой экстракт | 24 | |
Глицерин 99% («Sigma-Aldrich») | 20* |
Примечание. *Концентрация глицерина указана в мл/л.
Клетки E. coli TOP10 трансформировали полученными лигазными смесями методом теплового шока и растили в среде LB (табл. 1) при 37ºС. Наличие вставки проверяли методом ПЦР с праймерами для клонирования. С помощью метода секвенирования по Сэнгеру подтверждали наличие тэга 6 гистидинов, старт и стоп кодонов, отсутствие несинонимических замен. Секвенирование проводили с помощью набора «BigDye Terminator v.3.1 Cicle Sequencing Kit» («Thermo Fisher Scientific») на приборе «Applied Biosystems 3500 Genetic Analyzer» («Waltham»).
Трансформация и культивирование клеток E. сoli при экспрессии
При трансформации для экспрессии белков использовали штаммы: для плазмиды pQE32 — штамм JM109, для pet28a+ — штамм Bl21. Для культивирования клеток использовали среды: LB, SOB и TB (табл. 1).
Затем отбирали одну колонию клеток с чашки Петри и растили её в 5 мл среды с добавлением антибиотика 100 нг/мл (ампициллин — для pQE32, канамицин — для pet28a+) в течение 18 ч. Далее клеточную суспензию переносили в 250 мл среды с ампициллином 100 нг/мл или канамицином 50 нг/мл. При достижении клеточной массы оптической плотности 0,5–0,8 при длине волны 600 нм (9,6 × 109 клеток/мл) добавляли изопропил-β-D-1-тиогалактопиранозидом (ИПТГ; «Helicon»). Инкубировали клетки при различной температуре и времени при перемешивании. Далее клеточную массу осаждали центрифугированием при 1700g, 4ºС в течение 30 мин, полученный осадок промывали 50 мл фосфатно-солевого буфера (PBS; «Sigma-Aldrich»).
Условия, при которых проводили экспрессию рекомбинантных белков, если не указано иного: время инкубации клеток — 12 ч в среде LB при 37ºС и концентрации ИПТГ 0,5 мМ.
Разрушение клеток ультразвуком
Клеточную массу переосаждали в 20 мл лизирующего буфера (HEPES 100 мМ («ДиаМ»), NaCl 0,15 М, pH 8,5) и обрабатывали ультразвуком (прибор «Soniprep 150», «MSE») следующим образом: 3 раза по 1 мин импульсом 7 мс на льду. Далее клетки центрифугировали (7800g, 4ºС, 30 мин), осадок ресуспензировали в 20 мл лизирующего буфера с 8 М мочевиной (для выхода белка в растворимую фракцию) и обрабатывали ультразвуком 1 раз 30 с, после чего центрифугировали (7800g, 4ºС, 30 мин).
Выделение и очистка рекомбинантных белков
Очистку рекомбинантных белков проводили методом аффинной хроматографии с помощью готового набора для выделения Ni-NTA Fast Start («Qiagen»).
Смену буфера на PBS и концентрирование проводили с помощью центрифужных ультрафильтров «Amicon Ultra-15» 10 кДа («Merck»).
Полученные рекомбинантные белки разделяли электрофорезом в 15% полиакриламидном геле (ПААГ) в денатурирующих условиях (ПААГ-SDS). Для определения концентрации целевых белков использовали калибровочный график, построенный по известным концентрациям BSA («Genesystool»). Далее концентрацию целевого белка измеряли с помощью прибора «GBox» («Syngene») в программе «GeneTools» («Syngene»).
Получение отрицательного контроля (Mock)
Для получения отрицательного контроля (Mock) были проведены те же манипуляции с плазмидами pQE-32 и pet28a+ без вставки, что и с конструкциями со вставкой: трансформация, культивирование соответствующих бактериальных клеток, экспрессия, выделение и очистка. Далее контроль использовали для визуализации в ПААГ, иммуноблотинге и ИФА.
Иммуноблотинг
Полученные рекомбинантные белки разделяли электрофорезом в 15% ПААГ-SDS и переносили на нитроцеллюлозную мембрану («Bio-Rad»). Мембрану инкубировали с 5% обезжиренным коровьим молоком («Best Value») в трис-солевом буфере (TBS: 25 мМ Tris, 0,15 M NaCl, рН 8,3) в течение 1 ч.
Затем мембрану инкубировали с целевой сывороткой 1 ч: мыши, человека или к гистидиновому тэгу. Далее промывали мембрану TBS с 0,05% Tвин-20 (TBS-T) и инкубировали с меченными пероксидазой хрена (HRP) антителами против IgG мыши или человека соответственно («Abcam») в течение 1 ч. В случае использования HRP-меченных антител к гистидиновому тэгу («Abcam») инкубирование со вторичными мечеными антителами не требуется.
Перед проявлением мембрану снова промывали TBS-T, затем проявляли с использованием набора «ECL» («Bio-Rad») в гель-документирующей системе «Genesys» («Genesys»).
Иммуноферментный анализ
В лунку 96-луночного планшета вносили 80 нг белка, разведённого в PBS, и инкубировали в течение ночи при 4ºС. Планшет промывали PBS, инкубировали с 4% обезжиренным коровьим молоком («Best Value») в PBS в течение 1 ч, затем с сыворотками мышей в PBS с 0,05% Tвин-20 1 ч. Планшет промывали, инкубировали с HRP-конъюгированными антителами против мышиного IgG («Abcam») соответственно в течение 1 ч, после чего промывали и вносили субстрат TMB («Sigma-Aldrich»), через 30 мин реакцию останавливали 2 М серной кислотой («Ленреактив»). Результаты детектировали при длине волны 450 нм на спектрофотометре («Thermo Fisher Scientific»).
Результаты
Выбор и получение мишеней для клонирования
В нашей работы был выбран предположительно капсидный белок VP2, т. к. китайскими учёными уже были обнаружены антитела у крупного рогатого скота к данному белку [13], а также мембранный белок VP3, который был клонирован впервые в нашей работе. Белки кодируются в 4-м сегменте генома ALSV.
Для белка VP2 была определена последовательность сигнального пептида (19 ак), гидрофобных участков он не имеет — для клонирования был выбран участок без сигнального пептида 243 ак, т. к. он мог затруднить последующее выделение белка. Белок VP3 содержит 9 трансмембранных гидрофобных доменов — для клонирования были выбраны гидрофильные участки 1–89 и 244–389 ак (рис. 1).
Рис. 1. Схематическое изображение целевых участков VP2 и VP3 для клонирования.
Черный фрагмент — сигнальный пептид белка VP2, серые — трансмембранные домены белка VP3. 1 — участок белка VP3 1–267 ак, 2 — участок белка VP3 244–389 ак.
Предположительные размеры белков: VP2 — 25 кДа, а гидрофильные участки белка VP3-1 и VP3-2 — 10 и 18 кДа соответственно.
Далее на основании нуклеотидных последовательностей белка VP2 и гидрофильных участков белка VP3 были подобраны праймеры (табл. 2) и получены соответствующие ПЦР-продукты (рис. 2).
Рис. 2. Электрофоретический анализ ампликонов целевых участков гена белков VP2 и VP3. MW — маркер длины ДНК. VP2 — участок, кодирующий 1-89 ак; VP3 — участок, кодирующий 244–389 ак VP3.
Таблица 2. Праймеры для клонирования белка VP2 и гидрофильного участка белка VP3
Праймер | Последовательность, 5'→3' | Участок генома на основе |
VP2-28s | GAGCTAGGATCCAAGCCAAACGGAGCCCCAGAT | 168–188 |
VP2-28as | GAGCTACTCGAGCTACTGAAAAACCTGGTAGTTG | 857–872 |
VP3s 244–389 | GAGCTAGGATCCGACAAGGATCAAGCCTACCTC | 1576–1597 |
VP3as 244–389 | TAGCTCAAGCTTCCATTGGGTGTAGACCAGGT | 1998–2017 |
MiVP3s 1–89 | GCTAGGATCCGTGCGACCCCAACTACCAGGT | 848–868 |
MiVP3as 1–89 | TAGCTCAAGCTT TCTCTCCTCCAGTCGCC | 1095–1114 |
Получение векторных конструкций
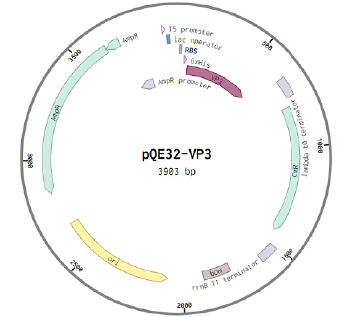
Конструкция со вставкой участка 244–389 ак белка VP3 на основе вектора pQE-32 оказалась удачной (рис. 3, 4). Однако с другими вставками на основе вектора pQE-32 экспрессия рекомбинантных белков либо не происходила (в случае вставки VP2), либо приводила к гибели бактериальных клеток на 3 ч культивирования (в случае вставки участка 1–267 ак белка VP3), что говорит о возможной токсичности белка для данных бактериальных клеток. В связи с этим нами было принято решение собрать новую генно-инженерную конструкцию плазмиды pET28a+ со вставкой белка VP2 (рис. 3).
Рис. 3. Генно-инженерные конструкции, с которыми была показана экспрессия. a — конструкция плазмиды pQE-32 и участка белка VP3; б — конструкция плазмиды pet28a и участка белка VP2. AmpR — ген устойчивости к ампициллину; lac operator — лактозный оператор; bp — нуклеотиды; KanR — ген устойчивости к канамицину; RBS — сайт посадки рибосомы; 6хHis — сайт 6 гистидинов; MCS — сайты рестрикции.
Рис. 4. Результаты иммуноблотинга рекомбинантных белков VP3 (a) и VP2 (б) с антителами к гистидину.
Успешность экспрессии белков в конструкциях pQE-32-244-389 и pet28a-VP2 была подтверждена с использованием антител к гистидиновой метке. Оба рекомбинантных белка показали положительные результаты в вестерн-блоте (рис. 4). Культивирование клеток проходило при условиях: среда LB, 37°С, концентрация ИПТГ 0,5 мМ, 12 ч.
Оптимизация условий экспрессии рекомбинантных белков
Для повышения выхода белков был предпринят ряд экспериментов. Оптимизировали следующие параметры: среду культивирования клеток, длительность инкубации с ИПТГ, концентрацию ИПТГ и температуру роста клеток. На рис. 5 показано, что наибольшая концентрация целевого белка VP3 достигается при добавлении 0,5 мМ ИПТГ при росте бактерий 12 ч при 37ºC. Использование различных сред LB, SOB и TB не влияло на экспрессию рекомбинантного участка белка VP3 (рис. 5, в).
Рис. 5. Электрофоретический анализ рекомбинантного участка белка VP3 244–389 ак в ПААГ при различных концентрации ИПТГ (a), времени (б), среде (в) и температуре (г) экспрессии для целевого белка.
В связи с этим нами были определены рабочие условия экспрессии целевого белка — культивирование клеток в течение 12 ч с концентрацией индуктора лактозного оператора 0,5 мМ при 37ºC в среде LB.
Рис. 6. Электрофоретический анализ рекомбинантного участка белка VP2 в ПААГ при различных температуре (а), концентрации ИПТГ (б), среде (в) и времени (г) экспрессии для целевого белка.
Изменения условий среды, концентрации ИПТГ и температуры не повлияли на экспрессию рекомбинантного белка VP2 в клетках E. coli, штамм BL21 (рис. 6), но при увеличении времени роста клеток бактерий экспрессия увеличивалась.
Поскольку среда для бактерий, температура их роста и концентрация ИПТГ не повлияли на экспрессию рекомбинантного белка VP2, нами были выбраны рабочие условия экспрессии: культивирование клеток в течение 12 ч при 37°C с концентрацией индуктора лактозного оператора 0,5 мМ в среде LB.
Выделение рекомбинантных белков
Одним из важных этапов для дальнейшего выделения белков является определение их растворимости. Для рекомбинантного участка белка VP3 было определено, что он находится в растворимой фракции без мочевины (рис. 7). Целевой белок VP2 находится в нерастворимой фракции (с 8 М мочевиной), что могло затруднить его дальнейшее получение и очистку. При этом добавление ингибиторов сериновых протеаз, которое может повлиять на растворимость белка, не дало результатов — для выделения рекомбинантного белка VP2 необходимо добавление мочевины.
Рис. 7. Определение фракций целевых белков VP2 (a) и VP3 (б) в ПААГ. а — лизат клеток после сонификации в лизирующем буфере: 1 — с 8 М мочевиной; 2 — без добавок; 3 — с 8 М мочевиной и ингибиторами сериновых протеаз; 4 — с ингибиторами сериновых протеаз. б — клеточный лизат после 12 ч культивирования (1), Mock (2), лизат клеток до добавления ИПТГ (3), лизат клеток после сонификации в лизирующем буфере (4), фракция осадка с 8 М мочевиной (5).
Далее рекомбинантные белки очищали на гравитационной колонке методом аффинной хроматографии (рис. 8). После обессоливания и концентрирования на центрифужных фильтрах измеряли концентрацию белков по методу Брэдфорда: для рекомбинантного участка белка VP3 она составила 70 мкг/мл, для белка VP2 — 120 мкг/мл (при экспрессии белков в 250 мл среды с клеточной массой).
Рис. 8. Выделение целевого белка VP2 в ПААГ с помощью набора «Qiagen Ni-NTA Fast Start» (а) и обессоливание с помощью амиконов (б). а: 1 — белок VP2 в лизирующем буфере с 8 М мочевиной; 2 — фракция проскока; 3 — фракция промывки колонки wash-буфером; 4 — элюат, содержащий целевой белок; 5 — элюат, содержащий продукты деградации белка. б — рекомбинантный белок VP2 и продукты его деградации (обозначение: треугольник); К+ — положительный контроль.
С помощью вестерн-блота и использования гипериммунных мышиных сывороток к ALSV была показана способность рекомбинатного белка VP2 взаимодействовать с противовирусными антителами. Были проверены 3 гипериммунные мышиные сыворотки — белок VP2 взаимодействовал со всеми, в то время как рекомбинантный участок белка VP3 был выявлен только с одной. В качестве примера на рис. 9 приведён иммуноблот рекомбинантных белков VP2 и VP3 с гипериммунной мышиной сывороткой. В качестве отрицательной сыворотки в вестерн-блоте была использована сыворотка неиммунизированной мыши.
Рис. 9. Результаты иммуноблотинга целевого белка с сывороткой мыши, иммунизированной вирусом Alongshan (штамм Miass527). a — экспрессия рекомбинантного белка VP3; б — лизат клеток после экспрессии рекомбинантного белка VP2 (1), выделенного и обессоленного рекомбинантного белка VP2 (2), Mock (3). Для детекции использовали HRP-меченные антитела против IgG мыши («Abcam»).
Для доказательства специфичности рекомбинантного белка VP2 в вестерн-блоте также использовали мышиные сыворотки к ВКЭ (рис. 10). В качестве положительного контроля служил рекомбинантный белок ВКЭ sE [22]. Полученный нами белок VP2 не связывался с антителами к ВКЭ.
Рис. 10. Результаты иммуноблотинга целевого белка мышиной гипериммунной сыворотки к ВКЭ (штамм КЭ-328). Для детекции использованы HRP-меченные антитела против IgG мыши («Abcam»). 1 — выделенный и обессоленный рекомбинантный белок VP2; 2 — Mock; 3 — лизат клеток СПЭВ без вируса ВКЭ; 4 — рекомбинантный белок sE размером 44 кДа [22].
Рис. 11. Анализ мышиной гипериммунной сыворотки к вирусу Alongshan Miass527 с рекомбинантным белком VP2 (a) и Mock (б).Лунки 96-луночного планшета сенсибилизировали раствором белка VP2; в анализе использована гипериммунная мышиная сыворотка к вирусу Alongshan (С+) и сыворотка неиммунизированной мыши (С–) с указанными на рисунке разведениями. Для детекции использованы HRP-меченные антитела против IgG мыши («Abcam»).
Результаты вестерн-блот-анализа были подтверждены в ИФА с мышиной гипериммунной сывороткой к ALSV (рис. 11). Для определения рабочей концентрации рекомбинантных белков в ИФА были проверены разные концентрации белка (20, 40, 80 и 120 нг/лунку) и разведение сыворотки (1 : 180 и 1 : 360). Оптимальной оказалась концентрация белка 80 нг/лунку. В качестве отрицательного контроля использовалась сыворотка неиммунизированной мыши. Для дополнительного подтверждения результатов мышиная гипериммунная сыворотка к ALSV также была проверена в ИФА, где в качестве подложки использовалась плазмида, с которой были произведены все те же манипуляции, что и с плазмидой со вставкой и рекомбинантным белком при выделении (Mock).
Положительные результаты ИФА и вестерн-блот позволяют использовать белок VP2 для детекции антител против ALSV в сыворотках.
Анализ сывороток условно здоровых людей
С помощью полученных нами рекомбинантных белков были проверены 30 сывороток условно здоровых людей из Москвы и Московской области, имеющих антитела к ВКЭ. При анализе методом ИФА использовали образцы целевого белка в концентрации 80 нг/лунку, в качестве отрицательного контроля в подложке был использован Mock (имел ту же концентрацию по общему белку), а в качестве отрицательной сыворотки — сыворотка условно здорового человека, не имевшего антитела к ВКЭ. Таким образом, была выявлена 1 сыворотка, содержащая антитела к белку VP2 ALSV. К рекомбинантному участку 244–389 ак белка VP3-антител не обнаружено.
Для подтверждения результатов ИФА нами был проведён вестерн-блот положительной в ИФА сыворотки пациента (рис. 12).
Рис. 12. Результаты иммуноблотинга целевого белка с сывороткой условно здорового человека. Для детекции использовали HRP-меченные антитела против IgG человека («Abcam»).
Обсуждение
Ранее белок VP2 уже был получен китайскими учёными с помощью вектора pET30a, который экспрессировали при 15ºС в клетках BL21 (DE3) E. сoli [17]. В нашей работе было показано, что белок VP2 успешно экспрессируется с использованием плазмиды плазмида pet28a(+), также была опробована низкая температура культивирования клеток, но это не повлияло на уровень экспрессии рекомбинантного белка. Эффективное выделение рекомбинантного белка VP2 проходит при добавлении 8 М мочевины. При этом было показано, что впервые полученный нами рекомбинантный участок белка VP3 (вектор pQE-32) является растворимым. Выход целевого продукта выше с вектором pet28a(+), чем с pQE-32, при этом полученных концентраций обоих белков достаточно для многократного проведения ИФА.
С помощью рекомбинантного белка VP2 были выявлены антитела у крупного рогатого скота в Китае [17]. В нашей работе мы подтвердили, что белок VP2 обладает антигенными свойствами в иммуноблоте и ИФА. Впервые нами было показано, что полученный нами рекомбинантный пептид VP2 ALSV штамм Miass527 не имеет антигенных перекрёстов с ВКЭ в вестерн-блоте. Показано, что при иммунизации мышей живым ALSV более регулярно синтезируются антитела к рекомбинантному белку VP2 и менее регулярно — к рекомбинантному участку белка VP3. Возможно, это связано с различным спектром антител в полученных мышиных сыворотках — белок VP2 взаимодействует с бÓльшим спектром антител, выработанных на разных этапах инфекции. Также в ИФА были обнаружены антитела у условно здорового человека с укусом клеща в анамнезе к рекомбинантному пептиду VP2, а к рекомбинантному пептиду VP3 антител в сыворотках людей не обнаружено.
1 SignalP 4.1 Server». URL: http://www.cbs.dtu.dk/services/TMHMM-2.0
Об авторах
Екатерина Владимировна Бондаренко
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Автор, ответственный за переписку.
Email: bondarenko_ev@chumakovs.su
ORCID iD: 0000-0002-5972-0761
младший научный сотрудник лаб. биохимии
Россия, МоскваЕлена Александровна Ермолаева
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: le.ermolaeva@mail.ru
ORCID iD: 0000-0002-0406-0604
младший научный сотрудник лаб. биохимии
Россия, Москва
Иван Сергеевич Холодилов
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: ivan-kholodilov@bk.ru
ORCID iD: 0000-0002-3764-7081
кандидат мед. наук, ведущий научный сотрудник лаб. биологии арбовирусов
Россия, МоскваАлександр Геннадьевич Литов
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: novosti-wxo@yandex.ru
ORCID iD: 0000-0002-6086-3655
кандидат биол. наук, ведущий научный сотрудник лаб. биологии арбовирусов
Россия, МоскваСписок литературы
- Wang Z.D., Wang B., Wei F., et al. A new segmented virus associated with human febrile illness in China. N. Engl. J. Med. 2019;380(22):2116–25. DOI: https://doi.org/10.1056/NEJMoa1805068
- Ackermann M., Padmanabhan R. De novo synthesis of RNA by the dengue virus RNA-dependent RNA polymerase exhibits temperature dependence at the initiation but not elongation phase. J. Biol. Chem. 2001;276(43):39926–37. DOI: https://doi.org/10.1074/jbc.M104248200
- Webster C.L., Waldron F.M., Robertson S., et al. The discovery, distribution, and evolution of viruses associated with Drosophila melanogaster. PLoS Biol. 2015;13(7):e1002210. DOI: https://doi.org/10.1371/journal.pbio.1002210
- Qin X.C., Shi M., Tian J.H., et al. A tick-borne segmented RNA virus contains genome segments derived from unsegmented viral ancestors. Proc. Natl. Acad. Sci. USA. 2014;111(18):6744–9. DOI: https://doi.org/10.1073/pnas.1324194111
- Kholodilov I.S., Litov A.G., Klimentov A.S., et al. Isolation and characterisation of Alongshan virus in Russia. Viruses. 2020;12(4):362. DOI: https://doi.org/10.3390/v12040362
- Kholodilov I.S., Belova O.A., Ivannikova A.Y., et al. Distribution and characterisation of tick-borne flavi-, flavi-like, and phenuiviruses in the Chelyabinsk region of Russia. Viruses. 2022;14(12):2699. DOI: https://doi.org/10.3390/v14122699
- Maruyama S.R., Castro-Jorge L.A., Ribeiro J.M., et al. Characterisation of divergent flavivirus NS3 and NS5 protein sequences detected in Rhipicephalus microplus ticks from Brazil. Mem. Inst. Oswaldo Cruz. 2014;109(1):38–50. DOI: https://doi.org/10.1590/0074-0276130166
- Vandegrift K.J., Kapoor A. The ecology of new constituents of the tick virome and their relevance to public health. Viruses. 2019;11(6):529. DOI: https://doi.org/10.3390/v11060529
- Ladner J.T., Wiley M.R., Beitzel B., et al. A multicomponent animal virus isolated from mosquitoes. Cell Host Microbe. 2016;20(3):357–67. DOI: https://doi.org/10.1016/j.chom.2016.07.011
- Kobayashi D., Kuwata R., Kimura T., et al. Detection of jingmenviruses in Japan with evidence of vertical transmission in ticks. Viruses. 2021;13(12):2547. DOI: https://doi.org/10.3390/v13122547
- Temmam S., Bigot T., Chrétien D., et al. Insights into the host range, genetic diversity, and geographical distribution of jingmenviruses. mSphere. 2019;4(6):e00645–19. DOI: https://doi.org/10.1128/mSphere.00645-19
- Dinçer E., Hacıoğlu S., Kar S., et al. Survey and characterization of Jingmen tick virus variants. Viruses. 2019;11(11):1071. DOI: https://doi.org/10.3390/v11111071
- Pascoal J.O., Siqueira S.M., Maia R.D.C., et al. Detection and molecular characterization of Mogiana tick virus (MGTV) in Rhipicephalus microplus collected from cattle in a savannah area, Uberlândia, Brazil. Ticks Tick Borne Dis. 2019;10(1):162–5. DOI: https://doi.org/10.1016/j.ttbdis.2018.10.002
- Терновой В.А., Гладышева А.В., Семенцова А.О. и др. Обнаружение РНК нового многокомпонентного вируса у больных Крымской-Конго геморрагической лихорадкой на юге России. Вестник Российской академии медицинских наук. 2020;75(2):129–34. Ternovoi V.A., Gladysheva A.V., Sementsova A.O., et al. Detection of the RNA for new multicomponent virus in patients with Crimean-Congo hemorrhagic fever in southern Russia. Annals of the Russian Academy of Medical Sciences. 2020;75(2):129–34. DOI: https://doi.org/10.15690/vramn1192, EDN: https://elibrary.ru/jfodao
- Taniguchi S. Detection of Jingmen tick virus in human patient specimens: emergence of a new tick-borne human disease? EBioMedicine. 2019;43:18–9. DOI: https://doi.org/10.1016/j.ebiom.2019.04.034
- Jia N., Liu H.B., Ni X.B., et al. Emergence of human infection with Jingmen tick virus in China: a retrospective study. EBioMedicine. 2019;43:317–24. DOI: https://doi.org/10.1016/j.ebiom.2019.04.004
- Wang Z.D., Wang W., Wang N.N., et al. Prevalence of the emerging novel Alongshan virus infection in sheep and cattle in Inner Mongolia, northeastern China. Parasit. Vectors. 2019;12(1):450. DOI: https://doi.org/10.1186/s13071-019-3707-1
- Карташов М.Ю., Кривошеина Е.И., Курушина В.Ю. и др. Встречаемость и генетическое разнообразие вируса Алонгшан (Flaviviridae), выявленного в клещах на юге Восточной Сибири. Вопросы вирусологии. 2024;69(2):151–61. Kartashov M.Yu., Krivosheina E.I., Kurushina V.Yu., et al. Prevalence and genetic diversity of the Alongshan virus (Flaviviridae) circulating in ticks in the south of Eastern Siberia. Problems of Virology. 2024;69(2):151–61. DOI: https://doi.org/10.36233/0507-4088-223, EDN: https://elibrary.ru/jwvfoe
- Morozkin E.S., Makenov M.T., Zhurenkova O.B., et al. Integrated Jingmenvirus polymerase gene in Ixodes ricinus genome. Viruses. 2022;14(9):1908. DOI: https://doi.org/10.3390/v14091908
- Kholodilov I.S., Belova O.A., Morozkin E.S., et al. Geographical and tick-dependent distribution of flavi-like Alongshan and Yanggou tick viruses in Russia. Viruses. 2021;13(3):458. DOI: https://doi.org/10.3390/v13030458
- Kuivanen S., Levanov L., Kareinen L., et al. Detection of novel tick-borne pathogen, Alongshan virus, in Ixodes ricinus ticks, south-eastern Finland, 2019. Euro. Surveill. 2019;24(27):1900394. DOI: https://doi.org/10.2807/1560-7917.ES.2019.24.27.1900394
- Барышникова В.С., Турченко Ю.В., Шишова А.А. и др. Рекомбинантный гликопротеин Е вируса клещевого энцефалита для создания дифференцирующей тест-системы. Биотехнология. 2022;38(6):73–83. Baryshnikova V.S., Turchenko Yu.V., Shishova А.А., et al. Recombinant glycoprotein E of tick-borne encephalitis virus for a developing differentiated test system. Biotekhnologiya. 2022;38(6):73–83. DOI: https://doi.org/10.56304/S0234275822060023, EDN: https://elibrary.ru/hzkfvy
Дополнительные файлы