Молекулярно-биологическая характеристика изолятов Streptococcus pneumoniae, выделенных от больных пневмококковым менингитом
- Авторы: Чагарян А.Н.1, Иванчик Н.В.1, Кузьменков А.Ю.1, Козлов Р.С.1,2, Гапонова И.И.2, Миронов К.О.2
-
Учреждения:
- Научно-исследовательский институт антимикробной химиотерапии Смоленского государственного медицинского университета
- Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
- Выпуск: Том 102, № 2 (2025)
- Страницы: 150-161
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18823
- DOI: https://doi.org/10.36233/0372-9311-614
- EDN: https://elibrary.ru/NRAEKS
- ID: 18823
Цитировать
Аннотация
Цель работы — дать ключевые характеристики изолятов Streptococcus pneumoniae, циркулирующих на территории России в 2015–2020 гг. и выделенных от больных пневмококковым менингитом, на основании данных высокопроизводительного секвенирования, включая глобальные кластеры пневмококковых последовательностей, серотипы, факторы вирулентности и генетические детерминанты резистентности, в сравнении с клиническими данными по чувствительности к антимикробным препаратам (АМП).
Материалы и методы. Исследовано 68 инвазивных изолятов S. pneumoniae, выделенных из крови и ликвора пациентов с бактериальным менингитом в разных регионах России в 2015–2020 гг. Видовую идентификацию проводили с учётом морфологии колоний на кровяном агаре, наличия α-гемолиза, отрицательной каталазной реакции, чувствительности к оптохину, положительных результатов латекс-агглютинации. Чувствительность изолятов к АМП определяли методом микроразведений в бульоне, категории чувствительности — на основании пограничных значений минимальных подавляющих концентраций (МПК). Проводили полногеномное секвенирование изолятов S. pneumoniae, анализ изолятов на сигнатуру пенициллинсвязывающих белков, определение глобальных кластеров пневмококковых последовательностей, аллелей MLST, серотипов, сиквенс-типов и генов приобретённой резистентности (mefA, ermB, tetM, folA/P, cat), идентифицировали гены вирулентности.
Результаты. Выявлены 28 GPSC, 45 сиквенс-типов и 27 серотипов. Степень охвата ППВ-23 и ПКВ-13 составила 78 и 59% соответственно. Доминировали серотипы 3 (18%), 19F (9%), 23F (7%) и 15В (6%). Преобладала (43%) линия GPSC12 (серотип 3). Линии, экспрессирующие вакцинные серотипы GPSC1(19F), GPSC6(14), GPSC13(6A), GPSC904(14) и GPSC10(19F), обладали множественной антимикробной резистентностью, включая резистентность к пенициллину. Резистентные линии, экспрессирующие невакцинные серотипы, — GPSC230 (13) и GPSC177 (35F). В большинстве случаев установлено соответствие генотипической и фенотипической резистентности к пенициллину (повышенные МПК β-лактамов коррелировали с типами пенициллинсвязывающих белков), эритромицину (ermB, mefA, ermB/mefA), клиндамицину (ermB) и тетрациклину (tetM) и триметоприму-сульфаметоксазолу (folA, folP). У всех изолятов обнаружены гены вирулентности cbpG, lytA, pce/cbpE, pavA, pfbA, ply, hysA, nanA и cps4A. Цинковая металлопротеиназа С обнаружена у 13% изолятов.
Заключение. Выявлено высокое разнообразие серотипов и линий среди изолятов пневмококков, выделенных у больных менингитом. Из 68 изолятов S. pneumoniae, выделенных у пациентов с бактериальным менингитом, более 17% относились к невакцинным серотипам. Результаты сопоставления фенотипической и генотипической антимикробной резистентности характеризовались хорошей конкордантностью, что указывает на необходимость дальнейшего изучения возможности использования полногеномного секвенирования в качестве диагностического инструмента для выявления механизмов резистентности у клинических изолятов пневмококков.
Полный текст
Введение
Streptococcus pneumoniae является патогеном дыхательных путей человека и основной причиной заболеваемости и смертности во всём мире. S. pneumoniae — 4-я по частоте причина смертельных инфекций, таких как септицемия и менингит, и является, по оценкам Всемирной организации здравоохранения (ВОЗ), причиной 1,6 млн смертей, из которых 0,7–1,0 млн приходится на детей в возрасте до 5 лет, в основном в развивающихся странах [1–3]. Поверхностные капсульные полисахариды S. pneumoniae являются одними из наиболее важных факторов вирулентности и основой серотипирования пневмококка. В настоящее время известны более 100 серотипов S. pneumoniae [4]. Благодаря своей способности приобретать экзогенную ДНК пневмококк может переключать серотипы и получать гены резистентности к антибиотикам [5]. Бесконтрольное использование антимикробных препаратов (АМП), избирательное давление пневмококковых вакцин, высокий уровень генетической рекомбинации S. pneumoniae ведут к изменению популяции пневмококков: возникновению новых невакцинных серотипов, появлению изолятов со множественной антимикробной резистентностью, изменению профиля вирулентности. В 2024 г. ВОЗ включила S. pneumoniae, резистентный к макролидам, в обновлённый список приоритетных бактериальных патогенов среднего уровня1.
В настоящее время технологии полногеномного секвенирования позволяют получить информацию о генетических изменениях, серотипах, сиквенс-типах, определённых как по «классической» 7-локусной схеме, так и по «основному геному» (core genome MLST), профиле вирулентности, статусе антимикробной резистентности пневмококков, что является важным для эпидемиологического надзора [6–10].
Цель исследования: дать ключевые характеристики изолятов S. pneumoniae, выделенных от больных пневмококковым менингитом, циркулирующих на территории России в 2015–2020 гг., на основании данных высокопроизводительного секвенирования, включая глобальные кластеры пневмококковых последовательностей, серотипы, факторы вирулентности и генетические детерминанты резистентности, в сравнении с клиническими данными по чувствительности к АМП.
Материалы и методы
Проведено исследование факторов вирулентности и генов резистентности у 68 инвазивных изолятов S. pneumoniae, выделенных из крови и ликвора пациентов с диагнозом «бактериальный менингит». Исследование проводилось при добровольном информированном письменном согласии пациентов. Протокол исследования одобрен Независимым междисциплинарным комитетом по этической экспертизе клинических исследований (протокол № 1 от 17.01.2020).
Все изоляты были получены при проведении различных этапов многоцентрового исследования «ПеГАС» в 2015–2020 гг. в разных регионах России [11]. Выделение и первичную идентификацию изолятов проводили в локальных микробиологических лабораториях центров — участников исследования в рамках стандартной процедуры бактериологического исследования биологического материала, полученного от пациентов с диагнозом «бактериальный менингит» и в соответствии с МУК 4.2.1887-04 «Лабораторная диагностика менингококковой инфекции и гнойных бактериальных менингитов». Транспортировку изолятов S. pneumoniae в центральную лабораторию Научно-исследовательского института антимикробной химиотерапии (НИИАХ) осуществляли на модифицированной среде Дорсэ. В НИИАХ проводились оценка соответствия присланных изолятов критериям включения, идентификация с учётом морфологии колоний на кровяном агаре («НEM»), наличия α-гемолиза, отрицательной каталазной реакции, чувствительности к оптохину («Oxoid») и положительных результатов латекс-агглютинации с использованием набора «DrySpot Pneumo» («Oxoid»). До момента определения чувствительности к АМП все изоляты хранили в пробирках с триптиказо-соевым бульоном («bioMerieux») с добавлением 30% стерильного глицерина («Sigma») при –70°С. Контаминированные и нежизнеспособные изоляты были исключены из исследования. Чувствительность к АМП определяли методом микроразведений в бульоне в соответствии с требованиями ISO 20776-1:20202, категории чувствительности изолятов к АМП — на основании пограничных значений минимальных подавляющих концентраций (МПК) в соответствии со стандартами EUCAST3 и российскими рекомендациями4. Для контроля качества определения чувствительности параллельно с исследуемыми изолятами тестировали референсный штамм S. pneumoniae ATCC 49619.
Полногеномное секвенирование проводили на базе ЦНИИ Эпидемиологии Роспотребнадзора. Пробоподготовку вели по протоколу «Nextera» («Illumina»). Высокопроизводительное секвенирование проводили на приборе «HiSeq 1500» с использованием наборов «HiSeq PE Rapid Cluster Kit v2» и «HiSeq Rapid SBS Kit v2» («Illumina»). Полногеномные нуклеотидные последовательности собирали с использованием программы «SPAdes v. 3.13». Подробное описание методики пробоподготовки для полногеномного секвенирование приведено нами ранее [12].
Полногеномные нуклеотидные последовательности изученных изолятов, данные о серотипах и чувствительности к антибиотикам, а также информация об источниках штаммов внесены в базу PubMLST5: идентификационные номера: 51080–51125, 73010–73011, 73013–73015, 73017–73033.
Инвазивные изоляты пневмококков были проанализированы на сигнатуру пенициллинсвязывающих белков (ПСБ), где комбинация 3 сигнатур (PBP1А, PBP2В, PBP2Х) определяет уровень резистентности к β-лактамам, были определены глобальные кластеры пневмококковых последовательностей, аллели MLST, серотипы, сиквенс-типы и гены приобретённой резистентности (mefA, ermB, tetM, folA/P, cat) с использованием инструмента, доступного на Pathogenwatch — глобальной платформе геномного наблюдения6. Гены вирулентности идентифицировали с помощью онлайн-программы AMRseq7 и программы BacWGSTdb8.
Исследование не являлось интервенционным и не предполагало сравнения групп. Для представления результатов использовали методы описательной статистики с определением абсолютного и относительного количества наблюдений.
Результаты
Молекулярно-биологическая характеристика инвазивных изолятов S. pneumoniae
Нами выявлено 28 глобальных кластеров пневмококковых последовательностей (GPSC), 45 сиквенс-типов и 27 серотипов (табл. 1).
Таблица 1. Глобальные кластеры пневмококковых последовательностей, ассоциированные с сиквенс-типами и серотипами
Глобальные кластеры | Сиквенс-типы | Серотипы | Количество |
1 | 236 | 19F | 2 (7) |
2 | 15249 | 1 | 1 (4) |
3 | 1012 | 11A | 1 (4) |
6 | 3418, 143 | 6E(6B),14 | 2 (7) |
7 | 311, 152248, 16095, 311 | 23F | 4 (14) |
10 | 230 | 19F | 1 (4) |
11 | 1262 | 15B | 2 (7) |
12 | 505, 180, 15251, 15250, 2049 | 3 | 12 (43) |
13 | 12493, 473 | 6A, 6B | 2 (7) |
16 | 66, 16098 | 9N | 2 (7) |
19 | 433 | 22F | 2 (7) |
32 | 3244, 11901,2824, 3544 | 7F, 8 | 4 (14) |
38 | 393 | 38 | 1 (4) |
43 | 239 | 9V | 3 (11) |
44 | 179 | 19F | 1 (4) |
49 | 440 | 23F | 1 (4) |
68 | 15252, 3187 | 18C | 2 (7) |
76 | 490 | 6A | 1 (4) |
98 | 1480 | 8 | 1 (4) |
123 | 447 | 37 | 1 (4) |
162 | 2361 | 4 | 2 (7) |
177 | 2991 | 35F | 2 (7) |
212 | 6202 | 12F, 15F | 4 (14) |
229 | 1025 | 15B, 15C | 3 (11) |
230 | 2754 | 13 | 1 (4) |
365 | 225 | 28A | 2 (7) |
376 | 9247 | 6E(6B) | 1 (4) |
904 | 782 | 14 | 1 (4) |
Not assigned | 15 | 19F | 2 (7) |
Not assigned | 15247 | 10С | 1 (4) |
Not assigned | 5205 | 8 | 1 (4) |
Not assigned | 13459 | 10А | 1 (4) |
Not assigned | 16099 | 4 | 1 (4) |
Примечание. Not assigned — не назначен номер глобального кластера пневмококковых последовательностей.
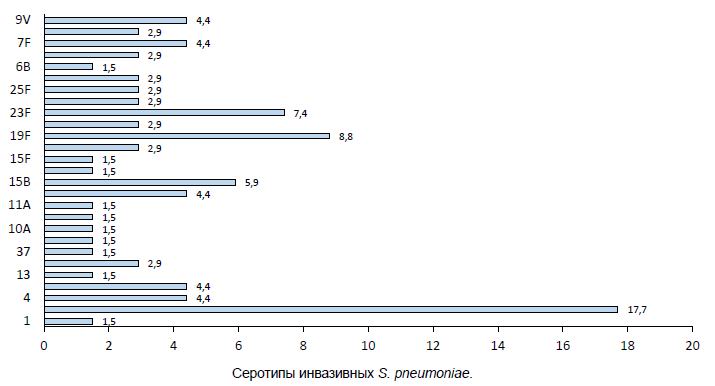
Анализ полногеномных данных показал, что среди инвазивных изолятов преобладали серотипы, входящие в состав пневмококковой полисахаридной 23-валентной вакцины (ППВ-23) и пневмококковой конъюгированной вакцины 13 (ПКВ-13) — 3 (18%), 19F (9%), 23F (7%) и 15В (6%). Степень охвата ППВ-23 составила 79%, ПКВ-13 — 59%. Частота выделения пневмококков невакцинных серотипов при менингите в России: 28A и 35F — по 3%; 13, 37, 38, 10C, 15C и 15F — более 1% (рисунок).
Серотипы инвазивных S. pneumoniae.
Из 28 GPSC 20 GPSC были представлены вакцинными серотипами, 6 GPSC — невакцинными серотипами. Две линии — GPSC212 (12F, 15F) и GPSC229 (15B, 15C) — экспрессировали серотипы как вакцинных, так и невакцинных серотипов. Линия GPSC12 экспрессировала только 3-й вакцинный серотип и составила более 42%. В ряде случаев один и тот же серотип был связан с разными линиями. Второй по частоте встречаемости серотип, 19F, экспрессировался линиями GPSC1, 10, 44 и новой линией, GPSC которой не определён, серотип 23F — GPSC7 и GPSC49, серотип 15В — GPSC11 и GPSC229. Невакцинные серотипы экспрессировались линиями GPSC 365 (серотип 28A), GPSC177 (серотип 35F), GPSC212 (серотип 15F), GPSC229 (серотип 15С), GPSC123 (серотип 37), GPSC38 (серотип 38), GPSC230 (серотип 13).
Чувствительность к антимикробным препаратам инвазивных изолятов S. pneumoniae
Анализ чувствительности к АМП показал, что резистентны к пенициллину были 6 (9%) инвазивных изолятов (табл. 2), к тетрациклину — 11 (16%), к эритромицину — 5 (7%), к клиндамицину — 2 (3%), к респираторным фторхинолонам — 1 (1%). К триметоприму-сульфаметоксазолу 12 (18%) изолятов были резистентны, 12 (18%) — чувствительны при увеличенной экспозиции.
Таблица 2. Резистентность пневмококковых линий GPSC к АМП
Пневмококковые | Cеротип | Количество | Генотип, резистентность, n (%) | ||||||
PEN | TET | TS | CL | ERY | CHL | FX | |||
1 | 19F | 2 | 2 (3) | 2 (3) | 2 (3) | 1 (1) | 2 (3) | 0 | 0 |
2 | 1 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
3 | 11A | 1 | 0 | 0 | 1 (1) | 0 | 0 | 0 | 0 |
6 | 6E(B),14 | 2 | 1 (1) | 2 (3) | 2 (3) | 2 (3) | 2 (3) | 0 | 0 |
7 | 23F | 4 | 0 | 0 | 4 (6) | 0 | 0 | 0 | 0 |
10 | 19F | 1 | 1 (1) | 1 (1) | 1 (1) | 0 | 0 | 0 | 0 |
11 | 15B | 2 | 0 | 0 | 2 (3) | 0 | 0 | 0 | 0 |
12 | 3 | 12 | 0 | 1 (1) | 0 | 0 | 0 | 0 | 1 (1) |
13 | 6A, 6B | 2 | 1 (1) | 1 (1) | 2 (3) | 0 | 1 (1) | 0 | 0 |
16 | 9N | 2 | 0 | 0 | 1 (4) | 0 | 0 | 0 | 1 (1) |
19 | 22F | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
32 | 7F,8 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
38 | 38 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
43 | 9V | 3 | 0 | 0 | 3 (4) | 0 | 0 | 0 | 0 |
44 | 19F | 1 | 0 | 1 (1) | 1 (1) | 1 (1) | 1 (1) | 0 | 0 |
49 | 23F | 1 | 0 | 0 | 1 (1) | 0 | 0 | 0 | 0 |
68 | 18C | 2 | 0 | 0 | 2 (3) | 0 | 0 | 0 | 0 |
76 | 6A | 1 | 0 | 0 | 1 (1) | 0 | 0 | 0 | 0 |
98 | 8 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
123 | 37 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
162 | 4 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
177 | 35F | 2 | 0 | 2 (3) | 2 (3) | 0 | 0 | 0 | 0 |
212 | 12F, 15F | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
229 | 15B, 15C | 3 | 0 | 0 | 3 (4) | 0 | 0 | 0 | 0 |
230 | 13 | 1 | 0 | 1 (1) | 1 (1) | 0 | 1 (1) | 0 | 0 |
365 | 28A | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
376 | 6E(6B) | 1 | 0 | 0 | 1 (1) | 0 | 0 | 1 (4) | 0 |
904;9 | 14 | 1 | 1 (1) | 1 (1) | 1 (1) | 0 | 0 | 0 | 0 |
Not assigned | 10С, 19F, 8, 10A ,4 | 6 | 0 | 2 (3) | 2 (3) | 0 | 0 | 0 | 0 |
28 | 27 | 68 | 6 (9) | 14 (21) | 33 (49) | 4 (6) | 7 (10) | 1 (1) | 2 (3) |
Примечание. PEN — резистентность к пенициллину, предсказанная на основе последовательностей PBP1a, PBP2b и PBP2x; TET — резистентность к тетрациклину, предсказанная по наличию гена tet M; TS — резистентность к триметоприму-сульфаметоксазолу, связана с заменой в folA I100L и/или вставкой 1 или 2 кодонов в folP_aa_insert_57-70, CL — резистентность к клиндамицину, предсказанная по наличию гена ermB; ERY — резистентность к макролидам, предсказанная по наличию гена метилазы (ermB) и гена насоса оттока макролидов (mefA/E); CHL — резистентность к хлорамфениколу, предсказанная по наличию гена хлорамфениколацетилтрансферазы (cat); FX — резистентность к фторхинолонам, предсказанная по наличию мутаций в генах gyrA, parC.
Среди изолятов 28 линий GPSC изоляты 5 линий, экспрессирующие вакцинные серотипы, были резистентны одновременно к 3 и более классам АМП: GPSC1 (серотип 19F), GPSC6 (серотип 14) были резистентны к пенициллину, тетрациклину, триметоприму-сульфаметоксазолу, эритромицину и клиндамицину; GPSC10 (серотип 19F), GPSC904;9 (серотип 14) — к пенициллину, тетрациклину и триметоприму-сульфаметоксазолу, GPSC6 (серотип 6E(B)) — к пенициллину, эритромицину и триметоприму-сульфаметоксазолу. Одна линия с вакцинными серотипами была резистентна одновременно к антибиотикам двух классов: GPSC44 (серотип 19F) — к тетрациклину и эритромицину. Две линии, экспрессирующие невакцинные серотипы, — GPSC177 (серотип 35F) и GPSC230 (серотип 13) — были резистентны к тетрациклину и триметоприму-сульфаметоксазолу.
Генетические детерминанты резистентности к антимикробным препаратам
У клинических изолятов S. pneumoniae резистентность к β-лактамам в первую очередь обусловлена вариациями аминокислотных последовательностей в транспептидазных доменах ПСБ: PBP1a, PBP2b и PBP2x, которые снижают сродство β-лактамных антибиотиков к этим участкам. Тип ПСБ позволяет прогнозировать уровни резистентности к β-лактамам [13]. Анализ результатов полногеномного секвенирования инвазивных изолятов S. pneumoniae выявил, что наиболее распространённым типом ПСБ у чувствительных изолятов (PBP1a-PBP2b-PBP2x) был 2-0-2 — 29%, реже встречались 11-4-0 — 4% и 12-0-6 — 3%. Все резистентные к пенициллину изоляты имели сигнатуры: 13-16-47, 17-15-22, 24-53-77, 36-34-44, 31-12-18. Выявлено также несколько комбинаций новых типов ПСБ: new-27-new, 34-11-new. Резистентность к макролидам и линкозамидам (эритромицину и клиндамицину) была обусловлена наличием гена метилазы (ermB) у 5 (7%) изолятов, у 1 (1%) изолята были одновременно обнаружены гены ermB и гены насоса оттока макролидов (mefA/E). Резистентность к триметоприму-сульфаметоксазолу была связана с заменой в folA I100L и/или вставкой 1 или 2 кодонов foP, в то время как у изолятов, относящихся к категории чувствительных при повышенной экспозиции, часто имела место вставка 1 или 2 кодонов в folP. Резистентность к хлорамфениколу прогнозировалась по наличию гена хлорамфениколацетилтрансферазы (cat), резистентность к фторхинолонам — мутациями в генах gyrA и parC.
Сравнение фенотипа и генотипа резистентности
Конкордантность генотипа и фенотипа резистентности в целом была высокой, однако в некоторых случаях были выявлены несоответствия между генотипической и фенотипической резистентностью.
Резистентность к β-лактамам показала хорошее соответствие. Шесть изолятов пневмококков, резистентных к пенициллину, имели сигнатуры ПСБ, характерные для резистентных пневмококков. Интересно, что все 6 резистентных к пенициллину изолятов имели сигнатуры PBP1а(13–36)-PBP2b(12–53)-PBP2х(18–77), в то время как все чувствительные изоляты имели сигнатуры ПСБ с низким номером. Таким образом, сигнатуры транспептидазы ПСБ являются надёжными индикаторами МПК различных β-лактамных антибиотиков у клинических изолятов пневмококков и могут служить альтернативой тестированию фенотипической чувствительности.
Все 11 резистентных к тетрациклину пневмококков несли гены tetM. Три изолята, содержавшие tetM, относились к категории чувствительных, что может быть обусловлено мутациями в tetM, не рассмотренными в нашем исследовании.
В случае с триметопримом-сульфаметоксазолом для большинства изолятов была выявлена хорошая корреляция между наличием маркеров резистентности и фенотипической резистентностью. Двенадцать изолятов являлись двойными мутантами с заменой в folA I100L и вставкой 1 или 2 кодонов в folP aa insert_57–70 и были резистентны к триметоприму-сульфаметоксазолу (табл. 2). Двенадцать изолятов пневмококка, содержащие вставки в folP, имели МПК 2 мг/л и были отнесены к категории чувствительных при увеличенной экспозиции, а 9 изолятов с одиночными мутациями в folP были отнесены к категории чувствительных (МПК ≤ 1 мг/л).
Все 5 изолятов, резистентных к эритромицину, несли ген ermB, 1 резистентный изолят нёс одновременно ermB и mefA, в то же время 2 изолята, имевшие ген mefA, сохраняли фенотипическую чувствительность к эритромицину. У 2 изолятов, резистентных к клиндамицину, были обнаружены гены ermB, но ermB был выявлен также у 2 фенотипически чувствительных изолятов.
В связи с тем, что для S. pneumoniae отсутствуют критерии для определения категории чувствительности к хлорамфениколу, оценка активности данного препарата проводилась на основании значения эпидемиологических точек отсечения (Epidemiological cut-off value). МПК хлорамфеникола для всех исследованных изолятов составила менее 8 мг/л, что соответствует популяции дикого типа), однако 1 изолят нёс ген cat.
Был выявлен 1 изолят, резистентный к респираторным фторхинолонам (левофлоксацину и моксифлоксацину), он имел мутации в генах gyrA и parC. В то же время среди чувствительных к фторхинолонам пневмококков у 1 изолята была выявлена мутация в гене parC.
Генетические детерминанты вирулентности пневмококков
Чтобы получить представление о генетических особенностях, способствующих вирулентности, мы исследовали наличие основных белковых факторов вирулентности пневмококка. У всех инвазивных изолятов пневмококков были обнаружены холинсвязывающие белки (CbpG, LytA и Pce/CbpE), PavA и PfbA, известные как фибронектин- и плазминогенсвязывающие белки, а также гиалуронидаза, пневмолизин, нейраминидаза, связанный с капсулой Cps4A (табл. 3). Цинковая металлопротеиназа С была обнаружена у 9 (13%) изолятов.
Таблица 3. Характеристика генов вирулентности
Гены | Название кодируемого белка | % гомологии | Количество изолятов | |
n | % | |||
cbpG | Холинсвязывающий белок G | 99,30 | 68 | 100 |
lytA | Аутолизин | 98,75 | 68 | 100 |
pce/cbpE | Холинсвязывающий белок Е | 99,18 | 68 | 100 |
ply | Пневмолизин | 99,86 | 68 | 100 |
pavA | Фибронектинсвязывающий белок | 99,52 | 68 | 100 |
pfbA | Плазмин- и фибронектинсвязывающий белок A | 99,72 | 68 | 100 |
hysA | Гиалуронидаза | 99,16 | 68 | 100 |
nanA | Нейраминидаза A | 98,77 | 68 | 100 |
cps4A | Синтез капсулы | 96,54 | 68 | 100 |
zmpC | Цинковая металлопротеиназа C | 99,96 | 9 | 13 |
Обсуждение
В нашем исследовании среди клинических изолятов, вызывающих менингит в России, преобладали пневмококки серотипа 3. Аналогичная ситуация отмечается и во многих других странах в поствакцинальный период. В Австрии, Англии, Канаде, Швеции и Германии за последние 3 года наблюдался значительный рост инвазивных пневмококковых заболеваний серотипа 3 у взрослых [14]. В Бразилии серотип 3 выступал как преобладающая причина инвазивного заболевания в эпоху после ПКВ среди взрослых [15, 16]. Низкая эффективность конъюгированных вакцин против пневмококков серотипа 3 связана с особенностями строения полисахаридной капсулы, которая нековалентно связана с пептидогликаном клеточной стенки [17–21]. Следует отметить, что изоляты линии GPSC12 (серотип 3), оставаясь основной причиной инвазивных форм пневмококковой инфекции во всём мире после введения ПКВ-13, как правило, сохраняют чувствительность к АМП [22–25]. Низкая частота резистентности к АМП изолятов серотипа 3 может быть связана с высокой инвазивностью изолятов данного серотипа и относительно короткой продолжительностью носительства, что, в свою очередь, снижает воздействие АМП при лечении инфекций другой этиологии [26]. В то же время исследование серотипа 3, проведённое в Англии [27], выявило, что с 2018 г. появляются изоляты линии GPSC12, резистентные к пенициллину, макролидам, хлорамфениколу и тетрациклину [28, 29]. Нарастание резистентности изолятов серотипа 3 указывает на циркуляцию более устойчивых к антибиотикам клонов [30]. В нашем исследовании все изоляты S. pneumoniae серотипа 3 были чувствительны к пенициллину, из 12 изолятов, выделенных из ликвора, только 2 содержали гены резистентности к фторхинолонам — parC и к тетрациклину — tetM, сохраняя при этом фенотипическую чувствительность к данным препаратам.
Вторыми по частоте выделения при менингите были пневмококки серотипа 19F, что может быть обусловлено особенностями капсульного полисахарида, который более устойчив к отложению C3b компонента комплемента и антител на стенки бактерии, что снижает чувствительность к опсонофагоцитозу [31, 32]. Полученные нами результаты свидетельствуют о том, что циркуляция серотипа 19F связана с распространением 3 линий: GPSC10, GPSC1 и GPSC44. Все линии характеризовались устойчивостью к различным АМП, причём линии GPSC10 и GPSC1 проявляли множественную антимикробную резистентность. В Канаде доминирование серотипа 19F было связано с распространением линий GPSC1, GPSC4, GPSC9, GPSC10, GPSC18, GPSC44 и GPSC119 [33], в Швеции — линии GPSC1 [34], в Азии, Европе, Северной Америке и Южной Америке серотип 19F был одним из доминирующих в линии GPSC1 [35]. В Южной Африке доминирование серотипа 19F было связано с распространением линий GPSC1 и GPSC21, при этом установлено, что высокая, порядка 50%, внутрибольничная смертность от пневмококкового менингита связана с серотипом 19F [35, 36]. Увеличение частоты встречаемости серотипа 19F после введения ПКВ-13 в Индии было связано с мультирезистентными линиями GPSC1 и GPSC10, при этом особого внимания заслуживает линия GPSC10, которая экспрессировала как вакцинные серотипы, включая 19F, так и невакцинные серотипы и тем самым вносила наибольший вклад в распространение невакцинных серотипов среди клинических изолятов [37]. Линия GPSC10 способна одновременно экспрессировать широкий спектр серотипов, что облегчает её адаптацию к селективному давлению вакцин. Международный набор данных линии GPSC10 показал, что эта линия экспрессирует 16 серотипов, из которых только 6 включены в ПКВ-13. При этом линия GPSC10 обладает относительно высоким потенциалом развития инвазивных форм инфекции и склонностью вызывать менингит, независимо от серотипа [38]. Было установлено, что для распространения пневмококков линии GPSC10 во Франции потребовалось порядка 3–5 лет, а в Испании, Аргентине и Израиле быстрое изменение состава серотипа этой линии произошло в поствакцинальный период. Таким образом, вместе с его трансмиссивностью GPSC10 следует рассматривать как линию высокого риска, которая со временем может снизить эффективность вакцин во всём мире [39, 40]. Е. Егоровой и соавт. установлено, что в России в 2011–2018 гг. изоляты серотипа 19F принадлежали к 8 различным линиям (GPSC1, GPSC44, GPSC10 GPSC6, GPSC11, GPSC18, GPSC43 и GPSC591), из них линии GPSC1, GPSC6 и GPSC10 характеризовались резистентностью к АМП [41].
По результатам настоящего исследования пневмококки серотипа 23F были третьими по распространённости среди серотипов, ответственных за развитие бактериального менингита в России. Четыре из 5 изолятов серотипа 23F принадлежали линии GPSC7, 1 — линии GPSC49. Все изоляты серотипа 23F характеризовались резистентностью к триметоприму-сульфаметоксазолу. В исследованиях, проведённых в Китае и Иране, серотип 23F был одним из доминирующих серотипов, выделенных у пациентов из ликвора [42, 43]. Результаты исследований, выполненных в Великобритании, показали, что изоляты серотипа 23F входили в линию GPSC7. Если в 2002 г. в этой линии преобладал серотип 23F и было лишь небольшое количество серотипа 23А, то в 2009 г. появились изоляты серотипа 23B [29]. Линия GPSC7 была одной из доминирующих линий, ответственных за инвазивные заболевания в эпоху ПКВ-13 в Гонконге, Израиле, Малави, Южной Африке, Гамбии и США [22].
Результаты международных исследований свидетельствуют о том, что поствакцинальный период характеризуется снижением доли вакцинных серотипов и увеличением невакцинных серотипов пневмококков среди разных возрастных групп населения [44, 45]. В популяции сохраняются линии, представленные вакцинными серотипами, в которых уже присутствовали невакцинные серотипы [15]. Отмечено, что эти невакцинные серотипы обладают высоким потенциалом развития инвазивных форм инфекции [46, 47]. Результаты нашего исследования свидетельствуют о том, что в России более 17% случаев пневмококкового менингита были вызваны пневмококками невакцинных серотипов. Обращает на себя внимание относительно высокая доля изолятов с серотипом 15B (6%) и присутствие изолятов с невакцинными серотипами 28А, 37 и 38, которые ранее не были ассоциированы с пневмококковым менингитом на территории России. Установлено, что уровень резистентности к антибиотикам у невакцинных серотипов ниже, чем у вакцинных, и различается в зависимости от линии GPSC. В нашем исследовании линии, экспрессирующие невакцинные серотипы, были чувствительны ко всем тестированным АМП, за исключением 2 линий (табл. 2).
В процессе инвазивной инфекции на разных стадиях участвуют различные факторы вирулентности. По результатам нашего исследования классические гены, кодирующие факторы вирулентности, такие как синтез капсулы, пневмококковый поверхностный адгезин, аутолизин, белок, связывающий фибронектин и пневмолизин, были обнаружены у всех инвазивных изолятов. Интересное наблюдение было сделано в отношении гена zmpC. Он был выявлен только у 9 инвазивных изолятов пневмококка линий GSPC229 (серотип 15С,15B), GSPC3 (серотип 11А), GSPC162 (серотип 4), GSCP904 (серотип 14) и новой линии GSPC (серотип 8). Ранее в исследовании в Нидерландах ген zmpC выявлен у инвазивных серотипов 8, 11А и 4, принадлежащих к линии GPSC3. Установлено, что случаи инвазивных пневмококковых инфекций, вызванные zmpC-положительными пневмококками, чаще сопровождались сепсисом [48]. Японскими учёными высказано предположение о том, что металлопротеаза цинка zmpC подавляет вирулентность пневмококков путём ингибирования бактериальной инвазии в центральную нервную систему [49]. Таким образом, металлопротеаза цинка zmpC представляет отдельный интерес и требует дополнительных исследований.
Выводы
- Выявлено 28 глобальных кластеров пневмококковых последовательностей (GPSC), 45 сиквенс-типов S. pneumoniae, ассоциированных с инвазивными штаммами, на территории России. Из 68 изолятов S. pneumoniae, выделенных у пациентов с бактериальным менингитом, более 17% относились к невакцинным серотипам.
- Антибиотикорезистентность пневмококков вакцинных серотипов была выше, чем у невакцинных серотипов.
- Появление линий невакцинных серотипов пневмококка с детерминантами высокой вирулентности, включая устойчивость к антибиотикам, обусловливает необходимость дальнейших исследований молекулярно-генетической характеристики изолятов, вызывающих менингит.
- Результаты сопоставления фенотипической и генотипической антимикробной резистентности характеризовались хорошей конкордантностью, что указывает на необходимость дальнейшего изучения возможности использования полногеномного секвенирования в качестве диагностического инструмента для выявления механизмов резистентности у клинических изолятов S. pneumoniae.
В заключение следует отметить, что характеристика пневмококковых линий, их генетические вариации, оказывающие влияние на резистентность и инвазивность, являются весьма информативными для создания глобальной стратегии непрерывного эпидемиологического контроля за популяцией пневмококков.
1 WHO bacterial priority pathogens list, 2024: Bacterial pathogens of public health importance to guide research, development and strategies to prevent and control antimicrobial resistance. URL: https://who.int/publications/i/item/9789240093461
2 Национальный cтандарт ГОСТ Р ИСО 2077612022. Исследование чувствительности инфекционных агентов и оценка функциональных характеристик изделий для исследования чувствительности к антимикробным средствам. Часть 1. Референтный метод лабораторного исследования активности антимикробных агентов против быстрорастущих аэробных бактерий, вызывающих инфекционные болезни).
3 European Committee on Antimicrobial Susceptibility testing (EUCAST). Breakpoint tables for interpretation of MICs and zone diameters. Ver. 14.0, 2024. URL: www.eucast.org/clinical_breakpoints/ (дата обращения 01.11.2024).
4 Российские рекомендации. Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2024-02. Смоленск; 2024. 192 с.
5 Streptococcus pneumoniae MLST Databases. URL: https://pubmlst.org/spneumoniae/ (дата обращения: 17.02.2020).
6 A Global Platform for Genomic Surveillancе. URL: https://pathogen.watch
7 AMRseq. URL: https://amrseq.net/ru/
8 BacWGSTdb. URL: http://bacdb.cn/BacWGSTdb/index.php
Об авторах
Аида Нуримановна Чагарян
Научно-исследовательский институт антимикробной химиотерапии Смоленского государственного медицинского университета
Автор, ответственный за переписку.
Email: aida.chagaryan@antibiotic.ru
ORCID iD: 0000-0001-9195-8764
кандидат биол. наук, научный сотрудник лаб. антибиотикорезистентности НИИ антимикробной химиотерапии
Россия, СмоленскНатали Владимировна Иванчик
Научно-исследовательский институт антимикробной химиотерапии Смоленского государственного медицинского университета
Email: natali.ivanchik@antibiotic.ru
ORCID iD: 0000-0002-9392-0732
кандидат мед. наук, старший научный сотрудник лаб. антибиотикорезистентности НИИ антимикробной химиотерапии
Россия, СмоленскАлексей Юрьевич Кузьменков
Научно-исследовательский институт антимикробной химиотерапии Смоленского государственного медицинского университета
Email: alexey.kuzmenkov@antibiotic.ru
ORCID iD: 0000-0001-9562-2096
доктор мед. наук, профессор каф. микробиологии, зам. директора по стратегическим разработкам НИИ антимикробной химиотерапии
Россия, СмоленскРоман Сергеевич Козлов
Научно-исследовательский институт антимикробной химиотерапии Смоленского государственного медицинского университета; Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: roman.kozlov@antibiotic.ru
ORCID iD: 0000-0001-8728-1113
доктор мед. наук, профессор, ректор, директор НИИ антимикробной химиотерапии
Россия, Смоленск; МоскваИрина Игоревна Гапонова
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: gaponova@cmd.su
ORCID iD: 0000-0003-4481-2249
лаборант-исследователь научной группы разработки новых методов выявления генетических полиморфизмов
Россия, МоскваКонстантин Олегович Миронов
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: mironov@pcr.ru
ORCID iD: 0000-0001-8207-9215
доктор мед. наук, рук. научной группы разработки новых методов выявления генетических полиморфизмов
Россия, МоскваСписок литературы
- Principi N., Di Cara G., Bizzarri I., et al. Prevention of invasive pneumococcal disease: problems emerged after some years of the 13-valent pneumococcal conjugate vaccine use. Curr. Infect. Dis. Rep. 2018;20(1):1. DOI: https://doi.org/10.1007/s11908-018-0607-z
- Briles D.E., Paton J.C., Mukerji R., et al. Pneumococcal vaccines. Microbiol. Spectr. 2019;7(6):10.1128/microbiolspec.gpp3-0028-2018. DOI: https://doi.org/10.1128/microbiolspec.GPP3-0028-2018
- Chen H., Matsumoto H., Horita N., et al. Prognostic factors for mortality in invasive pneumococcal disease in adults: a systematic review and meta-analysis. Sci. Rep. 2021;11(1):11865. DOI: https://doi.org/10.1038/s41598-021-91234-y
- Ganaie F., Saad JS., McGee L., et al. A new pneumococcal capsule type, 10D, is the 100th serotype and has a large cps fragment from an oral streptococcus. mBio. 2020;11(3):e00937-20. DOI: https://doi.org/10.1128/mbio.00937-20
- Salvadori G., Junges R., Morrison D.A., Petersen F.C. Competence in Streptococcus pneumoniae and close commensal relatives: mechanisms and implications. Front. Cell. Infect. Microbiol. 2019;9:94. DOI: https://doi.org/10.3389/fcimb.2019.00094
- Протасова И.Н., Бахарева Н.В., Перьянова О.В. и др. Молекулярно-эпидемиологическая характеристика и резистентность пневмококков у детей дошкольного возраста. Сибирское медицинское обозрение. 2018;(3):73–9. Protasova I.N., Bakhareva N.V., Peryanova O.V., et al. Molecular-epidemiological characteristics and resistance of pneumococcus in children of preschool age. Siberian Medical Review. 2018;(3):73–9. DOI: https://doi.org/10.20333/2500136-2018-3-73-79 EDN: https://elibrary.ru/xserud
- Sidorenko S., Rennert W., Lobzin Y., et al. Multicenter study of serotype distribution of Streptococcus pneumoniae nasopharyngeal isolates from healthy children in the Russian Federation after introduction of PCV13 into the National Vaccination Calendar. Diagn. Microbiol. Infect. Dis. 2020;96(1):114914. DOI: https://doi.org/10.1016/j.diagmicrobio.2019.114914
- Протасова И.Н., Мартынова Г.П., Ильенкова Н.А. и др. Этиологическая роль и молекулярно-генетические особенности Streptococcus pneumoniae при инфекционных заболеваниях у детей. Детские инфекции. 2020;19(1):7–12. DOI: https://doi.org/10.22627/2072-8107-2020-19-1-7-12 EDN: https://elibrary.ru/dwibms
- Миронов К.О., Гапонова И.И., Корчагин В.И. и др. Антигенная и генетическая характеристика штаммов Streptococcus pneumoniae, выделенных от больных инвазивными и неинвазивными пневмококковыми инфекциями, с использованием высокопроизводительного секвенирования. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(5):512–8. Mironov K.O., Gaponova I.I., Korchagin V.I., et al. Antigenic and genetic characterization of Streptococcus pneumoniae strains isolated from patients with invasive and non-invasive pneumococcal infections by using high-throughput sequencing. Journal of Microbiology, Epidemiology and Immunobiology. 2021;98(5):512–8. DOI: https://doi.org/10.36233/0372-9311-144, EDN: https://elibrary.ru/kvjhkq
- Vohrnová S., Kozáková J. Posibilities for use of whole genome sequencing (WGS) for the analysis of Streptococcus pneumoniae isolates. Epidemiol. Mikrobiol. Imunol. 2024;73(1):30–6. DOI: https://doi.org/10.61568/emi/11-6254/20240123/136240 (in Czech)
- Иванчик Н.В., Чагарян А.Н., Сухорукова М.В. и др. Антибиотикорезистентность клинических штаммов Streptococcus pneumoniae в России: результаты многоцентрового эпидемиологического исследования «ПеГАС 2014–2017». Клиническая микробиология и антимикробная химиотерапия. 2019;21(3):230–7. Ivanchik N.V., Chagaryan A.N., Sukhorukova M.V., et al. Antimicrobial resistance of clinical Streptococcus pneumoniae isolates in Russia: the results of multicenter epidemiological study «Pehasus 2014–2017». Clinical Microbiology and Antimicrobial Chemotherapy. 2019;21(3):230–7. DOI: https://doi.org/10.36488/cmac.2019.3.230-237, EDN: https://elibrary.ru/hlaxrl
- Миронов К.О., Корчагин В.И., Михайлова Ю.В. и др. Характеристика штаммов Streptococcus рneumoniae, выделенных от больных инвазивными пневмококковыми инфекциями, с использованием высокопроизводительного секвенирования. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;97(2):113–8. Mironov K.O., Korchagin V.I., Mikhailova Yu.V., et al. Characterization of Streptococcus pneumoniae strains causing invasive infections using whole-genome sequencing. Journal of Microbiology, Epidemiology and Immunobiology. 2020;97(2):113–8. DOI: https://doi.org/10.36233/0372-9311-2020-97-2-113-118 EDN: https://elibrary.ru/lnxmqy
- Kawaguchiya M., Urushibara N., Aung M.S., et al. Genetic characterization of penicillin-binding proteins of nonencapsulated Streptococcus pneumoniae in the postpneumococcal conjugate vaccine era in Japan. Int. J. Infect. Dis. 2022;120:174–6. DOI: https://doi.org/10.1016/j.ijid.2022.04.033
- Grant L.R., Slack M.P.E., Theilacker C., et al. Distribution of serotypes causing invasive pneumococcal disease in older adults from high-income countries and impact of pediatric and adult vaccination policies. Vaccine. 2023;41(38):5662–9. DOI: https://doi.org/10.1016/j.vaccine.2023.08.001
- Brandileone M.C.C., Almeida S.C.G., Minamisava R., Andrade A.L. Distribution of invasive Streptococcus pneumoniae serotypes before and 5 years after the introduction of a 10-valent pneumococcal conjugate vaccine in Brazil. Vaccine. 2018;36(19):2559–66. DOI: https://doi.org/10.1016/j.vaccine.2018.04.010
- Almeida S.C.G., Cassiolato A.P., Dias U.J., et al. Molecular characterization of invasive Streptococcus pneumoniae isolated in pre (2005–2009) and post (2011–2015) 10-valent pneumococcal conjugate vaccine introduction in Brazil. In: 37th Annual Meeting of the European Society for Paediatric Infectious Diseases. Ljubljana, Slovenia;2019.
- Shenoy A.T., Beno S.M., Brissac T., et al. Severity and properties of cardiac damage caused by Streptococcus pneumoniae are strain dependent. PLoS One. 2018;13(9):e0204032. DOI: https://doi.org/10.1371/journal.pone.0204032
- Andrews N., Kent A., Amin-Chowdhury Z., et al. Effectiveness of the seven-valent and thirteen-valent pneumococcal conjugate vaccines in England: The indirect cohort design, 2006–2018. Vaccine. 2019;37(32):4491–8. DOI: https://doi.org/10.1016/j.vaccine.2019.06.071
- Wijayasri S., Hillier K., Lim GH., et al. The shifting epidemiology and serotype distribution of invasive pneumococcal disease in Ontario, Canada, 2007–2017. PLoS One. 2019;14(12):e0226353. DOI: https://doi.org/10.1371/journal.pone.0226353
- Goettler D., Streng A., Kemmling D., et al. Increase in Streptococcus pneumoniae serotype 3 associated parapneumonic pleural effusion/empyema after the introduction of PCV13 in Germany. Vaccine. 2020;38(3):570–7. DOI: https://doi.org/10.1016/j.vaccine.2019.10.056
- Babb R., Doyle C.R., Pirofski L.A. Isolation and characterization of human monoclonal antibodies to pneumococcal capsular polysaccharide 3. Microbiol. Spectr. 2021;9(3):e0144621. DOI: https://doi.org/10.1128/Spectrum.01446-21
- Lo SW., Gladstone RA., van Tonder AJ., et al. Pneumococcal lineages associated with serotype replacement and antibiotic resistance in childhood invasive pneumococcal disease in the post-PCV13 era: an international whole-genome sequencing study. Lancet Infect. Dis. 2019;19(7):759–69. DOI: https://doi.org/10.1016/s1473-3099(19)30297-x
- Kandasamy R., Voysey M., Collins S., et al. Persistent circulation of vaccine serotypes and serotype replacement after 5 years of infant immunization with 13-valent pneumococcal conjugate vaccine in the United Kingdom. J. Infect. Dis. 2020;221(8):1361–70. DOI: https://doi.org/10.1093/infdis/jiz178
- Løchen A., Croucher N.J., Anderson R.M. Divergent serotype replacement trends and increasing diversity in pneumococcal disease in high-income settings reduce the benefit of expanding vaccine valency. Sci. Rep. 2020;10(1):18977. DOI: https://doi.org/10.1038/s41598-020-75691
- Kwun M.J., Ion A.V., Cheng H.C., et al. Post-vaccine epidemiology of serotype 3 pneumococci identifies transformation inhibition through prophage-driven alteration of a non-coding RNA. Genome Med. 2022;14(1):144. DOI: https://doi.org/10.1186/s13073-022-01147-2
- Butić I., Gužvinec M., Jelić M., et al. Serotype distribution and antimicrobial resistance of invasive Streptococcus pneumoniae isolates among Croatian adults during a fifteen-year period (2005–2019). Croat. Med. J. 2022;63(2):156–65. DOI: https://doi.org/10.3325/cmj.2022.63.156
- Azarian T., Mitchell P.K., Georgieva M., et al. Global emergence and population dynamics of divergent serotype 3 CC180 pneumococci. PLoS Pathog. 2018;14(11):e1007438. DOI: https://doi.org/10.1371/journal.ppat.1007438
- Sheppard C.L., Groves N., Andrews N., et al. The genomics of Streptococcus рneumoniae carriage isolates from UK children and their household contacts, pre-PCV7 to post-PCV13. Genes (Basel). 2019;10(9):687. DOI: https://doi.org/10.3390/genes10090687
- Groves N., Sheppard CL., Litt D., et al. Evolution of Streptococcus pneumoniae serotype 3 in England and Wales: a major vaccine evader. Genes (Basel). 2019;10(11):845. DOI: https://doi.org/10.3390/genes10110845
- Suaya J.A., Mendes R.E., Sings R.E., et al. Streptococcus pneumoniae serotype distribution and antimicrobial nonsusceptibility trends among adults with pneumonia in the United States, 2009‒2017. J. Infect. 2020;81(4):557–66. DOI: https://doi.org/10.1016/j.jinf.2020.07.035
- Sanapala S.R., Seco B.M.S., Baek J.Y., et al. Chimeric oligosaccharide conjugate induces opsonic antibodies against Streptococcus pneumoniae serotypes 19A and 19F. Chem. Sci. 2020;11(28):7401–7. DOI: https://doi.org/10.1039/d0sc02230f
- Downs SL., Olwagen CP., Van Der Merwe L., et al. Streptococcus pneumoniae and other bacterial nasopharyngeal colonization seven years post-introduction of 13-valent pneumococcal conjugate vaccine in South African children. Int. J. Infect. Dis. 2023;134: 45–52. DOI: https://doi.org/10.1016/j.ijid.2023.05.016
- Golden A.R., Adam H.J., Baxter M., et al. Whole genome characterization of Streptococcus pneumoniae from respiratory and blood cultures collected from Canadian hospitals before and after PCV-13 implementation in Canada: Focus on serotypes 22F and 33F from CANWARD 2007–2018. Vaccine. 2021;39(39): 5474–83. DOI: https://doi.org/10.1016/j.vaccine.2021.08.061
- Yamba Yamba L., Uddén F., Fuursted K., et al. Extensive/multidrug-resistant pneumococci detected in clinical respiratory tract samples in Southern Sweden are closely related to international multidrug-resistant lineages. Front. Cell. Infect. Microbiol. 2022;12:824449. DOI: https://doi.org/10.3389/fcimb.2022.824449
- Gladstone R.A., Lo S.W., Lees J.A., et al. International genomic definition of pneumococcal lineages, to contextualise disease, antibiotic resistance and vaccine impact. EBioMedicine. 2019;43:338–46. DOI: https://doi.org/10.1016/j.ebiom.2019.04.021
- Lekhuleni C., Ndlangisa K., Gladstone R.A., et al. Impact of pneumococcal conjugate vaccines on invasive pneumococcal disease-causing lineages among South African children. Nat. Commun. 2024;15(1):8401. DOI: https://doi.org/10.1038/s41467-024-52459-3
- Nagaraj G., Govindan V., Ganaie F., et al. Streptococcus pneumoniae genomic datasets from an Indian population describing pre-vaccine evolutionary epidemiology using a whole genome sequencing approach. Microb. Genom. 2021;7(9):000645. DOI: https://doi.org/10.1099/mgen.0.000645
- Lo S.W., Gladstone R.A., van Tonder A.J., et al. A mosaic tetracycline resistance gene tet(S/M) detected in an MDR pneumococcal CC230 lineage that underwent capsular switching in South Africa. J. Antimicrob. Chemother. 2020;75(3):512–20. DOI: https://doi.org/10.1093/jac/dkz477
- Gagetti P., Lo SW., Hawkins PA., et al. Population genetic structure, serotype distribution and antibiotic resistance of Streptococcus pneumoniae causing invasive disease in children in Argentina. Microb. Genom. 2021;7(9):000636. DOI: https://doi.org/10.1099/mgen.0.000636
- Lo S.W., Mellor K., Cohen R., Alonso A.R. Emergence of a multidrug-resistant and virulent Streptococcus pneumoniae lineage mediates serotype replacement after PCV13: an international whole-genome sequencing study. Lancet Microbe. 2022;3(10):e735–43. DOI: https://doi.org/10.1016/s2666-5247(22)00158-6
- Egorova E., Kumar N., Gladstone R.A., et al. Key features of pneumococcal isolates recovered in Central and Northwestern Russia in 2011–2018 determined through whole-genome sequencing. Microb. Genom. 2022;8(9):mgen000851. DOI: https://doi.org/10.1099/mgen.0.000851
- Beheshti M., Jabalameli F., Feizabadi M.M., et al. Molecular characterization, antibiotic resistance pattern and capsular types of invasive Streptococcus pneumoniae isolated from clinical samples in Tehran, Iran. BMC Microbiol. 2020;20(1):167. DOI: https://doi.org/10.1186/s12866-020-01855-y
- Zhou M., Wang L., Wang Z., et al. Molecular characterization of penicillin-binding protein2x, 2b and 1a of Streptococcus pneumoniae causing invasive pneumococcal diseases in China: a multicenter study. Front. Microbiol. 2022;13:838790. DOI: https://doi.org/10.3389/fmicb.2022.838790
- Ouldali N., Varon E., Levy C., et al. Invasive pneumococcal disease incidence in children and adults in France during the pneumococcal conjugate vaccine era: an interrupted time-series analysis of data from a 17-year national prospective surveillance study. Lancet Infect. Dis. 2021;21(1):137–47. DOI: https://doi.org/10.1016/S1473-3099(20)30165-1
- Andrejko K., Ratnasiri B., Lewnard J.A. Association of pneumococcal serotype with susceptibility to antimicrobial drugs: a systematic review and meta-analysis. Clin. Infect. Dis. 2022;75(1):131–40. DOI: https://doi.org/10.1093/cid/ciab852
- Balsells E., Dagan R., Yildirim I., et al. The relative invasive disease potential of Streptococcus pneumoniae among children after PCV introduction: a systematic review and meta-analysis. J. Infect. 2018;77(5):368–78. DOI: https://doi.org/10.1016/j.jinf.2018.06.004
- Amin-Chowdhury Z., Collins S., Sheppard C., et al. Characteristics of invasive pneumococcal disease caused by emerging serotypes after the introduction of the 13-valent pneumococcal conjugate vaccine in England: a prospective observational cohort study, 2014–2018. Clin. Infect. Dis. 2020;71(8):e235–43. DOI: https://doi.org/10.1093/cid/ciaa043
- Hansen C.B., Fuursted K., Valentiner-Branth P., et al. Molecular characterization and epidemiology of Streptococcus pneumoniae serotype 8 in Denmark. BMC Infect. Dis. 2021;21(1):421. DOI: https://doi.org/10.1186/s12879-021-06103-w
- Yamaguchi M. Investigation of pneumococcal virulence factors in the infection process. Nihon Saikingaku Zasshi. 2020;75(2): 173–83. DOI: https://doi.org/10.3412/jsb.75.173 (in Japanese)
Дополнительные файлы