Детекция генетических детерминант потенциально онкогенных представителей микробиоты кишечника в качестве биомаркеров колоректального рака
- Авторы: Шумилова В.Н.1, Гончаров А.Е.1,2, Азаров Д.В.1,2, Ситкин С.И.1,2,3, Латария Э.Л.1, Асланов Б.И.1, Бобраков М.А.1, Топузов Р.Э.1
-
Учреждения:
- Северо-Западный государственный медицинский университет имени И.И. Мечникова
- Институт экспериментальной медицины
- Национальный медицинский исследовательский центр имени В.А. Алмазова
- Выпуск: Том 101, № 5 (2024)
- Страницы: 668-678
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18688
- DOI: https://doi.org/10.36233/0372-9311-564
- EDN: https://elibrary.ru/fximcu
- ID: 18688
Цитировать
Аннотация
Введение. Колоректальный рак (КРР) является второй по значимости причиной смертности от рака в мире. Для скрининга КРР применяются неинвазивные методы диагностики, основанные на определении скрытой крови в стуле (фекальный иммунохимический тест, гваяковый тест), хорошо зарекомендовавшие себя в клинических исследованиях. Однако существенным недостатком неинвазивных методов диагностики является невысокая чувствительность при выявлении онкологического процесса на ранних стадиях. В ряде современных работ обсуждается связь заболевания с различными потенциально онкогенными микроорганизмами (МО) в кишечном тракте человека, которые могут быть использованы для расширения арсенала неинвазивных методов диагностики КРР на основе молекулярно-генетического исследования образца кала для идентификации онкогенных МО.
Цель исследования — оценка возможности использования генетических детерминант потенциально онкогенных МО в качестве маркеров КРР, основанная на сопоставлении их распространённости в группах пациентов с КРР, факультативными предраковыми состояниями и пациентов без патологии кишечника.
Материалы и методы. В исследование, организованное по дизайну «случай–контроль», было включено 215 участников: 70 пациентов с впервые выявленным КРР, 70 пациентов с воспалительными заболеваниями кишечника, 75 участников без диагностированной патологии кишечника. Детекцию генов потенциально онкогенных МО осуществляли с помощью метода полимеразной цепной реакции.
Результаты и обсуждение. Установлена связь между КРР и наличием гена фрагилизина Bacteroides fragilis (ОШ = 7,00; 95% ДИ 2,55–22,50; p < 0,001), видоспецифических генов пародонтопатогенных МО Fusobacterium nucleatum (ОШ = 5,61; 95% ДИ 2,87–11,30; p < 0,001) и Porphyromonas gingivalis (ОШ = 16,3; 95% ДИ 4,33–106,00; p < 0,001), гена clbB острова патогенности pks энтеробактерий (ОШ = 3,44; 95% ДИ 1,39–8,51; p = 0,010).
Заключение. Наличие в составе кишечного микробиома генетических маркеров потенциально онкогенных видов бактерий ассоциировано с КРР. Полученные результаты обосновывают возможность применения молекулярно-генетической детекции изученных потенциально онкогенных МО в качестве метода неинвазивной диагностики КРР.
Полный текст
Введение
Колоректальный рак (КРР) является 3-м по распространённости видом рака и 2-й по значимости причиной смертности от рака в мире [1]. Обращает на себя внимание тренд на рост заболеваемости КРР среди лиц моложе 50 лет [2]. Для выявления онкологических заболеваний толстой кишки применяются неинвазивные (тест на скрытую кровь в стуле, гваяковый тест и фекальный иммунохимический тест (ФИТ)) и инвазивные (гибкая ректороманоскопия, колоноскопия) методы диагностики. Очевидными преимуществами неинвазивных методов диагностики являются их простота и доступность для скрининговых обследований лиц из групп риска.
Использование в скрининговых исследованиях методов неинвазивной диагностики, таких как ФИТ, позволяет добиться снижения смертности от КРР на 27% [3]. Метаанализ результатов 4 рандомизированных контролируемых исследований продемонстрировал, что применение гваякового теста и гибкой ректороманоскопии способствует снижению смертности от КРР на 18 и 26% соответственно [4].
Однако существенным недостатком неинвазивных методов является их невысокая диагностическая чувствительность на ранних стадиях заболевания. Так, чувствительность ФИТ на I стадии КРР составляет 68% (95% ДИ 57–78%), на II — 92% (95% ДИ 87–96%), на III — 82% (95% ДИ 73–89%) [5]. Таким образом, существует необходимость расширения арсенала доступных неинвазивных методов для скрининга КРР.
В качестве диагностических маркеров КРР могут выступать особенности количественного и качественного состава микробиоты, что подробно рассмотрено в обзорах, посвящённых роли кишечной микробиоты в развитии и диагностике онкологических заболеваний кишечника [6, 7]. Многочисленные исследования выявили изменения в составе микробиома кишечника, ассоциированные с развитием КРР, что позволяет предположить возможность использования идентификации отдельных представителей кишечного микробиома в качестве самостоятельного метода неинвазивной диагностики КРР или дополнения к существующим неинвазивным методам.
Первая модель классификации, основанная на микробных маркерах кишечника и позволявшая отличать пациентов с КРР от контроля, была предложена G. Zeller и соавт. [8]. Алгоритм классификации включал данные об относительной численности 22 видов микроорганизмов (МО), однако по крайней мере половину предсказательной силы модели определяли всего 4 вида: два вида Fusobacterium, Porphyromonas asaccharolytica и Peptostreptococcus stomatis, представленность каждого из которых была повышена при КРР.
Авторы из Китайского университета Гонконга разработали диагностическую модель, демонстрирующую специфичность 81,2% и чувствительность 93,8% при сочетании ФИТ и 4 бактериальных маркеров (ген-маркер “m3” “Lachnoclostridium” sp., Fusobacterium nucleatum, Hungatella hathewayi (базоним: Clostridium hathewayi) и Bacteroides clarus) [9]. В более раннем исследовании экспериментальная модель на основе 23 МО семейств Oscillospiraceae (гетеротипический синоним: Ruminococcaceae) и Lachnospiraceae, родов Bacteroides, Porphyromonas, Parabacteroides, Collinsella и семейства Enterobacteriaceae выявила в выборке из 490 пациентов 91,7% случаев КРР по сравнению с 75,0% случаев, выявленных с помощью ФИТ [10].
К числу МО, наиболее тесно ассоциированных с КРР, относятся как некоторые патобионты полости рта, так и кишечные бактерии. Первые, помимо уже упомянутых представителей родов Fusobacterium, Porphyromonas и Peptostreptococcus, включают Parvimonas micra, Gemella morbillorum, Tannerella forsythia и некоторые другие виды [11]. Кишечные бактерии чаще всего представлены энтеротоксигенными штаммами Bacteroides fragilis, патогенными и условно-патогенными бактериями семейства Enterobacteriaceae (Escherichia coli, Salmonella spp., Klebsiella pneumoniae, Citrobacter rodentium), а также Campylobacter jejuni, Morganella morganii, Enterococcus faecalis, Clostridioides difficile и др. [12].
На основании результатов обзора литературы были отобраны МО, наиболее часто ассоциированные с КРР по данным исследований. К числу потенциально онкогенных МО мы отнесли колибактин-продуцирующие энтеробактерии, несущие гены clbA и clbB в составе острова патогенности pks, фрагилизин-продуцирующие Bacteroides fragilis, несущие ген bft, пародонтопатогенные бактерии Fusobacterium nucleatum и Porphyromonas gingivalis [6]. Дополнительным фактором в пользу включения указанных МО в список потенциальных онкогенов послужила их связь со стадийностью (прогрессированием) КРР, прогнозом/выживаемостью и резистентностью к терапии у пациентов с КРР [13, 14].
С учётом вероятных региональных, этнических и прочих особенностей количественного и качественного состава кишечной микробиоты, актуальна оценка распространённости указанных выше потенциально онкогенных МО среди населения России и их роли в развитии КРР.
Целью настоящего исследования является оценка возможности использования генетических детерминант потенциально онкогенных МО в качестве маркеров КРР, основанная на сопоставлении их распространённости в группах пациентов с КРР, факультативными предраковыми состояниями и пациентов без патологии кишечника.
Материалы и методы
На базе клинических подразделений Клиники им. Петра Великого СЗГМУ им. И.И. Мечникова и Городского онкологического диспансера Санкт-Петербурга в 2022–2024 гг. проведено исследование «случай–контроль». В исследовании приняли участие 215 человек: группа из 70 пациентов с диагностированным КРР (группа КРР); группа из 70 пациентов с воспалительными заболеваниями кишечника (язвенный колит, болезнь Крона — группа ВЗК); 75 участников без диагностированной патологии кишечника (контрольная группа). Исследование проводилось при добровольном информированном согласии пациентов и было одобрено на заседании Локального этического комитета СЗГМУ им. И.И. Мечникова (протокол № 10 от 03.11.2021).
В группе пациентов с КРР распределение по стадиям онкологического процесса с учётом классификации TNM было следующим: 0 стадия — 1 пациент; I стадия — 17 пациентов; II — 13 пациентов; III — 37 пациентов; IV — 12 пациентов.
Критерии включения в исследование пациентов из группы КРР: возраст старше 18 лет; установленный впервые на основании данных анамнеза, физикального обследования, морфологического исследования опухолевого материала, данных инструментальных и лабораторных методов обследования диагноз КРР; получение от пациента клинического материала (кал).
Критерии включения в исследование пациентов из группы ВЗК: возраст старше 18 лет; установленный диагноз ВЗК.
Критерии включения в исследование пациентов из контрольной группы: возраст старше 18 лет; отсутствие диагностированных ВЗК и КРР.
Критерии исключения для всех групп исследования: приём антибактериального препарата за последние 30 дней и/или прохождение эндоскопического исследования (колоноскопии, ректороманоскопии) за последние 14 дней до сдачи клинического материала (кал).
Образцы клинического материала, полученные от участников исследования, до проведения молекулярно-генетических исследования хранили при температуре –20ºС.
ДНК из образцов фекалий для постановки полимеразной цепной реакции (ПЦР) выделяли методом сорбции на магнитных частицах с использованием набора реагентов «MetaFec» («Raissol»). В постановке ПЦР были применены последовательности праймеров, использованные ранее для идентификации потенциально онкогенных МО (табл. 1).
Таблица 1. Нуклеотидные последовательности праймеров для идентификации потенциально онкогенных МО
Table 1. Nucleotide sequences of primers for identification of potentially oncogenic microorganisms
Детектируемый ген Target gene | Номер доступа в GenBank GenBank Accession number | Прямой праймер/обратный праймер Forward primer/reverse primer | Источник Source |
Ген clbA pks+ (поликетидсинтаза) E. coli The clbA pks+ (polyketide synthase) gene of E. coli | CP155641.1 | 5'-CTCCACAGGAAGCTACTAAC-3' 5'-CGTGGTGATAAAGTTGGGAC-3' | [15] |
Ген clbB pks+ (поликетидсинтаза) E. coli Тhe clbB pks+ (polyketide synthase) gene of E. coli | CP155641.1 | 5'-GCAACATACTCGCCCAGACT-3' 5'-TCTCAAGGCGTTGTTGTTTG-3' probe FAM (5'-CAAGGTGCGCGCTAGGCTGT-3'); | [16] |
Ген фрагилизина (bft), синтезируемого энтеротоксигенным B. fragilis Тhe fragilisin (bft) gene synthesized by enterotoxigenic B. fragilis | AF103902.1 | 5'-GAACCTAAAACGGTATATGT-3' 5'-GTTGTAGACATCCCACTGGC-3' | [15] |
Ген адгезина fadA F. nucleatum fadA adhesion protein gene of F. nucleatum | DQ012973.1 | 5'-GCAGTTTCTGCTTCAGCATTT-3' 5'-TGCTTGAAGTCTTTGAGCTCTTT-3' | [17] |
Ген биоплёнкообразования fimA P. gingivalis fimA gene for biofilm formation of P. gingivalis | AB195793.1 | 5'-TGCGACGCTATATGCAAGAC-3' 5'-TCTTCAAAACCACGCTGATG-3' | [17] |
Для идентификации потенциально онкогенных МО была проведена количественная ПЦР с гибридизационно-флуоресцентной детекцией (термоциклер «Bio-Rad CFX96») для clbB pks+ и качественная ПЦР (термоциклер «Bio-Rad T100 Thermal Cycler») с электрофоретической детекцией для остальных маркеров.
Случаев неспецифической амплификации выявлено не было.
Валидацию результатов амплификации маркерных генов проводили методом капиллярного секвенирования ампликонов на приборе «GenomeLab GeXP» («Beckman Coulter, Inc.»), при этом во всех случаях были получены последовательности, соответствующие последовательностям целевых фрагментов маркерных генов, представленным в GenBank (табл. 1). Аликвоты тотальной ДНК из первых 5 образцов биологического материала, в которых были получены положительные результаты ПЦР, после подтверждения специфичности амплификации секвенированием были использованы в качестве положительных контролей, а в качестве отрицательного контроля служила стерильная деионизированная вода.
Для статистической обработки данных была использована программа «R» («RStudio»). Для количественной оценки связи потенциально онкогенных МО с КРР определяли показатели отношения шансов (ОШ) и 95% доверительные интервалы (ДИ) к ним. Чувствительность, специфичность и ДИ были рассчитаны с помощью программы «Epitools»1. Статистически значимыми считали результаты при p < 0,05.
Результаты
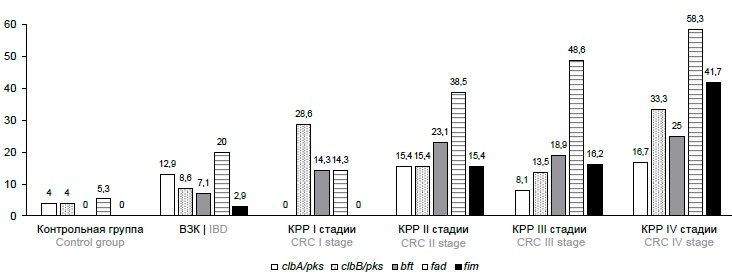
Исследование образцов клинического материала методом ПЦР позволило определить частоты обнаружения генетических маркеров потенциально онкогенных МО у пациентов с КРР на различных стадиях заболевания и в группах сравнения (рисунок). У пациентов с КРР выявлена более высокая распространённость потенциально онкогенных маркеров по сравнению с пациентами с ВЗК и участниками контрольной группы. Прослеживается прямая связь между стадией онкологического заболевания и распространённостью потенциально онкогенных маркеров, в частности ДНК F. nucleatum, а также обращает на себя внимание более высокая частота обнаружения пародонтопатогенных МО на поздних стадиях онкологического процесса. На ранних стадиях опухоли превалируют колибактин-продуцирующие бактерии, несущие ген clbB острова патогенности pks.
Распространённость потенциально онкогенных МО у пациентов с КРР на различных стадиях заболевания и в группах сравнения.
The prevalence of potentially oncogenic microorganisms in patients with CRC at various stages of the disease and in comparison groups.
В ходе исследования «случай–контроль» отмечена ассоциация отдельных потенциально онкогенных представителей микробиома кишечника с КРР (табл. 2). Так, наличие гена bft энтеротоксигенного B. fragilis значимо различается в группах пациентов с ВЗК и пациентов с КРР и ассоциировано с микробиомом пациентов с КРР (ОШ = 3,25; 95% ДИ 1,16–10,6; p = 0,033). Кроме того, обнаружена более высокая распространённость данного гена у пациентов с КРР по сравнению с пациентами с ВЗК, а в образцах от участников контрольной группы ген фрагилизина энтеротоксигенного B. fragilis не обнаружен.
Таблица 2. Представители кишечного микробиома, ассоциированные с КРР
Table 2. Representatives of the intestinal microbiome associated with CRC
Детектируемый ген Target gene | КРР, n (%) CRC, n (%) | ВЗК, n (%) IBD, n (%) | Контроль, n (%) Control, n (%) | ОШ (95% ДИ) | OR (95% CI) | |||
КРР/ВЗК CRC/IBD | КРР/контроль CRC/Control | КРР + ВЗК/контроль CRC + IBD/Control | КРР/ВЗК + контроль CRC/IBD + Control | ||||
Ген фрагилизина bft энтеротоксигенного B. fragilis Fragilisin bft gene of enterotoxigenic B. fragilis | 14 (20%) | 5 (7,1%) | 0 (0%) | 3,25 (1,16–10,6) | ∞ | ∞ | 7 (2,55–22,5) |
Ген адгезина fadA F. nucleatum fadA adhesion protein gene of F. nucleatum | 31 (44%) | 14 (20%) | 4 (5,3%) | 3,18 (1,52–6,9) | 14,1 (5,13–50,1) | 8,41 (2,89–24,46) | 5,61 (2,87–11,3) |
Ген биоплёнкообразования fimA P. gingivalis fimA gene for biofilm formation of P. gingivalis | 13 (19%) | 2 (2,9%) | 0 (0%) | 7,75 (2,03–50,9) | ∞ | ∞ | 16,3 (4,33–106) |
Ген clbA острова патогенности pks E. coli Тhe gene clbA of the pks pathogenicity island of E. coli | 7 (10%) | 9 (13%) | 3 (4,0%) | 0,75 (0,25–2,15) | 2,67 (0,71–12,8) | 3,09 (0,87–10,99) | 1,23 (0,44–3,21) |
Ген clbB острова патогенности pks E. coli Тhe gene clbB of the pks pathogenicity island of E. coli | 13 (19%) | 6 (8,6%) | 3 (4,0%) | 2,43 (0,9–7,31) | 5,47 (1,49–20,14) | 3,77 (1,08–13,18) | 3,44 (1,39–8,51) |
Примечание. ∞ — в связи с нулевым значением знаменателя рассчитать показатель ОШ не представляется возможным.
Note. ∞ — due to the zero value of the denominator, it is not possible to calculate the OR indicator.
По данным проведённого исследования установлено, что наличие ДНК пародонтопатогенного МО F. nucleatum ассоциировано с КРР, и частота её обнаружения различается в группе случаев и контрольных группах. У пациентов с ВЗК наличие ДНК другого пародонтопатогенного МО — P. gingivalis (ОШ = 7,75; 95% ДИ 2,03–50,9; p = 0,009) ассоциировано с КРР.
Частота идентификации ДНК F. nucleatum была выше у пациентов с КРР (44%) по сравнению с пациентами с ВЗК (22%) и участниками контрольной группы (5,3%). Была обнаружена высокая частота выявления ДНК P. gingivalis у пациентов с КРР (в 19% образцах) по сравнению с пациентами с ВЗК (в 2,9% образцах), ДНК P. gingivalis не обнаружена у участников контрольной группы.
В ходе исследования обнаружено, что наличие гена clbB острова патогенности pks энтеробактерий (ОШ = 5,47; 95% ДИ 1,49–20,14; p = 0,015) ассоциировано с КРР и позволяет отделить микробиом пациентов с этой патологией от микробиома участников контрольной группы. Детектируемый ген clbB острова патогенности pks энтеробактерий обнаружен в 19% образцах пациентов с КРР, в 8,6% — у пациентов с ВЗК, в 4% — у участников контрольной группы. Напротив, частота идентификации гена clbA не различалась в группах сравнения. Ген clbА выявлен в 10% образцах у пациентов с КРР, в 13% — у пациентов с ВЗК, в 4% — у участников контрольной группы.
У пациентов с КРР частота обнаружения маркеров потенциально онкогенных МО не зависела от локализации опухоли: детекция F. nucleatum в опухоли дистального расположения — в 14 случаях, проксимального расположения — в 15; P. gingivalis — в 5 и 7 случаях; гена clbB острова патогенности pks энтеробактерий — в 6 и 7 случаях; гена clbА — в 2 и 5 случаях; гена фрагилизина bft энтеротоксигенного B. fragilis — в 6 и 7 случаях соответственно. Не выявлено значимых различий, связанных с морфологическим типом опухоли (обнаружение F. nucleatum в 18 случаях высокодифференцированной опухоли, в 13 случаях низкодифференцированной опухоли; P. gingivalis — в 6 и 7 случаях; гена clbB острова патогенности pks энтеробактерий — в 7 и 6 случаях; гена clbА — в 4 и 3 случаях; гена фрагилизина bft энтеротоксигенного B. fragilis — в 6 и 8 соответственно). Таким образом, детекция маркеров потенциально онкогенных МО позволяет различать КРР вне зависимости от локализации и морфологического типа опухоли.
С учётом полученных данных, нами рассчитаны показатели чувствительности и специфичности диагностического теста, позволяющего различить микробиомы пациентов с КРР и микробиомы пациентов с ВЗК и участников контрольной группы при отдельном и совместном обнаружении генетических детерминант потенциально онкогенных МО (табл. 3). Оптимальным (по сочетанию чувствительности и специфичности) представляется вариант тестирования, при котором учитывается факт идентификации ДНК хотя бы 1 из 5 потенциальных микробных онкомаркеров.
Таблица 3. Характеристика чувствительности и специфичности идентификации потенциально онкогенных МО для диагностики КРР
Table 3. Characterization of sensitivity and specificity of identification of potentially oncogenic microorganisms for the diagnosis of CRC
Параметр метода диагностики Parameter of the diagnostic method | КРР, n CRC, n | ВЗК + контроль, n IBD + control, n | Чувствительность, % (95% ДИ) Sensitivity, % (95% CI) | Специфичность, % (95% ДИ) Specificity, % (95% CI) |
Обнаружение гена clbА Detection of the clbA gene | 7 | 11 | 10 (5–19) | 92 (86–95) |
Обнаружение гена фрагилизина bft энтеротоксигенного B. fragilis Detection of the fragilisin bft gene of enterotoxigenic B. fragilis | 14 | 5 | 20 (12–31) | 97 (92–99) |
Обнаружение гена адгезина fadA F. nucleatum Detection the fadA adhesion protein gene of F. nucleatum | 31 | 18 | 44 (33–56) | 88 (81–92) |
Обнаружение гена биоплёнкообразования fimA P. gingivalis Detection the fimA gene for biofilm formation of P. gingivalis | 13 | 2 | 19 (11–29) | 99 (95–99) |
Обнаружение гена clbB Detection of the clbB gene | 13 | 9 | 19 (11–29) | 94 (89–97) |
Обнаружение 1 и более МО Detection of 1 or more microorganisms | 36 | 27 | 51 (39–64) | 81 (74–87) |
Обнаружение 2 и более МО Detection of 2 or more microorganisms | 22 | 10 | 31 (21–44) | 93 (88–97) |
Обнаружение 3 и более МО Detection of 3 or more microorganisms | 12 | 4 | 17 (9–28) | 97 (93–99) |
Обнаружение 4 и более МО Detection of 4 or more microorganisms | 6 | 3 | 9 (3–18) | 98 (94–100) |
Обнаружение 5 и более МО Detection of 5 or more microorganisms | 2 | 2 | 3 (0,35–10,00) | 99 (95–100) |
Обсуждение
В настоящем исследовании мы оценили распространённость потенциально онкогенных МО, ассоциированных с КРР, среди жителей российского мегаполиса с диагностированными КРР, ВЗК и лиц без патологии кишечного тракта.
Известно, что B. fragilis является комменсальным представителем микробиоты кишечника. В желудочно-кишечном тракте представлены как нетоксигенные штаммы B. fragilis (не связанные с КРР) [18], так и энтеротоксигенные B. fragilis, синтезирующие фрагилизин — токсин, который расщепляет белок клеточной адгезии Е-кадгерин, нарушая кишечный барьер и способствуя развитию диареи [19]. Кроме того, данный токсин может активировать реализацию сигнального пути Wnt/β-катенина, способствуя пролиферации клеток, индукции выработки медиаторов воспаления и канцерогенезу [20]. Токсин B. fragilis кодируется геном bft с 3 изотипами (bft 1, bft 2, bft 3), который расположен на острове патогенности (PAI) и фланкирован генами, кодирующими белки мобилизации и представляющими собой последовательности конъюгативных транспозонов CTn86 и CTn9343. Нетоксигенные штаммы B. fragilis не обладают островом патогенности, но при наличии конъюгативных транспозонов у некоторых штаммов PAI может переходить от энтеротоксигенного B. fragilis к нетоксигенным штаммам B. fragilis [21]. Установлена роль энтеротоксигенного B. fragilis в качестве «водителя» в модели «водитель–пассажир», которая заключается в повреждении бактериями-«водителями» эпителиальной ДНК, что приводит к развитию канцерогенеза и изменению микробного сообщества, далее в процессе онкогенеза «водители» вытесняются комменсальными бактериями-«пассажирами», обладающими стимулирующими опухоль свойствами [22]. Энтеротоксигенные штаммы B. fragilis способны ингибировать экзосомальную микроРНК miR-149-3p, опосредующую межклеточные взаимодействия путём модуляции дифференцировки клеток Th17, способствуя воспалению и канцерогенезу в кишечнике [23].
Выявленная в ходе нашего исследования ассоциация энтеротоксигенного B. fragilis с КРР подтверждена в разных этнических когортах. К примеру, в популяции жителей Ирана частота детекции гена bft в биопсийных образцах толстой кишки пациентов с КРР варьировала от 30,5 до 47% по сравнению с участниками контрольной группы — до 6,25% биопсийных образцов [24, 25]. При этом среди пациентов из Тегерана с язвенным колитом обнаружена более высокая распространённость энтеротоксигенного B. fragilis в образцах биопсии по сравнению с лицами без патологии кишечника [26]. В канадской и французской когортах пациентов с КРР была выявлена высокая распространённость энтеротоксигенного B. fragilis (до 32% образцах) по сравнению с лицами контрольной группы [15, 19]. Результаты европейского проспективного исследования питания и рака (EPIC) показали, что в европейской когорте IgA- и IgG-серопозитивность к энтеротоксигенному B. fragilis и генотоксичной E. coli была значимо связана с развитием КРР [27].
F. nucleatum является грамотрицательным неспорообразующим облигатным анаэробным МО семейства Fusobacteriaceae и доминирующим МО в биоплёнках зубного налёта [28]. F. nucleatum способствует канцерогенезу и метастазированию посредством множества механизмов: способствует размножению миелоидных супрессорных клеток; ускоряет апоптоз Т-клеток, подавляет пролиферацию Т-клеток, тем самым организуя микроокружение опухоли, способствующее онкогенезу и метастазированию; вызывает экспрессию белка молекулярной структуры S100A9 и запускает активацию макрофагов M2 посредством ядерного фактора-κB, тем самым активизируя пролиферацию и миграцию опухолевых клеток; стимулирует пролиферацию регуляторных Т-клеток Foxp3+ и ингибирование пролиферации и функции эффекторных Т-клеток, препятствуя противоопухолевому иммунному ответу; вызывает секрецию циркулирующих экзосом, усиливая инвазию опухоли; кроме того, описана возможная роль F. nucleatum в резистентности при иммунотерапии и химиотерапии опухолей [29]. Ключевым фактором вирулентности/онкогенности F. nucleatum является адгезин FadA, регулирующий экспрессию аннексина А1 посредством E-кадгерина. Индукция аннексина А1, являющегося модулятором Wnt/β-катенина, специфически стимулирует клетки колоректальной карциномы, способствуя прогрессированию КРР [30]. Кроме того, F. nucleatum стимулирует воспалительные и антиапоптотические реакции в клетках КРР посредством высвобождения АДФ-гептозы и активации оси ALPK1/TIFA [31]. Недавно охарактеризована отдельная клада Fna C2 F. nucleatum, ассоциированная с КРР, которая обладает повышенной вирулентностью [32].
По мнению J. Jones и соавт., именно F. nucleatum и энтеротоксигенный B. fragilis представляют собой два ключевых патобионта, способствующих онкогенному перепрограммированию эпителиальных клеток кишечника [11].
P. gingivalis является анаэробной бактерией полости рта, вызывающей хронический пародонтит. За последнее десятилетие выявлены механизмы, с помощью которых P. gingivalis способствует прогрессированию опухоли, стимулирует клеточную инвазию и метастазирование опухолевых клеток. Данные механизмы включают усиление экспрессии провоспалительных факторов и матриксных металлопротеиназ, которые разрушают базальные мембраны и внеклеточный матрикс эпителия кишечника [33].
По данным исследований обнаружена связь между наличием пародонтопатогенных бактерий в образцах фекалий и биопсийном материале с КРР. В исследовании «случай–контроль» с использованием метагеномного секвенирования выявлено, что частота детекции Fusobacterium была выше у больных КРР (31,9% против 11,7% у контрольной группы) и развитие КРР связано с наличием F. nucleatum (ОШ = 4,11; 95% ДИ 1,62–10,47; p = 0,004) и P. gingivalis (ОШ = 5,17; 95% ДИ 1,75–15,25; p = 0,001) [34]. В проведённом во Франции исследовании выявлено, что распространённость F. nucleatum среди пациентов с КРР (70,4%) была выше по сравнению с лицами без патологии кишечника [19].
P. gingivalis и F. nucleatum, бактерии полости рта, относящиеся к так называемым «красному» и «оранжевому» комплексам, способны не только индуцировать хроническое воспаление, но и способствовать онкогенезу как в полости рта, так и в кишечнике, обладая, возможно, синергетическим действием [35].
Следует также отметить, что все три онкогенные бактерии (F. nucleatum, B. fragilis и P. gingivalis) потенциально связаны не только с развитием КРР, но и с худшим прогнозом для пациентов (более низкой выживаемостью) [13, 14]. Кроме того, результаты нашего исследования свидетельствуют о наличии прямой связи между стадией онкологического процесса и распространённостью пародонтопатогенных МО F. nucleatum и P. gingivalis.
Различными авторами также обнаружена связь колибактин-продуцирующих генотипов энтеробактерий с КРР. Колибактин — генотоксин, вызывающий двухцепочечные разрывы ДНК, остановку клеточного цикла, хромосомную нестабильность в эукариотических клетках. Он синтезируется сборочной линией нерибосомной поликетидсинтазы (pks), состоящей из 19 генов (от clbA до clbS), расположенных на геномном острове размером 54 т. п. н. [36]. Островок pks присутствует в геномах K. pneumoniae, K. aerogenes (базоним: Enterobacter aerogenes), Citrobacter koseri, в филогенетических группах E. coli [19]. Инфицирование может происходить на ранних этапах онтогенеза: известно, что передача колибактин-продуцирующих генотипов энтеробактерий происходит в перинатальном периоде при прохождении через родовые пути (ген clbВ выявлен у 87,5% детей, родившихся естественным путём, у 12,5% — путём кесарева сечения) и в результате грудного вскармливания [37]. Частота детекции гена clbN была выше у пациентов с КРР (49,4%) по сравнению с участниками контрольной группы (24%; p < 0,005), при этом высокая распространённость (72,2%) обнаружена на последней стадии (IV) по сравнению с КРР стадии I/II (42,3%; р < 0,05) и КРР III стадии (43,2%; р < 0,05) [19]. В исследовании на японской когорте (543 случаев колоректальной неоплазии (22 КРР и 521 аденома), 425 участников контрольной группы) pks+-E. coli обнаружена в 32,6% образцах фекалий у пациентов с колоректальной неоплазией и в 30,8% — у участников контрольной группы [38]. Также среди канадской когорты обнаружено, что частота колонизации бактериями pks+ не различалась среди участников контрольной группы (42%) и пациентов с КРР (46%), примечательно, что pks+-бактерии были распространены на поздних стадиях КРР (40/79; 52%) по сравнению с ранней стадией опухоли (3/15; 20%; р < 0,05) [15]. В когортном исследовании pks+-E. coli обнаружена в 9,44% (111/1175) биопсийных образцах пациентов с КРР, при этом ДНК pks+-E. coli обратно пропорционально связано со стадией опухолевого процесса (p = 0,008) [16]. В ходе нашего исследования выявлена высокая распространённость гена clbB острова патогенности pks+-E. coli на I стадии онкологического процесса.
Заключение
Результаты проведённого исследования позволяют заключить, что КРР у пациентов крупного мегаполиса ассоциирован с наличием в составе кишечного микробиома генов потенциально онкогенных бактерий, в частности видоспецифических генов пародонтопатогенов F. nucleatum, P. gingivalis, гена токсина-фрагилизина bft B. fragilis, гена поликетидсинтазы clbB острова патогенности pks энтеробактерий. Полученные результаты согласуются с современными представлениями о патогенетической роли этих бактерий и/или их токсинобразующих штаммов при КРР.
Молекулярно-генетическая детекция вышеуказанных генетических детерминант потенциально онкогенных МО может быть применена в качестве метода неинвазивной диагностики КРР вне зависимости от локализации и морфологического типа опухоли как отдельно, так и совместно с другими рекомендованными тестами.
С учётом имеющихся данных о связи данных бактерий со стадийностью/прогрессированием КРР, прогнозом/выживаемостью и резистентностью к иммунотерапии и химиотерапии, можно предположить возможность их использования в качестве неинвазивных биомаркеров для прогнозирования течения и исходов КРР, ответа на противоопухолевую терапию, а в перспективе для разработки соответствующих онкопрофилактических мероприятий, включая персонифицированную коррекцию дисбиоза полости рта и кишечника и/или их санацию.
1 Epitools – Epidemiological Calculators.
Об авторах
Виктория Николаевна Шумилова
Северо-Западный государственный медицинский университет имени И.И. Мечникова
Автор, ответственный за переписку.
Email: tori.lovas@gmail.com
ORCID iD: 0009-0004-4271-6530
аспирант каф. эпидемиологии, паразитологии и дезинфектологии, врач-эпидемиолог эпидемиологического отдела
Россия, Санкт-ПетербургАртемий Евгеньевич Гончаров
Северо-Западный государственный медицинский университет имени И.И. Мечникова; Институт экспериментальной медицины
Email: tori.lovas@gmail.com
ORCID iD: 0000-0002-5206-6656
д. м. н., зав. лаб. функциональной геномики и протеомики микроорганизмов, профессор каф. эпидемиологии, паразитологии и дезинфектологии
Россия, Санкт-Петербург; Санкт-ПетербургДаниил Валерьевич Азаров
Северо-Западный государственный медицинский университет имени И.И. Мечникова; Институт экспериментальной медицины
Email: tori.lovas@gmail.com
ORCID iD: 0000-0003-2483-5144
к. м. н., ассистент каф. эпидемиологии, паразитологии и дезинфектологии, н. с. лаб. функциональной геномики и протеомики микроорганизмов
Россия, Санкт-Петербург; Санкт-ПетербургСтанислав Игоревич Ситкин
Северо-Западный государственный медицинский университет имени И.И. Мечникова; Институт экспериментальной медицины; Национальный медицинский исследовательский центр имени В.А. Алмазова
Email: tori.lovas@gmail.com
Scopus Author ID: 0000-0003-0331-0963
к. м. н., зав. научно-исследовательской группы эпигенетики и метагеномики Института перинатологии и педиатрии, доцент каф. пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С.М. Рысса, в. н. с.
Россия, Санкт-Петербург; Санкт-Петербург; Санкт-ПетербургЭлгуджа Лаврентьевич Латария
Северо-Западный государственный медицинский университет имени И.И. Мечникова
Email: tori.lovas@gmail.com
ORCID iD: 0000-0002-9569-8485
к. м. н., доцент каф. факультетской хирургии им. И.И. Грекова, проректор по клинической работе
Россия, Санкт-ПетербургБатырбек Исмелович Асланов
Северо-Западный государственный медицинский университет имени И.И. Мечникова
Email: tori.lovas@gmail.com
ORCID iD: 0000-0002-6890-8096
д. м. н., доцент, зав. каф. эпидемиологии, паразитологии и дезинфектологии; зав. научно-исследовательской лабораторией молекулярной эпидемиологии и исследования бактериофагов
Россия, Санкт-ПетербургМихаил Анатольевич Бобраков
Северо-Западный государственный медицинский университет имени И.И. Мечникова
Email: tori.lovas@gmail.com
ORCID iD: 0009-0003-3003-8886
врач-хирург, онколог, ассистент каф. госпитальной хирургии им. В.А. Оппеля
Россия, Санкт-ПетербургРустем Эльдарович Топузов
Северо-Западный государственный медицинский университет имени И.И. Мечникова
Email: tori.lovas@gmail.com
ORCID iD: 0000-0001-8168-6187
к. м. н., врач-хирург, онколог, доцент каф. госпитальной хирургии им. В.А. Оппеля
Россия, Санкт-ПетербургСписок литературы
- Baidoun F., Elshiwy K., Elkeraie Y., et al. Colorectal cancer epidemiology: recent trends and impact on outcomes. Curr. Drug Targets. 2021;22(9):998–1009. DOI: https://doi.org/10.2174/1389450121999201117115717
- Patel S.G., Karlitz J.J., Yen T., et al. The rising tide of early-onset colorectal cancer: a comprehensive review of epidemiology, clinical features, biology, risk factors, prevention, and early detection. Lancet Gastroenterol. Hepatol. 2022;7(3):262–74. DOI: https://doi.org/10.1016/S2468-1253(21)00426-X
- Giorgi Rossi P., Vicentini M., Sacchettini C., et al. Impact of screening program on incidence of colorectal cancer: a cohort study in Italy. Am. J. Gastroenterol. 2015;110(9):1359–66. DOI: https://doi.org/10.1038/ajg.2015.240
- Fitzpatrick-Lewis D., Ali M.U., Warren R., et al. Screening for colorectal cancer: a systematic review and meta-analysis. Clin. Colorectal Cancer. 2016;15(4):298–313. DOI: https://doi.org/10.1016/j.clcc.2016.03.003
- Niedermaier T., Tikk K., Gies A., et al. Sensitivity of fecal immunochemical test for colorectal cancer detection differs according to stage and location. Clin. Gastroenterol. Hepatol. 2020;18(13):2920–8.e6. DOI: https://doi.org/10.1016/j.cgh.2020.01.025
- Шумилова В.Н., Гончаров А.Е., Латария Э.Л., Асланов Б.И. Роль кишечной микробиоты в диагностике колоректального рака. Фундаментальная и клиническая медицина. 2024;9(1):112–23. Shumilova V.N., Goncharov A.E., Latariya E.L., Aslanov B.I. The role of the gut microbiota in the development of colorectal cancer. Fundamental and Clinical Medicine. 2024;9(1):112–23. DOI: https://doi.org/10.23946/2500-0764-2024-9-1-112-123 EDN: https://elibrary.ru/mzdotq
- Костин Р.К., Малюгин Д.А., Соленова Л.Г., Кулаева Е.Д. Микробиота желудочно-кишечного тракта и канцерогенез в различных органах человека. Журнал микробиологии, эпидемиологии и иммунобиологии. 2023;100(1):110–25. Kostin R.K., Malyugin D.A., Solenova L.G., Kulaeva E.D. Gut microbiota and carcinogenesis in various human organs. Journal of Microbiology, Epidemiology and Immunobiology. 2023;100(1):110–25. DOI: https://doi.org/10.36233/0372-9311-310 EDN: https://elibrary.ru/cybybs
- Zeller G., Tap J., Voigt A.Y., et al. Potential of fecal microbiota for early-stage detection of colorectal cancer. Mol. Syst. Biol. 2014;10(11):766. DOI: https://doi.org/10.15252/msb.20145645
- Liang J.Q., Li T., Nakatsu G., et al. A novel faecal Lachnoclostridium marker for the non-invasive diagnosis of colorectal adenoma and cancer. Gut. 2020;69(7):1248–57. DOI: https://doi.org/10.1136/gutjnl-2019-318532
- Baxter N.T., Ruffin M.T. 4th, Rogers M.A., Schloss P.D. Microbiota-based model improves the sensitivity of fecal immunochemical test for detecting colonic lesions. Genome Med. 2016;8(1):37. DOI: https://doi.org/10.1186/s13073-016-0290-3
- Jones J., Shi Q., Nath R.R., Brito I.L. Keystone pathobionts associated with colorectal cancer promote oncogenic reprograming. PLoS One. 2024;19(2):e0297897. DOI: https://doi.org/10.1371/journal.pone.0297897
- Dougherty M.W., Jobin C. Intestinal bacteria and colorectal cancer: etiology and treatment. Gut Microbes. 2023;15(1):2185028. DOI: https://doi.org/10.1080/19490976.2023.2185028
- Wei Z., Cao S., Liu S., et al. Could gut microbiota serve as prognostic biomarker associated with colorectal cancer patients' survival? A pilot study on relevant mechanism. Oncotarget. 2016;7(29):46158–72. DOI: https://doi.org/10.18632/oncotarget.10064
- Kerdreux M., Edin S., Löwenmark T., et al. Porphyromonas gingivalis in colorectal cancer and its association to patient prognosis. J. Cancer. 2023;14(9):1479–85. DOI: https://doi.org/10.7150/jca.83395
- Oliero M., Hajjar R., Cuisiniere T., et al. Prevalence of pks + bacteria and enterotoxigenic Bacteroides fragilis in patients with colorectal cancer. Gut Pathog. 2022;14(1):51. DOI: https://doi.org/10.1186/s13099-022-00523-y
- Arima K., Zhong R., Ugai T., et al. Western-style diet, pks Island-carrying Escherichia coli, and colorectal cancer: analyses from two large prospective cohort studies. Gastroenterology. 2022;163(4):862–74. DOI: https://doi.org/10.1053/j.gastro.2022.06.054
- de la Fuente C., Flores S., Moraga M. DNA from human ancient bacteria: a novel source of genetic evidence from archaeological dental calculus. Archaeometry. 2013;55(4):767–78. DOI: https://doi.org/10.1111/j.1475-4754.2012.00707.x
- Chan J.L., Wu S., Geis A.L., et al. Non-toxigenic Bacteroides fragilis (NTBF) administration reduces bacteria-driven chronic colitis and tumor development independent of polysaccharide A. Mucosal Immunol. 2019;12(1):164–77. DOI: https://doi.org/10.1038/s41385-018-0085-5
- Périchon B., Lichtl-Häfele J., Bergsten E., et al. Detection of Streptococcus gallolyticus and four other CRC-associated bacteria in patient stools reveals a potential "driver" role for enterotoxigenic Bacteroides fragilis. Front. Cell. Infect. Microbiol. 2022;12:794391. DOI: https://doi.org/10.3389/fcimb.2022.794391
- Sears C.L., Geis A.L., Housseau F. Bacteroides fragilis subverts mucosal biology: from symbiont to colon carcinogenesis. J. Clin. Invest. 2014;124(10):4166–72. DOI: https://doi.org/10.1172/JCI72334
- Buckwold S.L., Shoemaker N.B., Sears C.L., Franco A.A. Identification and characterization of conjugative transposons CTn86 and CTn9343 in Bacteroides fragilis strains. Appl. Environ. Microbiol. 2007;73(1):53–63. DOI: https://doi.org/10.1128/AEM.01669-06
- Tjalsma H., Boleij A., Marchesi J.R., Dutilh B.E. A bacterial driver-passenger model for colorectal cancer: beyond the usual suspects. Nat. Rev. Microbiol. 2012;10(8):575–82. DOI: https://doi.org/10.1038/nrmicro2819
- Cao Y., Wang Z., Yan Y., et al. Enterotoxigenic Bacteroides fragilis promotes intestinal inflammation and malignancy by inhibiting exosome-packaged miR-149-3p. Gastroenterology. 2021;161(5):1552–66.e12. DOI: https://doi.org/10.1053/j.gastro.2021.08.003
- Jasemi S., Emaneini M., Fazeli M.S., et al. Toxigenic and non-toxigenic patterns I, II and III and biofilm-forming ability in Bacteroides fragilis strains isolated from patients diagnosed with colorectal cancer. Gut Pathog. 2020;12:28. DOI: https://doi.org/10.1186/s13099-020-00366-5
- Zamani S., Taslimi R., Sarabi A., et al. Enterotoxigenic Bacteroides fragilis: a possible etiological candidate for bacteriallyinduced colorectal precancerous and cancerous lesions. Front. Cell. Infect. Microbiol. 2020;9:449. DOI: https://doi.org/10.3389/fcimb.2019.00449
- Zamani S., Hesam Shariati S., Zali M.R., et al. Detection of enterotoxigenic Bacteroides fragilis in patients with ulcerative colitis. Gut Pathog. 2017;9:53. DOI: https://doi.org/10.1186/s13099-017-0202-0
- Butt J., Jenab M., Werner J., et al. Association of pre-diagnostic antibody responses to Escherichia coli and Bacteroides fragilis toxin proteins with colorectal cancer in a European cohort. Gut Microbes. 2021;13(1):1–14. DOI: https://doi.org/10.1080/19490976.2021.1903825
- Signat B., Roques C., Poulet P., Duffaut D. Fusobacterium nucleatum in periodontal health and disease. Curr. Issues Mol. Biol. 2011;13(2):25–36. DOI: https://doi.org/10.21775/cimb.013.025
- Ye C., Liu X., Liu Z., et al. Fusobacterium nucleatum in tumors: from tumorigenesis to tumor metastasis and tumor resistance. Cancer Biol. Ther. 2024;25(1):2306676. DOI: https://doi.org/10.1080/15384047.2024.2306676
- Rubinstein M.R., Baik J.E., Lagana S.M., et al. Fusobacterium nucleatum promotes colorectal cancer by inducing Wnt/β-catenin modulator Annexin A1. EMBO Rep. 2019;20(4):e47638. DOI: https://doi.org/10.15252/embr.201847638
- Martin-Gallausiaux C., Salesse L., Garcia-Weber D., et al. Fusobacterium nucleatum promotes inflammatory and antiapoptotic responses in colorectal cancer cells via ADP-heptose release and ALPK1/TIFA axis activation. Gut Microbes. 2024;16(1):2295384. DOI: https://doi.org/10.1080/19490976.2023.2295384
- Zepeda-Rivera M., Minot S.S., Bouzek H., et al. A distinct Fusobacterium nucleatum clade dominates the colorectal cancer niche. Nature. 2024;628(8007):424–32. DOI: https://doi.org/10.1038/s41586-024-07182-w
- Chang C., Wang H., Liu J., et al. Porphyromonas gingivalis infection promoted the proliferation of oral squamous cell carcinoma cells through the miR-21/PDCD4/AP-1 negative signaling pathway. ACS Infect. Dis. 2019;5(8):1336–47. DOI: https://doi.org/10.1021/acsinfecdis.9b00032
- Ahn J., Sinha R., Pei Z., et al. Human gut microbiome and risk for colorectal cancer. J. Natl Cancer Inst. 2013;105(24):1907–11. DOI: https://doi.org/10.1093/jnci/djt300
- Леонов Г.Е., Вараева Ю.Р., Ливанцова Е.Н., Стародубова А.В. Особенности микробиома ротовой полости при различных соматических заболеваниях. Вопросы питания. 2023;92(4):6–19. Leonov G.E., Varaeva Yu.R., Livantsova E.N., Starodubova A.V. The oral microbiome in the context of systemic disease. Problems of Nutrition. 2023;92(4):6–19. DOI: https://doi.org/10.33029/0042-8833-2023-92-4-6-19
- Johnson J.R., Johnston B., Kuskowski M.A., et al. Molecular epidemiology and phylogenetic distribution of the Escherichia coli pks genomic island. J. Clin. Microbiol. 2008;46(12):3906–11. DOI: https://doi.org/10.1128/JCM.00949-08
- Tsunematsu Y., Hosomi K., Kunisawa J., et al. Mother-to-infant transmission of the carcinogenic colibactin-producing bacteria. BMC Microbiol. 2021;21(1):235. DOI: https://doi.org/10.1186/s12866-021-02292-1
- Iwasaki M., Kanehara R., Yamaji T., et al. Association of Escherichia coli containing polyketide synthase in the gut microbiota with colorectal neoplasia in Japan. Cancer Sci. 2022;113(1):277–86. DOI: https://doi.org/10.1111/cas.15196
Дополнительные файлы