Исследование тропизма и биораспределения рекомбинантного аденовируса обезьян 25-го серотипа in vitro и in vivo
- Авторы: Вавилова И.В.1, Ожаровская Т.А.1, Зубкова О.В.1, Попова О.1, Воронина Д.В.1, Голдовская П.П.1, Зрелкин Д.И.1, Джаруллаева А.Ш.1, Должикова И.В.1, Щебляков Д.В.1, Логунов Д.Ю.1, Гинцбург А.Л.1
-
Учреждения:
- Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
- Выпуск: Том 101, № 5 (2024)
- Страницы: 594-605
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18681
- DOI: https://doi.org/10.36233/0372-9311-573
- EDN: https://elibrary.ru/aspmgu
- ID: 18681
Цитировать
Аннотация
Введение. Рекомбинантные аденовирусы (rAd) широко используются для разработки вакцин против ряда инфекционных заболеваний. Несмотря на большое количество клинических исследований, на сегодняшний день только несколько серотипов аденовирусов человека (5-й и 26-й серотипы) и обезьян (изолят Y25) на постоянной основе применяются для создания вакцинных препаратов. Различные серотипы rAd отличаются тропностью к клеткам, что играет ключевую роль в их способности к индукции иммунного ответа.
Цель работы — изучить клеточный тропизм in vitro и биораспределение in vivo rAd обезьян 25-го серотипа (SAd25) в сравнении с аденовирусами человека 5-го и 26-го серотипов.
Материалы и методы. Эффективность трансдукции in vitro оценивали на 15 клеточных линиях с использованием rAd, экспрессирующих репортерный ген EGFP. Биораспределение и биолюминесцентную визуализацию in vivo оценивали на мышах BALB/c с использованием rAd, экспрессирующих репортерный ген люциферазы. Острую токсичность SAd25 оценивали на мышах и крысах при внутримышечном и внутривенном введении.
Результаты. SAd25 эффективно трансдуцирует всю панель клеточных линий, при этом обнаружена более высокая тропность к клеткам глиобластомы человека (GL-6) по сравнению с двумя другими исследованными rAd. В экспериментах in vivo показано, что rAd в основном локализуются в месте введения, экспрессия трансгена сохраняется в течение 21 дня. В экспериментах по оценке острой токсичности SAd25 животные хорошо переносили введение препарата, гибель животных не зафиксирована, токсические эффекты не обнаружены.
Заключение. Новая платформа на основе SAd25 не уступает уже существующим и хорошо зарекомендовавшим себя системам доставки на основе аденовирусов человека 5-го и 26-го серотипов. Благодаря высокому уровню трансдукции и благоприятному профилю безопасности SAd25 может предложить ряд преимуществ для разработки вакцин против новых инфекционных заболеваний.
Ключевые слова
Полный текст
Введение
Аденовирусы (Ad) — это безоболочечные ДНК-содержащие вирусы икосаэдрической формы. Семейство Adenoviridae состоит из 6 родов, среди которых вирусы рода Mastadenovirus, инфицирующие млекопитающих, в том числе человека [1]. Ad человека разделяют на 7 видов (Mastadenovirus adami, Mastadenovirus blackbeardi, Mastadenovirus caesari, Mastadenovirus dominans, Mastadenovirus exoticum, Mastadenovirus faecale, Mastadenovirus russelli) в зависимости от их морфологических, вирусологических, серологических и генетических характеристик. Давно и широко изучены фундаментальные биологические свойства Ad вида Mastadenovirus caesari (ранее аденовирусы человека подгруппы С), что сделало их популярными объектами для разработки векторных систем доставки чужеродной генетической информации in vivo и in vitro [2, 3].
К настоящему времени достигнуты значительные успехи в использовании Ad в качестве векторных вакцин [3–6]. В течение последних 10 лет в России были одобрены и зарегистрированы вакцины для профилактики болезни, вызванной вирусом Эбола, и коронавирусной инфекции COVID-19 [7, 8]. Опыт вакцинации во время пандемии COVID-19 доказал безопасность и эффективность векторных вакцин на основе Ad. Для проведения масштабной вакцинации использовали 3 Ad-платформы: на основе Ad человека 5-го (Ad5), 26-го серотипов (Ad26) и Ad шимпанзе (изолят Y25) [5, 7, 9]. Несмотря на большое количество клинических исследований, только несколько серотипов Ad человека и шимпанзе (Ad6, Ad35, ChAd63, ChAd3) были изучены в качестве основы для векторных вакцин [10]. Разные серотипы обладают различными характеристиками в клеточном тропизме, что может играть ключевую роль в индукции иммунного ответа, влияя на экспрессию и распределение целевого антигена [11]. Ключевыми характеристиками при выборе альтернативных серотипов являются низкая серопревалентность в человеческой популяции и способность вызывать высокий уровень специфических иммунных реакций на целевой антиген.
Ранее нами была разработана технологическая платформа на основе Ad обезьян 25-го серотипа (SAd25) [12]. Целью данного исследования было сравнение тропизма Ad5 и Ad26 и SAd25 in vitro и in vivo.
Материалы и методы
Клеточные линии
В экспериментах использовали 15 клеточных линий разного происхождения:
- клетки человека: HEK 293 (клетки почки эмбриона, трансформированные Е1-областью Ad5), H292 (клетки мукоэпидермоидной карциномы лёгкого), H460 (клетки крупноклеточной карциномы лёгкого), H1299 (клетки немелкоклеточного рака лёгкого), А549 (клетки аденокарциномы лёгкого), A431 (клетки эпидермоидной карциномы), GL-6 (клетки глиобластомы), ЛЭЧ-Т (клетки лёгкого эмбриона), HeLa (клетки карциномы шейки матки);
- клетки обезьян: две линии клеток почки зелёной мартышки (CV-1 и Vero E6);
- клетки мышей: L929 (клетки фибробластов) и ЭПНТ-5 (клетки глиобластомы);
- клетки хомячков: CHO (клетки яичника китайского хомячка) и BHK-21 (клетки почки новорождённого сирийского хомячка).
Рекомбинантные аденовирусы
Рекомбинантные Ad5- и Ad26-векторы, несущие репортерный ген усиленного зелёного флуоресцентного белка EGFP (rAd5-EGFP и rAd26-EGFP), ген люциферазы (rAd5-Luc, rAd26-Luc), получены ранее [7, 12, 13]. Для клонирования гена люциферазы или гена гликопротеина S вируса SARS-CoV-2 в геном rSAd25 использовали методику, описанную ранее [12]. pArms-SAd25-Luc или pArms-SAd25-S-CoV2, несущие экспрессионные кассеты с репортерным геном или антигеном, линеаризовали и соединяли с pSAd25-EGFP, содержащей ΔЕ1/ΔE3 геном. После электропорации в клетках Escherichia coli BJ5183 в результате гомологичной рекомбинации получили pSAd25-Luc или pSAd25-S-CoV2, кодирующие ΔЕ1/ΔE3 геном SAd25 с экспрессионной кассетой. rAd оживляли и наращивали в клетках НЕК 293.
Лабораторные животные
Все эксперименты на животных проводили в строгом соответствии с рекомендациями Национального стандарта РФ (ГОСТ Р 53434–2009 «Принципы надлежащей лабораторной практики»), а используемые методики одобрены комитетом по биомедицинской этике НИЦЭМ им. Н.Ф. Гамалеи (протокол № 30 от 28.10.2022). Шестинедельные самки мышей BALB/c (18–20 г) получены из Пущинского питомника (Россия; аккредитован Международной ассоциацией по оценке и аккредитации ухода за лабораторными животными). Аутбредные (беспородные) мыши и крысы получены из филиала «Андреевка» НЦБМТ ФМБА России. Животные имели свободный доступ к воде и стандартному корму для грызунов.
Определение инфекционного титра аденовирусов
Количество инфекционных Ad-частиц определяли методом титрования по конечной точке наличия цитопатического действия (ЦПД) в культуре клеток НЕК 293. Клетки рассевали на 96-луночные планшеты в количестве 3 × 104 клеток на лунку. Затем вносили последовательные 10-кратные разведения вируса в 8 повторах. Планшеты инкубировали 12–14 сут, результат учитывали визуально по наличию ЦПД. Расчёт титра вируса проводили по формуле Рида–Менча и выражали в ТЦД50/мл [14].
Определение репликации аденовирусов
Для исследования кинетики репликации Ad культуру клеток НЕК 293 рассевали на 96-луночные планшеты в количестве 3 × 104 клеток на лунку. Далее клетки инфицировали препаратами rAd5-EGFP, rAd26-EGFP и rSAd25-EGFP в дозе 0,01 ТЦД50/клетку. Культуральные планшеты инкубировали 6–7 дней при 37ºC и 5% CO2. Учёт результатов проводили с помощью автоматического микроскопа «Lionheart FX Automated Microscope» («BioTek Instruments Inc.»).
Трансдукция клеточных линий рекомбинантными аденовирусами
За 2–3 ч до трансдукции клетки рассевали на 48-луночные планшеты в количестве 105 клеток/лунку. Далее клетки трансдуцировали препаратами rAd5-EGFP, rAd26-EGFP и rSAd25-EGFP в дозе 1 ТЦД50/клетку. Культуральные планшеты инкубировали при 37ºC и 5% CO2. Интенсивность флуоресценции измеряли на гибридном мультифункциональном ридере «Synergy H1» («BioTek Instruments Inc.») с помощью программного обеспечения «Gen5 Microplate Reader» и «Imager Software».
Введение рекомбинантных аденовирусов животным
Для исследования биораспределения rAd вводили однократно внутримышечно в дозе 1010 или 1011 вирусных частиц (в.ч.) на животное (n = 3). Контрольной группе животных вводили стерильный фосфатно-солевой буфер (ФСБ) («Панэко»). Протокол исследования одобрен комитетом по биомедицинской этике НИЦЭМ им. Н.Ф. Гамалеи (протокол № 30 от 28.10.2022).
Определение ДНК аденовирусов в органах и тканях животных
Через 24 ч после введения rAd проводили эвтаназию животных. Отбирали органы, взвешивали и гомогенизировали в ФСБ. ДНК выделяли при помощи набора «Wizard Genomic DNA Purification Kit» («Promega»). Вирусную ДНК определяли методом полимеразной цепной реакции в режиме реального времени на амплификаторе «CFX 96» («Bio-Rad»): праймеры (5'-GGCGGCTGGCGGTAGA-3' и 5'-GCAACATCTGGAACCGCG-3'), смесь qPCRmix-HS SYBR («Евроген»). За начальной стадией денатурации (5 мин при 95ºС) следовали 40 циклов по 15 с при 95ºС, 30 с при 61ºС и 30 с при 72ºС. Данные обрабатывали с помощью программного обеспечения «Bio-Rad CFX Manager».
Биолюминесцентная визуализация in vivo
Люциферин («Promega»; 2,5 мг/животное) разводили в ФСБ и вводили мышам внутрибрюшинно на 1, 3, 7, 14 и 21-й дни после введения rAd. Животных анестезировали изофлураном («Piramal Critical Care») в течение 5–10 мин, после чего проводили визуализацию биолюминисценции на приборе «IVIS Lumina Series II» («Caliper»). Время экспозиции было скорректировано, чтобы избежать пересыщения пикселей, а измерения потока были преобразованы в фотоны в секунду для сравнительной оценки люминесценции в разные моменты времени. Данные люминесцентного изображения анализировали с использованием программного обеспечения «Living Image v. 4.2».
Методы оценки острой токсичности
В эксперименте по изучению токсичности оценивали влияние rSAd25-S-CoV2 на состояние экспериментальных животных (мышей и крыс) при внутримышечном (для мышей и крыс) и внутривенном (для мышей) введении. Для каждого способа введения были сформированы 4 группы аутбредных мышей обоего пола (по 10 самок и 10 самцов в группе), которым вводили rAd в разных дозах (109, 1010 и 1011 в.ч./животное). Контрольной группе вводили ФСБ. Формировали 3 группы крыс (по 10 самок и 10 самцов в группе), которым вводили rAd в разных дозах (1010 и 1011 в.ч./животное). Контрольной группе вводили ФСБ. После однократного введения препарата за животными наблюдали в течение 14 дней, ежедневно проводя клинический осмотр. Фиксировали параметры функционального состояния, внешний вид, физиологические функции. На 0, 7 и 14-й дни производили взвешивание. На 14-й день животных подвергали эвтаназии и проводили полную некропсию. При некропсии исследовали внешнее состояние тела, внутренние поверхности и проходы, полость черепа, грудную, брюшную и тазовую полости с находящимися в них органами и тканями, шею с органами и тканями, а также скелетно-мышечную систему.
Статистический анализ
Обработку данных проводили с использованием компьютерных программ «GraphPad 8.0» («GraphPad Software») и «Excel» («Microsoft»). Для количественных результатов рассчитывали среднее арифметическое, среднее геометрическое, стандартную ошибку среднего, стандартное отклонение. При анализе данных несвязанных выборок использовали критерий Стьюдента, критерий Манна–Уитни или критерий Краскела–Уоллиса. Априорный уровень значимости принимали равным α = 0,05. Различия считали статистически достоверными при достигнутом уровне значимости р < α.
Результаты
Конструирование рекомбинантных векторов на основе аденовируса обезьян 25-го серотипа
Рекомбинантный репликативно-дефектный вектор на основе SAd25 с репортерным геном EGFP (rSAd25-EGFP) получен ранее [12]. Аналогичным образом были получены рекомбинантные векторы, несущие ген люциферазы (rSAd25-Luc) и ген S-белка коронавируса SARS-CoV-2 (rSAd25-S-CoV2) (рис. 1, а).
Рис. 1. Схематическое изображение геномов рекомбинантных SAd25 (а) и сравнение эффективности репродукции rSAd25-EGFP, rAd5-EGFP и rAd26-EGFP в НЕК 293 (б).
Fig. 1. Schematic representation of the recombinant SAd25 genomes (a) and comparison of the reproduction efficiency of rSAd25-EGFP, rAd5-EGFP and rAd26-EGFP in HEK 293 (b).
Для оценки эффективности репродукции рекомбинантного вектора на основе Ad обезьян в пермиссивной культуре использовали rSAd25-EGFP, несущий ген репортерного флуоресцентного белка. В качестве векторов сравнения служили rAd5-EGFP и rAd26-EGFP с аналогичным трансгеном. Клетки HEK 293 инфицировали исследуемыми Ad из расчёта приблизительно 1 инфекционная частица на 100 клеток. Визуальную оценку результатов проводили начиная с 96 ч после трансдукции каждые 16 ч (рис. 1, б).
Через 96 ч наблюдали интенсивную флуоресценцию, индуцируемую рекомбинантными вирусными векторами. При этом, в отличие от векторов сравнения, только в лунках с rSAd25-EGFP детектировали формирование флуоресцентных фокусов, что свидетельствует о более высокой скорости накопления вирусного потомства в заражённых клетках. С течением времени фокусы увеличивались в размере, что приводило к лизису клеточного монослоя и ярко выраженному цитопатическому действию. Таким образом, вектор rSAd25 обладает литическим потенциалом, репликация приводит к значительно большему повреждению клеток в сравнении с rAd5 и rAd26.
Исследование тропизма rSAd25-EGFP in vitro
Для определения тропизма rSAd25 была исследована эффективность трансдукции различных типов клеток (человека, хомячка, обезьяны, мыши) по сравнению с широко используемыми векторами rAd5 и rAd26. Используемые репликативно-дефектные векторы содержали ген EGFP под контролем промотора цитомегаловируса, что обеспечивает аналогичные уровни экспрессии после трансдукции. Все клеточные линии были трансформированы rSAd25-EGFP, rAd5-EGFP и rAd26-EGFP в дозе 1 ТЦД50/клетку. Указанная доза вируса, с одной стороны, не обладает цитотоксичностью, а с другой — позволяет рассчитывать на то, что каждая клетка будет содержать примерно только 1 в.ч. Трансдукция более высокой дозой приводит к заражению одной клетки несколькими вирусными частицами, и, следовательно, экспрессия трансгена не линейна. Эффективность трансдукции оценивали по уровню флуоресценции EGFP в клетках и выражали в относительных единицах. Итоговое значение определяли путём вычитания уровня флуоресценции интактных клеток из уровня флуоресценции трансдуцированных (рис. 2).
Рис. 2. Тропизм rAd5-EGFP, rAd26-EGFP и rSAd25-EGFP к различным культурам клеток млекопитающих.
* — статистически достоверная разница с rSAd25-EGFP; & — статистически достоверная разница с rAd26-EGFP; # — статистически достоверная разница с rAd5-EGFP.
Fig. 2. Tropism of rAd5-EGFP, rAd26-EGFP and rSAd25-EGFP to different mammalian cell cultures.
* — statistically significant difference with rSAd25-EGFP; & — statistically significant difference with rAd26-EGFP; # — statistically significant difference with rAd5-EGFP.
Экспрессия EGFP была обнаружена во всех используемых типах клеток. Трансдукция клеток обезьян Vero E6 отличалась при использовании различных Ad-векторов. Наибольший уровень экспрессии EGFP в клетках Vero E6 наблюдали для rSAd25-EGFP.
В клетки хомячка (BHK-21, СНО) и мыши (L929, ЭПНТ-6) исследованные Ad проникали с сопоставимой эффективностью.
Тропизм rSAd25-EGFP, rAd5-EGFP и rAd26-EGFP отличался в клетках человека. SAd25-EGFP с большей эффективностью проникал в клетки глиобластомы человека GL-6. Уровень флуоресценции rSAd25-EGFP в клетках карциномы лёгкого человека Н292 и Н460 был достоверно выше, чем для rAd5-EGFP. При этом в другой линии клеток карциномы лёгкого (Н1299) преимущество показал rAd26-EGFP.
Оценка биораспределения рекомбинантных аденовирусов in vivo
Особенности биораспределения rAd5-EGFP, rAd26-EGFP и rSAd25-EGFP изучали в экспериментах на мышах линии BALB/c двумя методами: по определению вирусных геномов и по экспрессии трансгена. Через 24 ч после внутримышечного введения rAd в дозе 1010 в.ч. анализировали количество копий генома Ad в тканях и органах с помощью полимеразной цепной реакции в режиме реального времени (рис. 3).
Рис. 3. Сравнительный анализ биораспределения Ad у мышей.
Каждый столбец представляет собой среднее количество геномов со стандартным отклонением.
Fig. 3. Comparative analysis of adenovirus biodistribution in mice.
Each column represents the average number of genomes with a standard deviation.
Среди 14 отобранных органов и тканей вирусную ДНК в основном обнаруживали в образцах мышц, взятых из места введения. При этом количество копий ДНК rSAd25-EGFP в мышцах было значительно больше, чем ДНК rAd26-EGFP и rAd5-EGFP соответственно. Помимо места инъекции, небольшое количество геномов rAd5 было обнаружено в нижних лимфатических узлах, а также в крови (rSAd25 и rAd5).
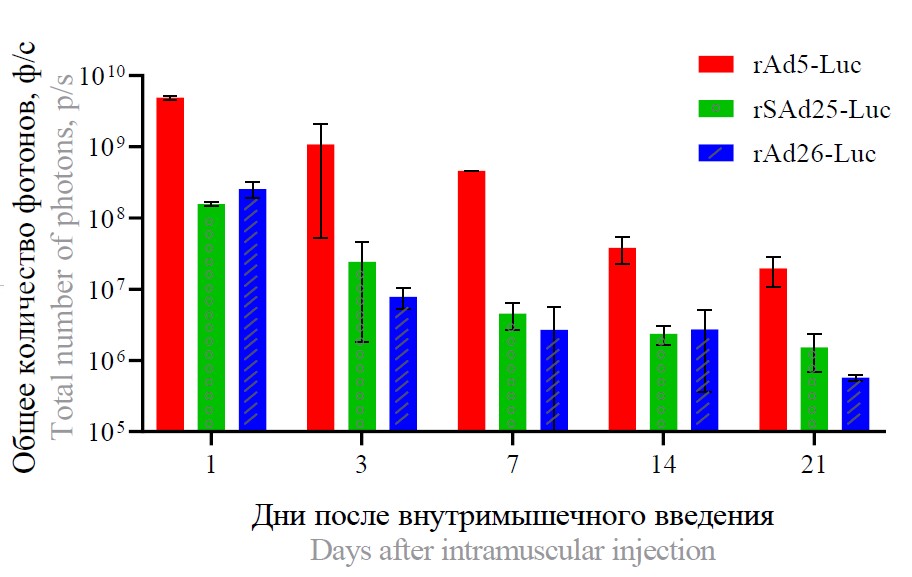
Для биолюминесцентной визуализации использовали rAd, экспрессирующие ген люциферазы, которые вводили животным внутримышечно в дозе 1011 в.ч. Для всех типов Ad биолюминесцентный сигнал был обнаружен только в месте инъекции (рис. 4). После однократного введения rAd5-Luc, rAd26-Luc или rSAd25-Luc самую высокую экспрессию люциферазы детектировали через 1 сут после введения (рис. 4, а). Наибольшая активность люциферазы наблюдалась у мышей, которым вводили rAd5-Luc, в то время как наименьшая активность — у группы мышей с rAd26-Luc. Активность люциферазы постепенно снижалась к 21-му дню для всех аденовирусов (рис. 4, б). При этом наименьшее падение уровня экспрессии трансгена (примерно в 100 раз) наблюдали у мышей, которым вводили rSAd25-Luc. Для rAd5-Luc и rAd26-Luc активность люциферазы снизилась более чем в 250 и 400 раз соответственно (рис. 4, в).
Рис. 4. Биораспределение rAd5-Luc, rAd26-Luc, rSAd25-Luc у мышей после внутримышечного введения методом биолюминесцентной визуализации при усреднённой (а) и усиленной шкале люминисценции (б). в — поток фотонов, измеренный в области люминесценции.
Fig. 4. Biodistribution of recombinant adenoviruses rAd5-Luc, rAd26-Luc, rSAd25-Luc in mice after intramuscular administration by bioluminescence imaging with averaged (a) and enhanced luminescence scale (b). c — photon flux measured in the regions of interest.
Изучение острой токсичности rSAd25
Исследование острой токсичности rSAd25, экспрессирующего целевой ген белка S вируса SARS-CoV-2 (rSAd25-S-CoV2), проводили на мышах и крысах обоих полов при однократном внутримышечном или внутривенном введении. Использование rAd с целевым антигеном позволяет наиболее адекватно оценить токсичность как самого вектора, так и вставки.
Тестируемые животные (мыши и крысы) хорошо перенесли как внутримышечное, так и внутривенное введение Ad-препарата во всех дозах. За время наблюдения ни одно животное не пало, клинических признаков интоксикации не наблюдали. Интегральные показатели состояния животных не различались между опытными и контрольными группами. Отмечена положительная динамика изменения массы тела животных во всех группах (рис. 5).
Рис. 5. Изучение острой токсичности rSAd25-S-CoV2 на мышах и крысах.
в/в — внутривенно; в/м — внутримышечно.
Fig. 5. Study of acute toxicity of rSAd25-S-CoV2 in mice and rats.
i.v. — intravenous; i.m. — intramuscular.
При макроскопическом исследовании мышей не установлено влияния rSAd25 на состояние внутренних органов; различий между контрольными и опытными группами не обнаружено. Макроскопическое исследование самцов крыс выявило различия между экспериментальной и контрольной группами. У 4 из 10 самцов крыс, которым вводили 1011 в.ч., и у 2 из 10 самцов крыс, которым вводили 1010 в.ч., наблюдали участки снижения воздушности тканей лёгкого (ателектазы) и очаги коагуляционного некроза с признаками организации. Важно отметить, что у исследуемых самок патоморфологических изменений лёгких не детектировали. Результаты макроскопического исследования других внутренних органов крыс экспериментальных групп не отличались от таковых контрольной группы.
Обсуждение
Векторы на основе Ad являются отличными инструментами для доставки чужеродной генетической информации в клетки млекопитающих за счёт большой пакующей ёмкости и высоких функциональных титров. Ad-векторы широко применяются для разработки векторных вакцин и генотерапевтических препаратов. Однако их использование может быть ограничено в случаях, когда целевые клетки не имеют рецепторов, участвующих в прикреплении и интернализации. При этом использование векторов на основе Ad альтернативных серотипов будет иметь значение только при высоком репродуктивном потенциале выбранного вектора.
Стандартной стратегией для получения рекомбинантных репликативно-дефектных Ad является удаление Е1-области генома. Одним из важных аспектов успешной комплементации Е1-делетированных Ad является функциональное взаимодействие белка E1B 55K (производимого транс-комплементарной клеточной линией) с белком E4 34К в геноме вируса. При этом разработка комплементарных линий клеток для разных серотипов репликативно-дефектных векторов является трудоёмким процессом. Поэтому наличие серотипов, не относящихся к Ad человека, способных реплицироваться в таких клетках, как HEK 293 (клетки человека, трансформированные Е1-областью Ad5), является большим преимуществом. Несмотря на то что сходство последовательности между белками E1B 55K Ad5 и SAd25 составляет около 56%, rSAd25-EGFP был получен и накоплен в высоких титрах в культуре клеток HEK 293 без дополнительных модификаций вирусного генома. Полученные результаты значительно отличаются от данных других исследований, в которых показано, что для успешной репликации рекомбинантного вектора необходима замена открытой рамки считывания 6 в Е4-области [15].
Характер экспрессии Ad-рецепторов на поверхности клеток (как первичных, так и вторичных) определяет тропизм вируса, который обусловливает спектр применения векторов. SAd25 в качестве первичного клеточного рецептора, как и большинство других серотипов Ad, использует CAR (coxsackie and adenovirus receptor) [16, 17]. Аминокислоты, участвующие во взаимодействии с CAR, находятся в петле AB knob-домена фибера. Ключевыми аминокислотами у Ad5 являются Ser408, Pro409, Lys417 и соответствующие аминокислоты у других серотипов: у Ad26 — Ser196, Pro197, Lys205, у SAd25 — Ser255, Pro256, Lys267 [17]. Последовательности фиберов Ad5 и SAd25 похожи на 63,9%, и неудивительно, что оба распознают один и тот же рецептор. В качестве вторичного рецептора для интернализации SAd25, как и Ad5 и Ad26, использует αv-интегрины за счёт наличия последовательности RGD (Arg-Glu-Asp) в основании пентона [18].
Чтобы лучше понять тропизм SAd25, мы проанализировали эффективность трансдукции SAd25 в сравнении с Ad5 и Ad26, используя репликативно-дефектные векторы, экспрессирующие EGFP (SAd25-EGFP, Ad5-EGFP, Ad26-EGFP). Результаты экспериментов показали, что SAd25 эффективно проникает во все исследуемые клеточные линии. Широкий профиль трансдукции объясняется его взаимодействием с CAR и αv-интегринами. Однако взаимодействие с этими рецепторами не является единственным фактором, определяющим клеточный тропизм вируса. На наблюдаемые различия в тропизме Ad подгрупп C, D и E может существенно влиять длина фибера, т. к. она является основным фактором, который определяет стратегию прикрепления Ad к клетке. Поэтому интересным аспектом нашего анализа была повышенная тропность SAd25 к клеткам нейробластомы человека. Необходимы дальнейшие исследования, чтобы конкретно определить механизм проникновения вируса в эти клетки.
В проведённом исследовании показано биораспределение SAd25 по детекции вирусной ДНК в органах или тканях и экспрессии трансгена. Следует отметить, что эти два показателя не обязательно совпадают друг с другом по нескольким причинам: один и тот же промотор может иметь переменную активность в разных типах клеток; различные типы вирусов могут иметь разные судьбы после попадания в один и тот же тип клеток; деградировавший вирус в лизосоме больше не может экспрессировать трансген, но вирусная ДНК ещё обнаруживается.
Учитывая, что внутримышечный путь является наиболее часто используемой стратегией вакцинации, проведено сравнение векторов на основе разных типов Ad после однократного введения. Локальная экспрессия гена люциферазы продолжалась 3 нед и постепенно снижалась. Уровень экспрессии после введения rSAd25-Luc был ниже, чем после rAd5-Luc, но выше, чем после введения rAd26-Luc. Таким образом, полученные данные показали, что SAd25 может быть отличным вектором для разработки вакцин, наряду с Ad5 и Ad26.
Результаты определения острой токсичности продемонстрировали, что однократное внутримышечное или внутривенное введение SAd25 мышам в дозах, превышающих эквитерапевтическую дозу в 100 и 1000 раз, хорошо переносится животными. Гибель и клинические проявления токсических реакций не наблюдали. Однократное внутримышечное введение SAd25 крысам в диапазоне исследуемых доз не приводило к значимому токсическому действию. У некоторых самцов крыс были обнаружены патоморфологические изменения в лёгких, которые не сопровождались клиническими проявлениями. Других токсических реакций не обнаружено. Не ясно, связаны ли эти изменения с введением Ad-вектора или вызваны другими факторами, а также являлись ли изменения временными или носили постоянный характер. Указанные факторы требуют дальнейшего изучения, в том числе проведения полного цикла доклинических исследований. В целом полученные данные согласуются с результатами, полученными для других векторов на основе различных Ad [19–21].
Заключение
Новая платформа на основе SAd25 не уступает уже существующим и хорошо зарекомендовавшим себя платформам на основе Ad5 и Ad26. Учитывая актуальные вызовы, такие как появление новых вирусных инфекций, например пандемия COVID-19, и возвращение в популяцию известных патогенов, использование Ad обезьян может существенно ускорить процесс разработки и внедрения новых вакцин. В конечном итоге это будет способствовать улучшению здоровья населения как в России, так и за её пределами.
Об авторах
Ирина Викторовна Вавилова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Автор, ответственный за переписку.
Email: vavilovairinav@yandex.ru
ORCID iD: 0009-0008-6272-0368
м. н. с. лаб. иммунобиотехнологии
Россия, МоскваТатьяна Андреевна Ожаровская
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0001-7147-1553
к. б. н., с. н. с. лаб. иммунобиотехнологии
Россия, МоскваОльга Вадимовна Зубкова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0001-7893-8419
к. б. н., в. н. с. лаб. иммунобиотехнологии
Россия, МоскваОльга Попова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0003-3248-1227
м.н.с., лаб. иммунобиотехнологии
Россия, МоскваДарья Владимировна Воронина
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0001-6629-744X
м. н. с. лаб. иммунобиотехнологии
Россия, МоскваПолина Павловна Голдовская
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0009-0000-1965-0482
лаборант-исследователь лаб. иммунобиотехнологии
Россия, МоскваДенис Игоревич Зрелкин
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0003-0899-8357
м. н. с. лаб. иммунобиотехнологии
Россия, МоскваАлина Шахмировна Джаруллаева
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0003-1743-0798
к. б. н., н. с. лаб. клеточной микробиологии
Россия, МоскваИнна Вадимовна Должикова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0003-2548-6142
к. б. н., зав. лаб. государственной коллекции вирусов
Россия, МоскваДмитрий Викторович Щебляков
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0002-1289-3411
к. б. н., в. н. с., зав. лаб. иммунобиотехнологии
Россия, МоскваДенис Юрьевич Логунов
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0003-4035-6581
д. б. н., академик РАН, зав. лаб. клеточной микробиологии
Россия, МоскваАлександр Леонидович Гинцбург
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: vavilovairinav@yandex.ru
ORCID iD: 0000-0003-1769-5059
д. б. н., академик РАН, профессор, директор НИЦЭМ им. Н.Ф. Гамалеи
Россия, МоскваСписок литературы
- Benko M., Aoki K., Arnberg N., et al. ICTV virus taxonomy profile: adenoviridae 2022. J. Gen. Virol. 2022;103:001721. DOI: https://doi.org/10.1099/jgv.0.001721
- Crystal R.G. Adenovirus: The first effective in vivo gene delivery vector. Hum. Gene Ther. 2014;25:3–11. DOI: https://doi.org/10.1089/hum.2013.2527
- Fougeroux C., Holst P.J. Future prospects for the development of cost-effective adenovirus vaccines. Int. J. Mol. Sci. 2017;18:686. DOI: https://doi.org/10.3390/ijms18040686
- Majhen D. Human adenovirus type 26 basic biology and its usage as vaccine vector. Rev. Med. Virol. 2022;32:e2338. DOI: https://doi.org/10.1002/rmv.2338
- Patel R., Kaki M., Potluri V.S., et al. A comprehensive review of SARS-CoV-2 vaccines: Pfizer, Moderna & Johnson & Johnson. Hum. Vaccin. Immunother. 2022;18:2002083. DOI: https://doi.org/10.1080/21645515.2021.2002083
- Ledgerwood J.E., Sullivan N.J., Graham B.S. Chimpanzee adenovirus vector Ebola vaccine – preliminary report. N. Engl. J. Med. 2015;373:776. DOI: https://doi.org/10.1056/NEJMc1505499
- Logunov D.Y., Dolzhikova I.V., Zubkova O.V., et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 2020;396(10255):887–97. DOI: https://doi.org/10.1016/S0140-6736(20)31866-3
- Dolzhikova I.V., Zubkova O.V., Tukhvatulin A.I., et al. Safety and immunogenicity of GamEvac-Combi, a heterologous VSV- and Ad5-vectored Ebola vaccine: An open phase I/II trial in healthy adults in Russia. Hum. Vaccin. Immunother. 2017;13(3):613–20. DOI: https://doi.org/10.1080/21645515.2016.1238535
- Zhu F.C., Guan X.H., Li Y.H., et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020;396(10249):479–88. DOI: https://doi.org/10.1016/S0140-6736(20)31605-6
- Trivedi P.D., Byrne B.J., Corti M. Evolving horizons: adenovirus vectors’ timeless influence on cancer, gene therapy and vaccines. Viruses. 2023;15(12):2378. DOI: https://doi.org/10.3390/v15122378
- Marquez-Martinez S., Vijayan A., Khan S., Zahn R. Cell entry and innate sensing shape adaptive immune responses to adenovirus-based vaccines. Curr. Opin. Immunol. 2023;80:102282. DOI: https://doi.org/10.1016/j.coi.2023.102282
- Ожаровская Т.А., Попова О., Зубкова О.В. и др. Разработка и характеристика векторной системы на основе аденовируса обезьян 25-го серотипа. Вестник РГМУ. 2023;(1):4–11. Ozharovskaia T.A., Popova O., Zubkova O.V., et al. Development and characterization of a vector system based on the simian adenovirus type 25. Bulletin of RSMU. 2023;(1):4–11. DOI: https://doi.org/10.24075/brsmu.2023.006
- Logunov D.Y., Zubkova O.V., Karyagina-Zhulina A.S., et al. Identification of HI-like loop in CELO adenovirus fiber for incorporation of receptor binding motifs. J. Virol. 2007;81(18):9641–52. DOI: https://doi.org/10.1128/JVI.00534-07
- Ramakrishnan M.A. Determination of 50% endpoint titer using a simple formula. World J. Virol. 2016;5(2):85–6. DOI: https://doi.org/10.5501/wjv.v5.i2.85
- Lan W., Quan L., Li Y., et al. Isolation of novel simian adenoviruses from macaques for development of a vector for human gene therapy and vaccines. J. Virol. 2023;97(10):e0101423. DOI: https://doi.org/10.1128/jvi.01014-23
- Roelvink P.W., Lizonova A., Lee J.G., et al. The coxsackievirus-adenovirus receptor protein can function as a cellular attachment protein for adenovirus serotypes from subgroups A, C, D, E, and F. J. Virol. 1998;72(10):7909–15. DOI: https://doi.org/10.1128/JVI.72.10.7909-7915.1998
- Law L.K., Davidson B.L. What does it take to bind CAR? Mol. Ther. 2005;12(4):599–609. DOI: https://doi.org/10.1016/j.ymthe.2005.05.017
- Zhang Y., Bergelson J.M. Adenovirus receptors. Journal of Virology. 2005;79(19):12125–31. DOI: https://doi.org/10.1128/jvi.79.19.12125-12131.2005
- Tandon M., Sharma A., Vemula S.V., et al. Sequential administration of bovine and human adenovirus vectors to overcome vector immunity in an immunocompetent mouse model of breast cancer. Virus Res. 2012;163(1):202–11. DOI: https://doi.org/10.1016/j.virusres.2011.09.031
- Lichtenstein D.L., Spencer J.F., Doronin K., et al. An acute toxicology study with INGN 007, an oncolytic adenovirus vector, in mice and permissive Syrian hamsters; comparisons with wild-type Ad5 and a replication-defective adenovirus vector. Cancer Gene. Ther. 2009;16(8):644–54. DOI: https://doi.org/10.1038/cgt.2009.5
- Hassan P.M., Ali T., Saber E., et al. Potency, toxicity and protection evaluation of PastoCoAd candidate vaccines: Novel preclinical mix and match rAd5 S, rAd5 RBD-N and SOBERANA dimeric-RBD protein. Vaccine. 2022;40(20):2856–68. DOI: https://doi.org/10.1016/j.vaccine.2022.03.066
Дополнительные файлы