Кампилобактериоз: генотипическая характеристика возбудителя и иммунологический статус пациентов
- Авторы: Лобзин Ю.В.1,2, Ермоленко К.Д.1, Макарова М.А.2,3, Кафтырева Л.А.2,3, Мартенс Э.А.1,2, Полев Д.Е.3, Ермоленко Е.И.2,4
-
Учреждения:
- Детский научно-клинический центр инфекционных болезней
- Северо-Западный государственный медицинский университет имени И.И. Мечникова
- Научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
- Институт экспериментальной медицины
- Выпуск: Том 101, № 3 (2024)
- Страницы: 315-326
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18617
- DOI: https://doi.org/10.36233/0372-9311-531
- EDN: https://elibrary.ru/kihkmo
- ID: 18617
Цитировать
Аннотация
Введение. Кампилобактерии входят в число ведущих возбудителей острых кишечных инфекций. Тяжесть кампилобактериоза и формирование отдалённых осложнений могут быть обусловлены генотипом возбудителя, биологические свойства которого оказывают влияние на параметры иммунного ответа.
Целью исследования явились обнаружение наиболее распространённых генотипов эпидемических клонов возбудителей кампилобактериоза и оценка характера иммунного ответа и тяжести заболевания.
Материалы и методы. В исследование включены 203 пациента в возрасте от 1 мес до 17 лет c кампилобактериозом, проходивших лечение в 2019–2021 гг. в клинике ДНКЦИБ ФМБА. Подтверждение диагноза осуществляли методом полимеразной цепной реакции. Пробы пациентов также исследовали культуральным методом. Тотальную ДНК выделяли с использованием набoра «QIAamp DNA Mini Kit». Поиск генетических детерминант, кодирующих факторы вирулентности, и MLST-типирование проводили в программе «ResFinder». Иммунный статус пациентов изучали на 1-й и 7-й дни заболевания. Иммунологическое исследование включало oпределение кoнцентрaции сывoрoтoчных иммунoглoбулинoв клaссoв A, М, G, С-реактивного белка, интерлейкинов-1β, -1, -2, -4, -5, -6, -7, -8, -10, фактора некроза опухоли-α и интерферона-γ.
Результаты. При анализе распространённости сиквенс-типов кампилобактерий, выявленных у детей с клиникой кишечной инфекции, установлено, что наиболее схожим является профиль выделяемых изолятов в странах Северной Америки (США и Канада), Северной Европы (Великобритании, Голландия) и Скандинавии (Дания, Швеция, Финляндия). Выявление возбудителя с генотипом flgE+, cdtА+, cdtC+ сопровождалось статистически значимым повышением уровня интерлейкина-8, понижением содержания IgA в сыворотке периферической крови, что отражало низкую эффективность иммунного ответа при инфицировании кампилобактериями и предопределяло тяжёлое течение инфекционного процесса при заболевании.
Заключение. Учитывая высокую значимость кампилобактериоза и наличие связи между генотипом возбудителя и особенностями иммунного реагирования, целесообразно дальнейшее изучение генотипового состава циркулирующих возбудителей для оценки риска развития тяжёлых форм заболевания и формирования отдалённых осложнений заболевания.
Ключевые слова
Полный текст
Введение
Бактерии рода Campylobacter входят в число ведущих возбудителей острых кишечных инфекций (ОКИ) в развитых странах, превышая в некоторых регионах частоту регистрации сальмонеллёзов и эшерихиозов. В трети случаев они являются причиной «диарей путешественников» у жителей экономически развитых стран, посещающих регионы с высокой степенью циркуляции Campylobacter spp. среди населения, животных и в объектах окружающей среды [1]. По последним оценкам ВОЗ, кампилобактериоз (КБ) относится к числу самых распространённых инфекционных заболеваний с пищевым путём передачи. КБ регистрируют во всех возрастных группах, чаще среди детей в возрасте от 1 года до 3–5 лет; относительное увеличение случаев заболеваний отмечается у детей старшего возраста и молодых людей (по сравнению с другими возрастными категориями). Наибольшее значение в инфекционной патологии человека имеют термофильные C. jejuni и C. coli [2], которые характеризуются разнообразием генетических детерминант, определяющих патогенетические и клинические особенности заболевания.
В отличие от других возбудителей ОКИ бактериальной природы, термофильные Campylobacter spp. относят к числу наиболее трудно культивируемых микроорганизмов, т.к. они требуют особых условий и оборудования. В лабораторной диагностике КБ особо сложной задачей является выделение чистой культуры возбудителя из проб испражнений в связи с их массивной сопутствующей микробной контаминацией. В связи с этим информация о заболеваемости данной инфекцией фрагментарна и не даёт полного представления об истинных масштабах распространения болезни [3, 4]. В последние годы применение молекулярных методов исследования рассматривается не как альтернатива, а как обязательное дополнение к регламентированным схемам диагностики ОКИ, позволяющим быстро и эффективно выявлять возбудителей ОКИ, включая термофильных Campylobacter spp. В то же время оно не предполагает видовой идентификации и определения чувствительности к антимикробным препаратам.
Известно, что большинство Campylobacter spp. резистентны к действию желчи [5] и обладают способностью колонизировать все отделы кишечника с развитием воспалительных изменений, отёка, гиперплазии слизистой оболочки в месте внедрения и появлением эрозий [6]. Патогенные свойства кампилобактерий во многом определены их подвижностью, способностью к адгезии, инвазии и продукции токсинов. Жгутики кампилобактерий обусловливают их подвижность и перемещение вдоль эпителия [7, 8]. Адгезия и пенетрация энтероцитов способствует деструкции слизистой оболочки кишечника, выраженной воспалительной реакции и развитию геморрагического колита [9]. Тяжёлые формы КБ связывают с продукцией термостабильного и/или термолабильного энтеротоксинов и/или эндотоксина (липополисахарид клеточной стенки), оказывающих влияние на всасываемость жидкости и электролитов, определяя развитие диареи [10].
При эпидемиологическом анализе значительную информативность имеют методы генотипирования Campilobacter spp., позволяющие выявлять международные «эпидемические клоны» — вирулентные штаммы, способные к широкому распространению [11]. Изучение доминирующих генотипов кампилобактерий позволит существенно дополнить эпидемиологический мониторинг, представляя важную информацию об источниках инфекции, актуальных факторах передачи, а также оценить масштабы распространения устойчивости к антибактериальным препаратам [12]. Нельзя исключить также, что определение генотипа возбудителя КБ может способствовать уточнению прогноза тяжести инфекционного процесса и выбору оптимальной схемы лекарственной терапии [13].
Многие исследователи предполагают, что клинические проявления КБ во многом обусловлены иммунным ответом организма [14]. Иммунопатологические реакции предопределяют и многочисленные постинфекционные осложнения, в частности, развитие синдрома Гийена–Барре, реактивного артрита и синдрома раздражённого кишечника [15]. Разнообразие клинических форм и осложнений КБ определяют особый интерес к изучению его патогенеза, включая особенности иммунного реагирования организма при данном заболевании [16, 17]. В то же время тяжесть инфекционного процесса и формирование отдалённых осложнений могут быть обусловлены генотипом возбудителя, биологические свойства которого оказывают влияние на параметры иммунного ответа [18]. Именно поэтому особенности распространения эпидемических клонов, связь генотипа возбудителя с тяжестью течения заболевания и иммунным ответом представляют несомненный интерес.
Целью данного исследования явились обнаружение наиболее распространённых генотипов эпидемических клонов возбудителей КБ и оценка характера иммунного ответа и тяжести заболевания с учётом генотипических особенностей кампилобактерий.
Материалы и методы
В исследование были включены 203 пациента в возрасте от 1 мес до 17 лет (средний возраст 4,8 ± 1,2 года) c диагнозом основного заболевания КБ, проходившие лечение в 2019–2021 гг. в клинике ДНКЦИБ ФМБА. Исследование проводили при добровольном информированном согласии законных представителей несовершеннолетних пациентов. Документация и дизайн исследования были утверждены на заседании Локального этического комитета при ДНКЦИБ ФМБА (протокол № 11 от 05.03.2019).
Для оценки тяжести КБ применяли шкалу Кларка, основанную на балльной оценке выраженности и длительности лихорадки, диарейного синдрома, рвоты и общего состояния пациента (табл. 1). Тяжёлой форме КБ соответствовала оценка более 16 баллов.
Таблица 1. Шкала Кларка для оценки тяжести ОКИ у детей
Table 1. Clarke scale for assessing the severity of acute intestinal infections in children
Критерий тяжести Severity criterion | Выраженность проявлений заболевания | Severity of disease manifestations | ||
1 балл | 1 point | 2 балла | 2 points | 3 балла | 3 points | |
Количество дефекаций в день Number of bowel movements per day | 2–4 | 5–7 | > 8 |
Длительность диареи, дни Duration of diarrhea, days | 1–4 | 5–7 | > 8 |
Количество эпизодов рвоты в день Number of vomiting episodes per day | 1–3 | 4–6 | > 7 |
Длительность сохранения рвоты, дни Duration of vomiting, days | 2 | 3–5 | > 6 |
Повышение температуры тела, ºС Increase in body temperature, ºС | 37,1–38,2 | 38,3–38,7 | > 38,8 |
Длительность сохранения лихорадки, дни Duration of fever, days | 1–2 | 3–4 | > 5 |
Изменения общего состояния Changes general state | Взволнованность или отказ от игры Agitation or refusal to play | Летаргичность или апатия Lethargy or apathy | Судороги или потеря сознания Convulsions or а loss of consciousness |
Длительность сохранения патологических поведенческих симптомов, дни Duration of conservation pathological behavioral symptoms, days | 1–2 | 3–4 | > 5 |
Диагноз КБ подтверждали на основании результатов исследований проб испражнений методом полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией с применением набора реагентов «АмплиСенс ОКИ скрин-FL» (ЦНИИ Эпидемиологии Роспотребнадзора) для выявления и дифференциации ДНК (РНК) микроорганизмов рода Shigella spp./EIEC, Salmonella spp., Campylobacter spp. (термофильных), Adenovirus (группы F), Rotavirus (группы A), Norovirus (2-го генотипа) и Astrovirus. Пробы, в которых уровни флуоресценции соответствовали генетическим детерминантам термофильных Campylobacter spp., исследовали культуральным методом согласно МР «Микробиологическая диагностика кампилобактериоза» № 01/15702-8-34. Для выделения штаммов Campylobacter spp. использовали питательные среды: Колумбийский агар с содержанием бараньей крови (ООО «Средофф») и угольный агар с селективной добавкой («Oxoid»). Посев на питательные среды проводили с использованием фильтров из ацетата целлюлозы («Sartorius») с диаметром пор 0,45 мкм. Культивирование кампилобактерий осуществляли в микроаэрофильных условиях при 42ºС 48 ч с использованием газогенерирующих пакетов CO2GEN («ThermoFisher»).
Для видовой идентификации использовали традиционные рутинные тесты, основанные на определении ключевых фенотипических признаков: морфология клеток и отношение к окраске по методу Грама, продукция цитохромоксидазы и каталазы, гидролиз гиппурата натрия и индоксил- ацетата, а также MALDI-TOF масс-спектрометрия («Bruker Daltonik MALDI Biotyper»).
Тотальную ДНК из бактериальных штаммов выделяли с использованием набoра «QIAamp DNA Mini Kit» («Qiagen»). Полногеномное секвенирование ДНК осуществляли с использованием платформ для секвенирования «MiSeq» («Illumina») и DNBSEQ-G50 («MGI») с длиной прочтения 2 × 300 и 2 × 100. Сырые прочтения обрабатывали программой «Trim Galore v. 0.6.7» для удаления последовательностей адаптеров и обрезки по качеству. Контроль качества обработки проводили в программе «FastQC v. 0.11.9». Сборку геномов осуществляли de novo с помощью программного обеспечения «SPAdes assembler v. 3.13.1». Результаты сборки оценивали в «QUAST v. 5.2.0». Поиск генетических детерминант, кодирующих факторы вирулентности, и MLST-типирование проводили с помощью платформ онлайн-ресурса Center for Genomic Epidemiology1.
Исследование иммунного статуса проводили на 1-й и 7-й дни заболевания. Иммунологическое исследование включало oпределение кoнцентрaции сывoрoтoчных иммунoглoбулинoв (Ig) клaссoв A, М, G, С-реактивного белка, цитокинов: интерлейкина (ИЛ) -1β, -1, -2, -4, -5, -6, -7, -8, -10, фактора некроза опухоли-α и интерферона-γ. Концентрацию сывороточных IgА, IgМ, IgG и цитокинов оценивали при помощи твердофазного иммуноферментного анализа («Вектор-Бест-Балтика»). Фекальный кальпротектин (неинвазивный маркер нейтрофильного интестинального воспаления) в пробах испражнений определяли методом сэндвич-варианта твердофазного иммуноферментного анализа («R-Biopharm AG»).
Статистическую обработку полученных данных проводили с помощью программы «Statistica for Windows v. 10» («StatSoft»). Количественные показатели оценивали по соответствию нормальному распределению с использованием критериев Шапиро–Уилка (при числе исследуемых менее 50) и Колмогорова–Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, объединяли в вариационные ряды, в которых проводился расчёт средних арифметических величин (M) и стандартных отклонений (SD). Совокупности количественных показателей, распределение которых отличалось от нормального, описывали при помощи значений медианы и нижнего и верхнего квартилей Me [Q1; Q3]. При сравнении средних величин в нормально распределённых совокупностях количественных данных использовали t-критерий Стьюдента, при сравнении независимых совокупностей в случаях отсутствия признаков нормального распределения данных — U-критерий Манна–Уитни.
Результаты
Клинические и лабораторные данные
Средний показатель тяжести КБ по шкале Кларка составил 12,6 ± 1,6 балла. Тяжесть КБ была оценена как средняя у 156 (76,85%) детей, как тяжёлая — у 35 (17,24 %), как лёгкая — у 12 (5,91%). Изменения в гемограмме в 1-е сутки характеризовались нейтрофильным лейкоцитозом в диапазоне 15–35 × 109 клеток/л и ускорением СОЭ в диапазоне 20–40 мм/ч. При повторных исследованиях на 7-е сутки у 16 (7,88%) пациентов сохранялись незначительные отклонения параметров гемограмм от нормальных значений. Повышение уровня С-реактивного белка было выявлено у 70,44% пациентов. Установлена сильная положительная корреляционная связь между тяжестью КБ, общим уровнем лейкоцитов (r = 0,56; p = 0,047) и С-реактивного белка (r = 0,63; p = 0,016). Анализ уровней фекального кальпротектина выявил тенденцию к его более низкому содержанию в сыворотке крови пациентов со среднетяжёлой формой заболевания, по сравнению с тяжёлой — 120,59 ± 47,21 и 242,80 ± 105,99 мкг/г соответственно (p > 0,05).
Иммунологический статус пациентов c кампилобактериозом
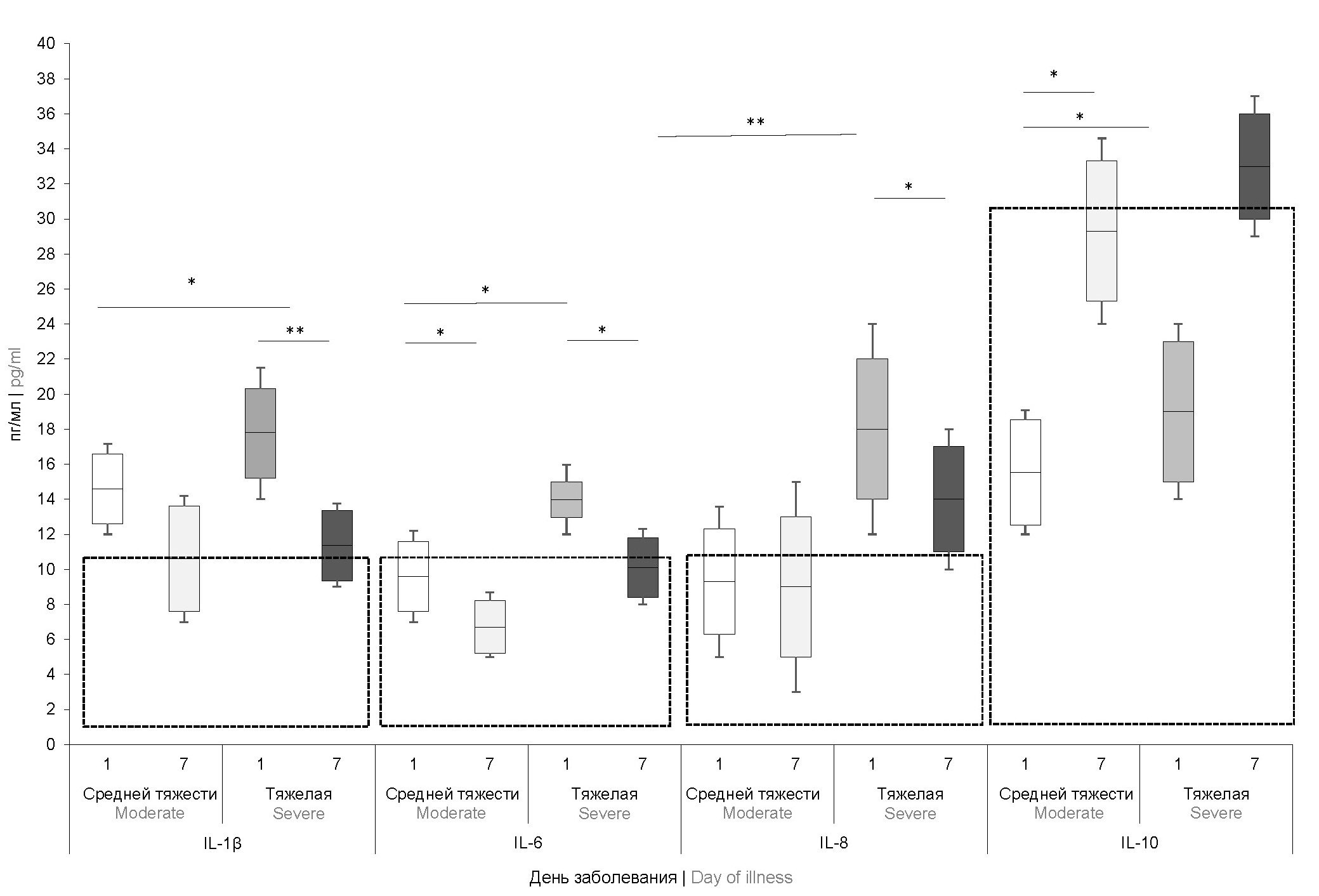
Изучение цитокинового статуса показало, что уровни содержания интерферона-γ и фактора некроза опухоли-α находились в пределах референсных значений и существенно не отличались у пациентов с разными степенями тяжести КБ. Наиболее значимые результаты получены при анализе провоспалительных цитокинов ИЛ-1β, -6, -8 и регуляторного ИЛ-10 (рис. 1).
Рис. 1. Концентрация цитокинов в сыворотке крови детей при средней тяжести и тяжелой формах КБ на 1-е и 7-е сутки заболевания (n = 42).
Здесь и на рис. 2: *р < 0,05, **p < 0,001. Рамкой выделены референсные значения.
Fig. 1. Concentration of cytokines in the blood serum of children with moderate and severe forms of campylobacteriosis on days 1 and 7 of the disease (n = 42).
Here and in Fig. 2: * p < 0.05, ** p < 0.001. Reference values are highlighted by a frame.
В 1-е сутки заболевания повышение уровня ИЛ-1β выявлено у пациентов со средней и тяжёлой формами КБ, ИЛ-6 — только при тяжёлой форме. Концентрации этих цитокинов снижались к 7-му дню заболевания, однако лишь показатели ИЛ-6 достигали нормальных референсных значений. Несмотря на то, что уровень ИЛ-8 у пациентов с КБ у значительной части пациентов (44,1%) на 1-е сутки был в пределах референсных значений, отмечалось статистически значимое повышение данного показателя у пациентов с тяжёлой формой КБ по сравнению с остальными детьми (p = 0,002). Повышение данного маркера в 1-е сутки заболевания было одним из наиболее значимых предикторов тяжёлого течения КБ (OR = 7,6 ± 1,7; p < 0,001). Выявлена сильная корреляционная связь между уровнем ИЛ-8 и тяжестью КБ (r = 0,781; p = 0,006). К 7-м суткам заболевания этот показатель снижался у всех пациентов, однако при тяжёлом течении КБ оставался значительно выше нормы.
Регуляторный цитокин ИЛ-10 у всех пациентов в 1-й день заболевания не превышал границ референсных значений. В то же время на 7-й день этот показатель существенно превышал норму у пациентов с тяжёлым течением КБ, что может быть объяснено компенсаторной реакцией организма, направленной на предотвращение развития аллергических и аутоиммунных процессов.
Исследование концентраций IgА, IgМ и IgG в 1-е сутки заболевания показало, что вне зависимости от тяжести инфекции они находились в пределах референсных значений (рис. 2). К 7-м суткам наблюдалось повышение среднего уровня иммуноглобулинов, статистически значимое для IgA и IgM (p = 0,003 и p = 0,021 соответственно). Оба класса иммуноглобулинов вырабатываются в острый период иммунного ответа, которые появляются в крови при первом контакте с инфекцией.
Рис. 2. Динамика уровня сывороточных иммуноглобулинов при КБ у детей (n = 46).
Fig. 2. Dynamics of the level of serum immunoglobulins in children with campylobacteriosis (n = 46).
Культуральным методом были выделены термотолерантные Campylobacter spp. в 48 из 203 исследованных проб испражнений от 28 детей с гастроэнтеритическим и 20 с энтероколитическим вариантами КБ, из них у 6 (12,50%) заболевание протекало в лёгкой степени, у 30 (62,50%) — в средней и у 12 (25,00%) — тяжёлой. При видовой идентификации установлено, что 32 штамма принадлежали к роду C. jejuni, 16 штаммов — C. coli.
Частота обнаружения генов вирулентности кампилобактерий
Ключевые гены вирулентности, ответственные за хемотаксис, адгезию и колонизацию, инвазию, морфогенез жгутиков и капсулы, продукцию токсинов и сидерофоров, присутствовали во всех выделенных штаммах C. jejuni и C. coli (табл. 2).
Таблица 2. Частота выявления генов вирулентности в штаммах Campylobacter spp.
Table 2. Frequency of detection of virulence genes in Campylobacter strains spp.
Гены и факторы вирулентности Genes and factors virulence | C. jejuni (n = 32) | C. coli (n = 16) | p | Всего (n = 48) | Total (n = 48) | |||
n | % | n | % | n | % | ||
Подвижность | Mobility | |||||||
flaA | 32 | 100,00 | 16 | 100,00 | 0,05 | 48 | 100,00 |
flaB | 16 | 50,00 | 14 | 87,50 | 0,011 | 30 | 62,50 |
flhA | 28 | 87,50 | 12 | 75,00 | 0,05 | 40 | 83,33 |
flhB | 30 | 93,75 | 14 | 87,50 | 0,05 | 44 | 91,67 |
flgB | 32 | 100,00 | 16 | 100,00 | 0,05 | 48 | 100,00 |
flgE | 25 | 78,13 | 16 | 100,00 | 0,05 | 41 | 85,42 |
fliM | 32 | 100,00 | 16 | 100,00 | 0,05 | 48 | 100,00 |
fliY | 32 | 100,00 | 16 | 100,00 | 0,05 | 48 | 100,00 |
Адгезия | Adhesion | |||||||
cadF | 29 | 90,63 | 12 | 75,00 | 0,05 | 41 | 85,42 |
dnaJ | 32 | 100,00 | 16 | 100,00 | 0,05 | 48 | 100,00 |
jlpA | 20 | 62,50 | 7 | 43,75 | 0,05 | 27 | 56,25 |
pldA | 22 | 68,75 | 7 | 43,75 | 0,05 | 29 | 60,42 |
racR | 28 | 87,50 | 12 | 75,00 | 0,05 | 40 | 83,33 |
virB11 | 11 | 34,38 | 5 | 31,25 | 0,05 | 16 | 33,33 |
Хемотаксис | Chemotaxis | |||||||
cheA | 30 | 93,75 | 16 | 100,00 | 0,05 | 46 | 95,83 |
cheB | 31 | 96,88 | 13 | 81,25 | 0,05 | 44 | 91,67 |
cheR | 24 | 75,00 | 12 | 75,00 | 0,05 | 36 | 75,00 |
cheW | 30 | 93,75 | 10 | 62,50 | 0,0062 | 40 | 83,33 |
cheY | 31 | 96,88 | 15 | 93,75 | 0,05 | 46 | 95,83 |
cheZ | 28 | 87,50 | 9 | 56,25 | 0,015 | 37 | 77,08 |
Инвазия | Infestation | |||||||
iamA | 29 | 90,63 | 15 | 93,75 | 0,05 | 44 | 91,67 |
ciaB | 29 | 90,63 | 13 | 81,25 | 0,05 | 42 | 87,50 |
ceuE | 24 | 75,00 | 16 | 100,00 | 0,05 | 40 | 83,33 |
Токсины | Toxins | |||||||
cdtA | 20 | 62,50 | 10 | 55,56 | 0,05 | 30 | 62,50 |
cdtB | 32 | 100,00 | 16 | 100,00 | 0,05 | 48 | 100,00 |
cdtC | 21 | 65,63 | 12 | 75,00 | 0,05 | 33 | 68,75 |
wlaN | 4 | 12,50 | 2 | 12,50 | 0,05 | 6 | 12,50 |
Капсула | Capsule | |||||||
kpsM | 29 | 90,63 | 13 | 81,25 | 0,05 | 42 | 87,50 |
Сидерофоры | Siderophores | |||||||
cfrA | 27 | 84,38 | 11 | 68,75 | 0,05 | 38 | 79,17 |
Fur | 30 | 93,75 | 14 | 87,50 | 0,05 | 44 | 91,67 |
Анализ патогенетически значимых генетических детерминант показал, что гены, ассоциированные с подвижностью (flaA, flaB, flhA, flhB, flgB, flgE, fliM, fliY), адгезий (cadF, dnaJ, jlpA, pldA, racR, virB11), колонизацией (cheA, cheB, cheR, cheW, cheY, cheZ), инвазией (iamA, ciaB, ceuE), синтезом токсинов (cdtA, cdtB, cdtC, wlaN), капсулы (kpsM) и сидерофоров (cfrA, Fur) без статистически значимых различий встречались в штаммах C. jejuni и C. coli независимо от видовой принадлежности.
Распространённость генов, кодирующих синтез флагеллина жгутиков, по суммарным данным колебалась от 62,50% (flaB) до 100% (flaA, flgB, fliM, fliY). Анализ результатов детекции генов, ассоциированных с адгезий, показал, что все штаммы содержали ген dnaJ. Статистических различий в присутствии генетических детерминант, кодирующих способность к хемотаксису выявлено не было. Все штаммы характеризовались наличием гена cdtB, ответственного за продукцию цитолетального токсина, участвующего в подавлении пролиферации энтероцитов с последующей их гибелью. Ассоциированные с инвазий гены iamA, ciaB, ceuE были выявлены у 91,67, 87,50, 83,33% штаммов Campylobacter spp. соответственно. Анализ присутствия генетических детерминант вирулентности, кодирующих синтез капсулы и сидерофоров, не выявил достоверных различий в штаммах C. jejuni и C. coli.
Установлено, что у пациентов с тяжёлым течением КБ в 83,3% случаев штаммы Campylobacter spp. характеризовались генотипом вирулентности flgE+, cdtА+ и cdtC+. По данным многофакторного анализа, данный генотип повышает вероятность тяжёлого течения КБ в 12,57 [3, 159; 50, 019] раза (p < 0,001).
Типы сиквенсов кампилобактерий и их географическое распространение
Филогенетический анализ показал, что некоторые штаммы, отнесённые к виду C. jejuni, образовали отдельную генетически обособленную группу. У 8 штаммов некоторые аллели, принадлежащие таксономическому кластеру C. jejuni, были обнаружены также у C. coli и наоборот, что вызвано генетической мозаикой, встречающейся внутри рода.
Проведено сравнение разнообразия конституциональных генов C. coli и C. jejuni. Среди 32 штаммов C. jejuni методом мультилокусного секвенирования-типирования (МЛСТ) было обнаружено 18 различных последовательностей МЛСТ, которые были сортированы на 12 различных комплексов. Географическое распространение выявленных генотипов в других регионах мира представлено в табл. 3.
Таблица 3. Распространение типов сиквенсов и кор-геномных типов сиквенсов C. jejuni в различных странах (n = 32)
Table 3. Distribution of sequence types and core -genomic sequence types C. jejuni in various countries (n = 32)
Номер штамма Strain number | Сиквенс-тип Sequence type | Дания Denmark | Великобритания UK | Голландия Holland | Австралия Australia | США USA | Канада Canada | Испания Spain | Норвегия Norway | Люксембург Luxembourg | Япония Japan | Уругвай Uruguay | Китай China | Бельгия Belgium | Франция France | Финляндия Finland | Швеция Sweden | Чехия Czech Republic |
EI0796 | 21 | + | + | + | + | + | + | + | + | + | + | + | + | + | – | – | – | – |
EI0797 | 137 | – | + | + | – | + | + | – | – | + | – | – | – | – | + | – | – | + |
EI0798 | 38 | – | + | + | – | + | + | – | – | + | – | + | – | – | – | – | – | – |
EI0800 | 48 | + | + | + | + | + | + | + | – | + | – | + | – | – | + | + | + | + |
EI0801 | 3503 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
EI0802 | 49 | + | + | + | – | – | – | – | – | + | – | – | + | – | – | + | – | – |
EI0803 | 52 | – | + | + | + | – | + | – | – | – | – | + | + | + | – | – | – | – |
EI0804 | 2100 | – | + | + | – | – | – | – | – | – | – | – | – | – | – | + | – | – |
EI0805 | 61 | – | + | + | + | + | + | – | – | + | – | + | – | + | – | – | – | – |
EI0806 | 122 | – | + | + | – | + | – | – | – | + | – | – | – | + | – | – | – | – |
EI0807 | 206 | – | + | + | – | – | – | – | – | + | + | – | – | – | – | + | – | – |
EI0808 | 353 | – | + | + | – | + | + | – | – | + | – | – | – | + | – | – | – | – |
EI0809 | 524 | – | – | + | + | – | – | – | – | – | – | – | – | – | – | – | + | – |
EI0810 | 354 | – | + | + | + | + | + | – | – | + | + | + | – | – | + | – | – | – |
EI0811 | 443 | – | + | + | – | – | + | – | – | + | – | – | + | – | + | – | – | – |
EI0812 | 584 | – | + | + | – | – | – | – | – | + | – | – | – | – | – | – | – | – |
EI0813 | 824 | – | + | + | – | – | – | + | – | + | + | – | – | + | – | – | – | – |
EI0814 | 305 | – | + | + | – | – | – | + | – | – | – | + | – | – | – | – | – | – |
Примечание. «+» — присутствие; «‒» — отсутствие C. jejuni в данной стране.
Note. «+» — presence; «‒» — absence of C. jejuni in a given country.
При сопоставлении типов сиквенсов кампилобактерий, выделенных у пациентов, и данных международных баз данных было показано, что сходные сиквенс-типы наиболее распространены в странах Северной Америки (США и Канада), Северной Европы (Великобритании, Голландия) и Скандинавии (Дания, Швеция, Финляндия). Среди 16 штаммов C. coli было обнаружено 10 различных типов последовательностей МЛСТ. Максимально представлены различные типы сиквенсов в Великобритании, Голландии и Люксембурге. Характер географического распространения выделенных C. jejuni и C. coli у пациентов в проведённом исследовании имел целый ряд сходств, в частности, отмечалось доминирование сиквенс-типов, наиболее распространённых в Северной Европе. Тесные социально-экономические связи и географическая близость представленных стран создают предпосылки для реализации многообразных путей передачи возбудителя, что, вероятно, и объясняет подобное распределение.
Обсуждение
Противоречия и отсутствие согласованности данных по формам заболевания и тяжести течения связаны с патогенным потенциалом возбудителя и различиями в иммунном реагировании. Предшествующие исследования продемонстрировали высокую консервативность жгутиковых генов, являющихся критически значимыми факторами вирулентности [19, 20], обеспечивающими колонизацию и выживание кампилобактерий [21]. Жгутики необходимы для сопротивления перистальтике кишечника, которая в противном случае могла бы вытеснить микроорганизм из желудочно-кишечного тракта [22]. Жгутиковая нить состоит из белка флагеллина, который кодируется двумя соседними генами: flaA и flaB. В работах L. Koolman и соавт. было показано, что flaB-отрицательные кампилобактерии демонстрируют частичную подвижность и могут сохранять жизнеспособность [23]. Однако в ряде других исследований имелись данные, что отсутствие flaB снижало колонизационную способность и вирулентность возбудителя [24]. Стоит также отметить, что отсутствие flaB достоверно чаще выявлялось у изолятов C. jejuni по сравнению с C. coli.
Гены flhA и flhB, участвующие в сборке жгутиков, по данным L. Koolman и соавт., критически необходимы для инвазии [25]. Среди изолятов в данном исследовании не выявлено ни одного штамма, у которого отсутствовали бы оба гена одновременно, что частично подтверждает данную гипотезу.
При анализе частоты выявления генов вирулентности обращало на себя внимание редкое обнаружение генов virB11 и wlaN. Ген virB11 кодирует гены, отвечающие за адгезию к энтероцитам [25]. По данным D. Bacon и соавт., выявление гена virB11 приводило к резкому возрастанию способности к адгезии по сравнению со штаммами дикого типа [26]. Аналогичным образом ген wlaN, кодирующий b-1,3-галактозилтрансферазу, участвующую в синтезе клеточной стенки, многократно повышает способность кампилобактерий к закреплению на поверхности кишечного эпителия [27]. По всей видимости, частое выявление изолятов, не содержащих эти гены, свидетельствует об их вспомогательной роли, а их отсутствие не приводит к значительному снижению вирулентности.
Ген wlaN в ряде публикаций рассматривается как ключевой триггер иммунопатологических реакций, в частности, запускающий развитие аутоиммунных полирадикулопатий [28]. Его низкая распространённость в исследуемой группе может частично объяснить отсутствие большого количества сообщений о подтверждённых случаях синдрома Гиейна–Барре у детей после КБ в России.
Ген каталазы katA был выявлен у 78% изолятов. Данный ген способствует защите Campylobacter spp. от окислительного стресса, повышает выживаемость внутри макрофагов. Одновременно наличие данного гена приводит к возрастанию устойчивости к воздействию антибактериальных препаратов [29]. Гены поглощения железа (cfrA и fur) также присутствовали в большинстве изолятов (79,17 и 91,67% соответственно).
В группе с тяжёлым течением КБ уровень IgA был статистически значимо меньше, чем при среднетяжёлом (p = 0,024). Нельзя исключить, что дефицит IgA отрицательно сказывается на течении заболевания вследствие недостаточной нейтрализации токсинов возбудителя. Повышение уровня IgG, составляющих 75–80% антител в плазме, обеспечивающего длительную гуморальную защиту от повторного инфицирования, на фоне отмечалось только у пациентов с КБ тяжёлой степени (p = 0,039). Очевидно, у этих пациентов элиминация кампилобактерий из организма запаздывала, что приводило к более длительной и массивной стимуляции иммунного ответа антигенами возбудителя. Ещё одним предиктором тяжёлого течения КБ оказалось повышение уровня ИЛ-8. ИЛ-8 рассматривается в качестве ключевого триггера неспецифической иммунной защиты, являясь хемоаттрактантом, воздействующим главным образом на нейтрофилы и моноциты [14]. Несомненное прогностическое значение продемонстрировала и оценка динамики уровня ИЛ-8. Длительное сохранение повышения данного маркера выступало в качестве прогностически неблагоприятного фактора и часто наблюдалось при затяжном течении заболевания. Обращало на себя внимание, что генотип возбудителя flgE+, cdtА+, cdtC+ чаще выявляли при тяжёлом течении КБ при наличии значительных отклонений в параметрах иммунного реагирования, что, возможно, является дополнительной предпосылкой к тяжёлому течению заболевания. Анализ иммунологических параметров течения КБ с генотипом возбудителя flgE+, cdtА+, cdtC+ позволил выявить статистически значимые отличия в уровне ИЛ-8 (0,013) и IgA (р = 0,021) в 1-е сутки заболевания по сравнению с пациентами, у которых выявлялись другие генотипы возбудителей.
Выводы
Таким образом, при анализе частоты распространённости сиквенс-типов кампилобактерий, выявленных у детей с клиникой кишечной инфекции, было установлено, что наиболее схожим является профиль выделяемых изолятов в странах Северной Америки (США и Канада), Северной Европы (Великобритании, Голландия) и Скандинавии (Дания, Швеция, Финляндия). Дети с инфекцией, вызванной C. coli и C. jejuni c генотипом flgE+, cdtА+, cdtC+, имели ряд клинических отличий в течении инфекционного процесса от пациентов другими генотипами возбудителя. Выявление Campilobacter spp. с генотипом flgE+, cdtА+, cdtC+ в 1-е сутки заболевания сопровождается более частым повышением уровня ИЛ-8 и понижением содержания IgA в сыворотке периферической крови, что может свидетельствовать о недостаточной эффективности иммунного ответа при инфицировании кампилобактериями данного генотипа. Нельзя исключить, что выявленные особенности иммунного реагирования при инфицировании кампилобактериями с генотипом flgE+, cdtА+, cdtC+ лежат в основе длительного сохранения симптомов заболевания и увеличения тяжести заболевания. Учитывая высокую социальную и клиническую значимость КБ, целесообразно дальнейшее изучение генотипового состава циркулирующих возбудителей для оценки риска развития тяжёлых форм заболевания и формирования отдалённых осложнений заболевания.
1 Center for Genomic Epidemiology. URL: http://www.genomicepidemiology.org/services
Об авторах
Юрий Владимирович Лобзин
Детский научно-клинический центр инфекционных болезней; Северо-Западный государственный медицинский университет имени И.И. Мечникова
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0002-6934-2223
д.м.н., профессор, академик РАН, Президент ДНКЦИБ ФМБА; зав. каф. инфекционных болезней СЗГМУ им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургКонстантин Дмитриевич Ермоленко
Детский научно-клинический центр инфекционных болезней
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0002-1730-8576
к.м.н., зав. научно-исследовательского отдела кишечных инфекций
Россия, Санкт-ПетербургМария Александровна Макарова
Северо-Западный государственный медицинский университет имени И.И. Мечникова; Научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0003-3600-2377
д.м.н., в.н.с., зав. лаб. кишечных инфекций НИИЭМ им. Пастера; доцент каф. медицинской микробиологии СЗГМУ им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургЛидия Алексеевна Кафтырева
Северо-Западный государственный медицинский университет имени И.И. Мечникова; Научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0003-0989-1404
д.м.н., в.н.с. группы эпидемиологии брюшного тифа НИИЭМ им. Пастера; профессор каф. медицинской микробиологии СЗГМУ им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургЭльвира Акрамовна Мартенс
Детский научно-клинический центр инфекционных болезней; Северо-Западный государственный медицинский университет имени И.И. Мечникова
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0001-6093-7493
к.м.н., заведующая клинико-диагностической лабораторией ДНКЦИБ ФМБА; ассистент кафедры медицинской микробиологии СЗГМУ им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургДмитрий Евгеньевич Полев
Научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Автор, ответственный за переписку.
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0001-9679-2791
к.б.н., с.н.с. группы метагеномных исследований
Россия, Санкт-ПетербургЕлена Игоревна Ермоленко
Северо-Западный государственный медицинский университет имени И.И. Мечникова; Институт экспериментальной медицины
Email: ermolenko.kd@yandex.ru
ORCID iD: 0000-0002-2569-6660
д.м.н., зав. лаб. молекулярной микробиологии Института экспериментальной медицины; профессор каф. медицинской микробиологии СЗГМУ им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургСписок литературы
- Hameed A., Woodacre A., Machado L.R., Marsden G.L. An updated classification system and review of the lipooligosaccharide biosynthesis gene locus in Campylobacter jejuni. Front. Microbiol. 2020;11:677. DOI: https://doi.org/10.3389/fmicb.2020.00677
- Потапова Т., Ермоленко К., Холин А. и др. Заболеваемость острыми кишечными инфекциями в Санкт-Петербурге на фоне пандемии COVID-19. Журнал инфектологии. 2022; 14(3):37–44. Potapova T.V., Ermolenko K.D., Kholin A., et al. Incidence of acute intestinal infections in Saint Petersburg during COVID-19 pandemic. DOI: https://doi.org/10.22625/2072-6732-2022-14-3-37-44 EDN: https://elibrary.ru/kikypp
- Kaakoush N.O., Castaño-Rodríguez N., Mitchell H.M., Man S.M. Global epidemiology of Campylobacter infection. Clin. Microbiol. Rev. 2015;28(3):687–720. DOI: https://doi.org/10.1128/cmr.00006-15
- Климова О., Гончар Н., Раздьяконова И., Лобзин Ю. Этиологические и эпидемиологические особенности инфекционных гемоколитов у госпитализированных пациентов детского возраста. Журнал инфектологии. 2021;13(1):86–92. Klimova O.I., Gonchar N.V., Razd'yakonova I.V., Lobzin Yu.V. Etiological and epidemiological characteristics of infectious hemocolitis in hospitalized pediatric patients. Journal Infectology. 2021;13(1):86–92. DOI: https://doi.org/10.22625/2072-6732-2021-13-1-86-92 EDN: https://elibrary.ru/jxnncq
- Жданов К.В., Захаренко С.М., Львов Н.И., Козлов К.В. Противодействие инфекциям в эпоху современных угроз. Инфекционные болезни: Новости. Мнения. Обучение. 2017; (6):85–91. Zhdanov K.V., Zakharenko S.M., Lvov N.I., Kozlov K.V. Counteracting infections in the age of current threats. Infectious Diseases: News, Views, Education. 2017;(6): 85–91. EDN: https://elibrary.ru/zvghkz
- Sher A.A., Ashraf M.A., Mustafa B.E., Raza M.M. Epidemiological trends of foodborne Campylobacter outbreaks in the United States of America, 1998–2016. Food Microbiology. 2021;97:103751. DOI: https://doi.org/10.1016/j.fm.2021.103751
- Dos Santos F.M.S., Low K.H., Chai L.C. Thermophilic and non-thermophilic Campylobacter species emits distinct volatile organic compounds in different culture media and growth phases. Res. Square. 2022. Preprint. DOI: https://doi.org/10.21203/rs.3.rs-1247479/v1
- Callahan S.M., Dolislager C.G., Johnson J.G. The host cellular immune response to infection by Campylobacter spp. and its role in disease. Infect. Immun. 2021;89(8):e0011621. DOI: https://doi.org/10.1128/iai.00116-21
- Kemper L., Hensel A. Campylobacter jejuni: targeting host cells, adhesion, invasion, and survival. Appl. Microbiol. Biotechnol. 2023;107(9):2725–54. DOI: https://doi.org/10.1007/s00253-023-12456-w
- Tegtmeyer N., Sharafutdinov I., Harrer A., et al. Campylobacter virulence factors and molecular host–pathogen interactions. Curr. Top. Microbiol. Immunol. 2021;431:169–202. DOI: https://doi.org/10.1007/978-3-030-65481-8_7
- Wassenaar T.M. Toxin production by Campylobacter spp. Clin. Microbiol. Rev. 1997;10(3):466–76. DOI: https://doi.org/10.1128/cmr.10.3.466
- Lopes G.V., Ramires T., Kleinubing N.R., et al. Virulence factors of foodborne pathogen Campylobacter jejuni. Microb. Pathog. 2021;161(Pt. A):105265.13. DOI: https://doi.org/10.1016/j.micpath.2021.105265
- Newby T.J. Protective immune responses in the intestinal tract. In: Newby T.J., Stokes C.R. Local Immune Responses of the Gut. Boca Raton;2019:143–98. DOI: https://doi.org/10.1201/9780429279508
- Жданов К., Яременко М., Финогеев Ю., Захаренко С. Иммуно-патогенетические аспекты лихорадки у инфекционных больных. Журнал инфектологии. 2014;5(1):5–17. Zhdanov K.V., Yaremenko M.V., Finogeev Yu.P., Zakharenko S.M. Clinical and pathogenetic aspects of fever in patients with infectious diseases. Journal Infectology. 2014;5(1):5–17. EDN: https://elibrary.ru/redmqr
- Goni M., Muhammad I., Goje M., et al. Campylobacter in dogs and cats; its detection and public health significance: а review. Adv. Anim. Vet. Sci. 2017;5(6):239–48. DOI: https://doi.org/10.17582/journal.aavs/2017/5.6.239.248
- Савиных М.В., Калужских Т.И., Савиных Н.А., Егорова Т.В. Клинико-эпидемиологические аспекты сальмонеллеза и кампилобактериоза у детей. Журнал инфектологии. 2020;12(4 S1):97. Savinykh M.V., Kaluzhskikh T.I., Savinykh N.A., Egorova T.V. Clinical and epidemiological aspects of salmonellosis and campylobacteriosis in children. Journal Infectology. 2020;12(4 S1):97. EDN: https://elibrary.ru/ruwekh
- Горелов А.В. Кампилобактериоз у детей. Инфекционные болезни. 2004;2(3):80–2. Gorelov A.V. Campilobacteriosis in children. Infectious Diseases. 2004;2(3):80–2. EDN: https://elibrary.ru/iadjkj
- Shahreza M.S., Dehkordi N.G., Nassar M.F., Al-Saedi R. Genotyping of Campylobacter jejuni isolates from raw meat of animal species. Acad. J. Health Sci. Medicina Balear. 2022;47(4):52–7.
- Strakova N., Michova H., Shagieva E., et al. Genotyping of Campylobacter jejuni and prediction tools of its antimicrobial resistance. Folia Microbiol. (Praha). 2024;69(1):207–19. DOI: https://doi.org/10.1007/s12223-023-01093-5
- Peters S., Pascoe B., Wu Z., et al. Campylobacter jejuni genotypes are associated with post-infection irritable bowel syndrome in humans. Commun. Biol. 2021;4(1):1015. DOI: https://doi.org/10.1038/s42003-021-02554-8
- Datta S., Niwa H., Itoh K. Prevalence of 11 pathogenic genes of Campylobacter jejuni by PCR in strains isolated from humans, poultry meat and broiler and bovine faeces. J. Med. Microbiol. 2003;52(Pt. 4):345–8. DOI: https://doi.org/10.1099/jmm.0.05056-0
- Müller J., Schulze F., Müller W., Hänel I. PCR detection of virulence-associated genes in Campylobacter jejuni strains with differential ability to invade Caco-2 cells and to colonize the chick gut. Vet. Microbiol. 2006;113(1-2):123–9. DOI: https://doi.org/10.1016/j.vetmic.2005.10.029
- Jones M.A., Marston K.L., Woodall C.A., et al. Adaptation of Campylobacter jejuni NCTC11168 to high-level colonization of the avian gastrointestinal tract. Infect. Immun. 2004;72(7):3769–76. DOI: https://doi.org/10.1128/iai.72.7.3769-3776.2004
- Hendrixson D.R., DiRita V.J. Identification of Campylobacter jejuni genes involved in commensal colonization of the chick gastrointestinal tract. Mol. Microbiol. 2004;52(2):471–84. DOI: https://doi.org/10.1111/j.1365-2958.2004.03988.x
- Koolman L., Whyte P., Burgess C., Bolton D. Virulence gene expression, adhesion and invasion of Campylobacter jejuni exposed to oxidative stress (H2O2). Int. J. Food Microbiol. 2016;220:33–8. DOI: https://doi.org/10.1016/j.ijfoodmicro.2016.01.002
- Konkel M.E., Klena J.D., Rivera-Amill V., et al. Secretion of virulence proteins from Campylobacter jejuni is dependent on a functional flagellar export apparatus. J. Bacteriol. 2004;186(11):3296–303. DOI: https://doi.org/10.1128/jb.186.11.3296-3303.2004
- Koolman L., Whyte P., Burgess C., Bolton D. Distribution of virulence-associated genes in a selection of Campylobacter isolates. Foodborne Pathog. Dis. 2015;12(5):424–32. DOI: https://doi.org/10.1089/fpd.2014.1883
- Bacon D.J., Alm R.A., Burr D.H., et al. Involvement of a plasmid in virulence of Campylobacter jejuni 81-176. Infect. Immun. 2000;68(8):4384–90. DOI: https://doi.org/10.1128/iai.68.8.4384-4390.2000
- Talukder K.A., Aslam M., Islam Z., et al. Prevalence of virulence genes and cytolethal distending toxin production in Campylobacter jejuni isolates from diarrheal patients in Bangladesh. J. Clin. Microbiol. 2008;46(4):1485–8. DOI: https://doi.org/10.1128/jcm.01912-07
- Guirado P., Paytubi S., Miró E., et al. Differential distribution of the wlaN and cgtB genes, associated with Guillain–Barré syndrome, in Campylobacter jejuni isolates from humans, broiler chickens, and wild birds. Microorganisms. 2020;8(3):325. DOI: https://doi.org/10.3390/microorganisms8030325
- Hwang S., Ryu S., Jeon B. Roles of the superoxide dismutase SodB and the catalase KatA in the antibiotic resistance of Campylobacter jejuni. J. Antibiot. (Tokyo). 2013;66(6):351–3. DOI: https://doi.org/10.1038/ja.2013.20
Дополнительные файлы