Современные данные о циркуляции возбудителя лихорадки Ку на территории Гвинейской Республики
- Авторы: Найденова Е.В.1, Захаров К.С.1, Агафонов Д.А.1, Карташов М.Ю.2, Сеничкина А.М.1, Халилов Э.С.3, Ибрагим А.Б.4, Ба М.Б.4, Нурдин И.4,5, Токаревич Н.К.3, Бумбали С.4,5, Сидиме Ю.6, Щербакова С.А.1, Кутырев В.В.1
-
Учреждения:
- Российский научно-исследовательский противочумный институт «Микроб»
- Государственный научный центр вирусологии и биотехнологии «Вектор»
- Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
- Исследовательский институт прикладной биологии Гвинеи
- Исследовательский центр вирусологии
- Институт медицинской ветеринарии
- Выпуск: Том 101, № 5 (2024)
- Страницы: 606-618
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18611
- DOI: https://doi.org/10.36233/0372-9311-557
- EDN: https://elibrary.ru/tezljr
- ID: 18611
Цитировать
Аннотация
Введение. Лихорадка Ку является наиболее изученным зоонозом, широко распространённым практически на всей территории Африки, исключая территорию Сахары. Однако сведения о заболеваемости коксиеллезом и циркуляции Coxiella burnetii на этом континенте являются ограниченными и неоднородными.
В Гвинейской Республике в 1980–1990 гг. на базе Советско-Гвинейской научно-исследовательской вирусологической и микробиологической лаборатории проводились исследования по изучению распространения возбудителя лихорадки Ку, получены данные об иммунной прослойке населения и выявлены специфические антитела в сыворотках крови сельскохозяйственных животных. В последующие годы исследования были приостановлены.
Цель работы — получение современных данных о распространении C. burnetii на территории всех ландшафтно-географических зон Гвинейской Республики.
Материалы и методы. Исследования проводили в лаборатории Российско-Гвинейского центра эпидемиологии и профилактики инфекционных болезней (Киндия, Гвинейская Республика), для чего были получены 332 сыворотки крови лихорадящих больных и 3156 сывороток крови практически здоровых людей, 1074 образца крови сельскохозяйственных животных, 1648 суспензий клещей, 319 экземпляров мелких млекопитающих и 298 — рукокрылых. Исследование проводили методами иммуноферментного анализа и полимеразной цепной реакции, отдельные образцы подвергали углублённому генетическому анализу.
Результаты и обсуждение. Проведено изучение распространения C. burnetii на территории всех ландшафтно-географических зон Гвинейской Республики. Впервые выявлен и подтверждён лабораторными методами случай заболевания человека лихорадкой Ку. Установлена роль сельскохозяйственных животных, мелких млекопитающих и рукокрылых в циркуляции возбудителя. Показано, что основными переносчиками на территории Гвинеи являются иксодовые клещи видов Amblyomma variegatum, Hyalomma truncatum и Rhipicephalus decoloratus. При проведении молекулярно-генетических исследований выявлены штаммы C. burnetii, несущие плазмиду QpH1, способные вызывать заболевания людей и животных. Определены полные нуклеотидные последовательности 16S рРНК возбудителя лихорадки Ку, обнаруженного на территории Гвинеи, которые в последующем зарегистрированы в базе данных GenBank (OQ152497–OQ152500).
Заключение. С учётом полученных сведений о распространении возбудителя лихорадки Ку актуальной задачей остается продолжение изучения особенностей циркуляции C. burnetii на территории Гвинеи. Регулярный мониторинг и оценка факторов риска возникновения заболеваний, вызываемых коксиеллами, позволят разработать алгоритм лабораторной диагностики и рекомендации для врачей.
Полный текст
Введение
Лихорадка Ку, или коксиеллёз, — общее для человека и животных природно-очаговое заболевание, этиологическим агентом которого являются бактерии Coxiella burnetii (семейство Legionellaceae, класс Gammaproteobacteria), характеризующееся полиморфизмом клинической картины у человека и разнообразными механизмами передачи возбудителя. В природных очагах основным переносчиком C. burnetii считаются иксодовые, реже аргасовые клещи, а резервуаром — дикие млекопитающие, среди сельскохозяйственных животных — мелкий (МРС) и крупный рогатый скот (КРС) [1, 2].
Заболевание у людей протекает в виде лихорадки с общетоксическими симптомами с возможным переходом в хроническую форму. В связи с широким распространением инфекции, многообразием путей передачи (контактный, пищевой, воздушно-пылевой) лихорадка Ку представляет важную медико-социальную проблему во всём мире.
Помимо этого данная инфекционная болезнь имеет и важное ветеринарное значение, т. к. вызывает репродуктивные нарушения (аборты и мертворождения) у КРС и МРС, что влечёт значительные экономические потери, особенно в тех регионах, где животноводство является основной отраслью сельскохозяйственного производства [2].
Коксиеллёз является одним из наиболее изученных зоонозов на территории Африки. Появляются новые свидетельства того, что инфицирование C. burnetii является причиной лихорадочных заболеваний, не связанных с малярией, и внебольничной пневмонии во многих африканских странах. Однако современные сведения о заболеваемости лихорадкой Ку и циркуляции C. burnetii на этом континенте являются ограниченными и неоднородными [3].
Имеющиеся публикации о предыдущих исследованиях указывают на достаточно высокий уровень выявления специфических антител к возбудителю у населения некоторых африканских стран [4–9]. Например, при исследовании образцов сывороток крови жителей отдельных населённых пунктов региона Син-Салум (Республика Сенегал) показано, что специфические антитела к C. burnetii были выявлены в 3,7–24,8% образцов (в зависимости от места проживания обследуемых лиц) [5]. Схожие данные получены при проведении иммуносерологического мониторинга в общинах скотоводов в округе Марсабит на севере Кении, когда положительные результаты были получены в 13,2% случаев [6]. Вероятность выявления иммунологических маркеров у мужчин в Кении была значительно выше, чем у женщин [7].
Показано, что племена скотоводов подвержены наиболее высокому риску заражения коксиеллёзом из-за их кочевого образа жизни и хорошо сохранившихся традиций, которые повышают вероятность употребления в пищу некипячёных молочных продуктов и сырого мяса инфицированных животных. Не исключено также, что заражение происходит при контакте с мочой, фекалиями, кровью заражённых животных, а также околоплодными водами после аборта или доношенных родов [6–9].
Известно и то, что лихорадка Ку вызывает значительные потери среди не только сельскохозяйственных, но и диких животных: антилоп, жирафов, львов и гепардов, нанося непоправимый урон численности этих редких млекопитающих [10].
Данная инфекционная болезнь приобретает актуальность и в качестве «болезни путешественников» в связи с популяризацией Африканского континента и стремительно развивающимся туризмом на данной территории. В литературе описана вспышка лихорадки Ку, когда во время сафари в природном парке Кении из 50 участников туристического маршрута 4 (8%) подверглись заражению, что стало причиной завозных случаев на территорию Европы [11].
Большинство опубликованной в открытой печати информации по изучению циркуляции возбудителя лихорадки Ку относится к странам Восточной Африки. О ситуации в западной части континента сведений гораздо меньше. Имеются данные об исследованиях, проводимых в природных очагах коксиеллёза, Гане, Нигерии, Мали [12–14], а также в Сенегале, где в 2023 г. в пробах от мелких млекопитающих были выявлены два новых генотипа Coxiella burnetii, патогенность которых ещё предстоит изучить [15].
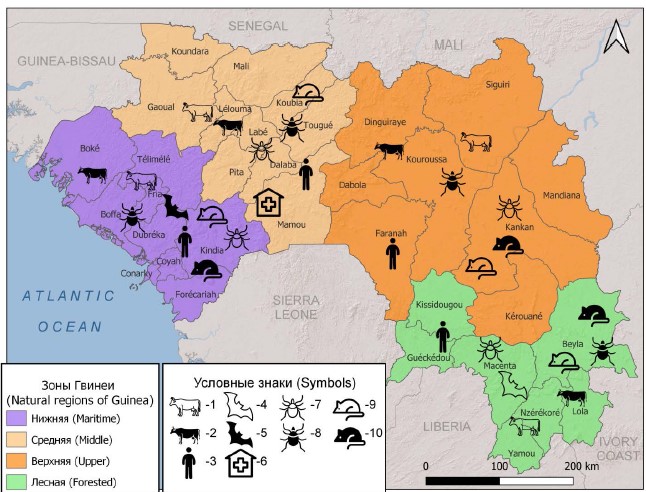
Гвинейская Республика расположена в Западной Африке, на побережье Атлантического океана. Население страны, по данным на конец марта 2024 г., составляет около 14,5 млн человек1. Территория государства на основании географических и природно-климатических признаков условно разделена на 4 ландшафтно-географические зоны: Нижнюю (Приморскую), Среднюю, Верхнюю и Лесную (рисунок) [16].
Ландшафтно-географические зоны Гвинейской Республики, где были выявлены маркеры возбудителя лихорадки Ку.
1 — ДНК в сыворотках крови КРС; 2 — IgG в сыворотках крови КРС; 3 — IgG в сыворотках крови жителей; 4 — ДНК в суспензиях органов рукокрылых; 5 — антигены в суспензиях органов рукокрылых; 6 — случаи заболевания людей; 7 — ДНК в суспензиях иксодовых клещей; 8 — антигены в суспензиях иксодовых клещей; 9 — ДНК в суспензиях органов мелких млекопитающих; 10 — антигены в суспензиях органов мелких млекопитающих.
Landscape and geographical zones of the Republic of Guinea, where markers of the Q fever pathogen were identified.
1 — DNA in blood sera of cattle; 2 — IgG antibodies in blood sera of cattle; 3 — IgG antibodies in blood sera of residents; 4 — DNA in suspensions of bat organs; 5 — antigens in suspensions of bat organs; 6 — cases of human disease; 7 — DNA in suspensions of ixodes ticks; 8 — antigens in suspensions of ixodes ticks; 9 — DNA in suspensions of organs of small mammals; 10 — antigens in suspensions of organs of small mammals.
В 1980–1990 гг. на базе Советско-Гвинейской научно-исследовательской вирусологической и микробиологической лаборатории было проведено достаточно большое количество исследований с целью изучения распространения возбудителя лихорадки Ку на территории Гвинейской Республики, в том числе получены данные об иммунной прослойке населения страны и выявлены специфические антитела в сыворотках крови сельскохозяйственных животных [17]. В последующие десятилетия, в силу сложившихся экономических и политических условий, исследования были приостановлены, а значимость лихорадки Ку в общей структуре заболеваемости так и не определена. В 2017 г. в рамках работы Российско-Гвинейского центра эпидемиологии и профилактики инфекционных болезней (далее — Центр), созданном на основании распоряжений Правительства РФ на территории Института прикладной биологии Гвинеи (г. Киндиа), исследования были продолжены [18–20].
Цель работы — получение современных данных о распространении C. burnetii и особенностей природных очагов лихорадки Ку на территории различных ландшафтно-географических зон Гвинеи.
Материалы и методы
Сбор образцов клинического и биологического материала и последующую диагностическую работу проводили на базе лаборатории Центра российские и гвинейские специалисты, руководствуясь требованиями санитарных правил и норм СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней».
Сыворотка крови людей
Сыворотка крови практически здоровых людей была собрана в региональных госпиталях Гвинеи местными специалистами. Забор крови производили в утренние часы натощак из локтевой вены в количестве 5–10 мл в одноразовую стерильную вакуумную пробирку с активатором образования сгустка с соблюдением правил асептики.
Далее полученные образцы доставляли в лабораторию Центра с соблюдением правил биологической безопасности и температурного режима. Все образцы сыворотки предварительно исследовали методом иммунохроматографического анализа для обнаружения антигенов малярийных плазмодиев с набором реагентов «SDBIOLINE Malaria Ag P.f./Pan» («Standart Diagnostics, Inc.»). Для исключения вероятности неспецифических реакций образцы, содержащие антигены возбудителей малярии, в последующие исследования не вошли.
Для изучения иммунной прослойки населения Гвинеи к возбудителю лихорадки Ку была составлена панель из 3156 сывороток крови практически здоровых людей, проживающих во всех 4 ландшафтно-географических зонах страны. В работу были включены представители разных возрастных групп: 1519 (48,2%) женщин и 1637 (51,8%) мужчин. Работу проводили методом иммуноферментного анализа (ИФА) c использованием набора реагентов «Тест-система иммуноферментная для выявления антител класса G к антигенам Coxiella burnetii» (НИИ эпидемиологии и микробиологии им. Пастера, Россия). Сыворотки исследовали в разведении 1 : 100.
Для выяснения возможности заболевания людей лихорадкой Ку были собраны и исследованы 332 сыворотки крови лихорадящих больных, обратившихся за медицинской помощью в региональные госпитали Гвинеи с жалобами на продолжительную лихорадку и другими симптомами, не исключающими коксиеллёз. Сбор материала также проводили гвинейские специалисты по вышеописанной методике. Для проведения исследований молекулярно-генетическими методами кровь также отбирали в количестве 5–10 мл в одноразовую стерильную вакуумную пробирку с 3,8% цитратом натрия.
Образцы исследовали методом полимеразной цепной реакции (ПЦР) с целью выявить ДНК C. burnetii с набором реагентов «АмплиСенс Coxiella burnetii-FL» (ЦНИИ Эпидемиологии, Россия) и ИФА с использованием диагностического препарата «Coxiella burnetii ELISA IgM» («Vircell») для определения антител класса IgM к возбудителю.
Исследование проб клинического и биологического материала от людей проводили при информированном согласии пациентов, для несовершеннолетних — с разрешения родителей (официальных представителей). Протокол исследования одобрен решением Национального этического комитета Министерства здравоохранения Гвинейской Республики (протокол № 129/CNERS/16 от 31.08.2015).
Сыворотка крови сельскохозяйственных животных
Образцы крови получали на скотобойнях, используя общепринятую методику, от взрослых животных (возраст более 1,5 года) без признаков инфекционных заболеваний после их осмотра ветеринарным врачом. Всего для работы была сформирована панель из 1074 образцов крови КРС. Полученные сыворотки тестировали методами ИФА и ПЦР с использованием наборов реагентов для выявления специфических антител класса IgG к C. burnetii «ID Screen Q Fever Indirect Multi-species» («ID Screen»), который рекомендован в качестве ветеринарного препарата, и ДНК C. burnetii — «АмплиСенс Coxiella burnetii-FL» (ЦНИИ Эпидемиологии, Россия).
Суспензии клещей
Сбор иксодовых клещей осуществляли на территории всех 4 ландшафтно-географических зон Гвинеи. Эктопаразитов снимали вручную, используя средства индивидуальной защиты, с людей, сельскохозяйственных животных, домашних и безнадзорных собак и кошек, мелких млекопитающих, рептилий. Всего за время проведения исследований было собрано 4709 экземпляров клещей, которых на основании морфологических признаков отнесли к 11 видам: Amblyomma variegatum Fabricius, 1794; Haemaphysalis leachi Audouin, 1826; Hyalomma rufipes Koch, 1844; Hyalomma truncatum Koch, 1844; Rhipicephalus (Boophilus) decoloratus Koch, 1844; Rhipicephalus (Boophilus) geigyi Aeschliman & Morel, 1965; Rhipicephalus (Boophilus) annulatus Say, 1821; Rhipicephalus (Boophilus) microplus Canestrini, 1888; Rhipicephalus lunulatus Neumann, 1907; Rhipicephalus sanguineus Latreille, 1806; Rhipicephalus senegalensis Koch, 1844, согласно определителю [21]. Далее с учётом вида, пола, фазы развития и упитанности отдельных особей клещей, а также мест сбора эктопаразитов, было сформировано 1648 пулов. Эктопаразитов дважды отмывали 70% этанолом для удаления внешних загрязнений и наружной микрофлоры. Подготовку проб для исследования проводили с использованием лабораторного гомогенизатора «TissueLyser II» («Qiagen») в 500 мкл стерильного фосфатно-солевого буферного раствора.
Полученный материал был протестирован методами ПЦР и ИФА с использованием набора реагентов «АмплиСенс Coxiella burnetii-FL» (ЦНИИ Эпидемиологии) и тест-системы иммуноферментной для выявления антигенов коксиелл Бернета «ИФА-Ку-антиген (комплект N1)» (НИИ эпидемиологии и микробиологии им. Пастера) соответственно. Часть проб, содержащих и ДНК, и антигены C. burnetii, исследованы с использованием высокопроизводительного секвенирования на платформе «Ion S5» («Thermo Scientific»), далее прочтения картировались на последовательность 16S рРНК из базы NCBI GenBank с помощью алгоритма BWA [22]. Изучен также плазмидный профиль со специфическими праймерами к локусам плазмид QpH1, QpRS и QpDV.
Суспензии органов мелких млекопитающих
При проведении эпизоотологического мониторинга на территории Гвинеи отловлено 319 экземпляров мелких млекопитающих (Rodentia, Eulipotyphla). Видовой спектр грызунов представлен 13 видами: Arvicanthis ansorgei Thomas, 1910 (суданская травяная мышь); Heliosciurus gambianus Ogibly, 1835 (гамбийская белка); Cricetomys gambianus Waterhouse, 1840 (гамбийская хомяковидная крыса); Lemniscomys striatus Linnaeus, 1758 (полосатая мышь); Lophuromys sikapusi Temminck, 1853 (ржавобрюхая жесткошёрстная мышь); Mastomys erythroleucus Temminck, 1853 (гвинейская многососковая мышь); Mastomys natalensis A. Smith, 1834 (натальская мышь); Mus minutoides A. Smith, 1834 (карликовая мышь); Mus musculoides Temminck, 1853 (Темминкова мышь); Praomys daltoni Thomas, 1892 (мышь Дальтона); Rattus rattus Linnaeus, 1758 (чёрная крыса); Crocidura olivieri Lesson, 1827 (африканская гигантская белозубка); Crocidura sp. Wagler, 1832 (белозубки) [23–26].
Добыто 298 экземпляров рукокрылых (Chiroptera) 14 видов: Eidolon helvum Kerr, 1792 (пальмовый крылан); Epomophorus gambianus Ogilby, 1835 (большой эполетовый крылан); Lissonycteris angolensis Bocage, 1898 (ангольская летучая собака); Rousettus aegyptiacus E. Geoffroy, 1810 (египетская летучая собака); Chaerephon pumillus Cretzschmar, 1830 (карликовый складчатогуб); Mops condylurus A. Smith, 1833 (ангольский складчатогуб); Hipposideros caffer Sundevall, 1846 (южноафриканский листонос); Hipposideros jonesi Hayman, 1947 (листонос Джонса); Hipposideros ruber Noack, 1893 (красный листонос); Nycteris hispida Schreber, 1775 (мохнатый щелеморд); Neoromicia guineensis Bocage, 1889 (гвинейский кожан); Scotophilus dinganii A. Smith, 1833 (африканский гладконос); Scotophilus leucogaster Cretzschmar, 1830 (белобрюхий домовый гладконос); Rhinolophus alcyone Temminck, 1853 (ганский подковонос) [23–26].
Млекопитающих вскрывали с соблюдением правил биологической безопасности не позднее чем через 3 ч после отлова. При отсутствии такой возможности тушки животных замораживали при –20ºС и доставляли в лабораторию, где в последующем вскрывали и отбирали образцы органов. В качестве материала для работы служили объединённые суспензии лёгких и почек, в которых проводили поиск маркеров возбудителя коксиеллёза (ДНК и антигенов) с упомянутыми выше наборами реагентов.
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с «Consensus author guidelines for animal use» (IAVES 23 July 2010). Исследование одобрено комиссией по биоэтике Российского противочумного института «Микроб» (протокол № 8 от 21.11.2023).
При статистической обработке материала рассчитывали долю выявленных маркеров возбудителей в каждой выборке, 95% доверительные интервалы (ДИ) для долей по методу Уилсона.
Результаты и обсуждение
Выявление случая заболеваний людей лихорадкой Ку в Гвинее
До настоящего времени выявление больных с подозрением на лихорадку Ку на территории Гвинеи не проводилось. Это можно объяснить тем, что отсутствует настороженность медицинских работников в местных госпиталях в отношении данной инфекционной болезни. В связи с этим большой интерес представляет случай заболевания, впервые зарегистрированный на территории страны.
Пациентка Д., 28 лет, проживающая в г. Маму (Средняя Гвинея), поступила в инфекционное отделение регионального госпиталя. При госпитализации у больной отмечались затяжная (более 1 мес) субфебрильная лихорадка, мышечные и суставные боли, затруднённое дыхание. Результаты анализа на выявление возбудителей малярии, проведённого методами иммунохроматографического анализа и микроскопии, были отрицательными.
Для проведения дальнейшей дифференциальной диагностики сыворотка крови больной направлена в лабораторию Центра. Полученный материал исследовали методом ПЦР с обратной транскрипцией с целью выявления РНК вирусов Эбола, жёлтой лихорадки, Западного Нила, денге, Зика, Крымской-Конго геморрагической лихорадки, гепатита С, 16S РНК возбудителей лептоспироза, ДНК вируса гепатита В, возбудителей лихорадки Ку и риккетсиозов. По результатам работы в сыворотке крови пациентки обнаружена ДНК C. burnetii. Также материал протестирован с использованием ИФА, выявлены специфические антитела класса IgM к коксиеллам в титре 1 : 400. В последующем полученный образец крови использовали для определения нуклеотидной последовательности ДНК возбудителя лихорадки Ку. При проведении частичного секвенирования со специфическими праймерами выявлена 99% идентичность исследуемого образца с геномом C. burnetii. Филогенетический анализ с помощью алгоритма BLAST2 показал 96% гомологии со штаммами, выделенными в Намибии.
При опросе больная Д. упоминала тесный контакт с сельскохозяйственными животными, в частности с КРС, находящимся в собственности, а также указала, что в деревне, где проживала пациентка, были отмечены случаи спонтанных абортов у МРС.
В остальных пробах сывороток крови от лихорадящих больных, доставленных из госпиталей Гвинеи, ни генетические маркеры C. burnetii, ни специфические антитела класса IgM к коксиеллам не выявлены.
Определение уровня иммунной прослойки жителей Гвинеи к возбудителю лихорадки Ку
В настоящем исследовании сывороток крови людей, проживающих в различных зонах Гвинеи, специфические антитела к возбудителю лихорадки Ку, относящиеся к классу IgG, выявлены во всех возрастных группах, при этом зависимости уровня иммунной прослойки от половой принадлежности обследованных лиц не наблюдалось (табл. 1). В целом по стране специфические иммуноглобулины к C. burnetii были зарегистрированы в 366 из 3156 образцов сыворотки крови, что составило 11,6% (95% ДИ 10,5–12,8).
Таблица 1. Выявление специфических антител класса IgG к возбудителю лихорадки Ку в сыворотках крови жителей Гвинеи
Table 1. Identification of specific IgG antibodies to the Q fever pathogen in the blood sera of residents of the Republic of Guinea
Возраст, лет Age, years | Количество образцов | Number of samples | ||||||
всего total | мужчины | men | женщины | women | |||||
всего total | положительных positive | % (95% ДИ | 95% CI) | всего total | положительных positive | % (95% ДИ | 95% CI) | ||
< 10 | 197 | 108 | 8 | 7,4 (3,8–13,9) | 89 | 6 | 6,7 (3,1–13,9) |
10–20 | 498 | 275 | 26 | 9,4 (6,5–13,4) | 223 | 27 | 12,1 (8,4–17,0) |
20–30 | 699 | 340 | 32 | 9,4 (6,7–12,9) | 359 | 29 | 8,1 (5,7–11,4) |
30–40 | 595 | 300 | 39 | 13,0 (9,7–17,3) | 295 | 33 | 11,2 (8,1–15,3) |
40–50 | 559 | 285 | 35 | 12,3 (8,9–16,6) | 277 | 29 | 10,5 (7,4–14,6) |
50–60 | 339 | 230 | 37 | 16,1 (11,9–21,4) | 109 | 26 | 23,8 (16,8–32,6) |
> 70 | 269 | 102 | 20 | 19,6 (13,1–28,3) | 167 | 19 | 11,4 (7,4–17,1) |
Всего | Total | 3156 | 1637 | 197 | 12,1 (10,5–13,7) | 1519 | 169 | 11,3 (9,6–12,8) |
Определение уровня иммунной прослойки сельскохозяйственных животных к возбудителю лихорадки Ку
Одним из показателей циркуляции возбудителей природно-очаговых инфекционных болезней на определённой территории является выявление специфических иммуноглобулинов класса G в сыворотках крови сельскохозяйственных животных, обитающих в данном регионе.
В результате данной работы антитела к возбудителю лихорадки Ку выявлены в 172 образцах, что составило 16,0% (95% ДИ 13,9–18,3). Положительные результаты зарегистрированы во всех ландшафтно-географических зонах.
Выявление специфических маркеров (ДНК и антигены) возбудителя лихорадки Ку в суспензиях клещей
Методами ПЦР и ИФА исследованы суспензии иксодовых клещей различных видов, являющихся основными переносчиками C. burnetii, которые были собраны во всех ландшафтно-географических зонах Гвинеи. ДНК возбудителя выявлена в 294 (17,9%) пробах, антиген — в 307 (18,7%) (табл. 2). Положительные находки отмечались среди всех видов иксодовых клещей, представленных в работе, но большинство относились к Am. variegatum, Hy. truncatum, Rh. decoloratus (табл. 2).
Таблица 2. Выявление маркеров C. burnetii в суспензиях иксодовых клещей разных видов, собранных на территории Гвинеи
Table 2. Identification of C. burnetii markers in suspensions of ixodid ticks of different species collected in the territory of the Republic of Guinea
Вид клещей Tick species | Количество проб (экземпляров) Number of samples (copies) | Количество положительных проб; % (95% ДИ) The number of positive samples; % (95% СI) | |
ПЦР | PCR | ИФА | ELISA | ||
Am. variegatum | 872 (2493) | 159; 18,2 (15,8–20,9) | 193; 22,1 (19,5–25,0) |
Ha. leachi | 16 (56) | 0 | 0 |
Hy. truncatum | 52 (95) | 14; 26,9 (16,8–40,3) | 16; 30,8 (19,9–44,3) |
Rh. annulatus | 58 (161) | 36; 62,1 (49,2–73,4) | 29; 50 (37,5–62,5) |
Rh. decoloratus | 391 (1104) | 47; 12 (9,2–15,6) | 37; 9,5 (6,9–12,8) |
Rh. geigyi | 210 (668) | 36; 17,1 (12,7–22,8) | 29; 13,8 (9,8–19,1) |
Rh. microplus | 18 (47) | 0 | 1; 5,6 (1,0–25,8) |
Rh. sanguineus | 10 (42) | 0 | 1; 10 (1,8–40,4) |
Rh. senegalensis | 18 (29) | 2; 11,1 (3,1–32,8) | 1; 5,6 (1,0–25,8) |
Rh. lunulatus | 2 (11) | 0 | 0 |
Hy. rufipes | 1 (3) | 0 | 0 |
Всего | Total | 1648 (4709) | 294; 17,8 (16,1–19,8) | 307; 18,6 (16,8–20,6) |
Анализ плазмидных профилей является важным инструментом для изучения распространения лихорадки Ку и определения типа возбудителя. Для проведения генетического типирования C. burnetii была создана панель из 20 проб, представленных разными видами клещей, в которых выявлены одновременно и ДНК (уровень ct не более 15), и антиген возбудителя. Методом ПЦР со специфическими праймерами к локусам плазмид QpH1, QpRS и QpDV в 5 образцах выявлено наличие только QpH1. Последовательности фрагментов плазмид QpRS и QpDV ни в одной пробе не выявлено. В ходе анализа полученных результатов и данных литературы установлено, что штаммы, несущие плазмиду QpH1, широко распространены на территории стран Экваториальной Африки и способны вызывать заболевания у людей и животных [27, 28], что не исключает возможность их циркуляции и на территории Гвинеи.
Cформированная панель образцов была проанализирована с использованием методов высокопроизводительного секвенирования на платформе «Ion S5» («Thermo Scientific»). В результате работы в 8 пробах определена нуклеотидная последовательность 16S рРНК возбудителя лихорадки Ку, которая на 99,9% совпадает с референсным штаммом, представленным в базе данных NCBI GenBank. При сравнении полученной консенсусной последовательности с базой NCBI BLAST обнаружены штаммы C. burnetii, выделенные в Намибии, показавшие гомологию (96%) с исследуемым образцом. Дополнительно полученные прочтения классифицировались алгоритмом kraken2 с использованием базы 16S РНК Greengenes, что также показало принадлежность исследуемого образца к виду C. burnetii. Часть полученных нуклеотидных последовательностей 16S рРНК с наиболее высоким качеством прочтения были депонированы в международную базу данных GenBank под номерами OQ152497–OQ152500.
Выявление специфических маркеров (ДНК и антигены) возбудителя лихорадки Ку в суспензиях органов мелких млекопитающих
В результате исследований методами ПЦР и ИФА маркеры возбудителя лихорадки Ку были выявлены в материале, собранном во всех зонах Гвинеи. Антиген обнаружен в 0,9% проб, ДНК — в 5,1%. Максимальное количество положительных находок было получено при исследовании материала от грызунов вида Mastomys erythroleucus (табл. 3). Данные сведения могут свидетельствовать об участии животных этой систематической группы в распространении C. burnetii на территории Гвинеи.
Таблица 3. Выявление маркеров C. burnetii в суспензиях органов мелких млекопитающих разных видов, собранных на территории Гвинеи
Table 3. Identification of C. burnetii markers in suspensions of organs of small mammals of different species collected on the territory of the Republic of Guinea
Вид мелких млекопитающих Small mammal species | Количество проб (экземпляров) Number of samples (copies) | Количество положительных проб; % (95% ДИ) The number of positive samples; % (95% СI) | |
ПЦР | PCR | ИФА | ELISA | ||
Arvicanthis ansorgei | 3 | 0 | 0 |
Heliosciurus gambianus | 4 | 0 | 0 |
Cricetomys gambianus | 7 | 1; 14,3 (2,6–51,3) | 0 |
Lemniscomys striatus | 3 | 0 | 0 |
Lophuromys sikapusi | 1 | 0 | 0 |
Mastomys erythroleucus | 124 | 8; 6,5 (3,3–12,2) | 2; 1,6 (0,4–5,7) |
Mastomys natalensis | 32 | 2; 6,3 (1,7–20,1) | 0 |
Mus minutoides | 5 | 0 | 0 |
Mus musculoides | 16 | 1; 6,3 (1,1–28,3) | 0 |
Praomys daltoni | 6 | 0 | 0 |
Rattus rattus | 96 | 4; 4,2 (1,6–10,2) | 1; 1,0 (0,2–5,7) |
Crocidura olivieri | 7 | 0 | 0 |
Crocidura sp. | 15 | 0 | 0 |
Всего | Total | 319 | 16; 5,0 (3,1–8,0) | 3; 0,9 (0,3–2,7) |
Выявление специфических маркеров (ДНК и антигены) возбудителя лихорадки Ку в суспензиях органов рукокрылых
При исследовании объединённых проб лёгких и почек, полученных от рукокрылых, были выявлены как антигены (в 1% случаев), так и ДНК C. burnetii (2%). Большинство положительных проб сформированы из органов Scotophilus leucogaster (табл. 4). Представители этого вида широко распространены на территории всей Африки южнее Сахары. Полученные данные подтверждают роль рукокрылых в циркуляции возбудителя лихорадки Ку, что свидетельствует о необходимости проведения дополнительных исследований для определения роли этих млекопитающих в экологии возбудителя.
Таблица 4. Выявление маркеров C. burnetii в суспензиях органов рукокрылых разных видов, собранных на территории Гвинеи
Table 4. Identification of C. burnetii markers in organ suspensions of bats of various species collected on the territory of the Republic of Guinea
Виды рукокрылых Bat species | Количество проб (экземпляров) Number of samples (copies) | Количество положительных проб; % (95% ДИ) The number of positive samples; % (95% СI) | |
ПЦР | PCR | ИФА | ELISA | ||
Eidolon helvum | 1 | 0 | 0 |
Epomophorus gambianus | 4 | 0 | 0 |
Lissonycteris angolensis | 4 | 0 | 0 |
Rousettus aegyptiacus | 15 | 0 | 0 |
Chaerephon pumillus | 3 | 0 | 0 |
Mops condylurus | 26 | 1; 3,8 (0,7–18,9) | 0 |
Hipposideros caffer | 32 | 0 | 0 |
Hipposideros jonesi | 25 | 0 | 0 |
Hipposideros ruber | 41 | 1; 2,4 (0,4–12,6) | 1; 2,4 (0,4–12,6) |
Nycteris hispida | 5 | 0 | 0 |
Neoromicia guineensis | 23 | 1; 4,3 (0,8–21,0) | 0 |
Scotophilus dinganii | 1 | 0 | 0 |
Scotophilus leucogaster | 117 | 3; 2,6 (0,9–7,3) | 2; 1,7 (0,5–6,0) |
Rhinolophus alcyone | 1 | 0 | 0 |
Всего | Total | 298 | 6; 2,0 (0,9–4,3) | 3; 1,0 (0,3–2,9) |
Заключение
В результате работы проведено изучение распространения C. burnetii на территории всех ландшафтно-географических зон Гвинеи, в том числе впервые выявлен и лабораторно подтверждён случай заболевания человека лихорадкой Ку (табл. 5). Установлена роль сельскохозяйственных животных, мелких млекопитающих и рукокрылых в циркуляции C. burnetii. Показано, что основными переносчиками возбудителя на территории Гвинеи являются иксодовые клещи видов Am. variegatum, Hy. truncatum и Rh. decoloratus. При проведении молекулярно-генетических исследований материала, собранного в Гвинее, выявлены штаммы C. burnetii, несущие плазмиду QpH1, которые способны вызывать заболевания у людей и животных, и впервые для данного региона определена и зарегистрирована в международной базе данных GenBank полная нуклеотидная последовательность гена 16S рРНК возбудителя лихорадки Ку.
Таблица 5. Выявление маркеров возбудителя лихорадки Ку в различном материале, собранном на территории Гвинейской Республики
Table 5. Identification of markers of the Q fever pathogen in various materials collected on the territory of the Republic of Guinea
Вид исследуемого материала Type of the studied samples | Количество проб Number of samples | Количество положительных проб; % (95% ДИ) The number of positive; % (95% CI) | ||
ПЦР | PCR | ИФА | ELISA | |||
ДНК | DNA | антиген | antigen | IgG | ||
Нижняя (Приморская) Гвинея | Lower (Maritime) Guinea | ||||
Сыворотка крови практически здоровых людей Blood serum of practically healthy people | 943 | Н. и. | N. i. | Н. и. | N. i. | 106; 11,2 (9,4–13,4) |
Сывороткa крови КРС | Blood serum of cattle | 371 | 6; 1,6 (0,7–3,5) | Н. и. | N. i. | 64; 17,2 (13,7–21,4) |
Суспензии клещей | Suspensions of ticks | 624 | 111; 17,8 (15,0–21,0) | 131; 21,0 (18,0–24,4) | Н. и. | N. i. |
Суспензии органов мелких млекопитающих Suspensions of organs of small mammals | 149 | 8; 5,4 (2,7–10,2) | 0; 0 (0–2,5) | Н. и. | N. i. |
Суспензии органов рукокрылых Suspensions of bat organs | 107 | 0; 0 (0–3,4) | 3; 2,8 (0,9–7,9) | Н. и. | N. i. |
Средняя Гвинея | Middle Guinea | ||||
Сыворотка крови практически здоровых людей Blood serum of practically healthy people | 778 | Н. и. | N. i. | Н. и. | N. i. | 82; 10,5 (8,6–12,8) |
Сыворотка крови КРС | Blood serum of cattle | 257 | 3; 1,2 (0,4–3,4) | Н. и. | N. i. | 49; 19,2 (14,7–24,3) |
Суспензии клещей | Suspensions of ticks | 402 | 71; 17,7 (14,2–21,7) | 77; 19,1 (15,6–23,3) | Н. и. | N. i. |
Суспензии органов мелких млекопитающих Suspensions of organs of small mammals | 55 | 3; 5,4 (1,9–14,8) | 0; 0 (0–6,5) | Н. и. | N. i. |
Суспензии органов рукокрылых Suspensions of bat organs | 61 | 0; 0 (0–5,8) | 0; 0 (0–5,8) | Н. и. | N. i. |
Верхняя Гвинея | Upper Guinea | ||||
Сыворотка крови практически здоровых людей Blood serum of practically healthy people | 655 | Н. и. | N. i. | Н. и. | N. i. | 77; 11,8 (9,5–14,4) |
Сыворотка крови КРС | Blood serum of cattle | 182 | 2; 1,1 (0,3–3,9) | Н. и. | N. i. | 35; 13,2 (9,6–17,8) |
Суспензии клещей | Suspensions of ticks | 245 | 53; 21,6 (16,9–27,2) | 28; 0,8 (0,3–2,9) | Н. и. | N. i. |
Суспензии органов мелких млекопитающих Suspensions of organs of small mammals | 43 | 2; 4,6 (1,3–15,4) | 1; 2,3 (0,4–12,1) | Н. и. | N. i. |
Суспензии органов рукокрылых Suspensions of bat organs | 54 | 0; 0 (0–6,6) | 0; 0 (0–6,6) | Н. и. | N. i. |
Лесная Гвинея | Forest Guinea | ||||
Сыворотка крови практически здоровых людей Blood serum of practically healthy people | 780 | Н. и. | N. i. | Н. и. | N. i. | 101; 12,9 (10,7–15,5) |
Сыворотка крови КРС | Blood serum of cattle | 264 | 3; 1,1 (0,4–3,3) | Н. и. | N. i. | 35; 13,2 (9,6–17,8) |
Суспензии клещей | Suspensions of ticks | 377 | 59; 15,6 (12,3–19,7) | 61; 16,2 (12,8–20,2) | Н. и. | N. i. |
Суспензии органов мелких млекопитающих Suspensions of organs of small mammals | 72 | 3; 4,2 (1,4–11,5) | 2; 2,8 (0,8–9,5) | Н. и. | N. i. |
Суспензии органов рукокрылых Suspensions of bat organs | 76 | 6; 7,9 (3,7–16,1) | 0; 0 (0–4,8) | Н. и. | N. i. |
Общее по стране | General by country | ||||
Сыворотка крови практически здоровых людей Blood serum of practically healthy people | 3156 | Н. и. | N. i. | Н. и. | N. i. | 366; 11,6 (10,5–12,7) |
Сыворотка крови КРС | Blood serum of cattle | 1074 | 14; 1,3 (0,8–2,1) | Н. и. | N. i. | 172; 16,0 (13,9–18,3) |
Суспензии клещей | Suspensions of ticks | 1648 | 294; 17,8 (16,1–19,8) | 307; 18,6 (16,8–20,6) | Н. и. | N. i. |
Суспензии органов мелких млекопитающих Suspensions of organs of small mammals | 319 | 16; 5,0 (3,1–8,0) | 3; 0,9 (0,3–2,7) | Н. и. | N. i. |
Суспензии органов рукокрылых Suspensions of bat organs | 298 | 6; 2,0 (0,9–4,3) | 3; 1,0 (0,3–2,9) | Н. и. | N. i. |
Примечание. Н. и. — не исследовали.
Note. N. i. — not investigated.
Наше исследование позволило расширить данные о циркуляции и распространении C. burnetii в Западной Африке. Актуальной задачей остаётся изучение особенностей циркуляции C. burnetii на территории Гвинеи. Систематически получаемые сведения о выявлении возбудителя и оценка факторов риска возникновения вспышек заболеваний, вызываемых коксиеллами, необходимы для разработки алгоритма лабораторной диагностики и составления рекомендаций для врачей-клиницистов. Регулярный мониторинг за распространением лихорадки Ку, проводимый при участии как медицинских, так и ветеринарных служб Гвинеи, позволит прогнозировать эпидемиологическую ситуацию и координировать профилактические (противоэпидемические) мероприятия в рамках концепции «Единое здоровье» (One Health)3.
1 Countrymeters. Население Гвинеи.
URL: http://countrymeters.info/ru/guinea
2 URL: https://blast.ncbi.nlm.nih.gov/Blast.cgi
3 WHO. One health. URL: https://www.who.int/health-topics/one-health#tab=tab_1 (дата обращения: 26.05.2024).
Об авторах
Екатерина Владимировна Найденова
Российский научно-исследовательский противочумный институт «Микроб»
Автор, ответственный за переписку.
Email: katim2003@mail.ru
ORCID iD: 0000-0001-6474-3696
к. б. н., в. н. с. отдела диагностики инфекционных болезней
Россия, СаратовКирилл Сергеевич Захаров
Российский научно-исследовательский противочумный институт «Микроб»
Email: katim2003@mail.ru
ORCID iD: 0000-0002-4726-309X
к. б. н., с. н. с. отдела эпидемиологии инфекционных болезней
Россия, СаратовДмитрий Алексеевич Агафонов
Российский научно-исследовательский противочумный институт «Микроб»
Email: katim2003@mail.ru
ORCID iD: 0000-0001-9273-6063
старший научный сотрудник отдела диагностики инфекционных болезней ФКУН Российский противочумный институт «Микроб» Роспотребнадзора, к.б.н.
Россия, СаратовМихаил Юрьевич Карташов
Государственный научный центр вирусологии и биотехнологии «Вектор»
Email: katim2003@mail.ru
ORCID iD: 0000-0002-7857-6822
к. б. н., с. н. с. отдела молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, р.п. КольцовоАйслу Мухамятовна Сеничкина
Российский научно-исследовательский противочумный институт «Микроб»
Email: katim2003@mail.ru
ORCID iD: 0000-0003-1026-2680
к. б. н., с. н. с. отдела диагностики инфекционных болезней
Россия, СаратовЭрик Серкалиевич Халилов
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: katim2003@mail.ru
ORCID iD: 0000-0002-0599-4302
м. н. с. лаб. зооантропонозных инфекций
Россия, Санкт-ПетербургАбдул Бастои Ибрагим
Исследовательский институт прикладной биологии Гвинеи
Email: katim2003@mail.ru
ORCID iD: 0009-0003-2547-8705
н. с. лаб. вирусных геморрагических лихорадок Гвинеи
Гвинея, КиндиаМамадю Бандикура Ба
Исследовательский институт прикладной биологии Гвинеи
Email: katim2003@mail.ru
ORCID iD: 0000-0002-4565-269X
н. с.
Гвинея, КиндиаИбрагим Нурдин
Исследовательский институт прикладной биологии Гвинеи; Исследовательский центр вирусологии
Email: katim2003@mail.ru
ORCID iD: 0000-0002-2970-9676
к. б. н., н. с. лаб. вирусных геморрагических лихорадок
Гвинея, Киндиа; КонакриНиколай Константинович Токаревич
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: katim2003@mail.ru
ORCID iD: 0000-0001-6433-3486
д. м. н., профессор, зав. лаб. зооантропонозных инфекций
Россия, Санкт-ПетербургСанаба Бумбали
Исследовательский институт прикладной биологии Гвинеи; Исследовательский центр вирусологии
Email: katim2003@mail.ru
ORCID iD: 0000-0002-4506-6033
к. б. н., профессор, директор лаб. вирусных геморрагических лихорадок Гвинеи
Гвинея, Киндиа; КонакриЮсуф Сидиме
Институт медицинской ветеринарии
Email: katim2003@mail.ru
ORCID iD: 0000-0002-0742-0468
к. вет. н., профессор, директор Института медицинской ветеринарии
Гвинея, ДалабаСветлана Анатольевна Щербакова
Российский научно-исследовательский противочумный институт «Микроб»
Email: katim2003@mail.ru
ORCID iD: 0000-0003-1143-4069
д. б. н., зам. директора
Россия, СаратовВладимир Викторович Кутырев
Российский научно-исследовательский противочумный институт «Микроб»
Email: katim2003@mail.ru
ORCID iD: 0000-0003-3788-3452
д. м. н., профессор, академик РАН, директор Российского противочумного института «Микроб»
Россия, СаратовСписок литературы
- Онищенко Г.Г., Кутырева В.В., ред. Специфическая индикация патогенных биологических агентов. М.; 2014. Onishchenko G.G., Kutyrev V.V., eds. Specific Indication of Pathogenic Biological Agents. Moscow; 2014. EDN: https://elibrary.ru/qlnqhv
- Лукин Е.П., Мищенко О.А., Борисевич С.В. Лихорадка Ку в XXI в.: материал для подготовки лекции. Инфекционные болезни: новости, мнения, обучение. 2019;8(4):62–77. Lukin E.P., Mishchenko O.A., Borisevich S.V. Ku fever in the XXI century: material for preparing a lecture. Infectious Diseases: News, Opinions, Training. 2019;8(4):62–77. DOI: https://doi.org/10.24411/2305-3496-2019-14009, EDN: https://elibrary.ru/houbuj
- Vanderburg S., Rubach M.P., Halliday J.E., et al. Epidemiology of Coxiella burnetii infection in Africa: a OneHealth systematic review. PLoS Negl. Trop. Dis. 2014;8(4):e2787. DOI: https://doi.org/10.1371/journal.pntd.0002787
- Dupont H.T., Brouqui P., Faugere B., Raoult D. Prevalence of antibodies to Coxiella burnetti, Rickettsia conorii, and Rickettsia typhi in seven African countries. Clin. Infect. Dis. 1995;21(5):1126–33. DOI: https://doi.org/10.1093/clinids/21.5.1126
- Mediannikov O., Fenollar F., Socolovschi C., et al. Coxiella burnetii in humans and ticks in rural Senegal. PLoS Negl. Trop. Dis. 2010;4(4):e654. DOI: https://doi.org/10.1371/journal.pntd.0000654
- Muema J., Nyamai M., Wheelhouse N., et al. Endemicity of Coxiella burnetii infection among people and their livestock in pastoral communities in northern Kenya. Heliyon. 2022;8(10):e11133. DOI: https://doi.org/10.1016/j.heliyon.2022.e11133
- Mwololo D., Nthiwa D., Kitala P., et al. Sero-epidemiological survey of Coxiella burnetii in livestock and humans in Tana River and Garissa counties in Kenya. PLoS Negl. Trop. Dis. 2022;16(3):e0010214. DOI: https://doi.org/10.1371/journal.pntd.0010214
- Crump J.A., Morrissey A.B., Nicholson W.L., et al. Etiology of severe non-malaria febrile illness in Northern Tanzania: a prospective cohort study. PLoS Negl. Trop. Dis. 2013;7(7):e2324. DOI: https://doi.org/10.1371/journal.pntd.0002324
- Larson P.S., Espira L., Grabow C., et al. The sero-epidemiology of Coxiella burnetii (Q fever) across livestock species and herding contexts in Laikipia County, Kenya. Zoonoses Public Health. 2019;66(3):316–24. DOI: https://doi.org/10.1111/zph.12567
- Mangena M.L., Gcebe N., Thompson P.N., Adesiyun A.A. Q fever and toxoplasmosis in South African livestock and wildlife: a retrospective study on seropositivity, sporadic abortion, and stillbirth cases in livestock caused by Coxiella burnetii. BMC Vet. Res. 2023;19(1):168. DOI: https://doi.org/10.1186/s12917-023-03645-w
- Njeru J., Henning K., Pletz M.W., et al. Febrile patients admitted to remote hospitals in Northeastern Kenya: seroprevalence, risk factors and a clinical prediction tool for Q-Fever. BMC Infect. Dis. 2016;16:244. DOI: https://doi.org/10.1186/s12879-016-1569-0
- Dione M.M., Séry A., Sidibé C.A.K., et al. Exposure to multiple pathogens — serological evidence for Rift Valley fever virus, Coxiella burnetii, Bluetongue virus and Brucella spp. in cattle, sheep and goat in Mali. PLoS Negl. Trop. Dis. 2022;16(4):e0010342. DOI: https://doi.org/10.1371/journal.pntd.0010342
- Addo S.O., Bentil R.E., Baako B.O.A., et al. Occurrence of Rickettsia spp. and Coxiella burnetii in ixodid ticks in Kassena-Nankana, Ghana. Exp. Appl. Acarol. 2023;90(1-2):137–53. DOI: https://doi.org/10.1007/s10493-023-00808-0
- Kamani J., Baneth G., Gutiérrez R., et al. Coxiella burnetii and Rickettsia conorii: Two zoonotic pathogens in peridomestic rodents and their ectoparasites in Nigeria. Ticks Tick Borne Dis. 2018;9(1):86–92. DOI: https://doi.org/10.1016/j.ttbdis.2017.10.004
- Mangombi-Pambou J., Granjon L., Labarrere C., et al. New genotype of Coxiella burnetii causing epizootic q fever outbreak in rodents, Northern Senegal. Emerg. Infect. Dis. 2023;29(5):1078–81. DOI: https://doi.org/10.3201/eid2905.221034
- Черч Гаррисон Р.Дж. Западная Африка. Природная среда и ее хозяйственное использование. М.;1959. Church Harrison R.J. West Africa. A study of the environment and of man's use of it. New York;1957.
- Каливоги С., Буаро М.Е., Константинов О.К., Плотникова Л.Ф. Иммунная структура населения и домашних животных Гвинейской Республики в отношении риккетсиозов группы клещевой пятнистой лихорадки и лихорадки Ку. Медицинская паразитология и паразитарные болезни. 2013;(1):28–30. Kalivogi S., Boiro M.E., Konstantinov O.K., Plotnikova L.F. The immune structure of the population and domestic animals of the Republic of Guinea in relation to rickettsioses of the tick-borne spotted fever and Ku fever group. Medical Parasitology and Parasitic Diseases. 2013;(1):28–30. EDN: https://elibrary.ru/tvzcbv
- Найденова Е.В., Каливоги С., Карташов М.Ю. и др. Новые данные об уровне иммунной прослойки населения Гвинейской Республики к возбудителю лихорадки Ку. Инфекция и иммунитет. 2021;11(1):165–70. Naidenova E.V., Kalivogui S., Kartashov M.Y., et al. New data on the level of immune stratum against Q fever agent in population of the of Republic of Guinea. Russian Journal of Infection and Immunity. 2021;11(1):165–70. DOI: https://doi.org/10.15789/2220-7619-NDO-1485 EDN: https://elibrary.ru/wzsxmv
- Найденова Е.В., Захаров К.С., Карташов М.Ю. и др. Выявление генетических маркеров возбудителей природно-очаговых инфекционных болезней в пробах иксодовых клещей, собранных на территории Гвинейской Республики. Проблемы особо опасных инфекций. 2023;(4):115–24. Naidenova E.V., Zakharov K.S., Kartashov M.Yu., et al. Genetic Marker Detection of Natural-Focal Infectious Disease Pathogens in Samples of Ixodidae Ticks, Collected on the Territory of the Republic of Guinea. Problems of Particularly Dangerous Infections. 2023;(4):115–24. DOI: https://doi.org/10.21055/0370-1069-2023-4-115-124 EDN: https://elibrary.ru/lnomas
- Найденова Е.В., Карташов М.Ю., Шевцова А.П. и др. Определение уровня иммунной прослойки сельскохозяйственных животных к возбудителям зоонозных инфекционных болезней в Гвинейской Республике. Проблемы особо опасных инфекций. 2022;(2):101–6. Naidenova E.V., Kartashov M.Yu., Shevtsova A.P., et al. Identification of the farm animals immune to pathogens of zoonotic infectious diseases in the Republic of Guinea. Problems of Particularly Dangerous Infections. 2022;(2):101–6. DOI: https://doi.org/10.21055/0370-1069-2022-2-101-106 EDN: https://elibrary.ru/bssaaq
- Walker A.R., Bouattour A., Camicas J.L., et al. Ticks of Domestic Animals in Africa: A Guide to Identification of Species. Edinburgh;2014.
- Li H., Durbin R. Fast and accurate short read alignment with Burrows–Wheeler transform. Bioinformatics. 2009; 25(14):1754–60. DOI: https://doi.org/10.1093/bioinformatics/btp324
- Wilson D.E., Reeder D.M., eds. Mammal Species of the World. A Taxonomic and Geographic Reference. Baltimore;2005.
- Happold D.C.D., ed. Mammals of Africa. Volume III: Rodents, Hares and Rabbits. London;2013.
- Happold M., Happold D.C.D., eds. Mammals of Africa. Volume IV: Hedgehogs, Shrews and Bats. London;2013.
- Соколов В.Е. Пятиязычный словарь названий животных. Млекопитающие. Латинский — русский — английский — немецкий — французский. М.;1984. Sokolov V.E. A Five-Language Dictionary of Animal Names. Mammals. Latin — Russian — English — German — French. Moscow;1984.
- Luo S., Lu S., Fan H., et al. The Coxiella burnetii QpH1 plasmid is a virulence factor for colonizing bone marrow-derived murine macrophages. J. Bacteriol. 2021;203(9):e00588–20. DOI: https://doi.org/10.1128/jb.00588-20
- Панферова Ю.А., Фрейлихман О.А., Токаревич Н.К. и др. Детекция Coxiella burnetii в клещах, собранных с крупного рогатого скота, на территории некоторых провинций Гвинейской Республики. Эпидемиология и инфекционные болезни. 2019;24(5-6):234–9. Panferova Yu.A., Freylikhman О.А., Tokarevich N.K., et al. Detection of Coxiella burnetii in ticks collected from cattle in several provinces of the Republic of Guinea. Epidemiology and infectious diseases. 2019;24(5-6): 234–9. EDN: https://elibrary.ru/twsemw
Дополнительные файлы