Исследование устойчивости вируса иммунодефицита человека типа I к антиретровирусным препаратам у наивных пациентов в Армении в 2017–2021 годах
- Авторы: Осадчая О.А.1, Киреев Д.Е.1, Салеева Д.В.1, Кириченко А.А.1, Лаповок И.А.1, Лопатухин А.Э.1, Шлыкова А.В.1, Махмудова Л.Ф.1, Ладная Н.Н.1, Овакимян Э.М.2, Мартоян С.В.2, Казарян О.К.2, Овсепян Т.В.2, Саргсянц Н.К.2, Покровский В.В.1
-
Учреждения:
- Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
- Национальный центр инфекционных болезней
- Выпуск: Том 101, № 2 (2024)
- Страницы: 184-192
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18581
- DOI: https://doi.org/10.36233/0372-9311-398
- EDN: https://elibrary.ru/mnxbqo
- ID: 18581
Цитировать
Аннотация
Введение. Увеличение охвата пациентов, принимающих антиретровирусную терапию (АРВТ), и ограничения в проведении тестов на лекарственную устойчивость (ЛУ) определяют важность эпидемиологического надзора за резистентностью ВИЧ-1 в Республике Армения.
Цель исследования — определение распространённости ЛУ ВИЧ-1 на обширной выборке ВИЧ-инфицированных граждан Республики Армения, не имевших опыта приёма антиретровирусных препаратов (АРВП).
Материалы и методы. Исследование было выполнено на выборке, составляющей более 20% людей, живущих с ВИЧ, в Республике Армения. Полученные 982 нуклеотидные последовательности фрагмента гена pol ВИЧ-1, кодирующих область протеазы и обратной транскриптазы, а также 367 последовательностей гена интегразы были проанализированы с помощью базы данных Стенфордского университета и инструмента СPR на наличие мутаций резистентности и определение уровня ЛУ к АРВП. Субтип ВИЧ-1 в исследованных образцах был определён с помощью базы данных Стэнфордского университета и подтверждён филогенетическим анализом.
Результаты. Общая распространённость ЛУ к АРВП у наивных пациентов составила 13,8%. Резистентность к ненуклеозидным ингибиторам обратной транскриптазы составила 11,2%, к нуклеозидным ингибиторам обратной транскриптазы — 1,4%, к ингибиторам протеазы — 2,0%, к ингибиторам интегразы — 0,5%. Преобладающим генетическим вариантом среди вирусов, содержащих мутации резистентности, был субтип В. Резистентность наиболее часто регистрировалась у мужчин, имеющих секс с мужчинами, проживающих в Ереване.
Заключение. В нашем исследовании высокий уровень ЛУ оказался высоким только к ненуклеозидным ингибиторам обратной транскриптазы. Результаты показывают, что рекомендуемые в современных национальных руководствах АРВП 1-й линии терапии с высокой долей вероятности будут эффективными. Проведённый анализ был осуществлён на значимой доле ВИЧ-инфицированных граждан Республики Армения, что повышает достоверность и точность полученных данных.
Полный текст
Введение
Республика Армения — страна Восточной Европы и Центральной Азии (ВЕЦА), активно участвующая в борьбе с ВИЧ/СПИДом на протяжении последних десятилетий. По данным глобальной статистики Организации Объединенных Наций по борьбе с ВИЧ/СПИД (ЮНЭЙДС)1, в странах ВЕЦА на 2021 г. насчитывалось 1,8 млн людей, живущих с ВИЧ, и число новых случаев инфицирования продолжает увеличиваться.
После распада Советского Союза период экономического коллапса серьёзно ослабил инфраструктуру здравоохранения новых независимых республик. В тот период эпидемии ВИЧ-1 уделялось мало внимания. В значительной части бывшего Советского Союза наблюдалась одна из самых быстрорастущих эпидемий ВИЧ-1 в мире, в некоторых регионах количество инфицированных лиц ежегодно удваивалось [1]. Политика открытых границ в регионах не препятствовала миграции, которая в свою очередь способствовала распространению инфекционных заболеваний2. Результаты исследований показывают, что среди граждан Армении самая высокая распространённость ВИЧ-1 была зафиксирована среди трудовых мигрантов [2, 3].
Одной из основных причин роста случаев инфицирования ВИЧ-1 в Армении являлся низкий уровень доступа к антиретровирусной терапии (АРВТ). Комбинированная АРВТ стала широко распространяться в мире с 1996 г. Однако в странах с низким и средним уровнем дохода внедрение АРВТ произошло только в середине 2000-х гг. [4]. Благодаря усилиям Всемирной организации здравоохранения (ВОЗ) в начале ХХ в. снизилось неравенство между богатыми и бедными странами в отношении возможности лечения. Развивающиеся страны получили возможность приобретать препараты по доступным ценам, что в свою очередь снизило смертность. В этот период было издано первое руководство по лечению ВИЧ-1 в условиях ограниченных ресурсов, которое содержало упрощённые схемы лечения [5].
В настоящее время поражённость населения в Армении ВИЧ-инфекцией невысока. Общее число случаев заражения не превышает 4600 человек, что составляет всего 0,12% населения страны3. Как и в других странах, программы в Армении нацелены на достижение целей ЮНЭЙДС. По итогам стратегии «90–90–90» в регионе был достигнут хороший результат — в 2020 г. 81% людей, живущих с ВИЧ, знали свой статус, и 86% людей, кому была назначена АРВТ, достигли неопределяемой вирусной нагрузки4. С 2018 г. предпочтительная схема лечения включает ингибитор интегразы (ИИ) долутегравир в комбинации с двумя нуклеозидными ингибиторами обратной транскриптазы (НИОТ) — тенофовиром, ламивудином или эмтрицитабином. Альтернативная схема представляет собой два препарата НИОТ (тенофовир и ламивудин) и один препарат группы ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) — эфавиренз5.
В связи с увеличением количества пациентов, принимающих АРВТ, значимой проблемой в борьбе с эпидемией ВИЧ-инфекции является развитие резистентности вируса. ВОЗ рекомендует проводить тестирование на устойчивость к препаратам до лечения и при неэффективности АРВТ. К сожалению, такой подход доступен не всем странам. В большинстве развивающихся стран тестированию подвергаются только определённые группы пациентов и только в случае вирусологического неуспеха АРВТ6.
Тесты на резистентность ВИЧ также рекомендуется проводить с целью эпидемиологического надзора за лекарственной устойчивостью (ЛУ) [6]. Согласно отчётам ВОЗ, распространённость передаваемой ЛУ за 2017 и 2020 гг. в большинстве стран превысила порог 5%, причём у 67% стран этот показатель превысил 10%. Наличие ЛУ ВИЧ-1 у наивных пациентов уменьшает выбор эффективной АРВТ и может увеличить риск вирусологической неудачи лечения [7].
В ранее опубликованных работах исследовалась распространённость ЛУ ВИЧ-1 в Армении у нелеченных пациентов и сообщалось о значительном росте резистентности. Если в 2015 г. уровень устойчивости составлял всего 1,5%, то в исследованиях 2020 и 2021 гг. распространённость ЛУ увеличилась до 5,5 и 9,2% соответственно и приблизилась к 10% порогу ВОЗ, по достижении которого необходимо пересматривать клинические рекомендации по лечению [8–10]. Однако в публикации 2022 г. указывалось на снижение в 2020–2021 гг. уровня ЛУ у наивных пациентов до 7,5% [11]. Проведённые ранее исследования ЛУ ВИЧ-1 характеризовались небольшими размерами выборок, в связи с чем имели ограниченную достоверность результатов.
Цель исследования — оценка распространённости и структуры ЛУ ВИЧ-1 в Республике Армения путём анализа обширной когорты пациентов, не имевших опыта приёма антиретровирусных препаратов (АРВП).
Материалы и методы
Сбор биологического материала и сопутствующей информации о пациентах проходил в 2018–2022 гг. Всего в исследовании приняло участие 982 пациента, ранее не получавших АРВТ. Пациенты включались последовательно во время визитов в Республиканский центр по профилактике СПИДа Министерства здравоохранения Республики Армения. Собираемые демографические и клинические данные содержали возраст, пол, дату первого положительного иммунного блота, предполагаемый путь передачи ВИЧ-1, вирусную нагрузку РНК ВИЧ-1 и количество CD4+-клеток. Исследование проводилось при добровольном информированном согласии пациентов. Исследование было одобрено локальным этическим комитетом ЦНИИ Эпидемиологии Роспотребнадзора (протокол № 92 от 21.05.2019).
Образцы исследовали методом массового параллельного секвенирования с помощью лабораторной методики, разработанной в ЦНИИ Эпидемиологии (n = 367), либо классического секвенирования по Сэнгеру с использованием набора реагентов «АмплиСенс HIV-Resist-Seq» (ЦНИИ Эпидемиологии) (n = 615). При массовом параллельном секвенировании анализу подвергались три вирусных гена: протеаза, обратная транскриптаза и интегразы. При проведении секвенирования по Сэнгеру были получены нуклеотидные последовательности гена протеазы и фрагмента гена обратной транскриптазы, в которых могут появляться мутации резистентности. Секвенирование осуществляли с помощью приборов «MiSeq» («Illumina») и «Applied Biosystems 3500 Genetic Analyzer» («Life Technologies»).
Предварительное субтипирование ВИЧ-1 было выполнено с использованием онлайн-инструментов «REGA v. 3.0»7 и базы данных Стенфордского университета8. Результаты предварительного субтипирования были проверены методом филогенетического анализа с помощью программного обеспечения «MEGA v. 6.0» c референтными последовательностями субтипов ВИЧ-1 и рекомбинантных форм, загруженных из базы данных «Los-Alamos»9. Выравнивание нуклеотидных последовательностей и дальнейшее редактирование проводили с помощью «BioEdit v. 7.2»10.
Качество нуклеотидных последовательностей оценивали с использованием инструментов «WHO HIV DR v. 2.30»11 и «Calibrated Population Resistance Tool»12.
ЛУ к АРВП идентифицировали с использованием базы данных Стенфордского университета. Мутации резистентности из перечня надзорных мутаций были определены с помощью списка ВОЗ «Surveillance Drug Resistance Mutation Worksheet» (2014 г.).
РЕЗУЛЬТАТЫ
Характеристика исследуемой группы
Средний возраст участников на момент включения в исследование составил 41 (19–75) год, наибольшее количество людей с ВИЧ-инфекцией было в возрасте 30–40 лет; 68,9% пациентов были мужского пола. В исследуемой группе в качестве наиболее вероятного пути передачи инфекции преобладал гетеросексуальный (83,2%).
Результаты субтипирования показали высокую степень генетического разнообразия среди вариантов, циркулирующих в исследуемом регионе. Преобладающим являлся ВИЧ-1 суб-субтипа А6 с долей 87,0%, следующим по частоте встречаемости был субтип В (5,9%). В единичных случаях выявлялись также вирусы субтипов А1, С и G. Кроме того, были обнаружены 6 различных рекомбинантных форм: CRF02_AG, CRF03_A6B, CRF06_cpx, CRF20_BG, CRF24_BG и CRF63_02A6, которые часто встречаются в странах ВЕЦА.
Эпидемиологические данные участников исследования представлены в табл. 1. Для каждой эпидемиологической группы был посчитан 95% доверительный интервал (ДИ).
Таблица 1. Эпидемиологические характеристики пациентов, включённых в исследование, n (%; 95% ДИ)
Table 1. Epidemiological characteristics of patients included in the study, n (%; 95% CI)
Характеристики | Characteristics | Мужчины | Men | Женщины | Women | Всего | All |
Количество пациентов | Number of patients | 677 (68,9; 66,0–71,8) | 305 (31,1; 28,2–34,0) | 982 |
Группа риска передачи инфекции | Transmission risk group of infection | |||
Гетеросексуальный контакт | Heterosexual | 514 (52,3; 49,2–55,5) | 303 (30,9; 28,0–33,8) | 817 (83,2; 80,7–85,4) |
Мужчины, имеющие половые контакты с мужчинами Men who have sex with men | 98 (10,0; 8,3–12,0) | – | 98 (10,0; 8,3–12,0) |
Потребители инъекционных наркотиков Injecting drug users | 65 (6,6; 5,2–8,4) | 2 (0,2; < 0,01–0,8) | 67 (6,8; 5,4–8,6) |
Генетические варианты ВИЧ-1 | HIV-1 genetic variants | |||
A1 | 1 (0,1; < 0,01–0,6) | 0 | 1 (0,1; < 0,01–0,6) |
A6 | 567 (57,7; 54,6–60,8) | 287 (29,2;26,5–32,2) | 854 (87,0; 84,7–88,9) |
B | 56 (5,7; 4,4–7,3) | 2 (0,2; < 0,01–0,8) | 58 (5,9; 4,6–7,6) |
C | 1 (0,1; < 0,01–0,6) | 1 (0,1; < 0,01–0,6) | 2 (0,2; < 0,01–0,8) |
G | 1 (0,1; < 0,01–0,6) | 0 | 1 (0,1; < 0,01–0,6) |
CRF02_AG | 16 (1,6; 1,0–2,7) | 6 (0,6; 0,3–1,4) | 22 (2,2; 1,5–3,4) |
CRF03_A6B | 5 (0,5; 0,2–1,2) | 2 (0,2; < 0,01–0,8) | 7 (0,7; 0,3–1,5) |
CRF06_cpx | 2 (0,2; < 0,01–0,8) | 1 (0,1; < 0,01–0,6) | 3 (0,3; 0,1–0,9) |
CRF20_BG | 1 (0,1; < 0,01–0,6) | 0 | 1 (0,1; < 0,01–0,6) |
CRF24_BG | 7 (0,7; 0,3–1,5) | 0 | 7 (0,7; 0,3–1,5) |
CRF63_02A6 | 20 (2,0; 1,3–3,1) | 6 (0,6; 0,3–1,4) | 26 (2,7; 1,8–3,9) |
Оценка распространённости ЛУ к АРВП и мутаций резистентности
Проведён анализ 982 нуклеотидных последовательностей для определения ЛУ ВИЧ-1 к АРВП классов НИОТ, ННИОТ и ингибиторов протеазы (ИП) и 367 нуклеотидных последовательностей для определения ЛУ ВИЧ-1 к препаратам класса ИИ.
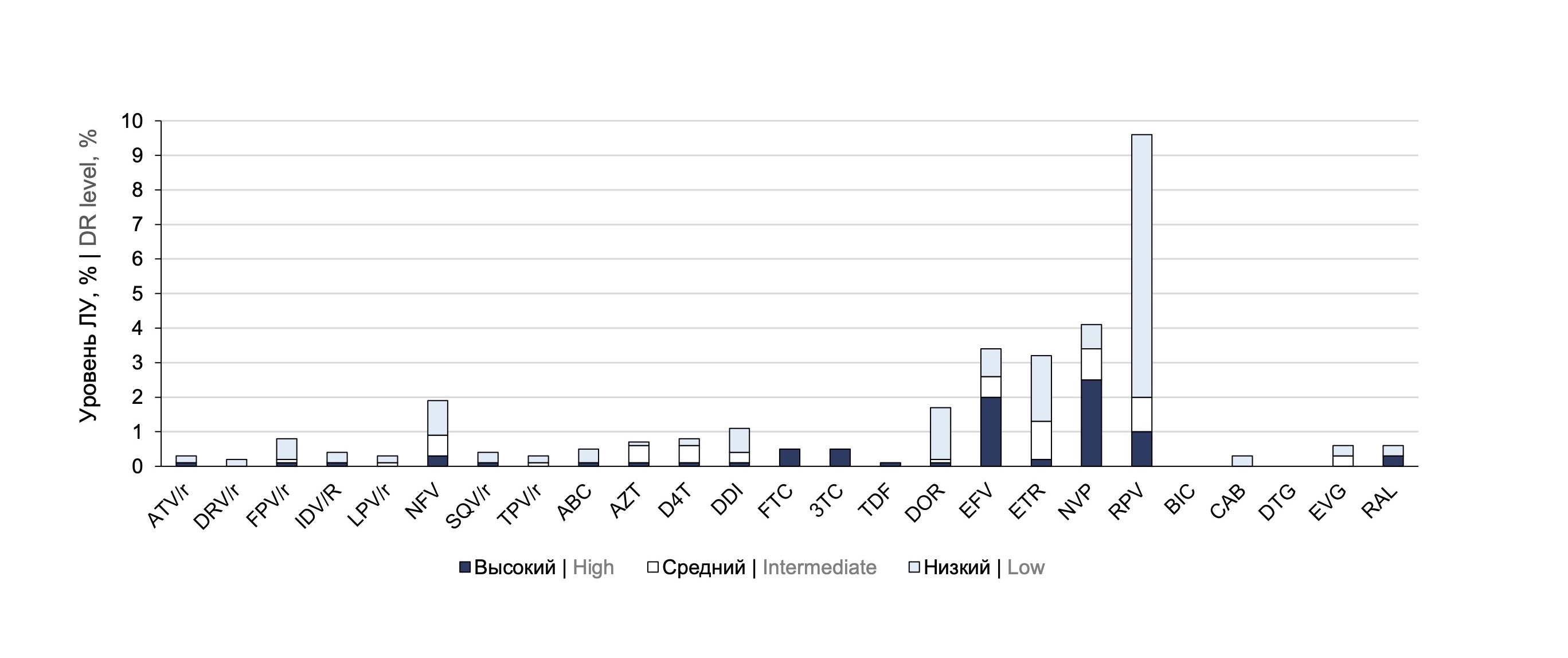
Общая распространённость ЛУ ВИЧ к препаратам всех классов составила 13,8% (95% ДИ 11,8–16,2%). К отдельным классам АРВП ЛУ встречалась с частотой: к ИП — 2,0% (95% ДИ 1,3–3,1%); к НИОТ — 1,4% (95% ДИ 0,8–2,4%); к ННИОТ — 11,2% (95% ДИ 9,4–13,3%); к ИИ — 0,5% (95% ДИ 0,02–2,1%). Подробная информация о распространённости ЛУ к каждому препарату в отдельности представлена на рис. 1.
Рис. 1. Частота возникновения и уровень резистентности к АРВП.
Fig. 1. Frequency of occurrence and level of resistance to antiretroviral drugs.
ЛУ ВИЧ наиболее часто регистрировалась к препарату рилпивирин класса ННИОТ (9,7% случаев), правда, в 7,6% случаев это была резистентность низкого уровня. К другим препаратам этого класса — невирапину и эфавирензу — ЛУ была выявлена в 4,2 и 3,5% случаях соответственно, причём в основном это была резистентность высокого уровня. Резистентность к каждому в отдельности АРВП классов НИОТ, ИП и ИИ не превышала 2%.
Надзорные мутации резистентности, выявленные более чем у 1 пациента, представлены в табл. 2.
Таблица 2. Надзорные мутации ЛУ ВИЧ-1, выявленные более чем у 1 пациента
Table 2. Surveillance HIV-1 drug resistance mutations HIV-1 identified more than in one patient
Надзорные мутации ЛУ Surveillance DR mutations | Количество пациентов Patients count | Распространённость мутаций, % (95% ДИ) Prevalence mutations, % (95% CI) |
Мутации ННИОТ | Mutations NNRTI | ||
K101E | 13 | 1,3 (0,8–2,3) |
K103N | 12 | 1,2 (0,7–2,2) |
Y181C | 7 | 0,7 (0,3–1,5) |
G190A | 8 | 0,8 (0,4–1,6) |
Мутации НИОТ | Mutations NRTI | ||
T69D | 3 | 0,3 (0,06–0,9) |
M184V | 4 | 0,4 (0,1–1,1) |
L210W | 5 | 0,5 (0,2–1,2) |
T215D | 4 | 0,4 (0,1–1,1) |
Мутации ИП | Mutations PI | ||
D30N | 2 | 0,2 (< 0,001–0,8) |
M46I | 6 | 0,6 (0,2–1,4) |
К АРВП класса ИИ надзорные мутации ЛУ были выявлены только в 2 случаях — у 1 пациента — E92G и у второго — Y143H.
Общая распространённость надзорных мутаций ЛУ ВИЧ-1 к АРВП класса ИП составила 1,4% (95% ДИ 0,8–2,4%), класса НИОТ — 1,5% (95% ДИ 0,9–2,5%), класса ННИОТ — 3,1% (95% ДИ 2,1–4,3%), класса ИИ — 0,6% (95% ДИ 0,02–2,10%).
Зависимость распространённости резистентности от анализируемых показателей исследуемой выборки
В работе была изучена динамика распространённости ЛУ к АРВП различных классов в зависимости от года первого положительного иммунного блота. Для получения сопоставимых по размеру когорт были сформированы группы пациентов с выявленной ВИЧ-инфекцией: до 2017 г. включительно (n = 146), в 2018 г. (n = 241), 2019 г. (n = 332), 2020 г. (n = 81) и 2020 г. (n = 182). Результаты анализа представлены на рис. 2. Динамика общей распространённости ЛУ ВИЧ-1 к АРВП в значительной степени была обусловлена ЛУ к АРВП класса ННИОТ. За исследуемый период отмечена незначительная тенденция к росту ЛУ в стране. С 2020 г. значительная часть больных стала получать в схеме терапии 1-го ряда АРВП из группы ИИ — долутегравир, и этот показатель к концу 2021 г. возрос с 30 до 80% [8, 11]. Вероятно, с этим связано появление единичных случаев резистентности вируса к АРВП этого класса в 2019–2020 гг.
Рис. 2. Динамика распространённости ЛУ ВИЧ-1 к АРВП в зависимости от года первого положительного иммунного блота.
Fig. 2. The dynamics of HIV-1 drug resistance by the year of the first positive immune blot.
Нами проанализирована ассоциация между распространённостью ЛУ ВИЧ-1 к АРВП и генетическими вариантами вируса. Среди вариантов, встречающихся более чем в 1% случаев, наиболее часто резистентными являлись вирусы субтипа В — в 36,2% случаев (21 из 58). Выше среднего уровня они также регистрировались у пациентов, инфицированных CRF63_02A6, — у 15,4% (4 из 26). Ниже среднего они встречались у пациентов с суб-субтипом А6 — у 11,5% (98 из 854) и CRF02_AG — у 9,1% (3 из 22).
Распространённость ЛУ ВИЧ-1 к АРВП у мужчин регистрировалась почти в 1,5 раза чаще, чем у женщин, — 15,4% по сравнению с 10,5% (p = 0,041). Анализ распространённости резистентности в зависимости от предполагаемой группы риска показал, что наиболее часто резистентные варианты встречались среди мужчин, имеющих секс с мужчинами (27,6%; 27 из 98), затем среди потребителей инъекционных наркотиков (17,9%; 12 из 67). Реже всего ЛУ-вирусы обнаруживались среди пациентов, инфицированных в ходе гетеросексуального контакта (11,9%; 97 из 817).
На заключительном этапе была проанализирована распространённость ЛУ ВИЧ-1 к АРВП в различных регионах Армении. Все они были поделены на три группы: г. Ереван; области, прилегающие к Еревану; области, удалённые от Еревана.
В ряде областей, таких как Сюникская и Тавушская, распространённость ЛУ ВИЧ-1 была наивысшей (табл. 3). Однако в среднем частота встречаемости в близлежащих и удалённых областях была ниже, чем в столице, — 12,7 и 12,6% соответственно.
Таблица 3. Распространённость ЛУ ВИЧ-1 в регионах Армении
Table 3. Prevalence of HIV-1 DR in the regions of Armenia
Регион Region | Количество пациентов Patients count | Количество пациентов с ЛУ Patients with drug resistance count | Распространённость, % Prevalence, % |
Ереван | Yerevan | 278 | 47 | 16,9 |
Близлежащие области | Nearby regions | |||
Арагацотнская | Aragatsonion | 34 | 4 | 11,8 |
Армавирская | Armavir | 79 | 12 | 15,2 |
Араратская | Ararat | 94 | 11 | 11,7 |
Котайская | Kotay | 77 | 9 | 11,7 |
Удалённые области | Remote regions | |||
Вайодзорская | Vayodzor | 18 | 1 | 5,6 |
Гехаркуникская | Gegharkunik | 96 | 10 | 10,4 |
Лорийская | Lori | 91 | 11 | 12,1 |
Сюникская | Syunik | 68 | 12 | 17,6 |
Тавушская | Tavush | 30 | 6 | 20,0 |
Ширакская | Shirak | 117 | 13 | 11,1 |
Обсуждение
Выполненная работа представляет собой национальное эпидемиологическое исследование ЛУ ВИЧ-1 в Республике Армения с использованием обширной выборки наивных пациентов. Общая распространённость ЛУ к АРВП составила 13,8% и была несколько выше, чем описано в других исследованиях. Коллективы, ранее проводившие изучение резистентности ВИЧ у пациентов без опыта приёма АРВТ, показали распространённость 5,5–9,2% [9–11]. Однако необходимо учитывать, что в указанных исследованиях ЛУ оценивалась не ко всем АРВП. В частности, в соответствии с предыдущими исследованиями, устойчивость к АРВП группы ННИОТ варьировала от 4,4 до 6,0%, в нашем исследовании этот показатель повысился до 11,2% [9, 11]. Такое значимое различие было получено в связи с тем, что в нашем исследовании учитывалась ЛУ ВИЧ-1 к рилпивирину. Если же провести сравнение по отдельным препаратам, то в предыдущем исследовании [11] ЛУ к EFV и NVP составила 6 и 6,8%, а в текущем — 3,5 и 4,2% соответственно.
АРВП группы ННИОТ обладают низким генетическим барьером, и единичная точечная замена в обратной транскриптазе может приводить к развитию устойчивости высокого уровня и в дальнейшем к передаче устойчивых вариантов с изменениями в популяцию. Поэтому среди пациентов в данном классе продолжали сохраняться мутации, значительно снижающие чувствительность к невирапину и эфавирензу. Поскольку в регионе тесты на первичную резистентность в рутинном порядке не проводятся, и в связи с руководством ВОЗ от 2018 г., в схеме терапии 1-го ряда начали использовать комбинацию 2 НИОТ + 1 ИИ. Невирапин был исключён из перечня препаратов для лечения ВИЧ-1 в Армении, а эфавиренз рекомендовали для назначения в составе альтернативной схемы.
В то же время по отношению к классам НИОТ, ИП и ИИ была зафиксирована низкая распространённость ЛУ. Уровень ЛУ к НИОТ значительно снизился — с 5,0 до 1,4% [10, 11]. Наиболее часто у пациентов обнаруживались замены, обусловливающие ЛУ высокого уровня к ламивудину и эмтрицитабину.
В нашем исследовании впервые в Республике Армения была оценена эффективность применения ИИ у лиц, ранее не получавших АРВТ, и выявлены мутации резистентности, значительно снижающие чувствительность к ралтегравиру и частично к элвитегравиру.
Результаты показали, что комбинации препаратов, используемые в 1-й линии терапии, являются эффективными, и это подтверждают данные об увеличении неопределяемой вирусной нагрузки у лиц, получающих АРВТ, с 68% в 2016 г. до 86% в 2020 г.13 Однако нужно с осторожностью назначать или минимизировать схемы терапии, содержащие эфавиренз и невирапин, поскольку доля циркулирующих ЛУ-вариантов вируса к каждому из препаратов достаточно высока и составляет приблизительно 4%14.
Общая распространённость мутаций, важных с точки зрения надзора, не превышала 5% ни для одного из классов АРВП в отдельности и была наивысшей для класса ННИОТ (3,1%).
В нашем исследовании были проанализированы ассоциации между наличием ЛУ и различными характеристиками вируса и пациента. Обнаружено, что вероятность резистентности была намного выше в случае инфекции, вызванной вирусом субтипа В. ЛУ-варианты чаще регистрировались у пациентов мужского пола; из группы риска мужчин, имеющих половые контакты с мужчинами; проживающих в г. Ереване.
Распространённость вариантов ВИЧ-1 с резистентностью высокого уровня повышает риск передачи первичной ЛУ. Поэтому оценка показателей широты распространения передаваемой ЛУ является объективной необходимостью не только для успешного назначения терапии, но и для минимизации риска передачи ЛУ-вариантов вируса.
Заключение
В нашем исследовании уровень ЛУ ВИЧ-1 к АРВП у пациентов без опыта приёма терапии составил 13,8%. Однако в основном он был обусловлен резистентностью к АРВП класса ННИОТ. Данные результаты показывают, что рекомендуемые в настоящее время АРВП классов НИОТ, ИП, ИИ с высокой долей вероятности будут эффективными, а резистентность вируса будет иметь слабое негативное влияние на достижение Арменией целей стратегии ЮНЭЙДС «95–95–95». Исследование было осуществлено на выборке 982 ВИЧ-инфицированных пациентов и позволило определить ЛУ ВИЧ-1 у более чем 20% граждан страны с диагнозом «ВИЧ-инфекция».
1 ЮНЭЙДС. Информационный бюллетень — последние глобальные и статистические данные о состоянии эпидемии СПИДа 2022 г.
URL: https://www.unaids.org/ru/resources/fact-sheet
2 ЮНЭЙДС. Информационный бюллетень — глобальная статистика по ВИЧ и СПИДу 2019 г.
URL: https://www.unaids.org/ru/resources/fact-sheet
3 Joint United Nations Programme on HIV/AIDS 2021.
URL: https://www.unaids.org/sites/default/files/media_asset/JC3032_AIDS_Data_book_2021_En.pdf
4 UNAIDS DATA, 2021. URL: https://www.unaids.org/en/resources/documents/2021/2021_unaids_data
5 Мониторинг закупок препаратов для лечения ВИЧ-инфекции и ВГС; выработка решений по оптимизации ситуации с целью способствования бесперебойному доступу к препаратам в Республике Армения, 2020.
URL: https://itpc-eeca.org/wp-content/uploads/2020/11/armenia_monitoring_final_05.11.2020.pdf
6 World Health Organization. Global action plan on HIV drug resistance 2017–2021: 2018 progress report, July 2018: executive summary. URL: https://apps.who.int/iris/handle/10665/273049
7 Stanford University. REGA HIV-1 Subtyping Tool — Version 3.0. URL: http://dbpartners.stanford.edu:8080/RegaSubtyping/stanford-hiv/typingtool/
8 Stanford University. HIV Drug Resistance Database.
URL: https://hivdb.stanford.edu/
9 HIV databases. URL: https://www.hiv.lanl.gov/content/index
10 BioEdit 7.7. URL: https://bioedit.software.informer.com
11 WHO HIVDR QC Tool.
URL: https://sequenceqc.bccfe.ca/who_qc
12 Calibrated Population Resistance Tool.
URL: https://hivdb.stanford.edu/cpr
13 European Centre for Disease Prevention and Control Continuum of HIV care. Monitoring Implementation of the Dublin Declaration on Partnership to Fight HIV/AIDS in Europe and Central Asia: 2018 Progress Report. Stockholm: ECDC. 2018. URL: https://www.ecdc.europa.eu/en/publications-data/continuum-hiv-care-monitoring-implementation-dublin-declaration-2018-progress (дата обращения: 05.08.2022); European Centre for Disease Prevention and Control Continuum of HIV Care. Monitoring Implementation of the Dublin Declaration on Partnership to Fight HIV/AIDS in Europe and Central Asia: 2020 Progress Report. Stockholm: ECDC. 2021. URL: https://www.ecdc.europa.eu/en/publications-data/hiv-continuum-care-monitoring-implementation-dublin-declaration (дата обращения: 05.08.2022).
14 International Treatment Preparedness Coalition Monitoring the Procurement of Drugs for the Treatment of HIV Infection and HCV. Development of Solutions to Optimize the Situation in Order to Promote Uninterrupted Access to Drugs in the Republic of Armenia, 2018–2019. URL: https://itpc-eeca.org/wp-content/uploads/2019/11/Monitoring-zakupok-preparatov-Armeniya_2018-2019.pdf (дата обращения: 05.08.2022); .
Об авторах
Ольга Алексеевна Осадчая
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0003-1543-5579
м.н.с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваДмитрий Евгеньевич Киреев
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-7896-2379
к.б.н., н.с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваДарья Владиславовна Салеева
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-5870-5594
н.с., лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваАлина Алексеевна Кириченко
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-7116-0138
н.с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваИлья Андреевич Лаповок
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-6328-1415
к.б.н., с.н.с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваАлексей Эдуардович Лопатухин
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-2826-699X
н.с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваАнастасия Вениаминовна Шлыкова
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-1390-8021
н.с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваЛейла Фазировна Махмудова
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0009-0002-8168-9497
лаборант-исследователь лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваНаталья Николаевна Ладная
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0003-2994-151X
к.б.н., с.н.с. Федерального научно-методического центра по профилактике и борьбе со СПИДом
Россия, МоскваЭрмис Мисаковна Овакимян
Национальный центр инфекционных болезней
Email: osadchaya96@yandex.ru
зав. клиническим отделением
Армения, ЕреванСирануш Вачиковна Мартоян
Национальный центр инфекционных болезней
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-2067-9503
врач-эпидемиолог
Армения, ЕреванОвсеп Карапетович Казарян
Национальный центр инфекционных болезней
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0001-5612-8933
к.б.н., н.с.
Армения, ЕреванТамара Врежовна Овсепян
Национальный центр инфекционных болезней
Автор, ответственный за переписку.
Email: osadchaya96@yandex.ru
зав. лабораторией
Армения, ЕреванНарина Константиновна Саргсянц
Национальный центр инфекционных болезней
Email: osadchaya96@yandex.ru
к.м.н., зам. директора
Армения, ЕреванВадим Валентинович Покровский
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: osadchaya96@yandex.ru
ORCID iD: 0000-0002-9514-7288
д.м.н., профессор, академик РАН, зав. Специализированного научно-исследовательского отдела по профилактике и борьбе со СПИДом
Россия, МоскваСписок литературы
- Saadat V.M. HIV risks, testing, and treatment in the former Soviet Union: challenges and future directions in research and methodology. Cent. Asian J. Glob. Health. 2015;4(2):225. doi: https://doi.org/10.5195/cajgh.2015.225
- Kelly S.L., Shattock A.J., Kerr C.C., et al. Optimizing HIV/AIDS resources in Armenia increasing ART investment and examining HIV programmes for seasonal migrant labourers. J. Int. AIDS Soc. 2016;19(1):20772. doi: https://doi.org/10.7448/ias.19.1.20772
- National Center for AIDS Prevention. Biological and Behavioral Surveillance Survey on Armenia, Male, Seasonal Labor Migrants in Urban Communities in Armenia; 2018.
- Mallitt K.A., Grigoryan S.R., Papoyan A.S., et al. Access to antiretroviral therapy and survival in Eastern Europe and Central Asia: a case study in Armenia. J. Int. AIDS Soc. 2014;17(1):18795. DOI: https://doi.org/10.7448/ias.17.1.18795
- Vella S., Schwartländer B., Sow S.P., et al. The history of antiretroviral therapy and of its implementation in resource-limited areas of the world. AIDS. 2012;26(10):1231–41. doi: https://doi.org/10.1097/qad.0b013e32835521a3
- Seble G.K., Geoffrey B., Jagadish C.S., et al. HIV-1 transmitted drug resistance surveillance shifting trends in study and prevalence estimates. J. Int. AIDS Soc. 2020;23(9):e25611. DOI: https://doi.org/10.1002/jia2.25611
- WHO. HIV Drug Resistance Report 2017. Geneva; 2017.
- Laga V., Vasilyev A., Lapovok I., et al. HIV type 1 subtype A1 dominates in Armenia. Curr. HIV Res. 2015;13(3):219–25. DOI: https://doi.org/10.2174/1570162x13666150407142834
- Осадчая О.А., Ерошкин П.В., Кириченко А.А. и др. Изучение передачи лекарственной устойчивости ВИЧ-1 в Республике Армения с помощью биоинформатических методов. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2021;11(4):53–60. Osadchaya O.A., Eroshkin P.V., Kirichenko A.A., et al. Studying the transmission of HIV-1 drug resistance in the Republic of Armenia using bioinformatics methods. Epidemiology and Infectious Diseases. Current Items. 2021;11(4):53–60. doi: https://doi.org/10.18565/epidem.2021.11.4.53-60 EDN: https://elibrary.ru/zylroa
- Kirichenko A., Kireev D., Lopatukhin A., et al. Prevalence of HIV-1 drug resistance in Eastern European and Central Asian countries. PLoS One. 2022;17(1):e0257731. doi: https://doi.org/10.1371/journal.pone.0257731
- Kirichenko A., Kireev D., Lapovok I., et al. Prevalence of pretreatment HIV-1 drug resistance in Armenia in 2017–2018 and 2020–2021 following a WHO survey. Viruses. 2022;14(11):2320. DOI: https://doi.org/10.3390/v14112320
Дополнительные файлы