Сравнительная оценка эффективности воздействия дезинфицирующих веществ на микроорганизмы в биоплёнке
- Авторы: Федорова Л.С.1, Ильякова А.В.1
-
Учреждения:
- Научно-исследовательский институт системной биологии и медицины
- Выпуск: Том 100, № 5 (2023)
- Страницы: 302-309
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18476
- DOI: https://doi.org/10.36233/0372-9311-422
- EDN: https://elibrary.ru/uhrcap
- ID: 18476
Цитировать
Аннотация
Введение. Бактерии в биоплёнке (БП) обладают повышенной устойчивостью к антибактериальным агентам, в том числе дезинфицирующим веществам (ДВ), однако степень эффекта варьирует в зависимости от приложенного воздействия. В связи с этим оценка эффективности основных ДВ в отношении микроорганизмов в БП представляет научный и практический интерес.
Целью исследования было изучение воздействия ДВ различных химических групп на грамположительные и грамотрицательные бактерии в составе БП.
Материалы и методы. Изучено действие ДВ: алкилдиметилбензиламмония хлорида (АДБАХ), третичного амина (ТА), полигексаметиленгуанидина хлорида (ПГМГ), перекиси водорода (ПВ), хлорамина (ХА), натриевой соли дихлоризоциануровой кислоты (Na-ДХЦК), гипохлорита натрия (ГХ), спирта этилового (ЭС), глутарового альдегида (ГА)) в отношении Pseudomonas aeruginosa ATCC 15442 и Staphylococcus aureus ATCC 6538-P в БП. БП культивировали в 96-луночных планшетах при 37оС в течение 24 ч, затем воздействовали на них растворами биоцидов. Эффективность воздействия ДВ оценивали на основании регистрации оставшихся жизнеспособных клеток и относительной плотности БП.
Результаты. Изученные штаммы бактерий образовывали умеренную БП, среднее количество жизнеспособных клеток в БП составило 6,51 ± 0,19 lg. Количество жизнеспособных клеток бактерий в составе БП снижалось на 4 lg и более под действием растворов ПВ в концентрации 6%, раствора Na-ДХЦК — 0,1% (по активному хлору), ГХ — 1% (по активному хлору), ХА — 1% (по препарату), ПГМГ — 0,05%, ТА — 1,0 %. При этом плотность БП снижалась на 70% и более. Растворы АДБАХ в концентрациях 0,1–1,0%, ТА — 0,05%, ПВ — 3%, раствор Na-ДХЦК — 0,05% (по активному хлору) обеспечивали снижение жизнеспособных клеток в БП на 2 lg. Эффективность воздействия хлорактивных соединений и ПВ повышалась при добавлении 0,5% сульфонола. Растворы ГА (0,25–1,00%) и ЭС (40–70%) были неэффективны в отношении микроорганизмов в БП.
Заключение. Для борьбы с микробными плёнками перспективны ДВ из группы окислителей (хлорактивные и кислородсодержащие), ТА и ПГМГ; применение АДБАХ как индивидуального соединения неэффективно; альдегиды и спирты для разрушения БП и уничтожения в ней микроорганизмов не пригодны.
Ключевые слова
Полный текст
Введение
Способность микроорганизмов к биоплёнкообразованию практически на любых поверхностях является большой проблемой в медицинской практике и других областях человеческой жизнедеятельности [1–3]. Биологическая плёнка (БП) образуется в результате адгезии бактерий к поверхностям объектов окружающей среды, что особенно выражено в условиях высокой влажности [3]. БП состоит из непрерывного мультислоя бактериальных клеток, прикреплённых к поверхности и/или друг к другу, заключённых во внеклеточный полимерный матрикс, состоящий в основном из полисахаридов, белков и нуклеиновых кислот [3, 4]. Матрикс обеспечивает структуру БП, стабильность и защиту микробных клеток внутри БП от обезвоживания и других неблагоприятных для них воздействий окружающей среды [4–7]. Микроорганизмы в БП составляют около 10% от сухой массы, матрикс — до 90% [8].
Исследования [9–12] показали, что бактерии в составе БП более устойчивы к воздействию дезинфицирующих веществ (ДВ), чем их планктонные формы. Это во многом обусловлено затруднением проникновения химических соединений (ДВ) через внеклеточный матрикс, а также снижением метаболизма и скорости деления бактерий в БП [5, 7]. В результате режимы дезинфекции объектов внутрибольничной среды, разработанные с использованием планктонных клеток, неэффективны в отношении микроорганизмов в составе БП, а официальные методы оценки эффективности ДВ в отношении микроорганизмов в составе БП отсутствуют.
Вместе с тем в многочисленных исследованиях продемонстрировано присутствие сухих микробных БП на многих поверхностях в медицинских учреждениях [13–15]. Патогенные микроорганизмы, включённые в БП, на сухих поверхностях могут выживать в течение длительного времени и периодически высвобождаться в виде свободноживущих планктонных клеток в окружающую среду. БП, будучи резервуаром патогенных микроорганизмов, функционируют как источник распространения патогенных бактерий во внутрибольничной среде [16]. Исследованиями [17–19] подтверждена важная роль микробных БП, обнаруживаемых на эпидемиологически значимых объектах в медицинских учреждениях, в распространении и передаче госпитальных штаммов микроорганизмов и возникновении инфекций, связанных с оказанием медицинской помощи.
В настоящее время отсутствуют комплексные системные исследования по изучению воздействия биоцидов на микроорганизмы в составе БП и способности существующих рецептур моющих и дезинфицирующих средств разрушать БП.
В связи с этим была поставлена цель — определить антимикробную активность и разрушающее действие основных ДВ дезинфицирующих средств — хлорактивных и кислородактивных соединений, катионных поверхностно-активных веществ (ПАВ), спиртов и альдегидов — в отношении тест-микроорганизмов Pseudomonas aeruginosa ATCC 15442 и Staphylococcus aureus ATCC 6538-P в составе БП.
Материалы и методы
Для дезинфекции поверхностей в помещениях медицинских учреждений рекомендуется использовать ДВ на основе катионных ПАВ, спирта, перекись водорода и средства на основе хлора. Для исследования отобраны химические соединения — наиболее типичные представители основных ДВ, используемых в качестве активного вещества в рецептурах дезинфицирующих средств:
- из группы катионных ПАВ — алкилдиметилбензиламмоний хлорид (АДБАХ) в концентрациях 0,1–1,0%, полигексаметиленгуанидин гидрохлорид (ПГМГ) — 0,02–0,05%, третичный алкиламин (ТА) — 0,1–1,0%;
- из группы кислородактивных — перекись водорода (ПВ) в концентрациях рабочего раствора 3–6%;
- из группы хлорактивных — средство дезинфицирующее Хлорамин (ХА) в концентрациях рабочего раствора 0,5–1,0% по препарату; натриевая соль дихлоризоциануровой кислоты (Na-ДХЦК) 0,03–0,10% по активному хлору (АХ), гипохлорит натрия (ГХ) — 0,5–1,0% по АХ;
- из группы спиртов — этиловый спирт (ЭС) — 40–70%;
- из группы альдегидов — глутаровый альдегид (ГА) — 0,25–1,00%.
Средства на основе хлора и перекиси водорода при дезинфекции поверхностей наиболее часто используются с добавлением 0,5% моющего средства в целях придания дополнительно моющих свойств. В связи с этим изучена эффективность химических соединений Na-ДХЦК, ГХ и ПВ с добавлением 0,5% сульфонола, который является анионным ПАВ.
В качестве тест-микроорганизмов использованы референс-штаммы из коллекции американских типовых культур (АТСС) — P. aeruginosa ATCC 15442 и S. aureus ATCC 6538-P. Данные референс-штаммы используются для оценки бактерицидной активности в отношении грамотрицательных и грамположительных бактерий в соответствии с Р 4.2.3676-20 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности» [20].
Культивирование БП бактерий осуществляли статическим методом в 96-луночных плоскодонных полистироловых планшетах для микротитрования согласно G.A. O'Toole и соавт. [21]. Суточные культуры штаммов бактерий стандартизировали до 2,0 по McFarland и разводили 1 : 100 в триптон-соевом бульоне. В лунки 96-луночного плоскодонного планшета вносили по 100 мкл бульонных культур бактерий и закрытые планшеты выдерживали статически в термостате при 37ºС в течение 24 ч для формирования БП. После этого лунки планшетов трехкратно промывали фосфатно-буферной средой с целью удаления планктонных клеток. Затем в опытную часть лунок вносили 100 мкл ДВ в различных концентрациях, в контрольные лунки — физиологический раствор (0,9% NaCl), далее выдерживали 30 мин, после чего добавляли 100 мкл нейтрализатора, содержащего Твин 80 (3%), сапонин (0,3–3,0%), гистидин (0,1%), цистеин (0,1%), тиосульфат натрия (0,1%).
Эффективность воздействия на сформированные БП ДВ оценивали путём определения относительной оптической плотности красителя — кристаллического фиолетового, который связывался с матриксом БП. Для этого в лунки вносили 200 мкл 0,1% водного раствора кристаллического фиолетового и выдерживали 30 мин. Биомассу БП оценивали по уровню экстракции этанолом красителя, который измеряли на микропланшетном ридере «ТЕCAN DESKTOP-4A7U9AL\Infinite M Plex» при длине волны 580 нм в единицах оптической плотности (OD).
Для оценки жизнеспособности клеток в БП в лунки вносили 100 мкл фосфатно-буферной среды и обрабатывали ультразвуком в течение 1 мин при 37 кГц, поместив планшеты в ультразвуковую ванну «Elma Ultrasonic 30S» («Elma»). Жизнеспособность клеток оценивали по числу колониеобразующих единиц (КОЕ) после высева на плотную питательную среду (триптон-соевый агар) и подсчетом КОЕ/мл после инкубации при 37ºС 24 ч.
Для достоверного обсчёта результатов использовали 6 лунок на 1 опытный образец и рассчитывали среднюю величину оптической плотности опытного образца и логарифмическое число КОЕ. Далее сравнивали усреднённые показатели оптической плотности элюата из БП и КОЕ/мл, обработанных ДВ, с аналогичными в контроле. Сравнения проводили по t-критерию Стьюдента [22]. Данные обрабатывали с использованием пакета статистических программ «MS Excel для Windows». Значение p < 0,05 принимали статистически значимым.
ДВ считали эффективным в отношении тест-микроорганизмов в БП, если количество жизнеспособных клеток в составе БП после воздействия ДВ снизилось на 4 порядка и более. Если показатель оптической плотности после экспозиции снизился более чем на 70% по сравнению с контролем, считали, что ДВ обладает высокой эффективностью, снижение на 30–70% — средней, менее 30% — низкой.
Результаты
Исследуемые культуры микроорганизмов P. aeruginosa ATCC 15442 и S. aureus ATCC 6538-Р через 24 ч образовывали БП плотностью OD580 = 1,50 ± 0,19. Среднее количество жизнеспособных клеток в БП составило 6,2 ± 0,7 lg.
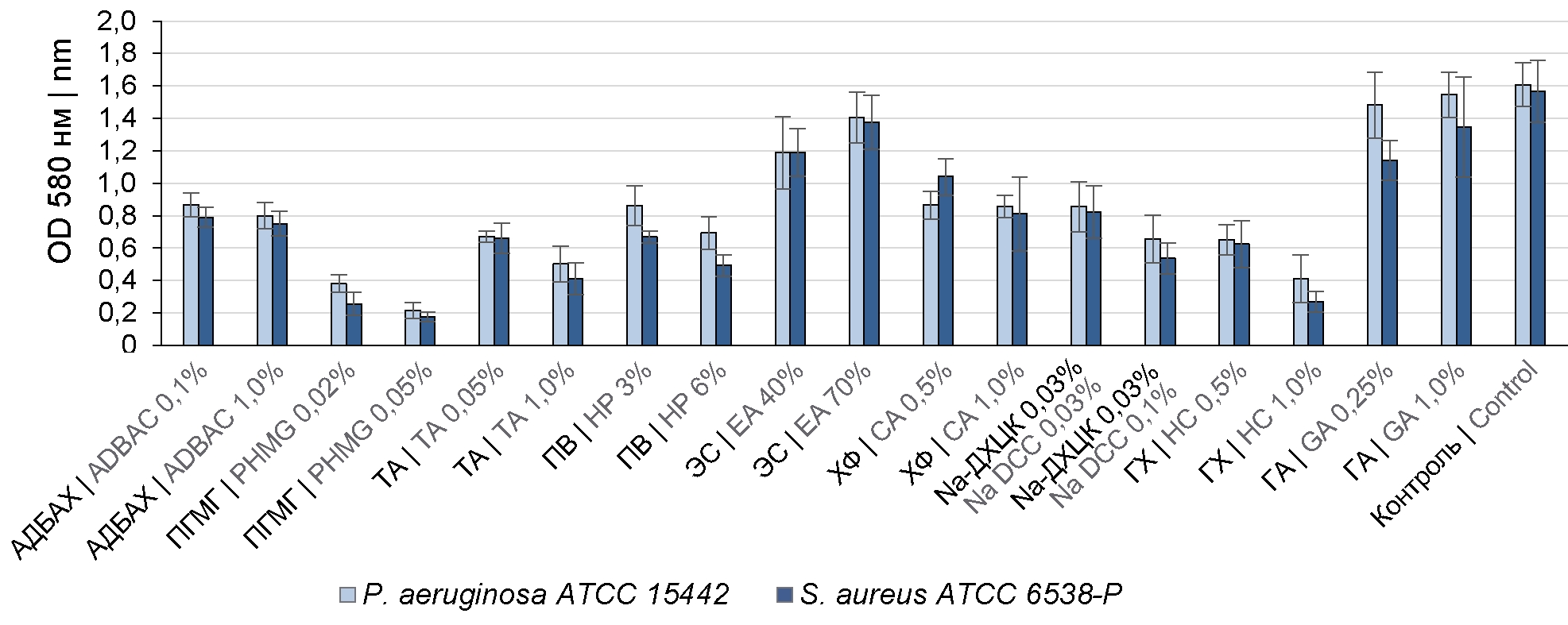
Воздействие на сформированные БП 0,1% и 1,0% растворов АДБАХ приводило к снижению плотности БП по сравнению с контролем (первичной БП) на 48,6 ± 9,5 и 51,2 ± 8,1% (рис. 1) и снижению количества жизнеспособных клеток в БП на 2 и 3 lg (рис. 2) соответственно.
Рис. 1. Сравнительная оценка воздействия ДВ на плотность сформированных БП P. aeruginosa ATCC 15442 и S. aureus ATCC 6538-Р.
Рис. 2. Сравнительная оценка воздействия ДВ на выживаемость клеток P. aeruginosa ATCC 15442 и S. aureus ATCC 6538-Р в БП.
При действии растворов ТА на БП наблюдалась прямая зависимость между повышением концентрации ДВ и разрушением матрикса БП. После воздействия на сформированные БП 0,1% и 1,0% растворов ТА плотность БП снижалась на 58,2 ± 5,5 и 72,5 ± 8,2%, а количество жизнеспособных клеток уменьшалось на 3 и 4 lg соответственно.
При воздействии на БП P. aeruginosa АТСС 15442 и S. aureus АТСС 6538-P 0,02 и 0,05% растворами ПГМГ наблюдали значительное снижение её плотности — на 78,1 ± 9,3 и 87,5 ± 5,9% и снижение количества жизнеспособных клеток на 5 lg и более.
При воздействии растворами ГА в концентрациях 0,25 и 1,0% наблюдалось слабое снижение плотности БП — на 24,66 ± 9,6 и 10,75 ± 4,5% и незначительное уменьшение количества микроорганизмов.
ЭС в концентрациях 40 и 70% также оказывал слабое разрушающее действие на БП. С увеличением концентрации ЭС наблюдалось снижение эффективности воздействия. Под влиянием 40% ЭС плотность БП снизилась на 20–25%, а 70% — на 10–12,5% (рис. 1).
Рабочие растворы ПВ в концентрации 3% снижали плотность БП P. aeruginosa АТСС 15442 и S. aureus АТСС 6538-P на 46,55 ± 9,45 и 54,45 ± 7,5%, а количество жизнеспособных клеток — на 2,8 и 3 lg соответственно (рис. 1, 2). При увеличении концентрации ПВ до 6% эффективность воздействия возрастала и наблюдалось снижение количества жизнеспособных клеток — на 4,0–4,5 lg.
При воздействии хлорактивных соединений на БП наблюдалась зависимость эффективности от концентрации ДВ. Более эффективными были 1,0% раствор ХА (по препарату), 0,1% раствор Na-ДХЦК (по АХ) и 1,0% раствор ГХ (по АХ) в сравнении с более низкими концентрациями этих ДВ (рис. 1, 2).
При добавлении в рабочие растворы 3% ПВ, 0,03% Na-ДХЦК (по АХ) и 0,5% ГХ (по АХ) моющего компонента сульфонола в концентрации 0,5% эффективность антимикробного воздействия на микроорганизмы в составе БП увеличилась на 40–52% (рис. 3).
Рис. 3. Сравнительная оценка ДВ с добавлением моющего средства на плотность БП (а) и выживаемость (б) P. aeruginosa АТСС 15442 и S. aureus АТСС 6538-P.
Обсуждение
Результаты действия дезинфицирующих растворов на БП не однозначны. Действие ДВ обычно ограничивается взаимодействием только с поверхностным слоем БП, поскольку матрикс не позволяет молекулам ДВ свободно диффундировать в глубинные слои. Также известен тот факт, что некоторые из них способны вызвать обратный эффект, проявляющийся в стимуляции роста БП. Это связано с их разрушающим действием только на поверхностные структуры, что облегчает поступление питательных веществ внутрь БП [9, 10].
Эффективность коммерческих дезинфицирующих средств изучена лишь в отношении планктонных форм микроорганизмов, данные об их биоцидной активности в отношении микроорганизмов, растущих в составе БП, отсутствуют. Несмотря на большое количество работ по стратегии борьбы с БП, до сих пор не найдены ДВ, которые могли бы специфически подавлять образование БП и убивать бактерии внутри БП, вызывая при этом их деградацию, разрушая матрикс. Системное исследование основных ДВ в отношении грамотрицательных и грамположительных микроорганизмов в БП проведено впервые. В результате выполненных исследований показано, что ПВ в концентрации 6%, раствор Na-ДХЦК — 0,1% (по АХ), ГХ — 1,0% (по АХ), ХА — 1,0% (по препарату), ПГМГ — 0,05%, ТА — 1,0% снижают количество микроорганизмов в БП на 4 lg и более, а плотность БП — на 70% и более. Необходимость применения биоцидов из группы окислителей в более высоких эффективных концентрациях, вероятнее всего, связана с частичной их инактивацией биополимерами в поверхностных слоях БП. Матрикс БП ограничивает диффузию через поверхность БП вглубь и нейтрализует часть ДВ, обеспечивая устойчивость микробной БП к действию этих соединений. Поскольку для придания моющих свойств хлорактивным соединениям в условиях практического использования к ним добавляют моющие вещества, изучено действие растворов этих соединений при добавлении 0,5% сульфонола. Установлено повышение эффективности воздействия хлорактивных соединений и ПВ, что, возможно, связано с повышением проницаемости матрикса БП под воздействием анионного ПАВ — сульфонола, способствовавшего повышению диффузии ДВ в БП из-за снижения поверхностного натяжения раствора и, следовательно, улучшения смачивания поверхности БП.
Из группы катионных ПАВ наименее активным в отношении бактерий в БП был АДБАХ. Это связано с тем, что отрицательно заряженные полисахариды БП способны связывать положительно заряженные молекулы АДБАХ и тем самым защищать БП от деструкции [23]. Вместе с тем имеются данные литературы о возможности применения четвертичных аммониевых соединений для борьбы с микробными БП при усилении их действия синергистами или ферментами в композиционных средствах [24].
ТА проявлял достаточное действие в концентрации 1%. Особенностью ТА является сочетание антимикробных и моющих свойств. За счёт наличия свободных аминогрупп и атома третичного азота формируется щелочная среда, что способствует повышению антимикробной активности [24].
ПГМГ продемонстрировал бактерицидные преимущества по сравнению с АДБАХ и ТА. Высокие показатели снижения плотности БП и выраженного антимикробного действия свидетельствует о существенном нарушении целостности структуры БП в результате разрушения полисахаридного матрикса и воздействии на бактерии. Механизм действия этого эффекта пока не раскрыт и требует более глубокого изучения.
Растворы ГА (0,25–1,00%) и ЭС (40–70%) на деструкцию БП и гибель микроорганизмов в БП влияли очень слабо. В исследованиях [25] было обнаружено, что ГА реагирует с аминогруппами БП, поперечно сшивая длинные молекулы биополимеров, чем вызывает лишь набухание или коагуляцию поверхностного слоя БП, делая невозможным дальнейшую диффузию ГА вглубь микробной БП. Низкая эффективность ЭС связана с наличием фиксирующего действия и плохим проникновением молекул спирта в богатые белком материалы [26]. С повышением концентрации спирта плотность БП повышалась.
Заключение
Для борьбы с микробными БП перспективны дезинфицирующие вещества из группы окислителей (хлорактивные и кислородсодержащие), ТА и ПГМГ; применение четвертичных аммониевых соединений как индивидуального соединения не эффективно; альдегиды и спирты для разрушения БП и уничтожения в ней микроорганизмов не пригодны. Применённая для оценки эффективности биоцидов методика может быть рекомендована для исследования и оценки дезинфицирующей активности средств для борьбы с микробными БП на этапе первичного отбора.
Об авторах
Людмила Самуиловна Федорова
Научно-исследовательский институт системной биологии и медицины
Автор, ответственный за переписку.
Email: fedorova-ls@yandex.ru
ORCID iD: 0000-0003-2663-0273
д.м.н., профессор, заведующий лабораторией преодоления микробной резистентности НИИ системной биологии и медицины
Россия, МоскваАнастасия Васильевна Ильякова
Научно-исследовательский институт системной биологии и медицины
Email: fedorova-ls@yandex.ru
ORCID iD: 0000-0002-1867-3495
н.с. лаб. преодоления микробной резистентности НИИ системной биологии и медицины
Россия, МоскваСписок литературы
- Algburi A., Comito N., Kashtanov D., et al. Control of biofilm formation: antibiotics and beyond. Appl. Environ. Microbiol. 2017;83(3):e02508–16. DOI: https://doi.org/10.1128/aem.02508-16
- Charron R., Boulanger M., Briandet R., Bridier A. Biofilms as protective cocoons against biocides: from bacterial adaptation to One Health issues. Microbiology (Reading). 2023;169(6): 001340. DOI: https://doi.org/10.1099/mic.0.001340
- Vieira-da-Silva B., Castanho M.A.R.B. The structure and matrix dynamics of bacterial biofilms as revealed by antimicrobial peptides’ diffusion. J. Pept. Sci. 2023;29(6):e3470. DOI: https://doi.org/10.1002/psc.3470
- Тутельян А.В., Юшина Ю.К., Соколова О.В. и др. Образование биологических плёнок микроорганизмов на пищевых производствах. Вопросы питания. 2019;88(3)32–43. Tutelyan A.V., Yushina Yu.K., Sokolova O.V., et al. Formation of biological films by microororganisms in food productions. Problems of Nutrition. 2019;88(3)32–43. DOI: https://doi.org/10.24411/0042-8833-2019-10027 EDN: https://elibrary.ru/tredji
- Hobley L., Harkins C., MacPhee C.E., Stanley-Wall N.R. Giving structure to the biofilm matrix: an overview of individual strategies and emerging common themes. FEMS Microbiol. Rev. 2015;39(5):649–69. DOI: https://doi.org/10.1093/femsre/fuv015
- Akinbobola A.B., Sherrya L., Mckay W.G., et al. Tolerance of Pseudomonas aeruginosa in in-vitro biofilms to high-level peracetic acid disinfection. J. Hosp. Infect. 2017;97(2):162–8. DOI: https://doi.org/10.1016/j.jhin.2017.06.024
- Donlan R.M., Costerton J.W. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin. Microbiol. Rev. 2002;15(2):167–93. DOI: https://doi.org/10.1128/CMR.15.2.167-193.2002
- Hung C., Zhou Y., Pinkner J.S., et al. Escherichia coli biofilms have an organized and complex extracellular matrix structure. mBio. 2013;4(5):e00645-13. DOI: https://doi.org/10.1128/mBio.00645-13
- Günther F., Scherrer M., Kaiser S.J., et al. Comparative testing of disinfectant efficacy on planktonic bacteria and bacterial biofilms using a new assay based on kinetic analysis of metabolic activity. J. Appl. Microbiol. 2017;122(3):625–33. DOI: https://doi.org/10.1111/jam.13358
- Cochran W.L., McFeters G.A., Stewart P.S. Reduced susceptibility of thin Pseudomonas aeruginosa biofilms to hydrogen peroxide and monochloramine. J. Appl. Microbiol. 2000;88(1): 22–30. DOI: https://doi.org/10.1046/j.1365-2672.2000.00825.x
- Lineback C.B., Nkemngong C.A., Wu S.T., et al. Hydrogen peroxide and sodium hypochlorite disinfectants are more effective against Staphylococcus aureus and Pseudomonas aeruginosa biofilms than quaternary ammonium compounds. Antimicrob. Resist. Infect. Control. 2018;7:154. DOI: https://doi.org/10.1186/s13756-018-0447-5
- Bae Y.M., Baek S.Y., Lee S.Y. Resistance of pathogenic bacteria on the surface of stainless steel depending on attachment form and efficacy of chemical sanitizers. Int. J. Food Microbiol. 2012;153(3):465–73. DOI: https://doi.org/10.1016/j.ijfoodmicro.2011.12.017
- Chowdhury D., Tahir S., Legge M., et al. Transfer of dry surface biofilm in the healthcare environment: the role of healthcare workers’ hands as vehicles. J. Hosp. Infect. 2018;100(3):e85–e90. DOI: https://doi.org/10.1016/j.jhin.2018.06.021
- Johani K., Abualsaud D., Costa D.M., et al. Characterization of microbial community composition, antimicrobial resistance and biofilm on intensive care surfaces. J. Infect. Public Health. 2017;11(3):418–24. DOI: https://doi.org/10.1016/j.jiph.2017.10.005
- Hu H., Johani K., Gosbell I.B., et al. Intensive care unit environmental surfaces are contaminated by multidrug-resistant bacteria in biofilms: combined results of conventional culture, pyrosequencing, scanning electron microscopy, and confocal laser microscopy. J. Hosp. Infect. 2015;91(1):35–44. DOI: https://doi.org/10.1016/j.jhin.2015.05.016
- Ledwoch K., Vickery K., Maillard J.Y. Dry surface biofilms: what you need to know. Br. J. Hosp. Med. (Lond). 2022;83(8): 1–3. DOI: https://doi.org/10.12968/hmed.2022.0274
- Otter J.A., Vickery K., Walker J.T., et al. Surface-attached cells, biofilms and biocide susceptibility: implications for hospital cleaning and disinfection. J. Hosp. Infect. 2015;89(1):16–27. DOI: https://doi.org/10.1016/j.jhin.2014.09.008
- Ledwoch K., Dancer S.J., Otter J.A., et al. Beware biofilm! Dry biofilms containing bacterial pathogens on multiple healthcare surfaces; a multi-centre study. J. Hosp. Infect. 2018;100(3):e47–e56. DOI: https://doi.org/10.1016/j.jhin.2018.06.028
- Costa D.M., Johani K., Melo D.S., et al. Biofilm contamination of high-touched surfaces in intensive care units: epidemiology and potential impacts. Lett. Appl. Microbiol. 2019;68(4):269–76. DOI: https://doi.org/10.1111/lam.13127
- Руководство Р 4. 2. 3 6 7 6- 20. Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности. М.; 2021.
- O’Toolе G.A., Kaplan H.B., Kolter R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 2000;54:49–79. DOI: https://doi.org/10.1146/annurev.micro.54.1.49
- Платонов А.Е. Статистический анализ в медицине и биологии: задачи, терминология, логика, компьютерные методы. М.; 2001. Platonov A.Ye. Statistical Analysis in Medicine and Biology: Tasks, Terminology, Logic, Computer Methods. Moscow; 2001. EDN: https://elibrary.ru/pbdijn
- Campanac C., Pineau L., Payard A., et al. Interaction between biocide cationic agents and bacterial biofilm. Antimicrob. Agents Chemother. 2002;46(5):1469–74. DOI: https://doi.org/10.1128/aac.46.5.1469-1474.2002
- Диденко Л.В., Смирнова Т.А., Толордава Э.Р. и др. Влияние третичных алкиламинов на биопленки, образованные Escherichia coli и Staphylococcus aureus (бактериологическое и электронно-микроскопическое исследование). Дезинфекционное дело. 2014;(2): 40–5. Didenko L.V., Smirnova T.A., Tolordava E.R., et al. Influence of tertiary alkylamines to biofilms, which were created by Escherichia coli and Staphylococcus aureus (bacteriological and electron microscopical investigation). Disinfection Affairs. 2014;(2):40–5. EDN: https://elibrary.ru/sgfmhl
- Simons C., Walsh S.E., Maillard J.Y., Russel A.D. A note: ortho-phthalaldehyde: proposed mechanism of action of a new antimicrobial agent. Lett. Appl. Microbiol. 2000;31(4):299–302. DOI: https://doi.org/10.1046/j.1472-765x.2000.00817.x
- Silveira M.G., Baumgartner M., Rombouts F.M., Abee T. Effect of adaptation to ethanol on cytoplasmic and membrane protein profiles of Oenococcus oeni. Appl. Environ. Microbiol. 2004;70(5):2748–55. DOI: https://doi.org/10.1128/aem.70.5.2748-2755.2004
Дополнительные файлы