Анализ уровня продукции факторов инвазии InlA и InlB у изолятов Listeria monocytogenes, выделенных на территории Российской Федерации
- Авторы: Калинин Е.В.1, Чаленко Я.М.1, Сафарова П.В.1, Федорова В.А.1, Ермолаева С.А.1
-
Учреждения:
- Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи
- Выпуск: Том 100, № 5 (2023)
- Страницы: 276-286
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18474
- DOI: https://doi.org/10.36233/0372-9311-397
- EDN: https://elibrary.ru/ucqwtu
- ID: 18474
Цитировать
Аннотация
Актуальность. Listeria monocytogenes характеризуется наличием эпидемически высоковирулентных клонов. Инвазия в непрофессиональные фагоциты — ключевой момент листериозной инфекции. Формирование высоковирулентных клонов обусловлено повышенной продукцией и/или наличием определённых изоформ факторов инвазии белков InlA и InlB.
Цель исследования — создать тест-систему для обнаружения InlA и InlB и на её основе оценить уровни продукции InlA и InlB у изолятов L. monocytogenes, относящихся к клональным группам с различным вирулентным потенциалом.
Материалы и методы. В работе использованы 32 штамма L. monocytogenes, относящихся к эпидемическим клонам ECII, ECIV, ECVII (клональные комплексы СС1, СС2, СС7) и гиповирулентному клональному комплексу СС9. Проведено секвенирование генов inlA и inlB. Для анализа уровня продукции белков InlA и InlB использован непрямой иммуноферментный анализ.
Результаты. Выявлена вариабельность InlA среди штаммов, относящихся к одному клональному комплексу: в том числе среди штаммов, принадлежащих к СС7, выявлены 3 изоформы InlA; из 8 штаммов, принадлежащих к СС9, у одного выявили стоп-кодон в гене inlA, приводящий к утрате функциональности белка InlA. Различия между аллелями inlB коррелировали с принадлежностью штаммов к конкретному клональному комплексу. Установлены различия в уровне продукции факторов инвазии. У штаммов, относящихся к СС9, уровень продукции InlA был в 2,5 раза ниже по сравнению со штаммами, относящимися к СС1, СС2 и СС7. Уровень продукции InlB был в среднем в 4 раза выше у штаммов, принадлежащих к филогенетически родственным СС1 и СС2, по сравнению со штаммами, относящимися к СС7 и СС9.
Заключение. Полученные результаты свидетельствуют о вариабельности основных факторов инвазии как между клональными комплексами, так и между штаммами одного комплекса. Повышенная продукция факторов инвазии InlA и InlB коррелирует с потенциальной вирулентностью штаммов.
Ключевые слова
Полный текст
Введение
Listeria monocytogenes вызывает опасную пищевую инфекцию с высокой (около 30%) летальностью у людей, находящихся в группе риска, а также у домашних и диких животных [1, 2]. Генетическую структуру вида L. monocytogenes подразделяют на 4 филогенетические линии [3].
I филогенетическая линия включает клональные комплексы (СС) CC1, CC2, СС4 и СС6, наиболее часто ассоциированные с листериозом у человека [4]. Штаммы CC1 и СС2 были разными методами отнесены к эпидемическим клонам ECII и ECIV соответственно, вызвавшим крупные вспышки листериоза в разных странах, в том числе в России. В Европе и США среди изолятов, выделенных из клинических случаев, преобладают штаммы СС1, на долю которых приходится 11,4% [5].
На территории России до 1980 г. доминировали штаммы II линии, выделяемые как из случаев листериоза у людей и животных, так и из природных источников, бóльшая часть которых относилась к СС7 (также известному как эпидемический клон ECVII) [6]. Штаммы CC7 и до настоящего времени преобладают в природных очагах на территории европейской части России, а также их часто выделяют при спорадических случаях листериоза у людей и животных [7]. Штаммы относящегося ко II линии СС9 часто выделяют из пищевых продуктов и объектов окружающей среды, в том числе на территории России [7]. В структуре инфекционной патологии стран Европы и Северной Америки штаммы СС7 относят к штаммам средней вирулентности, а клональный комплекс СС9 считают низковирулентным [8]. Разницу в частоте встречаемости среди клинических изолятов и, соответственно, в потенциальной вирулентности штаммов, относящихся к разным СС и/или филогенетическим линиям, разные авторы связывают с наличием дополнительных факторов вирулентности [9], аллельным разнообразием факторов вирулентности [10], а также уровнем их экспрессии [11].
Начальным этапом инфекции является взаимодействие листерий с непрофессиональными фагоцитами при помощи белков, относящихся к семейству интерналинов, — InlA и InlB, которые позволяют L. monocytogenes проникать в энтероциты кишечника и эпителиальные клетки через взаимодействие c целевыми рецепторами. Специфическим рецептором InlA является Е-кадгерин. InlB специфически взаимодействует с двумя рецепторами: c-Met и gС1q-R [12]. Для инвазии в энтероциты достаточно наличия функционального InlA [13], в гепатоциты — только InlB [14], а совместное действие InlA и InlB опосредует пересечение плацентарного барьера [15].
Для установления аллельного разнообразия генов inlA и inlB проводят их секвенирование. Результаты этих исследований показывают, что клинические штаммы и, что наиболее важно, штаммы, вызывающие внутриутробные и неонатальные инфекции, экспрессируют полноразмерный InlA чаще, чем штаммы пищевого происхождения. Укороченный InlA был обнаружен в большинстве гиповирулентных изолятов CC9 и CC121 [16] и в других клональных комплексах филогенетической линии II (например, CC331, CC199 и CC321) [4].
Ранее было показано, что клинические и пищевые изоляты отличаются уровнем экспрессии генов inlA и inlB [11]. Экспрессия ключевых факторов патогенности активируется во время клеточной инфекции и зависит от регулятора транскрипции PrfA. L. monocytogenes имеет сложную систему перекрёстных взаимодействий между регуляторными цепями σB и PrfA, чтобы обеспечить оптимальную реализацию генов, необходимых во внешней среде, включая репрессию генов, связанных с вирулентностью. И наоборот, внутри организма эта регуляторная сеть обеспечивает повышенную экспрессию генов, связанных с вирулентностью, для успешной инвазии [17]. Активность PrfA снижается при культивировании L. monocytogenes на богатой питательной среде. Гидрофобные адсорбенты, включённые в состав среды культивирования, активируют PrfA и индуцируют повышенную активность генов факторов вирулентности [18]. Однако механизмы, контролирующие уровень продукции соответствующих белков-факторов патогенности, остаются неисследованными.
Для оценки уровня экспрессии белков используют разнообразные методы, такие как ферментативная активность целевого образца и иммуноблотинг. Оценку ферментативной активности невозможно использовать, если белки не являются биокатализаторами. Применение иммуноблотинга является трудоёмким процессом, в котором анализ невозможно провести с большим числом образцов. В качестве альтернативного метода для качественной и количественной идентификации InlA и InlB была разработана тест-система на основе иммуноферментного анализа (ИФА). Используя данную ИФА-тест-систему, мы проанализировали изоляты L. monocytogenes из коллекции НИЦЭМ им. Н.Ф. Гамалеи на предмет уровня экспрессии InlA и InlB и его корреляции с филогенетическим положением штаммов.
Материалы и методы
Бактериальные штаммы и условия культивирования бактерий
В работе использованы штаммы Listeria spp. из коллекции НИЦЭМ им. Гамалеи (табл. 1). Культивирование микроорганизмов осуществляли в жидкой питательной среде BHI («Becton Dickinson») при 37ºС в режиме постоянного встряхивания при 180 об/мин. Для активации PrfA в бульон BHI добавляли 1% (мас/об.) гидрофобного адсорбента Amberlite XAD 4 («Sigma-Aldrich»).
Таблица 1. Используемые штаммы Listeria spp.
Table 1. Listeria spp. strains used in the study
Штамм | Strain | Характеристика | Characteristics | Источник | Source | Ссылка | Reference |
L. monocytogenes | |||
EGDe | CC9 | Типовой штамм | Type strain | BIGSdb ID = 1 |
EGDeΔinlB | inlB deletion | Предоставлен профессором J. Vazquez Boland Kindly provided by Prof. J. Vazquez-Boland | |
EGDeΔinlA | inlA deletion | ||
VIMHA004 | CC2 | Новорождённый | Newborn | BIGSdb ID = 3449 |
VIMHA007 | CC2 | Новорождённый | Newborn | BIGSdb ID = 3450 |
VIMHA006 | СС2 | Новорождённый | Newborn | BIGSdb ID = 3606 |
VIMHA009 | CC1 | Новорождённый | Newborn | BIGSdb ID = 3452 |
VIMHA011 | CC1 | Новорождённый | Newborn | BIGSdb ID = 3454 |
VIMHA010 | CC1 | Новорождённый | Newborn | BIGSdb ID = 3453 |
VIMHA012 | CC1 | Новорождённый | Newborn | BIGSdb ID = 3607 |
VIMHA017 | CC1 | Новорождённый | Newborn | BIGSdb ID = 3609 |
L.mo25 | CC1 | Курица | Chicken | BIGSdb ID = 79358 |
L.mo70 | CC8 | Курица | Chicken | BIGSdb ID = 78808 |
L.mo78 | CC37 | Курица | Chicken | BIGSdb ID = 79363 |
VIMPH006 | CC7 | Носитель | Carrier | BIGSdb ID = 3464 |
L.mo71 | CC59 | Курица | Chicken | BIGSdb ID = 78809 |
GIMC2010:LmcUH8 | СС7 | Носитель | Carrier | BIGSdb ID = 42978 |
GIMC2032:LmcINH-1 | СС7 | Носитель | Carrier | BIGSdb ID = 45728 |
GIMC2007:LmcIH1_3 | СС7 | Носитель | Carrier | BIGSdb ID = 42975 |
766 | СС7 | Свинья | Swine | BIGSdb ID = 5803 |
VIMPR134 | CC7 | Грызун | Rodent | BIGSdb ID = 3459 |
VIMPR422 | CC7 | Грызун | Rodent | BIGSdb ID = 3460 |
VIMPA064 | CC7 | Новорождённый | Newborn | BIGSdb ID = 3455 |
L.mo84 | СС37 | Мясо | Meat | BIGSdb ID = 79367 |
L.mo49 | CC9 | Курица | Chicken | BIGSdb ID = 79359 |
L.mo129/3 | CC9 | Молочные продукты | Dairy products | BIGSdb ID = 78797 |
L.mo75 | CC9 | BIGSdb ID = 79362 | |
GIMC2035:Lmc7218 | CC9 | Рыба | Fish | BIGSdb ID = 45731 |
GIMC2017: Lmc921 | CC9 | Мясо | Meat | BIGSdb ID = 42987 |
L.mo98-20 | CC9 | Молочные продукты | Dairy products | BIGSdb ID = 78795 |
LO28 | CC9 | Типовой штамм | Type strain | BIGSdb ID = 3364 |
L. ivanovii | |||
ATCC 19119 | Типовой штамм | Type strain | Американская коллекция типовых культур American Type Culture Collection | |
ПЦР-анализ
Коллекционные изоляты L. monocytogenes лизировали лизоцимом в концентрации 20 мкг/мл в течение 1 ч при 37ºС, далее лизаты обрабатывали протеиназой К в концентрации 25 мкг/мл при 56ºС в течение 1 ч. Полученные образцы кипятили на водяной бане в течение 10 мин. Амплификацию генов inlA и inlB осуществляли в термоциклере «Терцик» («ДНК-технология») по следующей программе с использованием TransStartTaq-ДНК-полимеразы («TransGen»): 1-й этап (1 цикл): 94ºС — 4 мин; 2-й этап (30 циклов): 94ºС — 30 с, 52ºС — 30 с, 72ºС — 2 мин; 3-й этап (1 цикл): 72ºС — 10 мин. Праймеры подбирали в программе «Ugene v. 40.1» и синтезировали в компании «Синтол». Для гена inlA использовали праймеры: InlA1 5’-ggttgaaaagtatactagtagc-3’; InlA2 5’-ggaagatattagcccaatttc-3’, для гена InlB: InlBF 5’-gcttatggatcctataattcaaaagaag, InlBR 5’-gaaaagctgcagaaaatccgccttc. Продукты амплификации выявляли методом гель-электрофореза. Целевые фрагменты ДНК очищали из геля с использованием набора «Dia-gene» («Диа-М»).
Секвенирование
Подготовку проб к секвенированию проводили согласно рекомендациям Центра коллективного пользования «Геном». Секвенирование ДНК выполняли с помощью набора реактивов «ABI PRISM BigDye Terminator v. 3.1» с последующим анализом продуктов реакции на автоматическом секвенаторе «Applied Biosystems 3730 DNA Analyzer». Для определения последовательностей генов были использованы праймеры: InlA1 5’-ggttgaaaagtatactagtagc-3’, InlA2 5’-ggaagatattagcccaatttc-3’, InlA-R 5’-cttcttttgaattata-ggatccataagc-3’, InlA3 5’-ccaatatcccgggaaaagctat-3’, 5’-gcttatggatcctataattcaaaagaag-3’, InlBR 5’-gaaaagctgcagaaaatccgccttc-3’, InlB1 5’-gaagcaggatcccggataac-tgcac-3’, InlB2 5’-atagcgggttaagttgactgc-3’. Для анализа нуклеотидных последовательностей использовали программу «Ugene v. 40.1» и базу данных BigSdb-Pasteur1.
Получение поликлональных моноспецифичных антител против InlA и InlB
Кроликов иммунизировали препаратами очищенных рекомбинантных белков InlA и InlB, как было описано ранее [19]. Работа с лабораторными животными проводилась с соблюдением этических принципов. Протокол исследования одобрен Этическим комитетом Национального исследовательского центра эпидемиологии и микробиологии им. Н.Ф. Гамалеи (протокол № 54 от 24.07.2023).
Глобулиновую фракцию гипериммунных сывороток осаждали, добавляя насыщенный раствор (NH4)2SO4 («Русхим»). Выпавший осадок, содержащий IgG, растворяли в 0,01 М Na-фосфатном буфере pH 6,5 и диализовали против этого же буфера. Полученный раствор пропускали через колонку с ДЭАЭ-сефадексом А-50 и собирали фракцию IgG, выходящую в свободном объёме буфера. Аффинные антитела выделяли на колонке против соответствующих рекомбинантных белков InlA и InlB, иммобилизованных на активированной BrCN-сефарозе («GE Healthcare»). Фракцию, полученную после ДЭАЭ-хроматографии, промывали 0,3 М NaCl и элюировали 4,5 М MgCl2 («Русхим»). Полученные образцы диализовали против фосфатно-солевого буфера («Sigma-Aldrich»), концентрировали, смешивали с глицерином до концентрации 50% и хранили при –20ºС.
Вестерн-блот-анализ лизатов L. monocytogenes
Белки клеточной стенки получали из ночной культуры, выращенной в BHI-бульоне с добавлением 1% Amberlite XAD 4. Лизаты разделяли в 10% SDS-PAGE в денатурирующих условиях по Леммли и переносили на нитроцеллюлозную мембрану («Bio-Rad») с диаметром по 0,45 мкм. Нитроцеллюлозные мембраны инкубировали с полученными антителами против InlA или InlB соответственно
в разведении 1 : 10 000 в течение 1 ч. Далее мембрану отмывали 3 раза ТТBS буфером («Bio-Rad») и добавляли вторичные антитела против IgG кролика (в разведении 1 : 20 000). Визуализацию целевых белков InlA и InlB на мембране осуществляли добавлением TMБ-субстрата («Thermo Fisher Scientific»). Для контроля нагрузки белков использовали антитела к GAPDH (в разведении 1: 1000 («Thermo Fisher Scientific»).
Непрямой иммуноферментный анализ
Бактериальные клетки культивировали в течение 24 ч на среде BHI, а затем центрифугировали и промывали трижды фосфатно-солевым буфером. Полученные образцы доводили до оптической плотности OD600 = 0,2. Чтобы проверить, что количество клеток совпадает, культуры высевали на агаризованную питательную среду. Лунки 96-луночного планшета покрывали аликвотами по 100 мкл соответствующих тестируемых штаммов L. monocytogenes. Планшеты инкубировали при 37ºC в течение 1 ч, далее трижды отмывали трис-буферным физиологическим раствором, содержащим 0,05% Твин-20 (TTBS) («Русхим»), а затем блокировали незанятые участки добавлением в лунки 200 мкл 2% бычьего сывороточного альбумина («Диа-М»), разведённого в фосфатно-солевом буфере в течение 30 мин. По окончании времени инкубации буфер для блокировки удаляли и добавляли 100 мкл анти-InlB или анти-InlA антител в разведении 1 : 4000 в TTBS и инкубировали 1 ч при комнатной температуре в режиме постоянного встряхивания при 140 об/мин. Далее лунки трижды промывали TTBS и добавляли 100 мкл вторичных антител (козьи антитела против IgG кролика, меченные пероксидазой хрена, «Bio-Rad»), в TTBS. После отмывали 6 раз TTBS по 250 мкл и проявляли добавлением 100 мкл ТМВ-субстрата. Для остановки реакции использовали 100 мкл 2 М H2SO4 («Русхим»). Измерение оптической плотности проводили при длине волны 450 нм на планшетном фотометре «iMark» («Bio-Rad»). Концентрацию InlA и InlB определяли по калибровочной кривой (рис. 1).
Рис. 1. 96-луночный планшет с результатами анализа.
Статистический анализ
Все эксперименты повторяли не менее 3 раз. Статистический анализ включал однофакторный ANOVA с тестом Тьюки. Значения p < 0,05 считали статистически значимыми.
Результаты
Анализ частоты встречаемости изолятов, депонированных в базе данных BigSdb-Pasteur, в зависимости от филогенетического положения и региона выделения
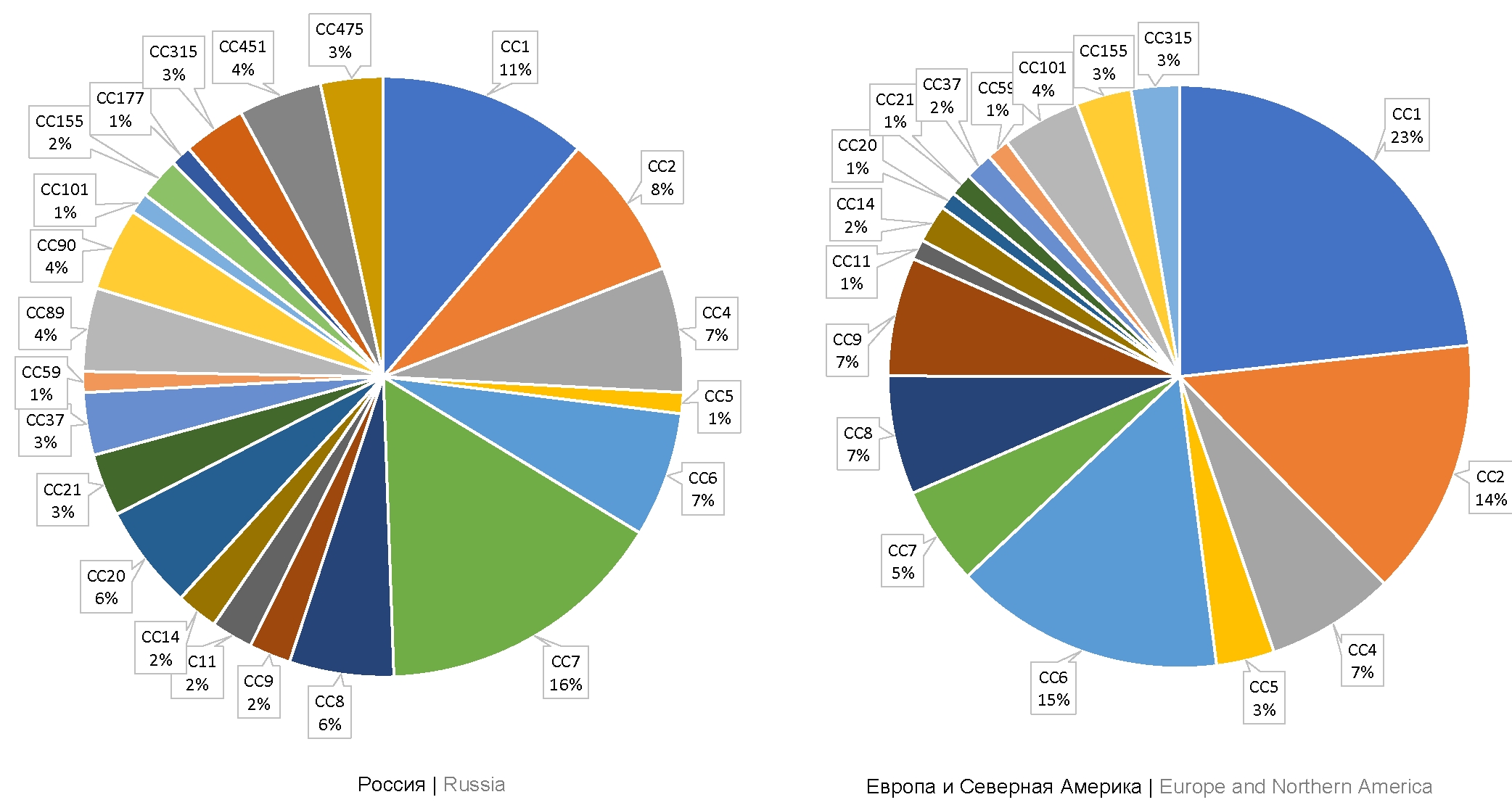
В совокупности в базе данных BigSdb-Pasteur депонировано 111 изолятов, выделенных на территории России от сельскохозяйственных животных и человека, инфицированных L. monocytogenes. Из них 83 изолята были выделены в 1958–2019 гг. сотрудниками НИИЭМ им. Г.П. Сомова, ФИЦВиМ, НИЦЭМ им. Н.Ф. Гамалеи и ГНЦ ПМБ из клинического материала, полученного от мертворождённых в результате перинатального листериоза детей, а также от беременных женщин без клинических признаков инфекции, и из образцов, забранных у пациентов с нейролистериозом и поражениями тканей лёгкого. Анализ базы данных показал, что в случаях листериоза человека преобладали изоляты, принадлежащие к СС7 (II филогенетическая линия), СС1 и СС2 (I филогенетическая линия) по 16, 11 и 8% соответственно. Изоляты, относящиеся к СС9 (II филогенетическая линия), составили 2% (рис. 2).
Рис. 2. Частота встречаемости СС среди штаммов L. monocytogenes, информация о которых хранится в базе данных ListiList (Institute Pasteur, Франция), для России и стран Европы и Северной Америки.
Далее мы проанализировали распределение в соответствии с СС для изолятов, выделенных на территории Европы (исключая страны, входившие в состав СССР) из клинического материала пациентов с листериозом. Всего в базе депонировано 747 изолятов. При этом 723 изолята представлены теми же клональными комплексами, что и на территории России. Однако процентное соотношение представленности отдельных СС среди клинических изолятов, выделенных на территории Европы, отличалось от российских. Среди европейских изолятов преобладали СС1, СС6 и СС2 (23, 15 и 14% соответственно).
Определение разнообразия inlA и inlB среди изолятов L. monocytogenes, выделенных на территории России, из коллекции НИЦЭМ им. Гамалеи
Анализ базы данных показал, что среди штаммов II филогенетической линии, преобладающих на территории России, штаммы, относящиеся к СС7, чаще встречаются среди клинических изолятов, по сравнению со штаммами, относящимися к СС9. Для понимания потенциальных механизмов, обеспечивающих эти различия, мы просеквенировали гены inlA и inlB 32 штаммов, принадлежащих к данным СС, которые были выделены на территории России.
Среди штаммов, принадлежащих к СС7, выявлены 3 аллельных варианта inlA, в том числе 15 штаммов обладали аллелем 2 гена inlA, представленным в базе данных BigSdb-Pasteur. Однако у 2 штаммов inlA отличался от аллелей, депонированных в этой базе данных. Выявленные мутации были несинонимическими, что указывало на потенциальное функциональное значение замен. Изолят VIMРA064 содержал 1 несинонимическую замену, приводящую к замене глутамина в 364-м положении на пролин в области интерналинового домена, вовлечённого в белок-белковое взаимодействие с эукариотическим рецептором Е-кадгерином. VIMPH006 содержал 3 несинонимические замены в положениях 618, 620 и 621 (пролин, лизин и глутамин вместо аланина, глутамина и серина) вне области интерналинового домена. Ни один из аллелей штаммов, относящихся к СС7, не содержал преждевременных стоп-кодонов.
Из 9 штаммов, принадлежащих к СС9, у 1 штамма выявили наличие стоп-кодона в гене inlA. Стоп-кодон находился вне области интерналинового домена, однако препятствовал формированию полноразмерного белка, в частности, связыванию белка с поверхностью бактерии, что необходимо для функциональной активности InlA как фактора инвазии. Остальные 8 штаммов СС9 кодировали полноразмерный вариант inlA относящийся к аллелю 1. Данные о последовательностях генов inlA доступны в базе данных GenBank под номерами OQ865090–OQ865119.
Секвенирование гена inlB у 32 штаммов не выявило особенностей в пределах клональных комплексов. Для штаммов, относящихся к СС7, был выявлен аллель 2, к СС9 — аллель 1.
Таким образом, анализируя последовательности inlA и inlB, у штаммов, относящихся к СС7 и СС9, установлена внутриклональная вариабельность inlA, в то время как inlB был консервативен для всех штаммов, относящихся к определённому клону. Аллели, выявленные среди штаммов высоковирулентного CC7, кодировали различные изоформы InlA, что может указывать на различия в их взаимодействии с таргетным рецептором на поверхности клеток человека. Вариант, кодируемый альтернативным аллелем inlA, выявленным среди штаммов, относящихся к редко встречающемуся среди клинических изолятов СС9, кодировал нефункциональный укороченный белок.
Уровень экспрессии фактора патогенности L. monocytogenes InlB в штаммах СС1, СС2, СС7 и СС9
Для оценки корреляции между уровнем продукции факторов инвазии InlA и InlB и частотой встречаемости штаммов данного СС среди клинических изолятов были сконструированы 2 тест-системы, основанные на ИФА. Концентрацию белков определяли по калибровочным кривым от 5 до 1000 нг/мл. В качестве стандартов использовали рекомбинантные InlA и InlB (рис. 3).
Рис. 3. Иммуноблот клеточных лизатов бактерий Listeria spp. а — моноспецифичные антитела против InlA; б — моноспецифичные антитела против InlB. 1 — L. monocytogenes EGDe ΔinlA; 2 — L. ivanovii ATCC 19119; 3 — L. monocytogenes EGDe (CC9); 4 — L. monocytogenes EGDe ΔinlB; 5 — L. monocytogenes L.mo49 (CC9).
Транскрипция обоих генов, кодирующих белки InlA и InlB, находится под контролем регулятора PrfA [12]. При культивировании L. monocytogenes на питательных средах активность PrfA увеличивается в присутствии гидрофобных адсорбентов (активированный уголь или Amberlite XAD4), достигая уровней, характерных для бактерий в процессе инфекции [18]. С целью изучения изменений в концентрации инвазинов в зависимости от состояния PrfA были измерены уровни InlA и InlB без активации и при активации PrfA регулона в зависимости от наличия в питательной среде адсорбента Amberlite XAD4. Без активации PrfA уровень InlA у штаммов L. monocytogenes варьировал от 5 до 65 нг/мл (рис. 4). При этом штаммы, относящиеся к СС1, СС2 и СС7, показывали в среднем более высокий уровень InlA в сравнении со штаммами, относящимися к СС9 (53,5 ± 5,3 нг/мл против 21,1 ± 3,2 нг/мл; p < 0,05). Исключение составил 1 штамм СС9 L.mo129-3, имеющий уровень, сравнимый со штаммами СС1, СС2, СС7 (59,1 ± 1,5 нг/мл).
Рис. 4. Уровни InlA изолятов, относящихся к разным СС. Концентрацию InlA измеряли при помощи разработанной ИФА-тест-системы. Бактерии выращивали в среде BHI без и с добавлением 1% Amberlite XAD4.
Комплементация питательной среды адсорбентом Amberlite XAD4 и соответствующая активация PrfA приводила к увеличению концентрации InlA у всех штаммов в среднем на 31%. При этом у отдельных штаммов концентрация достигала максимума: VIMHA017 (СС1) — 99 нг/мл, VIMHA007 (CC2) — 93 нг/мл, L.mo71 — 107 нг/мл (CC7), L.mo129-3 (CC9) — 90 нг/мл.
Уровень InlB между штаммами варьировал от 15 до 958 нг/мл без активации PrfA регулона (рис. 5). При этом в среднем концентрация у штаммов CC1 и CC2 составляла 740,5 нг/мл, что было существенно выше, чем у штаммов СС7 и СС9 (209,5 и 177,9 нг/мл соответственно). Но в сравнении с InlA уровень InlB у штамма L.mo129-3 не достигал значений, характерных для штаммов СС1 и СС2, и был меньше в 2 раза (p < 0,05).
Рис. 5. Уровни InlB изолятов, относящихся к разным СС. Концентрацию InlA измеряли при помощи разработанной ИФА-тест-системы. Бактерии выращивали в среде BHI без и с добавлением 1% Amberlite XAD4.
При активации PrfA концентрация InlB достигала максимальных значений 1353 нг/мл для штаммов СС1 и СС2, 917 нг/мл — для СС7, 835 нг/мл — для СС9. При этом наибольшего увеличения уровня InlB достигала у штаммов СС7 (в 3,29 раза в сравнении с уровнем без активации). Для штаммов СС9 и I филогенетической линии (СС1, СС2) увеличение уровня InlB в присутствии адсорбента составило 2,93 и 1,54 раза соответственно.
Обсуждение
У L. monocytogenes, как и у большинства других патогенных бактерий, клональные группы и линии различаются по вирулентному потенциалу [20, 21]. Например, штаммы II филогенетической линии чаще связаны с пищевыми продуктами, в то время как штаммы I филогенетической линии чаще обнаруживают в клинических изолятах. Однако даже внутри филогенетических линий распределение среди источников различное. Например, штаммы II филогенетической линии, принадлежащие к СС7, чаще, чем штаммы, относящиеся к СС9, выделяют из клинических образцов [20]. Установление природы такой гетерогенности необходимо для понимания механизмов эволюции и формирования высоковирулентных штаммов.
Для ряда патогенных бактерий, например для энтеропатогенных иерсиний, различия в вирулентности связаны с наличием дополнительных факторов патогенности, которые могут присутствовать на плазмидах и мобильных генетических элементах [22]. При поиске дополнительных факторов патогенности у штаммов L. monocytogenes, относящихся к клональному комплексу СС1, был обнаружен бактериоцин LLS, который, предположительно, позволяет листериям дольше выживать в присутствии нормальной микробиоты, однако не является полноценным фактором патогенности и отсутствует у других высоковирулентных штаммов, относящихся к другим СС [23].
Нами была предложена альтернативная гипотеза о роли вариабельности основных факторов патогенности как основного механизма формирования высоковирулентных штаммов L. monocytogenes и других возбудителей сапронозов [24]. Природные изоформы InlB отличаются между собой и по кинетике активации внутриклеточных сигнальных путей, и по константе связывания со своими целевыми рецепторами c-Met и gC1qR [25, 26]. Штаммы, отличающиеся только изоформой InlB, различались в способности поддерживать гастроинтестинальную инфекцию у мышевидных грызунов, а изоформы InlB обусловливали различную инвазию данных штаммов в эпителиальные клетки животных (клетки почки овцы, shKEC) [10]. В данной работе продемонстрирована вариабельность другого фактора инвазии — белка InlA среди штаммов, относящихся к СС II филогенетической линии: СС7 и СС9. Среди проанализированных штаммов выявлен один с нефункциональным белком InlA, что соответствует относительно низкой роли СС9 в клиническом распространении листериоза и совпадает с данными других авторов [27].
Ещё одним механизмом, определяющим вирулентный потенциал штамма, может быть уровень продукции основных факторов патогенности [11]. Ранее было установлено, что уровень продукции InlB влияет на взаимодействие L. monocytogenes с макрофагами [28]. У L. monocytogenes продукция факторов патогенности происходит под положительным контролем белка PrfA, который неактивен в условиях роста, свидетельствующих о пребывании вне организма хозяина (низкая температура, наличие растительных сахаров и гидрофобных пептидов) [22]. Данный механизм регуляции является оправданным, поскольку позволяет исключить избыточность синтеза факторов патогенности для возбудителей сапронозов, когда они обитают в абиотических условиях окружающей среды. Вместе с тем высокий уровень продукции факторов, необходимых для пересечения эпителиального барьера кишечника, должен положительно влиять на вирулентность бактерий. В соответствии с этой гипотезой в данном исследовании показано, что уровень продукции фактора инвазии InlB без активации PrfA был выше в 4 раза у штаммов I филогенетической линии (СС1 и СС2) в сравнении со штаммами II филогенетической линии (СС7, СС9). Уровень продукции InlA без активации PrfA и в условиях активации PrfA у изолятов, относящихся к СС1, СС2, СС7, был выше, чем у изолятов, относящихся к СС9. Это согласуется с тем, что наиболее часто на территории России в клинических образцах встречаются именно СС1, СС2, СС7. При этом у штаммов, относящихся к СС9, которые чаще выделяют из продуктов питания, уровень InlA был ниже в 2,5 раза, за исключением штамма L.mo129-3, который показал схожую с СС1 и СС2 концентрацию.
Таким образом, в нашем исследовании было показано, что высоковирулентные штаммы для человека характеризуются не только определёнными изоформами, но и повышенной продукцией InlA и InlB. Наши данные подтверждают результаты других исследователей, которые установили, что клинические изоляты отличаются от пищевых изолятов уровнем экспрессии inlA [11].
Заключение
В совокупности полученные нами данные согласуются с эпидемиологическими наблюдениями и раскрывают возможные механизмы формирования СС L. monocytogenes с различными вирулентными потенциалами. Полученные результаты имеют фундаментальное значение, но также могут послужить основой для классификации вновь выделенных изолятов на вирулентные и гиповирулентные клоны.
1 URL: https://bigsdb.pasteur.fr/listeria
Об авторах
Егор Валерьевич Калинин
Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи
Email: kalinin.egor@bk.ru
ORCID iD: 0000-0002-4478-3225
н.с. лаб. экологии возбудителей инфекций НИЦЭМ им. Н.Ф. Гамалеи
Россия, МоскваЯрослава Михайловна Чаленко
Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи
Email: kalinin.egor@bk.ru
ORCID iD: 0000-0002-7901-5226
к.м.н., с.н.с., лаб. экологии возбудителей инфекций НИЦЭМ им. Н.Ф. Гамалеи
Россия, МоскваПолина Вагифовна Сафарова
Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи
Email: kalinin.egor@bk.ru
ORCID iD: 0000-0001-9051-2664
лаборант-исследователь, лаб. экологии возбудителей инфекций НИЦЭМ им. Н.Ф. Гамалеи
Россия, МоскваВиктория Алексеевна Федорова
Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи
Автор, ответственный за переписку.
Email: kalinin.egor@bk.ru
ORCID iD: 0009-0000-9228-3818
лаборант-исследователь, лаб.экологии возбудителей инфекций НИЦЭМ им. Н.Ф. Гамалеи
Россия, МоскваСветлана Александровна Ермолаева
Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи
Email: kalinin.egor@bk.ru
ORCID iD: 0000-0003-3396-6816
д.б.н., зав. лаб. экологии возбудителей инфекций НИЦЭМ им. Н.Ф. Гамалеи
Россия, МоскваСписок литературы
- Pires S.M., Desta B.N., Mughini-Gras L., et al. Burden of foodborne diseases: think global, act local. Curr. Opin. Food Sci. 2021;39:152–9. DOI: https://doi.org/10.1016/J.COFS.2021.01.006
- Halbedel S., Wilking H., Holzer A., et al. Large nationwide outbreak of invasive listeriosis associated with blood sausage, Germany, 2018-2019. Emerg. Infect. Dis. 2020;26(7):1456–64. DOI: https://doi.org/10.3201/eid2607.200225
- Rasmussen O.F., Skouboe P., Dons L., et al. Listeria monocytogenes exists in at least three evolutionary lines: еvidence from flagellin, invasive associated protein and listeriolysin O genes. Microbiology (Reading). 1995;141(Pt. 9):2053–61. DOI: https://doi.org/10.1099/13500872-141-9-2053
- Moura A., Criscuolo A., Pouseele H., et al. Whole genome-based population biology and epidemiological surveillance of Listeria monocytogenes. Nat. Microbiol. 2016;2(2):1–10. DOI: https://doi.org/10.1038/nmicrobiol.2016.185
- Maury M.M., Tsai Y.H., Charlier C., et al. Uncovering Listeria monocytogenes hypervirulence by harnessing its biodiversity. Nat. Genet. 2016;48(3):308–13. DOI: https://doi.org/10.1038/ng.3501
- Psareva E.K., Egorova I.Y., Liskova E.A., et al. Retrospective study of Listeria monocytogenes isolated in the territory of inner Eurasia from 1947 to 1999. Pathogens. 2019;8(4):184. DOI: https://doi.org/10.3390/pathogens8040184
- Psareva E.K., Liskova E.A., Razheva I.V., et al. Diversity of Listeria monocytogenes strains isolated from food products in the central European part of Russia in 2000–2005 and 2019–2020. Foods. 2021;10(11):2790. DOI: https://doi.org/10.3390/foods10112790
- Charlier C., Perrodeau É., Leclercq A., et al. Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study. Lancet Infect. Dis. 2017;17(5):510–9. DOI: https://doi.org/10.1016/S1473-3099(16)30521-7
- Cotter P.D., Draper L.A., Lawton E.M., et al. Listeriolysin S, a novel peptide haemolysin associated with a subset of lineage I Listeria monocytogenes. PLoS Pathog. 2008;4(9):e1000144. DOI: https://doi.org/10.1371/journal.ppat.1000144
- Chalenko Y., Kolbasova O., Pivova E., et al. Listeria monocytogenes invasion into sheep kidney epithelial cells depends on InlB, and invasion efficiency is modulated by phylogenetically defined InlB isoforms. Front. Microbiol. 2022;13:825076. DOI: https://doi.org/10.3389/fmicb.2022.825076
- Severino P., Dussurget O., Vêncio R.Z.N., et al. Comparative transcriptome analysis of Listeria monocytogenes strains of the two major lineages reveals differences in virulence, cell wall, and stress response. Appl. Environ. Microbiol. 2007;73(19):6078–88. DOI: https://doi.org/10.1128/AEM.02730-06
- Kammoun H., Kim M., Hafner L., et al. Listeriosis, a model infection to study host-pathogen interactions in vivo. Curr. Opin. Microbiol. 2022;66:11–20. DOI: https://doi.org/10.1016/j.mib.2021.11.015
- Lecuit M., Ohayon H., Braun L., et al. Internalin of Listeria monocytogenes with an intact leucine-rich repeat region is sufficient to promote internalization. Infect. Immun. 1997;65(12): 5309–19. DOI: https://doi.org/10.1128/iai.65.12.5309-5319.1997
- Dramsi S., Biswas I., Maguin E., et al. Entry of Listeria monocytogenes into hepatocytes requires expression of InIB, a surface protein of the internalin multigene family. Mol. Microbiol. 1995;16(2):251–61. DOI: https://doi.org/10.1111/j.1365-2958.1995.tb02297.x
- Disson O., Grayo S., Huillet E., et al. Conjugated action of two species-specific invasion proteins for fetoplacental listeriosis. Nature. 2008;455(7216):1114–8. DOI: https://doi.org/10.1038/nature07303
- Gelbíčová T., Koláčková I., Pantůček R., Karpíšková R. A novel mutation leading to a premature stop codon in inlA of Listeria monocytogenes isolated from neonatal listeriosis. New Microbiol. 2015;38(2):293–6.
- Gaballa A., Guariglia-Oropeza V., Wiedmann M., et al. Cross talk between SigB and PrfA in Listeria monocytogenes facilitates transitions between extra- and intracellular environments. Microbiol. Mol. Biol. Rev. 2019;83(4):e00034-19. DOI: https://doi.org/10.1128/MMBR.00034-19
- Ermolaeva S., Novella S., Vega Y., et al. Negative control of Listeria monocytogenes virulence genes by a diffusible autorepressor. Mol. Microbiol. 2004;52(2):601–11. DOI: https://doi.org/10.1111/j.1365-2958.2004.04003.x
- Kalinin E.V., Chalenko Y.M., Kezimana P., et al. Combination of growth conditions and InlB-specific dot-immunoassay for rapid detection of Listeria monocytogenes in raw milk. J. Dairy Sci. 2023;106(3):1638–49. DOI: https://doi.org/10.3168/JDS.2022-21997
- Maury M.M., Bracq-Dieye H., Huang L., et al. Hypervirulent Listeria monocytogenes clones’ adaption to mammalian gut accounts for their association with dairy products. Nat. Commun. 2019;10(1):1–13. DOI: https://doi.org/10.1038/s41467-019-10380-0
- Quereda J.J., Morón-García A., Palacios-Gorba C., et al. Pathogenicity and virulence of Listeria monocytogenes: а trip from environmental to medical microbiology. Virulence. 2021;12(1):2509–45. DOI: https://doi.org/10.1080/21505594.2021.1975526
- Timchenko N.F., Adgamov R.R., Popov A.F., et al. Far Еast scarlet-like fever caused by a few related genotypes of Yersinia pseudotuberculosis, Russia. Emerg. Infect. Dis. 2016;22(3): 503–6. DOI: https://doi.org/10.3201/EID2203.150552
- Quereda J.J., Andersson C., Cossart P., et al. Role in virulence of phospholipases, listeriolysin O and listeriolysin S from epidemic Listeria monocytogenes using the chicken embryo infection model. Vet. Res. 2018;49(1):1–9. DOI: https://doi.org/10.1186/S13567-017-0496-4
- Ермолаева С.А., Зайцева Е.А., Тимченко Н.Ф., Адгамов Р.Р. Вариабельность функциональных доменов факторов инвазии как молекулярная основа полигостальности возбудителей сапронозов. Тихоокеанский медицинский журнал 2010;(4):24–8. Ermolaeva S.A., Zaitseva E.A., Timchenko N.F., Adgamov R.R. Variability of functional domains of invasion factors as molecular basis for polyhostality of sapronosis-induced microorganisms. Pacific Medical Journal. 2010;(4):24–8. EDN: https://elibrary.ru/ocqdnb
- Chalenko Y.M., Kalinin E.V., Marchenkov V.V., et al. Phylogenetically defined isoforms of Listeria monocytogenes invasion factor InlB differently activate intracellular signaling pathways and interact with the receptor gC1q-R. Int. J. Mol. Sci. 2019;20(17):4138. DOI: https://doi.org/10.3390/ijms20174138
- Chalenko Y.M., Slonova D.A., Kechko O.I., et al. Natural isoforms of Listeria monocytogenes virulence factor InlB differ in c-Met binding efficiency and differently affect uptake and survival listeria in macrophage. Int. J. Mol. Sci. 2023;24(8):7256. DOI: https://doi.org/10.3390/ijms24087256
- Phelps C.C., Vadia S., Arnett E., et al. Relative roles of listeriolysin O, InlA, and InlB in Listeria monocytogenes uptake by host cells. Infect. Immun. 2018;86(10):e00555-18. DOI: https://doi.org/10.1128/iai.00555-18
- Чаленко Я.М., Абдулкадиева М.М., Сафарова П.В. и др. Белок INLB, секретируемый Listeria monocytogenes, контролирует взаимодействие возбудителя с макрофагами. Вестник Российского государственного медицинского университета. 2022;(3):5–10. DOI: https://doi.org/10.24075/vrgmu.2022.034 Chalenko Y.M., Abdulkadieva M.M., Safarova P.V., et al. InlB protein secreted by Listeria monocytogenes controls the pathogen interaction with macrophages. Bulletin of Russian State Medical University. 2022;(3):5–10. DOI: https://doi.org/10.24075/brsmu.2022.034
Дополнительные файлы