Антибиотикочувствительность холерных вибрионов в сложных биоплёнках, сформированных на различных субстратах
- Авторы: Селянская Н.А.1, Титова С.В.1, Меньшикова Е.А.1
-
Учреждения:
- Ростовский-на-Дону противочумный институт Роспотребнадзора
- Выпуск: Том 100, № 2 (2023)
- Страницы: 188-195
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/1203
- DOI: https://doi.org/10.36233/0372-9311-268
- EDN: https://elibrary.ru/eibqqi
- ID: 1203
Цитировать
Полный текст
Аннотация
Введение. Изучение антибиотикочувствительности биоплёнок холерных вибрионов может помочь в поиске эффективных препаратов для борьбы с холерой.
Цель работы — оценить эффективность антибактериальных препаратов в отношении клеток Vibrio cholerae в составе полимикробной биоплёнки, образованной на различных субстратах.
Материалы и методы. Проводили моделирование моно- и полимикробных биоплёнок in vitro на хитине и пластике во флаконах с водопроводной автоклавированной водой, контаминированных взвесью 104 микробных клеток трёх штаммов V. cholerae О1 El Tor отдельно и в сочетании с Escherichia coli QD 5003.
Результаты. В составе моно- и полимикробных бактериальных сообществ, образованных изучаемыми штаммами на хитине или на пластике, клетки холерных вибрионов и кишечной палочки оказались менее восприимчивы к действию антибактериальных препаратов.
Заключение. Повышенная антибиотикоустойчивость биоплёнок холерных вибрионов, образованных на биотических и абиотических поверхностях, подчёркивает опасность их распространения и сохранения в окружающей среде, создаёт дополнительные проблемы в отношении использования антибиотиков и требует разработки альтернативных стратегий снижения резистентности.
Ключевые слова
Полный текст
Введение
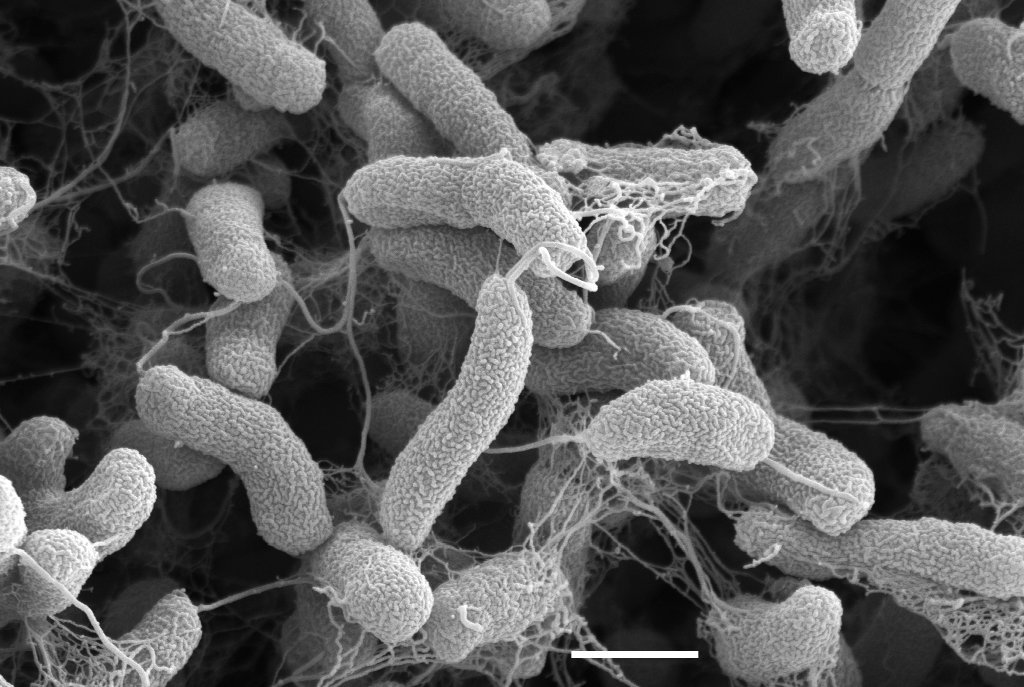
Биоплёнкообразование — важная часть жизненного цикла большинства бактерий. Холерные вибрионы могут образовывать биоплёнки на эпителии кишечника человека, что играет решающую роль в патогенезе и передаче инфекции [1]. Биоплёночные агрегаты, сформированные Vibrio cholerae в окружающей среде на биотических и абиотических поверхностях, включая хитин зоопланктона, пластик, стекло, обеспечивают сохранение и выживаемость возбудителя между эпидемическими сезонами и резко увеличивают его инфекциозность [2–4].
Последние десятилетия были отмечены значительным увеличением наших знаний о структуре, регуляции и функциях биоплёнок, о влиянии условий их формирования на происходящие в них физиологические и молекулярные процессы [5]. Доказано, что микробные сообщества, окружённые внеклеточным матриксом, по сравнению с планктонными клетками более защищены от неблагоприятных воздействий. В то же время степень этой защиты может зависеть от целого ряда факторов, включая поверхность образования и вид бактерий, формирующих биоплёнку [6, 7]. Сложные микробные взаимодействия, происходящие в смешанных поливидовых биоплёнках, наличие конкурентных взаимодействий способны изменять структурные и функциональные характеристики, химический состав биоплёнок, их подверженность дезинфицирующим средствам и антибиотикам [8]. Понимание механизмов развития сложных биоплёнок и их антибиотикочувствительности может помочь в поиске эффективных препаратов для борьбы с биоплёнкообразованием.
Цель работы — оценить эффективность антибактериальных препаратов (АБП) в отношении клеток V. cholerae в составе полимикробной биоплёнки, образованной на различных субстратах.
Материалы и методы
Для работы из Коллекции патогенных микроорганизмов Ростовского-на-Дону противочумного института Роспотребнадзора были получены штаммы: V. cholerae О1 El Tor (ctx+tcp+) №81, 19667, V. cholerae О1 El Tor (ctx–tcp–) № 20000, Escherichia coli QD 5003. Моделирование моно- и полимикробных биоплёнок in vitro проводили на фрагментах экзоскелета хитинового панциря широкопалого речного рака Astacus astacus либо пластиковых пластинках, которые помещали во флаконы с водопроводной автоклавированной водой (100 мл), контаминированные взвесью 104 микробных клеток каждого штамма или в сочетании E. coli с V. cholerae 1 : 1, способом, описанным ранее [9, 10]. Флаконы выдерживали 4 сут при 28ºС. На 5-е сутки культивирования пластинки хитина или пластика с образовавшимися биоплёнками после трёхкратного промывания в физиологическом растворе переносили в пенициллиновые флаконы, содержащие двукратные разведения АБП в жидкой питательной среде (бульон Хоттингера рН 7,7). В контрольный флакон с биоплёнкой АБП не добавляли. Через 24 ч выращивания в термостате (37ºС) делали отпечатки биоплёнок и высев по 0,1 мл планктонной культуры на пластинки с агаром Хоттингера (рН 7,7). Результат учитывали через 24 ч по наличию или отсутствию роста бактерий. Отнесение культур к чувствительным/устойчивым проводили в соответствии с МУК 4.2.2495-09, МУК 4.2.3745-22 и рекомендациями EUCAST «Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2021–01», определяя минимальные подавляющие концентрации (МПК) препаратов [11–13].
В работе использованы препараты первого (доксициклин, триметоприм/сульфаметоксазол, фуразолидон — отечественного производства, налидиксовая кислота (невиграмон, «CHINOIN Pharmaceutical and Chemical Works Private, Co. Ltd.», Венгрия) и второго ряда (тетрациклин, левомицетин (хлорамфеникол), рифампицин, стрептомицин, ампициллин — отечественного производства), рекомендуемые для определения чувствительности/устойчивости V. cholerae [11, 12].
Наличие биоплёнок в полученных образцах подтверждали по визуализации экзополисахаридного матрикса в мазках-отпечатках или непосредственно на пластинках в световом микроскопе («Carl Zeiss Microscopy») с использованием окраски конго красным и фуксином («Интерхим»).
Культуры в мазках-отпечатках биоплёнок идентифицировали по морфологии колоний, тесту на оксидазу и реакции агглютинации на стекле с О1-холерной сывороткой.
Статистическую обработку результатов определения МПК АБП проводили, вычисляя среднее арифметическое значение (М) результатов трёх повторных опытов, ошибку среднего арифметического значения (m). Различия между значениями МПК планктонных и биоплёночных культур оценивали при помощи критерия Стьюдента при уровне значимости p ≤ 0,05.
Результаты
Все исследуемые культуры на 5-е сутки культивирования образовывали биоплёнки, что подтверждает полученные ранее данные о способности V. cholerae образовывать моновидовые и сложные биоплёнки на хитине и пластике [14–17].
Все планктонные культуры штаммов V. cholerae El Tor проявляли устойчивость к триметоприму/сульфаметоксазолу и фуразолидону. Токсигенные штаммы (ctx+tcp+) V. cholerae El Tor 19667 и V. cholerae El Tor 81 дополнительно были нечувствительны к налидиксовой кислоте. Планктонные клетки E. coli были чувствительны ко всем исследуемым АБП (табл. 1).
Таблица 1. Значения МПК АБП в отношении планктонных и биоплёночных культур, образованных на разных субстратах
Table 1. The values of the MICs of antibacterial drugs against planktonic and biofilm cultures formed on different substrates
АБП Antibacterial drug | Штамм | Strain | |||||||||||||
пограничные значения МПК, мг/л# MIC limit values, mg/liter# | V. cholerae О1 El Tor 19667 | V. cholerae О1 El Tor 81 | V. cholerae О1 El Tor 20000 | E. coli QD 5003 | ||||||||||
ПК PC | БП BP | БХ BC | ПК PC | БП BP | БХ BC | ПК PC | БП BP | БХ BC | ПК PC | БП BP | БХ BC | |||
S | R | cредние значения МПК, мг/л (М ± m) | average MIC values, mg/liter (М ± m) | ||||||||||||
Доксициклин Doxycycline | ≤ 2 | ≥ 4 | 0,25*** | 4* | 4* | 0,25 | 32* | 32* | 0,5 | 16* | 16* | 0,5 | 32* | 32* |
Тетрациклин Tetracycline | ≤ 4 | ≥ 8 | 0,5 | 16* | 128*,** | 0,5 | 16* | 16* | 0,5 | 32* | 32* | 0,5 | 16* | 16* |
Левомицетин Chloramphenicol | ≤ 4 | ≥ 16 | 1,3 ± 0,3 | 128* | 64*,** | 4 | 128* | 128* | 4 | 128* | 128* | 2 | 256* | 256* |
Налидиксовая кислота Nalidixic acid | ≤ 4 | ≥ 16 | 64 | 2048* | 2048* | 64 | 1024* | 1024* | 1 | 512* | 512* | 2 | 1024* | 1024* |
Стрептомицин Streptomycin | ≤ 16 | ≥ 32 | 16 | 128* | 128* | 64 | 256* | 256* | 4 | 32* | 32* | 8 | 256* | 256* |
Ампициллин Ampicillin | ≤ 4 | ≥ 16 | 4 | 1024* | 1024* | 4 | 128* | 128* | 4 | 16* | 16* | 4 | 256* | 256* |
Рифампицин Rifampicin | ≤ 4 | ≥ 16 | 1,3 ± 0,3 | 32* | 64* | 4 | 128* | 128* | 2 | 128* | 128* | 2 | 128* | 128* |
Фуразолидон Furazolidone | ≤ 4 | ≥ 16 | 16 | 128* | 256* | 32 | 512* | 512* | 16 | 64* | 64* | 4 | 64* | 64* |
Триметоприм/ сульфаметоксазол Trimethoprim/sulfamethoxazole | ≤ 2/10 | ≥ 8/40 | 8/40 | 2048/10240* | 2048/10240* | 16/80 | 1024/5120* | 1024/5120* | 16/80 | 1024/5120* | 1024/5120* | 2/10 | 1024/5120* | 1024/5120* |
Примечание. Здесь и в табл. 2: S — чувствительный; R — устойчивый; ПК — планктонная культура; БП — биоплёнки, образованные на пластике; БХ — биоплёнки, образованные на хитине.
#Согласно МУК 4.2.2495-09, МУК 4.2.3745-22.
*p ≤ 0,05 по сравнению с ПК; **p ≤ 0,05 по сравнению с БП.
Note. Here and in the Table 2: S — sensitive; R — resistant; PC — plankton crops; BP — biofilm cultures on plastic; BC — biofilm cultures on chitin.
#According to Guidelines 4.2.2495-09 and 4.2.3745-22.
*p ≤ 0.05 when compared to PC; **p ≤ 0.05 when compared to BP.
В составе мономикробных бактериальных сообществ, независимо от субстрата образования, клетки V. cholerae и E. coli оказались менее восприимчивы к действию АБП, значения МПК которых достоверно увеличились (p ≤0,05) в сравнении со значениями для планктонных культур. До 256 раз возросли значения МПК препаратов, к которым штаммы были резистентны, а величина МПК антибиотиков, сохранявших активность в отношении планктонных культур, достигла показателей устойчивых (табл. 1). При этом уровень антибиотикоустойчивости исследуемых культур в биоплёнках, образованных на хитине и пластике, был одинаков, за исключением устойчивости к тетрациклину и левомицетину штамма V. cholerae О1 El Tor 19667, которая достоверно отличалась в 2–8 раз.
Полученные данные согласуются с наблюдениями зарубежных авторов о большей антибиотикоустойчивости штамма V. cholerae O139 MO10 (MTCC 3906) в составе биоплёнки в сравнении с его планктонной формой [18].
Антибиотикочувствительность E. coli и V. cholerae в составе сложных биоплёнок, образованных при их совместном культивировании, достоверно не отличалась от их чувствительности в моновидовых биоплёнках, полученных как на пластике, так и на хитине (табл. 2).
Таблица 2. Значения МПК АБП в отношении сложных биоплёночных культур, образованных на разных субстратах
Table 2. MICs values of antibacterial drugs against complex biofilm cultures formed on different substrates
АБП Antibacterial drug | Штамм | Strain | ||||||||||||||
пограничные значения МПК, мг/л# MIC limit values, mg/liter# | V. cholerae О1 El Tor 19667 + E. coli QD 5003 | V. cholerae О1 El Tor 81 + E. coli QD 5003 | V. cholerae О1 El Tor 20000 + E. coli QD 5003 | E. coli QD 5003 | |||||||||||
ПК PC | БП BP | БХ BC | ПК PC | БП BP | БХ BC | ПК PC | БП BP | БХ BC | ПК PC | БП BP | БХ BC | ||||
S | R | средние значения МПК, мг/л (М ± m) | аverage MIC values, mg/liter (М ± m) | |||||||||||||
Доксициклин Doxycycline | ≤ 2 | ≥ 4 | 0,25*** | 4* | 8*,*** | 0,25 | 32* | 32* | 0,5 | 16* | 16* | 0,5 | 32* | 32* | |
Тетрациклин Tetracycline | ≤ 4 | ≥ 8 | 0,5 | 16* | 128*,** | 0,5 | 16* | 16* | 0,5 | 32* | 32* | 0,5 | 16* | 16* | |
Левомицетин Chloramphenicol | ≤ 4 | ≥ 16 | 1,3 ± 0,3 | 128* | 64*,** | 4 | 128* | 128* | 4 | 128* | 128* | 2 | 256* | 256* | |
Налидиксовая кислота Nalidixic acid | ≤ 4 | ≥ 16 | 64 | 2048* | 2048* | 64 | 1024* | 1024* | 1 | 512* | 512* | 2 | 1024* | 1024* | |
Стрептомицин Streptomycin | ≤ 16 | ≥ 32 | 16 | 128* | 256* | 64 | 256* | 256* | 4 | 32* | 32* | 8 | 256* | 256* | |
Ампициллин Ampicillin | ≤ 4 | ≥ 16 | 4 | 1024* | 1024* | 4 | 128* | 128* | 4 | 16* | 16* | 4 | 256* | 256* | |
Рифампицин Rifampicin | ≤ 4 | ≥ 16 | 1,3 ± 0,3 | 32* | 64* | 4 | 128* | 128* | 2 | 128* | 128* | 2 | 128* | 128* | |
Фуразолидон Furazolidone | ≤ 4 | ≥ 16 | 16 | 128* | 256* | 32 | 512* | 512* | 16 | 64* | 64* | 4 | 64* | 64* | |
Триметоприм/ сульфаметоксазол Trimethoprim/sulfamethoxazole | ≤ 2/10 | ≥ 8/40 | 8/ 40 | 2048/10240* | 2048/10240* | 16/80 | 1024/5120* | 1024/5120* | 16/ 80 | 1024/5120* | 1024/5120* | 2/10 | 1024/5120* | 1024/5120* | |
Примечание. ***p ≤ 0,05 по сравнению с моновидовой биоплёнкой.
Note. ***p ≤ 0.05 when compared to monospecies biofilm.
Исключение составил доксициклин, значения МПК которого в отношении штамма V. cholerae О1 El Tor 19667 в сложной биоплёнке, образованной на хитине, достоверно превышали (в 2 раза) значения МПК в сложной биоплёнке, образованной этим штаммом на данном субстрате.
Подсчёт КОЕ методом истощающих мазков-отпечатков показал, что в смешанных биоплёнках преобладали клетки V. cholerae (КОЕ было больше на 1–2 порядка). Возможно, это связано с большей скоростью формирования зрелой биоплёнки у V. cholerae, чем у E. coli [19].
Обсуждение
V. cholerae в составе моно- и полимикробных сообществ, в отличие от планктонных культур, обладали более высокой резистентностью к АБП. Данные литературы свидетельствуют о меньшей чувствительности биоплёнок V. cholerae, выращенных на хитине, к воздействию факторов окружающей среды, в частности к действию простейших, в сравнении с биоплёнками, образованными на абиотических поверхностях [20], однако в нашем исследовании повышение антибиотикоустойчивости на хитине показано лишь к тетрациклину и только у одного токсигенного штамма V. cholerae. В отношении других исследованных штаммов не выявлено зависимости антибиотикоустойчивости от субстрата, на котором образовалась биоплёнка. Данный факт требует продолжения аналогичных исследований, но, по всей видимости, субстрат не является определяющим в проявлении устойчивости к антибиотикам у бактерий в биоплёночных сообществах, ведь механизмы антибиотикорезистентности в биоплёнках имеют универсальный характер и не зависят от поверхности, на которой они образованы.
Одним из механизмов повышенной устойчивости биоплёнок является трёхмерная структура экзополисахаридного матрикса, ключевыми детерминантами которой служат матричные белки RbmA, RbmC и Bap1, регулирующая проникновение различных веществ в биоплёнку [21]. Большинство клеток биоплёнки находятся в стационарном состоянии и представляют собой спящие клетки-персистеры, имеющие фенотип, отличный от планктонных клеток, и являющиеся более устойчивыми к факторам окружающей среды [22]. Экспрессия генов множественной лекарственной устойчивости внутри биоплёнки может приводить к изменению белков внешней мембраны клеток, продукции ферментов, связанных с резистентностью, изменению в деятельности насосов оттока лекарственных препаратов [23]. Другой механизм — это приобретение генов множественной лекарственной устойчивости путём горизонтального переноса, частота которого в биоплёнке выше, чем в планктонном режиме роста [24, 25]. Генетическая адаптация и эволюция, происходящие в биоплёнках, приводят к отбору субпопуляций с большей способностью противостоять текущему и будущему воздействию антибиотиков [26]. В нашем исследовании нарастание устойчивости штаммов V. cholerae к стрептомицину, триметоприму/сульфаметоксазолу и налидиксовой кислоте в биоплёночной форме при наличии резистентности к данным АБП у планктонной формы подтверждает наличие в биоплёнках наряду с классическими типами устойчивости, характерными для планктонных форм бактерий, специфических вариантов резистентности, возникающих в биоплёнках.
В полимикробных сообществах межвидовые взаимодействия могут оказывать влияние на устойчивость к антимикробным средствам, наблюдаемую в биоплёнках из одного штамма [8, 27]. Присутствие разных партнёров делает структуру и функцию сообщества более сложными. В механизм защиты включаются межвидовые сигналы, физиология клеток и генетическая пластичность, связанная со структурным пространственным расположением и архитектурной дифференциацией [28]. Из-за конкурентных взаимодействий биологические характеристики и химический состав моновидовых и полимикробных биоплёнок может сильно различаться [29, 30]. Так, присутствие комменсальной E. coli увеличивало образование биоплёнок V. cholerae на границе раздела воздух–жидкость in vitro и образование многоклеточных скоплений, похожих на биоплёнку, в фекалиях мышей [31]. Таким образом, различные виды бактерий, входящих в состав биоплёнки, могут влиять на её архитектуру и функции. В нашем исследовании в полимикробных биоплёнках, образованных V. cholerae совместно с E. coli, в сравнении с монобиоплёнками, наблюдалось повышение устойчивости одного токсигенного штамма V. cholerae к доксициклину, что свидетельствует о том, что эффективность АБП в составе полимикробных сообществ зависит не только от вида бактерий, образующих биоплёнку, но и имеет индивидуальные штаммовые особенности.
Выводы
- V. cholerae в составе биоплёнок, сформированных на биотических и абиотических поверхностях, обладают повышенной антибиотикоустойчивостью в сравнении с планктонной формой.
- Различия в антибиотикорезистентности V. cholerae в составе моновидовых и сложных биоплёнок в меньшей степени зависят от субстрата образования и в большей степени носят индивидуальный характер, связанный с конкретным штаммом, образующим биоплёнку.
Заключение
Способность V. cholerae формировать на биотических и абиотических поверхностях биоплёнки, обладающие повышенной антибиотикоустойчивостью, подчеркивает опасность их распространения и сохранения в окружающей среде, создаёт дополнительные проблемы в отношении использования антибиотиков и требует разработки альтернативных стратегий снижения резистентности. При этом следует учитывать наличие межвидовых взаимодействий в сложных сообществах, состоящих из бактерий разных видов, которые могут регулировать устойчивость биоплёнок к воздействию внешних факторов, в том числе АБП, а также штаммовые различия.
Об авторах
Надежда Александровна Селянская
Ростовский-на-Дону противочумный институт Роспотребнадзора
Автор, ответственный за переписку.
Email: ppdn@inbox.ru
ORCID iD: 0000-0002-0008-4705
к.м.н., с.н.с. отдела микробиологии холеры и других острых кишечных инфекций
Россия, Ростов-на-ДонуСветлана Викторовна Титова
Ростовский-на-Дону противочумный институт Роспотребнадзора
Email: svetatitova@bk.ru
ORCID iD: 0000-0002-7831-841X
к.м.н., в.н.с. отдела природно-очаговых инфекций
Россия, Ростов-на-ДонуЕлена Аркадьевна Меньшикова
Ростовский-на-Дону противочумный институт Роспотребнадзора
Email: super.monika2007@yandex.ru
ORCID iD: 0000-0002-6003-4283
к.б.н., с.н.с. отдела микробиологии холеры и других острых кишечных инфекций
Россия, Ростов-на-ДонуСписок литературы
- Silva A.J., Benitez J.A. Vibrio cholerae biofilms and cholera pathogenesis. PLoS Negl. Trop. Dis. 2016;10(2):e0004330. DOI: https://doi.org/10.1371/journal.pntd.0004330
- Laverty A.L., Primpke S., Lorenz C., et al. Bacterial biofilms colonizing plastics in estuarine waters, with an emphasis on Vibrio spp. and their antibacterial resistance. PLoS One. 2020;15(8):e0237704. DOI: https://doi.org/10.1371/journal.pntd.0004330
- Марков Е.Ю., Куликалова Е.С., Урбанович Л.Я. и др. Хитин и продукты его гидролиза в экологии Vibrio cholerae. Обзор. Биохимия. 2015;80(9):1334–43. Markov E.Yu., Kulikalova E.S., Urbanovich L.Yа., et al. Chitin and products of its hydrolysis in Vibrio cholerae ecology. Biochemistry (Moscow). 2015;80(9):1109–16. DOI: https://doi.org/10.1134/S0006297915090023 EDN: https://www.elibrary.ru/uzzknb
- Tamayo R., Patimalla B., Camilli A. Growth in a biofilm induces a hyperinfectious phenotype in Vibrio cholerae. Infect. Immun. 2010;78(8):3560–9. DOI: https://doi.org/10.1128/IAI.00048-10
- Sun S., Tay Q.X.M., Kjelleberg S., et al. Quorum sensing-regulated chitin metabolism provides grazing resistance to Vibrio cholerae biofilms. ISME J. 2015;9(8):1812–20. DOI: https://doi.org/10.1038/ismej.2014.265
- Rao H., Choo S., Mahalingam S.R.R., et al. Approaches for mitigating microbial biofilm-related drug resistance: a focus on micro- and nanotechnologies. Molecules. 2021;26(7):1870. DOI: https://doi.org/10.3390/molecules 26071870
- Chavez-Doza A., Gorman C., Erken M., Steinberg P.D., McDougald D., Nishiguchi M.K. Predation response of Vibrio fischeri biofilms to bacterivorus protists. Appl. Environ. Microbiol. 2013;79(2):553–58. DOI: https://doi.org/10.1128/AEM.02710-12
- Chen P., Wang J., Hong B., et al. Characterization of mixed-species biofilm formed by Vibrio parahaemolyticus and Listeria monocytogenes. Front. Microbiol. 2019;10:2543. DOI: https://doi.org/10.3389/fmicb.2019.02543
- Титова С.В., Веркина Л.М. Моделирование биопленок холерных вибрионов на твердых поверхностях (стекле и пластике) и их визуализация в световом и люминесцентном микроскопах. Клиническая лабораторная диагностика. 2016; 61(4):238–41. Titova S.V., Verkina L.M. The modeling of biofilms of comma bacillus on solid surfaces (glass and plastic) and their visualization in light and luminescent microscopes. Clinical Laboratory Diagnostics. 2016; 61(4):238–41. DOI: https://doi.org/10.18821/0869-2084-2016-61-4-238-241 EDN: https://www.elibrary.ru/vzgykd
- Способ моделирования биоплёнок, формируемых V. cholerae О1 серогрупп на поверхности хитина. Патент РФ 2018103604; 2019. A method for modeling biofilms formed by V. cholerae O1 serogroup on the chitin surface. Patent RF 2018103604; 2019.
- Методические указания МУК 4.2.2495–09. Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллёз, сап, мелиоидоз) к антибактериальным препаратам. М.; 2009. Methodological guidelines of MUC 4.2.2495–09. Determination of the sensitivity of pathogens of dangerous bacterial infections (plague, anthrax, cholera, tularemia, brucellosis, sap, melioidosis) to antibacterial drugs. Moscow; 2009.
- Методические указания МУК 4.2.3745-22. Методы лабораторной диагностики холеры. М.; 2022. Methodical instructions of the FLOUR 4.2.3745-22. Methods of laboratory diagnosis of cholera. Moscow; 2022.
- EUCAST «Определение чувствительности микроорганизмов к антимикробным препаратам. Версия 2021–01». EUCAST «Determination of the sensitivity of microorganisms to antimicrobial drugs. Version 2021–01».
- Водопьянов С.О., Веркина Л.М., Водопьянов А.С. и др. Анализ внутривидовой конкуренции в биопленке Vibrio cholerae классического и эльтор биоваров с помощью Indel-маркеров. В кн.: Молекулярная диагностика – 2017. Сборник трудов IХ Всероссийской научно-практической конференции с международным участием. М.;2017;1:300–1. Vodop'yanov S.O., Verkina L.M., Vodop'yanov A.S., et al. Analysis of intraspecific competition in the biofilm of Vibrio cholerae of classical and eltor biovars using Indel markers. In: Molecular Diagnostics – 2017. Proceedings of the IV All-Russian Scientific and Practical Conference with International Participation. Moscow; 2017;1:300–1.
- Меньшикова Е.А., Курбатова Е.М., Водопьянов С.О. и др. Межродовая конкуренция при формировании сложной биоплёнки Vibrio cholerae и аутохтонной микрофлоры водоемов на хитиновом панцире речного рака. Бактериология. 2019;4(1):50–3. Men'shikova E.A., Kurbatova E.M., Vodop'yanov S.O., et al. Intergenus competition in the formation of a complex biofilm of Vibrio cholerae and autokhtonic microflora of waters on the chitin panzer of crayfish. Bacteriology. 2019;4(1):50–3. DOI: https://doi.org/10.20953/2500-1027-2019-1-50-53 EDN: https://www.elibrary.ru/rwdhvg
- Меньшикова Е.А., Курбатова Е.М., Водопьянов С.О. и др. Оценка способности холерных вибрионов формировать биоплёнку на поверхности хитинового панциря речного рака. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(4):434–9. Men'shikova E.A., Kurbatova E.M., Vodop'yanov S.O., et al. Evaluation of the ability of cholera vibrios to form a biofilm on the surface of the chitinous shell of a crayfish by real-time PCR. Journal of Microbiology Epidemiology and Immunobiology. 2021;98(4):434–9. DOI: https://doi.org/10.36233/0372-9311-99 EDN: https://www.elibrary.ru/rvujzp
- Lutz C., Erken M., Noorian P., et al. Environmental reservoirs and mechanisms of persistence of Vibrio cholerae. Front. Microbiol. 2013;4:375. DOI: https://doi.org/10.3389/fmicb.2013.00375
- Gupta P., Mankere B., Keloth S.C., et al. Increased antibiotic resistance exhibited by the biofilm of Vibrio cholerae O139. J. Antimicrob. Chemother. 2018;73(7):1841–7. DOI: https://doi.org/10.1093/jac/dky127
- Abriat C., Enriquez K., Virgilio N., et al. Mechanical and microstructural insights of Vibrio cholerae and Escherichia coli dual-species biofilm at the air-liquid interface. Colloids Surf. B Biointerfaces. 2020;188:110786. DOI: https://doi.org/10.1016/j.colsurfb.2020.110786
- Chavez-Dozal A., Gorman C., Erken M., et al. Predation response of Vibrio fischeri biofilms to bacterivorus protists. Appl. Environ. Microbiol. 2013;79(2):553–8. DOI: https://doi.org/10.1128/AEM.02710-12
- Giacomucci S., Cros C.D., Perron X., et al. Flagella-dependent inhibition of biofilm formation by sub-inhibitory concentration of polymyxin B in Vibrio choleraе. PLoS One. 2019;14(8):e0221431. DOI: https://doi.org/10.1371/journal.pone.0221431
- Zhang K., Li X., Yu C., Wang Y. Promising therapeutic strategies against microbial biofilm challenges. Front. Cell. Infect. Microbiol. 2020;10:359. DOI: https://doi.org/10.3389/fcimb.2020.00359
- Kean R., Delaney C., Sherry L., et al. Transcriptome assembly and profiling of Candida auris reveals novel insights into biofilm-mediated resistance. mSphere. 2018;3(4):00334-18. DOI: https://doi.org/10.1128/mSphere.00334-18
- Laverty A.L., Primpke S., Lorenz C., et al. Bacterial biofilms colonizing plastics in estuarine waters, with an emphasis on Vibrio spp. and their antibacterial resistance. PLoS One. 2020;5(8):e0237704. DOI: https://doi.org/10.1371/journal.pone.0237704
- Virolle C., Goldlust K., Djermoun S., et al. Plasmid transfer by conjugation in gram-negative bacteria: from the cellular to the community level. Genes (Basel). 2020;11(11):1239. DOI: https://doi.org/10.3390/genes11111239
- Penesyan A., Paulsen I.T., Gillings M.R., et al. Secondary effects of antibiotics on microbial biofilms. Front. Microbiol. 2020;11:2109. DOI: https://doi.org/10.3389/fmicb.2020.02109
- Sanchez-Vizuete P., Orgaz B., Aymerich S., et al. Pathogens protection against the action of disinfectants in multispecies biofilms. Front. Microbiol. 2015;6:705. DOI: https://doi.org/10.3389/fmicb.2015.00705
- Giaouris E., Heir E., Desvaux M., et al. Intra- and inter-species interactions within biofilms of important foodborne bacterial pathogens. Front. Microbiol. 2015;6:841. DOI: https://doi.org/10.3389/fmicb.2015.00841
- Liu W. Z., Russel J., Burmolle M., et al. Micro-scale intermixing: a requisite for stable and synergistic co-establishment in a four-species biofilm. ISME J. 2018;12(8):1940–51. DOI: https://doi.org/10.1038/s41396-018-0112-2
- Ramirez-Mora T., Retana-Lobo C., Valle-Bourrouet G. Biochemical characterization of extracellular polymeric substances from endodontic biofilms. PLoS One. 2018;13(11):e0204081. DOI: https://doi.org/10.1371/journal.pone.0204081
- Wang H., Li F., Xu L., et al. Contributions of Escherichia coli and its motility to the formation of dual-species biofilms with Vibrio cholerae. Appl. Environ. Microbiol. 2021;87(18):e0093821. DOI: https://doi.org/10.1128/aem.00938-21
Дополнительные файлы