Структура ESKAPE-патогенов, изолированных от пациентов отделения реанимации и интенсивной терапии новорождённых Национального госпиталя педиатрии г. Ханой, Социалистическая Республика Вьетнам
- Авторы: Степанова Т.Ф.1, Катаева Л.В.1, Посоюзных О.В.1, Богун А.Г.2, Кисличкина А.А.2, Tran T.N.3
-
Учреждения:
- Тюменский научно-исследовательский институт краевой инфекционной патологии Роспотребнадзора
- Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора
- Совместный Российско-Вьетнамский тропический научно-исследовательский и технологический центр (Тропический центр)
- Выпуск: Том 100, № 2 (2023)
- Страницы: 168-177
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/11141
- DOI: https://doi.org/10.36233/0372-9311-329
- EDN: https://elibrary.ru/aamnei
- ID: 11141
Цитировать
Аннотация
Введение. Заболеваемость инфекциями, связанными с оказанием медицинской помощи, является одной из глобальных мировых проблем на современном этапе развития здравоохранения и затрагивает все страны вне зависимости от их экономического статуса. Основными возбудителями этих инфекций являются патогены группы ESKAPE.
Цель исследования — изучить структуру, молекулярные и антигенные характеристики ESKAPE-патогенов, выделенных со слизистых зева и ануса пациентов отделения реанимации и интенсивной терапии новорождённых (ОРИТН), для установления их этиологического значения в возникновении инфекций, связанных с оказанием медицинской помощи.
Материалы и методы. Обследовано 49 детей, в том числе 40 новорождённых, пациентов ОРИТН Национального госпиталя педиатрии г. Ханой. Посев биоматериала (мазки со слизистых зева, ректальные мазки) и выделение бактериальных культур осуществлялись классическим бактериологическим методом. Идентификация изолятов проведена методом масс-спектрометрии. Штаммы Klebsiella pneumoniae изучены методом полногеномного секвенирования.
Результаты. Группа грамположительных ESKAPE-патогенов, идентифицированных со слизистой зева, представлена изолятами Enterococcus faecium и Staphylococcus aureus. Среди изолятов семейства Enterobacteriaceae выделены K. pneumoniae, Escherichia coli, Enterobacter cloacae; в группе неферментирующих грамотрицательных бактерий — Pseudomonas aeruginosa, Acinetobacter baumannii. Структура ESKAPE-патогенов, персистирующих на слизистой ануса, характеризовалась преобладанием бактерий Enterococcus spp., E. coli, K. pneumoniae и P. aeruginosa. Результаты полногеномного секвенирования изолятов K. pneumoniae выявили 7 кластеров и 8 сиквенс-типов. Преимущественно определены ST14 и ST1741 — по 25% соответственно от количества исследованных штаммов. Молекулярное серотипирование установило, что по О-антигену штаммы отнесены в основном к серотипам O1v1, О1/О2v2, O5; по наличию капсульного антигена — к серотипам KL2, KL104, KL60.
Заключение. Исследование структуры ESKAPE-патогенов, изолированных со слизистых зева и ануса пациентов ОРИТН Национального госпиталя педиатрии г. Ханой, выявили этиологически значимых возбудителей бактериальных инфекций: S. aureus, K. pneumoniae, E. coli, E. cloacae, P. aeruginosa, A. baumannii. Проведение молекулярно-генетических исследований штаммов K. pneumoniae, циркулирующих одновременно на слизистых нескольких пациентов отделения, позволило установить их гомологию, что указывает на контаминацию детей госпитальными штаммами при оказании медицинской помощи.
Полный текст
Введение
Возникновение бактериальных инфекций новорождённых связано с действием множества факторов риска. Многообразие клинических форм инфекций детей обусловлено, прежде всего, несовершенством естественных барьерных функций организма, тем более на фоне антибактериальной терапии [1]. Уровень инфекционной заболеваемости определяется в основном частотой поражения кожи, глаз, пупка и желудочно-кишечного тракта. В этой связи в учреждениях родовспоможения мониторинг циркулирующих ESKAPE-патогенов особенно важен, поскольку в силу физиологического статуса новорождённых повышается риск развития бактериальных заболеваний [2, 3].
Широкое распространение инфекций, связанных с оказанием медицинской помощи (ИСМП), в медицинских организациях различного профиля, в первую очередь акушерского и педиатрического, наносит значительный ущерб здоровью новорождённых и населения в целом, экономике и демографической ситуации в разных странах [4, 5]. Приводимые в отечественной и зарубежной литературе показатели случаев внутрибольничных инфекций новорождённых часто не сопоставимы из-за отсутствия общих подходов в организации системы учёта и регистрации заболеваний [6, 7].
Распространение мультирезистентных нозокомиальных патогенов, провоцирующих инфекционные осложнения у детей, вызывает обеспокоенность клиницистов по всему миру. Среди этиологически значимых бактерий в настоящее время определяют группу видов ESKAPE, к которым относят Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa и Enterobacter spp. Доминирующие позиции среди этих возбудителей госпитальных инфекций занимают патогены, для которых характерно разнообразие механизмов резистентности к противомикробным препаратам. ESKAPE-патогены отнесены Всемирной организацией здравоохранения в группу микроорганизмов важнейшей приоритетности для разработки новых антибиотиков или новых способов лечения [8].
Оценка случаев внутрибольничных инфекций, особенно среди детей в странах с низким и средним уровнем дохода, недостаточно известна, и в большинстве случаев нет опубликованных данных. Европейское многоцентровое исследование случаев внутрибольничных инфекций в педиатрических стационарах показало их распространённость от 2,5% в отделениях общего профиля до 23,6% в отделениях интенсивной терапии. Высокие показатели этих инфекций также были зарегистрированы в отделениях интенсивной терапии новорождённых, распространённость была в 3–20 раз выше в условиях ограниченных ресурсов по сравнению со странами с высоким уровнем дохода населения.
Вьетнам — страна с низким уровнем дохода и быстро растущим государственным и частным сектором здравоохранения. Низкие показатели валового национального дохода и общегосударственных расходов на здравоохранение на душу населения приводят к тому, что около 80% расходов оплачиваются пациентами. В обществе широко используются антибиотики, которые в основном приобретаются в частных аптеках и клиниках. Сектор здравоохранения перегружен при относительно низкой численности медицинского персонала на душу населения (7 врачей на 10 000 населения), переполненности больничных коек до 170%. Во Вьетнаме нет национальной системы эпидемиологического надзора за ИСМП, а данные о случаях в отделениях интенсивной терапии ограниченны. В сочетании с высоким уровнем инфекционной заболеваемости это делает Вьетнам «очагом» устойчивости к противомикробным препаратам с одними из самых высоких показателей в Азии [9–11].
В ранее проведённых расследованиях случаев внутрибольничных инфекций в отделениях интенсивной терапии 3 вьетнамских педиатрических больниц отмечалось, что распространённость их составила 33% [9]. Одним из ведущих возбудителей нозокомиальных инфекций являются бактерии K. pneumoniae, обладающие способностью приобретать устойчивость к антимикробным препаратам [11–13]. Результаты молекулярно-генетических исследований штаммов бактерий, циркулирующих одновременно в конкретном отделении определённой медицинской организации, свидетельствуют об их высокой гетерогенности. Актуален вопрос о проведении мероприятий, направленных на предупреждение формирования высоковирулентных и резистентных штаммов, а также ограничение их распространения [14].
Изучение структуры ESKAPE-патогенов, контаминирующих новорождённых детей, в том числе недоношенных, получающих лечение в отделениях реанимации и интенсивной терапии (ОРИТН), является актуальной проблемой медицинских организаций как в России, так и в других странах, её решение будет способствовать минимизации рисков развития неблагоприятных эпидемиологических ситуаций.
Цель исследования — изучить структуру, молекулярные и антигенные характеристики ESKAPE-патогенов, выделенных со слизистых зева и ануса пациентов ОРИТН, для установления их этиологического значения в возникновении ИСМП.
Исследования проводились в соответствии с НИР ФБУН ТНИИКИП Роспотребнадзора во исполнение Плана мероприятий по оказанию научно-методической и материально-технической поддержки Социалистической Республике Вьетнам в области противодействия угрозам инфекционных болезней и минимизации рисков, связанных с опасными для здоровья химическими веществами, в 2020–2022 гг.1
Материалы и методы
В исследование включены 49 детей в возрасте 0–60 дней, в том числе 40 новорождённых (медиана показателя составила 13 дней; Q1–Q3: 7–23), получавших лечение в ОРИТН Национального госпиталя педиатрии г. Ханой. Образцы биоматериала отбирались одномоментно у всех детей вне зависимости от возраста, способа родоразрешения, степени недоношенности, массы тела при рождении, типа вскармливания, длительности пребывания в отделении, антибиотикотерапии (метод случайной выборки). Исследование проводилось при добровольном информированном согласии представителей пациентов. Протокол исследования одобрен Этическим комитетом Тюменского научно-исследовательского института краевой инфекционной патологии Роспотребнадзора (протокол № 1 от 01.06.2022).
Проведено бактериологическое исследование 98 образцов биоматериала, отобранных со слизистых зева и анального отверстия детей, рост микроорганизмов регистрировался в 96 пробах. Со слизистой зева обследованных детей выделен 101 изолят, со слизистой ануса — 137. Штаммы K. pneumoniae (n = 20), изолированные из исследованных локусов, изучены методом полногеномного секвенирования.
Микробиологические исследования проводились классическим бактериологическим методом. Видовую идентификацию бактерий подтверждали методом масс-спектрометрии с матрично-активированной лазерной десорбцией/ионизацией с использованием программного обеспечения «Maldi BioTyper 3.0». Уровень идентификации выше 2.0 свидетельствовал о высокой достоверности.
Полученные единичные прочтения для каждого штамма были собраны в контиги при помощи программы «Unicycler v.0.4.7». Образцы с величиной средних покрытий геномов выше 200 свидетельствовали о достаточном объёме данных. Обработка результатов полногеномного секвенирования проводилась с помощью программного обеспечения анализа метагеномных образцов «Kraken Metagenomics version 2» (классификатор ридов — коротких нуклеотидных последовательностей). Филогенетические исследования осуществляли в программе «Wombac 2.0», которая позволяла находить коровые однонуклеотидные полиморфизмы (SNP) в нуклеотидных последовательностях и производить выравнивание этих полиморфизмов. Для определения О-антигенов и капсульных антигенов штаммов K. pneumoniae использовали сервер «Kaptive». Сиквенс-типы определяли с использованием сервера MLST 2.02 и программы «Lasergene».
Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов были реализованы в электронных таблицах «Microsoft Office Excel 2016». Для анализа полученных данных применяли методы статистической обработки с применением программы «SPSS v. 22». Номинальные данные описывали с указанием абсолютных значений и процентных долей с указанием 95% доверительных интервалов (ДИ) — метод Клоппера–Пирсона.
Результаты
Результаты бактериологического исследования слизистых зева и анального прохода детей свидетельствуют о том, что выделенные изоляты представлены грамположительными и грамотрицательными бактериями, а также незначительным количеством грибов рода Candida. Группу грамположительных бактерий (27,3% [95% ДИ 21,7–33,4]) составили бактерии родов Staphylococcus (S. aureus и другие виды), Streptococcus (преимущественно S. vestibularis, S. salivarius) и Enterococcus faecalis. Грамотрицательные изоляты представлены бактериями Enterobacterales (41,6% [95% ДИ 35,3–48,1]) и неферментирующими грамотрицательными бактериями (22,7% [95% ДИ 17,5–28,5]). Среди представителей Enterobacterales идентифицированы бактерии родов: Escherichia, Klebsiella, Serratia, Enterobacter; кластер неферментирующих грамотрицательных бактерий составляли Acinetobacter spp., Pseudomonas spp., Stenotrophomonas maltophilia и Elizabethkingia meningoseptica. В структуре изолятов исследуемых локусов отмечено преобладание бактерий Enterobacterales. Грибы рода Candida составили 8,4% (95% ДИ 5,2–12,7).
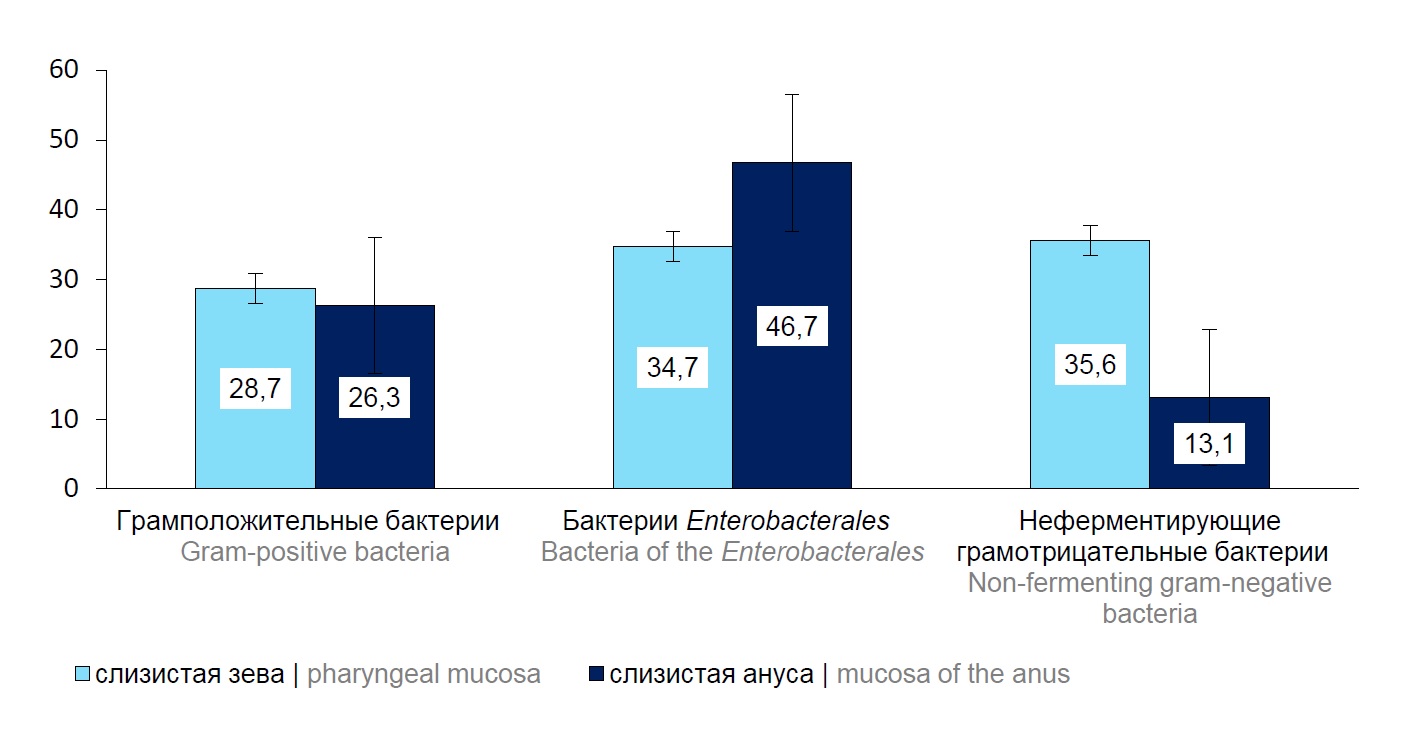
Характеристика количества выявленных изолятов указанных локусов определила незначительное преобладание бактерий Enterobacterales на слизистой анального прохода. На слизистой зева детей неферментирующие грамотрицательные бактерии идентифицировались в 35,6% случаев (95% ДИ 26,4–45,8), в отличие от частоты выделения их со слизистой ануса — 13,1% (95% ДИ 8,0–19,9) (рис. 1). Группы грамположительных бактерий, выделенных со слизистых зева и ануса, обнаруживались практически в равных долях.
Рис. 1. Частота обнаружения изолятов основных групп бактерий на слизистых зева и анального прохода детей, %.
Среди общего количества идентифицированных изолятов, выделенных из указанных локусов, к группе ESKAPE-патогенов отнесено 51,7% (95% ДИ 45,1–58,2) штаммов: S. aureus, K. pneumoniae, E. coli, E. cloacae, P. aeruginosa, A. baumannii. Сравнительная характеристика структуры бактерий этой группы, идентифицированных из образцов биоматериала со слизистых зева и анального прохода детей, представлена на рис. 2.
Рис. 2. Сравнительная характеристика бактерий группы ESKAPE-патогенов, выделенных со слизистых зева и анального прохода детей, %.
Таким образом, анализ изолятов группы ESKAPE, выделенных со слизистой зева, выявил преобладание в этом локусе бактерий семейства Enterobacteriaceae и неферментирующих грамотрицательных бактерий. Наряду с этим на слизистых зева обследованных детей были идентифицированы Streptococcus viridans и коагулазонегативные Staphylococcus spp., которые являются резидентной микробиотой зева.
Анализ бактериологического исследования образцов биологического материала пациентов показал, что доминирующее положение в микробиоте слизистой зева и прямой кишки в 51,9% случаев занимали бактерии K. pneumoniae. Результаты полногеномного секвенирования штаммов K. pneumoniae, изолированных со слизистой зева (9) и прямой кишки (11), свидетельствуют о том, что отобранные штаммы разделились на семь генетических кластеров. В кластер I вошли штаммы K. pneumoniae 39, 51, 57, 85 (выделенные со слизистой зева) и 42, 56, 96 (со слизистой прямой кишки). Структурный анализ коровых SNP-геномов штаммов K. pneumoniae кластера I показал деление его на две группы с отличием значения геномов друг от друга чуть более 10 000 SNP. Первая группа представлена штаммами 39, 42, 51, 56, 57, а вторая — 85, 96. Результат попарного сравнения сборок контигов представлен в табл. 1. Анализ коровых SNP первой группы штаммов выявил, различие их не более чем на 55, что подтверждает высокую гомологию этих изолятов.
Таблица 1. Результат сравнения сборок контигов штаммов K. pneumoniae, входящих в кластер I
SNP-dists 0.6.3 | Штамм 85 Strain 85 | Штамм 96 Strain 96 | Штамм 51 Strain 51 | Штамм 56 Strain 56 | Штамм 57 Strain 57 | Штамм 39 Strain 39 |
K. pneumoniae 96 | 19 | |||||
K. pneumoniae 51 | 10987 | 10987 | ||||
K. pneumoniae 56 | 10997 | 10993 | 52 | |||
K. pneumoniae 57 | 10980 | 10980 | 17 | 55 | ||
K. pneumoniae 39 | 10986 | 10984 | 15 | 55 | 16 | |
K. pneumoniae 42 | 10986 | 10986 | 11 | 51 | 8 | 10 |
Кластер II сформировали штаммы 91, 49 (со слизистой зева) и 92, 50, 66 (со слизистой прямой кишки); кластер III — штаммы 53 (со слизистой зева) и 54, 68 (со слизистой прямой кишки). Кластеры IV, V, VI, VII представлены единичными штаммами 74 и 82 (со слизистой прямой кишки) и штаммами 59, 31 (со слизистой зева). Молекулярное серотипирование по О- и капсульному антигенам установило, что каждый кластер штаммов K. pneumoniae отнесен к определённому серотипу (табл. 2). По О-антигену все штаммы кластера I и VII отнесены к серотипу Olvl. Штаммы кластера II по О-антигену имели некоторые различия и причислены к Ol/O2v2 и Olv2, также штамм кластера V. Кластеры III и IV определяли штаммы, содержащие антиген О5. В кластер VI отнесли штамм с антигеном О3b.
Таблица 2. Результаты молекулярного серотипирования штаммов K. pneumoniae
Название штамма Name of the strain | KL-антиген | KL-antigen | О-антиген | О-antigen | Кластер | Cluster |
K. pneumoniae 39 | KL2 | Olvl | I |
K. pneumoniae 42 | KL2 | Olvl | |
K. pneumoniae 51 | KL2 | Olvl | |
K. pneumoniae 56 | KL2 | Olvl | |
K. pneumoniae 57 | KL2 | Olvl | |
K. pneumoniae 85 | KL112 | Olvl | |
K. pneumoniae 96 | KL112 | Olvl | |
K. pneumoniae 92 | KL104 | Ol/O2v2 | II |
K. pneumoniae 50 | KL104 | Ol/O2v2 | |
K. pneumoniae 66 | KL104 | Olv2 | |
K. pneumoniae 49 | KL104 | Ol/O2v2 | |
K. pneumoniae 91 | KL104 | Ol/O2v2 | |
K. pneumoniae 68 | KL60 | O5 | III |
K. pneumoniae 54 | KL60 | O5 | |
K. pneumoniae 53 | KL60 | O5 | |
K. pneumoniae 74 | KL114 | O5 | IV |
K. pneumoniae 59 | KL62 | Olv2 | V |
K. pneumoniae 82 | KL128 | O3b | VI |
K. pneumoniae 31 | KL62 | Olvl | VII |
K. pneumoniae 95 | – | – | – |
Примечание. Штамм 95 — не серотипируемый по О-антигену и КL-антигену.
Анализ капсульного антигена (KL) показал, что штаммы всех кластеров характеризуются однородностью, исключение составляет кластер I, в котором 5 штаммов K. pneumoniae отнесены к серотипу КL2 и 2 — к КL112.
Мультилокусное сиквенс-типирование установило, что штаммы определённого кластера относились к одному сиквенс-типу (ST), кроме кластера I, разделившегося на ST14 и ST15. Характеризуя гомологию штаммов по кластерам, определили, что генотипы во всех кластерах оказались идентичными по локусам tonB, rpoB, phoE, pgi, mdh, gapA, отличия регистрировались только в кластере I, локусе infB (табл. 3).
Таблица 3. Результаты мультилокусного сиквенс-типирования штаммов K. pneumoniae
Название штамма Name of the strain | Сиквенс-тип Sequence type | Локусы | Loci | Кластер Cluster | ||||||
tonB | rpoB | phoE | pgi | mdh | gapA | infB | |||
K. pneumoniae 39 | 14 | 1 | 1 | 1 | 1 | 1 | 1 | 6 | I |
K. pneumoniae 42 | 14 | 1 | 1 | 1 | 1 | 1 | 1 | 6 | |
K. pneumoniae 51 | 14 | 1 | 1 | 1 | 1 | 1 | 1 | 6 | |
K. pneumoniae 56 | 14 | 1 | 1 | 1 | 1 | 1 | 1 | 6 | |
K. pneumoniae 57 | 14 | 1 | 1 | 1 | 1 | 1 | 1 | 6 | |
K. pneumoniae 85 | 15 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
K. pneumoniae 96 | 15 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
K. pneumoniae 92 | 1741 | 42 | 4 | 17 | 1 | 4 | 2 | 3 | II |
K. pneumoniae 50 | 1741 | 42 | 4 | 17 | 1 | 4 | 2 | 3 | |
K. pneumoniae 66 | 1741 | 42 | 4 | 17 | 1 | 4 | 2 | 3 | |
K. pneumoniae 49 | 1741 | 42 | 4 | 17 | 1 | 4 | 2 | 3 | |
K. pneumoniae 91 | 1741 | 42 | 4 | 17 | 1 | 4 | 2 | 3 | |
K. pneumoniae 68 | 1224 | 169 | 38 | 142 | 63 | 26 | 18 | 67 | III |
K. pneumoniae 54 | 1224 | 169 | 38 | 142 | 63 | 26 | 18 | 67 | |
K. pneumoniae 53 | 1224 | 169 | 38 | 142 | 63 | 26 | 18 | 67 | |
K. pneumoniae 74 | 3918, 1928, 4038 | 124 | 17 | 41 | 33 | 21 | 28 | 18 | IV |
K. pneumoniae 59 | 730 | 56 | 4 | 1 | 1 | 33 | 2 | 1 | V |
K. pneumoniae 82 | 16 | 4 | 4 | 4 | 1 | 2 | 2 | 1 | VI |
K. pneumoniae 31 | 48 | 10 | 1 | 7 | 2 | 2 | 2 | 5 | VII |
K. pneumoniae 95 | – | – | – | – | – | – | – | – | – |
Обсуждение
Обследованные дети являлись пациентами отделения интенсивной терапии крупного специализированного педиатрического центра и преимущественно были недоношенными. Степень недоношенности новорождённых обусловлена перинатальными факторами риска: способа родов, гестационного возраста, масса тела при рождении, асфиксии, респираторного дистресс-синдрома или врождённых пороков развития. Эти данные не были предоставлены для анализа, вместе с тем они имеют отношение к предрасположенности контаминации слизистых у детей патогенами группы ESKAPE, циркулирующими в данном отделении, и развитию бактериальных заболеваний.
Результаты проведённых исследований слизистых зева и прямой кишки пациентов ОРИТН Национального госпиталя педиатрии г. Ханой выявили большое разнообразие циркулирующих бактерий группы ESKAPE, являющихся этиологически значимыми возбудителями бактериальных инфекций, в том числе ИСМП. Важно подчеркнуть, что изоляты со слизистой прямой кишки K. pneumoniae и P. aeruginosa относятся к ESKAPE — патогенам высокого уровня опасности — и являются основной причиной внутрибольничных инфекций у пациентов с ослабленным иммунитетом [15, 16]. Вместе с тем бактерии Enterococcus spp. и E. coli являются важной составной частью микробиоты толстой кишки [13, 17].
Единичные публикации, свидетельствующие о случаях ИСМП в отделениях интенсивной терапии вьетнамских детских больниц, указывают на то, что наиболее частым возбудителем, выделенным от пациентов, являются бактерии K. pneumoniae. Распространение госпитальных штаммов этих бактерий, отличающихся широким спектром генетических комплексов вирулентности и резистентности, характеризуется преобладанием в медицинских стационарах Европы, США, Восточной и Юго-Восточной Азии [18–21].
Применение молекулярно-генетических методов исследования микробиома выявляет патогенный потенциал микробных сообществ, обитающих в определенных нишах. Полисахаридная цепочка, входящая в структуру наружной мембраны K. pneumoniae, обладает антигенными свойствами и служит признаком для разделения их на О-серотипы. По О-антигену все штаммы семи кластеров имели некоторые различия и отнесены к серотипам О1v1, Ol/O2v2 и Olv2, О3b и О5. При этом 70% штаммов имели антигены серотипа О1. Имеются данные о том, что серотипы О1, О2, О3 являются наиболее распространенными и обнаруживаются в 80% случаев инфекций, вызванных бактериями K. pneumoniae [22]. Анализ капсульного антигена показал, что штаммы всех кластеров также характеризовались разнообразием, выявлены серотипы КL2, КL60, КL62, КL104, КL112, КL114 и КL128. Серотипы КL2 и КL104 определены у половины штаммов (по 25 % соответственно). В клинической практике выделяют гипервирулентные серотипы КL1 и КL2. Известно, что они обладают гипермукоидным фенотипом и ассоциируются с особо тяжелым течением клебсиеллезной инфекции [23].
Мультилокусное сиквенс-типирование установило гомологию штаммов по кластерам, генотипы во всех кластерах оказались идентичными по локусам tonB, rpoB, phoE, pgi, mdh, gapA, отличия регистрировались в локусе infB. Выявлено преобладание сиквенс-типов ST14, ST1741 и ST1224. Кроме того, два штамма отнесены к сиквенс-типу ST15. Имеются указания на распространенность в Восточной Азии штаммов ST11, а также ST15, который встречается реже, тем не менее во всем мире о нем сообщается как об источнике больничных вспышек резистентной K. pneumoniae [12, 20]. В литературе описано, что эпидемиологическое неблагополучие в педиатрических стационарах связано с циркуляцией штаммов K. pneumoniae сиквенс-типов ST17, ST3181 и ST1564 [24].
Таким образом, проведенные молекулярно-генетические исследования свидетельствуют о том, что госпитальная популяция изолятов K. pneumoniae характеризовалась циркуляцией гомологичных штаммов одновременно на слизистых нескольких пациентов отделения, что указывает на контаминацию ими новорожденных при оказании медицинской помощи. Изучение не только видового состава циркулирующих микроорганизмов, но и полногеномное секвенирование, серотипирование и мультилокусное сиквенс-типирование, определение генетических маркеров потенциала патогенности штаммов позволят эффективно идентифицировать возбудителей ИСМП.
Этиологическая структура инфекций, в том числе ИСМП, как известно, зависит от условий каждого конкретного отделения медицинской организации. Учитывая такую тенденцию, становится очевидной необходимость постоянного наблюдения за циркуляцией патогенов группы ESKAPE, не только в случае регистрации проявления бактериальной инфекции, но и в плановом порядке [26]. Внедрение системы микробиологического мониторинга ESKAPE-патогенов, основанное на молекулярно-генетических исследованиях, позволит эффективно выявлять возбудителей ИСМП, прогнозировать эпидемиологическую ситуацию при оказании медицинской помощи новорождённым.
Этическое утверждение. Исследование выполнено при добровольном информированном согласии законных представителей несовершеннолетних пациентов. Протокол исследования одобрен Этическим комитетом Тюменского научно-исследовательского института краевой инфекционной патологии» Роспотребнадзора (протокол № 1 от 01.06.2022).
1 Распоряжение Правительства Российской Федерации от 13.07.2019 № 1536-р.
2 Multi-Locus Sequence Typing.
URL: https://cge.cbs.dtu.dk/services/MLST
Об авторах
Татьяна Федоровна Степанова
Тюменский научно-исследовательский институт краевой инфекционной патологии Роспотребнадзора
Email: info@tniikip.rospotrebnadzor.ru
ORCID iD: 0000-0002-6289-6274
д.м.н., проф., директор
Россия, ТюменьЛюбовь Владимировна Катаева
Тюменский научно-исследовательский институт краевой инфекционной патологии Роспотребнадзора
Автор, ответственный за переписку.
Email: info@tniikip.rospotrebnadzor.ru
ORCID iD: 0000-0001-9966-8454
д.м.н., г.н.с., зав. бактериологической лабораторией
Россия, ТюменьОльга Викторовна Посоюзных
Тюменский научно-исследовательский институт краевой инфекционной патологии Роспотребнадзора
Email: info@tniikip.rospotrebnadzor.ru
ORCID iD: 0000-0002-4364-9868
биолог бактериологической лаборатории
Россия, ТюменьАлександр Геннадьевич Богун
Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора
Email: info@tniikip.rospotrebnadzor.ru
ORCID iD: 0000-0001-5454-2495
к.б.н., зав. отделом коллекционных культур
Россия, ОболенскАнгелина Александровна Кисличкина
Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора
Email: info@tniikip.rospotrebnadzor.ru
ORCID iD: 0000-0001-8389-2494
к.б.н., с.н.с. отдела коллекционных культур
Россия, ОболенскThi Nhai Tran
Совместный Российско-Вьетнамский тропический научно-исследовательский и технологический центр (Тропический центр)
Email: info@tniikip.rospotrebnadzor.ru
ORCID iD: 0009-0003-1892-3241
н.с.
Вьетнам, ХанойСписок литературы
- Мухамедова Ш.Т., Шамсутдинов А.С., Хамраева Д.Р., Кароматова Ф.А. Внутрибольничная инфекция у новорождённых детей. Биология и интегративная медицина. 2021;(3):75–86. Mukhamedova Sh.T., Shamsutdinov A.S., Khamraeva D.R., Karomatova F.A. Nosocomial infections in newborns. Biologiya i integrativnaya meditsina. 2021;(3):75–86. EDN: https://www.elibrary.ru/eosqum
- Никитина И.В., Герасимова А.В., Иванова Л.А. и др. Инфекции, ассоциированные с оказанием медицинской помощи, у критически больных недоношенных новорожденных: эпидемиология, клиническая картина и диагностика в современных условиях. Неонатология: новости, мнения, обучение. 2020;8(3):7–17. Nikitina I.V., Gerasimova A.V., Ivanova L.A., et al. Health care-associated infections in critically ill premature newborns: epidemiology, clinical features and diagnostics in modern conditions. Neonatology: News, Opinions, Training. 2020;8(3):7–17. DOI: https://doi.org/10.33029/2308-2402-2020-8-3-7-17 EDN: https://www.elibrary.ru/ikcmfj
- Martin R.M., Bachman M.A. Colonization, infection, and the accessory genome of Klebsiella pneumoniae. Front. Cell. Infect. Microbiol. 2018;8:4. DOI: https://doi.org/10.3389/fcimb.2018.00004
- Богданова Н.М. Предупреждение внутрибольничной инфекции в родовспомогательных учреждениях при организации грудного вскармливания. Медицина: теория и практика. 2019;4(1):132–7. Bogdanova N.M. Prevention of intrabolichic infection in general supporting institutions at the organization of breastfeeding. Medicine: Theory and Practice. 2019;4(1):132–7. EDN: https://www.elibrary.ru/klykty
- Иванова М.В., Миндлина А.Я., Полибин Р.В., Ушанова А.В. Эпидемиологические особенности внутриутробных и внутрибольничных инфекций новорождённых в Российской Федерации. Инфекция и иммунитет. 2019;9(1):193–202. Ivanova M.V., Mindlina A.Ya., Polibin R.V., Ushanova A.V. Russia-wide epidemiological survey of congenital and nosocomial infections in newborns. Russian Journal of Infection and Immunity. 2019;9(1):193–202. DOI: https://doi.org/10.15789/2220-7619-2019-1-193-202 EDN: https://www.elibrary.ru/zgxqvf
- Найговзина Н.Б., Попова А.Ю., Бирюкова Е.Е. и др. Оптимизация системы мер борьбы и профилактики инфекций, связанных с оказанием медицинской помощи в Российской Федерации. ОРГЗДРАВ: новости, мнения, обучение. Вестник ВШОУЗ. 2018;(1):17–26. Naigovzina N.B., Popova A.Yu., Biryukova E.E., et al. Optimization of the system of measures to control and prevent infections associated with the provision of medical care in the Russian Federation. Healthcare Management: News, Views, Education. Bulletin of VSHOUZ. 2018;(1):17–26. EDN: https://www.elibrary.ru/yusipb
- Наумкина Е.В., Пахалкова Е.В., Пядочкина Т.В., Абросимова О.А. Микробиологический мониторинг в отделениях перинатального центра. Мать и дитя в Кузбассе. 2018;(1):23–7. Naumkina E.V., Pakhalkova E.V., Pyadochkina T.V., Abrosimova O.A. Microbiological monitoring in the departments of the perinatal center. Mother and Baby in Kuzbass. 2018;(1):23–7. EDN: https://www.elibrary.ru/yopgqq
- Ярец Ю.И. Патогенный потенциал бактерий группы ESKAPE, выделенных из ран: характеристика фено- и генотипических маркеров и возможность их практического применения. Журнал Гродненского государственного медицинского университета. 2022;20(4):400–13. Yarets Yu.I. Pathogenic potential of ESKAPE group bacteria isolated from wounds: characterization of phenotypic and genotypic markers and possibility of their practical application. Journal of the Grodno State Medical University. 2022;20(4):400–13. DOI: https://doi.org/10.25298/2221-8785-2022-20-4-400-413 EDN: https://www.elibrary.ru/vtsale
- Le N.K., Hf W., Vu P.D., et al. High prevalence of hospital-acquired infections caused by gram-negative carbapenem resistant strains in Vietnamese pediatric ICUs: A multi-centre point prevalence survey. Medicine (Baltimore). 2016;95(27):e4099. DOI: https://doi.org/10.1097/md.0000000000004099
- Berglund B., Hoang N.T.B., Lundberg L., et al. Clonal spread of carbapenem-resistant Klebsiella pneumoniae among patients at admission and discharge at a Vietnamese neonatal intensive care unit. Antimicrob. Resist. Infect. Control. 2021;10(1):162. DOI: https://doi.org/10.1186/s13756-021-01033-3
- Berglund B., Hoang N.T.B., Tärnberg M., et al. Colistin- and carbapenem-resistant Klebsiella pneumoniae carrying mcr-1 and blaOXA-48 isolated at a paediatric hospital in Vietnam. J. Antimicrob. Chemother. 2018;73(4):1100–2. DOI: https://doi.org/10.1093/jac/dkx491
- Piperaki E.T., Syrogiannopoulos G.A., Tzouvelekis L.S., Daikos G.L. Klebsiella pneumoniae: virulence, biofilm and antimicrobial resistance. Pediatr. Infect. Disease. 2017;36(10):1002–5. DOI: https://doi.org/10.1097/inf.0000000000001675
- Бондаренко А.П., Троценко О.Е., Зайцева Т.А. и др. Микробиологические и молекулярно-биологические методы в эпидемиологической оценке заболеваний, обусловленных Klebsiella pneumoniae и связанных с оказанием медицинской помощи (ИСМП). Дальневосточный журнал инфекционной патологии. 2021;(41):68–75. Bondarenko A.P., Trotsenko O.E., Zaitseva T.A., et al. Microbiological and molecular-biological methods in epidemiological evaluation of healthcare associated infections caused by Klebsiella pneumoniae. The Far Eastern Journal of Infectious Pathology. 2021;(41):68–75. EDN: https://www.elibrary.ru/ypthje
- Скачкова Т.С., Шипулина О.Ю., Шипулин Г.А. и др. Изучение генетического разнообразия штаммов Klebsiella pneumoniae, выделенных в многопрофильном медицинском центре г. Москвы, с помощью секвенирования нового поколения. Клиническая микробиология и антимикробная химиотерапия. 2019;21(1):69–74. Skachkova T.S., Shipulina O.Yu., Shipulin G.A., et al. Characterization of genetic diversity of the Klebsiella pneumoniae strains in a Moscow tertiary care center using next-generation sequencing. Clinical Microbiology and Antimicrobial Chemotherapy. 2019;21(1):69–74. EDN: https://www.elibrary.ru/wuxmap
- Zheng X., Wang J.F., Xu W.L., et al. Clinical and molecular characteristics, risk factors and outcomes of Carbapenem-resistant Klebsiella pneumoniae bloodstream infections in the intensive care unit. Antimicrob. Resist. Infect. Control. 2017;6:102. DOI: https://doi.org/10.1186/s13756-017-0256-2
- Белова И.В., Точилина А.Г., Соловьева И.В. и др. Характеристика госпитальных штаммов Klebsiella pneumoniae, циркулирующих в педиатрическом стационаре. Здоровье населения и среда обитания – ЗНиСО. 2019;(8):25–9. Belova I.V., Tochilina A.G., Solov'eva I.V., et al. Characteristic of hospital Klebsiella pneumoniae strains circulating in the pediatric hospital. Public Health and Life Environment – PH&LE. 2019;(8):25–9. DOI: https://doi.org/10.35627/2219-5238/2019-317-8-25-29 EDN: https://www.elibrary.ru/bbavei
- Peters L., Olson L., Khu D.T.K., et al. Multiple antibiotic resistance as a risk factor for mortality and prolonged hospital stay: A cohort study among neonatal intensive care patients with hospital-acquired infections caused by gram-negative bacteria in Vietnam. PLoS One. 2019;14(5):e0215666. DOI: https://doi.org/10.1371/journal.pone.0215666
- Berglund B., Hoang N.T.B., Tärnberg M., et al. Molecular and phenotypic characterization of clinical isolates belonging to a KPC-2-producing strain of ST15 Klebsiella pneumoniae from a Vietnamese pediatric hospital. Antimicrob. Resist. Infect. Control. 2019;16(8):156. DOI: https://doi.org/10.1186/s13756-019-0613-4
- Fursova N.K., Astashkin E.I., Lev A.I., et al. Phenotypes and genotypes of classical and hypervirulent Klebsiella pneumoniae clinical strains isolated in Moscow in 2013–2018. Russian Journal of Infection and Immunity. 2018;8(4):747. EDN: https://www.elibrary.ru/pohodv
- Чеботарь И.В., Бочарова Ю.А., Подопригора И.В., Шагин Д.А. Почему Klebsiella pneumoniae становится лидирующим оппортунистическим патогеном. Клиническая микробиология и антимикробная химиотерапия. 2020;22(1):4–19. Chebotar' I.V., Bocharova Yu.A., Podoprigora I.V., Shagin D.A. The reasons why Klebsiella pneumoniae becomes a leading opportunistic pathogen. Clinical Microbiology and Antimicrobial Chemotherapy. 2020;22(1):4–19. DOI: https://doi.org/10.36488/cmac.2020.1.4-19 EDN: https://www.elibrary.ru/ockpac
- Yu V.L., Hansen D.S., Ko W.C., et al. Virulence characteristics of Klebsiella and clinical manifestations of K. pneumoniae bloodstream infections. Emerg. Infect. Dis. 2007;13(7):986–93. DOI: https://doi.org/10.3201/eid1307.070187
- Точилина А.Г., Белова И.В., Соловьева И.В. и др. Молекулярное типирование госпитальных штаммов Klebsiella pneumoniae ssp. pneumoniae. Клиническая микробиология и антимикробная химиотерапия. 2019;21(S1):63–4. Tochilina A.G., Belova I.V., Solov'eva I.V., et al. Molecular typing of hospital strains of Klebsiella pneumoniae ssp. pneumoniae. Clinical Microbiology and Antimicrobial Chemotherapy. 2019;21(S1):63–4. EDN: https://www.elibrary.ru/ikfgvt
- Кузьменко С.А., Брежнева Н.И., Гончаров А.Е., Тутельян А.В. Характеристика свойств внутрибольничной популяции Klebsiella pneumoniae. Фундаментальная и клиническая медицина. 2019;4(2):58–65. Kuz'menko S.A., Brezhneva N.I., Goncharov A.E., Tutel'yan A.V. Features of nosocomial Klebsiella pneumoniae population. Fundamental and Clinical Medicine. 2019;4(2):58–65. DOI: https://doi.org/10.23946/2500-0764-2019-4-2-58-65 EDN: https://www.elibrary.ru/fwfxlj
- Кондратенко Т.А., Шеожева А.В. Мониторинг микробиоценоза у новорождённых в период пребывания в отделении реанимации и интенсивной терапии. Профилактика и клиническая медицина. 2018;(2):31–3. Kondratenko T.A., Sheozheva A.V. Monitoring of the microbiocenosis in newborns within intensive care units. Preventive and Clinical Medicine. 2018;(2):31–3. EDN: https://www.elibrary.ru/xwtohb
Дополнительные файлы