Динамика ферментативной активности в первичной культуре адгезивных лейкоцитов сирийского хомячка, заражённых SARS-CoV-2 ex vivo
- Авторы: Абрамова С.А.1, Ляпун И.Н.1, Дробот Е.И.1, Крылова Н.В.1,2, Иунихина О.В.1,2, Лубова В.А.1, Мерлов Е.К.1, Белов Ю.А.1,2, Сомова Л.М.1, Щелканов М.Ю.1,2
-
Учреждения:
- Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
- Дальневосточный федеральный университет
- Выпуск: Том 102, № 2 (2025)
- Страницы: 168-178
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18825
- DOI: https://doi.org/10.36233/0372-9311-649
- EDN: https://elibrary.ru/KTYMCV
- ID: 18825
Цитировать
Аннотация
Введение. Сохраняющаяся эпидемическая актуальность SARS-CoV-2 даже после завершения в 2023 г. связанной с ним пандемии COVID-19 определяет необходимость дальнейшего изучения взаимодействия этого вируса с клетками первой линии защиты — нейтрофилами.
Цель работы — определить ферментативную активность лейкоцитов периферической крови сирийских хомячков (Mesocricetus auratus) в динамике SARS-CoV-2-инфекции ex vivo, характеризующую микробицидный потенциал клеток врождённого иммунитета.
Материалы и методы. В работе использовался штамм SARS-CoV-2/Vladivostok/R-8726/2021 в заражающих дозах 3 lg (ТЦД50/мл) и 2 lg (ТЦД50/мл) (ТЦД50 — 50% тканевая цитопатическая доза для линии клеток Vero E6); время контакта заражающей вируссодержащей жидкости с клеточной культурой — 1 ч. Количество жизнеспособных клеток в культуре адгезивных лейкоцитов подсчитывали с помощью инвертированного микроскопа, оснащённого цифровой камерой, и программы MCView. Удельную (в расчёте на 1 жизнеспособную клетку) активности аденозинтрифосфатазы (АТФазы), 5′-нуклеотидазы (аденозинмонофосфатазы, АМФазы), лактатдегидрогеназы (ЛДГ), сукцинатдегидрогеназы (СДГ), миелопероксидазы (МПО) и цитохромоксидазы (ЦХО) определяли спектрофотометрическим методом после инкубации со специфическими субстратами инфицированных и неинфицированных клеточных культур через 1, 16, 24, 48 ч после инокуляции вируса (п.и.в.).
Результаты. Через 1 ч п.и.в. по сравнению с неинфицированными лейкоцитами была снижена удельная активность АТФазы, МПО, повышена активность АМФазы, ЛДГ, СДГ; через 16 ч п.и.в. снижена активность МПО, повышена активность АМФазы, ЛДГ, СДГ, на исходном уровне, т. е. примерно на уровне неинфицированного контроля находится активность АТФазы, ЦХО; через 24 ч п.и.в. снижена активность АМФазы, повышена активность АТФазы, на исходном уровне — активность ЛДГ, СДГ, МПО, ЦХО; через 48 ч п.и.в. повышена активность АТФазы, ЛДГ, СДГ, МПО, ЦХО, на исходном уровне — активность АМФазы. Изменения ферментативной активности зависят от величины заражающей дозы и коррелируют с накоплением вируса в культуральной среде.
Заключение. Выявленная динамика ферментативной активности в первичной культуре адгезивных лейкоцитов, инфицированных SARS-CoV-2 ex vivo, свидетельствует о снижении микробицидного потенциала клеток врождённого иммунитета в процессе этой инфекции.
Полный текст
Введение
Коронавирус тяжёлого острого респираторного синдрома 2-го типа (SARS-CoV-2 — severe acute respiratory coronavirus 2) (Nidovirales: Coronaviridae, Betacoronavirus, подрод Sarbecovirus) является этиологическим агентом коронавирусного заболевания 2019 г. (COVID-19), пандемия которого (2020–2023 гг.) стала самой продолжительной и одной из наиболее смертоносных среди острых респираторных заболеваний в новейшей истории человечества [1]. После окончания пандемического периода SARS-CoV-2 не исчез из человеческой популяции, а превратился в одну из составляющих в структуре сезонного подъёма заболеваемости острыми респираторными заболеваниями [2]. По этой причине изучение патогенеза SARS-CoV-2-инфекции не теряет своей актуальности, ряд аспектов этого процесса изучен недостаточно полно. В связи с этим особый интерес вызывает процесс взаимодействия вируса с клетками периферической крови, в частности, с клетками врождённого иммунитета — нейтрофилами и моноцитами.
В доступной литературе изложены теоретические предположения о возможной способности вируса SARS-CoV-2 инфицировать нейтрофилы. Так, N. Rong и соавт. сообщили о рецепторе CD147, альтернативном рецептору ACE2, который обусловливает тропизм вируса, экспрессируется в нейтрофилах здоровых доноров и активируется у пациентов с COVID-19 [3]. Другим неканоническим рецептором является лектиновый рецептор С-типа, который опосредует образование нейтрофильных внеклеточных ловушек при COVID-19 [4]. Исходя из этого можно сделать предположение о том, что вирус способен непосредственно влиять на лейкоциты крови.
Описанные нами ранее морфологические изменения лейкоцитов периферической крови также свидетельствуют об их значительном вовлечении в процесс SARS-CoV-2-инфекции [5–8]. Однако в научной литературе отсутствует подробная информация о характере и динамике ферментативной активности лейкоцитов при инфицировании данным вирусом. Имеются отдельные сообщения об изменениях активности миелопероксидазы (МПО) и лактатдегидрогеназы (ЛДГ) в сыворотке крови пациентов с диагнозом COVID-19, причём выраженность этих изменений коррелирует с тяжестью основного заболевания [9–11]. По этой причине необходимо изучить не только морфологические, но и морфофункциональные изменения в комплексе с целью суждения о метаболических процессах клеток врождённого иммунитета под влиянием SARS-CoV-2.
Целью данной работы является определение ферментативной активности лейкоцитов периферической крови сирийских хомячков в динамике SARS-CoV-2-инфекции ex vivo, характеризующей микробицидный потенциал клеток врождённого иммунитета.
Материалы и методы
Первичную адгезивную культуру лейкоцитов сирийского хомячка (Mesocricetus auratus) получали из крови 15 особей в возрасте 4 мес и массой около 100 г. Все процедуры с животными выполняли строго в соответствии с требованиями Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей, от 18.03.1986. Протокол исследования был одобрен Этическим комитетом НИИ эпидемиологии и микробиологии им. Г.П. Сомова Роспотребнадзора (протокол № 2 от 16.05.2024).
Кровь собирали из сердца в стеклянные пробирки с добавлением в каждую гепарина из расчёта 5 ЕД/мл. Пробирки помещали в термостат под углом 45° при 37°С на 1 ч, после чего осторожно удаляли верхний слой плазмы, а лейкоцитарную плёнку отбирали, доводили до концентрации 2 × 106 клеток/мл питательной средой 199 («БиолоТ») и разносили по 100 мкл в лунки плоскодонного 96-луночного планшета («TFS»), который помещали в термостат (5% СО2, 37°С) на 40 мин; затем среду с неадгезированными клетками удаляли и лунки трижды промывали 150 мкл среды 199.
Количество живых адгезированных клеток в лунке определяли с помощью инвертированного микроскопа «МИБ-Р» («ЛОМО»), оснащённого цифровой камерой МС-8.3 С («ЛОМО»). С помощью программы MCView («LOMO-Microsystems») площадь поля зрения, не включающего край лунки, выставляли равной 0,26 мм2, подсчитывали в ней число (n) живых (прикреплённых с целостной внешней мембраной) клеток; пересекающие внешнюю границу клетки учитывали на левой/верхней гранях квадрата поля зрения и не учитывали на правой/нижней гранях. Поскольку общая площадь лунки равна 35 мм2, то общее количество клеток в лунке (N) оценивали по формуле:
. (1)
Итоговую оценку количества живых клеток в каждой лунке производили по 10 случайно выбранным полям зрения.
Инфицирование первичной культуры адгезивных лейкоцитов сирийского хомячка ex vivo осуществляли путём внесения в лунки с монослоем клеток 100 мкл среды 199 с рабочим разведением супернатанта клеточной культуры Vero E6, инфицированной SARS-CoV-2 (в контрольные образцы — без вируссодержащего супернатанта) и последующей инкубацией 1 ч при 37°С, после чего проводили трёхкратную промывку и заполнение лунок средой для культивирования, содержащей среду 199 с 15% эмбриональной телячьей сывороткой (ЭТС) и 0,004% гентамицина К («БиолоТ»). Были использованы две инфицирующие дозы: 3 lg (ТЦД50/мл) и 2 lg (ТЦД50/мл), где ТЦД50 — это 50% тканевая цитопатическая доза для линии клеток почки африканской зелёной мартышки (Chlorocebus sabaeus, ♀) (Vero E6).
Штамм SARS-CoV-2/Vladivostok/R-8726/2021 был получен из Коллекции патогенных микроорганизмов НИИ эпидемиологии и микробиологии им. Г.П. Сомова. Данный штамм относится к генотипу Delta (AY.121) (VGARus ID: prim000041; GenBank ID: OQ318430; GISAID ID: EPI_ISL_16643370) и был выделен из назофарингеального смыва больного COVID-19 в декабре 2021 г. на модели клеточной линии Vero E6 [2].
Индикацию РНК SARS-CoV-2 осуществляли с помощью метода обратной транскрипции с последующей полимеразной цепной реакцией в режиме реального времени (ОТ-ПЦР-РВ) с использованием набора реагентов «ОТ-ПЦР-РВ-SARS-CoV-2» («Синтол»). РНК выделяли с использованием комплекса реагентов «М-Сорб-НК» («Синтол»). Все манипуляции осуществляли согласно протоколам производителя. Пороговый цикл (threshold cycle, СТ) ОТ-ПЦР-РВ рассматривали как полуколичественную характеристику содержания вирусных частиц в среде: чем выше их содержание, тем ниже СТ. Отсутствие вируса соответствовало СТ ≥ 36.
Активность аденозинтрифосфатазы (АТФазы) и аденозинмонофосфатазы (АМФазы) определяли после двукратной отмывки адгезированных лейкоцитов ростовой средой без ЭТС путём внесения в лунки планшета 50 мкл субстрата для АТФазы (8 мг/мл аденозин-5′-трифосфата в 10-кратно разведённом трис-HCl-буфере, рН 7,8, содержащем 87 мг NaCl, 28,7 мг KCl, 5,2 мг MgCl2 × 6 H2O) и для АМФазы (4 мг/мл аденозин-5′-монофосфата в таком же буферном растворе, содержащем 87 мг NaCl и 70 мг MgCl2). Образцы оставляли при 37°С на 30 и 60 мин соответственно. Реакцию останавливали добавлением 50 мкл смеси аскорбиновой и молибденовой кислот в соотношении 1 : 1. Через 20 мин поглощение растворов измеряли1 при длине волны 620 нм [12].
Активность ЛДГ и сукцинатдегидрогеназы (СДГ) определяли после двукратной отмывки адгезированных лейкоцитов ростовой средой без ЭТС путём внесения в лунки планшета 100 мкл раствора йодонитротетразолия («ICN») — для ЛДГ и бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиума («ICN») — для СДГ 2 мг/мл в фосфатном буфере рН 7,2 с 0,4% MnCl2 и инкубировали 30 мин при 37°С; затем среду удаляли и монослой клеток дважды отмывали раствором Хенкса рН 7,2. Внутриклеточные гранулы диформазана растворяли в 100 мкл изопропилового спирта, подкисленного 0,04 М HCl. Оптическую плотность измеряли при длине волны 492 нм (для ЛДГ) и 540 нм (для СДГ) [12].
Активность МПО и цитохромоксидазы (ЦХО) определяли после двукратной отмывки адгезированных лейкоцитов ростовой средой без ЭТС путём внесения в лунки планшета 100 мкл раствора ортофенилендиамина («Merck») 0,4 мг/мл — для МПО и 3,3′-диаминобензидина («Merck») 2 мг/мл — для ЦХО в фосфатно-цитратном буфере рН 5,0 с 0,033% H2O2 и инкубировали 10 мин при комнатной температуре. Реакцию останавливали добавлением 100 мкл 10% раствора серной кислоты. Оптическую плотность измеряли при длине волны 492 нм [12].
Вирусную нагрузку в динамике SARS-CoV-2-инфекции устанавливали полуколичественным методом на основе изменения порогового цикла в ОТ-ПЦР-РВ (CT(0)), через 1 ч (CT(1)) — в вируссодержащей жидкости после контакта с клетками; 16 ч (CT(16)), 24 ч (CT(24)) и 48 ч (CT(48)) — в ростовой среде инфицированных клеток.
Ферментативную активность клеток под действием SARS-CoV-2-инфекции определяли через 1, 16, 24, 48 ч после инокуляции вируса (п.и.в.) путём сравнения отношений удельных (в расчёте на 1 клетку) ферментативных активностей инфицированных и неинфицированных клеток: для каждого момента времени t вычисляли коэффициент изменения удельной ферментативной активности γ(t) по формуле:
, (2)
где учтены оптическая плотность и количество живых клеток для неинфицированного (D(t) и z(t)) и инфицированного (D~(t) и z~(t)) образцов соответственно [13, 14]. Разумеется, имеет место априорное равенство:
. (3)
Статистическая обработка результатов основывалась на том, что в каждый момент времени t для каждого из 6 ферментов измерения осуществляли в 3 лунках с неинфицированными клетками и в 3 лунках с инфицированными клетками. Для этого в начале производили удаление поддерживающей среды, чтобы после промывки внести среды с соответствующими субстратами. Пронумеруем ферменты в произвольном порядке, используя индекс f = 1, 2, …6. Тогда в каждый момент времени t имеется 6 × 3 = 18 образцов вируссодержащей жидкости: CTjf(t), j = 1, 2, 3. При этом CTjf(1) представляли собой вирусную нагрузку в образцах в результате накопления вируса в среде de novo: после того как исходная вируссодержащая жидкость CTjf(0) в течение 1 ч находилась в контакте с клетками; CTjf(16), CTjf(24) и CTjf(24). Таким образом, для t = 1, 16, 24, 48 ч выборочное среднее <CT(t)> и стандартное отклонение выборочного среднего mCT определяются по стандартным формулам в следующей модификации:
; (4)
. (5)
Исходный образец был в единственном экземпляре, и его вирусную нагрузку характеризовало единственное значение CT(0).
После проведения химических реакций, которые катализируются изучаемыми ферментами, измеряли оптическую плотность в 3 лунках с неинфицированными клетками (Di(t), i = 1, 2, 3) и в 3 лунках с инфицированными (D~j(t), j = 1, 2, 3) клетками. Перед этим в каждой лунке измеряли количество живых клеток: zi(t) (i = 1, 2, 3) и z~j(t) (j = 1, 2, 3). Оценку каждого значения zi(t) и z~j(t) осуществляли по 10 полям зрения в соответствии с (1)2: zik(t), k = 1, 2, …10 и z~hk(t), h = 1, 2, …10. При этом все измерения Di(t), zik(t), D~j(t), z~jh(t) при любых значениях коэффициентов независимы и равноправны. Существует 30 значений дроби D~j(t)/z~jh(t), 30 значений дроби zik(t)/Di(t) и 900 вариантов их произведений вида (2), т. е. выборкa состоит из 900 значений γ(t). Поэтому выборочное среднее <γ(t)> и стандартное отклонение выборочного среднего mγ(t) рассчитывали по стандартным формулам, модифицированным для данного случая:
(6)
(7)
Достоверность различий между выборками из 900 значений для значений времени — γ(t1) и γ(t2), а также между выборками из 18 значений для значений времени СТ(t1) и СТ(t2), где t1 = 1, 16, 24, 48 ч, t2 = 1, 16, 24, 48 ч, t1 ≠ t2, оценивали с помощью критерия Манна–Уитни–Вилкоксона. Этот непараметрический критерий не требует априорных предположений о функции распределения случайных величин, реализацией которых являются значения γ(t) и СТ(t). Достоверной считалась оценка при вероятности реализации альтернативной гипотезы р ≤ 0,05.
Результаты
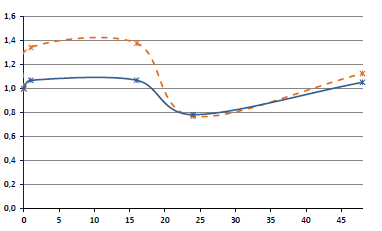
Содержание SARS-CoV-2 в ростовой среде культуры адгезивных лейкоцитов показано на рис. 1 (здесь и далее следует иметь в виду, что большему значению СТ соответствует меньшее содержание вируса в исследуемом образце). В течение 1-го часа п.и.в., когда имел место контакт вируссодержащей жидкости с клетками, происходило их инфицирование. После удаления вируссодержащей жидкости новые частицы в среде накапливались в результате репликации вируса в заражённых клетках. Учитывая тот факт, что это разные этапы инфекционного процесса, на динамических кривых рис. 1 сделан разрыв.
Рис. 1. Динамика вирусной нагрузки: меньшим значениям СТ соответствуют более высокие значения концентрации вирионов, и наоборот.
В течение 1-го часа после инокуляции вируса концентрация вирионов падает вследствие их проникновения в клетки-мишени. После этого происходит смена среды и начинается накопление de novo дочерних вирионов, продуцируемых инфицированными клетками. *р ≤ 0,05 по сравнению со значением СТ в предыдущий момент времени.
Через 1 ч п.и.в. (к окончанию процесса заражения) активность АТФазы адгезивных лейкоцитов под действием SARS-CoV-2-инфекции ex vivo дозозависимым образом снизилась относительно неинфицированного контроля (γ(1) < 1), но затем начала также дозозависимо повышаться: γ(16) ~ 1; γ(24) ≈ 1,2; γ(48) ≈ 1,6 (рис. 2, а). Возрастание АТФазной активности в период 16–48 ч было почти линейным при незначительном, но воспроизводимом превышении активности для дозы 3 lg(ТЦД50) по сравнению с 2 lg(ТЦД50).
Рис. 2. Изменения активности ферментов в результате инфекции SARS-CoV-2: АТФазы (а); АМФазы или 5’-нуклеотидазы (б); ЛДГ (в); СДГ (г); МПО (д); ЦХО (е).
По осям ординат — γ; по осям абсцисс — время после заражения, ч. *р ≤ 0,05 по сравнению со значением γ в предыдущий момент времени.
Активность АМФазы в процессе инфекции (рис. 2, б) изменялась иначе, нежели активность АТФазы. В начальный период инфекции уровень 5′-нуклеотидазы быстро повысился по сравнению с неинфицированным контролем и держался на этом уровне по меньшей мере 16 ч п.и.в., затем снижался к 24 ч (γ(24) ≈ 0,8 для обеих заражающих доз) и медленно возрастал в течение последующих 24 ч (γ(48) ~ 1).
Изменения активности ЛДГ (рис. 2, в) и СДГ (рис. 2, г) в процессе инфекции были аналогичны: сначала небольшой резкий рост (γ(1) ≈ γ(16) ≈ 1,2), затем возвращение к значению активности неинфицированного контроля (γ(24) ~ 1) и возрастание в течение последующих 24 ч (γ(48) ≈ 1,8). Снижение активности дегидрогеназ через 24 ч после инфицирования воспроизводится во всех случаях и, скорее всего, имеет дозозависимый характер (наиболее выраженный для СДГ).
Активность МПО в инфицированных клетках дозозависимым образом быстро снижалась по сравнению с неинфицированным контролем уже в течение 1 ч п.и.в. (рис. 2, д) и восстанавливалась к прежнему уровню через 24 ч (γ(24) ~ 1), после чего возрастала (γ(48) ≈ 1,4).
Активность ЦХО сначала дозозависимо снижалась (рис. 2, е), но затем возвращалась к уровню неинфицированного контроля уже через 16 ч п.и.в. (γ(16) ≈ γ(24) ≈ 1,0), после чего возрастала до γ(48) ≈ 1,2 для дозы 2 lg(ТЦД50) и до γ(48) ≈ 1,4 для дозы 3 lg(ТЦД50).
Обсуждение
Сирийские хомячки (Mesocricetus auratus) являются удобной экспериментальной моделью для воспроизведения коронавирусной инфекции SARS-CoV-2 [1, 16, 17]. В данной работе мы использовали инфицирование ex vivo культуры адгезивных лейкоцитов, которая содержит основную фракцию нейтрофилов, претерпевающих комплекс морфофункциональных изменений при контакте с инфекционными агентами [18]. Нейтрофилы — важное звено врождённого иммунитета, являются достаточно короткоживущими лейкоцитами, и уже через 48 ч их адгезивная популяция быстро истощается (это, в частности, определяет выбранную нами продолжительность эксперимента).
Известно, что АМФаза (5′-нуклеотидаза) и АТФаза активно вовлекаются в процесс пространственного преобразования плазматической мембраны нейтрофилов при хемотаксисе [18, 19]. В частности, 5′-нуклеотидаза является регулятором уровня циклического АМФ, который обеспечивает передачу сигналов от плазмалеммы внутрь клетки и регулирует образование внеклеточного аденозина, который через специфические рецепторы опосредует цитозащиту и разнообразные физиологические эффекты (подавление воспаления, вазодилатацию, ингибирование тромбоза, антиадренергию и др.) [20]. При повреждении клетки повышается содержание АМФ и понижается — АТФ [21, 22]. Соответственно, увеличение активности АМФазы и снижение активности АТФазы было зафиксировано в течение первых 16 ч п.и.в. Ранние этапы повреждения коронавирусами клеток-мишеней связаны с рецептор-опосредованным слиянием вирус-клеточных мембран и формированием в шероховатом эндоплазматическом ретикулуме инфицированной клетки специальных цистерн, в которых происходит сборка вирионов [23, 24]. Монотонное возрастание активности АТФазы, начиная примерно с 16 ч п.и.в., связано с активным синтезом вирусных белков (как структурных, так и регуляторных) и вирусспецифических РНК. Повторное возрастание активности АМФазы позже 24 ч п.и.в. (рис. 2, а, б), по-видимому, отражает процесс вторичного инфицирования лейкоцитов (в том числе в результате синцитиеобразования).
ЛДГ представляет собой цинксодержащий внутриклеточный фермент, который катализирует окисление молочной кислоты в пируват, принимает участие в обмене глюкозы, содержится практически во всех клетках организма и высвобождается при их повреждении [25]. Поэтому уровень сывороточной ЛДГ надёжно маркирует уровень неблагоприятных последствий воспалительных реакций и других патологических процессов. В частности, выявлена информативность уровня сывороточной ЛДГ для оценки клинической тяжести и мониторинга ответа на лечение при пневмонии у пациентов с COVID-19 [26]. СДГ относится к кофермент-независимым флавипротеинам и входит в мембраносвязанную дыхательную цепь мембран. Флавиновая группа этого фермента содержит 4 атома железа и ковалентно связана с белком, а ферментативная активность СДГ зависит от SH-групп [25]. СДГ млекопитающих не только участвует в образовании энергии в митохондриях, но также играет роль в чувствительности клетки к кислороду [27]. Дегидрогеназная активность инфицированных клеток сначала возрастает вследствие стимуляции вирусом репликационных процессов, а затем снижается в результате вирусиндуцированной цитодеструкции: на модели вируса иммунодефицита человека 1-го типа (Ortervirales: Retroviridae, Lentivirus) и иммортализованных клеточных линий различного происхождения показано, что величина и скорость такого дегидрогеназного сдвига пропорциональны заражающей дозе и уровню патогенности конкретного штамма (при одинаковой заражающей дозе) [13, 14]. В условиях описанного в данной статье эксперимента дегидрогеназная активность SARS-CoV-2-инфицированной первичной культуры адгезивных лейкоцитов сирийского хомячка (рис. 2, в, г) имеет два максимума: на 1-е сутки, который связан со входом вируса в клетку, и позже 1-х суток — в связи с продукцией вируса de novo (рис. 1, 2). Ещё одно объяснение (связанное с предыдущим): первый пик дегидрогеназной активности связан с жизнедеятельностью нейтрофилов, а второй — с более долгоживущими моноцитами (но пик максимума не был достигнут в связи с тем, что целью эксперимента было изучение в первую очередь биохимии инфицированных нейтрофилов).
МПО — гемопротеин, присутствующий в азурофильных гранулах нейтрофилов, выходящий при активации клетки в фаголизосому [28]. Этот фермент принимает участие в преобразовании супероксидного анион-радикала в гипохлорную кислоту, осуществляя защиту клетки от избыточного количества реактивных посредников кислорода [29]. После активации фагоцитов происходит дегрануляция, и МПО секретируется внутрь фагосомы либо во внеклеточное пространство. МПО является важной составной частью антимикробной активности фагоцитов, обеспечивающей врождённый неспецифический иммунитет. В ситуации in vivo МПО высвобождается во внеклеточную жидкость (в частности, в кровь), в том случае если по какой-либо причине нейтрофил не может фагоцитировать патоген, при клеточном лизисе или когда нейтрофил подвергается воздействию различных растворимых факторов [28].
При использовании автоматизированных цитохимических счётчиков клеток крови у пациентов с диагнозом COVID-19 отмечалось снижение активности МПО [9]. Вместе с тем при образовании нейтрофильных внеклеточных ловушек, формирующих одну из линий защиты от патогенов (включая вирусы, в том числе — SARS-CoV-2), выявляется повышение активности МПО во внеклеточном пространстве [30–32]. Снижение содержания МПО в культуре адгезивных лейкоцитов в течение 1 сут п.и.в. (рис. 1, е) может объясняться тем, что под действием SARS-CoV-2-инфекции нейтрофилы экскретируют МПО во внеклеточное пространство и формируют подобные нейтрофильным внеклеточным ловушкам структуры ex vivo.
ЦХО локализуется главным образом на внутренней мембране митохондрий, где захватывает протоны из внутримитохондриального матрикса и, перенося электроны с цитохрома С на кислород, восстанавливает О2 до Н2О. Этот фермент играет важную роль в функционировании аэробного звена дыхательной цепи и производстве энергии в клетках эукариот [25]. Поэтому снижение активности ЦХО коррелирует со снижением активности АТФазы в первые часы п.и.в. (см. рис. 2, а и е). Кроме того, в лейкоцитах активность ЦХО служит достоверным показателем уровня окислительного метаболизма, и при гибели клеток её активность повышается [25] — именно этот эффект наблюдается в культуре адгезивных лейкоцитов к концу 1-х суток п.и.в. (рис. 2, е).
Обнаруженные изменения ферментативного спектра SARS-CoV-2-инфицированных лейкоцитов имеют дозозависимый характер (рис. 2): модуль таких изменений пропорционален заражающей дозе вируса. При анализе динамики ферментативной активности необходимо учитывать, что к концу 1-х суток п.и.в. клеточный состав культуры адгезивных лейкоцитов уменьшается за счёт короткоживущих нейтрофилов, но при этом в культуре остаются более долгоживущие клетки.
Разумеется, нельзя исключить, что инфицированные вирусом SARS-CoV-2 клетки Vero E6 продуцируют растворимые экзогенные факторы, способные повлиять на физиологию клеток при заражении, поскольку использовался вируссодержащий супернатант клеточной культуры Vero E6. Однако известно, что клетки линии Vero и Vero E6 не продуцируют интерферон I типа за счёт потери кластера генов интерферона I типа [33, 34] и являются дефектными по продукции интерферонов-α-1/13, α-2, α-4, α-6, α-8, α-14, α-17, α-21, β-1 и ω-1 [33]. Что касается остальных вируссодержащих растворимых факторов — они могут стать предметом дальнейших исследований.
Вывод
Обнаруженные изменения ферментативной активности в нейтрофилах, инфицированных SARS-CoV-2 ex vivo, свидетельствуют о снижении микробицидного потенциала этих клеток врождённого иммунитета, что является одной из причин дисфункции иммунной системы при COVID-19.
1 Здесь и далее фотометрические измерения осуществляли с использованием спектрофотометра «Multiscan RC» («LabSystems»). Бланкирование проводили по раствору равного количества среды без соответствующих субстратов и клеток.
2 Подсчёт жизнеспособных клеток в суспензионных культурах проще всего проводить в камере Горяева, извлекая небольшой объём ростовой среды с клеточной взвесью. Этот метод более удобен для однократного измерения (который не даёт достаточной статистической точности), но затруднителен в случае нескольких повторов; кроме того, достоверность результатов МТТ-тестов при работе с суспензионными клеточными культурами дополнительно снижается артефактным захватом клеток при промывке, что приходится компенсировать применением дозаторных наконечников специальной конструкции (S-tips) [15].
Об авторах
Светлана Алексеевна Абрамова
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
Автор, ответственный за переписку.
Email: svetochey99@mail.ru
ORCID iD: 0000-0002-2428-3186
аспирант, младший научный сотрудник лаб. патоморфологии
Россия, ВладивостокИрина Николаевна Ляпун
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
Email: irina-lyapun@list.ru
ORCID iD: 0000-0002-5290-3864
кандидат биол. наук, старший научный сотрудник лаб. патоморфологии
Россия, ВладивостокЕлена Игоревна Дробот
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
Email: eidrobot@mail.ru
ORCID iD: 0000-0001-7672-1582
кандидат биол. наук, старший научный сотрудник лаб. патоморфологии
Россия, ВладивостокНаталья Владимировна Крылова
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора; Дальневосточный федеральный университет
Email: krylovanatalya@gmail.com
ORCID iD: 0000-0002-9048-6803
доктор биол. наук, ведущий научный сотрудник, зав. лаб. респираторных инфекций, доцент каф. эпидемиологии, микробиологии и паразитологии с Международным научно-образовательным Центром биологической безопасности Роспотребнадзора Школы наук о жизни и биомедицины
Россия, Владивосток; ВладивостокОльга Викторовна Иунихина
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора; Дальневосточный федеральный университет
Email: olga_iun@inbox.ru
ORCID iD: 0000-0002-6723-582X
доктор биол. наук, ведущий научный сотрудник, зав. лаб. респираторных инфекций, доцент каф. эпидемиологии, микробиологии и паразитологии с Международным научно-образовательным Центром биологической безопасности Роспотребнадзора Школы наук о жизни и биомедицины
Россия, Владивосток; ВладивостокВалерия Александровна Лубова
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
Email: valeri_priority@mail.ru
ORCID iD: 0000-0002-4290-6164
научный сотрудник лаб. природно-очаговых инфекций
Россия, ВладивостокЕвгений Константинович Мерлов
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
Email: zhenya.merlov.2000@mail.ru
ORCID iD: 0000-0003-1515-3221
младший научный сотрудник отд. экспериментальной биомедицины
Россия, ВладивостокЮрий Александрович Белов
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора; Дальневосточный федеральный университет
Email: bornley@yandex.ru
ORCID iD: 0000-0001-8313-5610
младший научный сотрудник, зав. центром молекулярной диагностики, ассистент каф. эпидемиологии, микробиологии и паразитологии с Международным научно-образовательным Центром биологической безопасности Роспотребнадзора Школы наук о жизни и биомедицины
Россия, Владивосток; ВладивостокЛариса Михайловна Сомова
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора
Email: l_somova@mail.ru
ORCID iD: 0000-0003-2023-1503
доктор мед. наук, профессор, главный научный сотрудник, зав. лаб. патоморфологии
Россия, ВладивостокМихаил Юрьевич Щелканов
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова Роспотребнадзора; Дальневосточный федеральный университет
Email: adorob@mail.ru
ORCID iD: 0000-0001-8610-7623
доктор биол. наук, директор, зав. каф. эпидемиологии, микробиологии и паразитологии с Международным научно-образовательным Центром биологической безопасности Роспотребнадзора Школы наук о жизни и биомедицины
Россия, Владивосток; ВладивостокСписок литературы
- Щелканов М.Ю. Этиология COVID-19. В кн.: COVID-19: от этиологии до вакцинопрофилактики. Руководство для врачей. М.;2023:11–53. Shchelkanov M.Yu. Etiology of COVID-19. In: COVID-19: from Etiology to Vaccination. A Guide for Doctors. Moscow; 2023:11–53. EDN: https://elibrary.ru/itytdm
- Попова А.Ю., Щелканов М.Ю., Крылова Н.В. и др. Генотипический портрет SARS-CoV-2 на территории Приморского края в период пандемии COVID-19. Журнал микробиологии, эпидемиологии и иммунобиологии. 2024;101(1):19–35. Popova A.Yu., Shchelkanov M.Y., Krylova N.V., et al. Genotypic portrait of SARS-CoV-2 in Primorsky krai during the COVID-19 pandemic. Journal of Microbiology, Epidemiology and Immunobiology. 2024;101(1):19-35. DOI: https://doi.org/10.36233/0372-9311-497, EDN: https://elibrary.ru/pujffa
- Rong N., Wei X., Liu J. The role of neutrophil in COVID-19: positive or negative. J. Innate Immun. 2024;16(1):80–95. DOI: https://doi.org/10.1159/000535541
- Zhu Y., Chen X., Liu X. NETosis and neutrophil extracellular traps in COVID-19: Immunothrombosis and beyond. Front. Immunol. 2022;13:838011. DOI: https://doi.org/10.3389/fimmu.2022.838011
- Сомова Л.М., Коцюрбий Е.А., Дробот Е.И. и др. Клинико-морфологические проявления дисфункции иммунной системы при новой коронавирусной инфекции COVID-19. Клиническая и экспериментальная морфология. 2021;10(1):11–20. Somova L.M., Kotsyurbiy E.A., Drobot E.I., et al. Clinical and morphological manifestations of immune system dysfunction in new coronavirus infection (COVID-19). Clinical and Experimental Morphology. 2021;10(1):11–20. DOI: https://doi.org/10.31088/CEM2021.10.1.11-20 EDN: https://elibrary.ru/upppqm
- Сомова Л.М., Дробот Е.И., Пустовалов Е.В. и др. Морфология лейкоцитов периферической крови у больных новой коронавирусной инфекцией COVID-19. Клиническая и экспериментальная морфология. 2023;12(3):41–9. Somova L.M., Drobot E.I., Pustovalov E.V., et al. Morphology of peripheral blood leucocytes in patients with new coronavirus infection (COVID-19). Clinical and Experimental Morphology. 2023;12(3):41–9. DOI: https://doi.org/10.31088/CEM2023.12.3.41-49, EDN: https://elibrary.ru/vcexry
- Сомова Л.М., Абрамова С.А., Дробот Е.И. и др. Нейтрофильные синцитии в периферической крови пациентов с коронавирусной инфекцией (COVID-19). Клиническая экспериментальная морфология. 2024;13(3):26–33. Somova L.M., Abramova S.A., Drobot E.I., et al. Neutrophil syncytia in the peripheral blood of patients with coronavirus infection (COVID-19). Clinical Experimental Morphology. 2024;13(3):26–33. DOI: https://doi.org/10.31088/CEM2024.13.3.26-33, EDN: https://elibrary.ru/soelfa
- Абрамова С.А., Дробот Е.И., Пустовалов Е.В. и др. Ультраструктурная патология клеток врождённого иммунитета при COVID-19. Дальневосточный журнал инфекционной патологии. 2023;(45):109–11. Abramova S.A., Drobot E.I., Pustovalov E.V., et al. Ultrastructure pathology of innate immunity cells during COVID-19. The Far Eastern Journal of Infectious Pathology. 2023;(45):109–11. EDN: https://elibrary.ru/jtwvjg
- Han Y., Zhang H., Mu S., et al. Lactate dehydrogenase, an independent risk factor of severe COVID-19 patients: a retrospective and observational study. Aging (Albany NY). 2020;12(12):11245–58. DOI: https://doi.org/10.18632/aging.103372
- Poggiali E., Zaino D., Immovilli P., et al. Lactate dehydrogenase and C-reactive protein as predictors of respiratory failure in COVID-19 patients. Clin. Chim. Acta. 2020;509:135–8. DOI: https://doi.org/10.1016/j.cca.2020.06.012
- Zini G., d'Onofrio G. Coronavirus disease 2019 (COVID-19): Focus on peripheral blood cell morphology. Br. J. Haematol. 2023;200(4):404–19. DOI: https://doi.org/10.1111/bjh.18489
- Сомова Л.М., Плехова Н.Г., Кондрашова Н.М., Запорожец Т.С. Определение функциональной активности лейкоцитов периферической крови в качестве показателя неспецифической защиты организма: Методические рекомендации. Владивосток;2005. Somova L.M., Plekhova N.G., Kondrashova N.M., Zaporozhets T.S. Determination of the functional activity of peripheral blood leukocytes as an indicator of nonspecific body protection: Methodological recommendations. Vladivostok;2005.
- Щелканов М.Ю., Сахурия И.Б., Бурунова В.В. и др. Дегидрогеназная активность ВИЧ-инфицированных клеток при анализе результатов МТТ-теста. Иммунология. 1999;20(1):37–41. Shchelkanov M.Yu., Sakhuria I.B., Burunova V.V., et al. HIV-infected cell dehydrogenase activity in the evaluation of anti-HIV compound efficiency. Immunologiya. 1999;20(1):37–41. EDN: https://elibrary.ru/lqohkg
- Щелканов М.Ю., Ерёмин В.Ф., Сахурия И.Б. и др. Дегидрогеназная активность инфицированных клеток и биологические свойства различных вариантов ВИЧ-1. Биохимия. 1999;64(4):513–9. Shchelkanov M.Yu., Eremin V.F., Sakhuriya I.B., et al. Dehydrogenase activity of infected cells and biological properties of HIV-1 variants. Biochemistry (Moscow). 1999;64(4):431–6. EDN: https://elibrary.ru/lfiulj
- Щелканов М.Ю., Сахурия И.Б., Полякова Е.Б. и др. Повышение качества МТТ-метода с помощью микродозаторных наконечников специальной конструкции. Иммунология. 1998;19(4):57–9. Shchelkanov M.Yu., Sakhuriya I.B., Polyakova E.B., et al. Improvement of the MTT-based assay by modification of pipette tips. Immunology (Moscow). 1998;19(4):57–9. EDN: https://elibrary.ru/mpawbj
- Грачева А.В., Дроков А.О., Смирнова Д.И. и др. Вирулентность и тканевая специфичность разных эпидемически значимых вариантов SARS-CoV-2 для золотистых сирийских хомячков. Журнал эпидемиологии, микробиологии и иммунобиологии. 2024;101(4):470–82. Gracheva A.V., Drokov A.O., Smirnova D.I., et al. Virulence and tissue tropism of different epidemiologically significant SARS-CoV-2 variants for golden Syrian hamsters. Journal of Epidemiology, Microbiology and Immunobiology. 2024;101(4):470–82. DOI: https://doi.org/10.36233/0372-9311-528 EDN: https://elibrary.ru/jukmca
- Фоменко Е.П., Гапека А.В., Милованкин П.Г. и др. Эффективные животные модели для изучения SARS-CoV-2-инфекции. Дальневосточный журнал инфекционной патологии. 2024;(47):36–8. Fomenko E.P., Gapeka A.V., Milovankin P.G., et al. Effective animal models for the study of SARS-CoV-2 infection. The Far Eastern Journal of Infectious Pathology. 2024;47(47):36–8. DOI: https://doi.org/10.62963/2073-2899-2024-47-36-38 EDN: https://elibrary.ru/rfdeaj
- Плехова Н.Г., Сомова Л.М., Слонова Р.А. и др. Метаболическая активность макрофагов, зараженных Hantaviruses — возбудителями геморрагической лихорадки с почечным синдромом. Биохимия. 2005;70(9):1198–208. Plekhova N.G., Somova L.M., Slonova R.A., et al. Metabolic activity of macrophages infected with hantavirus, an agent of hemorrhagic fever with renal syndrome. Biochemistry (Moscow). 2005;70(9): 990–7. DOI: https://doi.org/10.1007/s10541-005-0214-0, EDN: https://elibrary.ru/ljdewp
- Плехова Н.Г., Сомова Л.М. Роль моноцитов/макрофагов в патогенезе вирусных инфекций. Тихоокеанский медицинский журнал. 2010;(3):5–9. Plekhova N.G., Somova L.M. The role of monocytes/macrophages in pathogenesis of viral infections. Pacific Medical Journal. 2010;(3):5–9. EDN: https://elibrary.ru/oiheqp
- Zukowska P., Kutryb-Zajac В., Toczek М., et al. The role of ecto-5′-nucleotidase in endothelial dysfunction and vascular pathologies. Pharmacol. Rep. 2015;67(4):675–81. DOI: https://doi.org/10.1016/j.pharep.2015.05.002, EDN: https://elibrary.ru/xouavl
- Бра М., Квинан Б., Сузин С.А. Митохондрии в программированной гибели клетки: различные механизмы гибели (обзор). Биохимия. 2005;70(2):284–93. Bras M., Queenan B., Susin S.A. Programmed cell death via mitochondria: different modes of dying. Biochemistry (Moscow). 2005;70(2):231–9. DOI: https://doi.org/10.1007/s10541-005-0105-4, EDN: https://elibrary.ru/mhrivj
- Осколок Л.Н., Порядин Г.В. Основные механизмы повреждения клеток. М.;2016. Oskolok L.N., Poryadin G.V. The Main Mechanisms of Cell Damage. Moscow;2016. EDN: https://elibrary.ru/xglrxt
- Щелканов М.Ю., Колобухина Л.В., Бургасова О.А. и др. COVID-19: этиология, клиника, лечение. Инфекция и иммунитет. 2020;10(3):421–45. Shchelkanov M.Yu., Kolobukhina L.V., Burgasova O.A., et al. COVID-19: Etiology, Clinical Picture, Treatment. Russian Journal of Infection and Immunity. 2020;10(3):421–45. DOI: https://doi.org/10.15789/2220-7619-CEC-1473, EDN: https://elibrary.ru/imaadb
- Щелканов М.Ю., Попова А.Ю., Дедков В.Г. и др. История изучения и современная классификация коронавирусов (Nidovirales: Coronaviridae). Инфекция и иммунитет. 2020;10(2):221–46. Shchelkanov M.Yu., Popova A.Yu., Dedkov V.G., et al. History of investigation and current classification of coronaviruses (Nidovirales: Coronaviridae). Russian Journal of Infection and Immunity. 2020;10(2):221–46. DOI: https://doi.org/10.15789/2220-7619-HOI-1412, EDN: https://elibrary.ru/kziwrq
- Кольман Я., Рём К.Г. Наглядная биохимия. Пер. с нем. М.;2004. Koolman J., Röhm K.H. Taschenatlas der Biochemie. New York;1998. EDN: https://elibrary.ru/qkmqbj
- Wu M.Y., Yao L., Wang Y.I., et al. Clinical evaluation of potential usefulness of serum lactate dehydrogenase (LDH) in 2019 novel coronavirus (COVID-19) pneumonia. Respir. Res. 2020;21(1):171. DOI: https://doi.org/10.1186/s12931-020-01427-8, EDN: https://elibrary.ru/ojobmo
- Bardella C., Pollard P.J., Tomlinson I. SDH mutations in cancer. Biochim. Biophys. Acta. 2011;1807(11):1432–43. DOI: https://doi.org/10.1016/j.bbabio.2011.07.003, EDN: https://elibrary.ru/phvbwx
- Klebanoff S.J. Myeloperoxidase: friend and foe. J. Leukoc. Biol. 2005;77(5):598–625. DOI: https://doi.org/10.1189/jlb.1204697 EDN: https://elibrary.ru/mfbqgj
- Witko-Sarsat V., Rieu P., Descamps-Latscha B., et al. Neutrophils: molecules, functions and pathophysiological aspects. Lab. Invest. 2000;80(5):617–53. DOI: https://doi.org/10.1038/labinvest.3780067
- Ashar H.K., Mueller N.C., Rudd J.M., et al. The role of extracellular histones in influenza virus pathogenesis. Am. J. Pathol. 2018;188(1):135–48. DOI: https://doi.org/10.1016/j.ajpath.2017.09.014, EDN: https://elibrary.ru/yfdncp
- Bader S.M., Cooney J.P., Pellegrini M., Doerflinger M. Programmed cell death: the pathways to severe COVID-19? Biochem. J. 2022;479(5):609–28. DOI: https://doi.org/10.1042/bcj20210602, EDN: https://elibrary.ru/kcewfq
- Kapoor S., Mihalovičová L., Pisareva E., et al. Association of vascular netosis with COVID-19 severity in asymptomatic and symptomatic patients. iScience. 2024;27(5):109573. DOI: https://doi.org/10.1016/j.isci.2024.109573, EDN: https://elibrary.ru/rvfsne
- Osada N., Kohara A., Yamaji T., et al. The genome landscape of the African green monkey kidney-derived vero cell line. DNA Res. 2014;21(6):673–83. DOI: https://doi.org/10.1093/dnares/dsu029
- Konishi K., Yamaji T., Sakuma C., et al. Whole-genome sequencing of Vero E6 (Vero C1008) and comparative analysis of four Vero cell sublines. Front. Genet. 2022;13:801382. DOI: https://doi.org/10.3389/fgene.2022.801382
Дополнительные файлы