Molecular genetic characteristics of Vibrio cholerae nonO1/nonO139 strains isolated on the territory of Russian Federation from patients with otitis
- Authors: Monakhova E.V.1, Vodop'yanov A.S.1, Kruglikov V.D.1, Selyanskaya N.A.1, Pisanov R.V.1, Noskov A.K.1
-
Affiliations:
- Rostov-on-Don Plague Control Researsh Institute
- Issue: Vol 99, No 4 (2022)
- Pages: 465-477
- Section: ORIGINAL RESEARCHES
- URL: https://microbiol.crie.ru/jour/article/view/1315
- DOI: https://doi.org/10.36233/0372-9311-215
- ID: 1315
Cite item
Full Text
Abstract
Introduction. In 2017–2020 for the first time in many years strains of Vibrio cholerae nonO1/nonO139 (NAGs) were isolated in Russia from patients with otitis.
Aim — bioinformatic analysis of whole genome sequences (WGSs) and sequences of individual genes of NAG strains - causative agents of otitis isolated in Russia.
Materials and methods. Analysis of WGSs of eight NAG clinical isolates obtained on the MiSeq Illumina platform was carried out using BioEdit, BLASTN, BLASTP, Vector NTI programs; antibiotic resistance was determined according to MUK 4.2.2495-09.
Results. The strains differed in SNP content, sets of determinants of pathogenicity/persistence factors and their alleles. All lacked CTX, preCTX, RS1 prophages, VPI pathogenicity island, thermostable toxin gene, mobile elements associated with antibiotic resistance, pandemicity island VSP-I; two strains contained VSP-II island. Genes of a number of proteases, cholix toxin, type 3 secretion system (T3SS) cluster and additional T6SS clusters formed different combinations. Products of the altered genes retained or lost their characteristic active domains. In the cytotoxin MARTX of 6 strains, the key ACD domain was absent; in 4 strains a new rtxA-like domain was revealed. Biofilm gene clusters varied in their structure. The presence of genes for antibiotic resistance did not always correlate with antibioticograms. All strains were susceptible to most antibiotics, but some showed resistance to 1–4 drugs.
Conclusion. All the studied strains — causative agents of otitis, in spite of revealed differences, have sufficient sets of determinants responsible for realization of pathogenic and persistent potential. Due to discrepancy between the genotypic and phenotypic characteristics of antibiotic resistance, one should rely mainly on the phenotype when choosing drugs for the etiotropic therapy of NAG infections. Emergence of patients with otitis caused by NAG-vibrios in Russia indicates the advisability of the inclusion of tests for their identification in the scheme of bacteriological analysis for extraintestinal infections and, in cases of their isolation, for prompt determination of sensitivity to antibiotics.
Full Text
ВВЕДЕНИЕ
Холерные вибрионы nonО1/nonО139 серогрупп (НАГ-вибрионы), естественные обитатели поверхностных водоемов, способны вызывать острые кишечные инфекции различной степени тяжести в виде спорадических случаев либо локальных вспышек [1]. Гораздо реже они являются этиологическими агентами внекишечных форм, выявляемых, как правило, у ослабленных пациентов, страдающих сопутствующими хроническими заболеваниями. Тем не менее в литературе имеется достаточно много сообщений о выделении НАГ-вибрионов из клинического материала при первичной бактериемии, поражениях кожи и мягких тканей, мочеполовой системы, желчевыводящих путей, пневмонии [2][3]. Не последнее место в этом списке занимают отиты (острые либо хронические), проявляющиеся в виде воспаления среднего уха или наружного слухового прохода [3]. Случаи отитов, вызванных НАГ-вибрионами, регистрировались в нынешнем столетии в Германии, Австрии и Венгрии [2][3]. В 2019 г. в Германии наблюдали случай хронического отита у ребёнка, заразившегося при купании в Балтийском море. В Израиле зарегистрировано развитие хронического отита у воднолыжника, заразившегося в 2011 г. в Австралии в результате перфорации барабанной перепонки при аварии и попадании речной воды в среднее ухо; этиологическим агентом оказался штамм О100 серогруппы [4]. Во Франции в 2017 г. НАГ-вибрион был выделен из отделяемого уха ребёнка, больного хроническим рецидивирующим мокнущим отитом; незадолго до обострения он купался в реке на территории страны [5]. В том же году в Испании НАГ-вибрион был выделен от больного c диагнозом «острый наружный отит»; заболевание проявилось после купания в Средиземном море [6]. Aналогичные случаи заражения при купании в водоёмах отмечены также в Швеции, Финляндии, Бельгии, Великобритании, Испании, Румынии, на Маврикии [3].
Авторы отмечают, что заражение людей происходит преимущественно в тёплое время года, что создаёт благоприятные условия как для купания, так и для размножения НАГ-вибрионов [5][6]; высказывалось даже предположение о том, что продолжающиеся изменения климата могут в скором времени привести к повышению заболеваемости людей за счёт инфицирования НАГ-вибрионами и другими представителями вибриофлоры в мировом масштабе [7].
НАГ-вибрионы крайне вариабельны по генотипическим свойствам за счёт высокой пластичности их геномов. В имеющихся публикациях генетические характеристики возбудителей внекишечных форм заболеваний ограничены ПЦР детекцией отдельных генов, реже — данными частичного секвенирования их участков. В базах National Center for Biotechnology Information (NCBI) были найдены только полногеномные сиквенсы (WGSs) штаммов-возбудителей наружных отитов, выделенных в Австрии. Эти сиквенсы частично проанализированы S. Lepuschitz и соавт. в плане обнаружения генов антибиотикорезистентности [8].
Наш интерес к НАГ-вибрионам, вызвавшим отиты, обусловлен тем, что в 2017–2020 гг. такие штаммы выделялись из отделяемого уха больных на территории России.
Целью настоящей работы явился биоинформационный анализ полных геномов штаммов V. cholerae nonO1/nonO139, выделенных от больных отитом на территории России, а также отдельных генов и продуктов их трансляции in silico.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования служили 7 штаммов V. cholerae nonO1/nonO139, выделенные от людей на территории России в 2017–2020 гг. Для сравнения в анализ был включен ещё 1 штамм, выделенный из крови больного с неизвестным диагнозом (табл. 1). Все штаммы получены из Музея живых культур (коллекция Референс-центра Ростовского-на-Дону противочумного института Роспотребнадзора).
Таблица 1. Клинические штаммы V. cholerae nonO1/nonO139, использованные в работе
Table 1. V. cholerae nonO1/nonO139 clinical strains used in this study
Полногеномное секвенирование (WGS) осуществляли на платформе MiSeq [9]. Сравнительный однонуклеотидный (SNP) анализ проводили согласно предложенной ранее схеме [10].
Отдельные гены и их кластеры идентифицировали в полных геномах с помощью программ «BLASTN v. 2.2.29»1 и «BioEdit v. 7.2.5»2. Трансляцию генов, сравнительный анализ их нуклеотидных последовательностей и аминокислотных (аа) продуктов осуществляли с использованием пакета программ «Vector NTI Advance 11» («Invitrogen»). Прототипами служили соответствующие последовательности референс-штамма V. cholerae N16061 и другие, отсутствующие в его геноме (табл. 2). Для определения наличия и локализации активных доменов в белках, а также выявления их гомологов у штаммов из других регионов мира выполняли BLASTP-анализ.
Таблица 2. Сиквенсы, использованные в сравнительном анализе в качестве прототипов
Table 2. Reference sequences used as prototypes in comparative analysis
Поиск в WGSs генетических детерминант лекарственной устойчивости проводили с использованием базы CARD3, а также нуклеотидных последовательностей отдельных генов, встречающихся у холерных вибрионов и отбранных в соответствии с набором включенных в исследование антибиотиков (табл. 3). Фенотипически чувствительность/устойчивость штаммов к антибактериальным препаратам определяли согласно МУК 4.2.2495-094.
Таблица 3. Гены, использованные для идентификации детерминант антибиотикорезистентности в WGSs НАГ-вибрионов
Table 3. Genes used for identification of antibiotic resistance determinants in WGSs of NAGs
WGSs штаммов, полученные нами в рамках настоящего исследования, депонированы в NCBI GenBank (BioProject: PRJNA781803, BioSample ID SAMN23296539-23296546).
РЕЗУЛЬТАТЫ
С помощью SNP-анализа WGSs 8 штаммов НАГ-вибрионов была построена дендрограмма, отражающая их сходство и различия (рис. 1).
Рис. 1. Дендрограмма, построенная на основе кластерного анализа (UPGMA) распределения 3683 SNP, расположенных в открытых рамках считывания. В исследование включали только те SNP, для которых в пределах 9 п.н. от исследуемого полиморфизма не зафиксировано других мутаций.
Как видно из рис. 1, все штаммы различались между собой по содержанию SNP, хотя некоторые обладали более выраженным сходством друг с другом и образовали несколько кластеров, что указывает на отсутствие общих источников инфицирования даже в случаях одного места и времени выделения.
Далее были проведены идентификация в WGSs детерминант факторов патогенности/персистенции и их сравнительный биоинформационный анализ.
BLAST-анализ показал, что все исследованные штаммы были лишены профагов CTX, preCTX и RS1, острова патогенности VPI, гена термостабильного токсина stn/sto, а также острова пандемичности VSP-I. Однако остров VSP-II был выявлен у двух штаммов (173 и 1175).
Вместе с тем штаммы могли существенно различаться как по наборам генетических детерминант, так и по их аллельному составу. Так, всего у 2 штаммов, выделенных в Москве в 2019 г., присутствовали гены cholix-токсина (ChxA): у 173 — chxAI, у 1175 — chxAII.
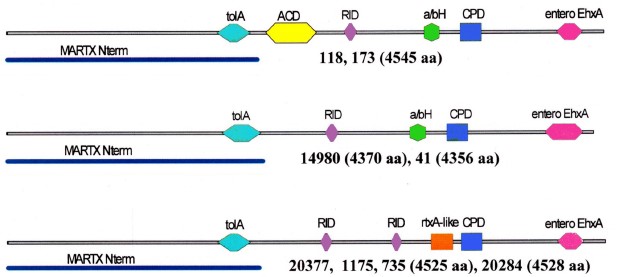
Интактный кластер RTX, ответственный за синтез цитотоксина-актиномодулятора MARTX, присутствовал у всех штаммов, однако ген собственно токсина rtxA отличался значительной вариабельностью по длине и числу молчащих и миссенс-мутаций, что отразилось на аа-составе продуктов разных аллелей. Как видно из рис. 2, только у 2 штаммов белки MARTX оказались наиболее близкими прототипному RtxA1 и содержали все характерные для него активные домены: актин-связывающий (ACD), инактивирующий Rho-ГТФазу (RID), цистеиновой протеазы (CPD) и α-β-гидролаз (α/βH), два других отличались от них не только длиной, но и отсутствием ACD. Белки оставшихся 4 штаммов, лишенные не только ACD, но и α/βH, содержали по 2 RID. Кроме того, у них появился новый домен, описанный программой «BLASTP» как «rtxA-подобный». На дендрограмме они образовали отдельный кластер.
Рис. 2. Дендрограмма, построенная по результатам AlignX-анализа MARTX НАГ-вибрионов (a) и топография доменов в их молекулах (б).
Ген гемолизина hlyA был интактным у всех 8 штаммов, хотя и представлен разными отличными от прототипа аллелями за счёт молчащих и миссенс-мутаций. Такая же картина наблюдалась и при анализе входящего в состав hly локуса гена металлопротеазы prtV. Оба гена имели «нормальную» (идентичную прототипу длину (соответственно 2226 и 2757 п.н.). Во всех геномах также присутствовали интактные гены других металлопротеаз — гемагглютинин протеазы HapA и коллагеназы VchC.
Кроме генов металлопротеаз, были идентифицированы гены сериновых протеаз vesA, vesC, ivaP, rssP, тогда как vesB найден только у 4 штаммов (1175, 118, 20284 и 41), у остальных он отсутствовал. Все исследуемые штаммы содержали разные аллели гена vesC, у четырех (173, 14980, 20377, 735) довольно близкие прототипу, у остальных они имели ряд делеций, кратных 3 нуклеотидам, в результате чего их продукты укоротились с 548 аа до 545 аа у штамма 118, 538 аа — у 1175 и 20284 аа, 534 аа — у 41, однако преждевременных стоп-кодонов не образовалось. Кроме того, у всех сохранились характерные активные домены и каталитическая триада Asp122, His75, Ser225 (у 3 последних — Ser219 за счёт предшествующей делеции 6 аа, однако остаток серина находился в короткой последовательности GDSGGPIFF, идентичной у всех штаммов). Также в типовых позициях находились S63, G159, Y277, Q279 (Q273), замещение которых на другие аа может приводить к блокировке активности белка [11].
Гены IvaP также различались по длине и нуклеотидному составу, однако их продукты имели те же домены, что у прототипа. В базах NCBI найдены их гомологи, принадлежащие штаммам из разных регионов мира (EGR2467683, KAA1203788, MBJ6933743, EGQ7641687 и др.). Гены ромбосортазы rssP также были представлены разными аллелями, из которых только один (штамма 735) был близок прототипу (со старт-кодоном TTG), тогда как 7 остальных были укорочены до 60 п.н. из-за SNP G58T и образования преждевременного стоп-кодона. Однако ниже этой открытой рамки считывания (ORF) образовалась вторая, со старт-кодоном GTG. Продукты этих ORF2 (183–185 аа), различаясь между собой по аа-составу, тем не менее имели все 4 характерных активных домена. Такие формы RssP широко представлены в NCBI и обозначены как ромбосортазы V. cholerae.
Значительным разнообразием отличались и гены cef (CHO cell elongating factor). Продукты всех 8 аллелей этого гена, несмотря на существенные различия, сохранили все характерные активные домены — Куница, лейциновую молнию, α/βH и LIP, а также субстрат-связывающий сайт GHSLG.
Что касается таких факторов, как контакт-зависимые системы секреции — 6-го и 3-го типов (T6SS и T3SS), то гены первой, входящие в состав основного кластера (vipAB, hiF, vasABCDEF, clpV, vasHIJKLM), присутствовали в WGSs всех 8 штаммов, тогда как гены эффектора vgrG3 отличались вариабельностью, и только у 2 штаммов (14980 и 735) сохранили полную последовательность, кодирующую концевой пептидокликан-связывющий домен PBD, у остальных были значительно укорочены. Также не у всех выявлены гены дополнительных кластеров T6SS [12]. Aux-1 отсутствовал у штаммов 118 и 173, у остальных обнаружен ген эффектора vgrG1 с последовательностью, кодирующей актин-связывающий домен ACD, но все были лишены tseL. Aux-2 не был найден у штаммов 20377 и 41, у остальных содержал гены эффекторов vasW и vasX. Aux-3 отсутствовал во всех WGS, а последовательности, гомологичные таковым Aux-4 [12], имелись у штаммов 1175, 41 и 735.
У одного из штаммов (118) присутствовал кластер T3SS, включая коровую область (гены регуляторов транскрипции vttR-A, B; структурных компонентов vcsN2, C2, T2, R2, Q2, U2, V2, J2, vspD; транслоконов vopH, A, M, I, W, F и 2 вариабельных фланкирующих участка: 3’ (ген предполагаемого фактора вирулентности acfA, транслоконов vopE, X) и 5’ (ген предполагаемых факторов вирулентности acfC, D и транслоконов vopG, K, Y, Z). Кроме того, в состав всех трех участков входили гены, функции которых пока не установлены. У штамма 118 структура кластера T3SS в целом совпадала с таковой референс-штамма АМ-19226, особенно коровой области, за исключением присутствия в ней дополнительной ORF длиной 1368 п.н., кодирующей белок-шаперон, после vopW. Почти все гены имели ту же длину, что у прототипа, но отличались значительным количеством SNP, ни один их которых не вызвал появления преждевременного стоп-кодона.
При анализе кластеров генов, обусловливающих продукцию маннозо-чувствительных пилей адгезии, установлено, что все изученные штаммы содержали изменённые гены структурных единиц пилей, ранее обозначенные нами как mshA-like и mshC-like [13]. Их продукты различались по аа-составу и на дендрограммах имели разную степень сходства друг с другом (данные не показаны), однако все сохраняли активные домены адгезинов. Белки MshA-like могли различаться и по длине (148–162 аа), тогда как MshC-like все содержали по 170 аа. Ни один не имел близкого родства с прототипными белками MshA (178 аа) и MshC (162 аа).
Кроме msh-кластера, у всех штаммов также присутствовали кластеры генов, ответственных за образование полисахаридов vpsI (vpsUABCDEFGYIJK), vpsII (vpsLMNOPQ) и матрикса биоплёнки rbm (rbmABCDEF), расположенного между ними. Все перечисленные гены у исследуемых штаммов в разной степени отличались как от прототипа, так и друг от друга по нуклеотидному составу, а некоторые и по длине, однако ни у одного не образовалось преждевременного стоп-кодона. Интактными оказались и гены регуляторов их экспрессии, локализованные в других участках генома — положительных (VpsR, VpsT) и отрицательных (CytR, HapR и H-NS). Наиболее гетерогенным оказался кластер vpsI: только у 5 штаммов (1175, 14980, 20284, 20377 и 735) его структура полностью совпадала с прототипом, хотя в самих генах обнаруживались различные SNP. Напротив, у остальных выявлены отклонения, состоящие в отсутствии генов vpsC, vpsG и появлении новых ORF, не идентифицированных программой «BioEdit». Так, у штаммов 173 и 41 при отсутствии идентифицируемых vpsF и vpsG на их месте находились 2 ORF. Согласно данным программы «BLASTP», продукт первой имел 99–100% идентичности ряду гипотетических белков холерных вибрионов (EGR4217822, EGQ7706406, EGQ7879351 и др.), однако самой программой был обозначен как белок синтеза полисахаридов семейства VpsF (WP_000660859). Продукт второй ORF также имел 99–100% гомологи в базе NCBI среди гликозилтрансфераз V. cholerae (WP_113629015, EEO14829, EGQ9982865, EGR2039702, EGR2114868 и др.). У штамма 118 перед геном, сходным с vpsI, находились 3 дополнительных ORF, имеющих гомологи в NCBI; продукт одной из них (ORF2) был гомологичен большей части молекул белков, обозначенных как рибозилтрансферазы (WP_108243855, EGQ7689606 и др.) и содержал соответствующие активные домены, тогда как продукты ORF1 и ORF3 одинаковой длины (374 аа), но с совершенно различным аа-составом, тем не менее содержали одинаковые потенциальные домены. Один из которых имеет отношение к синтезу полисахаридов, функция второго неизвестна, хотя он сходен с RimK α-глутаматлигаз.
Самой выраженной вариабельностью обладал ген vpsU. У всех исследуемых НАГ-вибрионов эти гены различались по нуклеотидному составу, у некоторых также по длине и старт-кодонам, а у штамма 118 он даже не был идентифицирован программой «BioEdit», однако в дальнейшем в его продукте программой «BLASTP» были выявлены те же домены низкомолекулярных тирозинфосфатаз, что и у VpsU.
Кластеры vpsII и rbm были более или менее близки прототипам (не считая SNP в генах), за исключением «неопознанного» гена rbmA штамма 20284, продукт которого был гомологичен гипотетическим белкам V. cholerae (WP_142569116, TQP27817, TQQ39191 и др.) и RbmA V. albensis (EEO04139).
Генов, гомологичных детерминантам антибиотикорезистентности (табл. 3), не выявлено почти у всех исследованных штаммов НАГ-вибрионов (табл. 4). Исключением явилось обнаружение гена blaP1 у штамма 735 и catB9 у него же и штаммов 118 и 14980. В то же время у всех выявлен ген nsfA, хотя его связь с устойчивостью к фуразолидону описана для ряда бактерий, но не для холерных вибрионов. Что касается детерминант эффлюкс-помп, участвующих в обеспечении множественной лекарственной устойчивости, то они присутствовали у всех штаммов. Не удалось выявить мобильных элементов (SXT, интегронов класса 1, плазмид) и связанных с ними интеграз. Фенотипически все исследованные штаммы были устойчивы к фуразолидону и чувствительны к большинству антибиотиков. Вместе с тем некоторые проявляли резистентность к отдельным препаратам — от 1 до 4 (табл. 4).
Таблица 4. Минимальная подавляющая концентрация (мг/л) штаммов V. cholerae nonO1/nonO139 и наличие генов антибиотикорезистентности
Table 4. Minimal inhibitory concentrations (mg/l) for V. cholerae nonO1/nonO139 strains and presence of genes associated with antibiotic resistance
Примечание. TET — тетрациклин, DOX — доксициклин, CMP — хлорамфеникол, AMP — ампициллин, CFT — цефтриаксон, NAL — налидиксовая кислота, CIP — ципрофлоксацин, STR — стрептомицин, KAN — канамицин, GEN — гентамицин, RIF — рифампицин, FUR — фуразолидон, SXT — триметоприм/сульфаметоксазол.У всех штаммов также выявлены гены эффлюкс-помп VC1634, vcmABDHN, vcrM и не выявлены SXT, интегроны 1 класса и плазмиды. R — устойчивость, I — промежуточная устойчивость; остальные значения соответствуют чувствительности в соответствии с МУК 4.2.2495-09.
Note. TET — tetracycline, DOX — doxycycline, CMP — chloramphenicol, AMP — ampicillin, CFT — ceftriaxone, NAL — nalidixic acid, CIP — ciprofloxacin, STR — streptomycin, KAN — kanamycin, GEN — gentamicin, RIF — rifampicin, SXT — trimethoprim/sulfamethoxazoleAll strains also shared efflux pump genes VC1634, vcmABDHN, vcrM, and lacked SXTelements, class 1 integrons and plasmids. R — resistance, I — intermediate resistance; the rest values correspond to sensitivity, in accordance with MUK 4.2.2495-09.
ОБСУЖДЕНИЕ
SNP-анализ показал, что исследованные штаммы НАГ-вибрионов, выделенные от разных больных, в большей или меньшей степени различались. Эти данные подтвердили отсутствие общих источников инфицирования даже в случаях одного места и времени выделения, что не удивительно, поскольку внекишечные формы заболеваний возникают, как правило, спорадически и не связаны с локальными вспышками.
Наибольший интерес представлял сравнительный анализ структуры генов факторов патогенности, которые могли внести свой вклад в развитие заболеваний, а также факторов персистенции, обеспечивающих выживание в водоёмах, обычно служащих источниками инфекции при отитах. При этом многие биологически активные субстанции вибрионов совмещают в себе свойства тех и других, т.е. являются по сути факторами патогенности/ персистенции.
Гены одного из таких факторов — cholix-токсина — были выявлены у 2 из 8 штаммов, причём в виде разных аллелей: chxAI и chxAII. Продукты этих генов (в отличие от третьей известной формы ChxAIII) считаются причастным к развитию в основном внекишечных форм заболеваний, тогда как их роль в патогенезе острых кишечных инфекций остаётся спорной [14]; в то же время все 3 формы могут способствовать персистенции возбудителей в ассоциации с водными ракообразными [15].
Одним из существенных факторов патогенности холерных вибрионов считается высокомолекулярный цитотоксин-актиномодулятор MARTX, чья биологическая активность обусловлена присутствием в молекуле нескольких активных доменов: ACD, RID, CPD, α/βH. У нетоксигенных штаммов, в особенности у НАГ-вибрионов, кодирующий его ген rtxA может быть представлен множеством аллелей. Среди их продуктов зачастую встречаются белки, утратившие один или более доменов, иногда взамен приобретя новые [16]. Наиболее близкими к прототипному MARTX оказались продукты генов двух разных по происхождению штаммов, два других отличались от них не только длиной, но и отсутствием ACD. Белки оставшихся 4 штаммов, лишённые не только ACD, но и α/βH, содержали по 2 RID. Наибольший интерес представляет обнаружение у них rtxA-подобного домена (cd147295), который не выявлялся в MARTX возбудителей кишечных инфекций, изученных нами ранее [16]. Этот домен ещё недостаточно охарактеризован, однако, согласно аннотации программы «BLASTP», встречается у ряда белков, включая MARTX этиологического агента наиболее опасных раневых инфекций V. vulnificus и дермонекротический токсин Pasteurella multicida — возбудителя пастереллеза, который у людей также может протекать в форме раневой инфекции. Поэтому не исключено, что данный изменённый фактор мог приобрести свойства других токсинов, способных участвовать в патогенезе.
В качестве мощного фактора патогенности может выступать гемолизин/цитолизин HlyA, особенно у нетоксигенных штаммов разных серогрупп [1]. В нашем случае кодирующий его ген был интактным у всех 8 штаммов, хотя и представлен разными отличными от прототипа аллелями за счёт молчащих и миссенс-мутаций. Такая же картина наблюдалась при анализе входящего в состав hly-локуса гена металлопротеазы PrtV, обладающей цитотоксической активностью за счёт деградации фибриногена, фибронектина и плазминогена, а также оказывающей летальное действие на водных беспозвоночных, питающихся бактериями [17]. Гены других металлопротеаз — гемагглютинин протеазы HA/P и коллагеназы VchC — также были интактными. Первая может выступать в роли токсина-актиномодулятора и обеспечивать конкурентоспособность вибрионов в разных экологических нишах, благодаря широкому спектру протеолитической активности, вторая, предположительно, способствует развитию раневых инфекций и утилизации коллагена гидробионтов в качестве источника питания [18].
Гены сериновых протеаз vesA, vesC, ivaP, rssP выявлены у всех штаммов, а vesB — только у 4, у остальных он отсутствовал. VesC способствует развитию воспалительной диареи [19], причастность к внекишечным формам заболевания и конкурентоспособности вибрионов нигде не описана, хотя можно предположить, что протеолитическая активность позволяет утилизировать белковые субстраты. VesA и VesB наряду с HA/P могут активировать А-субъединицу холерного токсина, что не актуально для нетоксигенных штаммов, но вносят (особенно вторая) значительный вклад в протеолитическую активность холерных вибрионов [20]. Поскольку холерные вибрионы обладают множеством протеаз, отсутствие гена vesB у 4 исследуемых штаммов вполне может компенсироваться экспрессией других генов. IvaP — сериновая протеаза семейства S8 — участвует в деградации фактора иммунной защиты макроорганизма интелектина, а также в переходе планктонных бактериальных клеток в биоплёнку и обратно [20]. Ромбосортаза (RssP) осуществляет посттранскрипционную модификацию Ves-протеаз, однако экспериментальные данные были получены с использованием прототипной RssP [21], тогда как активность ее изменённых форм неизвестна.
Значительным разнообразием отличались и гены cef, кодирующий цитотонический токсин, одновременно обладающий свойствами липазы/ эстеразы, ответственной за усвоение липидных субстратов и способной к разрушению поверхностно-активных веществ, в настоящее время часто загрязняющих поверхностные водоемы. Продукты всех 8 аллелей генов cef, несмотря на существенные различия, сохранили все характерные активные домены. Причастность Cef к патогенезу внекишечных форм заболеваний не известна, однако его способность повреждать ультраструктуру культивируемых клеток [22] не исключает такой возможности.
Важным фактором патогенности/персистенции холерных вибрионов является T6SS: в организме хозяина вызывает обездвиживание и гибель макрофагов, способствует колонизации кишечника [23], в объектах окружающей среды защищает вибрионы от поедания одноклеточными хищниками, питающимися бактериями, и участвует в колонизации хитина водных беспозвоночных, а в обоих нишах — убивает бактерий-конкурентов, продукты лизиса которых могут служить источниками питания [24]. Отсутствие у некоторых исследованных штаммов отдельных детерминант T6SS вызывает сомнения по поводу возможности её экспрессии, в особенности у штаммов 118, 173, 20377 и 41, поскольку у двух первых отсутствовал ген ключевого эффектора vgrG1, у двух вторых — vasX. Кроме того, у всех 8 штаммов отсутствовал ген tseL. Вместе с тем известно, что VgrG1, VasX и TseL необходимы для проявления устойчивости к поеданию простейшими, а последний и VgrG3 обеспечивают антагонистическую актиность по отношению к бактериям, причём степень утраты данных свойств зависит от числа отсутствующих либо повреждённых генов [25], поэтому для определения соответствующих фенотипов исследуемых штаммов требуются дополнительные экспериментальные исследования.
Наличие интактного кластера T3SS у одного из штаммов предполагает возможность экспрессии данной системы секреции. Известно, что она способствует колонизации кишечника и развитию тяжёлой летальной диареи у лабораторных животных [26]. Высказывалось предположение о её возможном вкладе в выживаемость вибрионов в объектах окружающей среды в ассоциации с водными организмами [27].
Одной из составляющих успешного переживания в водоёмах является способность вибрионов к биоплёнкообразованию. Кодируемые msh-кластером пили MSHA обеспечивают адгезию бактериальных клеток к абиотическим и биотическим поверхностям, предшествующую формированию биопленки, а её дальнейшее созревание зависит от экспрессии генов, организованных в 3 сцепленных кластера: vpsI-rbm-vps-II. Несмотря на существенные различия в структуре этих кластеров, мы полагаем, что все они находятся в функционально активном состоянии. Ранее нами были выявлены штаммы V. cholerae O1 серогруппы, обладающие сходной структурой генов mshA-like, mshC-like, vps, rbm и при этом в экспериментах in vitro образовавшие зрелые биоплёнки на стекле с гораздо большей скоростью по сравнению со штаммами, содержащими прототипные либо близкие им кластеры [9]. Не исключено, что именно эти изменения лежат в основе селективных преимуществ и НАГ-вибрионов. MSHA обычно связывают с персистенцией холерных вибрионов в водоёмах за счёт формирования биоплёнок на абиотических и биотических поверхностях и противостояния поеданию водными беспозвоночными, тогда как их роль в колонизации кишечника человека считается незначительной. Однако MSHA-подобные пили не чувствительны к маннозе, и в условиях эксперимента штаммы НАГ-вибрионов — возбудители острых кишечных инфекций с таким же генотипом — обладали адгезивной активностью [13]. Это позволяет предположить, что в отсутствие пилей TCP и других адгезинов они могут брать на себя роль ключевого фактора колонизации.
Для успешного лечения НАГ-инфекций крайне важны данные о спектрах резистентности штаммов-возбудителей. В литературе описан случай полного излечения больного, страдавшего от хронического отита в течение 3 лет, после непродолжительного применения ушных капель с правильно подобранным антибиотиком (ципрофлоксацином) [4]. Известны и другие случаи успешного лечения отитов препаратами, подобранными на основе антибиотикограмм [3][5][6]. В литературе встречаются сообщения о штаммах НАГ-вибрионов, устойчивых к одному и более антибактериальным препаратам и содержащих соответствующие генетические детерминанты в составе интегронов либо плазмид [28][29]. Изученные нами штаммы не содержали мобильных элементов SXT, интегронов 1 класса, плазмид и, соответственно, связанных с ними детерминант антибиотикорезистентности. В большинстве случаев их отсутствие коррелировало с чувствительностью к антибиотикам. Однако иногда наблюдалось несоответствие результатов изучения фено- и генотипов. Например, 5 из 8 штаммов были в различной степени устойчивы к ампициллину, и только у одного из них, самого устойчивого, были выявлены гомологи генов бета-лактамаз blaP1, blacarb7, bla-carb9, хотя все они обнаруживались в одной позиции, что указывает на присутствие одного гена в виде аллеля, характерного для этого штамма.
Что касается устойчивости всех изученных нами штаммов к фуразолидону, то не исключается, что она обусловлена продуктом гена nfsA, хотя сведения о связи между его экспрессией и реальной устойчивостью холерных вибрионов к нитрофуранам в литературе отсутствуют.
По одному штамму были устойчивы к цефтриаксону и налидиксовой кислоте, по 2 — к рифампицину и триметоприм/сульфаметоксазолу при полном отсутствии соответствующих генов. И наоборот, все 3 штамма, содержащие catB9, были чувствительны к хлорамфениколу. Аналогичные несоответствия были выявлены S. Lepuschitz и соавт. при изучении штаммов НАГ-вибрионов, выделенных из природного водоёма [8], несмотря на использование ими не только базы данных CARD, но и ResFinder6. Авторы считают, что на сегодняшний день эти базы являются недостаточно надёжными для оценки устойчивости НАГ-вибрионов и нуждаются в существенном пополнении.
С другой стороны, экспрессия генов не является единственным способом защиты от антимикробных агентов. Практически все холерные вибрионы, в том числе изученные нами штаммы, имеют эффлюкс-помпы, препятствующие проникновению антибиотиков в бактериальную клетку [30]. Кроме того, устойчивость зависит от внешних факторов и сложных регуляторных механизмов, требующих отдельного изучения.
В связи с вышеизложенным на данном этапе при выборе адекватного препарата для этиотропной терапии НАГ-инфекций следует полагаться в основном на фенотип.
ЗАКЛЮЧЕНИЕ
Проведённый анализ показал, что все изученные штаммы-возбудители отитов обладают достаточными наборами детерминант факторов патогенности для успешной реализации патогенетического потенциала, что, впрочем, характерно и для большинства НАГ-вибрионов, причастных к развитию других форм заболеваний (как внекишечных, так и кишечных). Эти наборы могут варьировать от штамма к штамму, но отсутствие одних генов может компенсироваться наличием других, что определяет способность вызывать различные патологические процессы в организме человека. Кроме того, НАГ-вибрионы как естественные обитатели поверхностных водоёмов хорошо приспособлены к длительному существованию в объектах окружающей среды за счёт целого ряда факторов персистенции, причём эти функции часто присущи факторам патогенности, поэтому мы назывем их факторами патогенности/персистенции. Продукция таких факторов находится под контролем ряда регуляторных белков, запускающих либо блокирующих экспрессию в зависимости от пребывания в той или иной экологической нише [1].
Несмотря на то что внекишечные формы НАГ-инфекций носят спорадический характер и не передаются от человека к человеку, выявление в последние годы штаммов-возбудителей на территории России вызывает настороженность и указывает на необходимость повышения внимания к данной группе микроорганизмов. В связи с этим представляется целесообразным включение тестов на присутствие НАГ-вибрионов в схему бактериологического анализа при отитах и других внекишечных инфекциях, этиологическим фактором которых могут быть эти микроорганизмы. В случаях их выделения требуется оперативное определение чувствительности к антибиотикам, что позволит обеспечить применение оптимальной схемы лечения больных или осуществить её своевременную коррекцию.
1. URL: http://blast.ncbi.nlm.nih.gov
2. URL: http://www.mbio.ncsu.edu/bioedit
3. Comprehensive Antibiotic Resistance Database. URL: https://card.mcmaster.ca
4. Методические указания 4.2.2495-09. Определение чувствительности возбудителей опасных бактериальных инфекций (чума, сибирская язва, холера, туляремия, бруцеллез, сап, мелиоидоз) к антибактериальным препаратам. М., 2009. 59 c.
5. По базе данных CDD — Conserved Domains Database. URL: https://www.ncbi.nlm.nih.gov/Structure/cdd
6. URL: http://www.genomicepidemiology.org
About the authors
Elena V. Monakhova
Rostov-on-Don Plague Control Researsh Institute
Author for correspondence.
Email: monakhova_ev@antiplague.ru
ORCID iD: 0000-0002-9216-7777
D. Sci. (Biol.), chief researcher, Department of microbiology of cholera and other acute intestinal infections
Russian Federation, Rostov-on-DonAlexey S. Vodop'yanov
Rostov-on-Don Plague Control Researsh Institute
Email: monakhova_ev@antiplague.ru
ORCID iD: 0000-0002-9056-3231
Cand. Sci. (Med.), senior researcher, Laboratory of molecular biology of natural focal and zoonotic infections
Vladimir D. Kruglikov
Rostov-on-Don Plague Control Researsh Institute
Email: monakhova_ev@antiplague.ru
ORCID iD: 0000-0002-6540-2778
D. Sci. (Med.), Head, Department of microbiology of cholera and other acute intestinal infections
Russian Federation, Rostov-on-DonNadezhda A. Selyanskaya
Rostov-on-Don Plague Control Researsh Institute
Email: monakhova_ev@antiplague.ru
ORCID iD: 0000-0002-0008-4705
Cand. Sci. (Med.), senior researcher, Department of microbiology of cholera and other acute intestinal infections
Russian Federation, Rostov-on-DonRuslan V. Pisanov
Rostov-on-Don Plague Control Researsh Institute
Email: monakhova_ev@antiplague.ru
ORCID iD: 0000-0002-7178-8021
Cand. Sci. (Biol.), Head, Laboratory of molecular biology of natural focal and zoonotic infections
Russian Federation, Rostov-on-DonAlexey K. Noskov
Rostov-on-Don Plague Control Researsh Institute
Email: monakhova_ev@antiplague.ru
ORCID iD: 0000-0003-0550-2221
Cand. Sci. (Med.), Director
Russian Federation, Rostov-on-DonReferences
- Монахова Е.В., Архангельская И.В. Холерные вибрионы неО1/неО139 серогрупп в этиологии острых кишечных инфекций: современная ситуация в России и в мире. Проблемы особо опасных инфекций. 2016; (2): 14-23. https://doi.org/10.21055/0370-1069-2016-2-14-23
- Schirmeister F., Dieckmann R., Bechlars S., Bier N., Faruque S.M., Strauch E. Genetic and phenotypic analysis of Vibrio cholerae non-O1, non-O139 isolated from German and Austrian patients. Eur. J. Clin. Microbiol. Infect. Dis. 2014; 33(5): 767- 78. https://doi.org/10.1007/s10096-013-2011-9.
- van Bonn S.M., Schraven S.P., Schuldt T., Heimesaat M.M., Mlynski R., Warnke P.C. Chronic otitis media following infection by non-O1/non-O139 Vibrio cholerae: a case report and review of the literature. Eur. J. Microbiol. Immunol. (Bp). 2020; 10(3): 186-91. https://doi.org/10.1556/1886.2020.0001310.1556/1886.202000013
- Kechker P., Senderovich Y., Ken-Dror S., Laviad-Shitrit S., Arakawa E., Halpern M. Otitis media caused by V. cholerae O100: a case report and review of the literature. Front. Microbiol. 2017; 8: 1619. https://doi.org/10.3389/fmicb.2017.01619
- Leroy A.G., Lerailler F., Quilici M.L., Bourdon S. Vibrio cholerae non-O1/non-O139 otitis in metropolitan France. Med. Mal. Infect. 2019; 49(5): 359-61. https://doi.org/10.1016/j.medmal.2019.03.003 (in French)
- Díaz-Menéndez M., Alguacil-Guillén M., Bloise I., García-Pallarés M., Mingorance J. A case of otitis externa caused by non01/non-0139 Vibrio cholerae after exposure at a Mediterranean bathing site. J. Rev. Esp. Quimioter. 2018; 31(3): 295-7.
- Vezzulli L., Grande C., Reid P.C., Hélaouët P., Edwards M., Höfle M.G., et al. Climate influence on Vibrio and associated human diseases during the past half-century in the coastal North Atlantic. Proc. Natl Acad. Sci. USA. 2016; 113(34): E5062-71. https://doi.org/10.1073/pnas.1609157113
- Lepuschitz S., Baron S., Larvor E., Granier S.A., Pretzer C., Mach R.L., et al. Phenotypic and genotypic antimicrobial resistance traits of Vibrio cholerae non-O1/non-O139 isolated from a large Austrian lake frequently associated with cases of human infection. Front. Microbiol. 2019; 10: 2600. https://doi.org/10.3389/fmicb.2019.02600
- Титова С.В., Монахова Е.В., Алексеева Л.П., Писанов Р.В. Молекулярно-генетические основы биопленкообразования как составляющей персистенции Vibrio cholerae в водоемах Российской Федерации. Экологическая генетика. 2018; 16(4): 23-32. https://doi.org/10.17816/ecogen16423-32
- Водопьянов А.С., Писанов Р.В., Водопьянов С.О., Мишанькин Б.Н., Олейников И.П., Кругликов В.Д. и др. Молекулярная эпидемиология Vibrio cholerae - разработка алгоритма анализа данных полногеномного секвенирования. Эпидемиология и инфекционные болезни. 2016; 21(3): 146-52. https://doi.org/10.18821/1560-9529-2016-21-3-146-152
- Rule C.S., Park Y.J., Delarosa J.R., Turley S., Hol W.G.J., McColm S., et al. Suppressor mutations in type II secretion mutants of Vibrio cholerae: inactivation of the VesC protease. mSphere. 2020; 5(6): e01125-20. https://doi.org/10.1128/mSphere.01125-20
- Crisan C.V., Hammer B.K. The Vibrio cholerae type VI secretion system: toxins, regulators and consequences. Environ. Microbiol. 2020; 22(10): 4112-22. https://doi.org/10.1111/1462-2920.14976
- Монахова Е.В., Архангельская И.В., Титова С.В., Писанов Р.В. MSHA-подобные пили нетоксигенных штаммов холерных вибрионов. Проблемы особо опасных инфекций. 2019; (3): 75-80. https://doi.org/10.21055/0370-1069-2019-3-75-80
- Awasthi S.P., Asakura M., Chowdury N., Neogi S.B., Hinenoya A., Golbar H.M., et al. Novel cholix toxin variants, ADPribosilating toxins in Vibrio cholerae nonO1/nonO139 strains, and their pathogenicity. Infect. Immun. 2013; 81(2): 531-41. https://doi.org/10.1128/IAI.00982-12
- Lugo M.R., Merrill A.R. The father, son and cholix toxin: the third member of the DT group mono-ADP-ribosyltransferase toxin family. Toxins (Basel). 2015; 7(8): 2757-72. https://doi.org/10.3390/toxins7082757
- Монахова Е.В., Архангельская И.В., Писанов Р.В., Титова С.В. Особенности первичной структуры цитотоксина MARTX нетоксигенных штаммов Vibrio cholerae разных серогрупп. Проблемы особо опасных инфекций. 2018; (3): 73-7. https://doi.org/10.21055/0370-1069-2018-3-73-77
- Vaitkevicius K., Rompikuntal P.K., Lindmark B., Vaitkevicius R., Song T., Wai S.N. The metalloprotease PrtV from Vibrio cholerae. FEBS J. 2008; 275(12): 3167-77. https://doi.org/10.1111/j.1742-4658.2008.06470.x
- Park B.R., Zielke R.A., Wierzbicki I.H., Mitchell K.C., Withey J.H., Sikora A.E. A metalloprotease secreted by the type II secretion system links Vibrio cholerae with collagen. J. Bacteriol. 2015; 197(6): 1051-64. https://doi.org/10.1128/JB.02329-14
- Syngkon A., Elluri S., Koley H., Rompikuntal P.K., Saha D.R., Chakrabarti M.K., et al. Studies on a novel serine protease of a ΔhapAΔprtV Vibrio cholerae O1 strain and its role in hemorrhagic response in the rabbit ileal loop model. PLoS One. 2010; 5(9): e13122. https://doi.org/10.1371/journal.pone.0013122
- Hatzios S.K., Abel S., Martell J., Hubbard T., Sasabe J., Munera D., et al. Chemoproteomic profiling of host and pathogen enzymes active in cholera. Nat. Chem. Biol. 2016; 12(4): 268- 74. https://doi.org/10.1038/nchembio.2025
- Gadwal S., Johnson T.L., Remmer H., Sandkvist M. C-terminal processing of GlyGly-CTERM containing proteins by rhombosortase in Vibrio cholerae. PLoS Pathog. 2018; 14(10): e1007341. https://doi.org/10.1371/journal.ppat.1007341
- Монахова Е.В., Федоренко Г.М., Мазрухо А.Б., Писанов Р.В., Кругликов В.Д., Маркина О.В. и др. Изучение биологического действия цитотонического фактора Cef холерных вибрионов на моделях in vitro и in vivo. Проблемы особо опасных инфекций. 2012; (1): 62-5.
- Blokesch M. Competence-induced type VI secretion might foster intestinal colonization by Vibrio cholerae: intestinal interbacterial killing by competence-induced V. cholerae. Bioessays. 2015; 37(11): 1163-8. https://doi.org/10.1002/bies.201500101
- Pukatzki S., Provenzano D. Vibrio cholerae as a predator: lessons from evolutionary principles. Front. Microbiol. 2013; 4: 384. https://doi.org/10.3389/fmicb.2013.00384
- Dong T.G., Ho B.T., Yoder‐Himes D.R., Mekalanos J.J. Identification of T6SS‐dependent effector and immunity proteins by Tn‐seq in Vibrio cholerae. Proc. Natl Acad. Sci. USA. 2013; 110(7): 2623-8. https://doi.org/10.1073/pnas.1222783110
- Shin O.S., Tam V.C., Suzuki M., Ritchie J.M., Bronson R.T., Waldor M.K., et al. Type III secretion is essential for the rapidly fatal diarrheal disease caused by non-O1, non-O139 Vibrio cholerae. mBio. 2011; 2(3): e00106-11. https://doi.org/10.1128/mBio.00106-11
- Dzeijman M., Serruto D., Tam V.C., Sturtevant D., Diraphat P., Faruque S.M., et al. Genomic characterization of non-O1, non-O139 Vibrio cholerae reveals genes for a type III secretion system. Proc. Natl Acad. Sci. USA. 2005; 102(90): 3465-70. https://doi.org/10.1073/pnas.0409918102
- Shi L., Fujihara K., Sato T., Ito H., Garg P., Chakrabarty R., et al. Distribution and characterization of integrons in various serogroups of Vibrio cholerae strains isolated from diarrhoeal patients between 1992 and 2000 in Kolkata, India. J. Med. Microbiol. 2006; 55(Pt. 5): 575-83. https://doi.org/10.1099/jmm.0.46339-0
- Verma J., Bag S., Saha B., Kumar P., Ghosh T.S., Dayal M., et al. Genomic plasticity associated with antimicrobial resistance in Vibrio cholerae. Proc. Natl Acad. Sci. USA. 2019; 116(13): 6226-31. https://doi.org/10.1073/pnas.1900141116
- Das B., Verma J., Kumar P., Ghosh A., Ramamurthy T. Antibiotic resistance in Vibrio cholerae: understanding the ecology of resistance genes and mechanisms. Vaccine. 2020; 38(Suppl. 1): A83-92. https://doi.org/10.1016/j.vaccine.2019.06.031
Supplementary files