Marburg virus and the disease it causes
- Authors: Markin V.A.1
-
Affiliations:
- 48 Central Research Institute of the Ministry of Defense of the Russian Federation
- Issue: Vol 99, No 5 (2022)
- Pages: 605-618
- Section: REVIEWS
- URL: https://microbiol.crie.ru/jour/article/view/1208
- DOI: https://doi.org/10.36233/0372-9311-273
- ID: 1208
Cite item
Full Text
Abstract
Over the 50 years since its discovery, many properties of the Marburg virus have been studied, but no reliable medical remedies of preventing and treating the infection it causes have been developed, although it can potentially cause large-scale epidemics.
Marburg fever is relevant due to the risk of importation to other countries. The source of infection in nature is bats (reservoir) and monkeys (intermediate host), and the routes of transmission are aerosol, contact and alimentary. The mortality rate in recent outbreaks has reached 90%. In convalescents the causative agent was identified in tears, semen, and liver biopsies weeks and months after recovery.
The lack of therapeutic and prophylactic antiviral drugs, high rates of mortality, infectivity, the ability of aerosol contamination, and a high epidemic potential all together define Marburg fever as a serious global threat to international health. The development of medical protection against this infection should be an urgent task of ensuring the biological safety of the population of the Russian Federation.
The most promising ways to develop vaccines against Marburg fever are the construction of recombinants based on adenovirus, vesicular stomatitis virus or alphavirus replicon, DNA vaccines. A reliable protective effect of the chemotherapy drug remdesivir in combination with human antibodies, as well as an etiotropic drug with an antisense mechanism of action and an interferon inducer has been shown. In model experiments with pseudovirus, fundamentally new ways of developing pathogen inhibitors were found — preventing its exit from cells, as well as the construction of anti-gene-binding Fab fragments that inhibit the synthesis of viral RNA.
Full Text
Введение
В 1967 г. произошли одновременные вспышки геморрагической лихорадки в Германии и Югославии, получившей название «лихорадка Марбург» (ЛМ) по месту первоначального выделения вируса. Возбудитель проявил себя в последующих эпидемиях в Африке как чрезвычайно патогенный для человека микроорганизм. Беспрецедентная эпидемия 2013–2016 гг., вызванная близкородственным филовирусом Эбола [1], объявленная ВОЗ чрезвычайной ситуацией, свидетельствует, что и филовирус Марбург (MARV) потенциально может вызвать крупномасштабные эпидемии. В 2018 г. ВОЗ включила обе эти инфекции в список приоритетных заболеваний в контексте чрезвычайных ситуаций в области общественного здравоохранения [2]. За время, прошедшее с момента открытия, изучены многие свойства MARV и вызываемого им заболевания, однако до настоящего времени в практике отсутствуют медицинские средства профилактики и лечения инфекции, что позволяет определить данный возбудитель в случае заноса или биотерроризма как потенциальную биологическую угрозу национальной безопасности России [3].
Цель настоящей работы — обобщение результатов более чем полувековой истории изучения MARV, достижений в исследовании эпидемиологии, проявлений заболевания, патогенеза инфекции, её диагностики, а также состояния разработки медицинских средств профилактики и лечения данной инфекции.
Таксономия
В соответствии с решением таксономического комитета по вирусам [4] семейство Filoviridae, входящее в порядок Mononegavirales, состоит из 6 родов: Ebolavirus, Marburgvirus, Cuevavirus, Dianlovirus, Striavirus, Thamnovirus. Наиболее изученными из них являются вирусы Эбола и MARV, имеющие сходную структуру, вызываемые ими заболевания близки по патогенезу, клиническим проявлениям, тяжести и исходу. Анализ гена гликопротеина (GP) выявил различия в составе нуклеотидов этих вирусов от 37 до 41%. Сиквенс геномов ангольских изолятов на внутривидовом уровне MARV показал вариацию в пределах 7% [5]. Род Marburgvirus по этой классификации представлен видом Marburg marburgvirus, включающим Marburgvirus (MARV) и Ravnvirus (RAVV) [4]. По анализу скорости молекулярной эволюции филовирусов S.A. Carroll и соавт. определили, что появление общего предшественника семейства Filoviridae произошло около 10 400 лет назад, а MARV — около 700 лет назад [6].
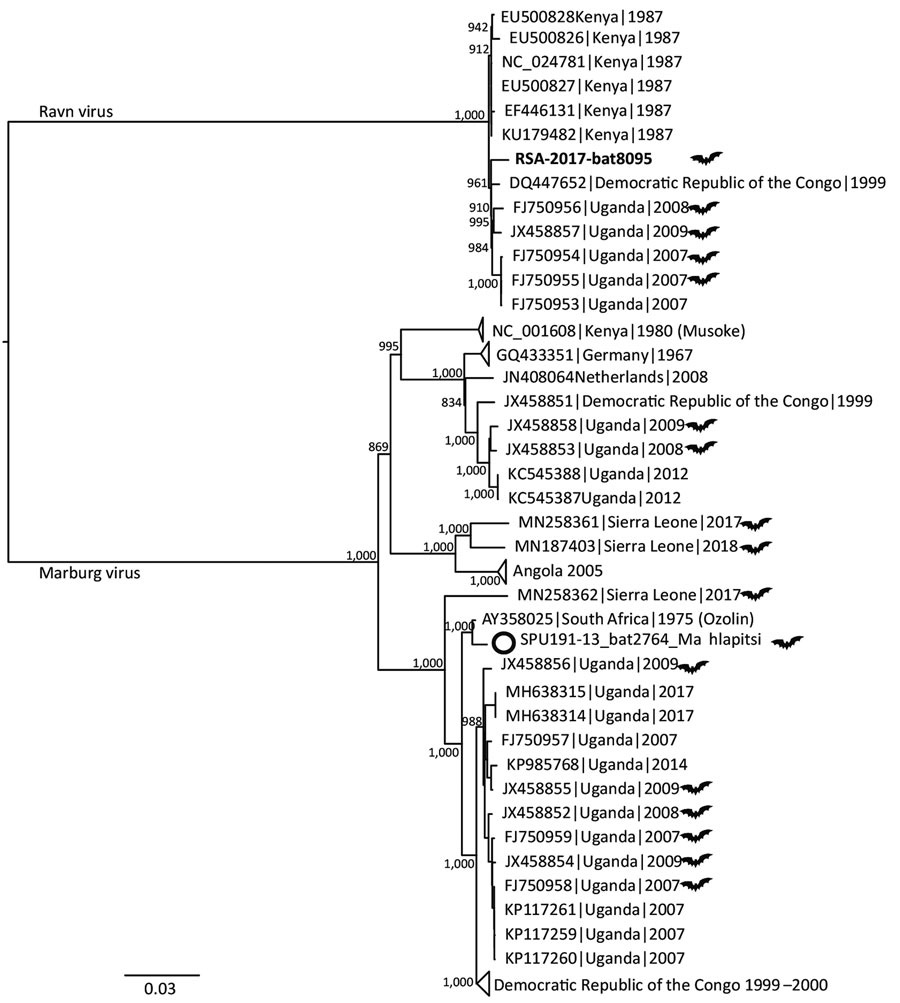
Филогенетический анализ сиквенсов генома вирусов рода Marburgvirus показал, что можно выявить по крайней мере 5 линий возбудителей этого рода, из которых 4 очень тесно связаны (последовательности нуклеотидов отличаются до 7%), в то время как пятый отстоит далеко (различия в нуклеотидном составе — 21%) [5]. Поскольку расхождения между их геномами ниже 23% — принятого уровня для классификации видов вирусов по их геномике, то 5 линий MARV были переклассифицированы в 2 вируса: MARV и RAVV [6]. Вирус RAVV был выделен в 1987 г. однократно при вспышке в Демократической Республике Конго (ДРК) в 1998–2000 гг., а также от одного человека и нескольких летучих мышей во время вспышки в Уганде в 2007 г. На рис. 1 представлена филогения рода Marburgvirus [7].
Рис. 1. Филогения рода Marburgvirus. Филогенетическое древо показывает эволюционные отношения видов возбудителя. Указаны регистрационные номера изолятов в GenBank. Изоляты, выделенные из летучих мышей, показаны с использованием символа летучей мыши. Шкала показывает нуклеотидные замены на сайт [7].
Геномы высокопатогенных для человека изолятов MARV из Анголы и менее патогенных большинства восточноафриканских изолятов возбудителя, а также вызвавших вспышки в 1967 г., отличаются приблизительно на 7%. В то же время не обнаружена корреляция наблюдаемых генетических различий с более высокой патогенностью вируса для людей [5]. В ДРК было выявлено не менее 9 различных вариантов вируса, выделенных от людей в разных вспышках и от животных — природных хозяев MARV. В ангольской вспышке последовательные контактные передачи возбудителя от человека к человеку показали весьма высокую генетическую стабильность вирусного генома данного варианта — даже после 2–3 передач MARV от человека к человеку у изолятов определялись идентичные геномы [8].
Эпидемиология
Ареал филовирусов включает Африку, Южную и Центральную Европу, Юго-Восточную Азию и Китай [8–10]. В августе 1967 г. в Марбурге, Франкфурте и Белграде одновременно заболел 31 сотрудник биологических институтов (25 первичных случаев, 6 вторичных), 7 из которых погибли; ещё 1 вторично инфицированный был диагностирован ретроспективно. Источником MARV явились мартышки (Chlorocebus aethiops), импортированные из Уганды одной партией. Кумулятивная летальность в данных вспышках составила 22%. Анализ европейских вспышек показал, что после 2–3 передач MARV от человека человеку его патогенность резко снижалась [11].
Вторая вспышка ЛМ произошла в 1975 г. в Зимбабве. С 1975 по 1997 г. регистрировали только спорадические вспышки этой инфекции на африканском континенте; было выявлено 474 случая заболевания при 377 смертельных исходах (летальность 79,5%) [12]. С учётом изолированности мест обитания людей, неразвитости здравоохранения, вероятно, фактических случаев заболевания было больше [13]. По сообщению Международного общества по инфекционным болезням, последняя вспышка ЛМ в Африке была зарегистрирована в июне 2022 г. в Гане, в которой на 02.08.2022 диагностировано 4 заболевших, 3 из которых в одной семье погибли. Это не первый случай обнаружения MARV в Западной Африке. В 2021 г. было 2 подтверждённых случая ЛМ в Гвинейской Республике. Ранее вирус был обнаружен в соседней Сьерра-Леоне у нескольких летучих мышей Rousettus aegyptiacus [14].
Кроме описанной выше ситуации 1967 г., случаи заноса ЛМ из Африки в другие регионы были зарегистрированы лишь дважды — в 2008 г. возбудитель был интрадуцирован в США и Нидерланды [5].
В дополнение к этим случаям заболевания известно о 28 внутрилабораторных заражениях MARV (в том числе 4 — в нашей стране), бóльшая часть пострадавших в которых погибла [12, 15].
Поскольку летальность, связанная с этим заболеванием, а также количество заболевших были существенно ниже, чем при вспышках лихорадки Эбола (до 90%), то долго считали, что ЛМ гораздо менее опасна. Это представление об опасности MARV было пересмотрено после больших вспышек в ДРК в 1998–2000 гг. и затем в крупнейшей зарегистрированной вспышке в Анголе в 2004–2005 гг. Общее количество (469 случаев) и высокая летальность (83% в ДРК и 90% в Анголе) показали, что ЛМ может представлять столь же большую угрозу здоровью населения, как и лихорадка Эбола [2, 3, 12, 16].
В связи с отсутствием вакцины и лечебных противовирусных препаратов, высокими показателями летальности и инфекциозности, а также потенциальной возможностью аэрозольного заражения, работы с MARV ограничиваются лабораториями наивысшего уровня биологической безопасности (BSL-4) [3]. В соответствии с Санитарными правилами MARV отнесён к возбудителям I группы патогенности.
ЛМ считают зоонозом, возбудитель которого сохраняется во внешне здоровом хозяине-резервуаре в эндемичных регионах. Люди и обезьяны — промежуточные хозяева, у которых высокий показатель летальности [17]. Почти все первичные природные инфицирования людей MARV до настоящего времени связаны с контактами с летучими мышами, в том числе с употреблением их в пищу [7, 13]. Эти животные — главный резервуар возбудителя в природе — играют важную роль в цикле его передачи. MARV был обнаружен в популяции нильского крылана — фруктоядной летучей мыши (R. aegyptiacus). Геномный анализ изолятов MARV от летучих мышей выявил близость их сиквенсов геномам изолятов от заражённых людей (рис. 1) [7, 17]. Из проверенной 1431 летучей мыши из ЮАР антитела к MARV были выявлены у 53% животных, а у части — к RAVV. Передача MARV среди летучих мышей может происходить вертикально или горизонтально через прямые контакты и, предположительно, через укусы, половые контакты или через членистоногих [16].
Летучие мыши являются естественными резервуарами филовирусов в 8 странах Азии, Африки и Европы. Генетически дивергентные филовирусы, обнаруженные у насекомоядных летучих мышей Rousettus и Eonycteris spp. в Китае, показали 61–99% гомологию с родом Dianlovirus; филогенетический анализ выявил также высокую схожесть их нуклеотидов с вирусами MARV и RAVV. Филогенетический анализ частичных последовательностей выявил 3 различные группы филовирусов, циркулирующих у плодовых летучих мышей в Китае [9].
Основные пути передачи MARV человеку — аэрозольный, контактный и алиментарный. Первичные пациенты с ЛМ, как правило, заражаются вирусом от инфицированных животных: животного-резервуара (летучие мыши видов R. аegyptiacus, Miniopterus inflatus и Rhinolophus eloquens) или промежуточного хозяина, как, например, обезьяны; заражение возможно и при употреблении в пищу продуктов, контаминированных выделениями инфицированных летучих мышей. Последующее распространение MARV между людьми — результат прямого контакта с кровью или другими жидкостями и экскретами (слюна, пот, кал, моча, слезы и грудное молоко) больных [8, 16]. Доказано наличие живого MARV в сперме инфицированных мужчин через 3 мес после выздоровления [15]. Особо эпидемиологически значимые находки вируса — в слезах, сперме и биопсийных материалах печени через недели и месяцы после выздоровления [15], что выдвигает на первый план важность контроля за реконвалесцентами. В экспериментальных исследованиях MARV выявляли длительное время в сперме выживших после заражения обезьян [8, 18, 19]. MARV представляет угрозу в связи с риском заноса в другие страны с путешественниками, импортированными обезьянами и летучими мышами [8, 12, 17].
Структура MARV
Вирионы возбудителя плеоморфны и имеют форму нити, прута, тора, крюка или цифры шесть. Анализ очищенных вирионов показал, что приблизительно 30% вирусных частиц, полученных в инфицированных клетках Vero, были нитевидными, 37% имели форму шестёрок и 33% были торообразными. Длина частиц MARV, по данным разных исследований, составляет до 14 000 нм (в среднем 790–892 нм), а средний диаметр — 80–91 нм. Вирионы MARV окружены мембраной, покрытой шипами длиной 5–10 нм, которые сформированы тримерами вирусного GP [5, 20]. Нуклеокапсид (NC) представляет собой трубчатую структуру с внешним диаметром 45–50 нм и электронно-плотной центральной осью диаметром 19–25 нм. Центральная ось окружена винтовой капсулой с поперечной бороздчатостью с интервалом 5 нм [21]. NC формирует левостороннюю спираль с шагом 7,5 нм при 14,96 выступа на виток с двумя плотными внутренними лепестками за выступами. Внутренние лепестки представляют нуклеопротеин (NP); NC MARV содержит в среднем 29,92 молекулы NP на виток; с каждой молекулой NP упакованы 6 оснований РНК [22].
Комплекс NC MARV состоит из геномной РНК и 4 плотно связанных белков: NP, VP35, VP30 и L. Энкапсидация вирусной РНК белками NC защищает её от разрушения РНКазами и от выявления клеточными рецепторами распознавания. Антигеномный РНК-репликативный посредник также энкапсидирован его белками. NC служит шаблоном для вирусной транскрипции и репликации [8, 23].
NP энкапсидирует геномную и антигеномную РНК и осуществляет взаимодействия с большинством других вирусных белков, приводя к их внутриклеточному перераспределению. NP имеет сильную связь с VP35 и VP30, направляя оба белка во включение в NC. Двусторонний мотив центральной части NP играет важную роль в самосборке и взаимодействии NP-VP35 [8, 20, 23].
Структура вириона MARV представлена на рис. 2 [16].
Рис. 2. Структура вириона и организация генома MARV [16].
Организация генома
Несегментированный негативный геном MARV состоит из 19 112 нуклеотидов и содержит 7 моноцистронных генов, кодирующих структурные белки в следующем линейном порядке: 3'-NP-VP35-VP40-GP-VP30-VP24-L-5'. Каждый ген составлен из консервативного сигнального участка начала транскрипции и сигнала остановки на длинных 3′- и 5′-нетранслируемых областях открытой рамки считывания [8]. Гены отделены короткими межгенными областями размерностью 4–97 нуклеотидов или сигналом остановки/начала транскрипции, разделёнными 5 чрезвычайно консервативными нуклеотидами. Трейлерная эксцистронная 5′-область включает 75 нуклеотидов генома MARV и содержит дополнение антигеномного репликативного промотера [20]. Организация генома MARV представлена на рис. 2 [16].
Вирусные белки
Единственный поверхностный белок MARV — GP — закодирован четвертым геном и имеет функцию проникновения вируса в клетки. После синтеза в эндоплазматическом ретикулуме прекурсор GP расщепляется до 2 дисульфидсвязанных субъединиц: GP1 (массой 160 кД) и GP2 (массой 38 кД) [20]. Внешняя область, которая сформирована главным образом GP1, образует связь с факторами входа и рецепторами; трансмембранная субъединица GP2 содержит пептид слияния вирусной и клеточной мембран. GP играет важную роль в уклонении от иммунного надзора и подавляет не только врождённые, но и адаптивную иммунные реакции [8]. Пептид, соответствующий предполагаемой иммунодепрессивной области GP, вызывает гибель лимфоцитов, подавление выработки цитокинов и блокировку активности нейтрализующих антител во время инфекции [24].
Матричный белок VP40 играет главную роль в почковании вирионов, направляя NC от перинуклеарной области к плазматической мембране, активируя функцию GP на местах почкования и выхода частиц. Белок VP40 покрывает внутреннюю сторону мембраны вириона и ассоциирован с NC. После синтеза в цитоплазме инфицированной клетки белок VP40 связывается с клеточными мембранами и накапливается в перепончатых структурах эндосом мультивезикулярных тел [25]. Помимо функции матричного белка, VP40 MARV также действует как фактор патогенности, противодействуя врождённой иммунной реакции и определяя пермиссивность хозяина для возбудителя, а также блокирует фосфорилирование киназ Janus, которые играют важную роль в многочисленных сигнальных патогенетических механизмах. У MARV, адаптированного к не- или малопермиссивным животным, таким как мышь или морская свинка, были выявлены мутации в белке VP40. Две изменённые аминокислотные последовательности в VP40 у адаптированного к мышам MARV привели к ингибированию интерферона клеток мыши [26].
Белок VP24 — минорный матричный белок вируса, расположен в непосредственной близости от белков NC и может быть частью данного комплекса [23]. Его незначительная часть (приблизительно 10%) слабо связана с клеточными мембранами, включая филоподии, а также находится в цитоплазме, перераспределяясь с NC-содержащими включениями и со свободным NC. Белок VP24 важен для выхода вирусных частиц в развитии инфекции — он вовлечён в созревание транспорт-компетентного NC и/или является медиатором взаимодействия между NC и местами почкования в плазматической мембране [8].
Белок VP35 — кофактор полимеразы для транскрипции и ответа. Вместе с каталитической субъединицей белка L белок VP35 формирует зависимый от РНК комплекс РНК-полимеразы. VP35 служит для соединения комплекса NC и белка L. Без VP35 белок L не связывается с NC, служащим шаблоном для вирусной транскрипции и репликации. Белок VP35 возбудителя, помимо функции транскрипции и репликации, действует и как антагонист интерферона — его экспрессии в отсутствие других вирусных белков было достаточно, чтобы полностью заблокировать индукцию интерферона-α в стимулируемых человеческих дендритных клетках [27].
Белок VP30 плотно ассоциирован с NC через закрепление с NP. Роль белка VP30 MARV в транскрипции и репликации возбудителя недостаточно известна; он, вероятно, играет важную роль в вирусной амплификации [8].
Главный компонент комплекса полимеразы MARV — белок L — имеет молекулярную массу 267 кД. Он важен для транскрипции и репликации, формируя вместе с белком VP35 РНК-зависимый РНК-полимеразный комплекс. Белок L имеет ферментативные функции полимеразы. Связывающим сайтом белка VP35 является 530 аминокислотный остаток белка L. Полагают, что полимераза L MARV выполняет синтез РНК, кэпирование и полиаденилирование вирусных мРНК, хотя эти функции не доказаны экспериментально [8, 20].
Репродукция вируса в клетке
В большинстве исследований по циклу размножения MARV использовали неинфекционные рекомбинантные конструкции, проводя эти эксперименты в лабораториях биологической безопасности низкого уровня защиты (BSL-2). Суррогатные системы, моделирующие определённые этапы в цикле репродукции MARV, включают гликопротеиновый псевдо-GP ретровируса или рекомбинантный ген везикуловирусов, экспрессирующие GP, а также минигеномные системы для исследования репликации и транскрипции. Поскольку такие эксперименты дают основу лишь для поверхностного анализа цикла репродукции MARV, их результаты ориентировочны, т.к. все суррогатные системы не соответствуют элементам инфекционного вируса — его морфологии и составу белков моделируемого возбудителя.
Проникновение MARV включает три фазы: прикрепление к клетке, эндоцитоз и слияние. Медиатором связывания возбудителя с клеткой и проникновения является GP. Вирус первоначально взаимодействует с молекулами поверхности клеток, GP1 расщепляется эндосомальными протеазами, облегчая закрепление с рецептором входа NPC1. После связывания вирионы MARV подвергаются эндоцитозу, механизм которого остаётся неизвестным. Другой важный процесс в проникновении MARV в клетку — протеолитическое расщепление GP1, происходящее, предположительно, когда вирионы продвигаются в пределах эндоцитозных пузырьков. Для эффективного входа вируса в клетку необходимы расщепление эндосомального GP1 хозяйской эндосомальной цистеиновой протеазой и протеолитическая активация GP1 эндосомальными протеазами, облегчающими закрепление рецептора обязательной области к эндосомальному фактору Niemann–Pick — белка C1 [8, 20, 28]. Вирусный NP выходит в цитозоль клетки и запускает транскрипцию вирусного генома; мРНК автоматически транслирует информацию клетке-хозяину. Синтез GP происходит в эндоплазматическом ретикулуме и подвергается многократным посттрансляционным модификациям. Положительные смысловые антигеномы синтезируются от поступающих вирусных геномов и служат шаблонами для копирования новых смысловых отрицательных геномов. После расщепления в аппарате Гольджи GP вириона транспортируются к мультивезикулярным телам и к клеточной мембране, где происходит сборка. NC и белок VP24 также принимают участие в сборке, которую ведёт белок VP40 [20, 28].
Синтезированные NC мигрируют к месту почкования вируса — апикальной мембране [28]. Выход вирионов определяет главным образом белок VP40 через инклюзию NC в плазменные мембраны. Индуцированное белком VP40 почкование усиливают белки NP, GP и VP24 [26]. Считают, что MARV может почковаться непосредственно в смежные клетки через установленный филоподиями межклеточный контакт [8]. Электронные томографические исследования инфицированных MARV клеток показали, что процесс почкования начинается, когда внутриклеточные NC ассоциируются с латеральной стороны плазматической мембраны. Плазматическая мембрана энкапсидирует NC, и вирионы выходят на поверхность клетки. Выход нитевидного MARV из инфицированных клеток достигает максимума через 1–2 сут после заражения, когда клетки внешне ещё не повреждены. На 4-е сутки после инфицирования большинство клеток везикулируются, а вышедшие вирионы имеют форму круга или согнуты, их инфекциозность снижена [21].
Патогенез
Вирус проникает через повреждения кожи или мембраны слизистых оболочек. В периоде инкубации патологические изменения начинают формироваться на биохимическом уровне, а также проявляться в активизации системы иммунитета. Во время инкубационного периода вирус размножается в лимфатических узлах, селезёнке и, возможно, в фиксированных макрофагах различных органов. У людей и животных клетки мононуклеарной системы фагоцитов, включая моноциты, макрофаги и дендритные клетки, являются для MARV первоначальными мишенями; они очень восприимчивы к нему и продуцируют инфекциозный возбудитель. Начальные места репродукции вируса — лимфатические узлы, печень и селезёнка, где происходят самые тяжёлые некротические повреждения [8, 29]. Эти органы содержат большое количество моноцитов и макрофагов, миграция которых после заражения в окружающие ткани, а также транспорт свободного вируса через лимфу или кровоток облегчают, на наш взгляд, диссеминацию возбудителя, приводящую к системной инфекции. Свободный вирус появляется в тканях и органах заражённых животных, а высокие концентрации вируса обнаруживают в крови [29]. Помимо моноцитов, макрофагов и дендритных клеток пермиссивны для MARV гепатоциты, клетки коры надпочечника, медуллярные клетки и фибробласты [28, 29].
В период продромы появляются неспецифические симптомы болезни; больные, как правило, не заразны. Период острого лихорадочного заболевания сопровождается высокой вирусемией и диссеминацией MARV по всем внутренним органам. В стадии разгара, внешне проявляющейся выраженной специфической симптоматикой, происходят все основные патологические процессы, часто приводящие больных к гибели. Патологические микроскопические изменения проявляются в генерализованных очаговых некрозах гепатоцитов с небольшими очажками воспаления, вызывающими нарушения функции печени. В селезёнке и лимфатических узлах появляются некрозы фолликулов, иногда сопровождаемые гиперплазией элементов ретикулоэндотелия. Несколько позже в органах появляются рассеянные геморрагии, особенно в желудочно-кишечном тракте, и диссеминированные внутрисосудистые коагуляции. На фоне этих явлений развиваются интерстициальная пневмония, панкреатит, орхит, иридоциклит и т.д. Поражение макроорганизма происходит на всех уровнях организации — от молекулярного до популяционного, о чём свидетельствуют молекулярно-биологические, вирусологические, биохимические, морфологические, цитохимические, серологические, клинические и эпидемиологические методы исследования ЛМ. Эндотелиальные клетки многих тканей поражаются при заключительной стадии ЛМ [16, 28–31]. На поздних стадиях инфекции MARV может быть выделен почти из каждого органа. Несмотря на высокий уровень концентрации возбудителя и некротические повреждения в заражённых тканях и органах, наблюдают только незначительное воспаление, связанное с разрегуляцией иммунных реакций. Выраженная патология печени влияет на синтез факторов свёртывания крови и способствует наблюдаемым дефектам коагуляции при ЛМ [16, 29]. Указанные патологические последствия размножения вируса в органах вызывают мультиорганный отказ с фатальным исходом [16].
На стадии реконвалесценции происходит нормализация функций органов. Иммунные ответы у людей при ЛМ недостаточно изучены. У выживших больных выявляли выработку вируснейтрализующих антител, титр которых снижался через 21 мес после заражения, а через 27 мес они исчезали [16]. Для сравнения, при лихорадке Эбола у реконвалесцентов вначале нарастают титры иммуноглобулинов М, а затем G и А; у погибающих иммуноглобулины в крови отсутствуют [15].
Механизм реализации патогенности возбудителя связан с прямым и опосредованным действием MARV, что проявляется гибелью клеток в результате размножения в них вируса и извращением защитных реакций организма. В качестве патогена выступают не только реплицирующийся MARV, но и секретируемый GP, а кроме этого — инициированные ими аутоантитела, цитокины, приводящие к нарушениям гомеостаза и развитию основного при ЛМ синдрома — диссеминированного внутрисосудистого свёртывания, приводящего к образованию тромбов в сосудах микроциркуляторного русла в сочетании с несвёртываемостью крови, выражающейся множественными массивными кровоизлияниями. Пусковым механизмом развития этого синдрома является выброс в кровь из лизированных MARV мононуклеарных фагоцитов цитокинов, в том числе фактора некроза опухолей-α (ФНО-α) [31]. Клетки после репродукции в них вируса остаются функционально способны, однако на их наружной поверхности при выходе возбудителя через клеточную мембрану остаётся GP, не востребованный при сборке, являющийся «мишенью» для Т-лимфоцитов. Атака их на эти участки приводит к разрушению жизнеспособных клеток и появлению зон некроза [8, 20]. В результате «цитокинового шторма», вызванного прямым и опосредованным действием вирусных белков на макрофаги, эндотелиальные и тучные клетки с выбросом ими цитокинов (ФНО-α, интерлейкинов-1, -6, -8 и др.), происходят нарастающие нарушения микроциркуляции, гемодинамики, свёртывания крови, метаболизма и функционирования органов, инициации, развития и реализации специфического иммунитета. Особое значение среди них в развитии ЛМ имеет ФНО-α [30, 31].
Причиной развития разнообразных клинических проявлений при ЛМ является каскадная активация комплемента, фагоцитов, свёртывающей системы крови, приводящая к резкому нерегулируемому повышению уровня медиаторов воспаления и иммунного ответа в целом. Данный каскад событий с активацией Т-лимфоцитов, нейтрофилов и тромбоцитов приводит к неконтролируемому выбросу в кровь разнообразных биологически активных веществ — естественные защитные реакции становятся аутоагрессивными, разбалансирующими систему гомеостаза по принципу «порочного круга». Развивается инфекционно-токсический шок с выработкой медиаторов воспаления, индуцирующих многочисленные повреждения разных структурно-функциональных систем [31]. Первичные моноциты и макрофаги человека, активированные MARV, in vitro вырабатывают воспалительные цитокины. Данные об уровнях цитокинов в сыворотках больных ЛМ пациентов не известны [8, 20]. В целом заражение MARV вызывает увеличение выработки воспалительных цитокинов и высокие уровни хемокинов, но молекулярные механизмы, приводящие к этим изменениям, недостаточно известны.
Инфекция у лабораторных животных
Течение ЛМ исследовали на обезьянах, мышах, морских свинках и хомячках. Павианы гамадрилы, циномолгусы, макаки резус и африканские зелёные мартышки в наибольшей степени воспроизводят симптомы и патологию ЛМ, наблюдаемую у людей, с близкой летальностью. Смерть у обезьян наступает через 6–13 сут от момента заражения при развитии тромбоцитопении, лимфопении, нарушении свёртывания крови и с кровоизлияниями [29–32].
Грызуны с неповреждённой иммунной системой не заболевают после заражения природным MARV. Штаммы Musoke, Ci67 MARV и вирус RAVV путём последовательных пассажей были адаптированы к мышам, морским свинкам и хомячкам, однако нарушения коагуляции, развитие типичной сыпи и геморрагических проявлений, как у обезьян, были у них не выражены. Сравнение сиквенсов последовательностей выявило мутации в открытых рамках считывания белков NP, VP35, VP40, VP30 и в вирусной полимеразе L у адаптированных к грызунам вариантах MARV [8, 20].
Проявления инфекции у людей
MARV является одним из самых патогенных и опасных вирусов, поражающих людей. Не зарегистрировано ни одного случая инаппарантного течения ЛМ у человека [8, 20]. Клинические наблюдения во время вспышек 1967 г. в Германии и Югославии, 1998–2000 гг. в ДРК и 2004–2005 гг. в Анголе показали, что при схожести большинства симптомов летальность была значительно выше в последних вспышках ЛМ [11, 15]. Инкубационный период, рассчитанный по самым достоверным зарегистрированным случаям заболевания, находится в пределах 3–21 сут (как правило, 5–10 сут) [11, 15, 16].
ЛМ протекает в 3 фазы: инициация, генерализация, исход.
Инициация (как правило, 1–4-е сутки от момента заражения) характерна гриппоподобными признаками: высокой температурой, сильной головной болью, ознобом, миалгией, недомоганием и иногда прострацией. У 50–75% пациентов это сопровождается быстрым истощением, характеризуемым желудочно-кишечными симптомами, включая анорексию, боль в животе, тошноту, рвоту и диарею.
Генерализация (5–13-е сутки) — сохраняются многие начальные признаки инфекции, в том числе высокая температура. Начиная с 4–5-х суток болезни развиваются сыпь, дисфазия и фарингит. Макуло-папулёзная сыпь, как правило, является первой отличительной особенностью, указывающей на филовирусную инфекцию; неспецифические проявления включают увеличение лимфатических узлов, лейкопению и тромбоцитопению. Дополнительно могут появиться неврологические и психические признаки, включая энцефалит, спутанность сознания, бред, агрессию и раздражительность. Развиваются нарушения сосудистой проницаемости, особенно инъекция конъюнктивы глаз и отёки. Более чем у 75% пациентов появляется геморрагический синдром: петехии, кровотечения, мелена, кровавый понос, кровавая рвота и экхимозы. Поражены многие органы, включая поджелудочную железу, почки и печень.
Исход (13-е сутки) приводит к гибели или выздоровлению пациентов. Типичные предагональные признаки включают беспокойство, спутанность сознания, слабоумие, конвульсии, замедление циркуляции крови из-за тяжёлого обезвоживания, расстройство обмена веществ, тяжёлую диффузную коагулопатию, мультиорганные отказы, шок и кому. Гибель, как правило, происходит на 8–16-е сутки болезни. В несмертельных случаях период выздоровления длительный с проявлениями миалгии, истощения, потливости, очищения кожи на местах сыпи, частичной амнезией и развитием вторичных инфекций [11, 12, 15, 16, 31–33].
Диагностика
Для выявления MARV разработаны вирусологические, серологические и молекулярные диагностические методы, включая выделение возбудителя, определение его видовой принадлежности в реакции связывания комплемента, реакции нейтрализации, иммуноферментном анализе, полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР), иммуноэлектронной микроскопии, иммуногистохимически и электрохимически [2, 8, 12, 15, 33, 34].
Экспрессный анализ с применением NP или GP MARV позволяет в иммуноферментном анализе обнаруживать вирусспецифические антитела к возбудителю, а исследование с моноклональными антителами выявляет вирусный антиген. В 48 ЦНИИ Минобороны России созданы тест-системы иммуноферментные для выявления антигенов вирусов Марбург и Эбола, а также антител к ним. Показатели их специфичности и воспроизводимости по результатам испытаний — не ниже 95%; чувствительность тест-систем для выявления антигенов вирусов составляет не менее 4,5 lg БОЕ/мл. Тест-системы иммуноферментные для выявления антигенов вирусов Марбург и Эбола, а также антител к ним внедрены в практику здравоохранения России [32].
В повседневной практике наиболее приемлем метод ОТ-ПЦР, выявляющий гены GP или NP; он позволяет работать с инактивированными пробами от больных. Модификация ОТ-ПЦР в режиме реального времени с использованием флуоресцентных зондов типа TaqMan (диагностикум «Marburg-TM:pan») позволяет выявлять 0,1–10 БОЕ/PCR штаммов Ci67, Musoke и Angola-TM вируса MARV и вирус RAVV [34].
Согласно результатам наших исследований, вирусологический метод наиболее чувствителен из способов индикации жизнеспособного возбудителя в пробах — пассажами через новорождённых мышей удаётся накопить и выявить минимальные концентрации возбудителя в материалах, не выявляемые в них другими методами. Недостатки данного метода — длительность анализа, высокая себестоимость и необходимость работы в лабораториях наивысшего уровня защиты (BSL-4).
Разработка вакцин
Отечественные и зарубежные подходы с использованием инактивированного вируса как кандидатной вакцины против ЛМ были неудачны или имели противоречивые результаты [8, 32, 35].
Рекомбинантный GP, экспрессированный в клетках насекомых, и основанные на выработке специфического GP ДНК-вакцины защищали лишь часть инфицированных морских свинок, но использование комбинации обоих этих препаратов привело к выживанию 100% этих животных [36, 37]. По сравнению с другими кандидатными препаратами при использовании ДНК-вакцин наблюдали низкую выработку вирусспецифических антител. В исследованиях на людях 2 кандидатные ДНК-вакцины против ЛМ имели низкую иммуногенность и были неспособны вызвать долгосрочный иммунитет [37]. Кодон-оптимизированная ДНК-вакцина генерировала сильный антительный ответ и защитила всех заражённых мышей [8]. Кандидатные вакцины, основанные на репликоновой основе вируса Венесуэльского эцефаломиелита лошадей, экспрессирующие GP MARV наряду с NP или только GP, защищали от гибели всех инфицированных морских свинок и обезьян [38].
Созданы другие системы, экспрессирующие GP MARV, основанные на рекомбинантных репликативно-дефектных векторах — аденовирусном или вирусе везикулярного стоматита (VVS). Основанная на аденовирусе конструкция успешно защищала морских свинок и обезьян от гибели, обеспечивая перекрёстную межштаммовую защиту Марбург-специфическими IgG и Т-клетками [39]. Препарат, сконструированный на платформе VVS, экспрессировал GP штамма Musoke MARV и обеспечил 100% защиту от гибели обезьян, заражённых внутримышечно или аэрозольно вирусом RAVV или штаммом Angola MARV; успешным было применение его и после заражения животных. Специфические нейтрализующие IgG у животных имели низкие уровни. У обезьян, привитых этим рекомбинантом, T-клеточных ответов не было [40, 41]. Основанная на платформе VVS филовирусная кандидатная GP-вакцина rVSV-MARV-GP в дозе 107 БОЕ защищала от гибели мышей с ослабленным иммунитетом, а также обезьян (Macaca fascicularis) и не проявляла нейровирулентности [37, 42].
Препарат, сконструированный из вирусоподобных частиц, содержащих GP MARV, индуцировал вирусспецифические антитела и обеспечивал защиту морских свинок от гибели. Механизм его действия состоял в активировании T-клеток CD4+. Вирусоподобные частицы, содержащие GP штамма Musoke MARV, обеспечили перекрёстную защиту морских свинок и обезьян, инфицированных штаммом Ci67 MARV или вирусом RAVV [43].
Перекрёстной защиты от вируса Эбола не было у животных, привитых препаратами против ЛМ, но комбинированные вакцины были успешны в защите от обоих вирусов, а также вируса RAVV [35, 44].
В опытах на обезьянах высокоэффективными были 14 кандидатных вакцин против ЛМ — рекомбинантные аденовирусные, на основе VVS или альфавирусного репликона, ДНК-вакцины, вирусоподобные частицы и некоторые их комбинации [8, 37, 44]. Однако ни один из этих препаратов не рекомендован для медицинского применения [8, 37]. Две кандидатные вакцины против ЛМ (cAd3 и MARV DNA) проходят первую фазу клинических испытаний, а препарат MVA-BN-Filo — вторую [15, 37, 45].
Лечение
До настоящего времени не разработано специфического лечения ЛМ в эпидочагах. Во время эпидемических вспышек основной была поддерживающая терапия (кровозамещающие жидкости, антибактериальные препараты, переливание крови), не дававшая существенных результатов [8, 12, 32, 33]. Лечение пациентов сыворотками реконвалесцентов или иммуноглобулинами было, как правило, малорезультативным [8, 32, 33, 46], что связано, скорее всего, с их поздним применением. Однако введение человеческих специфических моноклональных антител обезьянам вплоть до 5-х суток от заражения защищало животных от гибели [47, 48].
В 48 ЦНИИ Минобороны России более 20 лет назад были разработаны специфические лошадиные иммуноглобулины для экстренной профилактики лихорадок Марбург и Эбола. Введение их через 2 ч после заражения защищает 100% павианов гамадрилов и морских свинок от заражения 10–30 ЛД50 возбудителя [32]. Иммуноглобулины против лихорадок Эбола и Марбург из сыворотки крови лошадей жидкие внедрены в практику здравоохранения России. Экстренная терапия, начатая сразу после заражения, важна для предотвращения болезни в случае внутрилабораторного инфицирования.
В лабораторных исследованиях оценены следующие направления разработки средств лечения ЛМ. Иммуномодуляторы были малоэффективны — лишь 1 из 6 заражённых MARV обезьян выжила после лечения рекомбинантным коагулирующим белком-2 нематоды [49]. Антисмысловая технология была эффективнее — экстренное введение фосфородиамидатных морфолиновых олигомеров для блокирования экспрессии вирусного белка, начатое спустя 30–60 мин после заражения MARV, полностью защищало обезьян от гибели [50]. Комбинированная терапия химиопрепаратом широкого спектра действия ремдесивиром и человеческими антителами против MARV обеспечила защиту 80% обезьян, в то время как лечение только ремдесивиром или только антителами лечебного эффекта не имело [51, 52]. Как средство экстренной профилактики была эффективна векторная вакцина на платформе VVS, экспрессирующая GP MARV. Отмечено выживание 100% обезьян, когда кандидатную вакцину rVSV-MARV-GP вводили спустя 20–30 мин после заражения [53].
В последнее время разрабатывают принципиально новые пути создания ингибиторов MARV, однако они основаны на модельных опытах с псевдовирусом [54]. Так, получено соединение FC-10696, препятствующее выходу вирусоподобных частиц, содержащих VP40, и жизнеспособного MARV из клеток HeLa или первичных макрофагов человека. Введённый мышам препарат ослаблял проявления инфекции и защитил от гибели 14% животных [55]. Другой новый путь направлен на конструирование антигенсвязывающих Fab-фрагментов. Создано синтетическое антитело sFab H3, которое связывает белок VP35 MARV, являющийся критическим кофактором комплекса репликации вируса и антагонистом противовирусного иммунитета. Неполное антитело sFab H3 ингибировало синтез вирусной РНК в минигеномном анализе, что позволяет предположить возможность его потенциального использования в качестве антивирусного средства [56, 57].
Заключение
За 55-летнюю историю исследований MARV в Германии, США, Великобритании, России, Италии, Японии, Китае в гражданских и военных лабораториях наивысшего уровня защиты получены обширные данные по биологии возбудителя, в полевых условиях выявлены эпидемиологические особенности вызываемой им особо опасной инфекции человека, изучена экология вируса. Ареал представителей семейства Filoviridae, включающего род Marburgvirus, распространён в Африке, Южной и Центральной Европе, Юго-Восточной Азии и Китае. Два представителя этого семейства — вирусы Эбола и Марбург — являются одними из самых патогенных возбудителей заболеваний человека; опасность вирусов других родов филовирусов для человека малоизвестна.
Почти 30-летняя разработка средств и методов профилактики и лечения ЛМ дала некоторые результаты для практической медицины. Определено, что оценку эффективности препаратов целесообразно проводить на обезьянах, в наибольшей степени воспроизводящих симптомы и патологию, наблюдаемую у людей. В условиях чрезвычайной ситуации в области здравоохранения новые и альтернативные подходы к разработке вакцин необходимы для быстрой и массовой вакцинации, управления вспышкой заболевания и сокращения распространения эпидемии [58], что определило необходимость исследования разных путей разработки вакцин против ЛМ. Выявлены наиболее перспективные направления этой работы — конструирование рекомбинантов на основе аденовируса, VVS или альфа-вирусного репликона, ДНК-вакцины; 3 кандидатные вакцины из них проходят I–II фазы клинических испытаний. В лабораторных исследованиях показано достоверное защитное действие химиопрепарата ремдесивир в сочетании с человеческими антителами против MARV, а также этиотропного препарата с антисмысловым механизмом действия и индуктора интерферона. В модельных опытах с псевдовирусом найдены принципиально новые пути разработки ингибиторов возбудителя — препятствие выходу его из клеток, а также конструирование антигенсвязывающих Fab-фрагментов, ингибирующих синтез вирусной РНК. Единственный препарат, внедрённый лишь в практику здравоохранения России, — жидкий специфический лошадиный иммуноглобулин для экстренной профилактики ЛМ.
MARV представляет собой биологическую угрозу в связи с риском заноса его в нашу страну с туристами, импортированными обезьянами, летучими мышами или в случае биотерроризма. Особую эпидемическую значимость имеет персистенция вируса в тканях глаз, яичек и печени реконвалесцентов в течение месяцев после выздоровления. С учётом отсутствующих до настоящего времени средств профилактики и лечения ЛМ разработка защитных препаратов является насущной задачей обеспечения биологической безопасности России.
Возможное распространение новых для России особо опасных инфекций, таких как ЛМ, требует дальнейшего развития системы медико-биологических, санитарно-эпидемиологических, информационных и других мер, направленных на защиту населения от этих заболеваний.
About the authors
Vladimir A. Markin
48 Central Research Institute of the Ministry of Defense of the Russian Federation
Author for correspondence.
Email: vamarkin72@gmail.com
ORCID iD: 0000-0001-5996-3985
D. Sci. (Med.), senior researcher, leading researcher
Russian Federation, Sergiev PosadReferences
- Jacob S.T., Crozier I., Fischer W.A. 2nd, Hewlett A., Kraft C.S., Vega M.A., et al. Ebola virus disease. Nat. Rev. Dis. Primers. 2020; 6(1): 13. https://doi.org/10.1038/s41572-020-0147-3
- WHO. Prioritizing diseases for research and development in emergency contexts. Geneva; 2018. Available at: https://www.who.int/blueprint/priority-diseases/en/
- O'Brien C., Varty K., Ignaszak A. The electrochemical detection of bioterrorism agents: A review of the detection, diagnostics, and implementation of sensors in biosafety programs for class A bioweapons. Microsyst. Nanoeng. 2021; 7: 16. https://doi.org/10.1038/s41378-021-00242-5
- Kuhn J.H., Adachi T., Adhikari N.K.J., Arribas J.R., Bah I.E. New filovirus disease classification and nomenclature. Nat. Rev. Microbiol. 2019; 17(5): 261–3. https://doi.org/10.1038/s41579-019-0187-4
- Brauburger К., Hume A.J., Muhlberger E., Olejnik J. Forty-five years of Marburg virus research. Viruses. 2012; 4: 1878–27. https://doi.org/10.3390/v4101878
- Carroll S.A., Towner J.S., Sealy T.K. Molecular evolution of viruses of the family Filoviridae based on 97 whole genome sequences. J. Virol. 2013; 87(5): 2608–16. https://doi.org/org/10.1128/JVI.03118-12
- Pawęska J.T., Storm N., Markotter W., Paola N.D., Wiley M.R., Palacios G., et al. Shedding of Marburg virus in naturally infected Egyptian Rousette bats, South Africa, 2017. Emerg. Infect. Dis. 2020; 26(12): 3051–5. https://doi.org/10.3201/eid2612.202108
- Olejnik J., Muhlberger E., Hume A.J. Recent advances in marburgvirus research. F1000Res. 2019; 8: F1000 Faculty Rev-704. https://doi.org/10.12688/f1000research.17573.1
- Yang X.L., Zhang Y.Z., Jiang R.D. Genetically diverse filoviruses in Rousettus and Eonycteris spp. bats, China, 2009 and 2015. Emerg. Infect. Dis. 2017; 23(3): 482–6. https://doi.org/org/10.3201/eid2303.161119
- Porshakov A.M., Kononova Yu.V., Lyong T. Filoviruses of southeast Asia, China and Europe (review). Zhurnal infektologii. 2019; 11(2): 5–13. https://doi.org/org/10.22625/2072-6732-2019-11-2-5-13 (in Russian)
- Ristanović E.S., Kokoškov N.S., Crozier I., Kuhn J.H., Gligić A.S. A forgotten episode of Marburg virus disease: Belgrade, Yugoslavia, 1967. Microbiol. Mol. Biol. Rev. 2020; 84(2): e00095-19. https://doi.org/10.1128/MMBR.00095-19
- Bauer M.P., Timen A., Vossen A.C.T.M., van Disse J.T.l. Marburg haemorrhagic fever in returning travellers: Аn overview aimed at clinicians. Clin. Microbiol. Infect. 2019; 21S: e28-e31. https://doi.org/10.1111/1469-0691.12673
- Nyakarahuka L., Shoemaker T.R., Balinandi S., Chemos G., Kwesiga B., Mulei S., et al. Marburg virus disease outbreak in Kween District Uganda, 2017: Epidemiological and laboratory findings. PLoS Negl. Trop. Dis. 2019; 13(3): e0007257. https://doi.org/10.1371/journal.pntd.0007257
- WHO. Ghana declares first-ever outbreak of Marburg virus disease; 2022. Available at: https://www.afro.who.int/countries/ghana/news/ghana-declares-first-ever-outbreak-marburg-virus-disease-0
- Kortepeter M.G., Dierberg K.D., Shenoy E.S., Cieslak T.J. Marburg virus disease: A summary for clinicians. Int. J. Infect. Dis. 2020; 99: 233–42. https://doi.org/10.1016/j.ijid.2020.07.042
- Abir M.H., Rahman T., Das A., Etu S.N., Nafiz I.H., Rakib A., et al. Pathogenicity and virulence of Marburg virus. Virulence. 2022; 13(1): 609–33. https://doi.org/10.1080/21505594.2022.2054760
- Amman B.R., Schuh A.J., Albariño C.G., Towner J.S. Marburg virus persistence on fruit as a plausible route of bat to primate filovirus transmission. Viruses. 2021; 13(12): 2394. https://doi.org/10.3390/v13122394
- Coffin K.M., Liu J., Warren T.K., Blancett C.D., Kuehl K.A., Nichols D.K., et al. Persistent Marburg virus infection in the testes of nonhuman primate survivors. Cell. Host. Microbe. 2018; 24(3): 405–16.e3. https://doi.org/10.1016/j.chom.2018.08.003
- Higgs E.S., Gayedyu-Dennis D., Fisher W., Nason M., Reilly C., Beavogui A.H., et al. PREVAIL IV: A randomized, double-blind, two-phase, phase 2 trial of remdesivir versus placebo for reduction of Ebola virus RNA in the semen of male survivors. Clin. Infect. Dis. 2021; 73(10): 1849–56. https://doi.org/10.1093/cid/ciab215
- Emanuel J., Marzi A., Feldmann H. Filoviruses: Ecology, molecular biology, and evolution. Adv. Virus. Res. 2018; 100: 189221. https://doi.org/org/10.1016/bs.aivir.2017.12.002
- Welsch S., Kolesnikova L., Krahling V., Riches J.D., Becker S., Briggs J.A. Electron tomography reveals the steps in filovirus budding. PLoS Pathog. 2010; 6(4): e1000875. https://doi.org/10.1371/journal.ppat.1000875
- Bharat T.A., Riches J.D., Kolesnikova L., Welsch S., Krahling V., Davey N., et al. Cryo-electron tomography of Marburg virus particles and their morphogenesis within infected cells. PLoS Biol. 2011; 9(11): e1001196. https://doi.org/10.1371/journal.pbio.1001196
- Bamberg S., Kolesnikova L., Möller P., Klenk H.D., Becker S. VP24 of Marburg virus influences formation of infectious particles. J. Virol. 2005; 79(21): 13421–33. https://doi.org/10.1128/JVI.79.21.13421-13433.2005
- Yaddanapudi K., Palacios G., Towner J.S., Chen I., Sariol C.A., Nichol S.T., et al. Implication of a retrovirus-like glycoprotein peptide in the immunopathogenesis of Ebola and Marburg viruses. Faseb. J. 2006; 20: 2519–30. https://doi.org/10.1096/fj.06-6151com
- Amiar S., Husby M.L., Wijesinghe K.J., Angel S., Bhattarai N., Gerstman B.S., et al. Lipid-specific oligomerization of the Marburg virus matrix protein VP40 is regulated by two distinct interfaces for virion assembly. J. Biol. Chem. 2021; 296: 100796. https://doi.org/10.1016/j.jbc.2021.100796
- Koehler A., Pfeiffer S., Kolesnikova L., Becker S. Analysis of the multifunctionality of Marburg virus VP40. J. Gen. Virol. 2018; 99(12): 1614–20. https://doi.org/10.1099/jgv.0.001169
- Hume A., Mühlberger E. Marburg virus viral protein 35 inhibits protein kinase R activation in a cell type-specific manner. J. Infect. Dis. 2018; 218(Suppl. 5): S403–8. https://doi.org/10.1093/infdis/jiy473
- Schnittler H.J., Mahner F., Drenckhahn D., Klenk H.D., Feldmann H. Replication of Marburg virus in human endothelial cells. A possible mechanism for the development of viral hemorrhagic disease. J. Clin. Invest. 1993; 91(4): 1301–9. https://doi.org/10.1172/JCI116704
- Hensley L.E., Alves D.A., Geisbert J.B., Fritz E.A., Reed C., Larsen T., et al. Pathogenesis of Marburg hemorrhagic fever in cynomolgus macaques. J. Infect. Dis. 2011; 204(Suppl. 3): S1021–31. https://doi.org/10.1093/infdis/jir339
- Shifflett K., Marzi A. Marburg virus pathogenesis – differences and similarities in humans and animal models. Virol. J. 2019; 16(1): 165. https://doi.org/10.1186/s12985-019-1272-z
- Markin V.A., Borisevich I.V., Makhlay A.A. Features of the pathogenesis of viral especially dangerous hemorrhagic fevers. In: Pathogenetic Bases of Treatment of Acute Infectious Diseases [Patogeneticheskie osnovy lecheniya ostrykh infektsionnykh zabolevaniy]. Moscow: Meditsina; 1999: 228–36. (in Russian)
- Borisevich I.V., Markin V.A., Firsova I.V., Evseev A.A., Khamitov R.A., Maksimov V.A. Hemorrhagic (Marburg, Ebola, Lassa, and Bolivian) fevers: epidemiology, clinical pictures, and treatment. Voprosy virusologii. 2006; 51(5): 8–16. (in Russian)
- Mehedi M., Groseth A., Feldmann H., Ebihara H. Clinical aspects of Marburg hemorrhagic fever. Future Virol. 2011; 6(9): 1091–106. https://doi.org/10.2217/fvl.11.79
- Trombley A.R., Wachter L., Garrison J., Buckley-Beason V.A., Jahrling J., Hensley L.E., et al. Comprehensive panel of real-time TaqMan polymerase chain reaction assays for detection and absolute quantification of filoviruses, arenaviruses, and New World hantaviruses. Am. J. Trop. Med. Hyg. 2010; 82(5): 954–60. https://doi.org/10.4269/ajtmh.2010.09-0636
- Suschak J.J., Schmaljohn C.S. Vaccines against Ebola virus and Marburg virus: Recent advances and promising candidates. Hum. Vaccin. Immunother. 2019; 15(10): 2359–77. https://doi.org/10.1080/21645515.2019.1651140
- Hevey M., Negley D., Zanden L.V., Tammariello R.F., Geisbert J., Schmaljohn C., et al. Marburg virus vaccines: Comparing classical and new approaches. Vaccine. 2001; 20(3-4): 586–93. https://doi.org/10.1016/S0264-410X(01)00353-X
- Dulin N., Spanier A., Merino K., Hutter J.N., Waterman P.E., Lee C., et al. Systematic review of Marburg virus vaccine nonhuman primate studies and human clinical trials. Vaccine. 2021; 39(2): 202–8. https://doi.org/10.1016/j.vaccine.2020.11.042
- Hevey M., Negley D., Pushko P., Smith J., Schmaljohn A. Marburg virus vaccines based upon alphavirus replicons protect guinea pigs and nonhuman primates. Virology. 1998; 251(1): 28–37. https://doi.org/org/10.1006/viro.1998.9367
- Daddario-DiCaprio K.M., Geisbert T.W., Geisbert J.B., Stroher U., Hensley L.E., Grolla A., et al. Cross-protection against Marburg virus strains by using a live, attenuated recombinant vaccine. J. Virol. 2006; 80(19): 9659–66. https://doi.org/10.1128/JVI.00959-06
- Marzi A., Menicucci A.R., Engelmann F., Callison J., Horne E.J., Feldmann F., et al. Protection against Marburg virus using a recombinant VSV-vaccine depends on T and B cell activation. Front. Immunol. 2019; 9: 3071. https://doi.org/10.3389/fimmu.2018.03071
- Woolsey C., Geisbert J.B., Matassov D., Krystle N., Agans V., Borisevich V., et al. Postexposure efficacy of recombinant vesicular stomatitis virus vectors against high and low doses of Marburg virus variant Angola in nonhuman primates. J. Infect. Dis. 2018; 218(Suppl. 5): S582–7. https://doi.org/10.1093/infdis/jiy293
- Mire C.E., Miller A.D., Carville A., Westmoreland S.V., Geisbert J.B., Mansfield K.G., et al. Recombinant vesicular stomatitis virus vaccine vectors expressing filovirus glycoproteins lack neurovirulence in nonhuman primates. PLoS Negl. Trop. Dis. 2012; 6(3): e1567. https://doi.org/org/10.1371/journal.pntd.0001567
- Warfield K.L., Swenson D.L., Negley D.L., Schmaljohn A.L., Aman M.J., Bavari S. Marburg virus-like particles protect guinea pigs from lethal Marburg virus infection. Vaccine. 2004; 22(25-26): 3495–502. https://doi.org/org/10.1016/j.vaccine.2004.01.063
- Reynolds P., Marzi A., Reynolds P. Ebola and Marburg virus vaccines. Virus Genes. 2017; 53(4): 501–15. https://doi.org/10.1007/s11262-017-1455-x
- Volkova N.V., P'yankov O.V., Ivanova A.V., Isaeva A.A., Zybkina A.V., Kazachinskaya E.I., et al. Prototype of a DNA vaccine against Marburg virus. Byulleten' eksperimental'noy biologii i meditsiny. 2021; 170(10): 487–91. https://doi.org/10.47056/0365-9615-2020-170-10-487-491 (in Russian)
- Hargreaves A., Brady C., Mellors J., Tipton T., Miles W., Carroll S.L. Filovirus neutralising antibodies: Mechanisms of action and therapeutic application. Pathogens. 2021; 10(9): 1201. https://doi.org/org/10.3390/pathogens10091201
- King L.B., Fusco M.L., Flyak A.I., Ilinykh P.A., Huang K., Gunn B., et al. The marburgvirus-neutralizing human monoclonal antibody MR191 targets a conserved site to block virus receptor binding. Cell. Host. Microbe. 2018; 23(1): 101–9.e4. https://doi.org/10.1016/j.chom.2017.12.003
- Brannan J.M., He S., Howell K.A. Post-exposure immunotherapy for two ebolaviruses and Marburg virus in nonhuman primates. Nat. Commun. 2019; 10(1): 105. https://doi.org/10.1038/s41467-018-08040-w
- Geisbert T.W., Daddario-DiCaprio K.M., Geisbert J.B., Young H.A., Formenty P., Fritz E.A., et al. Marburg virus Angola infection of rhesus macaques: Pathogenesis and treatment with recombinant nematode anticoagulant protein c2. J. Infect. Dis. 2007; 196(Suppl. 2): S372–81. https://doi.org/10.1086/520608
- Warren T.K., Warfield K.L., Wells J., Swenson D.L., Donner K.S., Van Tongeren S.A., et al. Advanced antisense therapies for postexposure protection against lethal filovirus infections. Nat. Med. 2010; 16(9): 991–4. https://doi.org/10.1038/nm.2202
- Cross R.W., Bornholdt Z.A., Prasad A.N., Borisevich V., Agans K.N., Deer D.J., et al. Combination therapy protects macaques against advanced Marburg virus disease. Nat. Commun. 2021; 12(1): 1891. https://doi.org/10.1038/s41467-021-22132-0
- Porter D.P., Weidner J.M., Gomba L., Bannister R., Blair C., Jordan R., et al. Remdesivir (GS-5734) is efficacious in Cynomolgus Macaques infected with Marburg virus. J. Infect. Dis. 2020; 222(11): 1894–901. https://doi.org/10.1093/infdis/jiaa290
- Jones S.M., Feldmann H., Stroher U., Geisbert J.B., Fernando L., Grolla A., et al. Live attenuated recombinant vaccine protects nonhuman primates against Ebola and Marburg viruses. Nat. Med. 2005; 11(7): 786–90. https://doi.org/10.1038/nm1258
- Lehrer A.T., Chuang E., Namekar M., Williams C.A., Wong T.A.S., Lieberman M., et al. Recombinant protein filovirus vaccines protect Cynomolgus Macaques from Ebola, Sudan, and Marburg viruses. Front. Immunol. 2021; 12: 703986. https://doi.org/10.3389/fimmu.2021.703986
- Han Z., Ye H., Liang J., Shepley-McTaggart A., Wrobel J.E., Reitz A.B., et al. Compound FC-10696 inhibits egress of Marburg virus. Antimicrob. Agents. Chemother. 2021; 65(7): e0008621. https://doi.org/10.1128/AAC.00086-21
- Amatya P., Wagner N., Chen G., Luthra P., Shi L., Borek D., et al. Inhibition of Marburg virus RNA synthesis by a synthetic anti-VP35 antibody. ACS Infect. Dis. 2019; 5(8): 1385–96. https://doi.org/10.1021/acsinfecdis.9b00091
- Bournazos S., Gupta A., Ravetch J.V. The role of IgG Fc receptors in antibody-dependent enhancement. Nat. Rev. Immunol. 2020; 20(10): 633–43. https://doi.org/10.1038/s41577-020-00410-0
- Trovato M., Sartorius R., D’Apice L., Manco R., De Berardinis P. Viral emerging diseases: Challenges in developing vaccination strategies. Front. Immunol. 2020; 11: 2130. https://doi.org/10.3389/fimmu.2020.02130
Supplementary files