Клинико-эпидемиологическая характеристика злокачественных новообразований, ассоциированных с вирусом папилломы человека, в регионах Северо-Запада России
- Авторы: Лялина Л.В.1, Холопов Д.В.1, Язенок А.В.2, Хижа В.В.2, Топузов Э.Э.3, Касаткин Е.В.4, Горяев Е.А.5, Задоркина Т.Г.6, Молчанова Ж.Р.7
-
Учреждения:
- Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
- Медицинский информационно-аналитический центр
- Городской клинический онкологический диспансер, Санкт-Петербург
- Кожно-венерологический диспансер № 8, Санкт-Петербург
- Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями Ленинградской области
- Центр специализированных видов медицинской помощи Калининградской области
- Управление Роспотребнадзора по Калининградской области
- Выпуск: Том 100, № 1 (2023)
- Страницы: 52-64
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/7278
- DOI: https://doi.org/10.36233/0372-9311-327
- ID: 7278
Цитировать
Полный текст
Аннотация
Введение. Ведущая роль вируса папилломы человека (ВПЧ) в этиопатогенезе злокачественных новообразований (ЗНО) некоторых локализаций является общепризнанной. Применяемые в мире и России вакцины для профилактики папилломавирусной инфекции создают основу для элиминации заболеваний, ассоциированных с ВПЧ, в будущем.
Цель исследования — определение региональных, гендерных и возрастных особенностей ЗНО, ассоциированных с ВПЧ, для обоснования развития единой системы эпидемиологического надзора и вакцинопрофилактики.
Материалы и методы. Ретроспективный эпидемиологический анализ заболеваемости ЗНО, ассоциированными с ВПЧ, и смертности от этих неоплазий в регионах Северо-Западного федерального округа России проведён за 2011–2020 гг. по данным формы № 7 «Сведения о злокачественных новообразованиях» и Популяционных раковых регистров Санкт-Петербурга (13 117 случаев), Ленинградской (3204 случая) и Калининградской (2898 случаев) областей.
Результаты. В структуре ЗНО, ассоциированных с ВПЧ, в Санкт-Петербурге, Ленинградской и Калининградской областях у мужчин более 90% составили опухоли полости рта, ротоглотки и гортани, среди женщин более 60% занимает рак шейки матки. Установлены региональные и возрастные особенности заболеваемости раком шейки матки и смертности от этой патологии. Выявлены статистически значимые различия заболеваемости раком головы и шеи, ануса и анального канала различных возрастных групп мужчин и женщин.
Заключение. В результате проведённого исследования установлены региональные, гендерные и возрастные особенности заболеваемости ЗНО, ассоциированными с ВПЧ, на Северо-Западе России. Эти данные целесообразно использовать для развития единой системы эпидемиологического надзора и вакцинопрофилактики папилломавирусной инфекции и связанных с ней неоплазий.
Полный текст
Введение
Вопросы канцерогенеза, связанного с возбудителями инфекционных и паразитарных заболеваний, давно привлекают внимание отечественных и зарубежных исследователей. В этиологии злокачественных новообразований (ЗНО) в мире доля инфекций составляет до 20% [1]. К ЗНО, ассоциированным с вирусом папилломы человека (ВПЧ), Международное агентство по изучению рака относит рак полости рта, миндалин, ротоглотки, гортани, ануса и анального канала, шейки матки, вульвы, влагалища и полового члена [2]. Важное значение в развитии ЗНО отводится генотипам вируса — согласно опубликованным данным, в мире 4,5% случаев рака были связаны с ВПЧ 6, 11, 16, 18, 31, 33, 45, 52, 58-го генотипов [3].
Анализ опубликованных работ свидетельствует о наличии гендерных и возрастных особенностей ВПЧ-ассоциированных ЗНО: в 2020 г. в структуре всех ЗНО доля рака губы и полости рта составила 2,8% у мужчин и 1,3% у женщин, миндалин и ротоглотки — 0,8 и 0,2%, гортани — 1,7 и 0,3% соответственно, шейки матки — 6,9%, вульвы — 0,5%, влагалища — 0,2%, полового члена — 0,4% [4], анального канала (оба пола) — 0,3% [5]. В США в 2007–2016 гг. показатели заболеваемости раком полости рта и глотки увеличивались среди лиц в возрасте 50–79 лет [6]. В России в 2020 г. наибольший уровень заболеваемости раком полости рта и ротоглотки у мужчин зарегистрирован в возрастной группе 65–69 лет, у женщин — в группах 50–59 и 70–74 лет. Максимальная заболеваемость раком гортани выявлена в возрасте 65–69 лет у мужчин и 70–74 года у женщин — 37,37 и 1,84 на 100 тыс. мужского и женского населения соответственно [7]. Отмечается тенденция к росту заболеваемости раком анального канала с увеличением показателей почти на 2% ежегодно [8]. По данным некоторых авторов, рак вульвы значительно чаще обнаруживается в молодой группе пациентов [9]. Самые высокие уровни заболеваемости раком влагалища наблюдались у пожилых [7, 10].
В мире и России среди ЗНО, ассоциированных с ВПЧ, у женщин наиболее актуальной проблемой является рак шейки матки (РШМ), многие исследователи отмечают негативные тенденции заболеваемости женского населения репродуктивного и трудоспособного возраста. В мире средний возраст впервые выявленных больных с диагнозом РШМ составил 54 года, при этом самый ранний максимум заболеваемости установлен в Великобритании (30–34 года) [11]. В России в 2020 г. средний возраст больных РШМ оказался равным 53 года, наибольшая заболеваемость отмечена в возрастной группе 40–44 лет (36,61 на 100 тыс. населения) [7].
Заболеваемость раком полового члена характеризуется более низкими уровнями. По данным популяционного ракового регистра Норвегии, ЗНО этой локализации в 60% случаев обнаруживались у мужчин старше 65 лет [12], в России максимальная заболеваемость зарегистрирована в возрасте 75–79 лет (5,91 на 100 тыс. мужского населения) [7].
Результаты изучения смертности от ЗНО, ассоциированных с ВПЧ, также свидетельствуют о высокой социальной и медицинской значимости проблемы. В 2020 г. смертность в мире от рака ротоглотки и миндалин в возрастной группе 15–44 лет составила 0,12 и 0,03 на 100 тыс. мужского и женского населения соответственно [13]. В России в 2020 г. средний возраст умерших составил у мужчин 67 лет, у женщин — 69 лет [7]. Средний возраст больных раком анального канала — 60 лет [14], и эта локализация отличается высоким уровнем смертности [15]. В 2020 г. в России в структуре онкологической смертности женщин РШМ занял 1-е место (21,3%) в возрастной группе 30–39 лет [6]. Самые высокие показатели смертности от рака влагалища в Великобритании наблюдались в старших возрастных группах [16].
В 2007–2016 гг. в России выявлено 5 761 170 случаев доброкачественных новообразований и ЗНО, ассоциированных с ВПЧ [17], что составляет более 5% в структуре общей онкологической заболеваемости [18]. Клинико-эпидемиологические особенности и актуальность проблемы ВПЧ-ассоциированных ЗНО в России явились основой для научного обоснования необходимости совершенствования вакцинопрофилактики папилломавирусной инфекции в нашей стране [19–22]. В 2020 г. Всемирная организация здравоохранения опубликовала глобальную стратегию элиминации РШМ как проблемы общественного здравоохранения [23]. Это стало возможным благодаря доказанной эффективности вакцинации против ВПЧ в предотвращении тяжёлой дисплазии шейки матки [24–27] и первичной профилактики РШМ [28]. В России принята Стратегия развития иммунопрофилактики инфекционных болезней до 2035 г., которая предусматривает совершенствование вакцинации против папилломавирусной инфекции, что создаёт предпосылки для постепенного снижения заболеваемости и элиминации ЗНО, ассоциированных с ВПЧ, в будущем.
Цель исследования: определение региональных, гендерных и возрастных особенностей ЗНО, ассоциированных с ВПЧ, для обоснования развития единой системы эпидемиологического надзора и вакцинопрофилактики.
Материалы и методы
В исследование включены материалы о зарегистрированных ЗНО, ассоциированных с ВПЧ, в соответствии с рекомендациями Международного агентства по изучению рака и Международной классификацией болезней Десятого пересмотра (МКБ-10): рак полости рта (код МКБ-10 С01–С06), миндалин и ротоглотки (С09–10), гортани (С32), анального канала (С21), вульвы (С51), влагалища (С52), шейки матки (С53), полового члена (С60). Проведён анализ заболеваемости мужского и женского населения Северо-Западного федерального округа (СЗФО) в целом и отдельных регионов в 2011–2020 гг. Интенсивные и экстенсивные показатели рассчитывали по данным формы № 7 «Сведения о злокачественных новообразованиях» и материалам Популяционных раковых регистров Санкт-Петербурга (13 117 случаев), Ленинградской (3204 случая) и Калининградской (2898 случаев) областей. Материалы по Санкт-Петербургу включают также сведения о 7257 умерших от указанных ЗНО.
Популяционные раковые регистры велись на основании добровольных информированных согласий пациентов или их законных представителей. Протокол исследования одобрен Локальным этическим комитетом ФБУН НИИ эпидемиологии и микробиологии имени Пастера Роспотребнадзора (протокол № 56 от 26.11.2019).
Метод исследования: ретроспективный эпидемиологический анализ. Статистическую обработку данных осуществляли с использованием пакета «Statistica v. 12» («StatSoft»). Статистически значимыми считали различия при p < 0,05. Расчёт доверительных интервалов (ДИ) показателей заболеваемости и смертности проводили с помощью программы «WinPepi v. 11.65».
Результаты
Среди всех ЗНО, выявленных в 2011–2020 гг., ВПЧ-ассоциированные неоплазии у мужчин и женщин занимали в Санкт-Петербурге 5,1% (95% ДИ 5,07–5,36) и 5,7% (95% ДИ 5,67–5,92), в Калининградской области — 6,6% (95% ДИ 6,25–7,04) и 8,6% (95% ДИ 8,19–8,98) соответственно, региональные и гендерные различия статистически значимы (p < 0,05). Анализ структуры по локализации опухолевого процесса ЗНО, ассоциированных с ВПЧ, среди мужского и женского населения указанных территорий СЗФО в целом показал наличие общих закономерностей (таблица). У мужчин наибольшую долю ЗНО полости рта, миндалин, ротоглотки, гортани составили в Санкт-Петербурге (92,7%), Калининградской (92,1%) и Ленинградской (93,9%) областях. В структуре ВПЧ-ассоциированных ЗНО среди женщин преобладает РШМ, доля которого превысила 60–70%. Актуальной проблемой во всех регионах является рак гортани среди мужского населения, в Ленинградской области ЗНО этой локализации встречались среди мужчин чаще в 8,8 раза, в Санкт-Петербурге — в 11,6 раза, в Калининградской области — в 19,3 раза. Анальный рак на всех изученных территориях чаще регистрируется у женщин, различия по сравнению с мужчинами статистически значимы (p < 0,05). Доля неоплазий данной локализации по регионам существенно не отличалась. Рак влагалища и полового члена среди ВПЧ-ассоциированных ЗНО в субъектах СЗФО также занимает примерно одинаковые позиции, если оценивать показатели распределения. Некоторые региональные различия были выявлены в частоте регистрации рака гортани, вульвы и шейки матки.
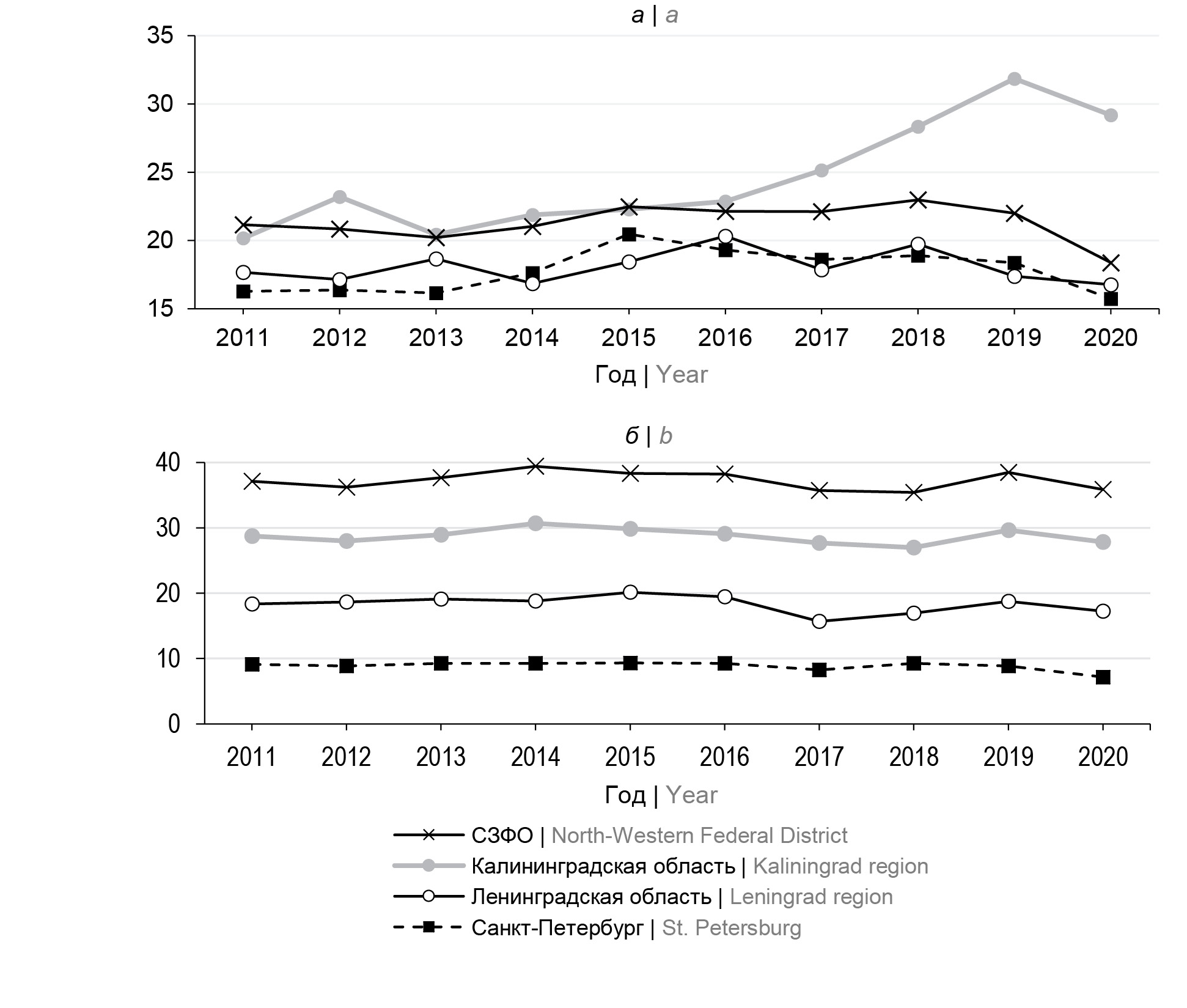
Анализ заболеваемости РШМ в регионах СЗФО в 2011–2020 гг. показал наличие региональных особенностей (рис. 1, а). В целом по округу показатели заболеваемости РШМ варьировали от 18,37 (95% ДИ 17,60–19,12) на 100 тыс. женского населения в 2020 г. до 22,97 (95% ДИ 22,13–23,84) в 2018 г. В Санкт-Петербурге уровень заболеваемости был ниже, минимальные и максимальные показатели составили 15,72 (95% ДИ 14,31–17,20) на 100 тыс. женского населения в 2020 г. и 20,46 (95% ДИ 18,80–22,19) в 2015 г. (р < 0,05), в 10-летнем отрезке времени тенденция к росту заболеваемости не выявлена. В Ленинградской области заболеваемость РШМ существенно не отличалась от уровней в Санкт-Петербурге, в 2011–2020 гг. показатели в этом регионе варьировали от 16,76 (95% ДИ 14,32–19,52) на 100 тыс. женского населения в 2020 г. до 20,32 (95% ДИ 17,54–23,40) в 2016 г. (р > 0,05). В Калининградской области отмечается тенденция к росту заболеваемости от 20,16 (95% ДИ 17,02–25,39) на 100 тыс. женского населения в 2011 г. до 29,18 (95% ДИ 25,78–35,47) в 2020 г. (р < 0,05). В 2020 г. в условиях эпидемии COVID-19 заболеваемость снизилась на всех территориях.
Рис. 1. Заболеваемость (а) и смертность (б) от РШМ в регионах СЗФО в 2011–2020 гг., на 100 тыс. женского населения.
Fig. 1. Cervical cancer incidence (а) and mortality (b) in the regions of the North-Western Federal District of Russia
in 2011–2020, рer 100,000 female population.
Показатели смертности от РШМ (рис. 1, б) на территории СЗФО в изученный период составили от 8,03 (95% ДИ 7,58–8,59) до 9,14 (95% ДИ 8,60–9,68) на 100 тыс. женского населения. В Санкт-Петербурге, Ленинградской и Калининградской областях смертность от РШМ была на уровне округа в целом — от 7,18 (95% ДИ 6,24–8,21) до 9,33 (95% ДИ 8,25–10,53), от 7,41 (95% ДИ 5,78–9,36) до 10,81 (95% ДИ 8,81–13,12), от 9,32 (95% ДИ 6,84–12,50) до 11,99 (95% ДИ 9,11–15,46) на 100 тыс. женского населения соответственно. Тенденции к росту показателей смертности от РШМ в округе и указанных регионах в течение 10 лет не выявлено.
Изучение региональных и гендерных особенностей рака ротоглотки (код МКБ-10 С10) в СЗФО показало, что среди мужчин (рис. 2, а) в 2011–2020 гг. уровни заболеваемости варьировали от 2,32 (95% ДИ 2,01–2,65) до 3,24 (95% ДИ 3,04–3,82) на 100 тыс. мужского населения, среди женщин (рис. 2, б) — от 0,35 (95% ДИ 0,26–0,48) до 0,71 (95% ДИ 0,57–0,88) на 100 тыс. женского населения, различия статистически значимы (р < 0,05), заболеваемость мужского населения была выше в 4,6–6,6 раза.
Рис. 2. Заболеваемость раком ротоглотки среди мужского (а) и женского (б) населения в регионах СЗФО в 2011–2020 гг., на 100 тыс. человек.
Fig. 2. Oropharyngeal cancer incidence among male (a) and female (b) populations in the regions of the North-Western Federal District of Russia in 2011–2020, рer 100,000 population.
В Санкт-Петербурге, Ленинградской и Калининградской областях заболеваемость раком ротоглотки также была выше среди мужчин, показатели варьировали, достигая в разные годы максимальных значений 3,26 (95% ДИ 2,58–4,08), 4,61 (95% ДИ 3,24–6,33) и 4,85 (95% ДИ 3,12–7,28) на 100 тыс. мужского населения соответственно, различия статистически не значимы (р > 0,05). Среди женщин максимальные уровни заболеваемости составили в Санкт-Петербурге 0,97 (95% ДИ 0,65–1,41) на 100 тыс. женского населения, в Ленинградской области — 0,95 (95% ДИ 0,43–1,81), в Калининградской области — 0,78 (95% ДИ 0,19–2,04). Устойчивой тенденции к росту заболеваемости мужского и женского населения в указанных регионах в изученном отрезке времени не наблюдается.
При анализе заболеваемости раком вульвы (рис. 3, а) в СЗФО в течение 10 лет установлены статистически значимые различия в минимальном и максимальном показателях — 2,38 в 2011 г. (95% ДИ 2,08–2,67) на 100 тыс. женского населения и 3,28 в 2019 г. (95% ДИ 2,98–3,63). В Санкт-Петербурге, Ленинградской и Калининградской областях заболеваемость ЗНО этой локализации существенно не отличалась от уровня по округу в целом и не имела статистически значимой тенденции к росту.
Рис. 3. Заболеваемость раком вульвы (а) и влагалища (б) в регионах СЗФО в 2011–2020 гг. на 100 тыс. женского населения.
Fig. 3. Vulvar (а) and vaginal (b) cancer incidence in the regions of the North-Western Federal District of Russia
in 2011–2020, рer 100,000 female population.
Заболеваемость раком влагалища в СЗФО характеризовалась более низкими уровнями — от 0,55 (95% ДИ 0,43–0,70) на 100 тыс. женского населения в 2016 г. до 0,92 (95% ДИ 0,77–1,11) в 2019 г. и в период 2011–2020 гг. не имела тенденции к росту (рис. 3, б). В Санкт-Петербурге и Ленинградской области показатели и динамика заболеваемости существенно не отличались от округа в целом, в последнем регионе наблюдалось снижение заболеваемости, однако различия оказались статистически не значимы (р > 0,05). В Калининградской области отмечено увеличение уровня заболеваемости от 0,20 (95% ДИ 0,01–1,15) на 100 тыс. женского населения в 2011 г. до 1,67 (95% ДИ 0,73–3,23) в 2020 г. (р > 0,05).
Важные результаты получены при изучении возрастной структуры больных РШМ в регионах СЗФО. В Санкт-Петербурге среди впервые выявленных больных с диагнозом РШМ в 2011–2020 гг. доля женщин репродуктивного возраста достигла 39,6%, в Ленинградской и Калининградской областях эти показатели были значительно выше — 46,5 и 45,5% соответственно (р < 0,05). Необходимо также отметить, что из числа умерших от РШМ в Санкт-Петербурге 27,7% составили женщины в возрасте 15–49 лет. При сравнении показателей и динамики заболеваемости различных возрастных групп женского населения в Санкт-Петербурге (рис. 4, а) и Калининградской области (рис. 4, б) выявлены некоторые региональные особенности. Единичные случаи РШМ регистрируются в возрастной группе 15–19 лет в обоих регионах. Среди женщин в возрасте 20–29 лет в Санкт-Петербурге показатели заболеваемости варьировали от 2,28 (95% ДИ 1,09–4,19) на 100 тыс. женского населения указанного возраста до 3,55 (95% ДИ 1,94–5,27), в Калининградской области — от 1,2 (95% ДИ 0,05–2,90) до 4,4 (95% ДИ 1,10–7,70), наблюдается увеличение заболеваемости, однако в 10-летнем отрезке времени различия статистически не значимы (р > 0,05).
Рис. 4. Заболеваемость РШМ в различных возрастных группах женского населения Санкт-Петербурга (а) и Калининградской области (б) в 2011–2020 гг. на 100 тыс. женского населения указанного возраста.
Fig. 4. Cervical cancer incidence in various age groups of the female population of St. Petersburg (а) and Kaliningrad region (b) in 2011–2020, рer 100,000 female population the same age.
В возрастной группе 30–39 лет в Санкт-Петербурге отмечено снижение заболеваемости РШМ от 20,92 (95% ДИ 16,61–26,00) на 100 тыс. женского населения указанного возраста в 2011 г. до 11,16 (95% ДИ 8,45–14,46) в 2020 г. В Калининградской области выявлена тенденция к росту заболеваемости женщин этого возраста, показатели в 2020 г. по сравнению с 2011 г. увеличились в 2,5 раза от 15,2 (95% ДИ 6,01–24,50) на 100 тыс. женского населения указанного возраста до 39,0 (95% ДИ 25,40–52,60), различия статистически значимы (р < 0,05). Среди женщин 40–49 лет в течение всего изученного периода зарегистрированы самые высокие уровни заболеваемости РШМ, достигшие в Санкт-Петербурге 38,19 (95% ДИ 32,17–45,01) на 100 тыс. женского населения указанного возраста в 2016 г., в Калининградской области — 58,3 (95% ДИ 40,90–75,70) в 2020 г. В старших возрастных группах в регионах сохраняется высокая заболеваемость РШМ.
На рис. 5 представлены результаты изучения гендерных и возрастных особенностей заболеваемости раком анального канала на примере Санкт-Петербурга. Заболеваемость женщин отличается более высокими показателями, различия составили 2,8–4,2 раза, и имеет статистически значимую тенденцию к росту от 1,18 (95% ДИ 0,81–1,66) на 100 тыс. женского населения в 2011 г. до 2,37 (95% ДИ 1,85–2,99) в 2020 г. Первые случаи заболевания выявлены в возрастной группе 30–39 лет. Самые высокие показатели заболеваемости отмечаются в возрасте 60–69 и 70–79 лет как среди мужчин, так и среди женщин.
Рис. 5. Заболеваемость раком анального канала в различных возрастных группах мужского (а) и женского (б) населения Санкт-Петербурга в 2011–2020 гг.
Fig. 5. Anal cancer incidence in various age groups of the male (а) and female (b) population of St. Petersburg
in 2011–2020.
Результаты анализа показателей смертности от РШМ и анального канала различных возрастных групп населения также характеризуют важное социальное и медицинское значение ЗНО, ассоциированных с ВПЧ. В Санкт-Петербурге зарегистрировано более 700 случаев летального исхода от РШМ среди женщин в возрасте до 49 лет, в том числе 25 случаев в группе 20–29 лет. Наиболее высокие показатели смертности отмечались в возрастных группах 50–59 и 60–69 лет, составившие 26,7 (95% ДИ 20,85–33,67) и 24,4 (95% ДИ 18,86–31,15) на 100 тыс. женского населения указанного возраста (рис. 6). Тенденция к росту уровня смертности во всех возрастных категориях в 2011–2020 гг. не выявлена.
Рис. 6. Смертность от РШМ различных возрастных групп женского населения Санкт-Петербурга в 2011–2020 гг.
Fig. 6. Cervical cancer associated mortality of various age groups of the female population of St. Petersburg in 2011–2020.
Анализ смертности от рака анального канала различных возрастных групп мужского (рис. 7, а) и женского (рис. 7, б) населения Санкт-Петербурга показал, что случаи летального исхода встречаются в возрасте 30–39 и 40–49 лет.
Рис. 7. Смертность от рака анального канала различных возрастных групп мужского (а) и женского (б) населения Санкт-Петербурга в 2011–2020 гг.
Fig. 7. Anal cancer associated mortality in various age groups of male (а) and female (b) population of St. Petersburg in 2011–2020.
Среди женщин показатели заболеваемости и смертности от рака этой локализации выше, чем у мужчин. Наиболее высокие уровни смертности в изученный период были в возрастных группах 60–69 и 70–79 лет как среди мужского, так и женского населения. Отмечается увеличение показателей смертности в 2016–2020 гг. среди мужчин в возрасте 60–69 лет и женщин 70–79 лет, различия статистически не значимы (р > 0,05).
Обсуждение
ЗНО, ассоциированные с ВПЧ, относятся к числу актуальных проблем в мире и России [2, 4, 7, 17, 22]. Изучение региональных особенностей заболеваемости и смертности от ВПЧ-ассоциированных ЗНО необходимо для обоснования и оценки эффективности программ вакцинопрофилактики папилломавирусной инфекции. Согласно опубликованным данным в мире 4,5% случаев рака были связаны с ВПЧ определённых генотипов [3], в России ЗНО, ассоциированные с ВПЧ, составили более 5% в структуре общей онкологической заболеваемости [18]. В результате проведённого нами исследования выявлены статистически значимые региональные и гендерные различия этого показателя среди всех ЗНО, диагностированных у мужчин и женщин в 2011–2020 гг., ВПЧ-ассоциированные неоплазии занимали в Санкт-Петербурге 5,1 и 5,7%, в Калининградской области — 6,6 и 8,6% соответственно.
Анализ опубликованных данных показал наличие гендерных и возрастных особенностей ВПЧ-ассоциированных ЗНО [4, 5, 7]. Авторы отмечают более высокую заболеваемость мужчин раком полости рта, глотки, гортани [7, 13]. В результате проведённого нами исследовании также установлено, что на территории СЗФО ЗНО, ассоциированные с ВПЧ, этих локализаций занимают среди мужского населения основную долю, а показатели заболеваемости были в 4–6 раз выше по сравнению с женщинами.
Обсуждая актуальность проблемы рака анального канала, исследователи указывают на тенденцию к росту заболеваемости с высокими темпами ежегодного прироста показателей [8] и высокую летальность [14]. В Санкт-Петербурге минимальные и максимальные уровни заболеваемости и смертности от неоплазии указанной локализации среди женщин были выше по сравнению с мужчинами, за 10 лет заболеваемость женского населения увеличилась в 2 раза. Сравнение с другими опубликованными данными на территории России затруднено, поскольку в форме государственного статистического наблюдения сведения о заболеваемости ЗНО анального канала объединены в группу «прямая кишка, ректосигмоидное соединение, анус». Объективная оценка показателей возможна при наличии в регионе популяционного ракового регистра.
Наиболее актуальной проблемой ЗНО, ассоциированных с ВПЧ, среди женщин в мире и России является РШМ [7, 11, 21, 23]. Это относится к показателям как заболеваемости, так и смертности, многие исследователи отмечают смещение заболеваемости на более молодые возрастные группы. В регионах СЗФО эта проблема также актуальна. В структуре ВПЧ-ассоциированных ЗНО среди женского населения РШМ занимает более 60–70%. Доля женщин репродуктивного возраста у впервые выявленных больных в Ленинградской и Калининградской областях превышает 45%. В Калининградской области отмечается статистически значимая тенденция к росту заболеваемости женщин в возрасте 30–39 лет. Наиболее высокие уровни заболеваемости в изученных регионах наблюдались в возрастной группе 40–49 лет, смертности — 50–59 лет. Из числа умерших от РШМ в Санкт-Петербурге более 27% составили женщины в возрасте 15–49 лет.
Обоснование актуальности и социальной значимости ВПЧ-ассоциированных ЗНО, в первую очередь РШМ, в России явилось основой для совершенствования вакцинопрофилактики папилломавирусной инфекции в нашей стране [20–22]. В 2020 г. Всемирная организация здравоохранения опубликовала глобальную стратегию элиминации РШМ как проблемы общественного здравоохранения [23]. Это стало возможным благодаря доказанной эффективности вакцинации против ВПЧ [25–28].
Выводы
- Структура ВПЧ-ассоциированных ЗНО имеет гендерные особенности: среди мужчин наибольшую долю занимает рак головы и шеи (полость рта, миндалины, ротоглотка, гортань), опухоли этой локализации в Санкт-Петербурге составили 92,7%, в Калининградской области — 92,1%, в Ленинградской области — 93,9%; среди женщин наиболее часто регистрируется РШМ (от 60 до 70% в указанных регионах СЗФО; р < 0,05).
- Региональные особенности установлены в уровнях и тенденциях заболеваемости РШМ, в Санкт-Петербурге и Ленинградской области в 2011–2020 гг. показатели были ниже по сравнению с СЗФО в целом, в 10-летнем отрезке времени тенденция к росту не выявлена; в Калининградской области отмечается статистически значимая тенденция к росту заболеваемости РШМ, в том числе у женщин в возрасте 30–39 лет (р < 0,05); среди впервые выявленных больных с диагнозом РШМ доля женщин репродуктивного возраста в Санкт-Петербурге составила 39,6%, в Ленинградской области — 46,5%, в Калининградской области — 45,5% (р < 0,05).
- Заболеваемость раком ротоглотки мужчин выше в 4,6–6,6 раза по сравнению с женщинами, показатели варьировали от 3,26 до 4,85 на 100 тыс. населения соответствующего пола; среди женщин максимальные уровни заболеваемости в Санкт-Петербурге составили 0,97, в Ленинградской области — 0,95, в Калининградской области — 0,78; в течение 10 лет заболеваемость мужского и женского населения в указанных регионах не имела тенденции к снижению.
- Рак анального канала чаще регистрируется среди женщин, в Санкт-Петербурге показатели заболеваемости были в 2,8–4,2 раза выше, чем у мужчин, с тенденцией к росту от 1,18 на 100 тыс. женского населения в 2011 г. до 2,37 в 2020 г. (р = 0,001), самые высокие показатели заболеваемости отмечаются в возрасте 60–69 и 70–79 лет как среди мужчин, так и среди женщин.
- Показатели смертности от ВПЧ-ассоциированных ЗНО согласуются с уровнями заболеваемости: наиболее высокие показатели смертности от РШМ в Санкт-Петербурге отмечались в возрастных группах 50–59 и 60–69 лет и составили 26,7 и 24,4 на 100 тыс. женского населения, тенденции к снижению смертности в 2011–2020 гг. не выявлено.
Заключение
В результате проведённого исследования установлены общие закономерности и особенности заболеваемости ЗНО, ассоциированными с ВПЧ, на Северо-Западе России. Эти данные являются основой для оптимизации системы эпидемиологического надзора и вакцинопрофилактики папилломавирусной инфекции. В России принята Стратегия развития иммунопрофилактики инфекционных заболеваний до 2035 г., которая предусматривает совершенствование вакцинации против папилломавирусной инфекции, что создаёт предпосылки для поэтапного снижения заболеваемости и в перспективе элиминации ЗНО, связанных с ВПЧ.
Об авторах
Людмила Владимировна Лялина
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Автор, ответственный за переписку.
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0001-9921-3505
д.м.н., профессор, зав. лаб. эпидемиологии инфекционных и неинфекционных заболеваний
Россия, Санкт-ПетербургДмитрий Вячеславович Холопов
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0002-1268-6172
аспирант
Россия, Санкт-ПетербургАркадий Витальевич Язенок
Медицинский информационно-аналитический центр
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0002-1334-8191
д.м.н., доцент, директор Медицинского информационно-аналитического центра
Россия, Санкт-ПетербургВалентин Васильевич Хижа
Медицинский информационно-аналитический центр
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0002-4218-0228
к.м.н., начальник отдела медицинской статистики опухолевых заболеваний Медицинского информационно-аналитического центра
Россия, Санкт-ПетербургЭльдар Эскендерович Топузов
Городской клинический онкологический диспансер, Санкт-Петербург
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0002-1700-1128
д.м.н., профессор, главный врач Городского клинического онкологического диспансера
Россия, Санкт-ПетербургЕвгений Владимирович Касаткин
Кожно-венерологический диспансер № 8, Санкт-Петербург
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0003-0029-7150
к.м.н, главный врач Кожно-венерологического диспансера № 8
Россия, Санкт-ПетербургЕвгений Александрович Горяев
Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями Ленинградской области
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0001-6842-7201
зав. отделом профилактики Центра по профилактике и борьбе со СПИД и инфекционными заболеваниями Ленинградской области
Россия, Санкт-ПетербургТатьяна Геннадьевна Задоркина
Центр специализированных видов медицинской помощи Калининградской области
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0002-2905-2635
к.м.н., главный врач
Россия, КалининградЖанна Руслановна Молчанова
Управление Роспотребнадзора по Калининградской области
Email: lvlyalina777@yandex.ru
ORCID iD: 0000-0002-2704-7832
главный специалист эксперт отдела эпидемиологического надзора и санитарной охраны территории Управления Роспотребнадзора по Калининградской области
Россия, КалининградСписок литературы
- Morales-Sánchez A., Fuentes-Pananá E. Human viruses and cancer. Viruses. 2014; 6(10): 4047–79. https://doi.org/10.3390/v6104047
- Wild C.P., Weiderpass E., Stewart B.W., eds. World Cancer Report: Cancer Research for Cancer Prevention. Licence: CC BY-NC-ND 3.0 IGO. Lyon, France: International Agency for Research on Cancer; 2020.
- De Martel C., Plummer M., Vignat J., Franceschi S. Worldwide burden of cancer attributable to HPV by site, country and HPV type. IJC. 2017; 141(4): 664–70. https://doi.org/10.1002/ijc.30716
- World Cancer Research Fund International. Worldwide cancer data – 2020. Available at: https://www.wcrf.org/dietandcancer/worldwide-cancer-data/
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2021; 71(3): 209–9. https://doi.org/10.3322/caac.21660
- Taylor D.E., Henley S.J., Senkomago V., O’Neil M.E., Wilson R.J., Singh S., et al. Trends in incidence of cancers of the oral cavity and pharynx – United States 2007–2016. MMWR Morb. Mortal. Wkly Rep. 2020; 69(15): 433–8. https://doi.org/10.15585/mmwr.mm6915a1
- Каприн А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.; 2021.
- Heer Е., Hackl М., Ferlitsch М., Waldhoer Т., Yang L. Trends in incidence of anal cancer in Austria, 1983–2016. Wien. Klin. Wochenschr. 2020; 132(15): 438–43. https://doi.org/10.1007/s00508-020-01622-z
- Hami L.T., Lampe B., Mallmann P., Forner D.M. The impact of age on the prognosis of vulvar cancer. Oncol. Res. Treat. 2018; 41(9): 520–4. https://doi.org/10.1159/000488800
- Vaginal cancer incidence statistics. Cancer Research UK; 2020. Available at: https://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/vaginal-cancer/incidence#heading-One.
- Arbyn M., Weiderpass E., Bruni L., de Sanjosé S., Saraiya M., Ferlay J., et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Glob. Health. 2020; 8(2): 191–203. https://doi.org/10.1016/S2214-109X(19)30482-6
- Hansen B.T., Orumaa M., Lie A.K., Brennhovd B., Nygård M. Trends in incidence, mortality and survival of penile squamous cell carcinoma in Norway 1956-2015. Int. J. Cancer. 2018; 142(8): 1586–93. https://doi.org/10.1016/S2214-109X(19)30482-6
- Cancer Stat Facts: Oral Cavity and Pharynx Cancer. Surveillance, Epidemiology, and End Results Programe 18, 2010–2016. National Cancer Institute; 2018. https://seer.cancer.gov/statfacts/html/oralcav.html
- Nelson V.M., Benson A.B. Epidemiology of anal canal cancer. Surg. Oncol. Clin. N. Am. 2017; 26(1): 9–15. https://doi.org/10.1016/j.soc.2016.07.001
- Mensah F.A., Mehta M.R., Lewis J.S., Lockhart A.C. The human papillomavirus vaccine: current perspective and future role in prevention and treatment of anal Intraepithelial neoplasia and anal cancer. Oncologist. 2016; 21(4): 453–60. https://doi.org/10.1634/theoncologist.2015-0075
- Vaginal cancer mortality statistics. Cancer Research UK; 2019. Available at: https://www.cancerresearchuk.org/health-professional/cancer-statistics/statistics-by-cancer-type/vaginal-cancer/mortality#heading-One
- Брико Н.И., Лопухов П.Д., Каприн А.Д., Новикова Е.Г., Трушина О.И., Халдин А.А. и др. ВПЧ-ассоцированные поражения в Российской Федерации: оценка состояния проблемы. Современная онкология. 2019; 21(1): 45–50. https://doi.org/10.26442/18151434.2019.190199
- Костин А.А., Старинский В.В., Самсонов Ю.В., Асратов А.Т. Анализ статистических данных о злокачественных новообразованиях, ассоциированных с вирусом папилломы человека. Исследования и практика в медицине. 2016; 3(1): 66–78. https://doi.org/10.17709/2409-2231-2016-3-1-9
- Нигматуллин Л.М. ВПЧ-ассоциированные онкологические заболевания. Поволжский онкологический вестник. 2017; (2): 48–55.
- Лопухов П.Д., Брико Н.И., Халдин А.А., Цапкова Н.Н., Лупашко О.В. Папилломавирусная инфекция: основные характеристики, клинические проявления, вакцинопрофилактика. Журнал микробиологии, эпидемиологии и иммунобиологии. 2016; (1): 71–8. https://doi.org/10.36233/0372-9311-2016-1-71-78
- Афанасьева Л.Н., Игнатьева М.Е., Лялина Л.В., Саввина Н.В., Сметанина В.Д. Региональный опыт профилактики рака шейки матки в Республике Саха (Якутия). Инфекция и иммунитет. 2014; 4(2): 137–42.
- Краснопольский В.И., Зароченцева Н.В., Белая Ю.М., Джиджихия Л.К. Предраковые и злокачественные заболевания, ассоциированные с вирусом папилломы человека. Анализ статистики в Московской области за последнее десятилетие. Вопросы гинекологии, акушерства и перинатологии. 2019; 18(6): 113–8. https://doi.org/10.20953/1726-1678-2019-6-113-118
- WHO. Global strategy to accelerate the elimination of cervical cancer as a public health problem. License: CC BY-NC-SA 3.0 IGO; 2020. Available at: https://apps.who.int/iris/handle/10665/336583
- Wang X., Huang X., Zhang Y. Involvement of Human Papillomaviruses in Cervical Cancer. Front. Microbiol. 2018; 9: 2896. https://doi.org/10.3389/fmicb.2018.02896
- Tanaka H., Shirasawa H., Shimizu D., Sato N., Ooyama N., Takahashi O., et al. Preventive effect of human papillomavirus vaccination on the development of uterine cervical lesions in young Japanese women. J. Obstet. Gynaecol. Res. 2017; 43(10): 1597–601. https://doi.org/10.1111/jog.13419
- Gertig D.M., Brotherton J.M., Budd A.C., Drennan К., Chappell G., Saville A.M. Impact of a population-based HPV vaccination program on cervical abnormalities: a data linkage study. BMC Med. 2013; 11: 227. https://doi.org/10.1186/1741-7015-11-227
- Mahmud S.M., Kliewer E.V., Lambert Р., Bozat-Emre S., Demers A.A. Effectiveness of the quadrivalent human papillomavirus vaccine against cervical dysplasia in Manitoba, Canada. J. Clin. Oncol. 2014; 32(5): 438–43. https://doi.org/10.1200/JCO.2013.52.4645
- Chan C.K., Aimagambetova G., Ukybassova Т., Kongrtay К., Azizan А. Review article human papillomavirus infection and cervical cancer: epidemiology, screening, and vaccination. Review of current perspectives. J. Oncol. 2019; 2019: 3257939. https://doi.org/10.1155/2019/3257939
Дополнительные файлы