Характеристика возбудителей сальмонеллёзов, циркулирующих в Приморском крае до и во время пандемии COVID-19
- Авторы: Показеева Ю.Н.1,2, Семейкина Л.М.3, Яковлев А.А.1,2, Тимченко Н.Ф.1, Макаренкова И.Д.1, Щелканов М.Ю.1,4
-
Учреждения:
- Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова
- Тихоокеанский медицинский университет
- Центр гигиены и эпидемиологии в Приморском крае
- Дальневосточный федеральный университет
- Выпуск: Том 102, № 4 (2025)
- Страницы: 404-412
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18923
- DOI: https://doi.org/10.36233/0372-9311-679
- EDN: https://elibrary.ru/UUUAQF
- ID: 18923
Цитировать
Аннотация
Введение. Сальмонеллёзы, для которых характерны острые вспышки заболеваемости, являются актуальной проблемой для здравоохранения.
Цель исследования: оценить влияние пандемии COVID-19 на эпидемиологические закономерности и молекулярно-биологические характеристики сальмонеллёзных инфекций в Приморском крае за 2019–2023 гг.
Материалы и методы. Проведён ретроспективный эпидемиологический анализ заболеваемости населения Приморского края сальмонеллёзами в период пандемии COVID-19. Методами щелочного лизиса и серологического типирования установлены плазмидная характеристика штаммов нетифоидных Salmonella и их серотип.
Результаты. Во время пандемии COVID-19 как в России, так и в Приморском крае регистрация сальмонеллёзов была значительно ниже, чем в допандемический период, а сезонность сальмонеллёзов сдвинулась на осенние месяцы. Выявлена обратная связь средней силы между данными помесячной заболеваемости сальмонеллёзами и COVID-19. Особых изменений в плазмидном спектре и в доле регистрации по серогруппам и серотипам Salmonella не наблюдалось. Показано, что сальмонеллёзные инфекции в Приморском крае в основном вызваны штаммами S. enteritidis с плазмидной характеристикой 38 МДа, 38:1,4 МДа, 38:2,3 МДа, 38:4,4 МДа, выявлялись также редкие варианты плазмидных типов. Влияние пандемии COVID-19 на появление новых плазмидных типов не установлено.
Заключение. Представленные результаты исследования об эпидемиологической и молекулярно-биологической характеристике Salmonella, циркулирующей в Приморском крае в период пандемии COVID-19, открывают перспективы для понимания эколого-эпидемиологических закономерностей развития эпидемического процесса сальмонеллёзов.
Ключевые слова
Полный текст
Введение
Сальмонеллёзы вызываются различными серотипами бактерий рода Salmonella, относятся к полиэтиологическим инфекционным заболеваниям у людей и животных и являются огромной проблемой для общественного здравоохранения во всём мире, способствуя увеличению экономического бремени. В зависимости от состояния здоровья организма хозяина и серотипа Salmonella, устойчивости бактерий к противомикробным препаратам, на 11–20 млн случаев сальмонеллёза в мире ежегодно регистрируется до 161 000 смертельных исходов [1].
В современный период сальмонеллёзы являются одной из наиболее распространённых бактериальных кишечных инфекций с тенденцией к увеличению вспышек заболеваемости. По данным официальной статистики, в последние годы в России средний показатель заболеваемости в 2021 г. находился на уровне 13,61 на 100 тыс. населения1, в 2022 г. — 17,1, в 2023 г. — 21,45, при этом в ряде территориальных округов он превышает средний показатель по стране.
В Приморском крае на протяжении последнего десятилетия на фоне существенного изменения этиологической структуры инфекций кишечной группы в сторону увеличения доли ротавирусной и норовирусной инфекций и снижения удельного веса таких заболеваний, как вирусные гепатиты А и E и шигеллёзы, удельный вес сальмонеллёзов практически не изменился и колеблется в пределах 10% [2].
В 2020 г. возникла чрезвычайная ситуация в связи с развитием пандемии новой коронавирусной инфекции (COVID-19), вызванной вирусом SARS-CoV-2, что существенно повлияло на заболеваемость другими инфекционными заболеваниями с различными механизмами передачи [3–9]. В литературе в основном представлены исследования, показывающие влияние COVID-19 на острые респираторные вирусные инфекции. Встречаются лишь отдельные публикации, в которых рассматривается влияние пандемии COVID-19 на эпидемиологические закономерности и микробиологические характеристики инфекций, относящихся к кишечной группе [4], при этом практически отсутствуют данные о его влиянии на эпидемиологические закономерности развития сальмонеллёзов в России.
Цель исследования — оценить влияние пандемии COVID-19 на эпидемиологические закономерности и молекулярно-биологические характеристики нетифоидных сальмонеллёзов в Приморском крае за 2019–2023 гг.
Материалы и методы
Ретроспективный эпидемиологический анализ заболеваемости сальмонеллёзами и COVID-19 населения Приморского края проводили на основе данных федерального государственного статистического наблюдения по Приморскому краю — «Сведения об инфекционных и паразитарных заболеваниях» (форма № 2) за 2009–2023 гг.
Спектр плазмидных типов в штаммах сальмонелл определяли методом щелочного лизиса [10]. Известные плазмидные типы RP4 (38 МДа), pBR322 (2,9 МДа), pVM82 (82 МДа) использовали как стандарты молекулярной массы.
При выполнении метода серологического типирования использовали диагностические сальмонеллёзные адсорбированные сухие сыворотки для реакции агглютинации («Петсал») в соответствии с антигенной схемой Кауфмана–Уайта [11].
Статистическую обработку данных проводили с использованием программ «Microsoft Excel 2010» и «Statistica v. 10». Величину критического уровня значимости p при проверке статистических гипотез принимали равной 0,05.
Результаты
Период с 2009 по 2012 г. в Приморском крае характеризовался ростом заболеваемости сальмонеллёзами, максимум был зарегистрирован в 2012 г. и составил 71,8 на 100 тыс. населения. В последующие годы наметилась тенденция к снижению заболеваемости, и к 2022 г. её уровень снизился до 13,3 на 100 тыс. населения (темп прироста составил –4,2), тогда как в России заболеваемость сальмонеллёзами была более стабильной (темп прироста составил –3,4). При этом показатели заболеваемости в Приморском крае превышали данные по стране в 2009–2019 гг., а начиная с 2020 г. практически сравнялись (рис. 1). В 2023 г. отмечен рост заболеваемости как в Приморском крае, так и в России в целом (до 21,6 на 100 тыс. населения).
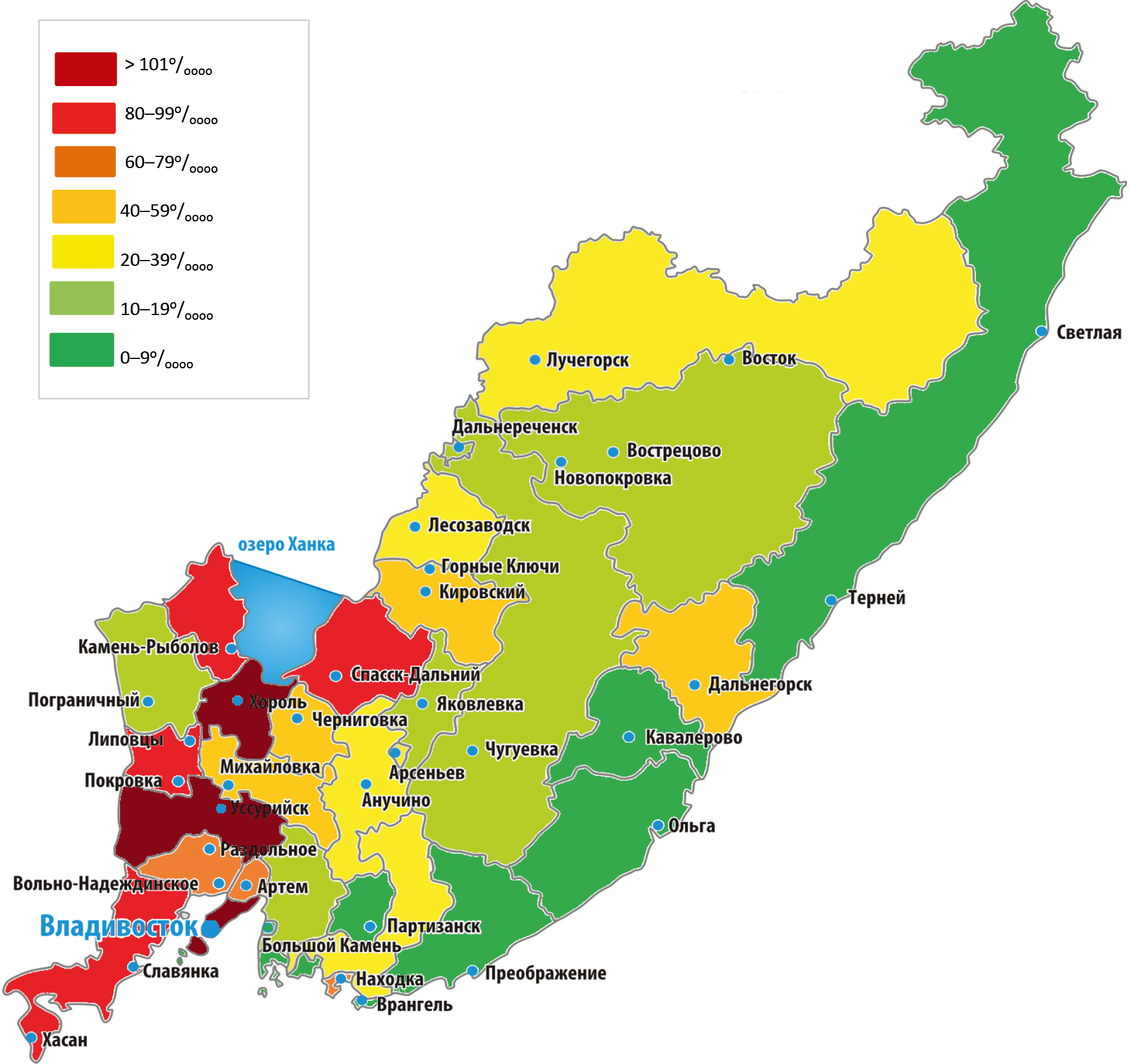
До и во время пандемии COVID-19 на территории Приморского края самая низкая заболеваемость сальмонеллёзными инфекциями зафиксирована в муниципальных округах, Тернейском, Кавалеровском, Лазовском, Ольгинском, Партизанском районах и Фокино (рис. 2). Следует отметить, что в разгар пандемии на этих территориях штаммы S. enterica не были изолированы.
Рис. 1. Динамика заболеваемости сальмонеллёзом в Приморском крае и Российской Федерации в 2009–2023 гг.
Рис. 2. Заболеваемость сальмонеллёзом на административных территориях Приморского края в 2019–2023 гг. (на 100 тыс. населения).
Цветной вариант рисунка — см. на сайте журнала: https://microbiol.crie.ru/jour
Высокий уровень сальмонеллёзов как до, так и во время пандемии COVID-19 регистрировался в городах Владивосток, Уссурийск, Спасск-Дальний, в Хорольском и Хасанском районах. Период максимального подъёма заболеваемости пришелся на 2019 г., а в 2023 г. зафиксировано постепенное её восстановление до обычного уровня.
В помесячной динамике (рис. 3) заболеваемость сальмонеллёзами до и во время пандемии COVID-19 с 2018 по 2019 г. регистрировались преимущественно в летне-осенний период (июнь–октябрь). В разгар пандемии COVID-19, начиная с 2020 г., сезонность сдвинулась на осенние месяцы (сентябрь–октябрь). В 2021 г. максимальные подъёмы заболеваемости сальмонеллёзами пришлись на май и июнь, август и сентябрь, а также ноябрь. В 2023 г. уровень заболеваемости сальмонеллёзами на территории Приморского края стал восстанавливаться, а его сезонность наблюдалась в летне-осенний период (июнь–октябрь). Близкие результаты приводят и другие авторы [4].
Рис. 3. Помесячная динамика заболеваемости сальмонеллёзом в Приморском крае в 2018–2023 гг.
Интересные данные были получены при сопряжённом анализе помесячной заболеваемости COVID-19 в одни и те же годы. Так, в динамике заболеваемости COVID-19 и сальмонеллёзами за 2021–2022 гг. (рис. 4) можно выделить четыре периода в изменении уровня заболеваемости. С января по октябрь 2021 г. наблюдался спад заболеваемости COVID-19, в то же время заболеваемость сальмонеллёзами возросла. С ноября 2021 г. по март 2022 г. заболеваемость COVID-19 возросла, а сальмонеллёзами с декабря 2021 г. по февраль 2022 г. — снизилась. С марта по июль 2022 г. отмечено значительное увеличение заболеваемости сальмонеллёзами. С августа по сентябрь 2022 г. отмечен подъём заболеваемости COVID-19 при снижении регистрации сальмонеллёзов. Корреляционный анализ приведённых данных по Спирмену позволил выявить обратную связь средней силы между анализируемыми данными помесячной заболеваемости обеими инфекциями (r = 0,5; p < 0,05).
Рис. 4. Сравнительный анализ помесячной динамики заболеваемости COVID-19 (а) и сальмонеллёзом (б) с 2021 по 2022 г.
Установлено, что в Приморском крае, как и в большинстве регионов Российской Федерации, и в мире, лидирующую позицию занимает Salmonella серогруппы D с доминирующим серотипом S. enteritidis, далее следуют серогруппы С и В с несущественным долевым значением (серогруппа В — 9,1 ± 1,3%; серогруппа С — 9,7 ± 1,3%). Последнее место занимает серогруппа Е, которая в 2022 г. не была зарегистрирована. Следует отметить, что наименьшая заболеваемость, вызванная и другими серогруппами S. enterica, была зафиксирована в 2022 г. (рис. 5).
Рис. 5. Динамика заболеваемости населения отдельными серогруппами Salmonella enterica в Приморском крае за 2019–2023 гг.
В современный период основными серотипами при выявлении сальмонеллезов являются S. enteritidis, S. typhimurium, S. infantis. Начиная с 1995 г. и по настоящее время, несмотря на многообразие плазмидных типов у ведущего серотипа S. enteritidis, доминирующее значение по-прежнему имеют три основных плазмидных типа: 38, 38:1,4 и 38:4,4 МДа (таблице). Не потеряли свою значимость в формировании эпидемической ситуации и другие, реже выделяемые плазмидные типы (38:2,3, 38:2,3:1,4, 38:2,6:1,4, 38:2,6:14, 38:3,0:1,4, 38:30, 38:30:1,4, 38:30:2,3 МДа — эпидемический пул).
Динамика числа плазмидных типов S. enteritidis, выделяемых в Приморском крае в 2009–2023 гг.
Плазмидные типы (МДа) | Год | Всего штаммов | Источник выделения | ||||||||||||||
2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 | 2023 | |||
38 | 220 | 128 | 110 | 397 | 313 | 234 | 211 | 140 | 93 | 76 | 96 | 41 | 31 | 37 | 26 | 2153 | п, пп, в |
38:1,4 | 297 | 323 | 299 | 343 | 538 | 349 | 309 | 154 | 186 | 138 | 66 | 17 | 17 | 12 | 17 | 3065 | п, пп, в |
38:2,3 | 7 | 5 | 9 | 12 | 8 | 2 | 5 | 7 | 13 | 10 | 11 | 9 | 3 | 2 | – | 103 | п, пп, в |
38:4,4 | 82 | 368 | 267 | 179 | 111 | 132 | 107 | 137 | 119 | 82 | 50 | 13 | 24 | 1 | 8 | 1760 | п, пп |
Примечание. п — пострадавшие; пп — пищевые продукты; в — внешняя среда.
Результаты исследования показали, что количество заболевших сальмонеллёзами, вызванными S. enteritidis с плазмидными типами 38, 38:1,4, 38:2,3 и 38:4,4 МДа, постепенно снижалось вплоть до 2019 г., а с начала пандемии COVID-19 сократилось в 2 раза (таблица).
Важно отметить, что как до, так и в период пандемии COVID-19 у серовара S. enteritidis выявлялись редкие варианты плазмидных типов: 38:26:2,6, 3,2:2,0, 38:3,8:3,0, 5,6:3,8:3,2:2,0, 38:4,4:3,2 50:38:20, 38:5,0:3,8:3,0 и 50:8,0:4,0:3,5:1,4 МДа. Влияние эпидемиологической ситуации во время пандемии COVID-19 на появление новых плазмидных типов нами не установлено.
Вторым по значимости серотипом в этиологии сальмонеллёзов в Приморском крае является S. typhimurium. За 2019–2023 гг. исследовано более 90 штаммов S. typhimurium, изолированных из различных источников. Все заражения носили пищевой характер, госпитальные штаммы не были выделены. Наиболее часто регистрировались штаммы с одним плазмидным типом — 60 МДа (14,3%), вторым по значимости оказался плазмидный тип 4,0:3,2 МДа (13,2%), впервые появившийся в 2015 г. (выделен от больного в г. Уссурийске).
У серотипа S. infantis, циркулирующего на территории Приморского края, в основном преобладал плазмидный тип массой 100 МДа (72%), выделенный из продуктов питания. Штаммы с другими плазмидными типами изолировались редко.
Обсуждение
Кишечные инфекции являются актуальной проблемой во всём мире ввиду чрезвычайно широкой распространённости данной патологии, высокого уровня заболеваемости и, как следствие, значительного экономического ущерба [12].
Сальмонеллёзные инфекции и COVID-19 имеют разные пути передачи, но в отдельных случаях проявляют сопоставимые симптомы [13, 14]. Кроме того, иммунологический ответ, который вызывает вирус SARS-CoV-2, способен повлиять на степень тяжести бактериальных инфекций, в том числе сальмонеллёзов [15]. Позднее было установлено, что эти факторы имеют серьёзные последствия, связанные с возникновением и лечением сальмонеллёзов [16–19]. Случаи коинфекции сальмонеллой и COVID-19 зарегистрированы в 9 исследованиях по всему миру [20], некоторые из них были обнаружены у пациентов из Пакистана [21], Турции [22] и Японии [23]. Пациенты с коинфекцией сталкиваются с более серьёзными последствиями и увеличивают сложность терапевтических решений, необходимых для решения этой проблемы.
В 2020 г. развитие пандемии COVID-19 во всём мире существенно повлияло на показатели заболеваемости другими инфекциями с разным механизмом передачи. Так, при сравнении со среднемноголетним показателем с 2016 по 2023 г. уровень заболеваемости инфекциями с аэрозольным механизмом передачи с 2020 по 2023 г. в Приморском крае был выше среднемноголетнего, тогда как показатели заболеваемости кишечными инфекциями — значительно ниже. Наименьшие показатели регистрировались в 2020–2021 гг., однако в последующие годы отмечается тенденция к их росту.
Показатели заболеваемости инфекциями с трансмиссивным механизмом передачи за 2020–2023 гг. также были значительно ниже среднемноголетних. Аналогичные данные получены и по заболеваемости инфекциями с контактным механизмом.
Установлено, что во всех группах, за исключением инфекций с аэрозольным механизмом передачи, заболеваемость в годы пандемии COVID-19, по сравнению со средними показателями за предыдущие годы, существенно снизилась.
Сальмонеллёзы в Приморском крае продолжают играть важную роль в формировании инфекционной заболеваемости, о чём свидетельствуют увеличение вспышек и превышение среднего уровня заболеваемости по сравнению с Россией в целом. Следует отметить, что в разгар пандемии COVID-19 наблюдалось снижение роста заболеваемости сальмонеллёзами. Самая низкая заболеваемость зарегистрирована в Тернейском, Кавалеровском, Лазовском, Ольгинском, Партизанском районах и Фокино, однако в городах Владивосток, Уссурийск, Спасск-Дальний, Хорольском, Хасанском районах отмечен высокий уровень сальмонеллёзов. В период пандемии отмечен разнонаправленный характер в помесячной динамике заболеваемости COVID-19 и сальмонеллёзами по сравнению с допандемическим периодом. Снижение регистрации случаев сальмонеллёзов, возможно, связано с изоляцией населения в период пандемии, переходом на удаленный формат работы, переводом на карантин многопрофильных медицинских организаций в связи с выявлением случаев заболеваемости коронавирусной инфекцией и перепрофилированием клинических больниц для диагностики и специализированного лечения больных с подтверждённым диагнозом. Тем не менее в формировании сложившейся эпидемиологической ситуации нельзя исключить и влияние биогеоценоза на саморегуляцию различных видов микроорганизмов в результате интеграционно-конкурентных взаимоотношений между ними, что отражается на изменении тенденции в динамике заболеваемости отдельными инфекциями и структуры инфекционной патологии [24, 25].
Несмотря на многообразие плазмидных типов у ведущего серотипа S. enteritidis, доминирующее значение в развитии заболеваемости сальмонеллёзом имеют три основных плазмидных типа: 38, 38:1,4 и 38:4,4 МДа, что подтверждается результатами исследования. Установлено, что сальмонеллёзные инфекции в Приморском крае как в допандемический период, так и в разгар пандемии COVID-19 в основном были вызваны штаммами S. enteritidis с плазмидной характеристикой 38, 38:1,4, 38:2,3 и 38:4,4 МДа. Как и в допандемический период, были выявлены и редкие варианты плазмидных типов. Влияние эпидемической ситуации во время пандемии COVID-19 на появление новых плазмидных типов не установлено.
Заключение
Полученные нами данные об эпидемиологических и молекулярно-биологических характеристиках возбудителей сальмонеллёзов, циркулирующих в Приморском крае в допандемический период и в разгар пандемии COVID-19, открывают перспективы для раскрытия эколого-эпидемиологических закономерностей развития эпидемического процесса, что позволит обоснованно принимать управленческие решения для реализации контроля за сальмонеллёзной инфекцией.
1 О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2023 году: Государственный доклад. М.; 2024. 368 с.
Об авторах
Юлия Николаевна Показеева
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова; Тихоокеанский медицинский университет
Автор, ответственный за переписку.
Email: pokazeeva_ylia@mail.ru
ORCID iD: 0000-0001-5725-830X
м. н. с. лаб. кишечных инфекций НИИ эпидемиологии и микробиологии им. Г.П. Сомова Роспотребнадзора, ассистент каф. нормальной и патологической физиологии Тихоокеанского медицинского университета
Россия, Владивосток; ВладивостокЛюбовь Михайловна Семейкина
Центр гигиены и эпидемиологии в Приморском крае
Email: pokazeeva_ylia@mail.ru
ORCID iD: 0009-0002-1095-7968
аспирант НИИ эпидемиологии и микробиологии им. Г.П. Сомова Роспотребнадзора, зам. зав. отделом эпидемиологии Центра гигиены и эпидемиологии в Приморском крае
Россия, ВладивостокАнатолий Александрович Яковлев
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова; Тихоокеанский медицинский университет
Email: pokazeeva_ylia@mail.ru
ORCID iD: 0000-0002-7008-3804
д. м. н., в. н. с. лаб. кишечных инфекций НИИ эпидемиологии и микробиологии им. Г.П. Сомова Роспотребнадзора, проф. каф. эпидемиологии и военной эпидемиологии Тихоокеанского медицинского университета
Россия, Владивосток; ВладивостокНелли Фёдоровна Тимченко
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова
Email: pokazeeva_ylia@mail.ru
ORCID iD: 0000-0001-6051-292X
д. м. н., в. н. с. лаб. кишечных инфекций
Россия, ВладивостокИлона Дамировна Макаренкова
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова
Email: pokazeeva_ylia@mail.ru
ORCID iD: 0000-0001-6450-840X
д. м. н., в. н. с. лаб. кишечных инфекций
Россия, ВладивостокМихаил Юрьевич Щелканов
Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова; Дальневосточный федеральный университет
Email: pokazeeva_ylia@mail.ru
д. б. н., член-корреспондент РАН, директор НИИ эпидемиологии и микробиологии им. Г.П. Сомова Роспотребнадзора, зав. каф. эпидемиологии, микробиологии и паразитологии Дальневосточного федерального университета
Россия, Владивосток; ВладивостокСписок литературы
- Naushad S., Ogunremi D., Huang H. Salmonella — perspectives for low-cost prevention, control and treatment. IntechOpen; 2024. DOI: https://doi.org/10.5772/intechopen.112948
- Яковлев А.А., Чекунина С.Н., Колпаков С.Л. Эпидемиологическая оценка факторов, детерминирующих эпидемический процесс гепатита А и шигелезов (на модели Приморского края). Владивосток;2020. Yakovlev A.A., Chekunina S.N., Kolpakov S.L. Epidemiological Assessment of the Factors that Determine the Epidemic Process of Hepatitis A and Shigellosis (on the Model of Primorsky Krai). Vladivostok;2020. EDN: https://elibrary.ru/kkjyzk
- Пшеничная Н.Ю., Гопаца Г.В., Углева С.В. и др. Эпидемиологические аспекты респираторных инфекций верхних и нижних отделов дыхательных путей в период пандемии COVID-19. Эпидемиология и инфекционные болезни. Актуальные вопросы 2022;12(4):72–6. Pshenichnaya N.Yu., Gopatsa G.V., Ugleva S.V., et al. Epidemiological aspects of respiratory infections of the upper and lower respiratory tract during the COVID-19 pandemic. Epidemiology and Infectious Diseases. Current Items. 2022;12(4):72–6. DOI: https://doi.org/10.18565/epidem.2022.12.4.72-6 EDN: https://elibrary.ru/ydeanh
- Любимова А.В., Сатосова Н.В., Кицбабашвили Р.В. Особенности эпидемического процесса сальмонеллёзной инфекции в период пандемии COVID-19. Эпидемиология и вакцинопрофилактика. 2023;22(2):95–102. Lyubimova A.V., Satosova N.V., Kitsbabashvili R.V. Salmonellosis in the COVID-19 pandemic era. Epidemiology and Vaccinal Prevention. 2023;22(2):95–102. DOI: https://doi.org/10/31631/2073-3046-2023-22-2-95-102 EDN: https://elibrary.ru/nzieml
- Лаврик Е.П., Кравченко А.Г., Трухина Г.М. и др. Влияние противоэпидемических (карантинных) мероприятий в условиях пандемии COVID-19 на снижение и рапрстранение инфекций с аэрогенным механизмом передачи (на примере ветряной оспы). Здоровье населения и среда обитания – ЗНиСО. 2021;29(8):55–62. Lavrik E.P., Kravchenko A.G., Trukhina G.M., et al. Reducing effects of antiepidemic (quarantine) measures during the COVID-19 pandemic on the incidence and spread of airborne infectious diseases (based on the example of varicella). Public Health and Life Environment – PH&LE. 2021;29(8):55–62. DOI: https://doi.org/10.35627/2219-5238/2021-29-8-55-62 EDN: https://elibrary.ru/nyeste
- Бутакова Л.В., Сапега Е.Ю., Троцено О.О. и др. Анализ заболеваемости энтеровирусной инфекцией в субъектах Дальневовосточного и Сибирского Федеральных округов Российской Федерации в период пандемии COVID-19 в 2020 году. Прогнозирование заболеваемости энтеровирусной инфекцией на 2021 г. Дальневосточный журнал инфекционной патологии. 2021;(40):66–71. Butakova L.V., Sapega E.Yu., Trotseno O.O., et al. Analysis of enterovirus infection incidence in constituent entities of the Far Eastern and Siberian federal districts of the Russian federation during COVID-19 pandemic in year 2020. Enterovirus infection incidence prognosis for year 2021. Far Eastern Journal of Infectious Pathology. 2021;(40):66–71. EDN: https://elibrary.ru/uyuuao
- Кандрычын С.В. Выявление случаев туберкулеза и других инфекций во время пандемии COVID-19. Туберкулез и болезни легких. 2021;99(4):66–8. Kandrychyn S.V. Detection of tuberculosis and other infections during the COVID-19 pandemic. Tuberculosis and Lung Diseases. 2021;99(4):66–8. DOI: https://doi.org/10.21292/2075-1230-2021-99-4-66-68 EDN: https://elibrary.ru/ocwfnf
- Щелканов М.Ю. Этиология COVID-19. В кн.: COVID-19: от этиологии до вакцинопрофилактики. М.;2023. Shchelkanov M.Yu. Etiology of COVID-19. In: COVID-19: from Etiology to Vaccine Prevention. Moscow;2023. DOI: https://doi.org/10.33029/9704-9767-4-COV-2023-1-288
- Попова А.Ю., Щелканов М.Ю., Крылова Н.В. и др. Генотипический портрет SARS-CoV-2 на территории Приморского края в период пандемии COVID-19. Журнал микробиологии, эпидемиологии и иммунобиологии. 2024;101(10):19–35. Popova A.Y., Shchelkanov M.Y., Krylova N.V., et al. Genotypic portrait of SARS-CoV-2 in Primorsky Krai during the COVID-19 pandemic. Journal of Microbiology, Epidemiology and Immunobiology. 2024; 101(10):19–35. DOI: https://doi.org/10.36233/0372-9311-497 EDN: https://elibrary.ru/pujffa
- Cado C.I., Liu S.T. Rapid procedure for detection and isolation of large and small plasmids. J. Bacteriol. 1981;145(3):1365–73. DOI: https://doi.org/10.1128/jb.145.3.1365-1373.1981
- Popoff M.Y., Bockemühl J., Gheesling L.L. Supplement 2002 (No 46) to the Kauffmann–White scheme. Res. Microbiol. 2004;155(7):568–70. DOI: https://doi.org/10.1016/j.resmic.2004.04.005
- Раков А.В., Шубин Ф.Н., Иванис В.А. и др. Сравнительная характеристика сальмонеллеза, вызванного различными плазмидоварами Salmonellaenteritidis. Эпидемиология и инфекционные болезни. 2001;(5):50–4. Rakov A.V., Shubin F.N., Ivanis V.A., et al. Comparative characteristics of salmonellosis caused by different plasmid variants of Salmonella enteritidis. Epidemiology and Infectious Diseases. 2001;(5):50–4.
- Lin L., Jiang X., Zhang Z., et al. Gastrointestinal symptoms of 95 cases with SARS-CoV-2 infection. Gut. 2020;69(6):997–1001. DOI: https://doi.org/10.1136/gutjnl-2020-321013
- Abdul Aziz J.M., Abdullah S.K., Al-Ahdal T.M.A., et al. Diagnostic bias during the COVID-19. A rare case report of Salmonella Typhi. Ann. Med. Surg. 2022;74:103282. DOI: https://doi.org/10.1016/j.amsu.2022.103282
- Bengoechea J.A., Bamford C.G.G. SARS-CoV-2, bacterial co-infections, and AMR: the deadly trio in COVID-19? EMBO Mol. Med. 2020;12:e12560. DOI: https://doi.org/10.15252/emmm.202012560
- Onyeaka H., Mazi I.M., Oladunjoye I.O., et al. Impact of COVID-19 on foodborne illness in Africa – a perspective piece. J. Infect Public Health. 2023;16(5):651–9. DOI: https://doi.org/10.1016/j.jiph.2023.02.018
- Mughini-Gras L., ChanaméPinedo L., Pijnacker R., et al. Impact of the COVID-19 pandemic on human salmonellosis in the Netherlands. Epidemiol. Infect. 2021;149:e254. DOI: https://doi.org/10.1017/S0950268821002557
- Davis B.P., Amin J., Franklin N., Beggs P.J. Salmonellosis in Australia in 2020: possible impacts of COVID-19 related public health measures. Commun. Dis. Intell. 2022;46:1–17. DOI: https://doi.org/10.33321/cdi.2022.46.2
- Prayoga W. Concurrent emergencies: overlapping Salmonella and COVID-19 concerns in public health strategies and preparedness. Front. Public Health. 2024;12:1331052. DOI: https://doi.org/10.3389/fpubh.2024.1331052
- Rawson T.M., Moore L.S.P., Zhu N., et al. Bacterial and fungal coinfection in individuals with coronavirus: a rapid review to support COVID-19 antimicrobial prescribing. Clin. Infect. Dis. 2020;71(9):2459–68. DOI: https://doi.org/10.1093/cid/ciaa530
- Haqqi A., Khurram M., Din M.S.U., et al. COVID-19 and Salmonella Typhi co-epidemics in Pakistan: a real problem. J. Med. Virol. 2021;93(1):184–6. DOI: https://doi.org/10.1002/jmv.26293
- Ürkmez F.Y., Atalay T. Salmonella bacteremia accompanying COVID-19: The first salmonella co-infection in the world unrelated to Pakistan. Mikrobiyol. Bul. 2022;56(2):357–64. DOI: https://doi.org/10.5578/mb.20229814 (in Turkish)
- Yogo A., Yamamoto S., Iwamoto N., et al. Non-typhoidal Salmonella bacteremia in COVID-19 with recrudescence of fever after corticosteroid discontinuation: A case report. IDCases. 2022;27:e01415. DOI: https://doi.org/10.1016/j.idcr.2022.e01415
- Шмальгаузен И.И. Кибернетические вопросы биологии. Новосибирск;1968. Shmalgauzen I.I. Cybernetic Issues of Biology. Novosibirsk;1968.
- Яковлев А.А., Поздеева Е.С. О возможных механизмах саморегуляции паразитарных систем в биогеоценозе. Вестник Российской академии медицинских наук. 2018;73(3):195–205. Yakovlev A.A., Pozdeeva E.S. On possible mechanisms of self-regulation of parasitic systems in biogeocenosis. Annals of the Russian Academy of Medical Sciences. 2018;73(3):195–205. DOI: https://doi.org/10.15690/vramn880 EDN: https://elibrary.ru/utykry
Дополнительные файлы