Сочетанное действие гиперэкспрессии и мутаций гена ERG11 при формировании резистентности Candida albicans к триазоловым противогрибковым препаратам
- Авторы: Несвижский Ю.В.1,2, Афанасьев С.С.2, Зверев В.В.1, Воропаев А.Д.2, Афанасьев М.С.1, Воропаева Е.А.2, Буданова Е.В.1, Смирнова Л.М.1, Анисова С.А.1, Урбан Ю.Н.2
-
Учреждения:
- Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
- Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского
- Выпуск: Том 102, № 3 (2025)
- Страницы: 325-330
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18877
- DOI: https://doi.org/10.36233/0372-9311-653
- EDN: https://elibrary.ru/QEKEIF
- ID: 18877
Цитировать
Аннотация
Введение. Современная медицина сталкивается с резистентностью Candida spp. к антимикотикам, обусловленной изменением экспрессии и структуры гена ERG11 — молекулярной мишени триазолов. Эти механизмы часто действуют одновременно, однако взаимодействие между ними остаётся недостаточно изученным.
Цель работы — изучение роли гиперэкспрессии гена ERG11 и его мутаций в формировании резистентности грибов C. albicans к триазолам.
Материалы и методы. Исследование выполнено на 11 штаммах грибов C. albicans из коллекции МНИИЭМ им. Г.Н. Габричевского. Штаммы были охарактеризованы по уровню экспрессии гена ERG11 и наличию в нем мутаций, а также чувствительности к триазолам: позаконазолу, вориконазолу, итраконазолу и флуконазолу.
Результаты. Штаммы C. albicans подразделили на 4 группы: 1-я группа — только с повышенной экспрессией гена ERG11; 2-я — только с мутациями в данном гене; 3-я — одновременно оба вида генетических изменений; 4-я — без данных генетических изменений. Установлено, что минимальная подавляющая концентрация (МПК) триазолов в 1-й группе была в 15,76 раза выше, чем во 2-й, в 4,97 раза выше, чем в 3-й, и в 2,51 раза ниже, чем в 4-й (везде p < 0,05). Во 2-й группе МПК триазолов была в 3,17 раза ниже, чем в 3-й, и в 40 раз ниже (p < 0,001), чем в 4-й. МПК триазолов в 3-й группе по сравнению с 4-й группой была в 12,5 раза ниже (p < 0,001). Популяционное варьирование МПК триазолов в большей степени зависит от изолированного действия мутаций гена ERG11 (45,94%), что в 5,27 раза превосходит эффект изолированной гиперэкспрессии гена.
Заключение. Устойчивость C. albicans к триазолам обеспечивается кооперативным действием гиперэкспрессии и мутаций гена ERG11: наибольшую резистентность обеспечивает гиперэкспрессия, популяционное разнообразие — мутации.
Ключевые слова
Полный текст
Введение
Современная медицина давно столкнулась с проблемой резистентности микробов к химиотерапевтическим препаратам. К настоящему моменту этот вопрос достаточно хорошо изучен и известно множество различных механизмов, обеспечивающих микробам уход от токсического действия антибиотиков. Наиболее примечательными являются генетически детерминированные механизмы резистентности, связанные со значительным увеличением продукции молекулярных мишеней антибиотиков или изменением структуры этих молекул-мишеней. Обсуждаемые механизмы резистентности могут реализовываться в микробной клетке параллельно и даже независимо друг от друга. Вместе с тем результаты их кооперативного действия недостаточно ясны [1–3].
Данный вопрос мы исследовали на примере грибов рода Candida, которых проблема резистентности к противомикробным антибиотическим препаратам также не обошла стороной. Одним из таких механизмов у данных микробов является повышенная экспрессия генов, кодирующих синтез мишени лекарственного препарата. В этом плане немаловажную роль играет ген ERG11, определяющий структуру ланостерол-14α-деметилазы. Она участвует в синтезе эргостерола, важного компонента клеточной стенки гриба. Гиперэкспрессия гена ERG11 обеспечивает синтез большого количества эргостерола, что в итоге делает грибы рода Candida малочувствительными к терапевтическим дозам препаратов азолового ряда [4].
Между тем в последнее время в гене ERG11 был обнаружен ряд несинонимичных мутаций, способных модифицировать эффекты данного гена в сторону как снижения, так и повышения чувствительности грибов рода Candida к азолам [5–9]. Например, согласно полученным нами данным, мутации в гене ERG11 снижали эффекты его гиперэкспрессии и уменьшали минимальную подавляющую концентрацию (МПК) триазоловых препаратов в мутантных штаммах C. albicans до 100 раз [10]. При этом полной отмены исходной резистентности не наблюдалось. Примечательно, что гиперэкспрессия гена ERG11 и его мутации проявляются в различных штаммах Candida spp. относительно независимо [5, 7–9, 11–15].
Очевидно, что оба отмеченных вида генетической изменчивости участвуют в формировании популяционного разнообразия грибов рода Candida по степени чувствительности к азолам. Однако остаются неясными характер и результат взаимодействия этих механизмов. Представляется, что исследование данного вопроса может составить чёткое представление о стратегии выживания Candida spp. в условиях массированного медикаментозного воздействия и перспективных векторах управления эпидемией микробной резистентности.
Цель настоящего исследования — изучение взаимодействия гиперэкспрессии гена ERG11 и его отдельных мутаций в формировании резистентности грибов C. albicans к триазоловым противогрибковым препаратам (ТПП).
Материалы и методы
Исследование выполнено на 11 штаммах грибов C. albicans из коллекции Московского научно-исследовательского института эпидемиологии и микробиологии им. Г.Н. Габричевского, изначально устойчивых к действию флуконазола и вориконазола.
Коллекционные штаммы грибов C. albicans прошли видовую идентификацию по биохимической активности и мультиплексной полимеразной цепной реакции в реальном времени (ПЦР-РВ), а также по уровню экспрессии и наличию мутаций гена ERG11. Подробное описание технологии характеристики дано в работе [10].
Согласно имеющейся характеристике, 7 исследованных штаммов были носителями 5 вариантов несинонимичных мутаций в гене ERG11 (E266D, G464S, I471L, D116E и V488I). В 6 штаммах была выявлена повышенная экспрессия гена ERG11.
Все исследованные штаммы C. albicans были разделены на 4 группы в соответствии с обнаруженными генетическими изменениями: 1-я группа (2 штамма) — только с повышенной экспрессией гена ERG11; 2-я (3 штамма) — с мутациями только в данном гене; 3-я (4 штамма) — с одновременной экспрессией обоих видов генетических изменений; 4-я (2 штамма) — без указанных генетических изменений.
Чувствительность изучаемых штаммов грибов C. albicans к четырем представителям ТПП (позаконазол, вориконазол, итраконазол, флуконазол) исследовали в соответствии с рекомендациями Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) по определению чувствительности микроорганизмов к антимикробным препаратам, основанных на стандартах CLSI M44 и M60 для грибов и стандартах и критериях Европейского комитета по определению чувствительности к антибиотикам (EUCAST) для метода микроразведений и бактериальных культур1.
МПК препарата (в мг/мл) определяли методом серийных микроразведений с помощью планшетов «Sensititre YeastOne10» («Trek diagnostic system»). Для этого инокулят подготавливали аналогично дискодиффузионному методу, после чего вносили в модифицированную среду RPMI-1640 и распределяли по 96-луночным планшетам для серийных микроразведений с предварительно внесёнными субстанциями ТПП [11]. Учёт результатов производили визуально, по сравнению с ростом в лунке с положительным контролем в соответствии с критериями EUCAST [12].
Для обеспечения сопоставимости результатов исследования данные по отдельным штаммам C. albicans к каждому ТПП были взвешены по среднему значению МПК для данного препарата. В дальнейшем анализировали полученные относительные значения.
Для статистического анализа использовали программное обеспечение «Microsoft Excel», «SciPy», «Matplotlib». Оценку значимости различий между проводили с помощью U-критерия Манна–Уитни. Вклад факторов в популяционную изменчивость признака оценивали в одно- и двуфакторном анализе с повторами (ANOVA). Критический уровень ошибки при проверке статистических гипотез принимали за р < 0,05.
Результаты
МПК ТПП при различных генетических изменениях в C. albicans представлены в табл. 1. Оказалось, что различия между отдельными препаратами для каждого варианта генетических изменений отсутствуют и имеют единую направленность. Данный факт позволил нам объединить результаты исследования МПК в единую группу триазолов. Итоговые характеристики групп представлены в табл. 2.
Таблица 1. МПК ТПП при различных вариантах генетических изменений в гене ERG11 C. albicans (X ± m)
Группа штаммов Strain group | n | Позаконазол | Вориконазол | Итраконазол | Флуконазол |
1 | 2 | 1,361 ± 1,351 | 1,184 ± 1,045 | 1,363 ± 1,353 | 1,579 ± 1,483 |
2 | 3 | 0,008 ± 0,002 | 0,139 ± 0,000 | 0,008 ± 0,002 | 0,191 ± 0,000 |
3 | 4 | 0,028 ± 0,019 | 0,383 ± 0,244 | 0,026 ± 0,020 | 0,669 ± 0,317 |
4 | 2 | 4,068 ± 1,357 | 3,343 ± 1,115 | 4,075 ± 1,359 | 2,296 ± 0,765 |
Таблица 2. МПК ТПП в исследуемых группах
Группа штаммов Strain group | n | X ± m | Me [Q1; Q3] |
1 | 8 | 1,371 ± 0,501 | |
2 | 12 | 0,087 ± 0,024 | |
3 | 16 | 0,276 ± 0,113 | |
4 | 8 | 3,445 ± 0,522 |
Сравнительный анализ полученных результатов показал, что МПК триазолов в 1-й группе была в 15,76 раза выше (p < 0,05), чем во 2-й, в 4,97 раза выше (p < 0,05), чем в 3-й, и в 2,51 раза ниже (p < 0,05), чем в 4-й. Во 2-й группе МПК триазолов была в 3,17 раза ниже, чем в 3-й, и в 40 раз ниже (p < 0,001), чем в 4-й. МПК триазолов в 3-й группе была в 12,5 раза ниже (p < 0,001) по сравнению с 4-й.
Оценку влияния различных генетических изменений на степень варьирования МПК триазолов в исследованной популяции C. albicans проводили с использованием дисперсионного анализа. Однофакторная модель показала, что совокупный эффект повышенной экспрессии и мутаций гена ERG11 составляет 58,58% (p < 0,001).
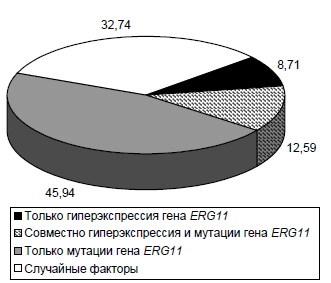
Для расчёта соотносительного влияния данных генетических изменений применили двухфакторный дисперсионный анализ (рисунок). На долю изолированного действия мутаций гена ERG11 пришлась почти половина (45,94%) всех эффектов генетических факторов, что более чем в 5,27 раза превышает вклад изолированного действия повышенной экспрессии этого гена и в 3,65 раза — сочетанного действия мутаций и гиперэкспрессии. При этом на долю совокупного эффекта всех генетических изменений приходится 67,26%, что сопоставимо с результатами расчёта однофакторной модели.
Двухфакторная модель влияния генетических изменений в гене ERG11 на варьирование МПК триазолов в популяции C. albicans, %.
Обсуждение
Мы подтвердили, что резистентность штаммов C. albicans, изначально устойчивых к действию флуконазола и вориконазола, к препаратам триазолового ряда обеспечивается как гиперэкспрессией гена ERG11, так и его мутациями. При этом был установлен принцип взаимодействия рассмотренных генетических механизмов в формировании резистентности: оба фактора могут действовать как независимо, так и в кооперации. Гиперэкспрессия гена ERG11 обладает более выраженным действием, чем его мутации, что совпадает с данными других авторов [4–9, 16, 17].
При сочетанном действии должна происходить суммация эффектов гиперэкспрессии и мутаций гена ERG11. Мутации способны нивелировать эффекты повышенной экспрессией гена ERG11. Конечный результат их сочетанного действия в нашем случае проявляется заметным снижением влияния последней. Мы не берёмся экстраполировать отмеченное на все возможные варианты генетически детерминированной резистентности изучаемого микроба и поэтому склонны расценивать данный факт как особенность нашей коллекции штаммов C. albicans.
К такой же особенности стоит отнести высокую резистентность к ТПП штаммов C. albicans, не экспрессирующих изменения в гене ERG11. Помимо них, например, может возникать гиперэкспрессия в генах CDR1, CDR2, MDR1 и др. [4, 5], сравнительную эффективность которых ещё предстоит оценить.
При проведении дисперсионного анализа мы приняли в расчёт, что популяционное разнообразие грибов C. albicans по чувствительности к ТПП определяется одновременно обоими векторами изменений в гене ERG11. Между тем долевое участие данных векторов оказалось неравнозначным. Установлена доминирующая роль мутаций гена ERG11 в этом процессе.
Оценивая биологическое и медицинское значение гиперэкспрессии и мутаций гена ERG11 в грибах C. albicans, мы обратили внимание на то, что гиперэкспрессия гена ERG11 и связанная с ней гиперпродукция молекулы ланостерол-14α-деметилазы намного эффективнее защищает C. albicans от пагубного воздействия ТПП, чем синтез генетически изменённых вариантов молекулы. Однако точечные несинонимичные мутации в этом гене явно способствуют повышению биологического разнообразия данного дрожжеподобного гриба, не усугубляя в значительной мере его медицинскую опасность в краткосрочной перспективе. Поэтому с практической точки зрения с целью прогнозирования риска возникновения резистентности штаммов C. albicans к ТПП представляется целесообразным выявление именно гиперэкспрессии гена ERG11.
Заключение
- Резистентность C. albicans к ТПП обеспечивается кооперативным действием гиперэкспрессии гена ERG11 и его мутаций.
- Эффект гиперэкспрессии гена ERG11 существенно превосходит таковой его несинонимичных мутаций.
- Мутации гена ERG11 по сравнению с его гиперэкспрессией являются доминантами при формировании популяционного разнообразия C. albicans по резистентности к ТПП.
- Для прогнозирования возникновения резистентности C. albicans к ТПП целесообразно тестировать штаммы на гиперэкспрессию гена ERG
1 Рекомендации МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021)». URL: https://www.antibiotic.ru/minzdrav/category/clinical-recommendations
Об авторах
Юрий Владимирович Несвижский
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского
Автор, ответственный за переписку.
Email: nesviz@mail.ru
ORCID iD: 0000-0003-0386-3883
д-р мед. наук, профессор, профессор каф. микробиологии, вирусологии и иммунологии ПМГМУ им. И.М. Сеченова (Сеченовский Университет); г. н. с. лаб. клинической микробиологии и биотехнологии МНИИЭиМ им. Г.Н. Габричевского
Россия, Москва; МоскваСтанислав Степанович Афанасьев
Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского
Email: afanasievss409.4@bk.ru
ORCID iD: 0000-0001-6497-1795
д-р мед. наук, профессор, г. н. с. лаб. клинической микробиологии и биотехнологии
Россия, МоскваВиталий Васильевич Зверев
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: vitalyzverev@outlook.com
ORCID iD: 0000-0001-5808-2246
д-р биол. наук, профессор, акад. РАН, зав. каф. микробиологии, вирусологии и иммунологии
Россия, МоскваАлександр Дмитриевич Воропаев
Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского
Email: advoropaev@gmail.com
ORCID iD: 0000-0002-6431-811X
канд. мед. наук, м. н. с. лаб. клинической микробиологии и биотехнологии
Россия, МоскваМаксим Станиславович Афанасьев
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: maxim.afanasyev78@gmail.com
ORCID iD: 0000-0002-5860-4152
д-р мед. наук, проф. каф. клинической аллергологии и иммунологии
Россия, МоскваЕлена Александровна Воропаева
Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского
Email: voropaevaea2011@gmail.com
ORCID iD: 0000-0002-0463-0136
д-р мед. наук, проф., г. н. с. лаб. клинической микробиологии и биотехнологии
Россия, МоскваЕлена Вячеславовна Буданова
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: e.v.budanova@mail.ru
ORCID iD: 0000-0003-1864-5635
канд. мед. наук, доцент, доцент каф. микробиологии, вирусологии и иммунологии
Россия, МоскваЛюдмила Михайловна Смирнова
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: lmsmirnova1306@gmail.com
ORCID iD: 0000-0002-6581-4529
канд. мед. наук, доцент, доцент каф. кожных и венерических болезней
Россия, МоскваСофья Александровна Анисова
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: sofaanisova@ya.ru
ORCID iD: 0009-0002-1099-4451
студент Клинического института детского здоровья им. Н.Ф. Филатова
Россия, МоскваЮлия Николаевна Урбан
Московский научно-исследовательский институт эпидемиологии и микробиологии имени Г.Н. Габричевского
Email: urbanek@mail.ru
ORCID iD: 0000-0003-0189-3608
канд. биол. наук, с. н. с. лаб. клинической микробиологии и биотехнологии
Россия, МоскваСписок литературы
- Xiong L., Wang X., Wang Y., et al. Molecular mechanisms underlying bacterial resistance to ceftazidime/avibactam. WIREs Mech. Dis. 2022;14(6):e1571. DOI: https://doi.org/10.1002/wsbm.1571
- Azargun R., Gholizadeh P., Sadeghi V., et al. Molecular mechanisms associated with quinolone resistance in Enterobacteriaceae: review and update. Trans. R. Soc. Trop. Med. Hyg. 2020; 114(10):770–81. DOI: https://doi.org/10.1093/trstmh/traa041
- Gogry F.A., Siddiqui M.T., Sultan I., Haq Q.M.R. Current update on intrinsic and acquired colistin resistance mechanisms in bacteria. Front. Med. (Lausanne). 2021;8:677720. DOI: https://doi.org/10.3389/fmed.2021.677720
- Biswas C., Chen S.C., Halliday C., et al. Identification of genetic markers of resistance to echinocandins, azoles and 5-fluorocytosine in Candida glabrata by next-generation sequencing: a feasibility study. Clin. Microbiol. Infect. 2017;23(9):676.e7–10. DOI: https://doi.org/10.1016/j.cmi.2017.03.014
- Cernicka J., Subik J. Resistance mechanisms in fluconazole-resistant Candida albicans isolates from vaginal candidiasis. Int. J. Antimicrob. Agents. 2006;27(5):403–8. DOI: https://doi.org/10.1016/j.ijantimicag.2005.12.005
- Lim H.J., Shin J.H., Kim M.N., et al. Evaluation of two commercial broth microdilution methods using different interpretive criteria for the detection of molecular mechanisms of acquired azole and echinocandin resistance in four common Candida species. Antimicrob. Agents Chemother. 2020;64(11):e00740-20. DOI: https://doi.org/10.1128/AAC.00740-20
- Lopes W., Vainstein M.H., Schrank A. Revealing colonial characteristics of Candida tropicalis by high-resolution scanning electron microscopy. Clin. Microbiol. Infect. 2019;25 (2):188–9. DOI: https://doi.org/10.1016/j.cmi.2018.06.032
- Pappas P.G., Kauffman C.A., Andes D.R., et al. Clinical practice guideline for the management of candidiasis: 2016 update by the infectious diseases society of America. Clin. Infect. Dis. 2016;62(4):e1–50. DOI: https://doi.org/10.1093/cid/civ933
- Castanheira M., Deshpande L.M., Messer S.A., et al. Analysis of global antifungal surveillance results reveals predominance of Erg11 Y132F alteration among azole-resistant Candida parapsilosis and Candida tropicalis and country-specific isolate dissemination. Int. J. Antimicrob. Agents. 2020;55(1):105799. DOI: https://doi.org/10.1016/j.ijantimicag.2019.09.003
- Несвижский Ю.В., Афанасьев С.С., Воропаев А.Д. и др. Спектр и функциональные свойства мутаций гена ERG11 флуконазол-резистентныйх грибов Candida albicans, выделенных от ВИЧ-инфицированных пациентов. ЖУРНАЛ МИКРОБИОЛОГИИ, ЭПИДЕМИОЛОГИИ И ИММУНОБИОЛОГИИ. 2023;100(4):285–92. Nesvizhsky Yu.V., Afanasiev S.S., Voropaev A.D., et al. Spectrum and functional properties of ERG11 gene mutations in fluconazole-resistant Candida albicans strains isolated from HIV-infected patients. Journal of Microbiology, Epidemiology and Immunobiology. 2023;100(4):285–92. DOI: https://doi.org/10.36233/0372-9311-407 EDN: https://elibrary.ru/pxrovi
- Godinho C.P., Sá-Correia I. Physiological genomics of multistress resistance in the yeast cell model and factory: аocus on MDR/MXR transporters. In: Sá-Correia I., eds. Yeasts in Biotechnology and Human Health. Progress in Molecular and Subcellular Biology, Volume 58. Cham;2019:1–35. DOI: https://doi.org/10.1007/978-3-030-13035-0_1
- Xu Y., Chen L., Li C. Susceptibility of clinical isolates of Candida species to fluconazole and detection of Candida albicans ERG11 mutations. J. Antimicrob. Chemother. 2008;61(4):798-804. DOI: https://doi.org/10.1093/jac/dkn015
- Kakeya H., Miyazaki Y., Miyazaki H., et al. Genetic analysis of azole resistance in the Darlington strain of Candida albicans. Antimicrob. Agents Chemother. 2000;44(11):2985–90. DOI: https://doi.org/10.1128/AAC.44.11.2985-2990.2000
- Finkina E.I., Bogdanov I.V., Ignatova A.A., et al. Antifungal activity, structural stability, and immunomodulatory effects on human immune cells of defensin from the lentil Lens culinaris. Membranes (Basel). 2022;12(9):855. DOI: https://doi.org/10.3390/membranes12090855
- Lee Y., Puumala E., Robbins N., Cowen L.E. Antifungal drug resistance: molecular mechanisms in Candida albicans and beyond. Chem. Rev. 2021;121(6):3390–411. DOI: https://doi.org/10.1021/acs.chemrev.0c00199
- Katsipoulaki M., Stappers M.H.T., Malavia-Jones D., et al. Candida albicans and Candida glabrata: global priority pathogens. Microbiol. Mol. Biol. Rev. 2024;88(2):e0002123. DOI: https://doi.org/10.1128/mmbr.00021-23
- Mahdizade A.H., Hoseinnejad A., Ghazanfari M., et al. The TAC1 gene in Candida albicans: structure, function, and role in azole resistance: a mini-review. Microb. Drug Resist. 2024;30(7): 288–96. DOI: https://doi.org/10.1089/mdr.2023.0334
Дополнительные файлы