Стабилизация растворов тигециклина при тестировании чувствительности микроорганизмов методом микроразведений в бульоне
- Авторы: Косилова И.С.1, Домотенко Л.В.1, Храмов М.В.1
-
Учреждения:
- Государственный научный центр прикладной микробиологии и биотехнологии
- Выпуск: Том 102, № 4 (2025)
- Страницы: 474-481
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18821
- DOI: https://doi.org/10.36233/0372-9311-690
- EDN: https://elibrary.ru/YNTISP
- ID: 18821
Цитировать
Аннотация
Введение. Тигециклин широко используется при лечении инфекций, что приводит к появлению устойчивых к нему бактерий. Определение чувствительности методом микроразведений в бульоне рекомендовано проводить, используя свежеприготовленный бульон Мюллера–Хинтон (МХБ) или МХБ с антиоксидантными добавками, что обусловлено окислением антибиотика. Вместе с тем отсутствует информация о возможности хранения и дальнейшего использования растворов антибиотика.
Цель исследования — определить возможность стабилизации и рационального использования растворов тигециклина для получения допустимых значений минимальных подавляющих концентраций (МПК) при тестировании контрольных штаммов референтным методом.
Материалы и методы. В работе определяли МПК тигециклина для Escherichia соli АТСС 25922, Staphylococcus aureus АТСС 29213, Enterococcus faecalis ATCC 29212, Streptococcus pneumoniae ATCC 49619 методом микроразведений в МХБ, заранее приготовленном и хранившемся 24–48 ч до исследования. Для исследования готовили базовый раствор тигециклина в воде и с добавлением различных концентраций оксиразы, которые хранили при 2–6°С и –70°С и затем проводили тестирование в соответствии с ГОСТ Р ИСО 20776-1-2022.
Результаты. В ходе исследования установлено, что при 2–6°С стабильность базовых растворов тигециклина сохраняется не более 5 ч, а с добавлением 5,0–8,0% оксиразы увеличивается до 16 сут, что позволяет получать значения МПК для всех тест-штаммов в допустимом диапазоне. Изменение температуры хранения до –70°С увеличивает стабильность растворов до 43 сут, а с добавлением 5,0–8,0% оксиразы — минимум до 48 нед.
Заключение. Определена возможность стабилизации растворов тигециклина, хранившихся при отрицательных температурах (с добавлением оксиразы и без неё) для получения допустимых значений МПК при определении чувствительности контрольных штаммов к антимикробным препаратам. Применение данных растворов позволило снизить затраты на тестирование за счёт рационального использования антибиотика.
Полный текст
Введение
Микроорганизмы, устойчивые к антимикробным препаратам, являются одной из самых больших угроз для здравоохранения и продовольственной безопасности во всём мире [1]. Стремительный рост распространения грамотрицательных микроорганизмов, особенно относящихся к Enterobacterales и Acinetobacter spp., которые проявляют устойчивость к препаратам выбора карбапенемам, ставит под угрозу эффективность их применения. Для лечения инфекций, вызванных такими штаммами микроорганизмов, используют в основном колистин и тигециклин [2, 3]. Однако в настоящее время более чем в 40 странах, включая Россию, зафиксировано глобальное распространение резистентности у исследуемых штаммов к колистину, опосредованное геном mcr (mobilized colistin resistance), что значительно снижает его клиническую эффективность [4–7], поэтому тигециклин является критически важным для медицины препаратом1, особенно при лечении инфекций, вызванных микроорганизмами с множественной лекарственной устойчивостью [8].
Тигециклин — антибиотик нового класса глицилциклинов, обладает широким спектром действия, структурно сходен с тетрациклинами, но более активен в отношении большинства грамположительных и грамотрицательных штаммов микроорганизмов. Однако некоторые бактерии, такие как Morganella spp., Proteus spp., Providencia spp. и Pseudomonas aeruginosa, проявляют природную устойчивость к тигециклину [9], описана пониженная чувствительность A. baumannii к нему [10], а у Klebsiella pneumoniae, E. aerogenes, E. cloacae и др. может развиться приобретённая устойчивость к тигециклину, обусловленная сверхэкспрессией гена неспецифичного активного выведения ArcAB, который обеспечивает резистентность ко многим лекарственным препаратам [11].
Для выбора и коррекции антибактериальной терапии рекомендуется проводить микробиологическую диагностику с идентификацией возбудителя и определением его чувствительности к тигециклину.
Референтным методом определения чувствительности является метод микроразведений в бульоне Мюллера–Хинтон (МХБ), позволяющий определять значения минимальных подавляющих концентраций (МПК) тестируемых антибиотиков. В ходе установления допустимых значений МПК тигециклина для контрольных штаммов были выявлены несоответствия в значениях МПК, которые были связаны со сроком хранения МХБ. Результаты ряда исследований показали, что при тестировании в свежеприготовленном (менее чем за 12 ч до начала тестирования) МХБ тигециклин был в 2–3 раза более активен в отношении 3 контрольных штаммов (Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 29213 и Enterococcus faecalis ATCC 29212), чем в хранившейся среде (МПК 0,03–0,25 и 0,12–0,50 мкг/мл соответственно) [12–14]. В связи с этим международными стандартами CLSI2, EUCAST3 и российскими рекомендациями4 для определения значений МПК тигециклина с помощью метода микроразведений в бульоне рекомендовано использовать только свежеприготовленный МХБ.
Нестабильность тигециклина в водных растворах связана с его химическим строением, т. к. он может быть подвержен двум химических процессам, приводящим к образованию фармакологически неактивных продуктов. С одной стороны, фенольная группа тигециклина делает его чувствительным к окислению, особенно при значениях рН, превышающих значение 7,0, с другой стороны, при более низком значении pH тигециклин более подвержен неферментативной эпимеризации5.
Для терапевтических целей тигециклин выпускается в виде лиофилизированного порошка6, содержащего вспомогательные вещества в виде лактозы для стабилизации препарата против эпимеризации, и соляную кислоту или гидроксида натрия для регулирования рН в диапазоне 4,5–5,5 и для предотвращения окисления [10, 15].
Поскольку pH МХБ со временем не изменяется, причину расхождений в результатах МПК связывают с ускорением окислительного разложения тигециклина, вызванного увеличением количества растворённого кислорода в МХБ во время хранения. Для стабилизации тигециклина исследованы различные антиоксидантные добавки в МХБ: аскорбиновая кислота, пируват натрия, тиогликолят натрия, L-цистеин, каталаза, а также анаэробные условия хранения МХБ [12, 15, 16]. Добавление аскорбиновой кислоты и пирувата в концентрациях 0,3 и 6% соответственно способствовало стабилизации тигециклина до 7 дней. Однако в исследовании [16] показано, что аскорбиновая кислота вызывает быструю деградацию тигециклина и приводит к потере антибактериальной активности. В ряде публикаций исследована возможность использования оксиразы — фермента, способствующего снижению концентрации кислорода в МХБ [12, 14, 16]. Результаты исследований показали сохранение активности тигециклина в 2% растворе оксиразы вплоть до 7 сут при 4–6°С.
В исследовании [12] описано применение замораживания при –20°C МХБ, содержащего тигециклин и разлитого в 96-луночные планшеты. Тестирование чувствительности тест-штаммов после размораживания показало, что активность антибиотика сохранялась до 6 нед, и результаты тестирования совпадали с данными, полученными со свежеприготовленным МХБ.
Анализ публикаций показал, что в исследованиях все манипуляции (антиоксидантные добавки, хранение в замороженном состоянии, в анаэробных условиях) проводили с МХБ, поэтому представляется важным изучение возможности хранения именно водных растворов антибиотика.
В соответствии с требованиями ГОСТ Р ИСО 20776-1-20227, который регламентирует процедуру выполнения метода микроразведений в бульоне, для тестирования используют базовые (основные) растворы антибиотиков, часть объёма которых, как правило, остаётся недоиспользованной. Требованиями ГОСТ Р ИСО 20776-1-2022 разрешено хранение стабильных растворов антибиотиков, а хранение нестабильных, к которым относятся водные растворы тигециклина, никак не регламентируется. Только уточняется, что если нет информации о стабильности растворов при определённых условиях хранения, то свежий базовый (основной) раствор следует готовить для каждой исследуемой партии.
Цель исследования — определить возможность стабилизации и рационального использования растворов тигециклина для получения допустимых значений МПК при тестировании контрольных штаммов референтным методом.
Материалы и методы
В работе использовали химические субстанции тигециклина («Sigma») и оксиразы («Sigma»). Определение значений МПК тигециклина для контрольных (тест-штаммов) E. соli АТСС 25922, S. aureus АТСС 29213, E. faecalis ATCC 29212, Streptococcus pneumoniae ATCC 49619 проводили методом микроразведений в МХБ (ГНЦ ПМБ), который заранее готовили и хранили 24–48 ч до исследования при комнатной температуре. При работе с тест-штаммом S. pneumoniae ATCC 49619 в бульон добавляли 5% лизированной лошадиной крови и 20 мг/л β-NAD («Sigma»). Все использованные в работе штаммы получены в лиофилизированном виде из Государственной коллекции патогенных микроорганизмов ГКПМ-Оболенск.
Лизированную лошадиную кровь готовили из дефибринированной («ЭКОлаб»). Для этого в дефибринированную лошадиную кровь добавляли стерильную деионизированную воду в соотношении 1 : 1, помещали в морозильную камеру на 7–8 ч при –20°C. Затем размороженную при комнатной температуре кровь повторно подвергали замораживанию–оттаиванию, повторяя данный цикл 4 раза до полного лизиса кровяных клеток. После этого лизированную лошадиную кровь осветляли центрифугированием при 7000 об/с в течение 30 мин на центрифуге «Eppendorf Centrifuge 5702» («Eppendorf»).
Тестирование проводили в соответствии с требованиями ГОСТ Р ИСО 20776-1-2022 в 3 повторностях. Для этого готовили базовый (основной) раствор тигециклина с концентрацией 512 мг/л в воде и в воде с добавлением различных концентраций оксиразы (2,0, 3,0, 5,0 и 8,0%), хранили при 2–6°С в бытовом холодильнике и при –70°С в низкотемпературном кельвинаторе «MDF-U33V» («Sanyo»). Через каждый час отдельные аликвоты раствора вынимали из камеры хранения, размораживали при комнатной температуре в течение 20–30 мин, готовили рабочие (двукратные) разведения в дистиллированной воде в диапазоне концентраций 0,016–1,000 мг/л и заполняли ими 96-луночный планшет.
Инокуляты всех тест-штаммов готовили в физиологическом растворе с концентрацией 1–2 × 108 КОЕ/мл и по 0,1 мл добавляли в 9,9 мл МХБ с двойной концентрацией. Инокуляты в МХБ вносили в соотношении 1 : 1 в подготовленные планшеты, которые инкубировали при 35 ± 1°C в течение 18 ± 2 ч, планшеты с S. pneumoniae ATCC 49619 — в атмосфере 4–6% СО2. Учёт результатов проводили по методологии EUCAST.
Результаты обрабатывали при помощи пакета программ «MS Excel». Достоверность различных средних величин оценивали с использованием t-критерия Стьюдента. Для сравнительного анализа использовали двусторонний критерий Фишера. Различия считали значимыми при p < 0,05.
Результаты
МПК тигециклина для всех тест-штаммов при использовании базовых растворов, хранившихся при 2–6°С до 3 ч, соответствовали целевым значениям, а при дальнейшем хранении до 5 ч — входили в допустимый интервал (табл. 1). Далее с увеличением времени хранения значения МПК превышали допустимый интервал.
Таблица 1. Влияние времени хранения при 2–6°С базового раствора тигециклина на величину МПК, мг/л
Время хранения базового (основного) раствора тигециклина | E. соli АТСС 25922 | S. aureus АТСС 29213 | E. faecalis ATCC 29212 | S. pneumoniae ATCC 49619 |
0 ч (контроль) | 0,06–0,12 | 0,06–0,12 | 0,03–0,06 | 0,03–0,06 |
1–2 ч | 0,06–0,12 | 0,06–0,12 | 0,03–0,06 | 0,03–0,06 |
3 ч | 0,06–0,12 | 0,06–0,12 | 0,03–0,06 | 0,03–0,06 |
4 ч | 0,12–0,25 | 0,12–0,25 | 0,03–0,12 | 0,06–0,12 |
5 ч | 0,12–0,25 | 0,12–0,25 | 0,06–0,12 | 0,06–0,12 |
6 ч | 0,5–1,0 | 0,5–1,0 | 0,5–1,0 | 0,5–1,0 |
7 ч | 0,5–1,0 | 0,5–1,0 | 0,5–1,0 | 0,5–1,0 |
8–10 ч | ≥ 1,0 | ≥ 1,0 | ≥ 1,0 | ≥ 1,0 |
Допустимый интервал, мг/л | 0,03–0,25 | 0,03–0,25 | 0,03–0,12 | 0,016–0,12 |
Целевые значения, мг/л | 0,06–0,12 | 0,06–0,12 | 0,06 | 0,03–0,06 |
Величина МПК тигециклина для всех тест-штаммов при использовании базовых растворов антибиотика, хранившихся при –70°С до 31 сут, соответствовала целевым значениям, при дальнейшем хранении до 43 сут — входила в допустимые интервалы (табл. 2). Более длительное хранение (≥ 44 сут) приводило к получению значений МПК для всех 4 тест-штаммов, превышающих допустимые диапазоны.
Таблица 2. Влияние времени хранения при –70°С базовых растворов тигециклина на значение МПК, мг/л
Время хранения растворов тигециклина, сут | E. соli АТСС 25922 | S. aureus АТСС 29213 | E. faecalis ATCC 29212 | S. pneumoniae ATCC 49619 |
1–18 | 0,06–0,12 | 0,06–0,12 | 0,03–0,06 | 0,03–0,06 |
19–31 | 0,06–0,12 | 0,06–0,12 | 0,03–0,06 | 0,03–0,06 |
32–43 | 0,12–0,25 | 0,12–0,25 | 0,06–0,12 | 0,06–0,12 |
44–56 | 0,5–1,0 | 0,5–1,0 | 0,25–0,50 | 0,25–0,50 |
57–68 | 0,5–1,0 | 0,5–1,0 | 0,25–0,50 | 0,25–0,50 |
69–80 | 0,5–1,0 | 0,5–1,0 | 0,5–1,0 | 0,5–1,0 |
≥ 81 | ≥ 1,0 | ≥ 1,0 | ≥ 1,0 | ≥ 1,0 |
Допустимый интервал, мг/л | 0,03–0,25 | 0,03–0,25 | 0,03–0,12 | 0,016–0,120 |
Целевые значения, мг/л | 0,06–0,12 | 0,06–0,12 | 0,06 | 0,03–0,06 |
Результаты, полученные на первом этапе исследования, показали, что активность базовых растворов тигециклина сохранялась более длительное время при –70°С (до 43 сут), чем при 2–6°С (не более 5 ч), что обеспечивало получение МПК тигециклина для всех тест-штаммов в допустимых интервалах значений.
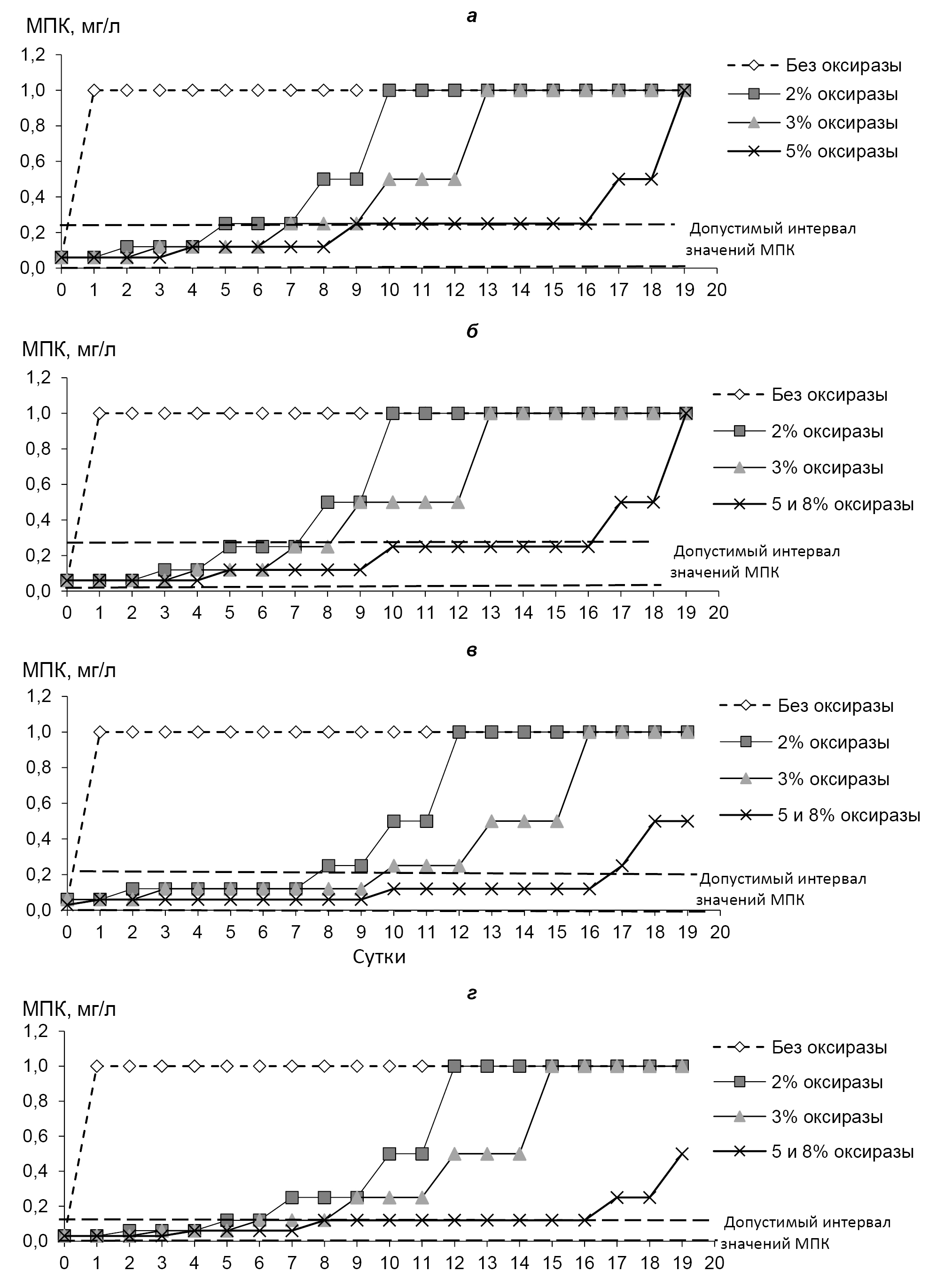
Второй этап исследования посвящен изучению влияния добавки оксиразы на величину МПК тигециклина для 4 тест-штаммов. Увеличение концентрации оксиразы способствовало более длительному хранению базовых растворов тигециклина при –2–6°С по сравнению с растворами без стабилизатора, т. к. полученные значения МПК для исследованных тест-штаммов соответствовали допустимым значениям более длительное время (рисунок, табл. 3). Добавление оксиразы в концентрациях 5 и 8% к базовому раствору тигециклина увеличивало время его хранения при 2–6°С с 4–5 ч до 16 сут и обеспечивало получение допустимых значений МПК для 4 тест-штаммов.
Зависимость значений МПК тигециклина для E. coli ATCC 25922 (а), S. aureus ATCC 29213 (б), E. faecalis ATCC 29212 (в) и S. pneumoniae ATCC 49619 (г) от концентрации оксиразы, добавленной в базовые растворы антибиотика, и сроков их хранения при 2–6°С.
Таблица 3. Сроки хранения при 2–6°С базовых растворов тигециклина при различных концентрациях оксиразы, обеспечивающие получение допустимых значений МПК, сут
Тест-штаммы | Без оксиразы | Концентрация оксиразы, % | |||
2 | 3 | 5 | 8 | ||
E. соli АТСС 25922 | 5 ч | 7 | 9 | 16 | 16 |
S. aureus АТСС 29213 | 5 ч | 7 | 8 | 16 | 16 |
E. faecalis ATCC 29212 | 4 ч | 7 | 9 | 16 | 16 |
S. pneumoniae ATCC 49619 | 5 ч | 6 | 8 | 16 | 16 |
Результаты измерений МПК тигециклина для тест-штаммов, полученные с помощью стабилизированных оксиразой базовых растворов антибиотика в процессе хранения при –70°С, приведены в табл. 4. Для удобства результаты МПК представлены в условных единицах: средние значения МПК из 3 измерений, входящие в допустимый интервал, обозначали «С» (Correct); средние значения из 3 измерений, превышающие допустимый интервал, обозначали «HE» (High error).
Таблица 4. Зависимость условных значений МПК тигециклина для тест-штаммов от концентрации оксиразы в базовых растворах антибиотика и сроков их хранения при –70°С
Срок хранения базовых растворов, нед | E. соli АТСС 25922 | S. aureus АТСС 29213 | E. faecalis ATCC 29212 | S. pneumoniae ATCC 49619 | ||||||||||||
2% | 3% | 5% | 8% | 2% | 3% | 5% | 8% | 2% | 3% | 5% | 8% | 2% | 3% | 5% | 8% | |
0 | C | C | C | C | C | C | C | C | C | C | C | C | C | C | C | C |
12 | C | C | C | C | C | C | C | C | C | C | C | C | C | C | C | C |
18 | C | C | C | C | C | C | C | C | C | C | C | C | C | C | C | C |
28 | HE | C | C | C | HE | C | C | C | HE | C | C | C | HE | C | C | C |
48 | HE | HE | C | C | HE | HE | C | C | HE | HE | C | C | HE | HE | C | C |
Как видно из табл. 4, использование оксиразы в качестве стабилизатора базовых растворов тигециклина показало, что стабильность данных растворов сохраняется до 18 нед при добавлении 2% оксиразы, до 28 нед при добавлении 3% оксиразы, до 48 нед при добавлении 5 или 8% оксиразы и приводит к получению значений МПК тигециклина для всех исследованных тест-штаммов, соответствующих допустимым величинам (С).
Обсуждение
В настоящее время тигециклин является препаратом выбора при лечении многих тяжёлых инфекций, вызванных микроорганизмами с множественной лекарственной устойчивостью. Из-за своей антибактериальной активности широкого спектра действия тигециклин часто применяют эмпирически, что приводит к появлению устойчивых к нему бактерий [17].
Поэтому лечение инфекционных болезней, в том числе тигециклином, целесообразно проводить на основе результатов идентификации возбудителя и определения чувствительности к антимикробным препаратам.
Определение чувствительности к тигециклину методом микроразведений в бульоне сопряжено с проблемой, связанной с его нестабильностью в водных растворах. Для получения достоверных результатов тестирования стандартами CLSI и EUCAST предложено использовать свежеприготовленный МХБ.
В данном исследовании изучено влияние различных способов стабилизации базовых водных растворов тигециклина: с помощью изменения температуры хранения и использования стабилизатора оксиразы в различных концентрациях для 4 тест-штаммов, включая тест-штамм со сложными питательными потребностями — S. pneumoniae ATCC 49619.
В ходе исследования использован заранее приготовленный МХБ и хранившийся в течение 24–48 ч. Определено, что при 2–6°С стабильность базовых растворов тигециклина без оксиразы сохраняется не более 5 ч, а с 5 и 8% оксиразы увеличивается до 16 сут. При хранении данных растворов без оксиразы при –70°С их стабильность увеличивается до 43 сут, а с добавлением 5 и 8% оксиразы — минимум до 48 нед. Полученные результаты коррелируются с опубликованными данными [12, 14, 16], в которых показано, что активность тигециклина в МХБ сохраняется до 6 нед (42 сут) при –17–18°С, а при 4–6°С с добавлением 2% растворов оксиразы — до 7 сут (табл. 3).
В ряде публикаций авторы отмечают, что оксираза и химически чистая субстанция тигециклина — достаточно дорогостоящие продукты [12–14]. Проведённые нами расчёты затрат показали, что из 5 мг химически чистой субстанции тигециклина (по цене в среднем 45 000 руб./5 мг) можно приготовить более 200 планшетов с рабочим диапазоном концентраций тигециклина (0,06–4,00) мг/л. При этом затраты на приготовление одного планшета составят около 270 руб. (с учётом стоимости самого планшета)8. Метод микроразведений в бульоне является трудоёмким процессом, поэтому не каждая бактериологическая лаборатория может использовать за один опыт такое количество планшетов. Неиспользованный базовый раствор тигециклина можно разлить по аликвотам в криопробирки и хранить при отрицательных температурах до следующего использования, а дополнительное введение оксиразы позволит еще увеличить время хранения и возможность использования хранившегося 24–48 ч МХБ. Стоимость того же количества планшетов с добавлением 5% оксиразы увеличивается незначительно (в среднем на 7–10%).
Заключение
Определена возможность стабилизации растворов тигециклина, хранившихся при отрицательных температурах (с добавлением оксиразы и без неё), для получения допустимых значений МПК при определении чувствительности контрольных штаммов к антимикробным препаратам. Применение данных растворов позволило снизить затраты на тестирование за счет рационального использования антибиотика. В дальнейшем будут продолжены работы по изучению возможности использования данных растворов тигециклина при тестировании клинических штаммов.
1 WHO. Critically important antimicrobials for human medicine (6th revision ed.) URL: https://www.who.int/publications/i/item/9789241515528 (дата обращения: 03.03.2025).
2 Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Thirty-third Informational Supplement. CLSI document M100, 33rd Edition. USA; 2022. 402 p.
3 European Committee for Antimicrobial Susceptibility Testing (EUCAST). Breakpoint tables for interpretation of MICs and zone diameters (Version 15.0). URL.: https://www.eucast.org/fileadmin/src/media/PDFs/EUCAST_files/Breakpoint_tables/v_15.0_Breakpoint_Tables.pdf (дата обращения: 12.03.2025).
4 Российские рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам» (версия 2024-02). URL: https://www.antibiotic.ru/files/334/ocmap2024.pdf
5 Fawzi M.B., Zhu T., Shah S.M. Tigecycline compositions and methods of preparation (patent). United States US-8975242-B2. 2011. URL.: https://patentimages.storage.googleapis.com/c2/25/07/73a12f6c15cdfa/US8975242.pdf (дата обращения: 07.03.2025).
6 Справочник лекарственных средств. Тигацил. Инструкция по применению. 2024. URL: https://www.vidal.ru/drugs/tigacil__23094 (дата обращения 12.03.2025).
7 ГОСТ Р ИСО 20776-1-2022 Исследование чувствительности инфекционных агентов и оценка функциональных характеристик изделий для исследования чувствительности к антимикробным средствам. Часть 1. Референтный метод микроразведений в бульоне для лабораторного исследования активности антимикробных агентов по отношению к быстрорастущим аэробным бактериям, вызывающим инфекционные заболевания. 2022, 20 с.
8 Merck — электронный каталог химических веществ, реагентов, расходных материалов для научных исследований и промышленности. URL: https://www.sigmaaldrich.com/RU/en/search/pz0021-5mg?focus=products&page=1&perpage=30&sort=relevance&term=PZ0021-5MG&type=product (дата обращения: 10.03.2025).
Об авторах
Ирина Сергеевна Косилова
Государственный научный центр прикладной микробиологии и биотехнологии
Автор, ответственный за переписку.
Email: kosilova.irina@gmail.com
ORCID iD: 0000-0003-4020-0894
канд. биол. наук, c. н. с. лаб. разработки питательных сред
Россия, Оболенск, Московская областьЛюбовь Викторовна Домотенко
Государственный научный центр прикладной микробиологии и биотехнологии
Email: domotenko@obolensk.org
ORCID iD: 0000-0002-4785-6418
канд. хим. наук, в. н. с. лаб. разработки питательных сред
Россия, Оболенск, Московская областьМихаил Владимирович Храмов
Государственный научный центр прикладной микробиологии и биотехнологии
Email: khramov@obolensk.org
ORCID iD: 0000-0002-4553-3826
канд. мед. наук, зам. директора по качеству и развитию
Россия, Оболенск, Московская областьСписок литературы
- Laxminarayan R., Sridhar D., Blaser M., et al. Achieving global targets for antimicrobial resistance. Science. 2016; 353(6302): 874–9. DOI: https://doi.org/10.1126/science.aaf9286
- Karageorgopoulos D.E., Falagas M.E. Current control and treatment of multidrug-resistant Acinetobacter baumannii infections. Lancet Infect. Dis. 2008;8(12):751–62. DOI: https://doi.org/10.1016/s1473-3099(08)70279-2
- Rodríguez-Baño J., Gutiérrez-Gutiérrez B., Machuca I., et al. Treatment of infections caused by extended-spectrum-beta-lactamase-, AmpC-, and carbapenemase-producing Enterobacteriaceae. Clin. Microbiol. Rev. 2018;31(2):e00079-17. DOI: https://doi.org/10.1128/cmr.00079-17
- IACG Discussion Paper. Interagency Coordination Group on Antimicrobial Resistance. Reduce unintentional exposure and the need for antimicrobials, and optimize their use;2018.
- Шедько Е.Д., Тимошина О.Ю., Азизов И.С. Молекулярная эпидемиология генов группы mcr. Клиническая микробиология и антимикробная химиотерапия. 2020;22(4): 287–300. Shedko E.D., Timoshina O.Yu., Azizov I.S. Molecular epidemiology of mcr group genes. Clinical Microbiology and Antimicrobial Chemotherapy. 2020;22(4):287–300. DOI: https://doi.org/10.36488/cmac.2020.4.287-300 EDN: https://elibrary.ru/ycsxgu
- Partridge S.R., Pilato V.D., Doi Y., et al. Proposal for assignment of allele numbers for mobile colistin resistance (mcr) genes. J. Antimicrob. Chemother. 2018;73(10):2625–30. DOI: https://doi.org/10.1093/jac/dky262
- Cheng Y., Li Y., Yu R., et al. Identification of novel tet(X3) variants resistant to tigecycline in Acinetobacter species. Microbiol. Spectr. 2022;10(6):e0133322. DOI: https://doi.org/10.1128/spectrum.01333-22
- Tasina E., Haidich A.B., Kokkali S., et al. Efficacy and safety of tigecycline for the treatment of infectious diseases: a meta-analysis. Lancet Infect. Dis. 2011;11(11): 834–44. DOI: https://doi.org/10.1016/s1473-3099(11)70177-3
- Korczak L., Majewski P., Iwaniuk D., et al. Molecular mechanisms of tigecycline-resistance among Enterobacterales. Front. Cell. Infect. Microbiol. 2024;14:1289396. DOI: https://doi.org/10.3389/fcimb.2024.1289396
- He T., Wang R., Liu D., et al. Emergence of plasmid-mediated high-level tigecycline resistance genes in animals and humans. Nat. Microbiol. 2019;4(9):1450–6. DOI: https://doi.org/10.1038/s41564-019-0445-2
- Liu C., Liu J., Lu Q., et al. The mechanism of tigecycline resistance in Acinetobacter baumannii under sub-minimal inhibitory concentrations of tigecycline. Int. J. Mol. Sci. 2024;25(3):1819. DOI: https://doi.org/10.3390/ijms25031819
- Bradford P.A., Petersen P.J., Young M., et al. Tigecycline MIC testing by broth dilution requires use of fresh medium or addition of the biocatalytic oxygen-reducing reagent Oxyrase to standardize the test method. Antimicrob. Agents Chemother. 2005;49(9):3903–9. DOI: https://doi.org/10.1128/aac.49.9.3903-3909.2005
- Brown S.D., Traczewski M.M. Comparative in vitro antimicrobial activity of tigecycline, a new glycylcycline compound, in freshly prepared medium and quality control. J. Clin. Microbiol. 2007;45(7):2173–9. DOI: https://doi.org/10.1128/jcm.02351-06
- Petersen P.J., Bradford P.A. Effect of medium age and supplementation with the biocatalytic oxygen-reducing reagent Oxyrase on in vitro activities of tigecycline against recent clinical isolates. Antimicrob. Agents Chemother. 2005;49(9):3910–8. DOI: https://doi.org/10.1128/aac.49.9.3910-3918.2005
- Jitkova Y., Gronda M., Hurren R., et al. A novel formulation of tigecycline has enhanced stability and sustained antibacterial and antileukemic activity. PLoS One. 2014;9(5):e95281. DOI: https://doi.org/10.1371/journal.pone.0095281
- Amann L.F., Vicente E.R., Rathke M., et al. Stability studies with tigecycline in bacterial growth medium and impact of stabilizing agents. Eur. J. Clin. Microbiol. Infect. Dis. 2021;40(1):215–8. DOI: https://doi.org/10.1007/s10096-020-03970-0
- Zhou H., Sun X., Lyu S., et al. Evaluation of tigecycline utilization and trends in antibacterial resistance from 2018 to 2021 in a comprehensive teaching hospital in China. Infect. Drug Resist. 2023;16:879–89. DOI: https://doi.org/10.2147/idr.s395158
Дополнительные файлы