Использование метода нейтрализации псевдовирусов для поиска новых антивирусных препаратов
- Авторы: Карпенко Л.И.1, Рудометова Н.Б.1, Низоленко Л.Ф.1, Локтев В.Б.1
-
Учреждения:
- Государственный научный центр вирусологии и биотехнологии «Вектор»
- Выпуск: Том 102, № 4 (2025)
- Страницы: 482-494
- Раздел: ОБЗОРЫ
- URL: https://microbiol.crie.ru/jour/article/view/18814
- DOI: https://doi.org/10.36233/0372-9311-684
- EDN: https://elibrary.ru/VRKCFO
- ID: 18814
Цитировать
Аннотация
В последние годы в области разработки лекарственных препаратов достигнут большой прогресс, в частности, благодаря использованию методов компьютерного моделирования. Одним из ключевых этапов разработки новых антивирусных препаратов является проверка эффективности перспективных кандидатов в экспериментах in vitro с использованием вирусов-мишеней. Использование новых технологий для проведения первичного скрининга с применением псевдотипированных вирусов обеспечивает упрощение исследований, повышение их эффективности и соблюдение биобезопасности проводимых исследований.
Целью данной работы является анализ исследований, в которых продемонстрировано успешное использование псевдовирусной технологии для поиска новых химиопрепаратов против ряда РНК-содержащих вирусов.
При подготовке обзора был проведён анализ литературы, представленной в базах PubMed, Scopus, Elsevier, Google Scholar по состоянию на 01.03.2025. Для поиска использовали ключевые слова: pseudovirus, virus inhibition, antiviral drugs, RNA viruses, псевдовирус, ингибирование вируса, противовирусные препараты, РНК-содержащие вирусы.
Псевдотипированные вирусы представляют собой рекомбинантные вирусные частицы, которые имеют коровые белки одного вируса, а поверхностные белки — другого, исследуемого вируса. Достоинствами псевдовирусной технологии являются её безопасность, высокий уровень воспроизводимости результатов и возможность стандартизации. Система, основанная на лентивирусах, была разработана одной из первых и по-прежнему является одной из наиболее востребованных. С помощью псевдовирусов были отобраны и исследованы молекулы-кандидаты для инфекций, вызываемых РНК-содержащими вирусами, такими как ВИЧ-1, вирус гепатита С, вирус клещевого энцефалита, вирусы гриппа птиц, SARS-CoV-2. Большинство из отобранных препаратов действуют на начальном этапе проникновения вируса в клетку-мишень. Приведённые примеры иллюстрируют существенный вклад технологии псевдовирусов в борьбу с серьёзными социально значимыми заболеваниями, вызываемыми РНК-содержащими вирусами.
Ключевые слова
Полный текст
Введение
Поиск и разработка новых лекарственных препаратов для профилактики и лечения вирусных инфекций является одной из важнейших задач медицинской химии, биологии и медицины по причине широкого распространения различных социально опасных вирусных инфекций и в связи с постоянным появлением новых вирусных заболеваний [1, 2].
Прогресс в области разработки лекарственных препаратов в последние годы во многом стал возможен благодаря использованию методов компьютерного моделирования для предсказания структуры молекул мишеней и их взаимодействий с кандидатными лекарственными соединениями [3]. Присуждение Нобелевской премии в 2024 г. за развитие методов компьютерного дизайна белков и предсказания четвертичной структуры белков наглядно иллюстрирует значимость научных достижений в этой области знаний. За короткий срок с использованием программы AlphaFold2 были расшифрованы (предсказаны) более 200 млн структур белков с участием приблизительно 2 млн исследователей из 190 стран1. Последние достижения в области искусственного интеллекта также создают принципиально новые возможности для конструирования новых лекарственных препаратов на основе компьютерного дизайна кандидатных лекарственных соединений и белков-мишеней [3].
При этом отобранные с помощью компьютерных технологий перспективные кандидаты будущих антивирусных препаратов необходимо проверять в реальных экспериментах in vitro с последующим тестированием отобранных активных молекул in vivo. Среди социально значимых инфекционных заболеваний следует отметить инфекции, вызываемые различными вирусными агентами, такими как ВИЧ-1, гепатит С, различными патогенными ортофлавивирусами, вирусами гриппа, SARS-CoV-2 и многими другими опасными и особо опасными вирусами. Экспериментальная работа с этими патогенами требует особых условий для соблюдения строгих требований биобезопасности и отличается сложностью проведения лабораторных экспериментов, отсутствием простых и безопасных лабораторных методик для работы с инфекционными агентами, невозможностью культивирования целого ряда вирусов в лаборатории, что затрудняет проведение экспериментов или даже делает их невозможными. Принципиально важной альтернативой для первичного скрининга является использование псевдотипированных вирусов [4]. Использование псевдовирусов с ограниченной репликацией, несущих белки вирусной оболочки, представляет собой безопасный и полезный метод, широко применяемый вирусологами для изучения, поиска и создания новых антивирусных химиопрепаратов.
Цель обзора — изучить исследования, в которых продемонстрировано успешное использование псевдовирусной технологии для поиска новых химиопрепаратов против ряда РНК-содержащих вирусов.
При подготовке обзора был проведён анализ литературы, представленной в научных базах PubMed, Scopus, Elsevier, Google Scholar по состоянию на 01.03.2025. Для поиска использовали ключевые слова: pseudovirus, virus inhibition, antiviral drugs, RNA viruses, псевдовирус, ингибирование вируса, противовирусные препараты, РНК-содержащие вирусы.
В научной электронной базе PubMed при поиске с использованием сочетания ключевых слов было найдено 293 источника, из них 228 — с полным текстом в открытом доступе. Подобным образом поиск был проведён также с помощью научных баз Scopus, Elsevier, Google Scholar, но для них дата публикации статьи была ограничена 2023–2024 гг. с целью не пропустить наиболее актуальные исследования. В целом в ходе поиска литературы в перечисленных базах данных на русском и английском языках, проводившегося с учётом таких критериев отбора, как год издания и доступность публикаций к прочтению, было проанализировано около 1700 источников, соответствующих тематике. В связи с ограничением по объёму статьи для исследования было отобрано 68 источников.
Псевдовирусы
Псевдовирусы — это искусственно созданные вирусы с дефектным геномом, которые, благодаря аналогичным конформационным структурам поверхностных гликопротеинов, способны проникать в восприимчивые клетки так же, как это делают природные вирусы [5–7]. В отличие от вирусов, псевдовирусы могут реплицироваться, как правило, только в течение одного цикла репликации [7, 8]. Ограничение репликации делает проведение экспериментов с ними безопасным и обеспечивает новые возможности для исследования высокопатогенных РНК-содержащих вирусов. Важно отметить, что использование псевдовирусов позволяет проводить исследования даже в случае, когда природные вирусы невозможно или очень сложно культивировать в лабораторных условиях [9].
Ещё раз подчеркнём, что, в отличие от инфекционных вирусов, работа с псевдовирусами безопасна, поскольку в кодирующие области генома внесены изменения (мутации), ограничивающие развитие вируса только одним циклом размножения, поэтому псевдовирусы нередко называют «вирусами одного цикла инфекции». Как правило, псевдотипированные вирусы несут маркерные гены (например, люциферазу или gfp), что позволяет проводить более лёгкую и точную количественную оценку при экспериментах с ними.
Таким образом, достоинствами псевдовирусной технологии являются безопасность, высокий уровень воспроизводимости результатов, возможности стандартизации и получения новых вариантов псевдовирусов для дальнейшего развития исследований. Это предопределяет широкое использование исследователями данной технологии для изучения особенностей проникновения вирусов в клетки-мишени, определения наличия вируснейтрализующих антител, поиска и разработки новых антивирусных препаратов.
Некоторые особенности конструирования псевдовирусов
Наиболее часто псевдовирусы разделяются на три основных типа: с лентивирусным геномом (ВИЧ-1), с геномом вируса везикулярного стоматита и с геномом вируса лейкемии мышей [10]. Система, основанная на лентивирусах, в частности Env-псевдовирусы ВИЧ-1, была разработана одной из первых для анализа иммунного ответа на вакцины против ВИЧ-1 и поиска противовирусных препаратов [11]. Она по-прежнему является одной из наиболее востребованных и часто используемой в исследованиях.
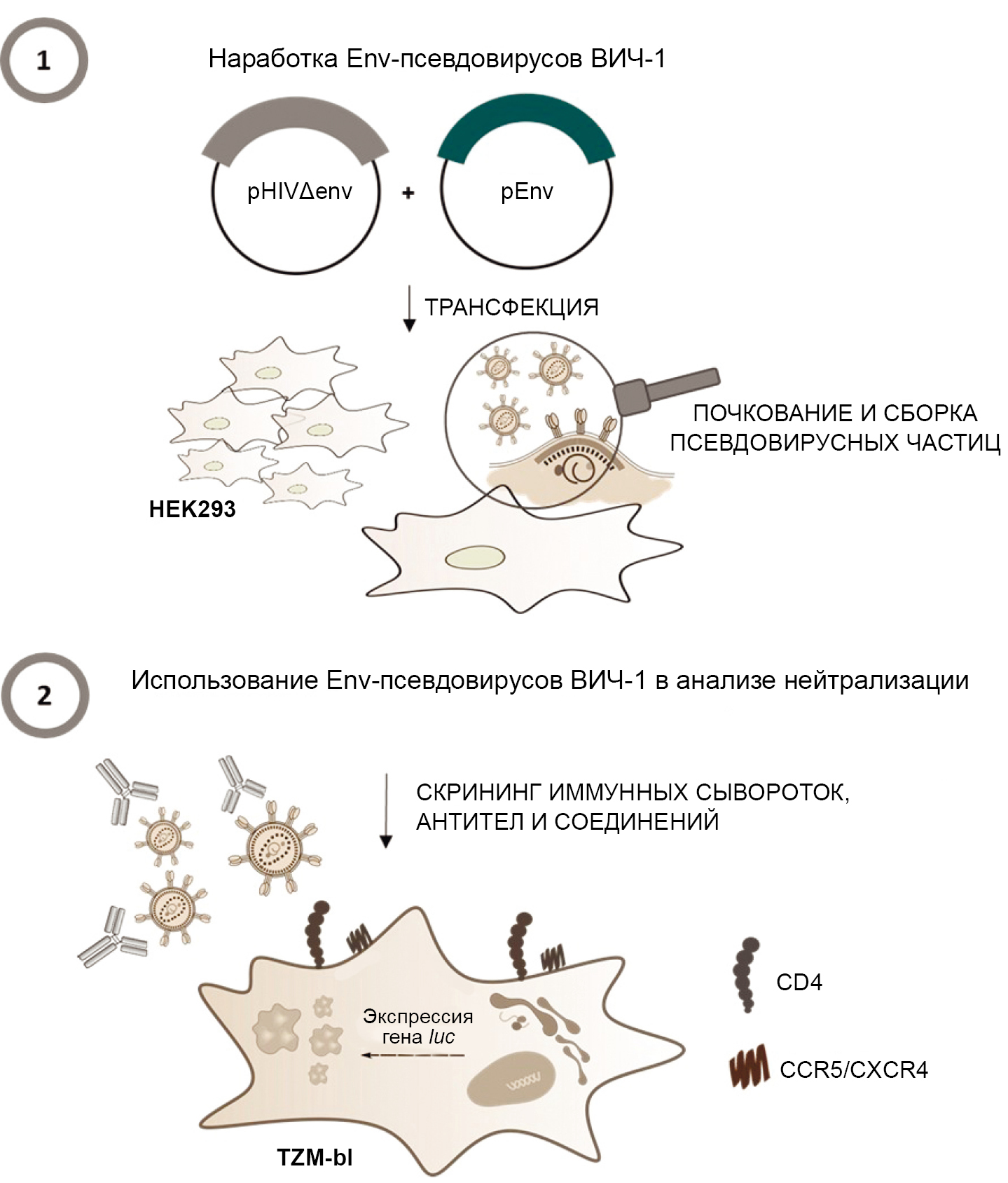
Env-псевдовирусы ВИЧ-1 представляют собой рекомбинантные вирусные частицы, которые получают путем трансфекции эукариотических клеток двумя плазмидами: коровой и оболочечной. Коровая плазмида содержит гены структурных, регуляторных и вспомогательных белков ВИЧ-1, необходимые для сборки вирусных частиц, а также последовательности, необходимые для упаковки вирусной РНК (Ψ); а оболочечная плазмида, в свою очередь, несет ген поверхностного гликопротеина (env) определённого подтипа ВИЧ-1. В результате трансфекции формируются вирусные частицы с дефектным геномом, не способным обеспечить сборку инфекционных дочерних вирионов при заражении [12, 13]. При работе с Env-псевдовирусами ВИЧ-1 используют генно-модифицированную клеточную линию TZM-bl, являющуюся производной клеточной линии HeLa и несущую на своей поверхности рецепторы CD4 и корецепторы CCR5 и CXCR4, которые ВИЧ-1 использует для проникновения в клетки-мишени. Важной особенностью клеточной линии TZM-bl является наличие интегрированных репортерных генов люциферазы светлячка и β-галактозидазы Escherichia coli под транскрипционным контролем длинного концевого повтора ВИЧ-1, белковые продукты которых используют для детекции проникновения Env-псевдовирусов ВИЧ-1 в клетки-мишени. Так, при проникновении псевдовируса в клетку-мишень TZM-bl в ответ на синтез вирусного белка Tat запускается экспрессия репортерных генов, которая, например, для гена люциферазы регистрируется с помощью люминометра. При этом высокая интенсивность люминесценции соответствует проникновению псевдовирусных частиц в клетки-мишени, а подавление люминесценции, наоборот, указывает на нейтрализацию Env-псевдовирусов ВИЧ-1 [14, 15]. На рисунке представлен общий принцип работы Env-псевдовирусов ВИЧ-1.
Заменяя ген env в лентивирусной системе на гены белков оболочки других вирусов, можно получать лентивирусные частицы, экспонирующие на поверхности соответствующие вирусные белки. С использованием этой технологии были получены псевдовирусы таких оболочечных РНК-вирусов, как вирусы гриппа [16], коронавирусы [3], ретровирусы [17], флавивирусы [18] и др., которые успешно применяются в исследованиях.
Общий принцип работы Env-псевдовирусов ВИЧ-1 ([4], с изменениями).
Практическая работа с Env-псевдовирусами ВИЧ-1 включает два основных этапа: 1-й этап — сборка вирусных частиц с помощью трансфекции клеточной линии HEK293 с использованием двух плазмид: коровой (pHIVΔenv) и оболочечной (pEnv); 2-й этап — анализ нейтрализации с использованием химиотерапевтических агентов с целью определения их способности блокировать проникновение псевдовирусов в клетку-мишень.
Псевдовирусная платформа в равной степени может быть также полезна для изучения проникновения в клетки вирусов, которые быстро накапливают мутации в результате адаптации в культуре из-за отсутствия селекционного давления, такого как иммунные реакции хозяина, существующего in vivo. Например, исследования in vitro с использованием живого ВИЧ-1 привели к тому, что из-за подверженной ошибкам природы обратной транскриптазы возникли мутации в гликопротеине Env, что обеспечило адаптацию к культуре тканей и привело к фенотипическим изменениям. В результате проникновение в клетки адаптированных к культуре штаммов ВИЧ-1 не соответствовало происходящему при естественной инфекции у людей и, таким образом, не давало клинически значимой модели [19].
Отметим, что, несмотря на перечисленные преимущества, система псевдовирусов имеет и ряд ограничений, которые следует иметь в виду при проведении любых исследований. Эта система в первую очередь предназначена для имитации процесса проникновения вирусного агента в клетку in vitro, однако процесс пролиферации и высвобождения вирусных частиц смоделирован быть не может. Распределение, конформация и плотность гетерологичных вирусных гликопротеинов на псевдовирусах не всегда могут отражать их «естественное» состояние на поверхности нативных вирусных частиц [13].
Поэтому результаты анализов с использованием псевдотипированных вирусов не всегда могут совпадать с данными, полученными с помощью анализа нативных вирусов [13]. Наконец, использование псевдовирусов эффективно при изучении оболочечных вирусов. Для таких вирусов, как, например, ротавирус и полиовирус, система псевдовирусов функционирует неудовлетворительно [7]. Для решения последней проблемы была разработана самоорганизующаяся псевдовирусная система, но здесь она рассматриваться не будет.
В данном обзоре будет проведён анализ и обобщение результатов использования технологии псевдовирусов для поиска препаратов против ВИЧ-1, ортофлавивирусов и вирусов гриппа птиц.
Псевдовирусы и противовирусные препараты
Антивирусные препараты, ингибирующие проникновение ВИЧ (Riboviria, Pararnavirae, Artverviricota, Revtraviricetes, Ortervirales, Retroviridae, Orthoretrovirinae, Lentivirus)
В настоящее время основой терапии пациентов с ВИЧ-инфекцией является антиретровирусная терапия — комбинация нескольких противовирусных препаратов, которые подавляют размножение вируса, воздействуя на разные этапы его жизнедеятельности, тем самым сохраняя иммунологические функции организма и снижая риск передачи вируса [20]. Однако распространение резистентности ВИЧ к антиретровирусным препаратам снижает эффективность лечения и увеличивает смертность от ВИЧ/СПИДа [21].
Нацеливание на начальный этап проникновения вируса в клетку-мишень даёт ряд преимуществ по сравнению с другими этапами жизненного цикла ВИЧ-1 [22]. Во-первых, генетический материал вируса не может интегрироваться в геном клетки хозяина. Во-вторых, ингибиторам проникновения не нужно преодолевать мембрану клетки, в отличие от ингибиторов обратной транскриптазы, интегразы или протеазы. В-третьих, поскольку проникновение вируса состоит из отдельных этапов, существует несколько мишеней для ингибиторов проникновения, что является гарантией от перекрёстной резистентности [23].
Важным моментом для поиска таких препаратов является то, что ВИЧ-1 для проникновения в клетку требуются корецепторы, и это увеличивает список мишеней для противовирусных препаратов [24]. Среди первых эффективных ингибиторов проникновения ВИЧ-1 был препарат маравирок [25]. Препарат связывается с CCR5, тем самым блокируя последующие этапы слияния вирусной и клеточной мембран и, следовательно, проникновение вируса в клетки-мишени. В этом случае ВИЧ-1 не может проникнуть в человеческие макрофаги и T-лимфоциты. Однако маравирок может вызывать серьёзные, опасные для жизни побочные эффекты. Этот факт ещё раз подчёркивает необходимость разработки новых ингибиторов проникновения ВИЧ-1.
Технология псевдовирусов широко используется для изучения препаратов, блокирующих связывание вируса с мембранными рецепторами и его проникновение внутрь клеток-мишеней. Перечень таких препаратов приведён в табл. 1.
Таблица 1. Антивирусные препараты против ВИЧ-1, полученные и/или исследованные с использованием псевдовирусной технологии
Вещество | Механизм действия | Источник |
Липопептиды на основе T20 (энфувиртида) | Ингибитор слияния | [27] |
HNG-105 — модификация линейного пептида 12p1 (RINNIPWSEAMM) | Ингибирование gp120 путём взаимодействия с сайтом, отличным от сайта связывания CD4 или корецептора, что приводит к резкому снижению сродства gp120 к любому из его рецепторов | [28] |
РНК аптамеры | Связывание с гликопротеинами gp120 или gp41 и другими молекулами вирусной поверхности | [29] |
ДНК-триплексы с гидрофобными модификациями | Взаимодействие с первичным карманом в повторе N-гептады гликопротеина 41 (gp41) | [30] |
Тиолированные производные пиримидина | Избирательное ингибирование, зависящее от предпочтения корецептора псевдовируса | [31] |
Малые молекулы NBD-14009 и NBD-14010 аналоги N-фенил-N'-(2,2,6,6-тетраметил-пиперидин-4-ил)-оксаламида | Ингибирование слияния клеток и передачи ВИЧ-1 от клетки к клетке I | [32] |
Метилгаллат из съедобного гриба Pholiota adiposa | Ингибирование репликации ВИЧ-1 в клетках TZM-BL, инфицированных псевдовирусом, блокирущее как процесс проникновения вируса, так и активность ключевых ферментов, необходимых для его жизненного цикла | [36] |
DAVEI — рекомбинантная пептидная химера лектина циановирина-N (CVN) и gp41 ВИЧ-1 | Связывание gp120 и gp41 | [40] |
Катехин из Peltophorum africanum | Не описан | [37] |
Метаноловый экстракт корня Elaeodendron transvaalense | Не описан | [37] |
Перколяционный экстракт Spatholobus suberectus Dunn | Взаимодействие с гликопротеином оболочки вируса gp160 | [38] |
Глицивир — смесь производных никотиновой и глицирризиновой кислот | Препятствует проникновению вируса в целевую клетку | [34] |
Энфувиртид (T20), который довольно долгое время оставался единственным ингибитором слияния вирусов, используемым в комбинированной терапии ВИЧ-инфекции, является пептидным препаратом, но он имеет относительно низкую противовирусную активность и легко вызывает лекарственную устойчивость. Активность липопептидных ингибиторов, разработанных на основе T20, значительно выше. Их разработке, анализу структуры, функции и сравнению активности в подавлении проникновения ВИЧ-1 и псевдовируса в клетки посвящена работа [26].
Ещё одним примером может служить искусственный пептид HNG-105, созданный путём клик-конъюгации линейного пептида 12p1 (RINNIPWSEAMM). HNG-105 изучили с помощью спектроскопии поверхностного плазмонного резонанса и анализов ингибирования псевдовируса. Результаты показывают, что молекула HNG-105 может быть эффективна в отношении подтипов ВИЧ-1, и подчёркивают её потенциал в качестве лидера для разработки терапевтических и микробицидных агентов, помогающих бороться с распространением СПИДа [27].
Ингибиторы проникновения ВИЧ разрабатывались также на основе нуклеиновых кислот. Так, были выделены и изучены 23 клона РНК-аптамеров против псевдотипированного вируса HIV-1CAP45, который относится к вирусам подтипа C, эндемичным в странах Африки к югу от Сахары и ответственным за большинство случаев заражения ВИЧ-1 в мире. Аптамеры ингибировали заражение целевых клеток, связываясь как с разными молекулами гликопротеинов (gp120 или gp41), так и с другими молекулами вирусной поверхности, необходимыми для инфицирования. Таким образом, они могут использоваться в качестве аналитических инструментов для исследования механизмов проникновения ВИЧ-1 и в качестве ингибиторов этого процесса [28]. Другую категорию ингибиторов ВИЧ-1 могут представлять комплексы на основе ДНК-триплексов с гидрофобными модификациями, взаимодействующие с первичным карманом в повторе N-гептады гликопротеина 41 (gp41). С использованием Env-псевдовирусов продемонстрировано, что триплексы являются ингибиторами слияния вируса с клетками [29].
В качестве потенциальных ингибиторов проникновения ВИЧ-1 были исследованы и искусственные химические соединения. Были синтезированы тиолированные производные пиримидина и количественно определён их антиретровирусный эффект против вируса иммунодефицита человека типа 1 (ВИЧ-1IIIB) и химерных псевдовирионов ВИЧ-1 в анализах вирусной инфекционности, включая анализ ингибирования синцития, а также анализ вирусной инфекции одного цикла на клетках HeLaCD4-LTR/β-gal. Ингибирование было избирательным и зависело от предпочтения корецептора псевдовируса [30].
Путём целевого скрининга коммерческих библиотек в 2005 г. были выделены малые молекулы, аналоги N-фенил-N'-(2,2,6,6-тетраметил-пиперидин-4-ил)-оксаламида, как новый класс ингибиторов проникновения ВИЧ-1, которые блокировали взаимодействие gp120-CD4 [31]. Однако они имели ряд существенных недостатков. Следующее десятилетие данная группа учёных последовательно изучала и модифицировала эти вещества, и в конечном итоге были получены малые молекулы NBD-14009 и NBD-14010, протестированные против панели из 51 Env-псевдовирусов ВИЧ-1, представляющих различные подтипы клинических изолятов. Эти соединения имели противовирусную активность в наномолярном диапазоне (IC50 ≈ 150 нМ). Также они ингибировали слияние клеток и передачу ВИЧ-1 от клетки к клетке [32].
Особого внимания заслуживают работы, посвящённые природным соединениям, нацеленным на этап проникновения ВИЧ-1 в клетки-мишени. Препарат глицивир — многокомпонентная смесь, содержащая моно-, ди-, три- и тетраникотинаты глицирризиновой кислоты, проявил выраженную ингибирующую активность против псевдовирусов ВИЧ-1 подтипов B, A6 и рекомбинантной формы CRF63_02A (диапазон IC50 3,9–27,5 мкМ). Анализ ингибирующей активности глицивира в зависимости от времени его добавления к Env-псевдовирусам ВИЧ-1 и клеткам-TZM-bl позволил предположить, что данный препарат действует на этапе проникновения вируса в клетку-мишень [33]. Позднее была разработана модифицированная методика синтеза препарата глицивира, которая позволила заменить исходные реагенты на менее токсичные и более дешёвые и получить препарат, по биологической активности приближенный к исходному глицивиру [34].
C.R. Wang и соавт. была продемонстрирована противовирусная активность метилгаллата из съедобного гриба Pholiota adiposa [35]. Метилгаллат подавлял проникновение Env-псевдовируса в клетки TZM-bl, при этом он обладал низкой токсичностью в отношении использованных культур клеток. Для идентификации ингибирующих веществ из растений был создан псевдовирус ВИЧ-1 подтипа C (HIV-1-C), а в качестве контроля были использованы псевдовирусы дикого типа ВИЧ-1 подтипа B (HIV-1-B) и мутанты, устойчивые к нуклеозидным и ненуклеозидным ингибиторам обратной транскриптазы. Так, катехин, полученный из Peltophorum africanum, ингибировал проникновение псевдовирусов ВИЧ-1-C и ВИЧ-1-B с индексами селективности 6304 мкМ (IC50: 0,49 мкМ, CC50: 3089 мкМ) и 1343 мкМ (IC50: 2,3 мкМ, CC50: 3089 мкМ) соответственно [36]. Широчайшим спектром противовирусной активности обладает перколяционный экстракт Spatholobus suberectus Dunn (SSP) против проникновения SARS-CoV, H5N1 IAV и ВИЧ-1. В частности, в случае ВИЧ-1 SSP взаимодействовал с гликопротеином gp160 оболочки вируса, который отвечает за проникновение вируса в клетки-мишени хозяина [37].
Новые противовирусные препараты, способные инактивировать инфекционную активность вирусных частиц, получили название инактиваторы. В отличие от ингибиторов слияния и антагонистов рецепторов, инактиваторы могут активно инактивировать вирионы в крови посредством взаимодействия с одним или несколькими участками гликопротеинов вирусной оболочки. Предполагается, что ряд разрабатываемых инактиваторов вирусов на основе белков и пептидов могут быть безопасными при их применении для лечения человека [38]. Например, рекомбинантная химера, обозначенная как DAVEI (двойной ингибитор вируцидного проникновения), состоящая из лектина циановирина-N (CVN) и пептида консервативной мембранно-проксимальной внешней области белка оболочки ВИЧ-1 gp41 (MPER), могла эффективно инактивировать псевдовирус ВИЧ-1 Bal.01 со значением EC50 28,3 нМ. Необратимая инактивация вирионов ВИЧ-1 происходила при двойном взаимодействии с gp120 и gp41. При этом сами исходные молекулы CVN или MPER не способны инактивировать вирионы ВИЧ-1 [39].
Антивирусные препараты, ингибирующие ортофлавивирусы
Ещё одним семейством РНК-содержащих вирусов, имеющих громадное медицинское значение, являются вирусы, относящиеся к семейству Flaviviridae (Riboviria, Orthornavirae, Kitrinoviricota, Flasuviricetes, Amarillovirale, Flaviviridae). Сегодня к семейству флавивирусов относят более 90 видов вирусов и множество новых, ещё неклассифицированных вирусов. Важно отметить, что в настоящее время ортофлавивирусы распространены практически глобально, и сотни миллионов человек ежегодно встречаются с ними, многие заболевают и даже погибают. Принято выделять так называемые большие флавивирусные инфекции, которые вызывают вирусы денге, японского энцефалита, Западного Нила, жёлтой лихорадки и Зика.
Вирус гепатита С (HCV), который также входит в отдельный род семейства Flaviviridae, является виновником около 170 млн случаев заболевания человека. Заболевание часто протекает в хронической форме, кончается трагически, а вирус гепатита С вполне заслуженно получил неофициальное название «ласковый убийца» [40]. Это единственный представитель ортофлавивирусов, против которых существуют официально зарегистрированные высокоэффективные лекарственные препараты, приводящие в большинстве случаев к излечению пациентов. К ним относятся ингибиторы протеазы HCV боцепривир и телапривир [41], а также даклатасвир, софосбувир и симепревир, нацеленные на вирусные ферменты — полимеразу NS5 или протеазу NS3. Они обеспечивают высокоэффективную антивирусную терапию у подавляющего большинства пациентов [42]. Однако в некоторых случаях такая терапия сопровождается неблагоприятными побочными эффектами [43]. Поэтому поиск препаратов против вируса гепатита С остается актуальной проблемой. Так, целый ряд работ был посвящён веществам, направленным против вируса гепатита С. Было продемонстрировано, что гарциановые кислоты A и B, выделенные из грибка Trichoderma harzianum, могут воздействовать на белок оболочки HCV E1/E2, а также CD81 клеток-хозяев, ингибируя проникновение псевдовирусов в клетки и обладая низкой цитотоксичностью [44]. На той же модели HCVpp было показано, что растительный алкалоид берберин проявляет противовирусную активность, взаимодействуя с гликопротеинами E1 и E2 оболочки HCV [45]. С помощью псевдотипированного вируса HCV выяснили, что LUMS1 — модифицированная форма лектина микровирина, известного как ингибитор проникновения ВИЧ-1, может столь же эффективно ингибировать и проникновение HCVpp в клетки-мишени хозяина [46]. Пангенотипическое проникновение псевдочастиц HCV в гепатоциты человека Huh7 ингибировали и производные схизандроновой кислоты, тритерпеноида из плодов Schisandra sphenanthera, препятствуя слиянию вириона и клеточной мембраны и не проявляя заметной цитотоксичности. Эти соединения продемонстрировали также сильную противоопухолевую активность против линий клеток Bel7404 и SMMC7721 [47]. Несколько производных флавоноидов, в которых триазольные группы были объединены с пиранофлавоноидным каркасом, ингибировали инфекцию клеток Huh7 вирусом гепатита С. Дополнительные исследования механизма действия с использованием псевдовирусов подтвердили, что наиболее эффективные из этих соединений ингибировали именно проникновение вируса в клетку [48]. Важно отметить, что вирус гепатита С фактически не культивируется в лабораторных условиях на культурах клеток. Успехи в создании антивирусных препаратов против HCV во многом были предопределены развитием и использованием технологий псевдовирусов для оценки антивирусной активности кандидатных соединений.
Псевдотипированные частицы были созданы и для других вирусов этого семейства, преимущественно с использованием лентивирусной системы, а именно: инфекционный псевдотипированный вирус гепатита С HCVpp, несущий немодифицированные гликопротеины HCV E1 и E2 [49], псевдотипированные вирусы японского энцефалита [50, 51], псевдотипированные вирусы денге D2(HIVluc) [52] и Зика — ZikaEnv/HIV-1 [53].
Псевдотипированные вирусы широко использовались для изучения рецепторного взаимодействия между поверхностными белками ортофлавивирусов с клетками хозяина, а также поиска и исследования механизма действия противовирусных препаратов [54]. Перечень таких препаратов приведён в табл. 2.
Таблица 2. Антивирусные препараты против флавивирусов, полученные и/или исследованные с использованием псевдовирусной технологии
Вещество | Инфекция | Механизм действия | Источник |
НПВП (аспирин, ибупрофен, напроксен, ацетаминофен, лорноксикам) | Зика | Снижение экспрессии клеточного белка AXL, кофактора проникновения ZIKV | [54] |
Гарциановые кислоты A и B из Trichoderma harzianum | Гепатит С* | Воздействие на белок оболочки вируса E1/E2, а также CD81 клеток-хозяев | [45] |
Берберин (растительный алкалоид) | Гепатит С | Взаимодействие с гликопротеинами E1 и E2 | [46] |
LUMS1 — модифицированная форма микровирина (лектин) | Гепатит С | Взаимодействие с гликопротеинами E1 и E2 | [47] |
Производные схизандроновой кислоты (тритерпеноида из плодов Schisandra sphenanthera | Гепатит С | Препятствуют слиянию вириона и клеточной мембраны | [48] |
Примечание. *Псевдовирус собран на базе генома вируса везикулярного стоматита. Все остальные псевдовирусы сконструированы на базе генома ВИЧ-1.
T. Pan и соавт. показали, что несколько нестероидных противовоспалительных препаратов (НПВП), включая аспирин, ибупрофен, напроксен, ацетаминофен и лорноксикам, эффективно подавляют проникновение псевдотипированных вирусов Зика Env/HIV-1, как и репликацию вируса Зика в клеточных линиях и в первичных эндотелиальных клетках плода человека [53]. Интересно, что НПВП-ингибирующий эффект был опосредован эффективным снижением экспрессии клеточного белка AXL — кофактора проникновения вируса Зика. Таким образом, был описан новый механизм действия противовирусных соединений, который включает блокаду проникновения вируса Зика посредством деградации кофактора проникновения вируса в клетку. Авторы пришли к выводу, что НПВП могут быть использованы на практике для профилактики заражения вирусом Зика у беременных женщин, поскольку некоторые НПВП, включая ибупрофен и ацетаминофен, считаются клинически безопасными.
Антивирусные препараты, ингибирующие проникновение вирусов гриппа
Вирусы гриппа — высококонтагиозные респираторные патогены человека, принадлежащие к семейству Orthomyxoviridae (Riboviria, Orthornavirae, Negarnaviricota, Polyploviricotina, Insthoviricetes, Articulavirales, Orthomyxoviridae). Семейство содержит четыре рода РНК-содержащих вирусов с сегментированным геномом: Alphainfluenzavirus, Betainfluenzavirus, Deltainfluenzavirus и Gammainfluenzavirus. Фактически каждый род включает один вид вируса: вирус гриппа А (Alphainfluenzavirus influenza), вирус гриппа В (Betainfluenzavirus influenza), вирус гриппа С (Gammainfluenzavirus influenzae) и вирус гриппа D (Deltainfluenzavirus influenza). С заболеваниями человека в основном ассоциируются с вирусами гриппа A, B и C, хотя семейство Orthomyxoviridae включает еще 5 родов вирусов.
На липидной оболочке вирусов гриппа доминируют два основных мембранных гликопротеина: гемагглютинин (HA) и нейраминидаза (NA). Поверхностный гликопротеин HA отвечает за прикрепление вирусной частицы и проникновение в клетки хозяина через рецепторы сиаловой кислоты, а NA своей ферментативной активностью обеспечивает высвобождение вирусного потомства из инфицированной клетки. Подтипы (серотипы) вируса гриппа А принято классифицировать в комбинации 18 типов HA и 11 типов NA [55].
Помимо вакцинации, для лечения и профилактики инфекции вируса гриппа А применяются противовирусные препараты. Поиску таких препаратов и изучению механизмов их действия с использованием псевдовирусных частиц посвящён ряд работ. Перечень таких препаратов приведён в табл. 3.
Таблица 3. Антивирусные препараты против вирусов гриппа А, полученные и/или исследованные с использованием псевдовирусной технологии
Вещество | Штамм гриппа | Механизм действия | Источник |
Малая молекула TBHQ | H7 A/Netherlands/219/2003, H3 A/Brisbane/10/2007 | Ароматическое кольцо TBHQ имеет обширный контакт с областью петли стебля HA | [59] |
C12-KKWK и C12-OOWO — мембранно-активные липопептиды | A/Puerto Rico/8/34, A/Aichi/2/68 | Взаимодействие с субъединицей HA2 | [60] |
Кверцетин (витамин группы Р) | A/Anhui/1/2005A, A/Xinjiang/1/2006, A/Hong Kong/156/1997, A/Qinghai/59/2005, A/Thailand/Kan353/2004, A/VietNam/1194/2004 | Взаимодействие с субъединицей HA2 вируса A (H5N1), которая опосредует слияние вирусной оболочки с эндосомальной мембраной на ранней стадии заражения | [61] |
Олиготиофеновые соединения | H5N1 | Связывание с НА | [62] |
H5N1-A/Thailand/ Kan353/2004 | Связывание НА | [63] | |
Пентациклические тритерпеновые сапонины C-28 | A/Duck/Guangdong/99 | Связывание с НА | [64] |
Перколяционный экстракт Spatholobus suberectus Dunn | H5N1Turkey | Прямое связывание гликопротеинов вирусной оболочки | [38] |
Гриффитсин из красных водорослей, и его модификация GL25E | H1N1: Puerto Rico/8/1934, California/07/2009, Shanghai/37T/2009, WSN/1933. H3N2: Guizhou/54/1989 | Связывание с НА на стадии проникновения вируса | [65] |
Лентивирусные псевдовирусные системы были разработаны для SARS-CoV, SARS-CoV-2 и птичьего гриппа H5 [56]. Однако две другие платформы — с геномом вируса везикулярного стоматита и геномом вируса лейкемии мышей — также используются в исследованиях [57].
А. Antanasijevic и соавт., анализируя проникновение псевдовируса, созданного на базе ВИЧ-1, выяснили, что малая молекула трет-бутилгидрохинона (TBHQ) ингибирует проникновение в клетки вируса гриппа, опосредованное HA типа H7, а также HA H3. Используя ядерно-магнитный резонанс, авторы показали, что ароматическое кольцо TBHQ имеет обширный контакт с областью петли стебля H7 HA [58].
Скрининг на основе псевдовирусов позволил идентифицировать два суперкоротких мембранно-активных липопептида (C12-KKWK и C12-OOWO) в качестве эффективных анти-IAV-агентов против штаммов гриппа A/Puerto Rico/8/34 и A/Aichi/2/68. Ингибирование проникновения вируса происходило путём взаимодействия этих соединений с субъединицей HA2 [59].
T.C. Hung и соавт. был проведён скрининг ряда препаратов и обнаружено, что кверцетин (витамин группы Р) ингибирует проникновение в клетку псевдовирусов, экспонирующих НА вируса H5N1 [48]. Исследования показали, что кверцетин взаимодействует с субъединицей HA2 на ранней стадии заражения гриппом и это обеспечивает возможность его применения для разработки эффективных, безопасных и доступных натуральных продуктов для лечения и профилактики гриппа А [60].
Серия олиготиофеновых соединений, нацеленных на НА вируса гриппа, была синтезирована в качестве специфических ингибиторов против подтипа H5 с помощью серии реакций алкилирования, азидирования, аминирования и амидирования. Ингибирующая активность этих соединений была протестирована на клеточном уровне против псевдовируса гриппа H5N1. Анализ структуры этих соединений показал, что размер олиготиофеновых соединений очень важен для уровня их ингибирующей активности [61].
Была оценена противогриппозная активность производных пиразоло[3, 4-b]пиридинонов, синтезированных с помощью оригинального протокола с использованием воды в качестве растворителя. Протокол позволял получать модифицированные варианты соединений в течение 1 ч. Результаты скрининга полученных соединений выделили два производных, которые проявили сильную ингибирующую активность против псевдовируса A/Thailand/Kan353/2004. Быстрота и экологичность синтеза этих производных открывает новые перспективы в области разработки лекарственных препаратов [62].
Ряд модифицированных пентациклических тритерпеновых сапонинов C-28 был синтезирован посредством конъюгации с амидными производными, и была оценена их противовирусная активность против вируса гриппа A/Duck/Guangdong/99 в клетках MDCK. Исследование механизмов действия показало, что эти тритерпеноиды могут прочно связываться с HA вирусной оболочки, блокируя прикрепление псевдовируса H5N1 к клеткам-мишеням [63].
После начала пандемии COVID-19 препараты, ингибирующие проникновение вирусов гриппа, практически всегда исследовались совместно с препаратами против SARS-CoV-2. Особенно пристальное внимание стало уделяться не химически синтезированным, а природным соединениям, поскольку натуральные противовирусные препараты были признаны безопасными и эффективными.
Например, уже упомянутый перколяционный экстракт Spatholobus suberectus Dunn (SSP) является ингибитором проникновения вируса широкого спектра действия против SARS-CoV-1/2 и других оболочечных вирусов. Ингибирующая активность SSP в отношении вирусов была оценена с использованием псевдотипированных SARS-CoV-1 и 2, HIV-1ADA и HXB2, а также H5N1.
Исследования in vivo показали, что даже при длительном лечении препарат не проявлял токсичности для подопытных крыс, по сравнению с животными контрольной группы. Полученные данные демонстрируют потенциал SSP как препарата-кандидата для профилактики и лечения инфекций, вызванных оболочечными вирусами [36].
Гриффитсин — белок, связывающий углеводы, выделенный из красных водорослей, а также двухвалентный ингибитор проникновения, созданный на его основе (GL25E), — рекомбинантный белок, состоящий из гриффитсина, линкера из 25 аминокислот, и EK1 — ингибитора коронавируса широкого спектра действия, могут эффективно ингибировать моноинфекцию вируса гриппа А и SARS-CoV-2 и их микст-инфекцию путём блокирования HA IAV и спайкового белка SARS-CoV-2. GL25E более эффективен, чем гриффитсин, поскольку GL25E также может взаимодействовать с доменом HR1 в белке S SARS-CoV-2 [64].
Следует отметить, что наибольшее количество исследований, связанных с поиском противовирусных препаратов с помощью технологии псевдовирусов, связано с пандемией COVID-19, вызванного коронавирусом SARS-CoV-2, которая породила настоящий бум вирусологических исследований. Опубликован ряд обзорных публикаций, посвящённых возможностям использования псевдовирусов в исследовании коронавирусных инфекций [8, 9, 65, 66]. В данных публикациях подчёркивается значимость использования псевдовирусов для исследования особенностей взаимодействия SARS-CoV-2 с пермиссивными клетками, количественного определения вируснейтрализующих антител, новых возможностях для конструирования вакцин, поиска новых антивирусных препаратов на основе оценки активности химически синтезированных соединений, исследований особенностей поведения псевдовирусных частиц в целом организме и их взаимодействии с различными органами и иммунной системой. Основные ограничения использования этой технологии связываются с ограничением представленности белков коронавируса на поверхности псевдовирусной частицы и невозможности использования для исследования неструктурных белков SARS-CoV-2. В целом количество публикаций по псевдовирусам и SARS-CoV-2 огромно и нуждается в отдельном рассмотрении.
Заключение
Проведён анализ использования псевдовирусов для создания новых средств диагностики, профилактики и лечения для ряда серьёзных социально значимых инфекционных заболеваний, вызываемых РНК-содержащими вирусами, на основе данных, опубликованных в последние годы. В настоящее время технологии с использованием псевдовирусов широко и успешно используются для исследований ВИЧ-1, вируса гепатита С, вируса клещевого энцефалита, вирусов гриппа птиц и SARS-CoV-2, а также вирусов особо опасных инфекций, например, вирусов лихорадок Марбург и Эбола [67, 68].
Успех использования псевдовирусов определяется принципиально новыми возможностями этой технологии:
- позволяет проводить исследования начального этапа проникновения вируса в клетку;
- выполнять исследования в условиях, обеспечивающих высокий уровень биобезопасности, особенно при работе с псевдовирусами, моделирующими высокопатогенные вирусные агенты;
- принципиально упрощает выполнение исследований и делает их возможными, особенно для плохо культивируемых или не культивированных вирусов;
- расширяет экспериментальные возможности исследователей;
- успешно сочетается с современными методами синтетической биологии и биоинформатики.
Совокупность представленных данных иллюстрирует принципиально новый вклад технологии псевдовирусов в поиск и создание нового поколения лекарственных препаратов для борьбы с серьёзными социально значимыми заболеваниями, вызываемыми РНК-содержащими вирусами.
1 MLA style: Press release. NobelPrize.org. Nobel Prize Outreach 2025. https://www.nobelprize.org/prizes/chemistry/2024/press-release/ (дата обращения: 02.04.2025).
Об авторах
Лариса Ивановна Карпенко
Государственный научный центр вирусологии и биотехнологии «Вектор»
Автор, ответственный за переписку.
Email: lkarpenko1@ya.ru
ORCID iD: 0000-0003-4365-8809
д-р биол. наук, зав. лаб. рекомбинантных вакцин, в. н. с. отдела биоинженерии
Россия, Кольцово, Новосибирская областьНадежда Борисовна Рудометова
Государственный научный центр вирусологии и биотехнологии «Вектор»
Email: nadenkaand100@mail.ru
ORCID iD: 0000-0002-1684-9071
канд. биол. наук, с. н. с. отдела биоинженерии
Россия, Кольцово, Новосибирская областьЛилия Филипповна Низоленко
Государственный научный центр вирусологии и биотехнологии «Вектор»
Email: nizolenko@inbox.ru
ORCID iD: 0000-0002-9647-4969
канд. биол. наук, с. н. с. отдела биоинженерии
Россия, Кольцово, Новосибирская областьВалерий Борисович Локтев
Государственный научный центр вирусологии и биотехнологии «Вектор»
Email: valeryloktev@gmail.com
ORCID iD: 0000-0002-0229-321X
д-р биол. наук, профессор, зав. отделом молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, Кольцово, Новосибирская областьСписок литературы
- Sagaya Jansi R., Khusro A., Agastian P., et al. Emerging paradigms of viral diseases and paramount role of natural resources as antiviral agents. Sci. Total. Environ. 2021;759: 143539. DOI: https://doi.org/10.1016/j.scitotenv.2020.143539
- Sharma K., Singh M., Sharma S.C. Revolutionizing antiviral therapeutics: in silico approaches for emerging and neglected RNA viruses. Curr. Pharm. Des. 2024;30(41):3276–90. DOI: https://doi.org/10.2174/0113816128322226240815063730
- Singh S., Kaur N., Gehlot A. Application of artificial intelligence in drug design: A review. Comput. Biol. Med. 2024;179:108810. DOI: https://doi.org/10.1016/j.compbiomed.2024.108810
- Рудометова Н.Б., Щербаков Д.Н., Рудометов А.П. и др. Модельные системы вируса иммунодефицита человека (ВИЧ-1), используемые для оценки эффективности кандидатных вакцин и лекарственных препаратов против ВИЧ-1 in vitro. Вавиловский журнал генетики и селекции. 2022;26(2): 214–21. Rudometova N.B., Shcherbakov D.N., Rudometov A.P., et al. Model systems of human immunodeficiency virus (HIV-1) for in vitro efficacy assessment of candidate vaccines and drugs against HIV-1. Vavilov Journal of Genetics and Breeding. 2022;26(2):214–21. DOI: https://doi.org/10.18699/VJGB-22-26 EDN: https://elibrary.ru/clbskg
- Welch S.R., Guerrero L.W., Chakrabarti A.K., et al. Lassa and Ebola virus inhibitors identified using minigenome and recombinant virus reporter systems. Antiviral. Res. 2016;136:9–18. DOI: https://doi.org/10.1016/j.antiviral.2016.10.007
- Chen M., Zhang X.E. Construction and applications of SARS-CoV-2 pseudoviruses: a mini review. Int. J. Biol. Sci. 2021;17(6):1574–80. DOI: https://doi.org/10.7150/ijbs.59184
- Xiang Q., Li L., Wu J., et al. Application of pseudovirus system in the development of vaccine, antiviral-drugs, and neutralizing antibodies. Microbiol. Res. 2022;258:126993. DOI: https://doi.org/10.1016/j.micres.2022.126993
- Ory D.S., Neugeboren B.A., Mulligan R.C. A stable human-derived packaging cell line for production of high titer retrovirus/vesicular stomatitis virus G pseudotypes. Proc. Natl. Acad. Sci. USA. 1996;93(21):11400–6. DOI: https://doi.org/10.1073/pnas.93.21.11400
- Nie J., Wu X., Wang Y. Assays based on pseudotyped viruses. Adv. Exp. Med. Biol. 2023;1407:29–44. DOI: https://doi.org/10.1007/978-981-99-0113-5_2
- Wang Y., ed. Pseudotyped Viruses. Springer Singapore;2023. DOI: https://doi.org/10.1007/978-981-99-0113-5
- Montefiori D.C., Mascola J.R. Neutralizing antibodies against HIV-1: can we elicit them with vaccines and how much do we need? Curr. Opin. HIV AIDS. 2009;4(5):347–51. DOI: https://doi.org/10.1097/COH.0b013e32832f4a4d
- Li M., Gao F., Mascola J.R., et al. Human immunodeficiency virus type 1 env clones from acute and early subtype B infections for standardized assessments of vaccine-elicited neutralizing antibodies. J. Virol. 200;79(16):10108–25. DOI: https://doi.org/10.1128/JVI.79.16.10108-10125.2005
- Li Q., Liu Q., Huang W., et al. Current status on the development of pseudoviruses for enveloped viruses. Rev. Med. Virol. 2018;28(1):e1963. DOI: https://doi.org/10.1002/rmv.1963
- Platt E.J., Wehrly K., Kuhmann S.E., et al. Effects of CCR5 and CD4 cell surface concentrations on infections by macrophagetropic isolates of human immunodeficiency virus type 1. J. Virol. 1998;72(4):2855–64. DOI: https://doi.org/10.1128/JVI.72.4.2855-2864.1998
- Wei X., Decker J.M., Liu H., et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy. Antimicrob. Agents Chemother. 2002;46(6):1896–905. DOI: https://doi.org/10.1128/AAC.46.6.1896-1905.2002
- Guo Y., Rumschlag-Booms E., Wang J., et al. Analysis of hemagglutinin-mediated entry tropism of H5N1 avian influenza. Virol. J. 2009;6:39. DOI: https://doi.org/10.1186/1743-422X-6-39
- Wang W., Nie J., Prochnow C., et al. A systematic study of the N-glycosylation sites of HIV-1 envelope protein on infectivity and antibody-mediated neutralization. Retrovirology. 2013;10:14. DOI: https://doi.org/10.1186/1742-4690-10-14
- Kretschmer M., Kadlubowska P., Hoffmann D., et al. Zikavirus prME envelope pseudotyped human immunodeficiency virus type-1 as a novel tool for glioblastoma-directed virotherapy. Cancers (Basel). 2020;12(4):1000. DOI: https://doi.org/10.3390/cancers12041000
- Wrin T., Loh T.P., Vennari J.C., et al. Adaptation to persistent growth in the H9 cell line renders a primary isolate of human immunodeficiency virus type 1 sensitive to neutralization by vaccine sera. J. Virol. 1995;69(1):39–48. DOI: https://doi.org/10.1128/JVI.69.1.39-48.1995
- Phanuphak N., Gulick R.M. HIV treatment and prevention 2019: current standards of care. Curr. Opin. HIV AIDS. 2020;15(1):4–12. DOI: https://doi.org/10.1097/COH.0000000000000588
- Arts E.J., Hazuda D.J. HIV-1 antiretroviral drug therapy. Cold Spring Harb. Perspect. Med. 2012;2(4):a007161. DOI: https://doi.org/10.1101/cshperspect.a007161
- Lobritz M.A., Ratcliff A.N., Arts E.J. HIV-1 entry, inhibitors, and resistance. Viruses. 2010;2(5):1069–105. DOI: https://doi.org/10.3390/v2051069
- Xiao T., Cai Y., Chen B. HIV-1 entry and membrane fusion inhibitors. Viruses. 2021;13(5):735. DOI: https://doi.org/10.3390/v13050735
- Solomon M., Liang C. Pseudotyped viruses for retroviruses. Adv. Exp. Med. Biol. 2023;1407:61–84. DOI: https://doi.org/10.1007/978-981-99-0113-5_4
- Westby M., van der Ryst E. CCR5 antagonists: host-targeted antivirals for the treatment of HIV infection. Antivir. Chem. Chemother. 2005;16(6):339–54. DOI: https://doi.org/10.1177/095632020501600601
- Ding X., Zhang X., Chong H., et al. Enfuvirtide (T20)-based lipopeptide is a potent HIV-1 cell fusion inhibitor: implications for viral entry and inhibition. J. Virol. 2017;91(18):e00831–17. DOI: https://doi.org/10.1128/JVI.00831-17
- Cocklin S., Gopi H., Querido B., et al. Broad-spectrum anti-human immunodeficiency virus (HIV) potential of a peptide HIV type 1 entry inhibitor. J. Virol. 2007;81(7):3645–8. DOI: https://doi.org/10.1128/JVI.01778-06
- London G.M., Mayosi B.M., Khati M. Isolation and characterization of 2'-F-RNA aptamers against whole HIV-1 subtype C envelope pseudovirus. Biochem. Biophys. Res. Commun. 2015;456(1):428–33. DOI: https://doi.org/10.1016/j.bbrc.2014.11.101
- Xu L., Zhang T., Xu X., et al. DNA triplex-based complexes display anti-HIV-1-Cell fusion activity. Nucleic Acid Ther. 2015;25(4):219–25. DOI: https://doi.org/10.1089/nat.2015.0535
- Kanizsai S., Ongrádi J., Aradi J., Nagy K. New approach for inhibition of HIV entry: modifying CD4 binding sites by thiolated pyrimidine derivatives. Pathol. Oncol. Res. 2016;22(3):617–23. DOI: https://doi.org/10.1007/s12253-016-0044-y
- Zhao Q., Ma L., Jiang S., et al. Identification of N-phenyl-N'-(2,2,6,6-tetramethyl-piperidin-4-yl)-oxalamides as a new class of HIV-1 entry inhibitors that prevent gp120 binding to CD4. Virology. 2005;339(2):213–25. DOI: https://doi.org/10.1016/j.virol.2005.06.008
- Curreli F., Belov D.S., Ramesh R.R., et al. Design, synthesis and evaluation of small molecule CD4-mimics as entry inhibitors possessing broad spectrum anti-HIV-1 activity. Bioorg. Med. Chem. 2016;24(22):5988–6003. DOI: https://doi.org/10.1016/j.bmc.2016.09.057
- Fomenko V.V., Rudometova N.B., Yarovaya O.I., et al. Synthesis and in vitro study of antiviral activity of glycyrrhizin nicotinate derivatives against HIV-1 pseudoviruses and SARS-CoV-2 viruses. Molecules. 2022;27(1):295. DOI: https://doi.org/10.3390/molecules27010295
- Фандо А.А., Фоменко В.В., Рудомётова Н.Б. и др. Модификация методики синтеза глицивира и исследование антивирусной активности полученных в ходе синтеза препаратов в отношении ENV-псевдовирусов ВИЧ-1. Химия растительного сырья. 2023;(4):387–95. Fando A.A., Fomenko V.V., Rudometova N.B., et al. Synthesis of glycivir derivatives using modification of synthesis procedure studying their antiviral activity against ENV-pseudovirouses HIV-1. Chemistry of Plant Raw Material. 2023;(4):387–95. DOI: https://doi.org/10.14258/jcprm.20230413841 EDN: https://elibrary.ru/uzjyqg
- Wang C.R., Zhou R., Ng T.B., et al. First report on isolation of methyl gallate with antioxidant, anti-HIV-1 and HIV-1 enzyme inhibitory activities from a mushroom (Pholiota adiposa). Environ. Toxicol. Pharmacol. 2014;37(2):626–37. DOI: https://doi.org/10.1016/j.etap.2014.01.023
- Mavhandu L.G., Cheng H., Bor Y.C., et al. Development of a pseudovirus assay and evaluation to screen natural products for inhibition of HIV-1 subtype C reverse transcriptase. J. Ethnopharmacol. 2020;258:112931. DOI: https://doi.org/10.1016/j.jep.2020.112931
- Liu Q., Kwan K.Y., Cao T., et al. Broad-spectrum antiviral activity of Spatholobus suberectus Dunn against SARS-CoV-2, SARS-CoV-1, H5N1, and other enveloped viruses. Phytother. Res. 2022;36(8):3232–47. DOI: https://doi.org/10.1002/ptr.7452
- Su X., Wang Q., Wen Y., et al. Protein- and peptide-based virus inactivators: inactivating viruses before their entry into cells. Front. Microbiol. 2020;11:1063. DOI: https://doi.org/10.3389/fmicb.2020.01063
- Parajuli B., Acharya K., Bach H.C., et al. Restricted HIV-1 Env glycan engagement by lectin-reengineered DAVEI protein chimera is sufficient for lytic inactivation of the virus. Biochem. J. 2018;475(5):931–57. DOI: https://doi.org/10.1042/BCJ20170662
- Беседнова Н.Н., Запорожец Т.С., Ермакова С.П., и др. Природные соединения – потенциальная основа средств профилактики и терапии гепатита С. Антибиотики и химиотерапия. 2023;68(11-12):75–90. Besednova N.N., Zaporozhets T.S., Ermakova S.P., et al. Natural compounds as potential basis for the prevention and treatment of hepatitis C. Antibiotics and Chemotherapy. 2023;68(11-12):75–90. DOI: https://doi.org/10.37489/0235-2990-2023-68-11-12-75-90 EDN: https://elibrary.ru/besoof
- Дерябин П.Г. Гепатит С: современное состояние и перспективы. Вопросы вирусологии. 2012;(S1):91–103. Deryabin P.G. Hepatitis C: current state and prospects. Problems of Virology. 2012;(S1):91–103. EDN: https://elibrary.ru/osnmkg
- Chowdhury P., Sahuc M.E., Rouillé Y., et al. Theaflavins, polyphenols of black tea, inhibit entry of hepatitis C virus in cell culture. PLoS One. 2018;13(11):e0198226. DOI: https://doi.org/10.1371/journal.pone.0198226
- Nafisi S., Roy S., Gish R., et al. Defining the possibilities: is short duration treatment of chronic hepatitis C genotype 1 with sofosbuvir-containing regimens likely to be as effective as current regimens? Expert. Rev. Anti. Infect. Ther. 2016;14(1): 41–56. DOI: https://doi.org/10.1586/14787210.2016.1114883
- Li B., Li L., Peng Z., et al. Harzianoic acids A and B, new natural scaffolds with inhibitory effects against hepatitis C virus. Bioorg. Med. Chem. 2019;27(3):560–7. DOI: https://doi.org/10.1016/j.bmc.2018.12.038
- Hung T.C., Jassey A., Liu C.H., et al. Berberine inhibits hepatitis C virus entry by targeting the viral E2 glycoprotein. Phytomedicine. 2019;53:62–9. DOI: https://doi.org/10.1016/j.phymed.2018.09.025
- Shahid M., Qadir A., Yang J., et al. An engineered microvirin variant with identical structural domains potently inhibits human immunodeficiency virus and hepatitis C virus cellular entry. Viruses. 2020;12(2):199. DOI: https://doi.org/10.3390/v12020199
- Zhang K.X., Qian X.J., Zheng W., et al. Synthesis and in vitro anti-HCV and antitumor evaluation of schisandronic acid derivatives. Med. Chem. 2021;17(9):974–82. DOI: https://doi.org/10.2174/1573406416999200818150053
- Zhang H., Zheng X., Li J., et al. Flavonoid-triazolyl hybrids as potential anti-hepatitis C virus agents: synthesis and biological evaluation. Eur. J. Med. Chem. 2021;218:113395. DOI: https://doi.org/10.1016/j.ejmech.2021.113395
- Bartosch B., Dubuisson J., Cosset F.L. Infectious hepatitis C virus pseudo-particles containing functional E1-E2 envelope protein complexes. J. Exp. Med. 2003;197(5):633–42. DOI: https://doi.org/10.1084/jem.20021756
- Kambara H., Tani H., Mori Y., et al. Involvement of cyclophilin B in the replication of Japanese encephalitis virus. Virology. 2011; 412(1):211–9. DOI: https://doi.org/10.1016/j.virol.2011.01.011
- Liu H., Wu R., Yuan L., et al. Introducing a cleavable signal peptide enhances the packaging efficiency of lentiviral vectors pseudotyped with Japanese encephalitis virus envelope proteins. Virus Res. 2017;229:9–16. DOI: https://doi.org/10.1016/j.virusres.2016.12.007
- Hu H.P., Hsieh S.C., King C.C., Wang W.K. Characterization of retrovirus-based reporter viruses pseudotyped with the precursor membrane and envelope glycoproteins of four serotypes of dengue viruses. Virology. 2007;368(2):376–87. DOI: https://doi.org/10.1016/j.virol.2007.06.026
- Pan T., Peng Z., Tan L., et al. Nonsteroidal anti-inflammatory drugs potently inhibit the replication of Zika viruses by inducing the degradation of AXL. J. Virol. 2018;92(20):e01018–18. DOI: https://doi.org/10.1128/JVI.01018-18
- Zhang L., Wang X., Ming A., Tan W. Pseudotyped virus for Flaviviridae. Adv. Exp. Med. Biol. 2023;1407:313–27. DOI: https://doi.org/10.1007/978-981-99-0113-5_17
- Del Rosario J.M.M., da Costa K.A.S., Temperton N.J. Pseudotyped viruses for influenza. Adv. Exp. Med. Biol. 2023;1407:153–73. DOI: https://doi.org/10.1007/978-981-99-0113-5_8
- Huang S.W., Tai C.H., Hsu Y.M., et al. Assessing the application of a pseudovirus system for emerging SARS-CoV-2 and re-emerging avian influenza virus H5 subtypes in vaccine development. Biomed. J. 2020;43(4):375–87. DOI: https://doi.org/10.1016/j.bj.2020.06.003
- Carnell G.W., Ferrara F., Grehan K., et al. Pseudotype-based neutralization assays for influenza: a systematic analysis. Front. Immunol. 2015;6:161. DOI: https://doi.org/10.3389/fimmu.2015.00161
- Antanasijevic A., Cheng H, Wardrop D.J., et al. Inhibition of influenza H7 hemagglutinin-mediated entry. PLoS One. 2013;8(10):e76363. DOI: https://doi.org/10.1371/journal.pone.0076363
- Wu W., Wang J., Lin D., et al. Super short membrane-active lipopeptides inhibiting the entry of influenza A virus. Biochim. Biophys. Acta. 2015a;1848(10 Pt. A):2344–50. DOI: https://doi.org/10.1016/j.bbamem.2015.06.015
- Wu W., Li R., Li X., et al. Quercetin as an antiviral agent inhibits influenza A virus (IAV) entry. Viruses. 2015;8(1):6. DOI: https://doi.org/10.3390/v8010006
- Zhu Z., Yao Z., Shen X., et al. Oligothiophene compounds inhibit the membrane fusion between H5N1 avian influenza virus and the endosome of host cell. Eur. J. Med. Chem. 2017;130:185–94. DOI: https://doi.org/10.1016/j.ejmech.2017.02
- Zeng L.Y., Liu T., Yang J., et al. "On-water" facile synthesis of novel Pyrazolo[3,4-b]pyridinones possessing anti-influenza virus activity. ACS Comb. Sci. 2017;19(7):437–46. DOI: https://doi.org/10.1021/acscombsci.7b00016
- Liao Y., Chen L., Li S., et al. Structure-aided optimization of 3-O-β-chacotriosyl ursolic acid as novel H5N1 entry inhibitors with high selective index. Bioorg. Med. Chem. 2019;27(18):4048–58. DOI: https://doi.org/10.1016/j.bmc.2019.07.028
- Cao N., Cai Y., Huang X., et al. Inhibition of influenza A virus and SARS-CoV-2 infection or co-infection by griffithsin and griffithsin-based bivalent entry inhibitor. mBio. 2024;15(5):e0074124. DOI: https://doi.org/10.1128/mbio.00741-24
- Tan C., Wang N., Deng S., et al. The development and application of pseudoviruses: assessment of SARS-CoV-2 pseudoviruses. PeerJ. 2023;11:e16234. DOI: https://doi.org/10.7717/peerj.16234
- Trischitta P., Tamburello M.P., Venuti A., et al. Pseudovirus-based systems for screening natural antiviral agents: a comprehensive review. Int. J. Mol. Sci. 2024;25(10):5188. DOI: https://doi.org/10.3390/ijms25105188
- Kononova A.A., Sokolova A.S., Cheresiz S.V., et al. N-heterocyclic borneol derivatives as inhibitors of Marburg virus glycoprotein-mediated VSIV pseudotype entry. Medchemcomm. 2017;8(12):2233–7. DOI: https://doi.org/10.1039/c7md00424a
- Liu Q., Fan C., Li Q., et al. Antibody-dependent-cellular-cytotoxicity-inducing antibodies significantly affect the post-exposure treatment of Ebola virus infection. Sci. Rep. 2017;7:45552. DOI: https://doi.org/10.1038/srep45552
Дополнительные файлы