Мониторинг Clostridioides difficile-ассоциированной инфекции в условиях стационара
- Авторы: Господарик А.В.1, Прохорова Н.Д.1, Куликова В.К.1, Калачнюк Т.Н.1, Хромых Н.И.1, Кудрявцева Ю.В.1, Беспятых Ю.А.1
-
Учреждения:
- Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
- Выпуск: Том 102, № 5 (2025)
- Страницы: 605-614
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18779
- DOI: https://doi.org/10.36233/0372-9311-662
- EDN: https://elibrary.ru/WQXHSZ
- ID: 18779
Цитировать
Полный текст
Аннотация
Введение. Clostridioides difficile — вид анаэробных спорообразующих грамположительных бактерий — является составной частью нормальной микрофлоры кишечника. C. difficile-ассоциированная инфекция развивается при избыточной колонизации C. difficile, вегетативные формы которой способны продуцировать экзотоксины, вызывающие воспаление в стенке толстой кишки. Токсигенные штаммы C. difficile являются основным возбудителем инфекций, связанных с оказанием медицинской помощи в стационаре.
Целью исследования является изучение частоты выявления C. difficile (как токсигенных, так и нетоксигенных штаммов) у пациентов гастроэнтерологического отделения ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России, госпитализированных в 2021–2023 гг. с синдромом диареи и другими установленными диагнозами.
Материалы и методы. В исследование были включены 547 пациентов в возрасте 19–88 лет (46,6% мужчин, 53,4% женщин). Для выявления ДНК C. difficile и генов её токсинов А и В применяли метод полимеразной цепной реакции в реальном времени, дополнительно проводили бактериологическое исследование кала. При обнаружении клинических признаков бактериальной инфекции проводили анализ на С-реактивный белок (СРБ).
Результаты. ДНК C. difficile выявлена у 65 (11,9%) пациентов, гены токсинов А и В обнаружены у 32 (5,9%) пациентов. Нетоксигенные штаммы C. difficile чаще детектировались у мужчин (55%) в возрасте до 40 лет. Токсигенные штаммы C. difficile с одинаковой частотой встречались у мужчин и женщин в возрасте до 40 лет. Анализ на СРБ показал, что воспалительные процессы чаще развиваются у пациентов старше 40 лет. Преобладающее заболевание с высоким показателем СРБ у пациентов с токсигенным штаммом — энтероколит, вызванный C. difficile (кодирование по МКБ-10: А04.7), в группе с нетоксигенным штаммом — у пациентов с диагнозом: язвенный колит (кодирование по МКБ-10: К51). У всех пациентов наблюдались выраженные нарушения баланса кишечной микрофлоры согласно развёрнутому бактериологическому анализу кала.
Заключение. В результате трёхлетнего мониторинга установлено увеличение доли пациентов с C. difficile с 6,6 до 7,9%. Доля образцов, положительных на гены токсинов A/B C. difficile, также увеличилась с 5,2 до 7,9%. Таким образом, необходимо проводить профилактические мероприятия для уменьшения влияния факторов риска развития C. difficile-ассоциированной инфекции в стационаре.
Полный текст
Введение
Обеспечение безопасной среды для пациентов и медицинских работников, а также контроль качества медицинской помощи являются приоритетными задачами в деятельности медицинских учреждений. Особую важность приобретает задача снижения заболеваемости и смертности, связанных с внутрибольничными инфекциями. Одним из ключевых факторов, способствующих снижению риска возникновения инфекций, связанных с оказанием медицинской помощи (ИСМП), является создание эффективной системы эпидемиологического мониторинга. Такая система позволяет своевременно выявлять наличие инфекционных заболеваний как у пациентов, так и у медицинских работников, что значительно повышает безопасность и качество медицинской помощи. Кроме того, профилактические меры, направленные на снижение ИСМП, могут способствовать снижению социальных рисков и вероятности страховых случаев для пациентов и медицинских работников1.
Возбудителями ИСМП являются разнообразные микроорганизмы, простейшие, гельминты, вирусы и прионы. Среди них наиболее распространены токсигенные штаммы Clostridioides difficile. Факторы, способствующие развитию инфекции C. difficile, многочисленны. Основным из них является использование антибактериальной терапии для лечения пациентов и связанное с этим изменение микрофлоры желудочно-кишечного тракта. Наибольший риск связан с применением антибактериальных препаратов из группы пенициллинов, цефалоспоринов, фторхинолонов и клиндамицина. Кроме того, факторами риска развития инфекции C. difficile являются возраст старше 65 лет, использование ингибиторов протонной помпы в схемах лечения, коморбидность. Механизм передачи C. difficile-ассоциированной инфекции — фекально-оральный, осуществляется контактно-бытовым путём (через контаминированные руки медицинского персонала, используемое медицинское оборудование и поверхности в помещениях стационара, с которыми соприкасается пациент). C. difficile является частью нормальной микрофлоры кишечника. Носителями спор C. difficile могут быть как пациенты, так и сотрудники медицинских организаций. Образование вегетативных форм может быть связано с индивидуальными особенностями организма (пациента или медицинского работника), нарушением состава кишечной микрофлоры, её индивидуальной стабильностью, а также со снижением количества представителей типов Firmicutes и Bacteroides.
Развитие клинической картины инфекции C. difficile обусловлено патогенными свойствами вегетативных форм, которые способны продуцировать экзотоксины: энтеротоксин А, цитотоксин В и бинарный токсин CDT. Некоторые штаммы C. difficile могут продуцировать токсины А и В, другие — только токсин А или бинарный токсин, реже — только токсин В. Наличие высокого титра антитоксических антител и колонизационная резистентность нормальной кишечной микрофлоры обеспечивают возможность клинически бессимптомных форм заболевания.
Этиологическая идентификация возбудителя C. difficile-ассоциированной инфекции актуальна при наличии клинических форм заболевания. Лабораторная диагностика C. difficile должна проводиться несколькими способами для повышения диагностической точности. В России в соответствии с клиническими рекомендациями2, а также с учётом клинических рекомендаций ACG [1] для проведения диагностики инфекции C. difficile рекомендован трёхэтапный алгоритм лабораторного подтверждения:
- Бактериологическим методом осуществляют выделение токсигенной культуры C. difficile и определяют её чувствительность к антибактериальным препаратам.
- Серологическими методами (иммунохроматографический анализ, иммуноферментный анализ) и методом полимеразной цепной реакции (ПЦР) в просветных фекалиях определяют содержание глутаматдегидрогеназы.
- Серологическими методами и методом ПЦР в просветных фекалиях определяют содержание токсинов А и В [2].
Золотым стандартом для установления этиологии заболевания считается бактериологический метод выделения чистой культуры и определение её цитотоксичности на культуре клеток. Однако определение токсинообразования выделенных штаммов C. difficile с помощью теста на выделенной культуре клеток обременительно для практических лабораторий в медицинских организациях, хотя обладает высокой чувствительностью и специфичностью. Кроме того, обнаружение чистой культуры C. difficile у пациентов с признаками острой кишечной инфекции не проводится, не включено в стандарты оказания медицинской помощи при кишечных инфекциях неустановленной этиологии, что существенно затрудняет своевременное установление диагноза при возникновении синдрома диареи в стационарных условиях в течение 48 ч от начала госпитализации или установления связи клинического эпизода диареи с нахождением в стационаре в последние 4 нед до него. Данные случаи возникновения заболевания должны быть расценены как ИСМП в случае как экзогенного, так и эндогенного инфицирования [3, 4].
Наиболее широко в лабораториях многопрофильных стационаров в России используется иммуноферментный анализ с определением токсинов А и В C. difficile в кале.
ПЦР в реальном времени (РВ-ПЦР) является высокочувствительным и приоритетным методом в связи с быстрым получением результата, используется в лабораторной диагностике в медицинских организациях, имеющих возможность проведения ПЦР, и предназначен для одновременного выявления и идентификации ДНК C. difficile + тoксин A + тoксин B в биологическом материале (кал). Комбинация метода ПЦР с другими методами позволяет повысить прогностическую ценность положительного результата [5].
Цель исследования — изучение частоты выявления C. difficile (как токсигенных, так и нетоксигенных штаммов) у пациентов гастроэнтерологического отделения многопрофильного стационара.
Материалы и методы
В гастроэнтерологическом отделении многопрофильного стационара ФНКЦ ФХМ им. Ю.М. Лопухина с 01.01.2021 по 31.12.2023 проведено ретроспективное наблюдательное открытое описательное исследование.
Объекты (участники) исследования
В исследование включены 547 человек обоих полов в возрасте 19–88 лет, из них 255 (46,6%) мужчин, 292 (53,4%) женщины. Средний койко-день пребывания пациентов в стационаре составил 9,44 сут.
Критерии включения в исследование: пациенты мужского и женского пола в возрасте 18–89 лет на момент включения в исследование, госпитализированные в гастроэнтерологическое отделение, имеющие клинические признаки синдрома диареи, с различными нозологическими группами, включая синдром раздражённого кишечника (кодирование по МКБ-10: К58), воспалительные заболевания кишечника: язвенный колит (К51), болезнь Крона (К50), энтероколит, вызванный C. difficile (А04.7), псевдомембранозный колит (К52.8) и мегаколон (К59.3).
Критерии невключения в исследование: пациенты с диареей без установленного диагноза; наличие признаков психических и поведенческих расстройств, не позволяющих осуществить сбор жалоб и анамнеза; иммунодефицитные состояния, в том числе ВИЧ-инфекция, трансплантация костного мозга или внутреннего органа или первичный иммунодефицит; сопутствующее заболевание, требующее госпитализации и/или хирургического вмешательства, или заболевание, которое считается угрожающим жизни, в течение 30 дней до и/или на момент включения в исследование по оценке исследователя; наличие в анамнезе тяжёлой алкогольной, лекарственной или наркотической зависимости.
Исследование проводилось при добровольном информированном письменном согласии пациентов. Протокол исследования одобрен локальным этическим комитетом ФНКЦ ФХМ им. Ю.М. Лопухина ФМБА России (протокол № 2022/05/31 от 31.05.2022).
Всем пациентам, включённым в исследование, было выполнено бактериологическое исследование кала, определение в кале ДНК C. difficile и генов, кодирующих токсины А и В (tcdA, tcdB), методом ПЦР. У пациентов с клиническими признаками бактериальной кишечной инфекции (сохранение фебрильной лихорадки на фоне проводимого лечения лихорадки более 3 сут, лейкоцитоз с наличием нейтрофильного сдвига лейкоцитарной формулы, появлением патологических примесей в стуле — крови, слизи) дополнительно было выполнено исследование крови на С-реактивный белок (СРБ).
Анализ кала на ДНК C. difficile и определение генов токсинов А и В
Для обеспечения стандартизации биоматериал (кал) для исследования на C. difficile забирали в первые 24 ч после поступления пациента в гастроэнтерологическое отделение стационара. Экстракцию ДНК из кала выполняли с использованием набора реагентов для выделения нуклеиновых кислот «НК-СОРБЕНТ» (НПФ «Литех»). До проведения ПЦР выделенная ДНК хранилась при –20°С.
Выявление и дифференциацию ДНК C. difficile и генов токсинов А и В выполняли с использованием набора реагентов «Флуороплекс Clostridioides difficile + Toxin A +Toxin B» (НПФ «Литех») методом РВ-ПЦР на амплификаторе «CFX96» («Bio-Rad Laboratories»). Для контроля качества выделения ДНК, а также предотвращения возникновения ложноотрицательных результатов в наборе использовался внутренний экзогенный контроль (детектируемый по каналу HEX), который вносится в исследуемые образцы на этапе экстракции ДНК. РВ-ПЦР проводили в следующем режиме: 80°С — 2 мин, 95°С — 1 мин 30 с, затем 40 циклов: 95°С — 15 с, 60°С — 30 с, 72°С — 40 с. Всего было протестировано 547 образцов ДНК.
Бактериологический посев кала
Анализ проводили согласно методическим рекомендациям «Бактериологическая диагностика дисбактериоза» (утв. 14.04.1977) и ОСТ 91500.11.0004-2003 «Протокол ведения больных. Дисбактериоз кишечника». Один грамм нативного образца кала гомогенизировали в 9 мл физиологического раствора (1/10), оставляли при комнатной температуре на 10–15 мин. Из исходного разведения (101) готовили ряд последующих разведений до 108. Далее полученную суспензию высевали на питательные среды для культивирования различных групп микроорганизмов.
Бактериологический анализ оценивали:
- через 20–22 ч на средах Эндо, кровяной агар, SS- и XLD-агар;
- через 48 ч на средах Сабуро, желточно-солевой агар и молочно-ингибиторной;
- через 72 ч на средах Блаурокк, МРС-2, железосульфитный агар.
Статистический анализ
Размер выборки предварительно не рассчитывали. Статистическую обработку результатов осуществляли с помощью программы «SPSS Statistics v. 27» («IBM»). Для анализа оценки распространённости токсигенных и нетоксигенных штаммов использовали такие показатели, как частота выявленной заболеваемости и структура заболеваемости (удельный вес). Количественные показатели оценивали на предмет соответствия нормальному распределению. Частоту встречаемости признака в группе описывали в виде процентного содержания. Для представления данных использовали методы описательной статистики (абсолютные значения, проценты). Ввиду описательного характера анализа динамики показателей мониторинга за 2021–2023 гг. расчёт статистической значимости различий не проводили.
Результаты
Основные результаты исследования
В проведённом нами исследовании по результатам РВ-ПЦР ДНК C. difficile была выявлена у 65 пациентов (34 — мужского пола, 31 — женского), что составило 11,9%, при этом гены токсинов А и В обнаружены у 32 (5,9%) пациентов. Нетоксигенные штаммы C. difficile преимущественно обнаружены у мужчин (55%) в возрасте до 40 лет. Токсигенные штаммы C. difficile (несущие гены токсинов А и В) с одинаковой частотой встречались у мужчин и женщин в возрасте до 40 лет.
Анализ частоты встречаемости инфекции в 2021–2023 гг. показал рост количества пациентов с C. difficile с 6,6 до 7,9%. Частота обнаружения токсигенных штаммов C. difficile также увеличилась с 5,2 до 7,9% (таблица).
Выявляемость токсигенных и нетоксигенных штаммов C. difficile у пациентов в период наблюдения 2021–2023 гг. (на 547 обследованных)
Анализ | 2021 г. | 2022 г. | 2023 г. | Итого пациентов | |||
количество пациентов | % | количество пациентов | % | количество пациентов | % | ||
Выявлены нетоксигенные штаммы C. difficile | 14 | 6,6 | 6* | 3,5 | 13 | 7,9 | 33 |
Выявлены токсигенные штаммы C. difficile (токсины A и B) | 11* | 5,2 | 8 | 4,7 | 13 | 7,9 | 32 |
Не обнаружены штаммы C. difficile | 186 | 88,2 | 157 | 91,8 | 139 | 84,2 | 482 |
Всего пациентов | 211 | 171 | 165 | 547 | |||
Примечание. *Один пациент госпитализирован дважды: первый раз — в 2021 г., затем независимо второй раз в 2022 г.
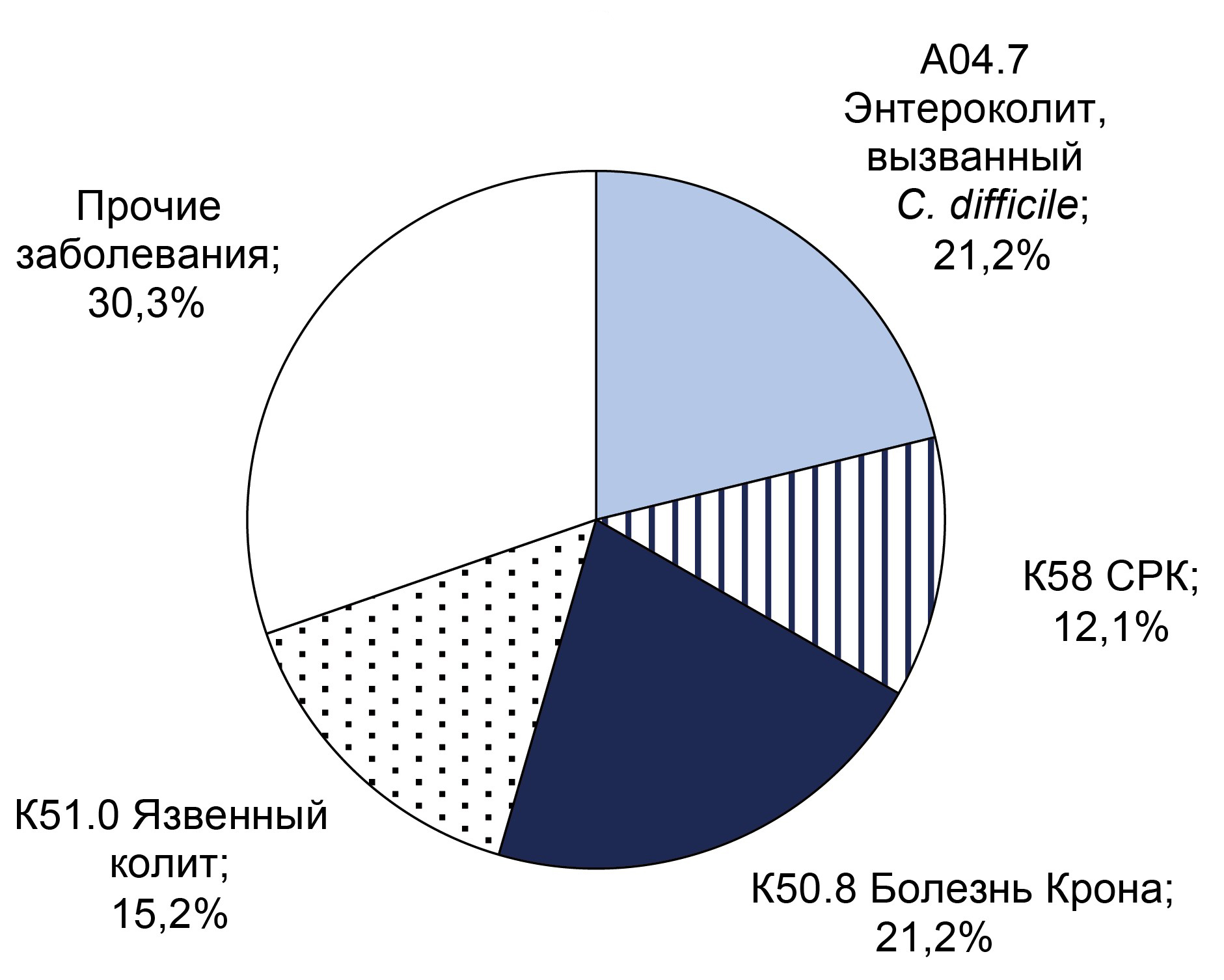
Соотношение частоты различных заболеваний среди пациентов с установленной инфекцией C. difficile представлено на рисунке.
Распределение подтверждённых диагнозов в группе пациентов с диагностированными нетоксигенными (а) и токсигенными (б) штаммами C. difficile.
Нетоксигенные штаммы C. difficile (n = 33) выявлены в группе пациентов с энтероколитом, вызванным C. difficile, у 7 (21,2%) пациентов с болезнью Крона, 5 (15,2%) пациентов с язвенным колитом, 4 (12,1%) пациентов с синдромом раздражённого кишечника. В 10 (30,3%) случаях нетоксигенные штаммы C. difficile были выявлены у пациентов с различными заболеваниями желудочно-кишечного тракта, включая язвенный колит, хронический панкреатит, стеатогепатит, язву желудка и др.
Токсигенные штаммы C. difficile (n = 32) выявлены у 17 (53,1%) пациентов с установленным диагнозом энтероколита, вызванного C. difficile, 5 (15,6%) пациентов с болезнью Крона, у 4 (12,5%) пациентов с язвенным колитом. Также токсигенные штаммы C. difficile были выявлены у 6 (18,8%) пациентов с язвенными поражениями отделов толстого кишечника.
Биохимические показатели крови
Биохимическое исследование крови на СРБ было выполнено 49 из 65 пациентов, у которых выявлены штаммы C. difficile. СРБ выше нормальных показателей (0–5 мг/л) диагностирован у 22 пациентов (группа с токсигенными штаммами C. difficile — 11 человек, из них 8 мужчин и 3 женщины; группа с нетоксигенными штаммами C. difficile — 11 человек, из них 6 мужчин и 5 женщин) и находится в пределах 6,53–240,9 мг/л. Высокий уровень СРБ наблюдался у пациентов мужского пола: превалирующее заболевание (45%) — среди пациентов (мужчин) с токсигенным штаммом — энтероколит, вызванный C. difficile (5 из 11 человек в возрасте старше 40 лет), в группе с нетоксигенными штаммами наибольшее количество мужчин (36,4%) имели диагноз язвенный колит (4 из 11 человек в возрасте 40–60 лет). Данные результаты свидетельствуют о том, что воспалительный процесс чаще развивается у пациентов старше 40 лет при различных формах колитов.
Бактериологический анализ кала
Развёрнутый бактериологический анализ на дисбиоз кишечника по клиническим показаниям был выполнен 36 (55,4%) пациентам с положительным ПЦР-анализом на C. difficile. У всех пациентов наблюдались выраженные нарушения баланса микрофлоры кишечника (нормофлоры): снижение облигатно-анаэробной микрофлоры (рода бифидо- и лактобактерий в ряде случаев снижены значительно), сдвиг соотношения лактозопозитивных и лактозонегативных кишечных палочек в сторону последних, появления гемолитически активной кишечной палочки, снижение общего количества энтерококков. В ходе микробиологического исследования обсеменённость сульфитредуцирующими анаэробами рода клостридий выявлена выше нормы (≤ 106) у 20 (55,6%) пациентов. У 18 (50%) пациентов выявлена повышенная обсеменённость условно-патогенной микрофлорой, в том числе Proteus spp., Klebsiella spp., Citrobacter spp., Enterobacter spp., Acinetobacter spp., Staphylococcus aureus. При этом у 13 (36%) пациентов обнаружена повышенная представленность грибов рода Candida, что свидетельствует о нарушениях баланса кишечной микрофлоры, вызванных в том числе антибиотикотерапией.
Лечение C. difficile-ассоциированной инфекции в стационаре
Из 65 пациентов гастроэнтерологического отделения, включённых в исследование, у которых была выявлена ДНК C. difficile, 24 (36,9%) в качестве препарата 1-й линии антибактериальной терапии был назначен ванкомицин в дозировке 1 г/сут перорально в течение 10–14 дней. Из пациентов, получающих данную схему терапии, 18 имели токсигенные штаммы C. difficile, 6 — нетоксигенные.
Для лечения рецидивирующей инфекции C. difficile 6 пациентам (4 женщины и 2 мужчин в возрасте до 60 лет) с диагнозом «энтероколит, вызванный C. difficile», была выполнена трансплантация фекальной микробиоты (ТФМ) в терминальный отдел двенадцатиперстной кишки через инструментальный канал эндоскопа.
Повторные обращения (рецидивы заболевания)
Повторная госпитализация пациентов, включённых в микробиологический мониторинг в 2021–2023 гг., с выявленной ДНК C. difficile зафиксирована у 9 (13,8% — 6 женщин и 3 мужчин) из 65 наблюдаемых. Среди них у 5 пациентов первично выявлены нетоксигенные штаммы C. difficile, у 4 — токсигенные. Повторное обращение в стационар было у пациентов с болезнью Крона (3 пациента с нетоксигенными штаммами, 1 — с токсигенным), язвенным колитом (2 пациента с нетоксигенными штаммами, 2 — с токсигенными), энтероколитом, вызванным токсигенным штаммом (1 пациент).
Обсуждение
Обобщение результатов исследования
Включение в исследование пациентов гастроэнтерологического отделения с синдромом диареи позволило нам сформировать выборку лиц с признаками активной инфекции C. difficile. Выбранная нами тактика согласуется с международным опытом тестирования на инфекцию C. difficile в стационаре. Так, по мнению ACG, необходимо тестировать лиц с указанием в анамнезе на 3 или более неоформленных стула в течение 24 ч, в том числе с высоким индексом коморбидности (пациентов онкологических, гематологических отделений и отделений трансплантологии), а также пациентов с признаками кишечной непроходимости [6, 7]. Результаты проведённого нами исследования свидетельствуют об увеличении числа случаев регистрации инфекции C. difficile в гастроэнтерологическом отделении стационара в 2021–2023 гг. с 6,6 до 7,9%, в том числе доля образцов, положительных на гены токсинов A и B C. difficile, увеличилась с 5,2 до 7,9%. Увеличение числа случаев регистрации инфекции C. difficile в 2021–2023 гг. может быть обусловлено пандемией новой коронавирусной инфекции. В исследовании Т. Zuo и соавт. сделан вывод о неблагоприятном воздействии течения коронавирусной инфекции на микрофлору кишечника, снижении колонизационной резистентности против C. difficile [8].
Особые опасения вызывает включение C. difficile в группу ESKAPE-патогенов и способность формировать госпитальные штаммы (клоны). Кроме заболеваний, напрямую связанных с C. difficile, таких как энтероколит, вызванный C. difficile, псевдомембранозный колит и мегаколон, существуют и другие нозологии, при которых присоединение инфекции C. difficile может служить отягчающим фактором, например, болезнь Крона, язвенный колит [9]. Таким образом, актуальным является эпидемиологический и микробиологический мониторинг встречаемости C. difficile у пациентов гастроэнтерологического отделения как с признаками синдрома диареи, так и при наличии факторов риска. Развитие инфекции C. difficile у пациентов может быть связано с эндогенными причинами (развитие клинических признаков заболевания у бессимптомных носителей при избыточной колонизации C. difficile и продукции токсинов), а также с оказанием медицинской помощи [10]. M. Sartelli и соавт. сообщают, что за последние 20 лет наблюдается рост внебольничных случаев инфекции (до 25–28% случаев C. difficile-ассоциированной инфекции) [11].
Выявление токсигенных и нетоксигенных штаммов
Являясь частью нормальной микрофлоры кишечника, C. difficile может не вызывать заболевание. В нашем исследовании, поскольку все пациенты имели синдром диареи, выявление исключительно нетоксигенных штаммов C. difficile (без генов токсинов) интерпретировалось как свидетельство того, что текущий эпизод диареи, вероятно, не связан с C. difficile, а вызван иными причинами (другими инфекционными агентами, обострением основного заболевания, лекарственными воздействиями и др.). Обнаружение нетоксигенных штаммов не всегда ассоциировано с наличием инфекционного заболевания, но имеются сведения о бессимптомном носительстве C. difficile как предрасполагающем факторе к развитию клинически развёрнутой инфекции C. difficile [12]. Выявлены географические различия частоты бессимптомного носительства C. difficile у взрослых госпитализированных пациентов от 4,4 до 23,2% [13]. Обнаружение токсигенных штаммов C. difficile у поступивших пациентов связано с почти в 6 раз более высоким риском развития клинически развернутой инфекции. Частота обнаружения токсигенных штаммов C. difficile у госпитализированных в стационар в многоцентровом исследовании I.M. Zacharioudakis и соавт. составила 8,1% 14]. В проведённом нами исследовании частота обнаружения токсигенных штаммов C. difficile в гастроэнтерологическом отделении многопрофильного стационара в 2023 г. составила 7,9%.
Исследование уровня СРБ
Использование стандартных лабораторных тестов в диагностике инфекции C. difficile и определении степени её тяжести, таких как маркеры системного воспалительного ответа, включая СРБ, позволяет определить группу пациентов с возможным развитием тяжёлого течения и неблагоприятным прогнозом.
Бактериологический анализ кала
В исследование нами были включены пациенты со взрослым состоянием микрофлоры кишечника, что предполагает наличие у неё основных характеристик: разнообразия, устойчивости, способности достигать стабильности. Сообщается о значительном снижении разнообразия и устойчивости кишечной микрофлоры при инфекции C. difficile, а также снижении количества представителей облигатной микробиоты (Firmicutes, Bacteroidetes и Actinobacteria) [15, 16]. Кроме того, отмечено преобладание количества протеобактерий (особенно Enterobacteriaceae). По результатам бактериологического исследования кала в нашем исследовании отмечено наличие дисбаланса кишечной микрофлоры, в том числе преобладание количества Proteus spp., Klebsiella spp., Citrobacter spp., Enterobacter spp., Acinetobacter spp., Staphylococcus aureus.
Лечение C. difficile-ассоциированной инфекции в стационаре
Выбор антиклостридиальной терапии согласно российским клиническим рекомендациям осуществляется в соответствии со степенью тяжести заболевания. Для лечения первого нетяжёлого эпизода у пациентов с благоприятным прогнозом (молодой возраст пациента, отсутствие признаков иммунодефицитного состояния и хронических заболеваний) может быть использован метронидазол в дозе 500 мг 3 раза в день в течение 10 дней. Для лечения первого нетяжёлого эпизода инфекции C. difficile у других групп пациентов рекомендуется использовать ванкомицин в дозе 250 мг 4 раза в день в течение 10 дней.
ТФМ имеет все ещё низкий уровень достоверности доказательств и слабый уровень убедительности рекомендаций, но рекомендована к применению при тяжёлой и фульминантной формах инфекции C. difficile, резистентной к стандартной антибактериальной терапии. Имеющиеся результаты обсервационных исследований позволяют использовать алгоритмы ТФМ [17]. Так, в случае тяжёлого или фульминантного течения инфекции, рефрактерного к терапии ванкомицином в комбинации с внутривенным введением метронидазола в течение 5 дней, пациенту показана ТФМ с использованием видеоколоноскопии. Результаты рандомизированного клинического исследования, выполненного G. Ianiro и соавт., свидетельствуют об эффективном использовании данного алгоритма в комбинации с 14-дневным курсом ванкомицина, что позволило достигнуть излечения в 75% случаев при проведении даже одного курса ТФМ и в 100% случаев — при выполнении нескольких процедур ТФМ [18]. Однако проведение ТФМ возможно при наличии доступа к банку замороженных образцов фекальной микробиоты.
В нашем исследовании 24 (36,9%) из 65 пациентов гастроэнтерологического отделения, включённых в исследование, у которых была выявлена ДНК C. difficile, проведена антибактериальная терапия ванкомицином в дозировке 1 г/сут перорально. При отсутствии положительной клинико-лабораторной динамики для лечения рецидивирующей инфекции C. difficile 6 пациентам была выполнена ТФМ. Клинический эффект достигнут у всех пациентов, повторных обращений в отделение стационара не регистрировалось. Полученные нами данные свидетельствуют о том, что метод ТФМ является крайне перспективным для лечения инфекций C. difficile, что согласуется в том числе с данными литературы [19–21].
Заключение
В результате трёхлетнего мониторинга установлено увеличение доли пациентов с C. difficile с 6,6 до 7,9%. Доля образцов, положительных на гены токсинов A/B C. difficile, также увеличилась с 5,2 до 7,9%. Таким образом, необходимо проводить профилактические мероприятия для уменьшения влияния факторов риска развития развитии C. difficile-ассоциированной инфекции в стационаре.
Выявление инфекции C. difficile среди пациентов различных нозологических групп свидетельствует о необходимости проведения исследования на инфекцию C. difficile всем пациентам с синдромом диареи. Для повышения диагностической точности и установления окончательного этиологического диагноза диареи необходимо использовать комбинацию методов идентификации. Единственный диагностический метод, который можно использовать без комбинации с другими методами, — это ПЦР, который на сегодня является самым высокочувствительным и приоритетным методом диагностики инфекции C. difficile. Включение ПЦР в клинические рекомендации по инфекции C. difficile и критерии качества по оказанию медицинской помощи больным с инфекцией C. difficile будет способствовать своевременному установлению клинического диагноза, точному применению и выбору схем антиклостридиальной терапии, снижению общей заболеваемости и смертности от ИСМП в стационаре.
Отдельным вопросом эпидемиологического и микробиологического мониторинга в медицинской организации остаётся мониторинг за отсутствием признаков заболевания или латентной инфекции у медицинских работников, осуществляющих профессиональную деятельность, а также за объектами внешней среды (аппаратура для диагностики и лечения, зонды для кормления и др.), которые могут быть контаминированы C. difficile, что особенно актуально для гастроэнтерологических отделений и будет учтено в первую очередь при планировании наших дальнейших, более детальных исследований в области эпидемиологии и профилактики инфекции C. difficile в стационаре.
Исключение факторов риска C. difficile-ассоциированной инфекции, в первую очередь разумное применение схем антибактериальной терапии в лечении пациентов, является главным профилактическим мероприятием, а основным способом профилактики рецидивов — поддержка диспозиционных свойств пациента, в частности, повышение колонизационной резистентности кишечника.
1 Методические рекомендации «Эпидемиологическая диагностика инфекционных болезней, связанных с оказанием медицинской помощи, на основе стандартных определений случая». 2024. URL: https://nasci.confreg.org/libs/files/mr_sos.pdf (дата обращения: 08.06.2025).
2 Клинические рекомендации «Клостридиальная инфекция: диагностика, лечение и профилактика». 2022. URL: https://www.rnmot.ru/public/uploads/RNMOT/clinical/2022/ФИНАЛЬНЫЕ%20КЛИНИЧЕСКИЕ%20РЕКОМЕНДАЦИИ%20Клостридиальная%20инфекция%209112022.pdf (дата обращения: 08.06.2025).
Об авторах
Алина Владимировна Господарик
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Автор, ответственный за переписку.
Email: alina.gospodaryk@rcpcm.org
ORCID iD: 0009-0003-7870-1106
канд. биол. наук, н. с. Центра молекулярной медицины и диагностики
Россия, МоскваНаталья Дмитриевна Прохорова
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Email: yfnecz510@yandex.ru
ORCID iD: 0000-0001-6485-1056
м. н. с. Центра молекулярной медицины и диагностики
Россия, МоскваВиктория Кирилловна Куликова
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Email: v.k.kulikova@gmail.com
ORCID iD: 0009-0002-7592-9108
лаборант-исследователь Центра молекулярной медицины и диагностики
Россия, МоскваТатьяна Николаевна Калачнюк
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Email: ktn-25@mail.ru
ORCID iD: 0009-0002-6953-6818
канд. мед. наук, зав. отд. гастроэнтерологии
Россия, МоскваНиколай Иванович Хромых
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Email: khromykh.nikolya@mail.ru
ORCID iD: 0009-0001-6806-3548
биолог Центра молекулярной медицины и диагностики
Россия, МоскваЮлия Витальевна Кудрявцева
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Email: vitolga10@mail.ru
ORCID iD: 0009-0001-6713-5140
лаборант-исследователь Центра молекулярной медицины и диагностики
Россия, МоскваЮлия Андреевна Беспятых
Федеральный научно-клинический центр физико-химической медицины имени академика Ю.М. Лопухина
Email: juliabes@rcpcm.org
ORCID iD: 0000-0002-4408-503X
канд. биол. наук, доцент, зав. лаб. молекулярной медицины, рук. Центра молекулярной медицины и диагностики
Россия, МоскваСписок литературы
- Kelly C.R., Fischer M., Allegretti J.R., et al. ACG clinical guidelines: prevention, diagnosis, and treatment of Сlostridioides difficile infections. Am. J. Gastroenterol. 2021;116(6): 1124–47. DOI: https://doi.org/10.14309/ajg.0000000000001278
- Khuvis J., Alsoubani M., Mae Rodday A., Doron S. The impact of diagnostic stewardship interventions on Clostridiodes difficile test ordering practices and results. Clin. Biochem. 2023;117: 23–9. DOI: https://doi.org/10.1016/j.clinbiochem.2022.03.009
- Solanky D., Juang D.K., Johns S.T., et al. Using diagnostic stewardship to reduce rates, healthcare expenditures and accurately identify cases of hospital-onset Clostridioides difficile infection. Infect. Control Hosp. Epidemiol. 2021;42(1):51–6. DOI: https://doi.org/10.1017/ice.2020.375
- Doll M., Marra A.R., Apisarnthanarak A., et al. Prevention of Clostridioides difficile in hospitals: а position paper of the International Society for Infectious Diseases. Int. J. Infect. Dis. 2021;102:188–95. DOI: https://doi.org/10.1016/j.ijid.2020.10.039
- Johnson S., Lavergne V., Skinner A.M., et al. Clinical practice guideline by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA): 2021 focused update guidelines on management of Clostridioides difficile infection in adults. Clin. Infect. Dis. 2021;73(5):e1029–44. DOI: https://doi.org/10.1093/cid/ciab549
- Kelly C.R., Fischer M., Allegretti J.R., et al. ACG clinical guidelines: prevention, diagnosis, and treatment of Clostridioides difficile infections. Am. J. Gastroenterol. 2021;116(6):1124–47. DOI: https://doi.org/10.14309/ajg.0000000000001278
- Захаренко С.М. Clostridioides difficile: название новое, проблемы диагностики и терапии прежние. Альманах клинической медицины. 2022;50(6):377–91. Zakharenko S.M. Clostridioides difficile – a new name, the old problems with diagnosis and treatment. Almanac of Clinical Medicine. 2022;50(6):377–91. DOI: https://doi.org/10.18786/2072-0505-2022-50-048 EDN: https://elibrary.ru/dqvpmx
- Zuo T. et al. Alterations in gut microbiota of patients with COVID-19 during time of hospitalization. Gastroenterology. 2020;159(3):944–55.e8. DOI: https://doi.org/10.1053/j.gastro.2020.05.048
- Zaver H.B., Moktan V.P., Harper E.P., et al. Reduction in health care facility-onset Clostridioides difficile infection: a quality improvement initiative. Mayo Clin. Proc. Innov. Qual. Outcomes. 2021;5(6):1066–74. DOI: https://doi.org/10.1016/j.mayocpiqo.2021.09.004
- Волчкова Е.В., Белоусова Е.А., Макарчук П.А. и др. Частота выявления инфекции Clostridium difficile в больничных условиях. Альманах клинической медицины. 2014;(33):71–6. Volchkova E.V., Belousova E.A., Makarchuk P.A., et al. Frequency of detection of Clostridium difficile infection in hospital conditions. Almanac of Clinical Medicine. 2014;(33):71–6. EDN: https://elibrary.ru/sxyjwn
- Sartelli M., Di Bella S., McFarland L.V., et al. 2019 update of the WSES guidelines for management of Clostridioides (Clostridium) difficile infection in surgical patients. World J. Emerg. Surg. 2019;14:8. DOI: https://doi.org/10.1186/s13017-019-0228-3
- Solbach P., Chhatwal P., Woltemate S., et al. Microbiota-associated risk factors for Clostridioides difficile acquisition in hospitalized patients: a prospective, multicentric study. Clin. Infect. Dis. 2021;73(9):e2625–34. DOI: https://doi.org/10.1093/cid/ciaa871
- Hung Y.P., Lee J.C., Lin H.J., et al. Clinical impact of Clostridium difficile colonization. J. Microbiol. Immunol. Infect. 2015;48(3):241–8. DOI: https://doi.org/10.1016/j.jmii.2014.04.011
- Zacharioudakis I.M., Zervou F.N., Pliakos E.E., et al. Colonization with toxinogenic C. difficile upon hospital admission, and risk of infection: a systematic review and meta-analysis. Am. J. Gastroenterol. 2015;110(3):381–90. DOI: https://doi.org/10.1038/ajg.2015.22
- Amrane S., Hocquart M., Afouda P., et al. Metagenomic and culturomic analysis of gut microbiota dysbiosis during Clostridium difficile infection. Sci. Rep. 2019;9(1):12807. DOI: https://doi.org/10.1038/s41598-019-49189-8
- Magne F., Gotteland M., Gauthier L., et al. The firmicutes/bacteroidetes ratio: a relevant marker of gut dysbiosis in obese patients? Nutrients. 2020;12(5):1474. DOI: https://doi.org/10.3390/nu12051474
- Fischer M., Kao D., Kassam Z., et al. Stool donor body mass index does not affect recipient weight after a single fecal microbiota transplantation for Clostridium difficile infection. Clin. Gastroenterol. Hepatol. 2018;16(8):1351–3. DOI: https://doi.org/10.1016/j.cgh.2017.12.007
- Ianiro G., Masucci L., Quaranta G., et al. Randomised clinical trial: faecal microbiota transplantation by colonoscopy plus vancomycin for the treatment of severe refractory Clostridium difficile infection-single versus multiple infusions. Aliment. Pharmacol. Ther. 2018;48(2):152–9. DOI: https://doi.org/10.1111/apt.14816
- Акиньшина А.И., Смирнова Д.В., Загайнова А.В. и др. Перспективы использования методов коррекции микробиоты при терапии воспалительных заболеваний кишечника. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(2):12–22. Akinshina A.I., Smirnova D.V., Zagainova A.V., et al. Prospects of using microbiota correction methods in the treatment of inflammatory bowel disease. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2019;29(2):12–22. DOI: https://doi.org/10.22416/1382-4376-2019-29-2-12-22 EDN: https://elibrary.ru/zgxuip
- Щербаков П.Л., Белова Н.Д., Генерозов Э.В. и др. Применение фекальной трансплантации в лечении заболеваний пищеварительного тракта (первый клинический опыт). Доктор.Ру. 2019;(3):40–6. Scherbakov P.L., Belova N.D., Generozov E.V., et al. Faecal transplant in git treatment (pilot clinical experience). Doctor.Ru. 2019;(3):40–6. DOI: https://doi.org/10.31550/1727-2378-2019-158-3-40-46 EDN: https://elibrary.ru/bsrtsj
- Woodworth M.H., Carpentieri C., Sitchenko K.L., Kraft C.S. Challenges in fecal donor selection and screening for fecal microbiota transplantation: a review. Gut Microbes. 2017;8(3): 225–37. DOI: https://doi.org/10.1080/19490976.2017.1286006
Дополнительные файлы