Клиническое исследование иммуногенности и защитной активности живой рекомбинантной вакцины «ГамЖВК» интраназального применения для профилактики коклюша у взрослых добровольцев
- Авторы: Лиджиева А.А.1, Медкова А.Ю.1, Куликов С.В.1, Синяшина Л.Н.1, Сюндюкова Р.А.1, Марков А.П.1, Верведа А.Б.2,3, Абаева Н.Е.4, Чернышова И.Н.4, Гаврилова М.В.1,4, Бушкова К.К.4, Дьяков И.Н.1,4, Каратаев Г.И.1
-
Учреждения:
- Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
- Научно-исследовательский институт промышленной и морской медицины
- Научно-исследовательский центр Эко-безопасность
- Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
- Выпуск: Том 101, № 6 (2024)
- Страницы: 779-793
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18724
- DOI: https://doi.org/10.36233/0372-9311-585
- EDN: https://elibrary.ru/vzqpli
- ID: 18724
Цитировать
Аннотация
Введение. Рост заболеваемости коклюшем в мире, недостаточная продолжительность, эффективность и неспособность иммунитета, индуцированного бесклеточной коклюшно-дифтерийно-столбнячной вакциной, обеспечить противобактерийную защиту и предотвратить передачу возбудителя от человека к человеку обосновывают необходимость разработки новых противококлюшных вакцин. Живая коклюшная вакцина «ГамЖВК» интраназального применения прошла доклинические исследования в экспериментах с низшими приматами и две стадии клинических исследований на взрослых добровольцах, доказавшие её безопасность, иммуногенность и защитную активность. Отработаны метод и схема введения препарата.
Цель работы — подтверждение иммуногенности и защитной противобактерийной активности «ГамЖВК» в рандомизированном многоцентровом клиническом исследовании на взрослых добровольцах.
Материалы и методы. В многоцентровом клиническом рандомизированном плацебо-контролируемом двойном слепом исследовании приняли участие 260 здоровых добровольцев в возрасте 18–65 лет. Из них 210 человек были рандомизированы в группу вакцинированных «ГамЖВК» и 50 человек — в группу плацебо. Препарат «ГамЖВК» вводили дважды в каждый носовой ход по 0,25 мл (5 × 109 КОЕ) с интервалом 60 дней. Методом иммуноферментного анализа и реакции агглютинации определяли уровни специфичных к Bordetella pertussis IgG-, IgA-антител в сыворотке крови и IgA в назальных аспиратах. Методом полимеразной цепной реакции в реальном времени измеряли число геном-эквивалентов B. pertussis в ротоглоточных смывах для оценки динамики элиминации аттенуированных бактерий B. pertussis после первого и повторного введения «ГамЖВК» добровольцам.
Результаты. Показаны достоверные сероконверсия по специфическим IgG и IgА в крови и рост уровня секреторных IgА в назальных аспиратах добровольцев. Динамика изменения содержания IgG и IgА указывает на бустерный эффект после повторной вакцинации. Аттенуированные бактерии B. pertussis персистируют в носо- и ротоглотке вакцинированных. Время выведения бактерий после 2-й вакцинации сокращается более чем в 2 раза в сравнении с 1-м введением, при этом количество персистирующих бактерий после 2-й вакцинации составляет менее 3% от значений после 1-й вакцинации.
Заключение. Доказаны высокая иммуногенность и формирование противобактерийной защиты после однократной и двукратной интраназальной вакцинации добровольцев «ГамЖВК».
Полный текст
Введение
Коклюш — высококонтагиозное инфекционное заболевание, передающееся воздушно-капельным путём, контролируемое с помощью вакцинопрофилактики. Вакцинация против коклюша входит в календари обязательных прививок большинства стран мира, начиная с раннего детского возраста. По данным Всемирной организации здравоохранения, в настоящее время 42 страны используют для профилактики коклюша бесклеточные коклюшно-дифтерийно-столбнячные вакцины (АаКДС), содержащие бесклеточный коклюшный компонент (БКВ), а 143 — коклюшно-дифтерийно-столбнячную адсорбированную вакцину, содержащую корпускулярный коклюшный компонент. Однако начиная с 2000-х гг. массовое использование БКВ в экономически развитых странах привело к росту заболеваемости коклюшем в этих странах, приближающемуся в отдельные годы к уровню довакцинного периода [1]. Изменилась возрастная структура в сторону увеличения процента заболеваемости среди подростков и взрослых [2]. Рост заболеваемости коклюшем среди старших детей и взрослого населения привёл к пониманию необходимости их ревакцинации. Изучается целесообразность вакцинации беременных [3], матерей и близких родственников для формирования «семейного иммунитета», предотвращающего инфицирование младенцев [4]. В качестве одной из причин роста заболеваемости рассматривают низкую эффективность и непродолжительность иммунитета после вакцинации БКВ, а также их неспособность формировать противобактерийный иммунитет [5]. Реактогенность корпускулярного коклюшного компонента и низкая эффективность БКВ стимулируют разработку новых препаратов, способных индуцировать длительный противобактерийный иммунитет, не травмирующих организм при вакцинации и удобных для массового применения.
В НИЦЭМ им. Н.Ф. Гамалеи разработана живая рекомбинантная вакцина интраназального применения для профилактики коклюша, названная «ГамЖВК». Вакцина «ГамЖВК» к настоящему времени прошла доклинические исследования и II фазу клинических исследований на взрослых здоровых добровольцах, доказавшие её безопасность, иммуногенность и защитную активность, отработаны способ и схема введения препарата [6–10]. Аналогичная рекомбинантная живая коклюшная вакцина (BPZE1), разработанная во Франции, находится на стадии клинических исследований [11–13].
Целью настоящей работы является подтверждение иммуногенности и защитной активности вакцины «ГамЖВК» при двукратном применении у взрослых добровольцев в возрасте 18–65 лет в многоцентровом клиническом исследовании.
Материалы и методы
Дизайн исследования
Проведено рандомизированное плацебо-контролируемое слепое многоцентровое клиническое исследование, посвящённое изучению иммуногенности и безопасности живой вакцины «ГамЖВК» по Протоколу клинического исследования № 03-ГамЖВК-2021, версия 3 от 28.01.2021, разрешение Министерства здравоохранения России № 277 от 08.06.2021.
Протокол клинического исследования № 03-ГамЖВК-2021 был одобрен Советом по этике при Министерстве здравоохранения РФ (выписка № 277 от 08.06.2021), а также локальными этическими комитетами:
- Этическим комитетом ИКБ № 1 ДЗМ (протокол заседания № 5 от 08.12.2021);
- Комитетом по вопросам этики при ООО «НИЦ Эко-безопасность» (выписка № 5 из протокола заседания № 221 от 20.01.2022; выписка № 2 из протокола заседания № 222 от 27.01.2022).
Ниже приведены критерии включения и невключения, значимые для оценки иммуногенности используемой вакцины и бактериальной нагрузки в носоглоточных аспиратах. Полный перечень критериев включения, невключения, досрочного исключения добровольца из исследования, состав и способ введения препарата, критериев оценки иммуногенности и эффективности препарата в соответствии с Протоколом представлены в Приложении к статье на сайте журнала.
При составлении протокола в исследования в качестве одного из критериев включения использовали уровень IgG-антител к Bordetella pertussis на момент включения. При этом диапазон значений уровня IgG-антител определяли на основании данных, полученных с использованием тест-системы «Ridascreen». Согласно указанной системе серонегативными (СН) считались добровольцы с уровнем IgG-антител менее 14 ЕД/мл, уровень антител считался неопределённым («серая зона», СЗ) в диапазоне от 14 до менее 18 ЕД/мл, и серопозитивными (СП) считались добровольцы с уровнем IgG-антител 18 ЕД/мл и более. Согласно протоколу в исследование могли включать добровольцев как СН, так и слабо- и умеренно-СП — с уровнем IgG-антител не выше 45 ЕД/мл. К моменту включения добровольцев в исследование тест-система «Ridascreen» была заменена на тест-систему «ESR120G» («Virion/Serion GmbH») в связи с организационными трудностями, связанными с отсутствием тест-системы «Ridascreen» на территории России. Согласно инструкции к набору «ESR120G» («Virion/Serion GmbH») СН считаются образцы с уровнем антител менее 40 МЕ/мл, СЗ — 40–50 МЕ/мл, СП — более 50 МЕ/мл. Уровень IgG-антител, равный 45 EД/мл при определении с помощью набора «Ridascreen», при пересчёте эквивалентен уровню IgG-антител, равному 126 МЕ/мл при определении с использованием набора «ESR120G» («Virion/Serion GmbH»).
Критерии включения: мужчины и женщины в возрасте 18–65 лет; стабильное с медицинской точки зрения состояние, отсутствие специфических антител IgM к возбудителю коклюша, уровень специфических к возбудителю коклюша IgG < 126 МЕ/мл («SERION ELISA classic ESR120G»), отсутствие ДНК B. pertussis в назофарингеальных аспиратах, подтверждённое методом полимеразной цепной реакции (ПЦР).
Критерии невключения: наличие коклюша в анамнезе; перенесённая вакцинация против коклюша в течение последних 10 лет, а также любая вакцинация в течение последнего года; любое заболевание, которое, по мнению исследователя, может повлиять на результаты исследования или может привести к ухудшению состояния здоровья в ходе исследования; зарегистрированные сильные поствакцинальные осложнения в анамнезе; курсовой приём лекарственных препаратов с профилактической или лечебной целью в течение 1 мес до скрининга; участие в других клинических исследованиях, наличие специфических IgM к возбудителю коклюша, уровень специфических IgG > 126 МЕ/мл («SERION ELISA classic ESR120G»), наличие ДНК B. pertussis в назофарингеальных/ротоглоточных аспиратах.
Обследование добровольцев и рандомизация
Все добровольцы, участвовавшие в исследовании, подписали форму добровольного информированного согласия, после чего им присвоен номер и проведены скрининговые исследования. Соответствие всем критериям включения/невключения было подтверждено до включения добровольцев в исследование. Популяцию исследования составили 260 добровольцев мужского и женского пола в возрасте 18–65 лет (включительно), отобранных в соответствии с критериями включения и не имеющих критериев невключения. Добровольцы распределены на 2 группы: получивших препарат «ГамЖВК» (группа «вакцинированные»; n = 210) и получивших плацебо (группа «плацебо»; n = 50) в соответствии с процедурой рандомизации протокола. Группа вакцинированных была разбита на 3 подгруппы по содержанию специфических противококлюшных IgG-антител до 1-го введения вакцины: 1-я подгруппа — СН (n = 168); 2-я — СЗ (n = 7); 3-я — СП (n = 35).
Клиническое исследование включало 1-е введение препарата, период наблюдения 60 ± 5 дней, 2-е введение препарата и период наблюдения 60 ± 5 дней. Определение уровня специфических антител IgG и IgA (иммуноферментный анализ (ИФА), в сыворотке крови, рото- и назофарингеальных секретах) и титров агглютинации сывороткой крови добровольцев суспензии бактерий возбудителя коклюша (реакция агглютинации, РА) при каждом введении препарата проводили перед введением (день 1-й), после введения на 8, 15, 29 и 60-й дни. Определение бактериальной нагрузки в рото- и назофарингеальных секретах методом ПЦР при каждом введении препарата проводили перед введением, после 1-го введения через 1 ч (1-й день), на 4, 8, 15, 29 и 60-й дни. Рандомизация и процедуры визитов представлены в Приложении к статье на сайте журнала.
Исследуемый препарат, дозы и способ введения
«ГамЖВК», живая вакцина интраназального применения для профилактики коклюша на основе аттенуированных бактерий B. pertussis 4MKS [14], в виде лиофилизата для приготовления суспензии интраназального введения произведена филиалом «Медгамал» НИЦЭМ им. Н.Ф. Гамалеи. Серии вакцины, использованные в клиническом исследовании, прошли все необходимые этапы контроля.
Препарат вводили в дозе 5 × 109 КОЕ в форме суспензии интраназально, закапывая по 0,25 мл в каждый носовой ход через шприц без иглы, двукратно, с интервалом 2 мес (60 ± 5 дней). В качестве плацебо применяли стерильный раствор лиофилизата стабилизатора. Оба препарата восстанавливали в 1 мл 0,9% NaCl для инъекций.
Количественное определение ДНК B. pertussis
Для ПЦР в реальном времени (РВ) использовали ДНК, выделенную из смывов заднеглоточных и назофарингеальных зондов (далее — аспиратов), помещённых в одну пробирку. Образцы после центрифугирования обрабатывали раствором гуанидинтиоцианата с последующей сорбцией ДНК на сорбенте [15]. Для определения количества геном-эквивалента (ГЭ) ДНК B. pertussis использовали разработанную и валидированную нами тест-систему ПЦР-РВ [16]. ПЦР-РВ проводили на амплификаторе «CFX-96 Touch» («Bio-Rad»).
Время элиминации аттенуированных бактерий из носо- и ротоглотки оценивали как временнóй промежуток в днях от момента введения (1 ч) до достижения установленного уровня. В качестве уровня, по достижении которого определяли момент завершения элиминации бактерий, были приняты средние значения уровня ДНК B. pertussis в обеих группах на этапе скрининга — 0,7 ГЭ/мл. Если указанный уровень не достигался, то время элиминации принималось равным 100 дням. Для сравнения групп добровольцев после 2-го введения бактерий и 1-й вакцинацией использовали метод Каплана–Мейера (модуль «Анализ выживаемости» — «Сравнение двух выборок» программы «Statistica v. 10.0»), позволяющий использовать цензурированные данные. К цензурированным данным были отнесены случаи, когда не достигался установленный уровень 0,7 ГЭ/мл. Такие случаи были отмечены после 1-й вакцинации, составив 6,2% (13 из 210), и 1 случай — менее 1,0% после 2-й вакцинации (1 из 202). Целесообразность использования этого метода обусловлена тем, что, как и в случае с анализом выживаемости, к моменту завершения исследования выведение было завершено не у всех лиц (цензурированные данные), но они были не исключены, а использованы при анализе. Различия оценивали с использованием лог-рангового критерия.
Методы оценки иммуногенности препарата «ГамЖВК»
Иммуногенность препарата «ГамЖВК» оценивали по индукции специфических IgG- и IgA-антител в сыворотке крови добровольцев, выявляемых с помощью ИФА и РА. Местный иммунный ответ оценивали по динамике специфических секреторных IgА к B. pertussis в назальных аспиратах.
Образцы крови отбирали в вакуумные пробирки с активатором свертывания крови («Vacuette»). Сыворотку крови отбирали после центрифугирования проб в течение 20 мин при 300g для уплотнения сгустка. Уровень специфических IgG- и IgA-антител к возбудителю коклюша в сыворотке определяли с помощью ИФА в соответствии с инструкцией производителя тест-систем «ESR120G», «ESR120А» и «ESR120M» («Virion/Serion GmbH»). IgA в аспиратах, как и в сыворотке крови, определяли с помощью тест-системы «ESR120А» («Virion/Serion GmbH»), но образцы разводили не в 100 (по инструкции производителя), а в 2 раза. Для получения абсолютных значений концентрации антител в аспиратах рассчитанные по калибровочной кривой значения делили на 50.
РА проводили на наборах производства «НПО Эколаб». Титром считали наибольшее разведение сыворотки, при котором получена РА не менее чем на «+++» («три креста»).
Статистическая обработка данных
Математико-статистический анализ результатов осуществляли с использованием пакетов «Statistica 10.0», R 4.2.1 и «Microsoft Office Excel 2013» для формирования графиков и таблиц.
Полученные количественные данные проверяли на соответствие закону нормального распределения. Для определения нормальности использовали критерий Колмогорова–Смирнова (при численности выборки более 50 добровольцев) или критерий W Шапиро–Уилка (при численности выборки менее 50 добровольцев). Если статистика значима, то гипотеза о нормальном распределении значений переменной отвергалась.
Оценку иммуногенности в исследуемых группах, представленных качественными признаками (долями), проводили с использованием критерия теста χ2 при ожидаемой частоте встречаемости признака более 5 или двустороннего точного критерия Фишера при несоблюдении условия для критерия χ2.
Точки иммуногенности для качественных показателей представлены в виде абсолютных частот (встречаемость признака), относительных частот (%) и 95% доверительного интервала доли (по Клопперу–Пирсону).
Количественные критерии иммуногенности оценивали с использованием непараметрических методов (критерий Манна–Уитни) или t-критерия Стьюдента для независимых выборок в соответствии с характером распределения. Также с учётом характера распределения осуществляли представление данных.
Для сравнения нескольких независимых выборок (более 2), представленных количественными переменными, применяли ранговый анализ вариаций по Краскелу–Уоллису. В случае установления статистически значимых различий между всеми группами для выявления различий между отдельными группами использовали апостериорный метод «Сравнение средних рангов для всех групп» (непараметрический тест Данна), учитывающий проблему множественных сравнений.
Дополнительно к показателям описательной статистики, приведённым для безопасности, для представления титров агглютинации использовали среднегеометрические значения с 95% доверительными интервалами.
Для сравнения групп добровольцев после 1-го и 2-го введений бактерий использовали лог-ранговый критерий.
Для точек иммуногенности применяли двусторонние критерии.
Величина ошибки для подтверждения нулевой гипотезы должна быть больше 0,05 (при р ≤ 0,05 нулевая гипотеза отклоняется, при р > 0,05 — принимается).
Результаты
Динамика специфических противококлюшных IgG- и IgA-антител в сыворотке крови и IgА-антител в назофарингеальных и ротоглоточных аспиратах. Результаты измерений IgG и IgA по подгруппам представлены на рис. 1, 2. Значимость статистических различий между общей группой вакцинированных и плацебо оценивали с использованием критерия Манна–Уитни. Оценку статистически значимых различий между подгруппами проводили с использованием непараметрического дисперсионного анализа — ранговый анализ вариаций по Краскелу–Уоллису и апостериорный непараметрический тест Данна (таблицы не приведены).
Рис. 1. Динамика специфических противококлюшных IgG-антител в сыворотке крови вакцинированных добровольцев и в подгруппах СН, СЗ и СП.
Здесь и на рис. 2–4 по оси абсцисс — сроки наблюдения за добровольцами в подгруппах после введения «ГамЖВК»: 0_1 — до введения препарата; 8_1, 15_1, 29_1, 60_1 — 8, 15, 29 и 60-й дни после 1-го введения «ГамЖВК» соответственно; 8_2, 15_2, 29_2, 60_2 — 8, 15, 29, 60-й дни после 2-го введения «ГамЖВК» соответственно.
По оси ординат — концентрация IgG в сыворотке крови добровольцев, МЕ/мл.
Fig. 1. B. pertussis-spesific IgG antibody dynamics in blood serum of vaccinated volunteers and additional groups SN, GZ and SP.
Here and on the Figs. 2–4: days after administration of GamLPV to volunteers from additional groups are plot on X-axis: 0_1 — the 1st day of administration of GamLPV (before administration), 8_1, 15_1, 29_1, 60_1 – 8, 15, 29 and 60 days after the 1st administration of GamLPV respectively; 8_2, 15_2, 29_2, 60_2 — 8, 15, 29, 60 days after the 2nd administration of GamLPV respectively. IgG antibody concentration (IU/mL) in the blood serum of volunteers is plot on Y-axis.
Рис. 2. Динамика специфических противококлюшных IgА-антител в сыворотке крови вакцинированных добровольцев и в подгруппах СН, СЗ и СП.
По оси ординат — концентрация IgА в сыворотке крови добровольцев, МЕ/мл.
Fig. 2. B. pertussis-spesific IgA antibody dynamics in blood serum of vaccinated volunteers and additional groups SN, GZ and SP.
IgA antibody concentration (IU/mL) in the blood serum of volunteers is plot on Y-axis.
На момент введения «ГамЖВК» значимые различия IgG-антител между общей группой вакцинированных и группой плацебо отсутствовали. На 8-е сутки после 1-го введения уровень IgG-антител в общей группе вакцинированных достоверно возрастал в сравнении с группой плацебо (р = 0,012); начиная с 15-го дня после 1-й вакцинации различия между группами стали высоко статистически значимыми (p < 0,0001). По сравнению с исходным уровнем (19 ME/мл) медианные значения уровня IgG-антител в группе вакцинированных после 1-го введения препарата на 8, 15, 29 и 60-й дни выросли в 1,1, 2,3, 3,6 и 3,8 раза соответственно. После 2-го введения «ГамЖВК» кратность возрастания уровня IgG на 8, 15, 29 и 60-й дни составила 3,7, 4,2, 3,9 и 3,8 раза соответственно (70,5–79,5 ME/мл). В группе плацебо медианный уровень IgG-антител достоверно не изменялся и варьировал в течение исследования в диапазоне 16,8–21,0 МЕ/мл.
До 1-го введения «ГамЖВК» медиана уровня IgG в каждой подгруппе (СН, СЗ, СП) достоверно отличалась от медианы общей группы вакцинированных. Достоверные различия отмечены также между подгруппами СН и СП, СН и СЗ. В рамках периода наблюдения медиана уровня IgG-антител в подгруппе СП достоверно отличалась от медианы для общей группы вакцинированных на 15-й день после 1-го введения (p = 0,001), а также на 29-й (p = 0,023) и 60-й (p = 0,001) дни после 2-го введения «ГамЖВК». Достоверные различия между группами СН и СП наблюдались на 15-й (p = 0,001) и 29-й (p = 0,023) дни после 1-го введения и на 29-й (p = 0,003) и 60-й (p = 0,001) дни после 2-го введения «ГамЖВК». Уровень IgG-антител в подгруппе СЗ достоверно не отличался от значений для других подгрупп или общей группы вакцинированных ни на одной из контрольных точек после вакцинации.
При оценке уровня специфических IgA-антител в крови установлены достоверные различия между группами вакцинированных и плацебо — 7,0 и 4,8 МЕ/мл соответственно (p = 0,014). При этом оба значения были значительно меньше границы серонегативности (< 25 МЕ/мл). После 1-й вакцинации начиная с 8-го дня достоверность различий между группами стала высоко значимой (p < 0,0001) и сохранялась на таком уровне до конца исследования. В группе вакцинированных после 1-го введения медианные значения на 8, 15, 29 и 60-й дни возрастали в 1,3, 3,6, 4,9 и 5,4 раза соответственно в сравнении с исходным уровнем. После 2-й вакцинации на 29-й день наблюдался бустерный эффект — уровень IgA-антител вырос в 6,2 раза в сравнении с исходным. К 60-му дню уровень IgA вернулся к уровню, выявленному перед 2-м введением. В группе плацебо существенных изменений за период наблюдения не установлено — медиана значений варьировала в диапазоне 4,0–6,0 ME/мл. Анализ подгрупп показал, что на момент перед 1-м введением «ГамЖВК» уровень IgA-антител к B. pertussis достоверно различался между подгруппами СП и СН (p = 0,001), при этом в подгруппе СП уровень антител достоверно отличался и от значения, характерного для общей группы вакцинированных (p = 0,001). На последующих контрольных точках, вплоть до 8-го дня после 2-го введения «ГамЖВК», достоверные различия между подгруппами отсутствовали. На 15-й день после 2-го введения вновь выявлены достоверные различия между подгруппами СП и СН (p = 0,001), а также между подгруппой СП и значением для общей группы вакцинированных (p = 0,001). На 29-й и 60-й дни после 2-го введения достоверные различия в уровне IgA-антител к B. pertussis сохранялись только между группами СП и СН (p = 0,049). Для подгруппы СЗ достоверных различий медианы уровня IgA с другими подгруппами не выявлено ни на одной из контрольных точек исследования.
Определение специфических секреторных противококлюшных IgА-антител в носо- и ротоглоточных смывах у добровольцев выявило на всех контрольных точках статистически высоко значимые (p < 0,0001) различия между группой вакцинированных добровольцев и группой плацебо (рис. 3). В группе вакцинированных по сравнению с исходным уровнем (0,20 ME/мл) медиана уровня секреторных IgA-антител на 15, 29 и 60-й дни после 1-й вакцинации увеличилась в 2,5, 4,5 и 3,2 раза соответственно. После 2-й вакцинации этот показатель непрерывно увеличивался, и на 8, 15 и 29-й дни кратность возрастания составила 4,4, 5,2 и 5,8 соответственно. На 60-й день медиана уровня секреторных IgA-антител вернулась к значениям, выявленным на 60-е сутки после 1-го введения «ГамЖВК». Анализ подгрупп показал наличие достоверных различий в уровне секреторных IgA-антител между подгруппами СН и СП на 29-й день после 2-го введения вакцины (p = 0,031).
Рис. 3. Динамика медианных значений концентрации специфических секреторных противококлюшных IgA-антител в носо- и ротоглоточных аспиратах у добровольцев в подгруппах СН, СЗ и СП.
По оси ординат — концентрация секреторных IgА-антител в аспиратах, МЕ/мл.
Fig. 3. B. pertussis-specific secretory IgA antibody (median values) dynamics in nasopharyngeal/oropharyngeal aspirates of vaccinated volunteers and additional groups SN, GZ and SP.
Secretory IgA antibody concentration (IU/ml) in nasopharyngeal/oropharyngeal aspirates is plot on Y-axis.
Динамика изменения доли добровольцев с более чем двукратным нарастанием уровня специфических противококлюшных IgА и IgG в сыворотке крови и назальных аспиратах. Кратность возрастания количества специфических противококлюшных IgА и IgG в аспиратах и в сыворотке крови на каждом визите анализировали по сравнению с данными до введения препарата (рис. 4).
Рис. 4. Динамика доли вакцинированных добровольцев с более чем двукратным нарастанием уровня специфических IgG к B. pertussis в сыворотке крови.
По оси ординат — доля добровольцев в исследуемой популяции с более чем двукратным нарастанием значений IgG, %.
Fig. 4. The dynamics of the proportion of vaccinated volunteers with more than a twofold increase of B. pertussis-specific IgG antibodies in blood serum.
The proportion of volunteers (%) with more than a twofold increase of B. pertussis-specific IgG antibodies in blood serum is plot on Y-axis.
Доля добровольцев с минимум двукратным возрастанием уровня IgG-антител в крови в группе вакцинированных достоверно отличалась (тест χ2, p < 0,0001) от группы плацебо уже на 15-й день после 1-го введения, при этом достоверность различий сохранялась до окончания исследования. На 15, 29 и 60-й дни после 1-го введения и на 8, 15, 29 и 60-й дни после 2-го введения доля добровольцев, достигших этого показателя, составила 46,4, 69,3, 72,8, 73,1, 75,0, 77,9 и 77,0% соответственно. Анализ подгрупп показал, что в подгруппе СН на 29-й день после 1-го введения доля таких пациентов составила 84,3%. На следующих точках это значение возрастало, достигнув максимума 92,4% на 29-е сутки после 2-го введения. В подгруппах СП и СЗ эти значения в рамках того же периода варьировали в диапазоне 11,4–17,1 и 14,3–57,1% соответственно.
При оценке уровня IgA-антител установлено, что начиная с 15-го дня после 1-го введения и до конца анализа доля пациентов с как минимум двукратным возрастанием уровня IgA-антител в сыворотке крови в группе вакцинированных отличалась от группы плацебо с высокой достоверностью (тест χ2, p < 0,0001). На 15, 29 и 60-й дни после 1-го введения доля таких добровольцев в группе вакцинированных составила 71,8, 85,1 и 86,1% соответственно. После 2-й вакцинации на 8, 15, 29 и 60-й дни этот показатель в группе вакцинированных составил 88,1, 88,1, 90,0 и 89,0% соответственно. Субанализ подгрупп показал, что в подгруппе СН двукратное возрастание уровня IgA-антител в крови отмечено более чем у 90,0% добровольцев начиная с 29-го дня исследования и до окончания исследования (91,6–94,9%). В подгруппе СП эти значения варьировали в диапазоне 60,0–74,3%, в подгруппе СЗ — 57,1–85,7%.
Динамика уровня секреторных IgA-антител была сходна с таковой IgA-антител в сыворотке крови. Высокодостоверные различия (p < 0,0001) между группой вакцинированных и плацебо были выявлены начиная с 15-го дня после 1-го введения вакцины. При этом доля добровольцев с двукратным возрастанием уровня IgA-антител на 15, 29 и 60-й дни после 1-го введения и на 8, 15, 29 и 60-й дни после 2-го введения вакцины составили 58,4, 71,6, 70,8, 80,2, 82,6, 84,0 и 73,5% соответственно. Достоверные различия между подгруппами СН, СЗ и СП отсутствовали, за исключением одной точки — 29 дней после 2-го введения вакцины, на которой подгруппы СН и СП достоверно различались (p = 0,031).
Сроки достижения максимальных значений IgА- и IgG-антител в сыворотке крови после 2-й вакцинации в сравнении с 1-й. Для проведения анализа сроков достижения максимальных концентраций анализировали данные только тех добровольцев группы вакцинированных, у которых уровень антител оценивали не менее чем в 3 точках, за исключением времени введения препарата.
После 2-й вакцинации наблюдается достоверное сокращение времени достижения максимальных значений уровня антител: более чем в 2 раза для IgG и в 4 раза для IgA сыворотки крови; в 2 раза для секреторных IgA (таблица).
Сравнительная оценка медианных значений концентрации специфических антител IgА и IgG в сыворотке крови и IgА в назофарингеальных/ротоглоточных аспиратах и времени их достижения у вакцинированных добровольцев после 1-й и 2-й вакцинаций
Comparative evaluation of B. pertussis-specific IgA and IgG antibody median values in blood serum and secretory IgA antibodies in nasopharyngeal/oropharyngeal aspirates of volunteers with time to Сmax in group of vaccinated volunteers after the 1st and the 2nd vaccination
Класс антител Class of antibodies | Кратность вакцинации Vaccination number | n | Медианное значение содержания специфических антител, ЕД/мл Median value of specific antibody content, IU/mL | р1 | Медианное значение времени выведения бактерий, день Median value of bacterial elimination time, day | р2 |
IgА в сыворотке крови Serum IgA | 1 | 207 | 44,0 | 0,006 | 56,0 | < 0,0001 |
2 | 200 | 55,5 | 14,0 | |||
IgG в сыворотке крови Serum IgG | 1 | 208 | 77,5 | < 0,0001 | 59,0 | < 0,0001 |
2 | 200 | 90,0 | 28,0 | |||
IgА в аспиратах Secretory IgA | 1 | 208 | 1,98 | < 0,0001 | 28,0 | < 0,0001 |
2 | 199 | 6,28 | 14,0 |
Примечание. Достоверность различий рассчитывали по критерию Вилкоксона.
Note. Reliability of differences was calculated using the Wilcoxon test.
Оценка иммунного ответа на вакцинацию добровольцев «ГамЖВК» с помощью РА. Оценку иммунного ответа, характеризующего уровень агглютинирующих антител в сыворотке крови вакцинированных добровольцев, осуществляли методом РА. Титры антител представляли в виде среднегеометрических значений с 95% доверительными интервалами и описательных статистик для ассиметрично распределённых данных (таблицы не представлены).
Во всех анализируемых точках установлены статистически значимые различия между группами вакцинированных добровольцев и получивших плацебо. Начиная с 15-го дня после 1-й вакцинации эти различия становились статистически высоко значимы (p < 0,0001). Титр антител в группе плацебо существенно не изменялся на протяжении всего периода обследования.
В группе вакцинированных среднегеометрический титр агглютинации на 8-й день после 1-й вакцинации (45,9) в целом соответствовал исходному уровню (42,4). Рост титра наблюдали начиная с 15-го дня после 1-го введения вакцины. Кратность увеличения среднегеометрического титра агглютинации на 15, 29 и 60-й дни составила 1,7, 2,3 и 2,0 соответственно. После 2-й вакцинации на 8, 15 и 29-й дни кратность составила 2,0, 2,6 и 2,7 соответственно. К 60-му дню после 2-й вакцинации титр незначительно снизился, но кратность увеличения (2,6) превысила аналогичный показатель на 60-й день после 1-й вакцинации.
Доля добровольцев с титром агглютинации 1 : 80 и выше на 8, 15, 29 и 60-й дни после 1-й вакцинации составила 38,1, 56,0, 73,6 и 65,8%, а после 2-й — 66,8, 77,6, 77,6 и 80,0%. После 1-й вакцинации доля добровольцев с титром агглютинации 1 : 80 в общей группе вакцинированных статистически значимо различалась с выделенными подгруппами. После 2-й вакцинации статистически значимых различий между подгруппами не установлено. Наиболее высокий процент лиц, соответствовавших заданному критерию, установлен в группе СП-добровольцев (от 80,0% на 15-й день после 1-го введения до 94,3% на 15-й и 60-й дни после 2-го введения вакцины). В подгруппе СН для того же временнóго промежутка данный показатель варьировал в диапазоне 51,5–75,9%, в подгруппе СЗ — 42,9–100,0%.
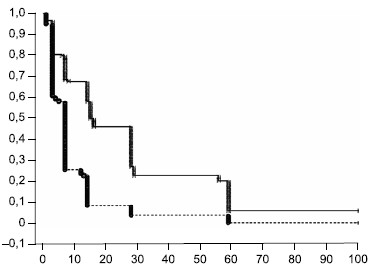
Время элиминации аттенуированных бактерий из носоглотки после 2-го введения бактерий в сравнении с 1-й вакцинацией. На рис. 5 представлена динамика элиминации аттенуированных бактерий из носоглотки как уменьшение кумулятивной доли лиц с невыведенными бактериями B. pertussis в отдельные временны́е интервалы. Из представленных данных видно, что элиминация вакцинных аттенуированных бактерий B. pertussis из носоглотки после 2-го введения бактерий происходит быстрее, чем после 1-й вакцинации добровольцев. При этом после 2-го введения вакцины больше доля добровольцев, у которых процесс элиминации завершился в ранние сроки — в течение первых 7 дней после введения.
Рис. 5. Динамика кумулятивной доли добровольцев с неэлиминированными из носоглотки бактериями B. pertussis после 2-го введения бактерий в сравнении с 1-й вакцинацией.
По оси абсцисс — время элиминации бактерий, начиная от 1 ч после введения «ГамЖВК»; по оси ординат — кумулятивная доля добровольцев, в аспиратах которых методом ПЦР выявлена ДНК бактерий B. pertussis в количестве больше 0,7 ГЭ/мл. Штриховой линией обозначен график повторной вакцинации добровольцев.
Fig. 5. The dynamics of cumulative fraction of volunteers who did not eliminate B. pertussis bacteria from the nasopharynx after second administration of bacteria compared with the first vaccination.
Time duration of B. pertussis bacteria elimination starting from the first hour after GamLPV administration are plot on X-axis; the cumulative fraction of volunteers in whose aspirates the DNA of B. pertussis bacteria was detected by PCR in an amount more than 0,7 GE/mL, is plot on Y-axis. The dashed line indicates the second vaccination schedule of volunteers.
Сравнительная оценка времени элиминации аттенуированных бактерий из носоглотки вакцинированных добровольцев общей группы после 1-й и 2-й вакцинаций с использованием лог-рангового критерия показала статистически высоко значимое (р < 0,0001) снижение продолжительности элиминации после 2-й вакцинации — с 16 до 7 дней по медианному значению. В подгруппе СН выявлена наибольшая разница в продолжительности периода элиминации бактерий после 1-й и 2-й вакцинаций — 28 и 7 дней соответственно. В подгруппе СП различия также были достоверны (p = 0,013) — медиана продолжительности элиминации бактерий составила 14 и 7 дней соответственно.
Дополнительно к анализу времени элиминации проводили оценку суммарного количества ДНК B. pertussis в носоглотке добровольцев в процессе наблюдения после 1-й и 2-й вакцинаций, рассчитанного с использованием методом линейных трапеций. Площадь под кривой после 1-й вакцинации составила 6714 (1539) ГЭ день/мл, после 2-й вакцинации — 443 (44) МЕ день/мл по медиане при расчёте в интервале с 3-го по 60-й день.
Обсуждение
Результаты изучения иммуногенности «ГамЖВК» и вирулентных бактерий B. pertussis на экспериментальной модели низших обезьян показали, что первый контакт с инфекцией индуцировал медленный и невыраженный рост специфических IgG, продолжающийся, как правило, до 46–60-го дня наблюдения. Повторное введение бактерий приводило к быстрому и выраженному росту IgG начиная с 3–7-го дня с достижением максимума на 14–28-й день после 2-го инфицирования [6, 7]. Результаты I этапа клинического исследования «ГамЖВК» подтвердили медленное нарастание значений IgG после 1-й вакцинации [8]. Тогда же было показано, что, по крайней мере среди добровольцев Москвы и Московской области при использовании набора «Ridacreen», СН являются менее 50% взрослых в возрасте 40–60 лет [8–10].
Тестируемая вакцина в перспективе предназначена для ревакцинации взрослых независимо от состояния их здоровья и уровня специфических IgG, поэтому практический интерес представляет изучение переносимости, иммуногенности и защитной активности «ГамЖВК» для добровольцев 18–65 лет, не имеющих явного нарушения здоровья, симптомов коклюша и уровень IgG в сыворотки крови, меньший порога, определённого в стране для лабораторной диагностики коклюша. Отсутствие исследований в России, определяющих серологический статус населения (уровень IgG, IgМ и IgА), и собственных тест-систем ИФА не позволяет количественно оценить уровень защитных антител после вакцинации и/или перенесённого заболевания. Поэтому, по результатам наших предыдущих исследований и некоторых данных отечественной литературы, в качестве порогового для включения в исследование принято значение IgG 45 ЕД/мл [9, 10], измеренное с помощью набора «Ridacreen», позволившее включить в исследование более 80% скринированных добровольцев. Невозможность использования тест-систем «Ridacreen» в представленном в этой статье исследовании привела к необходимости определения коэффициента пересчёта величины граничной точки критерия включения IgG < 45 ЕД/мл в международные единицы (МЕ/мл), измеряемые с помощью доступной и зарегистрированной в России тест-системы «ESR120G» («Institut Virion/Serion GmbH»). В результате полуэмпирических расчётов в качестве такого коэффициента принято значение, равное 2,8. Таким образом, в качестве верхней границы уровня IgG, при котором доброволец может быть включён в исследование, был принят уровень 126 МЕ/мл, определённый с помощью тест-системы «ESR120G» («Virion/Serion GmbH»). Рассчитанный коэффициент использовали только для определения границы в критерии включения. Все остальные значения параметров IgG и IgA сыворотки крови добровольцев и в аспиратах определяли с помощью тест-систем «ESR120А» «ESR120G» («Institut Virion/Serion GmbH») в используемых ими единицах (МЕ/мл).
Выбор параметров и критериев (контрольных точек) для оценки иммуногенности «ГамЖВК» интраназального применения по основным показателям является традиционным для многоцентровых исследований и обоснован в протоколах, брошюрах и отчётах о проведённых клинических исследованиях. Контрольные точки, характеризующие уровень иммуногенности препарата, приведены в Приложении к статье на сайте журнала.
Проведённое исследование продемонстрировало достоверную сероконверсию по IgG- и IgA-антителам в сыворотке крови и возрастание уровня секреторных IgA-антител в назальных аспиратах добровольцев. Полученные значения превышали исходный уровень антител у добровольцев, включённых в группу вакцинированных, и уровень антител у добровольцев группы плацебо. Достоверные различия между уровнями IgG- и IgA-антител в группах вакцинированных и плацебо наблюдали уже на 8-й день. Таким образом, гуморальный иммунный ответ на интраназальную вакцинацию добровольцев «ГамЖВК» начинает проявляться через неделю после введения препарата. Максимальное возрастание медианных значений уровней антител к B. pertussis в сыворотке крови добровольцев составило для IgG 6,2 раза, для IgA — 4,2 раза. Уровень IgA в аспиратах максимально возрастал в 5,8 раза после 2-й вакцинации. Аналогичная динамика зарегистрирована при оценке сероконверсии по показателю РА.
Показательным является время достижения максимальных уровней IgG- и IgA-антител в сыворотке крови и секреторных IgA-антител в назальных аспиратах после 1-й и 2-й вакцинаций добровольцев. Во всех случаях после 2-го введения препарата уровни антител, независимо от изотипа, не только превышали уровни после 1-го введения, но и достигали максимума в более короткие сроки.
Важным показателем является доля добровольцев, достигших заданного значения превышения исходного уровня антител. Выбранная нами и внесённая в протокол контрольная точка предполагает достижение не менее чем двукратного роста уровня IgG- и IgA-антител не менее чем у 80% вакцинированных добровольцев. При расчёте на общую группу эта контрольная точка была достигнута и превышена в отношении уровня IgA в сыворотке и в аспиратах. Для IgG двукратное возрастание уровня антител отмечено у 77,9% вакцинированных добровольцев.
Анализ динамики изменения уровня IgG- и IgA-антител в сыворотке крови по подгруппам подтвердил общую динамику возрастания уровня IgА- и IgG-антител. Вполне ожидаемо кратность возрастания в общей группе вакцинированных и подгруппе СН оказались близка друг к другу и значимо превышала кратность возрастания в подгруппах СП и СЗ (рис. 4), что обусловлено эффектом базы (исходного уровня антител, относительно которого рассчитывали кратность). Незначительное отставание доли добровольцев, достигших двукратного возрастания уровня IgG-антител от 80% в общей группе вакцинированных, полностью объясняется наличием в ней добровольцев подгрупп СП и СЗ с исходно высокими значениями IgG и, соответственно, невозможностью достижения ими высокой кратности прироста антител. Так, на 29-й день после 2-й вакцинации доля добровольцев с двукратным и более возрастанием уровня IgG-антител в сыворотке крови среди всех вакцинированных составила 77,9%, тогда как в подгруппе СН этот уровень превышал 92%, в подгруппе СП составил всего 17,1%, а в подгруппе СЗ — 57,1%. Подгруппы СП и СЗ суммарно составляют порядка 20% от общей группы вакцинированных, что повлияло на итоговое значение и определило минимальное значение (2,1%) этого показателя, которого не хватило для достижения заявленной первичной конечной точки в 80,0% пациентов с двукратным возрастанием уровня IgG-антител.
Следует отметить, что выбранный нами уровень 80% и достижение этого уровня при двукратной сероконверсии были определены по результатам предыдущего этапа исследования, в которого включали только СН по IgG-антителам добровольцев. Как видно из полученных данных, в группе СН заявленный показатель был достигнут [8–10]. Более того, в аналогичных экспериментах, проведённых в процессе клинических исследований вакцины BPZE1, авторы рассчитывали долю пациентов с 1,5-кратным приростом уровня антител и достигли контрольной точки только при этом критерии [13]. Перерасчёт наших значений для 1,5-кратного прироста показал достижение в проведённом нами исследовании этого параметра более чем у 80% добровольцев начиная с 29-го дня после 1-го введения «ГамЖВК».
Оценка иммуногенности «ГамЖВК» с помощью РА не выявила значимых различий с результатами, полученными методом ИФА, за исключением более выраженного роста доли добровольцев с титром агглютинации 1 : 80 и выше в подгруппе СП в сравнении с СН, тогда как динамика уровня IgА- и IgG-антител в этих группах носит обратный характер. Достоверность и биологический смысл выявленных различий требуют дальнейшего исследования. Обобщение результатов анализа сыворотки крови добровольцев в двух клинических исследованиях кандидатной вакцины «ГамЖВК», а также данных, полученных при изучении обезьян, иммунизированных «ГамЖВК» и/или экспериментально инфицированных вирулентными бактериями возбудителя коклюша, показало, что ИФА и РА в целом выявляют общую картину иммунологических реакций организма на иммунизацию и экспериментальную инфекцию. Использование РА в большинстве случаев не выявило значимых отличий от результатов, полученных с помощью ИФА, а различия в результатах РА, полученных с использованием разных серий препарата, при хорошей воспроизводимости результатов ИФА указывают на низкую стандартизацию наборов, использованных для постановки РА. Полученные результаты делают нецелесообразным использование РА в дальнейших клинических исследованиях «ГамЖВК». Безальтернативность ИФА для определения серологического статуса больных и вакцинированных людей ещё раз подчёркивает необходимость разработки и производства отечественной тест-системы ИФА для количественного определения антител к основным антигенам возбудителя коклюша.
Не выявлено достоверных различий в значениях по подгруппам в уровне секреторных IgA-антител в аспиратах, тогда как уровни IgA- и IgG-антител в сыворотке крови по подгруппам достоверно отличались, в том числе до начала эксперимента, что особенно выражено при сравнении подгрупп СН и СП. Выявленные различия в медианных значениях уровня IgA-антител в сыворотке крови до вакцинации, по-видимому, обусловлены наличием корреляции между уровнем IgG и IgА у добровольцев и отражают последствия предшествовавшего контакта с антигенами B. pertussis.
Динамика доли добровольцев с более чем двукратным нарастанием IgA в аспиратах достоверно не отличалась в подгруппах и достигала контрольных значений 80% на 15–29-й день после 2-й вакцинации. Отмеченная особенность может указывать на относительную независимость формирования местного иммунитета от исходного уровня IgG. Вторая вакцинация усиливает местный ответ независимо от серологического статуса добровольца, что ещё раз указывает на крайне важную роль местной иммунной защиты в формировании противобактерийного иммунитета при коклюше. На это же указывают результаты определения бактериальной нагрузки в носо- и ротоглотке вакцинированных добровольцев в динамике. Для каждой из подгрупп, за исключением СЗ, отмечено резкое сокращение времени выведения бактерий после 2-й вакцинации и отсутствие выраженной разницы в значении параметров для разных подгрупп добровольцев.
Дополнительным к времени выведения бактерий, применительно к оценке противобактерийной активности «ГамЖВК», можно считать количество бактерий, зарегистрированных у добровольцев за период наблюдения после 1-й и 2-й вакцинаций. Это значение оценено нами по результатам расчёта площади под кривой элиминации бактерий после каждой иммунизации. Анализ представленных данных свидетельствует о том, что эффективность элиминации за период с 3-го по 60-й день после 2-й вакцинации была в 33 раза выше по сравнению с 1-м введением вакцины. Поскольку для развития иммунного ответа необходимо время, наиболее адекватным является определение площади под кривой не с 1-х суток, когда организм не успел ещё среагировать на введение бактерий, а в период с 3-го по 60-й день. Кроме того, результаты измерения значений IgG и IgА указывают на то, что иммунный ответ организма после 1-й и 2-й вакцинаций проявляется ближе к 8-м суткам после введения бактерий.
Приведённые результаты анализа эффективности элиминации аттенуированных бактерий после 2-го введения вакцины позволяют предположить, что уровень специфических IgG- и IgА-антител в сыворотке крови не отражает в полной мере уровень противобактерийной защитной активности. Это соответствует утверждению об отсутствии корреляций между уровнем IgG в сыворотке и защитной активностью коклюшных вакцин на практике [5]. Приведённое утверждение, на первый взгляд, ограничивает использование показателей уровня сывороточных IgG- и IgА-антител в исследованиях по оценке иммуногенности коклюшных вакцин. Сероконверсия, безусловно, является важной характеристикой гуморального иммунного ответа при коклюше или вакцинации, а выработанные антитела участвуют в формировании иммунной защиты, направленной на нейтрализацию токсической активности возбудителя и предотвращение клинических проявлений заболевания, однако она не свидетельствует о формировании стерильного противобактерийного иммунитета, как после переболевания коклюшем или вакцинации живой коклюшной вакциной. Общепринятым сегодня является утверждение, что за формирование противобактерийной защиты при коклюше отвечает клеточная составляющая иммунитета. Прямые эксперименты на обезьянах демонстрируют, что наличие всех изотипов специфических антител к коклюшному токсину, филаментозному гемагглютинину, пертактину и фимбриям после их иммунизации БКВ не обеспечивает предотвращение или хотя бы сдерживание размножения вирулентных бактерий в носоглотке после экспериментальной инфекции животных [5]. Продемонстрированное нами отсутствие зависимости времени выведения бактерий от исходного уровня IgG и IgА в сыворотке крови перед вакцинацией может рассматриваться в качестве дополнительного аргумента в пользу сделанного предположения. Для оценки индуцированного противобактерийного ответа, вероятнее всего, следует использовать данные по уровню IgА-антител в рото- и носоглоточных смывах и параметры клеточного ответа, прежде всего, характеризующие ответ Th17.
Недавно опубликованные результаты клинического исследования вакцины BPZE1 в целом соответствуют представленным в настоящем исследовании [13]. Кроме того, они содержат сопоставление показателей иммунного ответа, индуцированного BPZE1 и АаКДС. По мнению авторов, уровень сероконверсии после интраназальной вакцинации добровольцев BPZE1 несколько ниже, но сопоставим со значениями IgG и IgА в сыворотке крови добровольцев после вакцинации АаКДС. В то же время инъекционная вакцинация АаКДС, в отличие от интраназальной BPZE1, не способна индуцировать специфические секреторные антитела в носоглотке добровольцев. Продемонстрирована хорошая переносимость вакцины BPZE1 и безопасность её интраназального применения у взрослых добровольцев.
Заключение
Результаты проведённого исследования показали иммунологическую эффективность (иммуногенность) живой коклюшной вакцины «ГамЖВК» при двукратном и однократном интраназальном применении в сравнении с плацебо у взрослых добровольцев. Основанием послужило достижение контрольных точек иммуногенности вакцины:
- доля добровольцев с более чем двукратным нарастанием уровня IgG- и IgА-антител в сыворотке крови после вакцинации составила более 80%;
- доля добровольцев с титром агглютинации 1 : 80 в РА после вакцинации составила более 80%;
- доля добровольцев с более чем двукратным нарастанием уровня IgА-антител в носо- и ротоглоточных аспиратах после вакцинации составила более 80%;
- показано статистически значимое снижение сроков достижения максимальных значений IgA-антител в сыворотке крови и носо- и ротоглоточных аспиратах после 2-й вакцинации в сравнении с 1-й и сокращение времени элиминации аттенуированных бактерий из носоглотки после 2-го введения бактерий в сравнении с 1-й вакцинацией добровольцев, оценённое по количеству ГЭ (с помощью ПЦР-РВ).
Различия в доле добровольцев с более чем двукратным увеличением уровня IgG у СН-добровольцев (более 90%) и доле СП-добровольцев (менее 78%) обусловлено изначально высоким уровне антител у последних и, соответственно, отсутствием его удвоения после следующего контакта с инфекцией. Рост доли добровольцев с более чем двукратным увеличением уровня IgА и IgG происходит в основном за счёт СН-добровольцев с более низким первичным уровнем IgА.
Вклад СН- и СП-добровольцев в долю добровольцев с более чем двукратным ростом секреторных IgА (более 80%) примерно одинаков при близких начальных значениях медианы IgА в каждой из групп, но больших значениях, достигаемых у СП-добровольцев. Последний результат может указывать на короткий период присутствия секреторных IgА после перенесённой инфекции/вакцинации, но ускоренную их выработку и достижение более высоких значений у СП-добровольцев, имевших ранее контакт с инфекцией.
Сокращение времени элиминации бактерий B. pertussis после 2-й вакцинации в сравнении с 1-й в одинаковой степени регистрируется у СН- и СП-добровольцев и составляет 2,0 и 2,3 раза в каждой группе соответственно.
Суммируя представленные результаты, можно утверждать, что уже 1-я интраназальная вакцинация добровольцев приводит к формированию специфического гуморального ответа организма, в том числе выработке специфических секреторных IgА. Повторное введение аттенуированных бактерий B. pertussis усиливает иммунный ответ и демонстрирует наличие противобактерийного иммунитета, сформированного в результате 1-й интраназальной вакцинации добровольцев препаратом «ГамЖВК». Для ревакцинации взрослого населения «ГамЖВК» достаточным может оказаться однократное интраназальное введение препарата. Необходимость двукратной вакцинации детей младшего возраста и подростков должна быть определена по результатам клинических исследований.
Об авторах
Алевтина Анатольевна Лиджиева
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: baburida@yandex.ru
ORCID iD: 0000-0002-1537-6444
м. н. с. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваАлиса Юрьевна Медкова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Автор, ответственный за переписку.
Email: baburida@yandex.ru
ORCID iD: 0000-0002-1509-0622
к. м. н., с. н. с. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваСергей Вячеславович Куликов
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: baburida@yandex.ru
ORCID iD: 0000-0001-7478-3624
м. н. с. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваЛюдмила Николаевна Синяшина
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: baburida@yandex.ru
ORCID iD: 0000-0003-1708-5453
д. м. н., в. н. с. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваРезида Анваровна Сюндюкова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: baburida@yandex.ru
ORCID iD: 0000-0001-5600-1967
к. б. н., с. н. с. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваАндрей Петрович Марков
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: baburida@yandex.ru
ORCID iD: 0009-0000-1857-967X
к. б. н., с. н. с. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваАлексей Борисович Верведа
Научно-исследовательский институт промышленной и морской медицины; Научно-исследовательский центр Эко-безопасность
Email: baburida@yandex.ru
ORCID iD: 0000-0003-4029-3170
к. м. н., в. н. с., с. н. с.
Россия, Санкт-Петербург; Санкт-ПетербургНаталья Евгеньевна Абаева
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: baburida@yandex.ru
ORCID iD: 0000-0003-3984-959X
н. с. лаб. биосинтеза иммуноглобулинов
Россия, МоскваИрина Николаевна Чернышова
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: baburida@yandex.ru
ORCID iD: 0000-0001-5053-2433
к. м. н., с. н. с. лаб. биосинтеза иммуноглобулинов
МоскваМарина Викторовна Гаврилова
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи; Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: baburida@yandex.ru
ORCID iD: 0000-0002-6936-2486
к. б. н., н. с. лаб. генетики бактерий отдела медицинской микробиологии, н. с. лаб. биосинтеза иммуноглобулинов
Россия, Москва; МоскваКристина Константиновна Бушкова
Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: baburida@yandex.ru
ORCID iD: 0000-0002-4757-0751
н. с. лаб. биосинтеза иммуноглобулинов
Россия, МоскваИлья Николаевич Дьяков
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи; Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова
Email: baburida@yandex.ru
ORCID iD: 0000-0001-5384-9866
к. б. н., н. с. лаб. генетики бактерий отдела медицинской микробиологии, в. н. с., зав. лаб. биосинтеза иммуноглобулинов
Россия, Москва; МоскваГеннадий Иванович Каратаев
Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи
Email: baburida@yandex.ru
ORCID iD: 0000-0001-8771-6092
д. б. н., в. н. с., рук. лаб. генетики бактерий отдела медицинской микробиологии
Россия, МоскваСписок литературы
- Decker M.D., Edwards K.M. Pertussis (whooping cough). J. Infect. Dis. 2021;224(12 Suppl. 2):310–20. DOI: https://doi.org/10.1093/infdis/jiaa469
- Macina D., Evans K.E. Bordetella pertussis in school-age children, adolescents, and adults: a systematic review of epidemiology, burden, and mortality in the Middle East. Infect. Dis. Ther. 2021;10(2):719–38. DOI: https://doi.org/10.1007/s40121-021-00440-8
- Locht C., Carbonetti N.H., Cherry J.D., et al. Highlights of the 12th international Bordetella symposium. Clin. Infect. Dis. 2020;71(9):2521–6. DOI: https://doi.org/10.1093/cid/ciaa651
- Locht C. Will we have new pertussis vaccines? Vaccine. 2018;36(36):5460–9. DOI: https://doi.org/10.1016/j.vaccine.2017.11.055
- Warfel J.M., Zimmerman L.I., Merkel T.J. Acellular pertussis vaccines protect against disease but fail to prevent infection and transmission in a nonhuman primate model. Proc. Natl Acad. Sci. USA. 2014;111(2):787–92. DOI: https://doi.org/10.1073/pnas.1314688110
- Медкова А.Ю., Синяшина Л.Н., Амичба А.А. и др. Доклинические исследования безопасности, иммуногенности и защитной активности аттенуированных бактерий Bordetella pertussis на экспериментальной модели Macaca mulatta. Журнал микробиологии, эпидемиологии и иммунобиологии. 2020;97(4):312–23. Medkova A.Yu., Sinyashina L.N., Amichba A.A., et al. Preclinical studies of safety, immunogenicity and protective activity of attenuated Bordetella pertussis bacteria on the Macaca mulatta model. = Journal of Microbiology, Epidemiology and Immunobiology. 2020;97(4):312–23. DOI: https://doi.org/10.36233/0372-9311-2020-97-4-3 EDN: https://elibrary.ru/zcqxpb
- Джидарян А.А., Матуа А.З., Медкова А.Ю. и др. Безопасность и иммуногенность препарата живой коклюшной вакцины ГамЖВК интраназального применения на экспериментальной модели детёнышей обезьян вида павиан гамадрил. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(2):203–14. Djidaryan A.A., Matua A.Z., Medkova A.Yu., et al. Safety and immunogenicity of live intranasal pertussis vaccine GamLPV in the experimental infant hamadryas baboon model. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(2):203–14. DOI: https://doi.org/10.36233/0372-9311-190
- Медкова А.Ю., Лиджиева А.А., Сёмин Е.Г. и др. Иммуногенность препарата «Живая вакцина интраназального применения для профилактики коклюша» (ГамЖВК) при однократном применении у здоровых добровольцев. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(6):706–20. Medkova A.Yu., Lidzhiyeva A.A., Semin E.G., et al. Immunogenicity of the drug «Live intranasal vaccine for the prevention of pertussis» (GamLPV) with a single use in healthy volunteers. Journal of Microbiology, Epidemiology and Immunobiology. 2021;98(6):706–20. DOI: https://doi.org/10.36233/0372-9311-194 EDN: https://elibrary.ru/jkxdrn
- Медкова А.Ю., Лиджиева А.А., Сёмин Е.Г. и др. Клинические исследования безопасности и переносимости живой вакцины интраназального применения для профилактики коклюша. Разработка и регистрация лекарственных средств. 2021;10(1):114–9. Medkova A.Yu., Lidzhieva A.A., Semin E.G., et al. A clinical study of the safety and tolerability of live nasal vaccine for the prevention of pertussis. Drug Development & Registration. 2021;10(1):114–9. DOI: https://doi.org/10.33380/2305-2066-2021-10-1-114-11 EDN: https://elibrary.ru/ivumga
- Каратаев Г.И., Медкова А.Ю., Сёмин Е.Г. и др. Разработка способа и схемы применения живой рекомбинантной коклюшной вакцины «ГамЖВК». Безопасность и переносимость двукратной интраназальной вакцинации здоровыми взрослыми добровольцами. Разработка и регистрация лекарственных средств. 2022;11(3):202–8. Karataev G.I., Medkova A.Yu., Semin E.G., et al. Development of a method and a scheme for the use of a live recombinant vaccine «GamLPV». Safety and tolerability of double intranasal vaccination of healthy adult volunteers. Drug Development & Registration. 2022;11(3):202–8. DOI: https://doi.org/10.33380/2305-2066-2022-11-3-202-208 EDN: https://elibrary.ru/sytabk
- Li R., Lim A., Ow S.T., et al. Development of live attenuated Bordetella pertussis strains expressing the universal influenza vaccine candidate M2e. Vaccine. 2011;29(33):5502–11. DOI: https://doi.org/10.1016/j.vaccine.2011.05.052
- Jahnmatz M., Richert L., Al-Tawil N., et al. Safety and immunogenicity of the live attenuated intranasal pertussis vaccine BPZE1: a phase 1b, double-blind, randomised, placebo-controlled dose-escalation study. Lancet Infect Dis. 2020;20(11): 1290–301. DOI: https://doi.org/10.1016/S1473-3099(20)30274-7
- Keech C., Miller V.E., Rizzardi B., et al. Immunogenicity and safety of BPZE1, an intranasal live attenuated pertussis vaccine, versus tetanus-diphtheria-acellular pertussis vaccine: a randomised, double-blind, phase 2b trial. Lancet. 2023;401(10379):843–55. DOI: https://doi.org/10.1016/S0140-6736(22)02644-7
- Семин Е.Г., Синяшина Л.Н., Медкова А.Ю. и др. Конструирование рекомбинантных аттенуированных бактерий Bordetella pertussis генотипа ptxP3. Журнал микробиологии, эпидемиологии и микробиологии. 2018;95(4):33–41. Semin E.G., Sinyashina L.N., Medkova A.Y., et al. Construction of recombinant attenuated Bordetella pertussis bacteria of ptxP3 genotype. Journal of Microbiology, Epidemiology and Immunobiology. 2018;95(4):33–41. DOI: https://doi.org/10.36233/0372-9311-2018-4-33-41 EDN: https://elibrary.ru/npsjcf
- Медкова А.Ю., Синяшина Л.Н., Румянцева Ю.П. и др. Накопление авирулентных инсерционных bvg- мутантов Bordetella pertussis при экспериментальной инфекции лабораторных мышей. Молекулярная генетика, микробиология и вирусология. 2013;(4):22–6. EDN: https://elibrary.ru/rtwart Medkova A.Yu., Sinyashina L.N., Rumyantseva Yu.P., et al. Accumulation of avirulent Bordetella pertussis Bvg mutants in the course of experimental whooping cough in mice. Molecular Genetics, Microbiology and Virology. 2013;28(4):156–61. DOI: https://doi.org/10.3103/S0891416813040058 EDN: https://elibrary.ru/sljrat
- Нестерова Ю.В., Медкова А.Ю., Бабаченко И.В. и др. Клинико-диагностическое значение генетических маркеров Bordetella pertussis у контактных лиц в семейных очагах. Журнал инфектологии. 2019;11(1):17–24. Nesterova Yu.V., Medkova A.Yu., Babachenko I.V., et al. Clinical-diagnostic value of Bordetella pertussis genetic markers in contact persons in familial foci. Journal Infectology. 2019;11(1):17–24. DOI: https://doi.org/10.22625/2072-6732-2019-11-1-17-24 EDN: https://elibrary.ru/ubtkhk
Дополнительные файлы