Анализ генетических вариантов и лекарственной устойчивости ВИЧ-1 среди мужчин с рискованным сексуальным поведением, граждан Кубы, проживающих в Москве в 2022–2024 годах
- Авторы: Лаповок И.А.1, Кириченко А.А.1, Шлыкова А.В.1, Киреев Д.Е.1, Попова А.А.1,2, Покровская А.В.1,3
-
Учреждения:
- Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
- Российская медицинская академия непрерывного профессионального образования
- Российский университет дружбы народов имени Патриса Лумумбы
- Выпуск: Том 102, № 4 (2025)
- Страницы: 425-435
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18703
- DOI: https://doi.org/10.36233/0372-9311-616
- EDN: https://elibrary.ru/zoyqjd
- ID: 18703
Цитировать
Аннотация
Введение. Эпидемия ВИЧ-инфекции на Кубе имеет свои особенности по сравнению с эпидемией в России. Миграционные потоки между Кубой и Россией способны оказать влияние на генетическое разнообразие и лекарственную устойчивость ВИЧ-1 в России. Отдельного внимания заслуживает уязвимая группа мужчин с рискованным сексуальным поведением, в частности — мужчины, практикующие секс с мужчинами (МСМ), и работники коммерческого секса.
Целью нашего исследования был анализ генетических вариантов ВИЧ-1 и лекарственной устойчивости ВИЧ-1 в образцах плазмы крови, полученных от мигрантов — МСМ с Кубы, проживающих в Москве.
Материалы и методы. Была собрана коллекция образцов плазмы крови, сопутствующая эпидемиологическая и клиническая информация от пациентов — МСМ с Кубы, получены нуклеотидные последовательности генома ВИЧ-1. Были проведены генотипический, кластерный анализ и анализ лекарственной устойчивости (ЛУ) ВИЧ-1.
Результаты. Были проанализированы образцы и эпидданные, полученные от 27 пациентов в 2022–2024 гг. Было выявлено, что 24/27 пациентов (включая 12/15, предполагающих факт инфицирования в Москве, и 10, предполагающих инфицирование на Кубе), были инфицированы вариантами ВИЧ-1, типичными для Кубы, а не для России. Это говорит об инфицировании 88,89% пациентов их согражданином. ЛУ была выявлена у 9 (33,33%; 95% ДИ 15,55–51,11) пациентов. Наиболее часто отмечалась устойчивость к эфавирензу и невирапину, что было связано с мутациями K103N, Y181C и P225H гена обратной транскриптазы.
Заключение. Фактор миграции должен учитываться в программах профилактики и противодействия распространению ВИЧ-инфекции в России, а генетические особенности ВИЧ-1 необходимо принимать во внимание при подборе эффективной терапии у мигрантов.
Ключевые слова
Полный текст
Введение
Связи между Кубой и Россией в последние годы значительно укрепились. В основе сотрудничества между государствами лежат Декларация о принципах взаимоотношений между Российской Федерацией и Республикой Куба1, Меморандум о принципах стратегического сотрудничества2 и Совместное заявление президентов двух стран3, принятые в 1996, 2009 и 2018 гг. соответственно.
Тесные связи между Россией и Кубой приводят к усилению миграционных процессов между странами. Поскольку в России и на Кубе существует проблема распространения ВИЧ-инфекции, то всегда есть опасность заноса на территорию одной страны вариантов ВИЧ-1, циркулирующих на территории другой страны. Затем распространение этих вариантов в пределах отдельных уязвимых групп может привести к увеличению случаев инфекции данными вариантами, что способно повлиять на генетический ландшафт ВИЧ-инфекции и профиль лекарственной устойчивости (ЛУ) в стране. Одной из таких уязвимых групп являются мужчины с рискованным сексуальным поведением, в частности мужчины, практикующие секс с мужчинами (МСМ), и работники коммерческого секса (КСР). Для представителей данной группы типичны половые контакты с гражданами других стран, что способно повлиять на генетическое разнообразие ВИЧ-1 и привести к генерации новых рекомбинантных форм вируса.
На Кубе в последние годы отмечен рост числа случаев ВИЧ-инфекции. По данным Объединённой программы Организации Объединённых Наций по ВИЧ/СПИДу (ЮНЭЙДС), общее число людей, живущих с ВИЧ-1 на Кубе, продолжало расти в последнее десятилетие, увеличившись с 3100 в 2000 г. до 14 000 в 2011 г. [1] и до 44 000 в 2023 г.4 Между тем в последние годы Куба демонстрирует успех в диагностике и лечении ВИЧ-инфекции. В общей сложности 33 000 (75%) человек в 2023 г. знали о своём ВИЧ-статусе. Из них 28 000 (84,84%) находились на антиретровирусной терапии (АРТ). Наконец, 24 000 (85,72%) пациентов, получавших АРТ, имели вирусологический успех. Таким образом, Куба уверенно приближается к выполнению стратегии Всемирной организации здравоохранения по противодействию ВИЧ-инфекции 90–90–90 и имеет перспективы достигнуть основных показателей стратегии 95–95–95 к 2030 г. [2].
Генетическое разнообразие ВИЧ-1 на Кубе сильно отличается от такового на территории стран Карибского бассейна. В то время как на территории большинства государств этого региона доминирует вирус субтипа B, связанный с более чем 90% случаев инфекции в начале 2000-х гг., на Кубе активно циркулирует большое количество других генетических вариантов ВИЧ-1, включая рекомбинантные формы, распространённые исключительно на острове [3]. Так, если ещё в середине 1990-х гг. доминирующим вирусным вариантом на Кубе был субтип B [4], то исследование 2002 г. показало, что лишь 48% пациентов были инфицированы этим генетическим вариантом [5]. В 2017 г. доля субтипа B в образцах от пациентов старше 18 лет, собранных за 1-е полугодие 2017 г., составила лишь 26,9%, а на инфекцию различными рекомбинантными формами приходилось 59,5% случаев ВИЧ-инфекции [6].
Касательно субтипа B, распространённого на Кубе, следует упомянуть, что этот вариант генетически близок к вирусу, доминирующему в США и большинстве стран Западной Европы, но отличается от вирусов, распространённых в других странах Карибского бассейна [1, 7, 8]. Одни исследователи связывают это с многократным несвязанным заносом субтипа B из США, Канады и европейского континента в конце 1970-х гг. [7]. Другие предполагают, что он попал на Кубу в начале 1990-х гг. из США, когда на фоне экономического кризиса, вызванного разрушением СССР, стал развиваться туристический бизнес на Кубе, а миграционные потоки переключились на США [1].
Помимо субтипа B, на Кубе циркулирует рекомбинантная форма CRF19_cpx, чей геном представлен фрагментами генома ВИЧ-1 субтипов D, A1 и G [3, 9]. Впервые CRF19_cpx был описан на Кубе в 1999 г. [10]. Детальный анализ позволил установить, что CRF19_cpx является рекомбинантом двух вирусных вариантов: AG-рекомбинанта из Камеруна, позже описанного как рекомбинант CRF37_cpx, и вируса субтипа D из Габона [9–11]. По-видимому, CRF19_cpx появился в кубинской общине на территории Демократической Республики Конго (ДРК) в 1966–1970 гг., откуда попал в провинцию Вилья-Клара (Куба) в конце 1970-х гг., т. е. до заноса ВИЧ-1 в страны Западной Европы (в конце 1970-х гг.). Далее произошло его распространение в Гавану и другие провинции Кубы [8, 10, 12]. К 2017 г. на этот генетический вариант приходилось 24,1% новых случаев ВИЧ-инфекции среди пациентов старше 18 лет [6].
Кроме CRF19_cpx, на Кубе широко распространён ещё один рекомбинант со сложной, мозаичной структурой генома — CRF18_cpx. По-видимому, он также имеет африканское происхождение и мог быть занесён с территории ДРК, Центральноафриканской Республики, Республики Камерун или Республики Ангола [1, 12, 13]. Структура генома CRF18_cpx более сложная, чем у CRF19_cpx, и представлена участками, идентичными вирусам субтипов A, F, G, H, K и U. При описании данного генетического варианта выявлены 40 генетически родственных образцов вирусов, включая вирусы CRF04_cpx и CRF13_cpx [13].
Период с середины 1980-х до середины 1990-х гг. отметился на Кубе появлениями в среде ВИЧ-инфицированных других рекомбинантных форм, включая BG-рекомбинанты [1]. Причём BG-рекомбинанты, циркулирующие на Кубе, имеют кубинское происхождение [3], став результатом рекомбинации вариантов ВИЧ-1 субтипов B и G, ранее уже циркулировавших на острове [1]. Вероятно, это событие произошло примерно в 1991 г. Все кубинские BG-рекомбинанты (CRF20, CRF23, CRF24) имеют общее происхождение от субтипа G из Центральной Африки, циркулирующего в среде гетеросексуалов, и субтипа B (близкого к распространённому в США), циркулирующего среди МСМ в Гаване в начале 2000-х гг. Закономерно, что изначально BG-рекомбинанты были выявлены именно в среде МСМ в Гаване, а к 2003 г. определяли более 30% случаев ВИЧ-инфекции в столице Кубы [1, 8, 12].
Этот факт ярко иллюстрирует роль рекомбинации как одного из движущих факторов генетической изменчивости ВИЧ-1 и делает Кубу одной из «горячих точек рекомбинации ВИЧ-1» наряду с Мьянмой, Южным Китаем, Восточной Африкой, Аргентиной и Бразилией [8]. Более того, сформированные на Кубе рекомбинанты впоследствии стали распространяться по миру. Так, кубинский CRF20_BG обнаруживается в Испании и Греции [1].
Помимо упомянутых выше рекомбинантных форм, на Кубе циркулируют и другие варианты ВИЧ-1: как минимум 2 линии субтипа C из Восточной и Южной Африки [1]. Ставший прародителем BG-рекомбинантов ВИЧ-1 субтипа G с высокой долей вероятности имеет центральноафриканское происхождение [1]. Кроме того, отмечена активная циркуляция ВИЧ-1 субтипа H в провинции Сантьяго-де-Куба [12, 14]. Наконец, выявлены единичные случаи ВИЧ-инфекции, вызванной CRF05_DF, который ранее был зарегистрирован в Бельгии, ДРК, Испании и Коста-Рике [14].
Роль уязвимой группы МСМ в эпидемии ВИЧ-инфекции на Кубе является решающей. Если в 2002 г. чуть более 81% ВИЧ-инфицированных мужчин относились к МСМ [5], то в 1-м полугодии 2017 г. этот показатель достиг 94,31% [6]. И в настоящее время данная уязвимая группа является на Кубе доминирующей. Именно проникновение в среду МСМ ВИЧ-1 субтипа B в конце ХХ в. привело к активному распространению и доминированию этого варианта на Кубе [7]. Этот же фактор стал основой для увеличения генетического разнообразия на Кубе: уже в начале 2000-х гг. среди МСМ стали распространяться кубинские BG-рекомбинантные формы ВИЧ-1 [1, 8, 12].
Полномасштабное применение АРТ началось на Кубе в 2001 г. за счёт применения в первую очередь дженериков нуклеозидных ингибиторов обратной транскриптазы (НИОТ) и ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) [6], что позволило достичь вирусологического успеха у 83% пациентов в 2017 г. и почти 86% — в 2023 г. [6]. Однако применение АРТ привело и к росту ЛУ в стране. В 2017 г. распространённость ЛУ у АРТ-наивных пациентов хотя бы к одному препарату составила 29,8%, что превышает данный показатель в 2007–2011 гг. (12,5%) и 2009–2012 гг. (20,2%) [6].
В 2017 г. первичная ЛУ к НИОТ составила 10,6%, а к ННИОТ — более 23%. Распространённость ЛУ высокого уровня к ННИОТ была связана с частой встречаемостью мутаций K103N, G190A, Y181C [6]. Причём достоверно чаще ЛУ выявлялась у людей 18–25 лет по сравнению с группами более старшего возраста.
Между генетическим разнообразием ВИЧ-1 на Кубе и в России есть значительные различия. В России с конца 1990-х гг. доминирует ВИЧ-1 суб-субтипа A6, распространившийся в России и странах бывшего СССР через потребителей инъекционных наркотиков [15, 16]. Вторым наиболее часто встречающимся вариантом ВИЧ-1 является рекомбинант CRF63_02A6, в последние годы активно распространяющийся в странах Центральной Азии и сибирском регионе России [15, 17].
В России выявлена циркуляция двух вариантов ВИЧ-1 субтипа B: Bwest, характерного для стран Западной Европы и Кубы, и Bfsu (IDU-B), чья циркуляция была отмечена на Дальнем Востоке России и который вместе с суб-субтипом A6 стал прародителем CRF03_AB [15, 16, 18, 19]. Также в России отмечена циркуляция субтипа C, CRF03_AB, суб-субтипа G ВИЧ-1 [15].
В последние годы в России часто выявляются уникальные и редкие AG-рекомбинантные формы, вероятно, заносимые из стран Центральной Азии [15].
Проблема ВИЧ-инфекции среди МСМ в России также имеет свои особенности, связанные, в первую очередь, с недостаточной изученностью этой уязвимой группы. Если до середины 1990-х гг. МСМ были основной уязвимой группой, то после проникновения ВИЧ-1 в среду потребителей инъекционных наркотиков именно данная группа стала основной уязвимой группой, а вклад МСМ в эпидемию ВИЧ-инфекции в России стал исчезающе низким [15, 16, 18, 20]. Во многом это может быть объяснено стигматизацией МСМ и отсутствием работ по мониторингу этой группы в России [18, 20]. Между тем существуют оценки вероятной распространённости ВИЧ-1 в среде МСМ в разных регионах страны — 5–25%, а ЮНЭЙДС в 2016 г. указывал на величину этого показателя в России в 6% [18].
В последние годы доля МСМ среди новых случаев ВИЧ-инфекции в России постепенно растёт. Так, на конец 2020 г. лишь 2,8% случаев ВИЧ-инфекции в стране были связаны с МСМ. К концу 2021 г. этот показатель увеличился до 3%, а к концу 2023 г. — до 4,1%5.
В среде российских МСМ исторически доминировал Bwest, однако в недавнем прошлом наметилась тенденция к увеличению в этой уязвимой группе доли ВИЧ-1 суб-субтипа A6 [15, 18], что говорит о размытии границ данной уязвимой группы. Кроме того, выявлена циркуляция в среде российских МСМ BG-рекомбинантов, генетически близких к вирусам, циркулирующим в Испании и Португалии, но не относящихся к CRF20/23/24, распространённым на Кубе [21].
Что касается проблемы ЛУ ВИЧ-1 в России, то наиболее часто выявлялись мутации устойчивости в тех же позициях, что и для кубинских образцов, — K103N/S, G190A/S. Между тем вместо Y181C в российских образцах чаще обнаруживают замену K101E, вызывающую устойчивость ко всем ННИОТ [22].
С учетом вышеописанных особенностей ВИЧ-инфекции на Кубе и в России, а также роли МСМ в эпидемии ВИЧ-инфекции в обеих странах, целью нашего исследования был анализ генетических вариантов ВИЧ-1 и лекарственной устойчивости вируса в образцах плазмы крови, полученных от мигрантов-МСМ с Кубы, проживающих в Москве — одном из наиболее экономически развитых центров России, где исторически существует обширное сообщество МСМ и мигрантов.
Материалы и методы
Исследована коллекция образцов плазмы крови, полученных от МСМ — граждан Кубы в период с марта 2022 г. по июнь 2024 г. Одновременно производили сбор и обработку клинико-эпидемиологических данных: возраст, даты последнего отрицательного теста и первого положительного теста на ВИЧ-инфекцию, информация о вероятном месте и времени инфицирования, количестве половых партнеров, опыте приёма АРТ, а также о стадии ВИЧ-инфекции. Набор пациентов для включения в исследование проводили в сотрудничестве с некоммерческими организациями: Фондом «Шаги»6 и Центром «LaSky»7.
Средний возраст пациентов составил 30 лет (95% доверительный интервал (ДИ) 27,29–33,68). Большинство пациентов (n = 18; 66,67%) стали посещать Россию и жить в Москве в 2021–2023 гг., самый ранний визит в Россию у 1 пациента состоялся в 2018 г. Для основной части пациентов (n = 19; 70,37%) длительность ВИЧ-инфекции от момента постановки диагноза до включения в исследование составляла не более 1 мес. Для 4 пациентов длительность инфекции от момента выявления ВИЧ-1 составляла от 3,5 до 10 мес. Еще у 4 пациентов длительность инфекции была более 1,5 года.
Два пациента не имели представления о возможной дате и месте инфицирования, для 25 (92,59%) пациентов средняя длительность инфекции с момента предполагаемого инфицирования была более 2 лет (780 дней; 95% ДИ 377,91–1181,69). Но эти данные не точные, т. к. пациенты могли указать только год (n = 12) или год и месяц (n = 13) предполагаемого инфицирования. В общей сложности 15 (55,56%) пациентов заявляли Москву как вероятное место инфицирования. Ещё 10 пациентов предполагали, что их инфицирование произошло на Кубе. Предполагаемое место инфицирования учитывалось в дальнейшем анализе генетических вариантов ВИЧ-1 в образцах.
Пять пациентов на момент забора образца были трансгендерными лицами. Десять пациентов (4 из которых были трансгендерными лицами) относились к группе КСР. Ещё 2 пациента указывали на большое количество половых партнёров за последние 6 мес и не могли назвать точное число; 4 пациента имели 30, 20, 10 и 5 половых партнёров соответственно; 2 пациента — по 4, ещё 2 пациента — по 3; 5 пациентов указали 1 партнёра и 2 не имели связей за последние 6 мес.
Опыт терапии в прошлом был у 5 (22,72%) пациентов, но все они прекратили приём препаратов минимум за 3 мес до включения в исследование. Пациент M222 периодически принимал эфавиренз + тенофовира дизопроксила фумарат + ламивудин, делая перерывы в несколько месяцев. У пациента M208, включённого в исследование в 2024 г., был опыт приёма трувады (эмтрицитабин + тенофовира дизопроксила фумарат) в 2022 г. Наконец, 3 пациента (M80, M177, M223) имели опыт эпизодического приёма неустановленных средств АРТ.
В образцах плазмы крови была определена концентрация РНК ВИЧ-1 (вирусная нагрузка, ВН), количество CD4-лимфоцитов.
Получены нуклеотидные последовательности региона pol (позиции 2253–3353 референсного штамма HXB-2, номер GenBank K03455), кодирующего протеазу, и фрагмент обратной транскриптазы ВИЧ-1 в исследованных образцах. Секвенирование проводили с помощью набора реагентов «АмплиСенс HIV-Resist-Seq» (ЦНИИ Эпидемиологии) и генетического анализатора «Applied Biosystems» («Life Technologies»).
Проведён последовательный анализ, включающий предварительное определение генетического варианта с помощью онлайн-приложения HIVBlast8, филогенетического анализа в программе «MEGA 6.0» [23] и кластерного анализа нуклеотидных последовательностей с помощью программы «ClusterPicker 1.2.3» (порог генетической дистанции 4,5% с bootstrap-поддержкой более 90%)9.
Для проведения филогенетического и кластерного анализов полученная выборка была дополнена нуклеотидными последовательностями кубинских пациентов (n = 430) из международной базы данных ВИЧ-1 Института Лос-Аламос (США)10, описанными в публикациях, посвящённых анализу образцов ВИЧ-1, выделенных на территории Кубы в 2007–2017 гг. [3, 6, 10]. Для филогенетического анализа геномов, генетически близких к циркулирующим в России вариантам ВИЧ-1, применяли подборку референтных последовательностей, использованную ранее при анализе вариантов ВИЧ-1, циркулировавших в странах Восточной Европы и Центральной Азии в 2010–2019 гг. [15].
Анализ ЛУ ВИЧ-1 проводили с помощью онлайн-приложения HIVdb базы данных Стэндфордского университета11 с определением как самих мутаций устойчивости, так и уровня ЛУ на основании подсчёта баллов Stanford Penalty Score [22, 24].
Полученные в ходе работы нуклеотидные последовательности были депонированы в Российскую базу данных устойчивости ВИЧ к антиретровирусным препаратам — RuHIV (https://ruhiv.ru/) под номерами RHD10698, RHD10712, RHD10720, RHD10721, RHD10725, RHD10727, RHD10733-RHD10736, RHD10739, RHD16068, RHD16123, RHD16132, RHD17497, RHD17505, RHD17513, RHD17514, RHD20769, RHD20773, RHD20782, RHD20783, RHD20796-RHD20798, RHD20806, RHD20813.
Данное исследование было одобрено ЛЭК ЦНИИ Эпидемиологии (протокол № 142 от 25.04.2024).
Результаты
Средний уровень ВН составил 5,33 (95% ДИ 5,19–5,44) log копий/мл, среднее число CD4-лимфоцитов — 405 (95% ДИ 296,34–513,34) клеток/мкл. Для 23 (85,19%) пациентов была определена 2а стадия ВИЧ-инфекции. Еще 4 пациента были на 3-й стадии. Не выявлено достоверных различий между стадией ВИЧ-инфекции и величиной ВН или числом CD4-лимфоцитов.
Был проведён анализ генетических вариантов ВИЧ-1 в образцах на основе поиска максимально генетически близких референтных последовательностей из базы данных GenBank с помощью онлайн-приложения HIVBlast. Результаты анализа представлены в таблице. Генетически близким с референтными последовательностями ВИЧ-1 с Кубы оказался 21/27 (77,78%) образец. При этом 12 (57,14%) из 21 пациентов, инфицированных этими вариантами ВИЧ-1, предполагали, что их инфицирование произошло в Москве, а не на Кубе.
Результаты предварительного генотипирования нуклеотидных последовательностей ВИЧ-1 в онлайн-приложении HIVBlast
Образец | Предполагаемое место инфицирования | Референтная последовательность в HIVBlast | |||
номер GenBank | генетический вариант | страна | генетическая близость, % | ||
M52 | Москва | MZ004274 | CRF19_cpx | Куба | 98 |
M67 | Москва | MZ004382 | CRF19_cpx | Куба | 95 |
M75 | Москва | MK817409 | CRF20_BG | Куба | 98 |
M76 | Москва | MK817388 | CRF20_BG | Куба | 96 |
M80 | Москва | MH471360 | Субтип B | Германия | 96 |
M82 | Москва | MH667011 | Субтип B | Россия | 98 |
M88 | Москва | DQ113271 | CRF19_cpx | Куба | 95 |
M89 | Москва | MZ004339 | CRF19_cpx | Куба | 96 |
M90 | Не известно | DQ113301 | Субтип B | Куба | 96 |
M91 | Москва | JQ585469 | Субтип B | Куба | 97 |
M94 | Москва | DQ113060 | CRF19_cpx | Куба | 96 |
M96 | Москва | OL792340 | Суб-субтип A6 | Россия | 97 |
M151 | Куба | KJ770458 | Субтип B | Германия | 96 |
M160 | Москва | MZ004178 | CRF19_cpx | Куба | 97 |
M169 | Москва | MK817435 | CRF18_cpx | Куба | 96 |
M177 | Москва | AY900579 | CRF24_BG | Куба | 97 |
M185 | Куба | KR860993 | Субтип C | Ботсвана | 95 |
M186 | Куба | KR860993 | Субтип C | Ботсвана | 94 |
M195 | Москва | JN000054 | CRF20_BG | Куба | 97 |
M199 | Куба | JN000009 | Субтип B | Куба | 97 |
M208 | Куба | MK817498 | CRF18_cpx | Куба | 96 |
M209 | Куба | MK817361 | Субтип B | Куба | 97 |
M222 | Куба | JN000021 | CRF24_BG | Куба | 96 |
M223 | Куба | MK817465 | CRF18_cpx | Куба | 96 |
M224 | Не известно | DQ020274 | CRF20_BG | Куба | 90 |
M232 | Куба | MK817454 | CRF18_cpx | Куба | 98 |
M240 | Куба | DQ113256 | Субтип B | Куба | 96 |
Два пациента были инфицированы ВИЧ-1 субтипа C, типичным для Ботсваны. Ещё 2 пациента имели ВИЧ-1 субтипа B, близкого к вирусам, выделенным в Германии: пациент M151, инфицированный ВИЧ-1 субтипа B, предполагал свое заражение на Кубе, а пациент M80 — в Москве.
Лишь от 2 пациентов были получены образцы ВИЧ-1, типичные для России: один пациент был инфицирован вирусом суб-субтипа A6, а ещё один — вирусом, генетически близким к референтам субтипа B из Чехии и России, причём российские референтные вирусы A6 и B были выделены от пациентов-мужчин c гомосексуальным и с гетеросексуальным путём передачи ВИЧ-1 в 2019 и 2015 гг. соответственно.
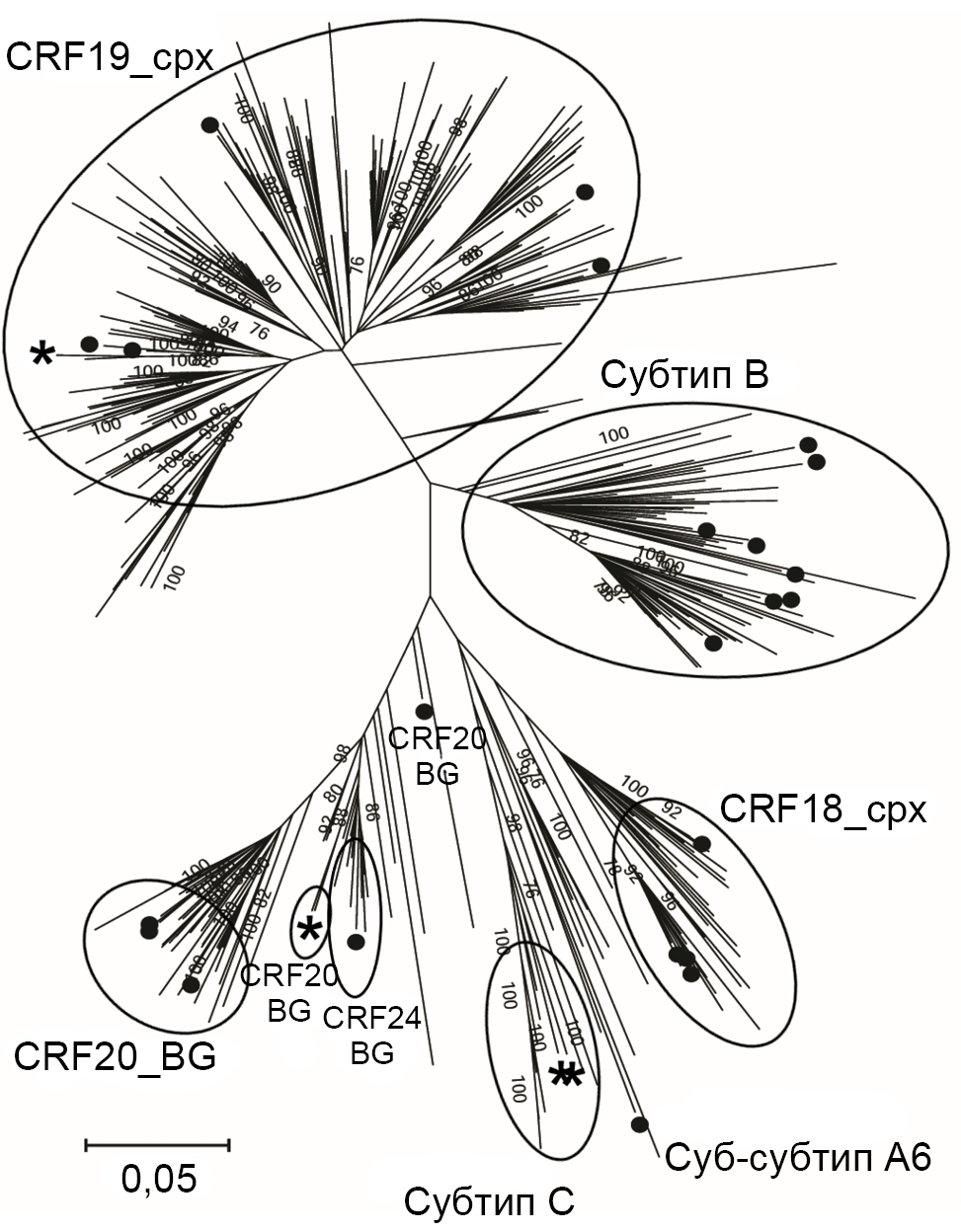
Полученные результаты предварительного генотипирования были в основной массе подтверждены филогенетическим анализом с референтными нуклеотидными последовательностями ВИЧ-1, выделенными от кубинских пациентов в 2007–2017 гг. (рис. 1). Эта же подборка референтных последовательностей и исследуемых геномов (n = 457) была подвергнута кластерному анализу.
Рис. 1. Результаты филогенетического и кластерного анализа нуклеотидных последовательностей фрагмента гена pol (позиции 2253–3353) исследуемой коллекции образцов ВИЧ-1 (n = 27) и группы сравнения (n = 430) кубинских образцов ВИЧ-1.
Филогенетический анализ проведён по методу максимального правдоподобия с использованием GTR+G+I-модели нуклеотидных замен в 500 независимых построениях. Кластерный анализ проводили с порогом генетической дистанции 4,5% и bootstrap-поддержкой более 90%. Последовательности исследуемой коллекции, сформировавшие кластеры, обозначены звездочками, не образовавшие — чёрными кружками.
Выявлены 3 кластера, образованных исследуемыми образцами:
1) кластер, образованный 2 образцами ВИЧ-1 субтипа С от эпидемиологически связанных пациентов M185 и M186;
2) кластер, образованный образцом от пациента M222 и референтом MK817363;
3) кластер, образованный образцом M160 и референтными последовательностями MZ004165 и MZ004178.
Пациент M222 — КСР, практикующий секс под химическими препаратами. ВИЧ-инфекция была выявлена у него в 2013 г., а предполагаемым местом заражения в том же 2013 г. была Куба. Поэтому не является неожиданностью формирование кластера между M222 и MK817363 — вирусом CRF20_BG, изолированным на Кубе в 2017 г. Интересно, что изначально этот образец в программе HIVBlast был идентифицирован как CRF24_BG (таблица), поскольку по исследуемому генетическому фрагменту CRF20 и CRF24 очень близки. Кластерный анализ позволил скорректировать эти данные, отнеся исследуемый образец к CRF20.
В то же время пациент M160, чей образец образовал общий кластер с образцами CRF19_cpx MZ004165 и MZ004178, выделенными в Гаване в 2013 г. от мужчины и женщины соответственно, также был КСР и трансгендерной персоной. ВИЧ-инфекция у пациента была выявлена в июне 2023 г., а предполагаемые место и дата инфицирования — Москва, январь 2022 г.
Образцы от пациентов M82 и M96, генетически близкие российским вирусам субтипа B и суб-субтипа A6 соответственно, были подвергнуты дополнительному филогенетическому анализу с референтными последовательностями циркулирующих в России генетических вариантов ВИЧ-1 (рис. 2). Образец M96 в 82% возможных построений образовывал общую ветвь с референтами суб-субтипа A6 AF413987 и AY500393. Образец M82, в свою очередь, с достоверностью в 78% образовывал общую ветвь с российским референтом Bwest AY819715 и основным мировым референтом этой же линии HXB-2 K03455.
Рис. 2. Результаты филогенетического анализа нуклеотидных последовательностей фрагмента гена pol (позиции 2253–3353) образцов ВИЧ-1 от пациентов M82 и M96, предположительно принадлежащих к генетическим вариантам, циркулирующим в России.
Филогенетический анализ проведён по методу максимального правдоподобия с использованием HKY+G-модели нуклеотидных замен и bootstrap-поддержкой 500. Последовательности M82 и M96 обозначены чёрными кружками. Подветви, образованные вирусами суб-субтипа A6, генетическими вариантами Bwest и Bfsu, выделены рамками.
Ни в одном образце ВИЧ-1 не было выявлено ЛУ к ингибиторам протеазы (рис. 3). ЛУ к хотя бы одному ингибитору обратной транскриптазы была выявлена в 9 (33,33%; 95% ДИ 15,55–51,11) образцах, причём 3 (11,11%; 95% ДИ 0–22,97) образца (один CRF19_cpx и два CRF20_BG) имели устойчивость и к НИОТ, и к ННИОТ. Типичные для России вирусы из упомянутых выше образцов от пациентов M82 и M96 не содержали ЛУ, как и вирусы субтипа C от пациентов M185 и M186 и ВИЧ-1 субтипа B от пациента M80. Наиболее часто (в 29,63% образцов; 95% ДИ 12,41–46,85) выявлялась ЛУ (преимущественно высокого уровня) к ННИОТ эфавирензу и невирапину, что было связано с мутациями K103N, Y181C и P225H (рис. 3).
Рис. 3. Результаты анализа частоты встречаемости ЛУ (a) и мутаций ЛУ к ингибиторам ВИЧ-1 классов НИОТ и ННИОТ (б).
ABC — абакавир; AZT — зидовудин; d4T — ставудин; ddl — диданозин; FTC — эмтрицитабин; 3TC — ламивудин; TDF — тенофовир дизопроксил; DOR — доравирин; EFV — эфавиренз; ETR — этравирин; NVP — невирапин; RPV — рилпивирин.
Анализ проведён с помощью онлайн-приложения HIVdb, степень устойчивости была определена на основании подсчёта баллов Stanford Penalty Score.
Устойчивость к рилпивирину также была связана с присутствием мутаций Y181C, K101E и E138A. Наконец, ЛУ высокого уровня к НИОТ эмтрицитабину и ламивудину у вируса в 2 (7,41%; 95% ДИ 0–17,29) образцах была связана с наличием мутации M184V.
У 6 из 9 пациентов, инфицированных ВИЧ-1 с ЛУ, не было опыта терапии, а у 3 — был опыт в прошлом. Пациент M222 с опытом приёма эфавиренз + тенофовир дизопроксил + ламивудин имел вирус с ЛУ высокого уровня к эфавирензу (и перекрестной ЛУ к невирапину) и ламивудину из-за сочетания мутаций M184V, K103N и P225H. У пациента M208 с опытом приёма трувады за 2 года до исследования был выявлен ВИЧ-1 только с мутацией K103N, вызывающей ЛУ высокого уровня к эфавирензу и невирапину. Эту же замену содержал вирус в образце пациента M223.
Обсуждение
Полученные нами результаты определения генетического варианта ВИЧ-1 говорят о том, что абсолютное большинство пациентов — 21 (77,78%), было инфицировано вариантом вируса, типичным для страны происхождения пациента — Кубы. В случае 12 из 15 пациентов, указавших в качестве вероятного места инфицирования Москву, либо имело место заражения от гражданина Кубы или общего с ним полового партнера, либо неверная оценка места вероятного заражения. Выявленные нами 2 случая инфекции типичным для Ботсваны вирусом субтипа C, скорее всего, произошли на территории Кубы, как и предполагали пациенты, т. к. на Кубе в 2013 г. были выявлены «африканские» варианты ВИЧ-1 [1]. То же касается пациента M151, у которого выявлена ВИЧ-инфекция вирусом субтипа B, генетически близким к вирусу, циркулирующему на территории Германии, что отражает связь эпидемии ВИЧ-инфекции на Кубе и в Западной Европе [1, 7].
Два образца — М222 (CRF20_BG) и М160 (CRF19_cpx) — образовали два «активных» (расширяющихся) кластера, в которые вошли также образцы, выделенные от кубинцев в другой временной период (разница в 4 года и 10 лет соответственно). Это говорит о продолжении циркуляции и дальнейшем распространении этих вирусных генетических линий в мире.
Таким образом, в общей сложности 24 (88,88%) исследованных нами МСМ — граждан Кубы, проживающих в Москве, вероятно, были инфицированы либо на родине, либо от своего согражданина. Лишь 3 пациента могли быть инфицированы на территории России:
- пациенты M82 и M96, инфицированные ВИЧ-1, типичными для территории России;
- пациент M80, инфицированный вирусом субтипа B, генетически близким к штамму, циркулирующему на территории Германии. Между тем циркуляция западноевропейских вариантов ВИЧ-1 типична для уязвимой группы МСМ в России [18, 20, 21].
Полученные нами данные о частоте встречаемости ЛУ имеют низкую статистическую достоверность из-за небольшого размера выборки (n = 27), что не позволяет достоверно сравнивать наши результаты с опубликованными данными о ЛУ ВИЧ-1 на Кубе. Мы выявили ЛУ в 9 образцах вируса, 3 из которых были получены от пациентов, имевших опыт терапии. Наиболее часто выявляемая ЛУ высокого уровня к эфавирензу и невирапину — тенденция последних лет в России и странах с низким и средним уровнем дохода населения [22, 24]. Наличие ВИЧ-1 с ЛУ у 6 (25%; 95% ДИ 8,67-41,33) из 24 пациентов, вероятно получивших ВИЧ-1 от граждан Кубы, является следствием проблемы распространения ЛУ на Кубе [6]. При этом применение эффективных схем терапии может стать залогом вирусологического успеха даже на фоне устойчивости ВИЧ-1 к эфавирензу и невирапину.
Заключение
Наши результаты говорят о вкладе миграции с Кубы в генетическое разнообразие ВИЧ-1 среди МСМ в Москве в последние годы и о её влиянии на распространение ЛУ ВИЧ-1 в этой уязвимой группе. Однако достоверные данные о степени такого влияния могут быть получены лишь при исследовании более широкой выборки пациентов группы МСМ. Таким образом, фактор миграции должен учитываться в программах профилактики и противодействия распространению ВИЧ-инфекции в России, а для эффективного лечения пациентов с ЛУ-вариантами ВИЧ-1 необходим подбор эффективной схемы терапии.
1 Декларация о принципах взаимоотношений между Российской Федерацией и Республикой Куба. 1996. URL: https://docs.cntd.ru/document/1902532?section=text
2 Меморандум о принципах стратегического сотрудничества между Российской Федерацией и Республикой Куба. 2009. URL: https://docs.cntd.ru/document/902161646?section=text
3 Совместное заявление Президента Российской Федерации В.В. Путина и Председателя Государственного Совета и Совета Министров Республики Куба М. Диас-Канеля Бермудеса об общих подходах в международных делах. 2018. URL: http://www.kremlin.ru/supplement/5354
4 Информационный бюллетень ЮНЭЙДС по странам. Куба, 2023. URL: https://www.unaids.org/en/regionscountries/countries/cuba
5 Федеральный научно-методический центр по профилактике и борьбе со СПИДом. URL: http://www.hivrussia.info
6 Фонд по профилактике социально значимых заболеваний «Шаги». URL: http://stepsfund.ru
7 Низкопороговый центр профилактики ВИЧ-инфекции и поддержки людей, живущих с ВИЧ в Москве и Московской области. URL: https://lasky.ru
8 Los Alamos National Laboratory. HIV BLAST. URL: https://www.hiv.lanl.gov/content/sequence/BASIC_BLAST/basic_blast.html
9 Leigh Brown HIV Research Group. Picking and Describing HIV Clusters in Phylogenetic Trees. URL: https://hiv.bio.ed.ac.uk/software.html
10 Los Alamos National Laboratory. HIV databases. URL: https://www.hiv.lanl.gov
11 Stanford HIV Drug Resistance Database. URL: https://hivdb.stanford.edu
Об авторах
Илья Андреевич Лаповок
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Автор, ответственный за переписку.
Email: i_lapovok@mail.ru
ORCID iD: 0000-0002-6328-1415
канд. биол. наук, с. н. с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваАлина Алексеевна Кириченко
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: kirichenko@cmd.su
ORCID iD: 0000-0002-7116-0138
канд. мед. наук, с. н. с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваАнастасия Вениаминовна Шлыкова
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: murzakova_a.v@mail.ru
ORCID iD: 0000-0002-1390-8021
н. с. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваДмитрий Евгеньевич Киреев
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора
Email: dmitkireev@yandex.ru
ORCID iD: 0000-0002-7896-2379
канд. биол. наук, зав. лаб. диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, МоскваАнна Анатольевна Попова
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора; Российская медицинская академия непрерывного профессионального образования
Email: asya-med@mail.ru
ORCID iD: 0000-0001-9484-5917
канд. мед. наук, с. н. с. Специализированного научно-исследовательского отдела по профилактике и борьбе со СПИДом ЦНИИ Эпидемиологии, доцент каф. инфекционных болезней РМАНПО
Россия, Москва; МоскваАнастасия Вадимовна Покровская
Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора; Российский университет дружбы народов имени Патриса Лумумбы
Email: pokrovskaya@cmd.su
ORCID iD: 0000-0002-2677-0404
д-р мед. наук, с. н. с. ЦНИИ Эпидемиологии, профессор каф. инфекционных болезней с курсами эпидемиологии и фтизиатрии Медицинского института РУДН им. Патриса Лумумбы
Россия, Москва; МоскваСписок литературы
- Delatorre E., Bello G. Phylodynamics of the HIV-1 epidemic in Cuba. PLoS One. 2013;8(9):e72448. DOI: https://doi.org/10.1371/journal.pone.0072448
- Frescura L., Godfrey-Faussett P., Feizzadeh A.A., et al. Achieving the 95 95 95 targets for all: A pathway to ending AIDS. PLoS One. 2022;17(8):e0272405. DOI: https://doi.org/10.1371/journal.pone.0272405
- Kouri V., Khouri R., Alemán Y., et al. CRF19_cpx is an evolutionary fit HIV-1 variant strongly associated with rapid progression to AIDS in Cuba. EBioMedicine. 2015;2(3):244–54. DOI: https://doi.org/10.1016/j.ebiom.2015.01.015
- Rolo F., Miranda L., Wainberg M., et al. Envelope V3 region sequences of Cuban HIV-1 isolates. J. Acquir. Immune Defic. Syndr. Hum. Retrovirol. 1995;9(2):123–5.
- Cuevas M.T., Ruibal I., Luisa M., et al. Villahermosa high HIV-1 genetic diversity in Cuba. AIDS. 2002;16(12):1643–53. DOI: https://doi.org/10.1097/00002030-200208160-00010
- Machado L.Y., Blanco M., López L.S., et al. National survey of pre-treatment HIV drug resistance in Cuban patients. PLoS One. 2019;14(9):e0221879. DOI: https://doi.org/10.1371/journal.pone.0221879
- Machado-Zaldívar L.Y., Díaz-Torres H.M., Blanco-de Armas M., et al. Origin and evolutionary history of HIV-1 subtype B in Cuba. MEDICC Rev. 2017;19(2-3):40. DOI: https://doi.org/10.37757/MR2017.V19.N2-3.7
- Pérez L., Thomson M.M., Bleda M.J. HIV type 1 molecular epidemiology in Cuba: high genetic diversity, frequent mosaicism, and recent expansion of BG intersubtype recombinant forms. AIDS Res. Hum. Retroviruses. 2006;22(8):724–33. DOI: https://doi.org/10.1089/aid.2006.22.724
- Casado G., Thomson M.M., Sierra M., et al. Identification of a novel HIV-1 circulating ADG intersubtype recombinant form (CRF19_cpx) in Cuba. J. Acquir. Immune Defic. Syndr. 2005;40(5):532–7. DOI: https://doi.org/10.1097/01.qai.0000186363.27587.c0
- Zhukova A., Voznica J., Dávila F.M., et al. Cuban history of CRF19 recombinant subtype of HIV-1. PLoS Pathog. 2021;17(8): e1009786. DOI: https://doi.org/10.1371/journal.ppat.1009786
- Powell R.L.R., Zhao J., Konings F.A.J., et al. Circulating recombinant form (CRF) 37_cpx: an old strain in Cameroon composed of diverse, genetically distant lineages of subtypes A and G. AIDS Res. Hum. Retroviruses. 2007;23(7):923–33. DOI: https://doi.org/10.1089/aid.2007.0040..
- Sierra M., Thomson M.M., Posada D. Identification of 3 phylogenetically related HIV-1 BG intersubtype circulating recombinant forms in Cuba. J. Acquir. Immune Defic. Syndr. 2007;45(2):151–60. DOI: https://doi.org/10.1097/QAI.0b013e318046ea47
- Thomson M.M., Casado G., Posada D. Identification of a novel HIV-1 complex circulating recombinant form (CRF18_cpx) of Central African origin in Cuba. AIDS. 2005;19(11):1155–63. DOI: https://doi.org/10.1097/01.aids.0000176215.95119.1d
- Machado L.Y., Blanco M., Dubed M., et al. HIV type 1 genetic diversity in newly diagnosed Cuban patients. AIDS Res. Hum. Retroviruses. 2012;28(8):956–60. DOI: https://doi.org/10.1089/aid.2011.0295
- Лаповок И.А., Кириченко А.А., Шлыкова А.В. и др. Молекулярно-эпидемиологический анализ генетических вариантов ВИЧ-1, циркулировавших в странах Восточной Европы и Центральной Азии в 2010–2019 гг. Эпидемиология и инфекционные болезни. Актуальные вопросы. 2022;12(3):31–40. Lapovok I.A., Kirichenko A.A., Shlykova A.V., et al. Molecular epidemiological analysis of HIV-1 genetic variants circulating in the countries of Eastern European and Central Asia in 2010–2019. Epidemiology and Infectious Diseases. Current Items. 2022;12(3):31–40. DOI: https://doi.org/10.18565/epidem.2022.12.3.31-40 EDN: https://elibrary.ru/poaufi
- Bobkova M. Current status of HIV-1 diversity and drug resistance monitoring in the former USSR. AIDS Rev. 2013;15(4):204–12.
- Kostaki E.G., Karamitros T., Bobkova M., et al. Spatiotemporal characteristics of the HIV-1 CRF02_AG/CRF63_02A1 epidemic in Russia and Central Asia. AIDS Res. Hum. Retroviruses. 2018;34(5):415–20. DOI: https://doi.org/10.1089/aid.2017.0233
- Kazennova E., Laga V., Gromov K., et al. Genetic variants of HIV type 1 in men who have sex with men in Russia. AIDS Res. Hum. Retroviruses. 2017;33(10):1061–4. DOI: https://doi.org/10.1089/aid.2017.0078
- Лаповок И.А., Лопатухин А.Э., Киреев Д.Е. и др. Молекулярно-эпидемиологический анализ вариантов ВИЧ-1, циркулировавших в России в 1987–2015 гг. Терапевтический архив. 2017;89(11):44–9. Lapovok I.A., Lopatukhin A.E., Kireev D.E., et al. Molecular epidemiological analysis of HIV-1 variants circulating in Russia in 1987–2015. Terapevticheskiy arkhiv. DOI: https://doi.org/10.17116/terarkh2017891144-49 EDN: https://elibrary.ru/zwosol
- Лаповок И.А., Кириченко А.А., Шлыкова А.В. и др. Анализ генетических вариантов ВИЧ-1 среди мужчин-мигрантов гомосексуальной ориентации, проживающих в Москве. Журнал инфектологии. 2023;15(2 S2):71–2. Lapovok I.A., Kirichenko A.A., Shlykova A.V., et al. Analysis of HIV-1 genetic variants among homosexual male migrants living in Moscow. Journal Infectology. 2023;15(2 S2):71–2. EDN: https://elibrary.ru/qtszlb
- Murzakova A., Kireev D., Baryshev P., et al. Molecular epidemiology of HIV-1 subtype G in the Russian Federation. Viruses. 2019;11(4):348. DOI: https://doi.org/10.3390/v11040348
- Kirichenko A., Kireev D., Lapovok I., et al. HIV-1 drug resistance among treatment-naïve patients in Russia: analysis of the national database, 2006–2022. Viruses. 2023;15(4):991. DOI: https://doi.org/10.3390/v15040991
- Tamura K., Stecher G., Peterson D., et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Mol. Biol. Evol. 2013;30(12):2725–9. DOI: https://doi.org/10.1093/molbev/mst197
- Kirichenko A., Kireev D., Lopatukhin A., et al. Prevalence of HIV-1 drug resistance in Eastern European and Central Asian countries. PLoS One. 2022;17(1):e0257731. DOI: https://doi.org/10.1371/journal.pone.0257731
Дополнительные файлы