Резистотипы как характеристика сообществ микроорганизмов, ассоциированных со здоровьем человека. Систематический обзор
- Авторы: Павленко А.В.1, Сонец И.В.1, Манолов А.И.1, Старикова Е.В.1, Ильина Е.Н.1
-
Учреждения:
- Научно-исследовательский институт системной биологии и медицины Роспотребнадзора
- Выпуск: Том 102, № 1 (2025)
- Страницы: 112-126
- Раздел: ОБЗОРЫ
- URL: https://microbiol.crie.ru/jour/article/view/18666
- DOI: https://doi.org/10.36233/0372-9311-597
- EDN: https://elibrary.ru/zrutam
- ID: 18666
Цитировать
Аннотация
Понятие резистотипа представляет собой новую характеристику бактериальных сообществ, отличную от их таксономического состава. Сейчас термином «резистотип» принято обозначать специфические кластеры внутри резистома, обладающие характерным фенотипическим профилем или набором генов резистентности к антимикробным препаратам. В отличие от традиционных подходов, которые фокусируются на отдельных генах резистентности или фенотипических проявлениях устойчивости, анализ резистотипов позволяет рассматривать устойчивость на более комплексном уровне, объединяя различные гены и их взаимодействия в рамках микробных популяций или целого микробного сообщества.
Цели и задачи обзора: проанализировать и обобщить актуальные данные о способах выявления и анализа резистотипов отдельных видов микроорганизмов и бактериальных сообществ.
Проведён анализ источников литературы, посвящённых выявлению резистотипов отдельных видов бактерий и бактериальных сообществ человека и сельскохозяйственных животных за прошедшие 10 лет.
На текущий момент выявление резистотипов микроорганизмов не является распространённой практикой для исследований, связанных с анализом резистентности. Для определения резистотипов изолятов бактерий используются фенотипические методы исследования, редко дополняемые генетическими или геномными данными. Для установления резистома и резистотипов сообществ микроорганизмов используются методы метагеномного секвенирования и биоинформатического анализа.
Заключение. Выявление резистотипов даёт дополнительную оценку резистома в различных популяциях микроорганизмов. Анализ резистотипов может быть применён как в клинической практике — для подбора наиболее подходящего метода терапии, так и в сельском хозяйстве — для улучшения контроля за антибиотикоустойчивостью микроорганизмов, патогенных для животных.
Ключевые слова
Полный текст
Интенсивное использование антимикробных препаратов приводит к увеличению количества генов резистентности как среди микроорганизмов, ассоциированных с биотопами тела человека, так и среди микроорганизмов, находящихся в его среде обитания. К последним могут относиться микроорганизмы, населяющие биотопы сельскохозяйственных и домашних животных, а также находящиеся в почве или на поверхностях предметов, окружающих человека. По данным Всемирной организации здравоохранения, около 50% антибактериальных препаратов используются не по назначению врача1. При этом, даже если человек не употребляет антибактериальные препараты, он всё равно может быть подвержен воздействию бактерий внешней среды, что может привести к распространению генов антибиотикорезистентности (АБР) в его собственной микрофлоре. Гены АБР могут быть приобретены не только комменсальной микрофлорой организма человека, но и патогенными или условно-патогенными микроорганизмами, что может существенно осложнить лечение инфекционных заболеваний.
Совокупность всех генов АБР, находящихся в одном биотопе, называют резистомом. Резистом биотопов, относящихся к организму человека, формируется в основном за счёт комменсальной микрофлоры, гены резистентности патогенных микроорганизмов составляют лишь небольшую его часть [1].
Использование полногеномного метагеномного секвенирования позволяет выявить большинство генов АБР, составляющих резистом, в том числе гены АБР в составе геномов некультивируемых микроорганизмов. Данный подход применяется в настоящее время для объективной характеристики резистома и последующего выявления резистотипов. Термин «резистотип» всё чаще можно встретить в научной литературе. Резистотипами принято называть специфические кластеры внутри резистома, обладающие характерным фенотипическим профилем или набором генов резистентности к антимикробным препаратам [2, 3].
Цели и задачи данного обзора: проанализировать и обобщить актуальные данные о способах выявления и анализа резистотипов отдельных видов микроорганизмов и бактериальных сообществ.
Поиск источников литературы осуществляли с использованием базы данных PubMed по запросу «resistotypes[text] OR resistotype[text]» (дата запроса 06.08.2024). Были рассмотрены полнотекстовые статьи, опубликованные в период с 2014 по 2024 г. Также был проведён поиск релевантных статей в базе данных Google Scholar по запросу «resistotype» за тот же период. В исследование были включены работы, в которых описаны отдельные резистотипы бактерий или микробных сообществ. Из результатов поиска были исключены работы, для которых не было возможности получить полный текст статьи, а также статьи, написанные не на английском языке (русскоязычных публикаций по данной теме не найдено, в том числе в базе данных eLIBRARY). В базе данных PubMed были обнаружены 43 статьи по вышеуказанному запросу. Также 5 статей были дополнительно включены в обзор на основании результатов поиска в базе данных Google Scholar (рис. 1). Из анализа были исключены 2 публикации на турецком языке и 22 статьи, в которых отсутствовало описание отдельных резистотипов.
Рис. 1. Схема отбора публикаций для обзора.
Fig. 1. Scheme for selecting publications for review.
В общей сложности на основании приведённых критериев включения/исключения были отобраны 24 публикации, вошедшие в настоящий обзор. Все проанализированные статьи описывали резистотипы отдельных изолятов бактерий или метагеномных сообществ как человека, так и сельскохозяйственных животных. Для определения резистотипов изолятов бактерий во всех публикациях использовали фенотипические методы исследования, редко дополняемые генетическими или геномными данными. Для определения резистома и резистотипов сообществ микроорганизмов применяли методы метагеномного секвенирования и биоинформатического анализа (табл. 1).
Таблица 1. Распределение публикаций по объекту исследования и применяемым методам определения резистотипов
Table 1. Distribution of publications by object of study and methods used to determine resistotypes
Тип исследований Type of research | Объект | Object | |
человек human | cельскохозяйственные животные farm animals | |
Метагеномные исследования Metagenomic studies | 6 | 1 |
Фенотипические методы/изоляты Phenotypic methods/isolates | 11 | 6 |
Резистотипы отдельных видов бактерий
Исследования, описывающие резистотипы отдельных видов бактерий, в настоящий момент посвящены либо анализу клинических изолятов, выделенных из образцов пациентов с различными инфекционными заболеваниями, либо анализу бактериальных изолятов, выделенных из образцов больных сельскохозяйственных животных. Для определения резистотипов у отдельных видов бактерий используются как классический диско-диффузионный метод определения фенотипической чувствительности к антибиотикам (АБ), так и методы генетического тестирования и полногеномного секвенирования. Рассмотренные в данном разделе обзора публикации можно условно разделить на две группы:
- работы, описывающие резистотипы клинически значимых для человека бактерий [2–4, 7–20];
- работы, описывающие резистотипы возбудителей инфекционных болезней сельскохозяйственных животных [21–27].
Резистотипы клинически значимых бактерий
Традиционным подходом к определению резистотипов отдельных видов микроорганизмов является применение фенотипических методов тестирования чувствительности к АБ, при этом подавляющее большинство исследований посвящено изучению микроорганизмов, входящих в число патогенов группы ESKAPE. В частности, в исследовании B. Pérez-Viso и соавт. приводятся результаты идентификации резистотипов изолятов бактерий Escherichia coli (n = 9514), Klebsiella pneumoniae (n = 2137) и Enterobacter cloacae (n = 516) на основании диско-диффузионного тестирования чувствительности к ампициллину, цефалотину, цефокситину, амоксицилину и клавулановой кислоте [8]. В результате исследования были обнаружены 5 вариантов резистотипов бактериальных изолятов, из которых 4 варианта встречались у всех 3 видов бактерий (табл. 2).
Таблица 2. Характеристики резистотипов из публикации B. Pérez-Viso и соавт. [7]
Table 2. Characteristics of resistotypes from the publication B. Pérez-Viso et al. [7]
Обозначение резистотипа в тексте публикации Resistotype designation in the text of the publication | Особенности Features | Чувствительность к АБ Antibiotic sensitivity | Устойчивость к АБ Antibiotic resistance | Связь с носителями, если указана Association with carriers, if specified | Размер когорты Cohort size |
Wild-type | – | Все протестированные All tested | – | E. coli, K. pneumoniae, E. cloacae | 7101 |
BSBL resistotype | Наличие β-лактамазы широкого спектра (БЛРС), отсутствие БЛРС Presence of broad-spectrum beta-lactamases, absence of extended-spectrum β-lactamases | Цефалотин, цефокситин Cephalothin, cefoxitin | Ампициллин Ampicillin | E. coli | 3653 |
ESBL resistotype | Наличие БЛРС, отсутствие β-лактамазы ampC и карбапенемазы Presence of extended-spectrum β-lactamases, absence of β-lactamase ampC and carbapenemase | Цефалоспорины Cephalosporins | E. coli, K. pneumoniae, E. cloacae | 1217 | |
AmpC resistotype | Наличие ampC β-лактамазы, отсутствие карбапенемазы и БЛРС Presence of ampC β-lactamase, absence of carbapenemase and extended-spectrum β-lactamases | Цефалоспорины и клавулановая кислота Cephalosporins and clavulanic acid | E. coli, K. pneumoniae | 195 |
Некоторые из проанализированных изолятов не попадали ни в одну из описанных 4 групп. Спектры резистентности этих изолятов были различны для разных видов бактерий.
Относительная распространённость резистотипов внутри одного вида бактериальных изолятов была различна для разных видов. Если в изолятах E. сoli наиболее распространены резистотипы дикого типа и BSBL-типа (49 и 37% соответственно), то в изолятах K. pneumoniae и E. cloacae преобладали резистотип дикого типа и группа неклассифицированных резистотипов. При этом резистотип BSBL был идентифицирован только у изолятов E. сoli. Хотя в данной публикации приводится подробная характеристика резистотипов изолятов, существенным её недостатком является отсутствие анализа по сопоставлению резистотипов с метаданными пациентов, из образцов которых были выделены анализируемые изоляты [8].
Среди других публикаций, посвящённых анализу резистотипов отдельных бактерий, встречаются работы, аналогичным образом описывающие резистотипы K. pneumoniae [12, 15–17], Pseudomonas aeruginosa [11, 18], Acinetobacter spp. [11, 13, 15, 17], а также Enterococcus spp., Staphylococcus aureus, Enterobacter spp. [15] и Stenotrophomonas maltophilia [14]. Во всех вышеприведённых публикациях установление резистотипа бактерий проводилось путём тестирования их чувствительности к АБ диско-диффузионным методом или с помощью E-тестов.
Недавно было опубликовано исследование, демонстрирующее изменчивость резистотипов изолятов Burkholderia cenocepacia, выделенных из мокроты пациента с муковисцидозом [9]. У 1 пациента в течение 63 мес (более 5 лет) собирали образцы мокроты, из которых выделяли изоляты B. cenocepacia. Полученные изоляты тестировали на чувствительность к цефтазидиму, меропенему, миноциклину и триметоприму-сульфаметоксазолу. Всего было проанализировано 11 изолятов, каждый из которых обладал уникальным резистотипом (рис. 2). В данной статье термином «резистотип» авторы обозначали определённый профиль АБР, характерный для изолята, при этом резистотипы могли меняться с течением времени. Если изолят, выделенный в начале исследования, был чувствителен ко всем 4 АБ, то у изолятов, выделенных в последующие месяцы, профиль устойчивости менялся, при этом наблюдаемые изменения не всегда были связаны с увеличением резистентности. Изолят, устойчивый ко всем 4 АБ, был получен только на 18-м месяце исследования и в последующие месяцы более не выявлялся.
Рис. 2. Описание 11 резистотипов изолятов B. cenocepacia, выделявшихся из образцов взрослого пациента с муковисцидозом в течение 63 мес.
Профили резистотипов основаны на чувствительности изолятов к 4 АБ (цефтазидиму, меропенему, миноциклину и триметоприм-сульфаметоксазолу). S — чувствительный; I — промежуточно устойчивый; R — устойчивый. CAZ — цефтазидим; COTRIM — триметоприм-сульфаметоксазол; MERO — меропенем; MINO — миноциклин. Данные приводятся по публикации [9].
Fig. 2. Description of 11 resistotypes of B. cenocepacia isolates from adult cystic fibrosis patient samples over a period of 63 months.
Resistotype profiles were based on the sensitivity of the isolates to 4 antibiotics (ceftazidime, meropenem, minocycline, and trimethoprim-sulfamethoxazole). S, sensitive; I, intermediately resistant; R, resistant. CAZ, ceftazidime; COTRIM, trimethoprim-sulfamethoxazole; MERO, meropenem; MINO, minocycline. Data are based on the publication [9].
Наиболее характерным исследованием, описывающим установление резистотипа бактерий путём сочетания фенотипического и генетического тестирований, является публикация [7], посвящённая изучению микробиологических и клинических характеристик бактерий рода Serratia, где приводятся результаты работы, проводившейся в течение 16 лет (2005–2020 гг.). Серрации — условно-патогенные микроорганизмы, вызывающие у человека гнойно-воспалительные заболевания различной локализации. Наиболее изученным видом этого рода является S. marcescens. Данный патоген является возбудителем диарейных заболеваний, менингита, артрита, сепсиса и инфекций мочевыводящих путей. Виды рода Serratia считаются одними из основных источников бактериемии в перинатальных центрах. Вошедшие в цитируемое исследование изоляты Serratia spp. были выделены из образцов пациентов университетской больницы Рамона и Кохаля (Мадрид), возраст которых составлял от 21 дня до 97 лет. Для проведения полногеномного секвенирования и последующего анализа резистома Serratia spp. было отобрано 107 изолятов.
В результате проведённого биоинформатического анализа среди проанализированной выборки изолятов были выявлены 4 резистотипа (табл. 3).
Таблица 3. Характеристики резистотипов Serratia spp. из публикации [7]
Table 3. Characteristics of Serratia spp. resistotypes from article [7]
Обозначение резистотипа в тексте публикации Resistotype designation in the text of the publication | Основные гены-драйверы резистотипа Major driver genes of resistotype | Устойчивость к АБ Antibiotic resistance | Связь с носителями Association with carriers | Размер когорты Cohort size |
Resistotype 1 | aac6-Ic, blaSST-1, tet41 | Аминогликозиды, β-лактамы, тетрациклин Aminoglycosides, β-lactams, tetracycline | S. marcescens, S. nematodiphila, S. ureilytica | 62 |
Resistotype 2 | aac6-Ic, blaSRT-1, blaSHV-12, blaVIM-1, cmlB1 | Аминогликозиды, β-лактамы, карбапенемы, цефалоспорины, хлорамфеникол Aminoglycosides, β-lactams, carbapenems, cephalosporins, chloramphenicol | 37 | |
Resistotype 3 | aac6-Ic, aadA1, blaSRT-1, blaVIM-1, tet41, sul1, catA1, catB2, dfrB1, mphE, msrE | Аминогликозиды, β-лактамы, карбапенемы, тетрациклины, макролиды Aminoglycosides, β-lactams, carbapenems, tetracyclines, macrolides | 6 | |
Resistotype 4 | aac6-Ic, blaSRT-1, blaSHV-12, blaLAP-2, qnr-S1 | Аминогликозиды, β-лактамы, карбапенемы, фторхинолоны Aminoglycosides, β-lactams, carbapenems, fluoroquinolones | 2 |
Резистотип I (гены aac6-Ic, blaSST-1 и tet41) и резистотип II (aac6-Ic и blaSRT-1) были представлены наиболее часто (58 и 34,6% соответственно). Резистотип III выявлен у 6 изолятов, продуцирующих карбапенемазы (aac6-Ic, aadA1, blaSRT-1, blaVIM-1, tet41, sul1, catA1, catB2, dfrB1, mphE, msrE), а резистотип IV был представлен 2 штаммами, продуцирующими БЛРС blaSHV-12 (aac6-Ic, blaSRT-1, blaSHV-12, blaLAP-2 и qnr-S1).
Гены blaSST-1 и blaSRT-1, кодирующие индуцируемые β-лактамазы ampC в геномах S. marcescens, были обнаружены во всех изолятах. Их фенотипическое проявление наблюдалась у 89,7% протестированных изолятов, восприимчивых к цефотаксиму (87 из 97 изолятов). В цитируемой работе приводится подробное описание выявленных резистотипов Serratia spp., однако не проводится сопоставление резистотипов с метаданными пациентов, из образцов которых проанализированные изоляты были выделены [7].
Резистотипы возбудителей инфекций сельскохозяйственных животных
Резистом возбудителей инфекционных заболеваний животных является предметом активного изучения исследователей, в том числе ввиду тесного контакта человека с сельскохозяйственными животными. Например, S. Chhabra и соавт. описали резистотипы изолятов бактерии Rhodococcus equi, выделенных из образцов жеребят с респираторными заболеваниями [20]. Данный патоген присутствует в почве, а также в кишечном тракте крупного рогатого скота, лошадей, овец, свиней и некоторых других животных. Он может являться причиной респираторных заболеваний у жеребят в возрасте 1–4 мес. R. equi считается серьёзной угрозой для коневодства ввиду высокой заболеваемости и смертности среди инфицированных молодых лошадей. В вышеприведённой работе исследовали 28 клинических изолятов R. equi, полученных из образцов жеребят с респираторными заболеваниями из различных частей штатов Харьяна и Раджастан в Индии. Собранные изоляты проверяли на устойчивость к 33 АБ диско-диффузионным методом. Все изоляты показали одинаковые результаты устойчивости к 29 АБ. Различия в профилях устойчивости наблюдали только по отношению к 4 антимикробным препаратам: амоксициллину, гентамицину, колистину и стрептомицину. На основе этих различий были выделены 10 резистотипов (R1–R10). Наиболее часто встречались резистотипы R1 (устойчивость к амоксициллину, гентамицину и стрептомицину; чувствительность к колистину) и R4 (устойчивость к гентамицину и стрептомицину; чувствительность к амоксициллину и колистину). В статье подчёркивается, что изучение резистотипов может помочь в определении источника инфекции и распространения болезни, а также может быть использовано для выбора эффективной терапии и контроля заболеваемости в конкретной географической зоне или на конкретной ферме.
Похожая работа была проведена с изолятами Enterococcus spp., полученными из образцов птиц 40 птицефабрик Сербии [22]. Чувствительность изолятов к АБ также определяли диско-диффузионным методом. В исследовании были выявлены разные виды рода Enterococcus с различными профилями устойчивости, в том числе E. faecalis, E. faecium, E. hirae, E. durans и E. thialandicus. При этом E. faecalis и E. faecium в наибольшей степени были ассоциированы с множественной лекарственной устойчивостью (МЛУ) к АБ. В данной работе выявлено 18 резистотипов, ассоциированных с устойчивостью к различным классам АБ. Например, выявлялись резистотипы, характеризующиеся устойчивостью исключительно к тетрациклину и доксициклину, в то время как для других резистотипов была характерна МЛУ к нескольким классам АБ. Выявленные штаммы с МЛУ могут представлять риск как для здоровья птиц, так и для здоровья человека, поскольку они могут способствовать распространению устойчивости к АБ через пищевую цепочку.
Крупное исследование J. Alvarez и соавт. было посвящено анализу резистотипов 3047 изолятов сальмонелл, выделенных из фекалий фермерских птиц (кур-несушек, цыплят-бройлеров и индеек) в Испании [24]. Чувствительность к 9 АБ (ампициллину, ципрофлоксацину, налидиксовой кислоте, хлорамфениколу, гентамицину, сульфаметоксазолу, тетрациклину, триметоприму и колистину) определяли с использованием метода серийных разведений. В исследовании было выявлено 94 резистотипа, из которых 33 встречались у всех видов птиц, 19 были характерны только для цыплят-бройлеров, 22 — для индеек, 3 — для кур-несушек.
Подобные исследования, описывающие резистотипы бактериальных патогенов сельскохозяйственных животных, были также проведены на птицефермах Зимбабве (для изолятов Salmonella enteritidis [23]) и Италии (для изолятов Campylobacter jejuni [24]). Также в исследовании D. Cid и соавт. были описаны резистотипы изолятов Pasteurella multocida, выделенных из образцов свиней и овец [25].
Таким образом, в рассмотренных публикациях под термином «резистотип» понимается определённый фенотип устойчивости микроорганизмов к набору АБ, выявляемый диск-диффузионным методом, методом серийных разведений или методом тест-полосок E-test.
Резистотипы комменсальных микробных сообществ
Микробиом, ассоциированный с организмом хозяина (человека или животного), представляет собой сложное и динамичное сообщество множества видов микроорганизмов: бактерий, архей, вирусов и грибов, населяющих различные биотопы — преимущественно кожу, слизистые и желудочно-кишечный тракт. Микробиом играет важную роль в поддержании здоровья организма хозяина и может быть ассоциирован с рядом заболеваний [28]. Лекарственные препараты, воздействующие на организм хозяина, также оказывают воздействие на микробиом, при этом наиболее выраженный эффект наблюдается для антимикробных препаратов [29, 30].
Даже здоровый человек, не принимающий АБ, постоянно контактирует с устойчивыми к АБ микроорганизмами, носителями которых могут выступать другие люди либо домашние животные. Это приводит к тому, что гены АБР могут попадать в его собственную микробиоту, становясь частью индивидуального резистома. Такие события наиболее вероятны в популяциях с большой частотой потребления АБ [31].
При определении резистомов и резистотипов микробных сообществ используются исключительно методы генетического тестирования, в отличие от работ по исследованию резистотипов отдельных видов бактерий. Из генетических методов, применяемых для анализа резистома, наиболее информативным является метагеномное секвенирование с последующим биоинформатическим анализом.
Первое упоминание термина «резистотип» применительно к микробным сообществам, ассоциированным с телом человека, относится к исследованию 2013 г. [3]. В данном исследовании был проведён анализ резистотипов микробиоты кишечника на основании метагеномных данных 275 здоровых добровольцев из Америки, Дании, Испании, Франции, Италии, Японии, Китая и Индии. В ходе анализа было выявлено присутствие потенциальных генов устойчивости к 53 различным АБ. В выборку вошли взрослые без серьёзных патологий (267 образцов), дети (4 образца) и младенцы (4 образца), что позволило провести сравнительный анализ резистотипов различных возрастных групп.
Для каждого метагенома были получены данные о распространённости генов АР. Гены, встречающиеся менее чем в 10% метагеномов, были исключены из анализа. Для полученных профилей представленности был выполнен Between Class Analysis (модификация Principal component analysis, более устойчивая к выбросам и зашумленности данных). В исследовании были идентифицированы 4 резистотипа методом кластерного анализа (табл. 4).
Таблица 4. Характеристики резистотипов бактериальных сообществ человека
Table 4. Characteristics of human bacterial community resistotypes
Объект исследования Object of study | Обозначение резистотипа в тексте публикации Resistotype designation in the text of the publication | Резистотипы (основные драйверы, если указаны) Resistotypes (main drivers, if specified) | Устойчивость к АБ Antibiotic resistance | Ассоциации с бактериями Associations with bacteria | Размер когорты Cohort size | Cвойства резистотипа Resistotype properties | Источник Reference |
Назофарингеальный микробиом недоношенных детей Nasopharyngeal microbiome of preterm infants | R1 | patA, patB, rlmA(II) | Фторхинолоны Fluoroquinolones | Streptococcus mitis/oralis, Gemella haemolysans/sanguinis | 66 | Один из наиболее представленных резистотипов у недоношенных детей One of the most represented resistotypes in premature infants | [18] |
R2 | SST-1, AAC(6')-Ic, tet(41), mexl | β-Лактамы, аминогликозиды, тетрациклин, МЛУ β-Lactams, aminoglycosides, tetracycline, multidrug resistance (MDR) | S. marcescens/ nematodiphila | Один из наиболее представленных резистотипов у недоношенных детей. Сохраняется длительное время One of the most represented resistotypes in premature infants. It persists for a long time | |||
R3 | blaZ | β-Лактамы β-Lactams | S. aureus, S. epidermidis | ||||
Микробиом дыхательных путей при бронхоэктазах The airway microbiome in bronchiectasis | RT1 | hmnM, PatA, tetB(46), ErmX | Фторхинолоны, тетрациклины, МЛУ Fluoroquinolones, tetracyclines, MDR | Haemophilus influenzae, Rothia mucilaginosa, Streptococcus spp. | 280 | RT1 — более благоприятный с клинической точки зрения профиль резистома, демонстрирующий меньшее разнообразие генов резистентности RT1 is a more clinically favorable resistome profile showing less resistance gene diversity | [2] |
RT2 | mexM, basA, PA_catB7, bcr_1, APH(3)''Ib | Аминогликозид, феникол, бицикломицин, МЛУ Aminoglycoside, phenicol, bicyclomycin, MDR | P. aeruginosa, K. pneumoniae | RT2 ассоциируется с бóльшим количеством обострений, худшей функцией лёгких и большей тяжестью заболевания RT2 is associated with more exacerbations, worse lung function, and greater disease severity | |||
Микробиом кишечника здоровых людей The gut microbiome of healthy individuals | Resistotype 1A | Бацитрацин, ванкомицин, тетрациклин, F3H8F5 (линкозамин, стрептограмин B и макролиды) Bacitracin, vancomycin, tetracycline, F3H8F5 (lincosamine, streptogramin B and macrolides) | 267 | Преимущественно выборка из Европы и Японии Predominantly sampled from Europe and Japan | [3] | ||
Resistotype 1B | Ванкомицин, бацитрацин, тетрациклины, цефалоспорины Vancomycin, bacitracin, tetracyclines, cephalosporins | Преимущественно выборка из Европы и США Predominantly sampled from Europe and the USA | |||||
Resistotype 1C | Фосмидомицин, цефалоспорин Fosmidomycin, cephalosporin | Преимущественно выборка из США Predominantly sampled from the US | |||||
Resistotype 2 | Тетрациклин, F3H8F5 (линкозамин, стрептограмин B и макролиды), цефалоспорин, линкомицин, макролид, J3I4 и триметоприм Tetracycline, F3H8F5 (lincosamine, streptogramin B and macrolides), cephalosporin, lincomycin, macrolide, J3I4 and trimethoprim | Преимущественно китайская выборка Predominantly Chinese sample | |||||
Микробиом кишечника здоровых людей The gut microbiome of healthy individuals | Background | Гликопептиды, тетрациклины Glycopeptides, tetracyclines | Coprococcus eutactus, Eubacterium siraeum | 3034 | Ассоциирован с непатогенными микроорганизмами Associated with non-pathogenic microorganisms | [4] | |
FAMP | Фторхинолоны, МЛУ, полипептиды, фторхинолоны, фосфомицин, аминогликозиды, сульфонамид Fluoroquinolones, MDR, polypeptides, fluoroquinolones, fosfomycin, aminoglycosides, sulfonamide | E. coli, Proteus mirabilis | 2338 | Ассоциирован с патогенными микроорганизмами. Встречается в метагеномах больных колоректальным раком (51,9%), метаболическими заболеваниями (58,2%), кишечными инфекциями, связанными с шига-токсин-продуцирующей кишечной палочкой (79,4%) и холерой Associated with pathogenic microorganisms. Occurs in metagenomes of patients with colorectal cancer (51.9%), metabolic diseases (58.2%), intestinal infections associated with Shiga toxin-producing E. coli (79.4%), and cholera | |||
Микробиота биоплёнки ротовой полости Microbiota of the oral cavity biofilm | Resistotype 1 | Высокая представленность mefA, msrD, ermB, blaCSP(1). Низкая представленность tet32 и tetQ High representation of mefA, msrD, ermB, blaCSP(1). Low representation of tet32 and tetQ | 179 | Представлен во всех группах людей (преимущественно у здоровых и с кариесом) Prevalent in all groups of people (predominantly in healthy individuals and those with caries) | [19] | ||
Resistotype 2 | Высокая представленность ermF and tet32, tetQ. Низкая представленность ermB and blaCSP(1) High representation of ermF and tet32, tetQ. Low representation of ermB and blaCSP(1) | Представлен во всех группах людей (преимущественно у здоровых и с кариесом) Present in all groups of people (predominantly in healthy individuals and those with caries) | |||||
Resistotype 3 | Высокая представленность pgpB. Низкая представленность mefA, msrD, ermF, ermB High representation of pgpB. Low representation of mefA, msrD, ermF, ermB | Представлен только в образцах людей с пародонтитом Present only in samples of people with periodontitis | |||||
Кишечная микробиота здоровых людей Intestinal microbiota of healthy individuals | Выявлено 6 резистотипов 6 resistotypes were identified | Резистотип 1 — ANT, Резистотип 3 Tet(M) и β-лактамазы класса C. Резистотип 4 Tet(X) и β-лактамазами класса A. Резистотип 6 — β-лактамазами класса B1, Sul Resistotype 1 is ANT, Resistotype 3 Tet(M) and class C β-lactamases. Resistotype 4 by Tet(X) and class A β-lactamases. Resistotype 6 by β-lactamases of class B1, Sul | Резистотипы 1 и 3 — бактериальный порядок Clostridiales. Резистотип 4 — бактериальный род Bacteroides. Резистотип 6 — род Prevotella Resistotypes 1 and 3 — bacterial order Clostridiales. Resistotype 4 — bacterial genus Bacteroides. Resistotype 6 — genus Prevotella | 663 | Наиболее представлены первые 4 резистотипа, в каждый из которых входило около 20% исследованных образцов. Пятый и шестой резистотипы представляли 8,7 и 7,5% соответственно The first 4 resistotypes were the most represented, each comprising about 20% of the samples studied. The fifth and sixth resistotypes represented 8.7 and 7.5%, respectively | [20] |
Резистотип 1 включал большинство исследуемых образцов микробиоты кишечника. Данный резистотип авторы разделили на 3 подтипа: 1A, 1B и 1C. Резистотип 1A был наиболее распространён среди европейских и японских участников исследования. В состав резистотипа 1B вошли образцы из разных регионов, выраженной географической специфики для данного подтипа не наблюдалось. Резистотип 1C включал значительное количество образцов из США (около 60% американских микробиомов). Данный резистотип характеризовался более высокой устойчивостью к фосмидомицину и цефалоспоринам, что может быть связано с особенностями использования этих АБ в США.
Резистотип 2 был специфичен для китайской популяции (24 из 30 китайских образцов), также для него было характерно высокое содержание генов устойчивости к тетрациклинам, линкомицинам и макролидам. Это отражает особенности использования АБ в Китае, где отмечается более широкое их применение по сравнению с другими странами [32].
В исследовании MetaHIT выявлены значимые географические различия в количестве идентифицируемых генов АБР [32]. В частности, в кишечнике людей из Южной Европы обнаружено большее количество генов АБР по сравнению с жителями Северной Европы и США. У детей из Японии было обнаружено большее количество генов АБР по сравнению с детьми из Индии, но здесь надо сделать поправку на небольшую выборку: из Индии и Японии было взято всего по 2 детских образца. Стоит отметить, что у младенцев из Японии (4 образца) обнаружено высокое количество генов АБР.
В исследовании E. Ruppé и соавт., выполненном с использованием метагеномных данных, полученных в рамках консорциума MetaHIT [32], для выявления резистотипов использовали метод DMM (Dirichlet-Multinomial Mixture Models) с применением критерия Лапласа для определения оптимального количества кластеров [19]. Проанализированы 663 метагеномных образца, которые удалось кластеризовать на 6 резистотипов. Из них наиболее распространены были первые 4 резистотипа, в каждый из которых входило около 20% исследованных образцов. Пятый и шестой резистотипы присутствовали в 8,7 и 7,5% образцов соответственно. Резистотип 1 был обогащён генами устойчивости к аминогликозидам ANT, в резистотипе 3 преобладали гены устойчивости к тетрациклинам tet(M) и β-лактамазы класса C. Резистотип 4 был обогащён генами устойчивости к тетрациклинам tet(X) и β-лактамазами класса A, а резистотип 6 — β-лактамазами класса B1 и генами устойчивости к сульфонамидам sul. Резистотипы 1 и 3 имели более высокое разнообразие генов АБР и были ассоциированы с бактериальным порядком Clostridiales. Резистотип 4 был ассоциирован с бактериями рода Bacteroides (они содержат гены tet(X) и β-лактамазы класса A), а резистотип 6 — с бактериями рода Prevotella.
За последние 2 года в высокорейтинговых журналах появилось несколько работ, развивающих тему характеристики резистотипов микробных сообществ, населяющих природные биотопы человека. Возможно, такой интерес к закономерностям распространения генов АБР вызван озабоченностью общества последствиями пандемии COVID-19, связанными с чрезмерным потреблением АБ2.
В частности, K. Lee и соавт. предприняли попытку оценить влияние использования АБ на микробиом человека на уровне популяции [4]. В исследование вошли метагеномные данные, полученные для микробиоты разных биотопов организма человека: ротовая полость, кожа, верхние дыхательные пути, влагалище, но основной массив (n = 5372) образцов составили метагеномы микробиоты кишечника. В исследование были включены метагеномы из разных стран: Австрии, Канады, Китая, Германии, Дании, Испании, Франции, Израиля, Италии, Казахстана, Мадагаскара, Нидерландов, Швеции и США. Метагеномы здоровых добровольцев составили 3565 из 8972 проанализированных образцов. Используя данную выборку, авторы показали, что представленность генов АБР коррелирует с уровнем потребления АБ на душу населения в анализируемой стране, причём такая корреляция прослеживается в первую очередь для генов АБР, соседствующих с мобильными генетическими элементами.
При анализе вышеупомянутых образцов были идентифицированы 422 семейства генов АБР с использованием базы данных CARD (Comprehensive Antibiotic Resistance Database). Полученные для метагеномных образцов резистомные профили кластеризовали методом NMDS (неметрического многомерного шкалирования) с использованием расстояний Брея–Кертиса, в результате чего удалось выявить 2 кластера-резистотипа. Разделение на 2 резистотипа было подтверждено с помощью методов PAM (разделение вокруг медоидов), UMAP (метод нелинейного снижения размерности данных) и k-means (метод k-средних).
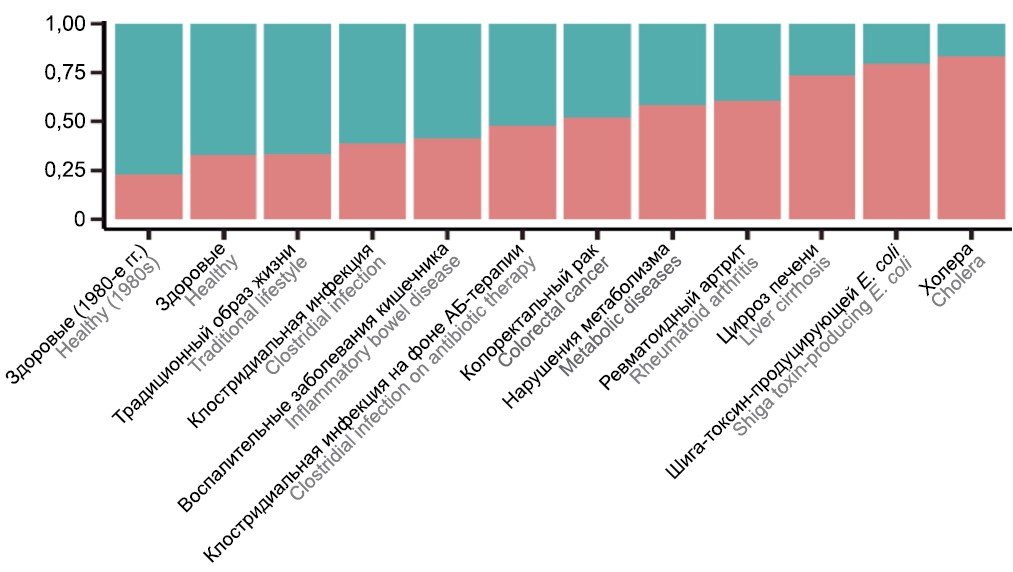
При анализе частот встречаемости резистотипов и представленности генов АБР в них установлено, что резистотип с более низкой частотой встречаемости в популяции более чем в 10 раз обогащён генами устойчивости к фторхинолонам, фосфомицинам, аминогликозидам и пептидным АБ, а также генами, детерминирующими МЛУ, по сравнению с другим резистотипом, который встречается в большем количестве образцов. Первый, более редкий резистотип обозначили аббревиатурой FAMP — по первым буквам названий групп АБ, гены устойчивости к которым характерны для этого резистотипа (Fluoroquinolones, Fosfomycins, Aminoglycosides, Multi-drug resistance, Peptide antibiotics). Другой резистотип обозначили как background. Важно отметить, что для выявленных резистотипов не обнаружено связи с энтеротипами, но при этом установлены ассоциации с конкретными бактериальными таксонами. Так, виды, ассоциированные с резистотипом FAMP, преимущественно относились к группе Proteobacteria, в частности, к семейству Enterobacteriaceae. При этом была отмечена связь частоты встречаемости резистотипа FAMP с группами пациентов по состоянию здоровья: так, у здоровых пациентов доля FAMP-образцов была минимальной, в то время как чаще всего резистотип FAMP встречался в группах пациентов с кишечными инфекциями, такими как холера (83,3%) и шига-токсин-продуцирующая кишечная палочка (79,4%) (рис. 3).
Рис. 3. Представленность резистотипов FAMP (нижняя часть столбиков) и background (верхняя часть столбиков) в микробиоте кишечника людей с разными заболеваниями [4].
Fig. 3. Representation of FAMP (bottom of the columns) and background (top of the columns) resistotypes in the gut microbiota of different categories of people [4].
Также в данном исследовании использовали лонгитюдные данные 12 здоровых добровольцев, получавших 4-дневный курс смеси из 3 АБ широкого спектра действия: меропенема, гентамицина и ванкомицина [34]. В результате анализа этих данных было показано, что употребление АБ приводит к переходу к FAMP-резистотипу для большинства пациентов в течение 8 дней после окончания курса АБ и сопровождается увеличением общего числа генов АБР. Данный эфффект частично сохраняется через 42 дня после окончания курса, но на 180-й день после окончания курса приёма АБ пациенты возвращаются к изначальному резистотипу (background). Наблюдаемый эффект авторы связывают с генами АБР, ассоциированными с одиночными видами протеобактерий.
Авторы предполагают, что использование АБ может приводить к возникновению резистентности в первую очередь у патогенных и условно-патогенных грамотрицательных микроорганизмов, которые могут проникать в кишечник человека при кишечных инфекциях, впоследствии передавая гены резистентности комменсальным бактериям. Авторы предполагают также, что такой процесс обмена генами устойчивости к АБ внутри микробного сообщества кишечника может занимать длительное время и скорость этого процесса может зависеть от общей интенсивности употребления АБ в популяции. Эти предположения позволяют объяснить ассоциацию резистотипа FAMP с кишечными инфекциями и протеобактериями как драйверами данного резистотипа, а также с общим уровнем потребления АБ в популяции.
Тему изменчивости резистотипов поднимают A. Dhariwal и соавт., исследовавшие формирование микробиома и резистома носоглотки у недоношенных детей с оценкой влияния раннего применения АБ на этот процесс [17]. В исследование были включены 66 недоношенных детей, образцы назофарингеального аспирата которых собирали в течение первых 6 мес жизни. Общий объём выборки составил 181 образец. По результатам метагеномного анализа с последующей обработкой данных в этой выборке были выявлены 3 основных резистотипа, характеристики которых приведены в табл. 4.
Авторы показали, что раннее применение АБ оказывало временное влияние на резистом и распределение резистотипов [17]. Воздействие АБ приводило к увеличению разнообразия и количества генов АБ-устойчивости. Однако это влияние было кратковременным, и различия в резистотипах между группами с применением АБ и без них сглаживались к 6 мес корригированного возраста. Наиболее долго после приёма АБ сохранялся резистотип R2, связанный с бактериями рода Serratia.
B. Pérez-Viso и соавт. обнаружили ассоциацию между резистотипом дыхательных путей пациентов с бронхоэктазами и их клиническими исходами [7]. Для анализа резистома и выявления резистотипов использовали данные метагеномного секвенирования образцов мокроты. В исследование было включено 280 человек в возрасте 59–73 лет из Великобритании (Шотландия), Греции, Сингапура, Малайзии и Италии. Резистотипы определяли с помощью биоинформатического анализа данных, который включал спектральную кластеризацию на основе расстояний Брэя–Кертиса и оценку устойчивости кластеров с помощью максимизации среднего коэффициента силуэта. Этот метод позволяет измерить различия в профилях генов устойчивости между разными образцами и группировать их в кластеры на основе схожести. Анализ профилей резистома позволил выделить 2 резистотипа (RT1 и RT2) и провести ассоциацию наблюдаемых резистотипов с исходом заболевания. RT1 был связан с более благоприятными клиническими исходами и содержал повышенное количество генов устойчивости к тетрациклинам, макролидам и β-лактамным АБ. RT2 был ассоциирован с неблагоприятными клиническими исходами и характеризовался повышенным количеством генов устойчивости к аминогликозидам, хлорамфениколу, бицикломицинам, пептидным АБ, а также повышенным количеством генов — детерминант МЛУ (табл. 4).
В образцах, относящихся к RT1, наблюдалась повышенная относительная представленность бактерий видов H. influenzae и R. mucilaginosa, а также нескольких видов рода Streptococcus. В образцах, относящихся к резистотипу RT2, наблюдалась повышенная представленность патогенов P. aeruginosa и K. pneumoniae. Успешная эрадикация P. aeruginosa у пациентов приводила к переходу от RT2 к RT1, что сопровождалось снижением разнообразия генов устойчивости и улучшением клинических показателей. Исследование подчеркивает важность анализа резистома для предсказания клинических исходов у пациентов с бронхоэктазами. Авторы работы полагают, что идентификация RT1 и RT2 открывает новые возможности для таргетной терапии и улучшения клинического исхода заболевания.
A.C. Anderson и соавт. описали особенности резистома биоплёнок ротовой полости у здоровых пациентов, а также пациентов с кариесом и пародонтитом [18]. В этой работе использовались метагеномные данные, полученные из образцов 179 человек. С использованием иерархической кластеризации на матрице различий Жаккара были выявлены 3 резистотипа. Резистотип 1 характеризовался высокой представленностью генов mefA, msrD, ermB и blaCSP(1) и низкой представленностью генов pgpB, tet32 и tetQ. В резистотипе 2 были высоко представлены гены ermF, tet32 и tetQ и низко представлены гены ermB и blaCSP(1). Резистотип 3 отличался высокой представленностью генов pgpB и низкой представленностью генов mefA, msrD, ermF и ermB. Резистотип 3 присутствовал только в образцах пациентов с пародонтитом, в то время как резистотипы 1 и 2 присутствовали во всех группах, но в наибольшей степени — в группах здоровых пациентов и пациентов с кариесом (табл. 4).
Единственное на данный момент исследование, описывающее резистотипы микробиоты сельскохозяйственных животных, посвящено анализу резистома микробиоты рубца коров и оценке связи между резистотипами и питательной ценностью молока [27]. В этом исследовании анализировали 49 образцов микробиоты рубца (начальный отдел желудка жвачных животных), собранных у коров из двух разных ферм в Китае. Исследование разделили на две части. Первая часть, в которую были включены образцы 33 коров, была посвящена оценке влияния количества потребляемого корма на резистом и резистотипы животных. Во второй части исследования определяли содержание белка в молоке коров в зависимости от резистома микробиоты рубца. В неё были включены 16 животных с высоким и низким содержанием белка в молоке. Гены АБР выявляли с использованием полногеномного метагеномного секвенирования, биоинформатическую обработку данных проводили с использованием базы CARD. Резистотипы выявляли с использованием кластеризации с применением алгоритма разделения вокруг медоида. В ходе исследования выделены 4 резистотипа, ассоциированные с выработкой молочного белка. Микробиота рубца коров с низким уровнем молочного белка была отнесена к одному резистотипу и характеризовалась высоким содержанием генов АБР. Наиболее представлены в этой группе были ген mfd, детерминирующий устойчивость к фторхинолонам, и ген sav1866, связанный с МЛУ. Связи между резистомом и потреблением различного количества корма в исследовании не установлено. Авторы делают вывод, что микробиом рубца коров и связанные с ним профили устойчивости к АБ могут оказывать влияние на качество производимой молочной продукции.
Обсуждение
Понятие резистотипа представляет собой новую характеристику бактериальных сообществ, отличную от их таксономического состава. В отличие от традиционных подходов, которые фокусируются на отдельных генах резистентности или фенотипических проявлениях устойчивости, анализ резистотипов позволяет рассматривать устойчивость на более комплексном уровне, объединяя различные гены и их взаимодействия в рамках микробных популяций или целого микробного сообщества.
С нашей стороны это не первое обращение к теме определения роли резистома в микробных сообществах. Будучи первой научной группой в России, описавшей особенности микробиоты кишечника жителей нашей страны (здоровых добровольцев) [35], мы также предложили инструмент для анализа резистома [36] и соотнесли данные резистома микробиоты кишечника россиян с имеющимися на тот момент представлениями о феномене резистома микробных сообществ [37].
Сегодня мы обращаемся к теме резистотипов как к независимой от таксономии характеристике микробиома, базируясь на собственном опыте обнаружения двух резистотипов микробиоты кишечника у пациентов, госпитализированных с COVID-19. Два обнаруженных нами резистотипа различались по количеству генов АБР, при этом у половины пациентов произошла смена резистотипа в ходе терапии. Стоит отметить, что для микробиоты орофарингеального тракта этих же пациентов мы наблюдали единственный резистотип, характеризующийся генами устойчивости к макролидам, фторхинолонам и линкозамиду [37].
В исследованиях, посвящённых резистотипам, применяют различную методологическую базу для их идентификации и характеристики. Исследования, посвящённые определению резистотипов отдельных видов бактерий, как правило, базируются на фенотипической характеристике чувствительности этих микроорганизмов к различным АБ и только изредка используют генетическое тестирование. Анализ резистотипов микробных сообществ, таких как микробиом кишечника человека, реализуется через полногеномное метагеномное секвенирование, которое позволяет выявить большинство генов АБР в резистоме, включая те, которые находятся в некультивируемых организмах. Этот метод позволяет получать детальную информацию о генетическом составе микробных сообществ и выявлять специфические кластеры генов АБР, которые формируют резистотипы. Таким образом, сегодня в научной печати параллельно встречаются разные интерпретации понятия «резистотип» в зависимости от объекта исследования и способа его характеристики. В случае изучения отдельных видов микроорганизмов резистотипом обозначают некий уникальный профиль фенотипической чувствительности, тогда как в случае метагеномного анализа микробных сообществ резистотипом называют результат кластеризации выявленных генов АБР и подбора оптимального количества кластеров.
Значение резистотипа как независимой характеристики микробного сообщества нам только предстоит осознать. В клинической практике определение резистотипов в будущем сможет играть роль в подборе рациональной антимикробной терапии. Знание о наличии конкретного резистотипа в микробиоте пациента позволит врачам выбирать наиболее эффективные сочетания АБ-препаратов, минимизируя риск развития АБР. Таким образом, резистотипирование может существенно ускорить и улучшить процесс принятия решений при лечении инфекционных заболеваний.
В сельскохозяйственной сфере основная цель изучения резистотипов заключается в выявлении спектра устойчивости микроорганизмов, патогенных для животных. Это особенно актуально для определения рисков передачи генов устойчивости от животных к человеку через пищевую цепочку. Например, выявление резистотипов у таких патогенов, как R. equi у лошадей или Enterococcus spp. у птиц, помогает оценить возможные последствия для здоровья как самих животных, так и людей, контактирующих с этими животными, а также разработать эффективные методы контроля за распространением этих патогенов.
Понимание особенностей резистотипов микробиоты животных может способствовать улучшению показателей сельскохозяйственного производства. Так, в исследовании связи резистотипов микробиоты рубца жвачных животных с качеством молочной продукции было показано, что определённые резистотипы могут быть ассоциированы с содержанием белка в молоке. Таким образом, мониторинг и контроль за резистотипами могут быть использованы для повышения эффективности производства и обеспечения безопасности сельскохозяйственной продукции.
Заключение
Резистотипы представляют собой новую характеристику бактериальных сообществ, рассматриваемую отдельно от таксономического состава. Выявление резистотипов позволяет дать дополнительную оценку резистома в различных популяциях микроорганизмов. В формировании резистотипов микробиоты отдельных людей могут играть роль различные факторы: клинические, культурные, географические и др., что подчёркивает необходимость учёта региональных особенностей при разработке стратегий по борьбе с АБР. Определение резистотипов имеет перспективы как в клинической практике, где это может способствовать выбору наиболее подходящего метода терапии, так и в сельском хозяйстве, где этот подход может быть использован для улучшения контроля за АБР микроорганизмов, патогенных для животных.
1 Организация Объединённых Наций. Злоупотребление антибиотиками приводит к росту смертности от инфекций. URL: https://news.un.org/ru/story/2019/11/1367331
2 Всемирная организация здравоохранения. ВОЗ сообщает о широкой практике избыточного назначения антибиотиков госпитализированным больным с COVID-19. URL: https://www.who.int/ru/news/item/26-04-2024-who-reports-widespread-overuse-of-antibiotics-in-patients--hospitalized-with-covid-19
Об авторах
Александр Владимирович Павленко
Научно-исследовательский институт системной биологии и медицины Роспотребнадзора
Автор, ответственный за переписку.
Email: pavav@mail.ru
ORCID iD: 0000-0002-9549-0289
н. с. лаб. математической биологии и биоинформатики
Россия, МоскваИгнат Валерьевич Сонец
Научно-исследовательский институт системной биологии и медицины Роспотребнадзора
Email: ignatsonets@gmail.com
ORCID iD: 0009-0009-7266-6657
м. н. с. лаб. математической биологии и биоинформатики
Россия, МоскваАлександр Иванович Манолов
Научно-исследовательский институт системной биологии и медицины Роспотребнадзора
Email: paraslonic@gmail.com
ORCID iD: 0000-0003-3912-429X
канд. биол. наук, в. н. с., зав. лаб. цифрового мониторинга здоровья человека
Россия, МоскваЕлизавета Валентиновна Старикова
Научно-исследовательский институт системной биологии и медицины Роспотребнадзора
Email: e.starikova@sysbiomed.ru
ORCID iD: 0000-0001-6582-210X
н. с. лаб. математической биологии и биоинформатики
Россия, МоскваЕлена Николаевна Ильина
Научно-исследовательский институт системной биологии и медицины Роспотребнадзора
Email: ilinaen@sysbiomed.ru
ORCID iD: 0000-0003-0130-5079
д-р биол. наук, член-корр. РАН, г. н. с., зав. лаб. математической биологии и биоинформатики
Россия, МоскваСписок литературы
- O'Connor L., Heyderman R. The challenges of defining the human nasopharyngeal resistome. Trends Microbiol. 2023;31(8):816–31. DOI: https://doi.org/10.1016/j.tim.2023.02.008
- Mac Aogáin M., Ivan F.X., Jaggi T.K., et al. Airway "resistotypes" and clinical outcomes in bronchiectasis. Am. J. Respir. Crit. Care Med. 2024;210(1):47–62. DOI: https://doi.org/10.1164/rccm.202306-1059oc
- Ghosh T.S., Gupta S.S., Nair G.B., Mande S.S. In silico analysis of antibiotic resistance genes in the gut microflora of individuals from diverse geographies and age-groups. PLoS One. 2013; 8(12):e83823. DOI: https://doi.org/10.1371/journal.pone.0083823
- Lee K., Raguideau S., Sirén K., et al. Population-level impacts of antibiotic usage on the human gut microbiome. Nat. Commun. 2023;14(1):1191. DOI: https://doi.org/10.1038/s41467-023-36633-7
- Johannessen H., Anthonisen I.L., Zecic N., et al. Characterization and fitness cost of Tn7100, a novel integrative and conjugative element conferring multidrug resistance in haemophilus influenzae. Front. Microbiol. 2022;13:945411. DOI: https://doi.org/10.3389/fmicb.2022.945411
- Cawez F., Mercuri P.S., Morales-Yãnez F.J., et al. Development of nanobodies as theranostic agents against CMY-2-like class C β-lactamases. Antimicrob. Agents Chemother. 2023;67(4): e0149922. DOI: https://doi.org/10.1128/aac.01499-22
- Pérez-Viso B., Hernández-García M., Rodríguez C.M., et al. A long-term survey of Serratia spp. bloodstream infections revealed an increase of antimicrobial resistance involving adult population. Microbiol. Spectr. 2024;12(2):e0276223. DOI: https://doi.org/10.1128/spectrum.02762-23
- Moore J.E., McCaughan J., Rendall J.C., Millar B.C. Case report: the conundrum of what to pick? Antibiotic susceptibility variability in Burkholderia cenocepacia in cystic fibrosis: implications for antibiotic susceptibility testing and treatment. Br. J. Biomed. Sci. 2024;81:12749. DOI: https://doi.org/10.3389/bjbs.2024.12749
- Gajdács M., Baráth Z., Kárpáti K., et al. no correlation between biofilm formation, virulence factors, and antibiotic resistance in pseudomonas aeruginosa: results from a laboratory-based in vitro study. Antibiotics (Basel). 2021;10(9):1134. DOI: https://doi.org/10.3390/antibiotics10091134
- Çöl A., Dedeić-Ljubović A., Salimović-Bešić I., Hukic M. Antibiotic resistance profiles and genetic similarities within a new generation of carbapenem-resistant Аcinetobacter calcoaceticus–A. baumannii complex resistotypes in Bosnia and Herzegovina. Microb. Drug Resist. 2016;22(8):655–61. DOI: https://doi.org/10.1089/mdr.2015.0257
- Granov D., Dedeić-Ljubović A., Salimović-Bešić I. Characterization of carbapenemase-producing Klebsiella pneumoniae in Clinical Center University of Sarajevo, Bosnia and Herzegovina. Microb. Drug Resist. 2020;26(9):1038–45. DOI: https://doi.org/10.1089/mdr.2019.0188
- Jakovac S., Goić-Barišić I., Pirija M., et al. Molecular characterization and survival of carbapenem-resistant Аcinetobacter baumannii isolated from hospitalized patients in Mostar, Bosnia and Herzegovina. Microb. Drug Resist. 2021;27(3):383–90. DOI: https://doi.org/10.1089/mdr.2020.0163
- Gajdács M., Urbán E. A 10-year single-center experience on Stenotrophomonas maltophilia resistotyping in Szeged, Hungary. Eur. J. Microbiol. Immunol. (Bp). 2020;10(2):91–7. DOI: https://doi.org/10.1556/1886.2020.00006
- Phoon H.Y.P., Hussin H., Hussain B.M., et al. Distribution, genetic diversity and antimicrobial resistance of clinically important bacteria from the environment of a tertiary hospital in Malaysia. J. Glob. Antimicrob Resist. 2018;14:132–40. DOI: https://doi.org/10.1016/j.jgar.2018.02.022
- Mohamed E.R., Aly S.A., Halby H.M., et al. Epidemiological typing of multidrug-resistant Klebsiella pneumoniae, which causes paediatric ventilator-associated pneumonia in Egypt. J. Med. Microbiol. 2017;66(5):628–34. DOI: https://doi.org/10.1099/jmm.0.000473
- Shokri D., Rabbani Khorasgani M., Fatemi S.M., Soleimani-Delfan A. Resistotyping, phenotyping and genotyping of New Delhi metallo-β-lactamase (NDM) among Gram-negative bacilli from Iranian patients. J. Med. Microbiol. 2017;66(4):402–11. DOI: https://doi.org/10.1099/jmm.0.000444
- Dhariwal A., Rajar P., Salvadori G., et al. Prolonged hospitalization signature and early antibiotic effects on the nasopharyngeal resistome in preterm infants. Nat. Commun. 2024;15(1): 6024. DOI: https://doi.org/10.1038/s41467-024-50433-7
- Anderson A.C., von Ohle C., Frese C., et al. The oral microbiota is a reservoir for antimicrobial resistance: resistome and phenotypic resistance characteristics of oral biofilm in health, caries, and periodontitis. Ann. Clin. Microbiol. Antimicrob. 2023;22(1):37. DOI: https://doi.org/10.1186/s12941-023-00585-z
- Ruppé E., Ghozlane A., Tap J., et al. Prediction of the intestinal resistome by a three-dimensional structure-based method. Nat. Microbiol. 2019;4(1):112–23. DOI: https://doi.org/10.1038/s41564-018-0292-6
- Chhabra S., Khurana S., Kapoor P., et al. Resistotypes of Rhodococcus equi isolated from foals with respiratory problems. J. Exp. Biol. 2016;4(3S):242–8. DOI: https://doi.org/10.18006/2016.4(3S).242.248
- Velhner M., Prunić B., Aleksić N., et al. antimicrobial resistance of enterococcus isolates from poultry farms in the Republic of Serbia (Autonomous province of Vojvodina). Microorganisms. 2024;12(7):1483. DOI: https://doi.org/10.3390/microorganisms12071483
- Khumalo J., Saidi B., Mbanga J. Evolution of antimicrobial resistance of Salmonella enteritidis (1972–2005). Onderstepoort J. Vet. Res. 2014;81(1):e1–6. DOI: https://doi.org/10.4102/ojvr.v81i1.807
- Manfreda G., Parisi A., De Cesare A., et al. Typing of Campylobacter jejuni isolated from Turkey by genotypic methods, antimicrobial susceptibility, and virulence gene patterns: a retrospective study. Foodborne Pathog. Dis. 2016;13(2):93–100. DOI: https://doi.org/10.1089/fpd.2015.2048
- Alvarez J., Lopez G., Muellner P., et al. Identifying emerging trends in antimicrobial resistance using Salmonella surveillance data in poultry in Spain. Transbound. Emerg. Dis. 2020;67(1):250–62. DOI: https://doi.org/10.1111/tbed.13346
- Cid D., Fernández-Garayzábal J.F., Pinto C., et al. Antimicrobial susceptibility of Pasteurella multocida isolated from sheep and pigs in Spain – short communication. Acta Vet. Hung. 2019;67(4):489–98. DOI: https://doi.org/10.1556/004.2019.048
- Xue M.Y., Xie Y.Y., Zhong Y.F., et al. Ruminal resistome of dairy cattle is individualized and the resistotypes are associated with milking traits. Anim. Microbiome. 2021;3(1):18. DOI: https://doi.org/10.1186/s42523-021-00081-9
- Chen Y., Zhou J., Wang L. Role and mechanism of gut microbiota in human disease. Front. Cell Infect. Microbiol. 2021;11:625913. DOI: https://doi.org/10.3389/fcimb.2021.625913
- Vich Vila A., Collij V., Sanna S., et al. Impact of commonly used drugs on the composition and metabolic function of the gut microbiota. Nat. Commun. 2020;11(1):362. DOI: https://doi.org/10.1038/s41467-019-14177-z
- Panda S., El khader I., Casellas F., et al. Short-term effect of antibiotics on human gut microbiota. PLoS One. 2014;9(4):e95476. DOI: https://doi.org/10.1371/journal.pone.0095476
- Konstantinidis T., Tsigalou C., Karvelas A., et al. Effects of antibiotics upon the gut microbiome: a review of the literature. Biomedicines. 2020;8(11):502. DOI: https://doi.org/10.3390/biomedicines8110502
- Hu Y.J., Cowling B.J. Reducing antibiotic use in livestock, China. Bull. World Health Organ. 2020;98(5):360–1. DOI: https://doi.org/10.2471/blt.19.243501
- Ehrlich S.D. MetaHIT: The European Union Project on Metagenomics of the Human Intestinal Tract. In: Nelson K.E., ed. Metagenomics of the Human Body. New York;2011:307–16. DOI: https://doi.org/10.1007/978-1-4419-7089-3_15
- Palleja A., Mikkelsen K.H., Forslund S.K., et al. Recovery of gut microbiota of healthy adults following antibiotic exposure. Nat. Microbiol. 2018;3(11):1255–65. DOI: https://doi.org/10.1038/s41564-018-0257-9
- Tyakht A.V., Kostryukova E.S., Popenko A.S., et al. Human gut microbiota community structures in urban and rural populations in Russia. Nat. Commun. 2013;4:2469. DOI: https://doi.org/10.1038/ncomms3469
- Yarygin K.S., Kovarsky B.A., Bibikova T.S., et al. ResistoMap-online visualization of human gut microbiota antibiotic resistome. Bioinformatics. 2017;33(14):2205–6. DOI: https://doi.org/10.1093/bioinformatics/btx134
- Ильина Е.Н., Олехнович Е.И., Павленко А.В. Резистом микробиоты кишечника как источник формирования лекарственной устойчивости возбудителей инфекционных заболеваний человека. Патогенез. 2017;15(3):20–32. Ilyina E.N., Olekhnovich E.I., Pavlenko A.V. The gut microbiota resistome provides development of drug resistance in causative agents of human infectious diseases. Pathogenesis. 2017;15(3):20–32. DOI: https://doi.org/10.25557/GM.2017.3.8494 EDN: https://elibrary.ru/zwohrj (in Russian)
- Starikova E.V., Galeeva Y.S., Fedorov D.E., et al. Oropharyngeal resistome remains stable during COVID-19 therapy, while fecal resistome shifts toward a less diverse resistotype. iScience. 2024; 27(12):111319. DOI: https://doi.org/10.1016/j.isci.2024.111319
Дополнительные файлы