Вирулентность и тканевая специфичность разных эпидемически значимых вариантов SARS-CoV-2 для золотистых сирийских хомячков
- Авторы: Грачева А.В.1, Дроков А.О.1, Смирнова Д.И.1, Хохлова Д.М.1, Корчевая Е.Р.1, Панкратов А.А.2, Трунова Г.В.2, Хохлова В.А.2, Воронцова М.С.2, Ленева И.А.1, Свитич О.А.1,3, Зверев В.В.1,3, Файзулоев Е.Б.1,4
-
Учреждения:
- Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
- Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
- Российская медицинская академия непрерывного профессионального образования
- Выпуск: Том 101, № 4 (2024)
- Страницы: 470-482
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18645
- DOI: https://doi.org/10.36233/0372-9311-528
- EDN: https://elibrary.ru/jukmca
- ID: 18645
Цитировать
Аннотация
Введение. Животные модели инфекции SARS-CoV-2, воспроизводящие клинические особенности COVID-19 у человека, являются важными инструментами изучения патогенеза заболевания, трансмиссии возбудителя и незаменимы при испытаниях противовирусных лекарственных препаратов и вакцин.
Целью исследования являлась оценка вирулентности и тканевой специфичности для золотистых сирийских хомячков штаммов SARS-CoV-2, относящихся к разным эпидемически значимым вариантам: Ухань-подобному, Delta, Omicron BA.1.1 и Omicron BA.5.2.
Материалы и методы. Хомячков интраназально заражали разными штаммами SARS-CoV-2. Вирулентность и тканевую специфичность штаммов SARS-CoV-2 оценивали путём сравнения динамики массы, вирусной нагрузки в органах и выраженности патоморфологических изменений в лёгких у заражённых и незаражённых животных.
Результаты. Наибольшей вирулентностью для хомячков обладал Ухань-подобный штамм, что проявлялось в развитии тяжёлой пневмонии и задержке в приросте массы на 14,6%, высоком содержании вируса в лёгких, носовых ходах и головном мозге — 6,2, 5,9 и 3,7 lg ТЦД50/мл гомогената соответственно. Предположительно именно поражение Ухань-подобным вирусом центральной нервной системы негативно повлияло на показатели массы и общее состояние животных. При заражении хомячков штаммами, относящимися к вариантам Delta и Omicron, незначительная потеря массы животными была неинформативной, поэтому при оценке патогенности вируса решающую роль играли такие показатели, как гистопатология лёгких, вирусная нагрузка в лёгких, носовых ходах, сердце и других органах. Особую ценность при сравнении тяжести пневмонии имела балльная оценка выраженности патоморфологических изменений в лёгких, поскольку она снижала субъективизм в оценке результатов гистологического исследования и давала полуколичественную оценку патологического процесса.
Заключение. Несмотря на выявленную более низкую вирулентность для хомячков штаммов, относящихся к вариантам Delta и Omicron, по сравнению с родоначальным Уханьским вирусом, данная животная модель COVID-19 сохраняет свою ценность для проведения доклинических испытаний противовирусных препаратов.
Полный текст
Введение
Моделирование вирусных заболеваний на лабораторных животных является одной из важнейших проблем медицинской вирусологии. Появление в 2019 г. и глобальное распространение коронавируса SARS-CoV-2 (вид Severe acute respiratory syndrome-related coronavirus, род Betacoronavirus, семейство Coronaviridae), сопровождавшееся высоким уровнем госпитализации и смертности среди заболевших, вызвало необходимость срочной разработки средств лечения и специфической профилактики COVID-19, что невозможно без проведения доклинических испытаний на адекватных животных моделях заболевания. С начала пандемии были предприняты значительные усилия по разработке эффективных и безопасных вакцин и терапевтических препаратов, а также проведены исследования патогенеза и особенностей иммунного ответа на инфекцию SARS-CoV-2 [1]. Успешность проведения этих исследований во многом зависела от наличия животных моделей коронавирусной инфекции, разработанных в первой декаде 2000-х гг. на фоне угрозы всемирного распространения SARS-CoV-1 — возбудителя тяжёлого острого респираторного синдрома [2], относящегося к одному виду с SARS-CoV-2. Модели инфекции, воспроизводящие на животных клинические и патологические особенности COVID-19 у человека, являются важными инструментами изучения патогенеза заболевания, трансмиссии возбудителя и незаменимы при испытаниях новых противовирусных лекарственных препаратов и вакцин [3–5].
На сегодняшний день имеется несколько животных моделей COVID-19, в первую очередь основанных на представителях отрядов приматов, хищных и грызунов. Однако проблема выбора наиболее адекватной, информативной и удобной модели остаётся актуальной. Ценность животных моделей коронавирусной пневмонии на основе приматов заключается в том, что обезьяны по своим физиологическим характеристикам и особенностям иммунной регуляции схожи с человеком. Для моделирования COVID-19 чаще всего используются макаки резусы, африканские зелёные мартышки, павианы и обыкновенная игрунка [1, 6, 7]. Основными недостатками таких моделей являются огромный спрос на животных, высокая стоимость, дефицит обученного персонала и вивариев для работы с приматами, оборудованных в соответствии с требованиями 3-го уровня биобезопасности [1, 6].
Норки, хорьки и кошки также восприимчивы к SARS-CoV-подобным коронавирусам [7–11]. Примечательно, что SARS-CoV-2 обнаруживается в носовой полости хорьков, и они могут быть инфицированы при непрямом контакте, что указывает на способность хорьков и норок передавать вирус, имитируя путь передачи SARS-CoV-2 у людей. Недостаток таких моделей заключается в том, что эти животные являются достаточно крупными хищниками, поэтому работа с ними затруднительна. В связи с этим имеется потребность в моделях, основанных на чувствительных к вирусу мелких лабораторных животных.
Мыши и другие грызуны наиболее часто используются для моделирования COVID-19. Однако мыши дикого типа невосприимчивы к инфекции родоначальным Уханьским вирусом SARS-CoV-2 [5, 6, 12], поскольку вирус способен эффективно связываться с ACE2-рецептором человека (hACE2), но не мышиным ACE2 (mACE2). Полученные нами ранее данные свидетельствуют о том, что Ухань-подобный вирус не вызывает продуктивной инфекции у мышей BALB/c и, напротив, при заражении Omicron-подобным вирусом размножается в лёгких, тканях головного мозга и других органах [5].
Известно несколько линий генетически модифицированных мышей с hACE2-рецептором, которые были адаптированы для исследований патогенеза сердечно-сосудистых заболеваний и моделирования коронавирусной инфекции [6, 12]. Эти линии трансгенных мышей, имеющие различное происхождение, способны обеспечивать стабильную экспрессию hACE2 во многих органах. Мышиная модель также имеет ряд серьёзных ограничений, включая отличия в паттернах экспрессии hACE2 в разных органах и тканях у человека и мышей. Поскольку экспрессия hACE2 у трансгенных мышей не является физиологической, заражение SARS-CoV-2 может вызывать у них нехарактерные для человека клинические проявления и патологические изменения [1]. Кроме того, трансгенные мыши малодоступны в России и отличаются высокой стоимостью.
Среди чувствительных к SARS-CoV-2 животных особый интерес представляют золотистые сирийские хомячки (Mesocricetus auratus; далее — хомячки). Генетическое сравнение hACE2 с аналогичными рецепторами других млекопитающих показало, что аминокислотная последовательность ACE2 хомячков очень схожа с последовательностью аналогичного человеческого рецептора, с которым она имеет всего 3–4 отличия. Кроме того, в ряде исследований ACE2 хомячков показал высокое сродство с S-белком SARS-CoV-2 и SARS-CoV [1, 3, 7].
Модель коронавирусной пневмонии на основе хомячков широко применяется в доклинических исследованиях вакцин и лекарственных препаратов [13]. На хомячках хорошо воспроизводятся симптомы, патогенез заболевания и иммунные реакции, характерные для человека с COVID-19 [3, 14]. Хомячки востребованы также при моделировании других респираторных вирусных инфекций человека [14], вызванных такими вирусами, как SARS-CoV-1 [2], вирусы гриппа [15, 16] и аденовирусы [14, 17]. Обладая такими преимуществами, как высокая скорость размножения, простота в обращении, доступная стоимость и наличие в питомниках, хомячки являются оптимальным выбором по сравнению с другими мелкими лабораторными животными.
Коронавирусное заболевание, вызванное у хомячков Ухань-подобными штаммами SARS-CoV-2, на сегодняшний день хорошо изучено и описано [13, 18–20]. Поскольку на современном этапе эпидемического процесса на смену родоначальному вирусу SARS-CoV-2 пришли новые эпидемически значимые варианты вируса (сначала Delta, потом Omicron и его потомки), представляет интерес изучение их вирулентности и патогенеза заболевания у заражённых хомячков. Ранее нами было проведено исследование, посвящённое изучению протективной активности прототипа живой аттенуированной вакцины против SARS-CoV-2 на хомячках, которое включало их заражение не только родительским Ухань-подобным вирусом, но и штаммами, относящимися к вариантам Delta и Omicron [21]. В настоящей статье нам представилось целесообразным подробнее рассмотреть и обсудить полученные результаты в контексте патогенности разных вариантов вируса для неиммунизированных хомячков.
Целью исследования являлась оценка вирулентности и тканевой специфичности для золотистых сирийских хомячков штаммов SARS-CoV-2, относящихся к разным эпидемически значимым вариантам.
Материалы и методы
Вирус
В исследовании использованы лабораторные штаммы SARS-CoV-2, изолированные в НИИВС им. И.И. Мечникова от пациентов с подтверждённым диагнозом COVID-19 в разные периоды пандемии (табл. 1). Все работы с вирусом SARS-CoV-2 проводили в условиях лаборатории 3-го уровня биобезопасности.
Таблица 1. Характеристики штаммов SARS-CoV-2, использованных в исследовании
Table 1. Characteristics of SARS-CoV-2 strains used in the study
Штамм Strain | Дата выделения Collection date | Номер GenBank GenBank ID | Вариант Variant | Линия по Pangolin Pangolin lineage | Пассаж Passage level | Титр, lg ТЦД50/мл Titer, log10 TCID50/ml |
Dubrovka | 04.06.2020 | MW514307.1 | Ухань-подобный Wuhan-like | B.1.1.317 | 17 | 7,85 |
Podolsk | 10.08.2021 | ON032860.1 | Delta | AY.122 | 16 | 7,0 |
Otradnoe | 25.01.2022 | ON032857.1 | Omicron | BA.1.1 | 8 | 6,0 |
FEB2 | 11.10.2022 | OP920753.1 | Omicron | BA.5.2 | 4 | 6,5 |
Культивирование SARS-CoV-2 проводили в культуре клеток эпителия почки африканской зелёной мартышки Vero CCL81 (ATСС) (далее — Vero) при 37⁰С в среде DMEM на основе буфера Эрла («ПанЭко») с добавлением 5% эмбриональной сыворотки коров («Gibco»), 300 мкг/мл L-глутамина («ПанЭко»), 40 мкг/мл гентамицина («ПанЭко») в атмосфере 5% СО2. Трёхдневный монослой клеток Vero заражали вирусом SARS-CoV-2 при множественности заражения MOI = 0,001. Адсорбцию вируса проводили в СО2-инкубаторе в течение 60 мин, затем добавляли поддерживающую среду (DMEM, 300 мкг/мл L-глутамина, 40 мкг/мл гентамицина) и инкубировали при 37⁰С до проявления выраженного цитопатического действия (ЦПД) в атмосфере 5% СО2. После появления выраженного ЦПД культуральную жидкость осветляли центрифугированием при 4000 об/мин в течение 10 мин и хранили при –80⁰С до использования в экспериментах.
Титр SARS-CoV-2 определяли в культуре клеток Vero по конечной точке ЦПД. Десятикратные разведения вируса в 4 повторах вносили в лунки 96-луночного планшета с 3-дневным монослоем клеток Vero и инкубировали в течение 5 сут при 37⁰C в атмосфере 5% CO2. Результаты титрования оценивали при микроскопическом исследовании монослоя клеток на наличие характерного ЦПД (округление клеток и отслоение клеток от монослоя). Титр вируса рассчитывали, как описано M.A. Ramakrishnan и соавт. [22], и выражали в lg ТЦД50/мл.
Животные
В работе использованы 4-недельные самки хомячков (n = 30) SPF массой 40–45 г (НПП «Питомник лабораторных животных» ФИБХ РАН, Россия). Хомячки были случайным образом распределены по группам. Содержание животных соответствовало правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник. Кормили животных брикетированными кормами в соответствии с утверждёнными нормами. При проведении экспериментального исследования на животных авторы соблюдали институциональные и национальные стандарты по использованию лабораторных животных. Проведение исследования одобрено Этическим комитетом НИИВС им. И.И. Мечникова (протокол № 2 от 24.05.2021).
Дизайн
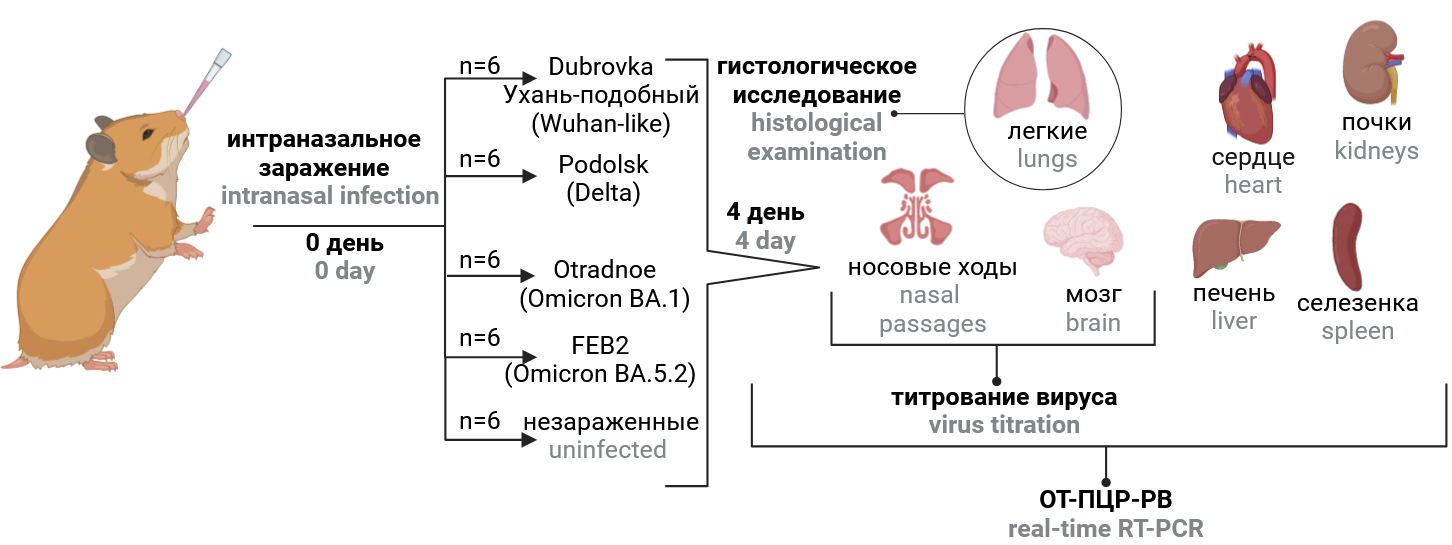
Дизайн исследования схематически представлен на рис. 1. Хомячков распределили на 5 групп по 6 животных и интраназально заразили разными штаммами вируса (табл. 1) в дозе 104 ТЦД50/голову (по 100 мкл). При интраназальном заражении животных обезболивали и удерживали в вертикальном положении. Группа отрицательного контроля получала эквивалентный объём фосфатно-солевого буфера рН 7,2. Ежедневно проводили контроль массы. Через 4 cут после заражения животных подвергли гуманной эвтаназии. Правое лёгкое хомячка фиксировали в 10% нейтральном забуференном формалине с целью проведения гистологического исследования. Ткани лёгких, головного мозга, носовых ходов, сердца, печени, селезёнки, почек и кровь собирали, гомогенизировали в 1 мл среды DMEM с гентамицином (40 мкг/мл, «ПанЭко») с использованием гомогенизатора «Tissue Lyser LT» («Qiagen») и центрифугировали при 10 000 об/мин в течение 5 мин при 4ºC. Надосадочную жидкость собирали для измерения титров вируса и концентрации вирусной РНК и хранили при температуре –80ºС до исследования. Изменения массы тела с 1-х по 4-е сутки после заражения, титр вируса и содержание вирусной РНК в органах и тканях, выраженность воспалительных изменений в лёгких животных на 4-е сутки после заражения отражали вирулентность штамма, а распределение вирусной РНК и инфекционного вируса по органам и тканям — его тканевую специфичность.
Рис. 1. Дизайн исследования. Доза заражения — 4,0 lg ТЦД50/голову в объёме 100 мкл.
Fig. 1. Study design. The infection dose of 4.0 log10 TCID50 per animal.
Количественное определение РНК SARS-CoV-2
Оценку накопления вирусной РНК в органах и тканях проводили методом количественной полимеразной цепной реакции с обратной транскрипцией, как было описано ранее [23]. Вирусную РНК выделяли из образцов с использованием набора реагентов «MagnoPrime UNI» («NextBio»). Для обнаружения вирусной РНК использовали праймеры и зонд, разработанные для гена нуклеокапсида (N) SARS-CoV-2, предложенные J. Chan и соавт. [24].
Гистологическое исследование лёгких
Правое лёгкое хомячка фиксировали в 10% нейтральном забуференном формалине («BioVitrum») в течение 24 ч, обезвоживали по стандартной гистологической методике, помещали в парафиновую среду Histomix («BioVitrum»). На ротационном микротоме «Leica RM 2125 RTS» («Leica») изготавливали ступенчатые продольные срезы толщиной 3–5 мкм, препараты окрашивали гематоксилином и эозином, заключали в канадский бальзам («Sigma-Aldrich»). Гистологические препараты исследовали с помощью светового микроскопа BX51 («Olympus»). Фотофиксацию полученных гистопрепаратов лёгких проводили с помощью фотокамеры «Olympus XC10» («Olympus»). Патоморфологические изменения в лёгких оценивали 2 специалиста слепым методом, используя совокупную оценку тяжести в баллах от 0 до 3 для каждого из морфологических критериев, предложенных A.D. Gruber и соавт. [25]. Максимально возможное количество баллов — 60.
Статистическая обработка данных
Статистический анализ проводили с использованием программного обеспечения «Graphpad Prism v. 8.0.01». Данные представлены на графиках в виде среднего, стандартного отклонения (SD), стандартной ошибки (SE), медианы, верхнего и нижнего квартилей. На коробчатых диаграммах границами «ящика» являются верхний и нижний квартили выборки (25% и 75%), концы «усов» — границы статистически значимой выборки (без выбросов), линия в самом «ящике» — медиана данных. Статистическую обработку полученных результатов проводили непараметрическим методом (U-критерий Манна–Уитни). Различия считали статистически значимыми при p < 0,05.
Результаты
При морфологическом исследовании в гистопрепаратах правого лёгкого незараженных животных патологические изменения отсутствовали (рис. 2). На 4-е сутки после заражения в гистопрепаратах лёгких хомячков всех групп выявлена бронхоинтерстициальная пневмония. Однако между группами наблюдались значительные различия в выраженности и распространённости альтеративно-воспалительных изменений.
Рис. 2. Бронхоинтерстициальная пневмония у хомячков на 4-е сутки после заражения разными штаммами SARS-CoV-2.
Fig. 2. Bronchointerstitial pneumonia in hamster on the 4th day post-challenge with different SARS-CoV-2 strains.
На 4-е сутки после заражения в группах животных, зараженных Ухань-подобным штаммом Dubrovka и штаммом FEB2 (BA 5.2), наблюдались схожие по характеру и выраженности воспалительные изменения, морфологическая картина которых соответствовала бронхоинтерстициальной пневмонии в вирусной стадии. Просветы бронхов и бронхиол, находящихся в очагах пневмонии, часто содержали клеточный дебрис, макрофаги и нейтрофилы. Целостность эпителиальной выстилки была очагово нарушена вследствие миграции лимфоидных клеток, дистрофии, некроза и десквамации эпителиоцитов. Встречались локусы гиперплазии эпителия. Стенка бронхов и бронхиол была умеренно инфильтрирована лимфоцитами, гистиоцитами с небольшой примесью полиморфноядерных лимфоцитов. Расширенные лимфатические сосуды, расположенные по ходу бронхиального дерева, содержали скопления лимфоцитов. В зонах бифуркации бронхов встречались крупные лимфоидные скопления (гиперплазия бронхоассоциированной лимфоидной ткани). В стенках средних и мелких ветвей лёгочной артерии, сопровождающих воздухоносные пути, также наблюдались воспалительные изменения. Периваскулярная лимфоидная ткань была в состоянии резкой гиперплазии.
Крупные сливные очаги пневмонии наблюдались во всех долях органа и располагались по ходу бронхиального дерева, распространяясь к периферии. Их площадь, оценённая на качественном уровне, занимала 50–90% площади гистологического среза органа. Респираторный отдел в очагах пневмонии представлял собой безвоздушные поля, просветы альвеол в которых не определялись, межальвеолярные перегородки были разрушены за счёт выраженного лимфоидно-гистиоцитарного инфильтрата с незначительной примесью нейтрофилов. Среди клеток воспалительного инфильтрата были видны остатки ядер погибших клеток, фибробласты, эритроциты. В более свежих участках пневмонии воздушность респираторного отдела была снижена за счёт резкого утолщения межальвеолярных перегородок и выраженной экссудации в полость альвеол жидкой части крови и клеток воспалительного инфильтрата: макрофагов, лимфоцитов, эритроцитов. Во многих альвеолах содержался эозинофильный нитевидный материал (предположительно, фибрин). В межальвеолярных перегородках отмечены полнокровие микрососудов, интерстициальный отёк и диффузно рассеянный лимфоидно-гистиоцитарный инфильтрат.
На 4-е сутки после заражения штаммом Podolsk (Delta) выраженность и распространённость воспалительных изменений в лёгких хомячков была ниже по сравнению с таковыми в группах животных, зараженных Ухань-подобным вирусом и штаммом FEB2 (BA.5.2). Небольшие очаги интерстициальной пневмонии находились не во всех долях, располагались по ходу крупных долевых и сегментарных бронхов, а их площадь не превышала 50% площади гистологического среза органа. Просветы бронхов и бронхиол в очагах пневмонии были преимущественно свободными, содержали единичные макрофаги, лимфоциты, небольшие группы десквамированных эпителиоцитов. Эпителиальная выстилка на большом протяжении выглядела сохранной, среди клеток мерцательного эпителия встречались единичные в поле зрения объектива ×20 лимфоциты. Воздушность лёгочной паренхимы в очагах пневмонии была снижена за счёт утолщения межальвеолярных перегородок. В полости альвеол наблюдали небольшие группы макрофагов, лимфоциты, единичные нейтрофилы, эритроциты и немногочисленные погибшие клетки (предположительно, альвеолоциты). Белоксодержащий экссудат в просвете альвеол встречался редко. На этом сроке эксперимента безвоздушные и сливные очаги пневмонии практически не встречались.
В гистопрепаратах лёгких хомячков, эвтаназированных на 4-е сутки после заражения штаммом Otradnoe (BA.1.1), отмечены наименее выраженные, по сравнению с другими группами, патоморфологические изменения. Небольшие очаги интерстициальной пневмонии, которые занимали не более 5–7% общей площади среза, располагались в 2–3 долях преимущественно в прикорневых участках по ходу долевых бронхов. Воспалительные изменения в стенке бронхов и сопровождающих их сосудов были выражены слабо.
При проведении гистологического исследования лёгких заражённых и незаражённых хомячков выявленным морфологическим проявлениям коронавирусной пневмонии была дана балльная оценка с применением рекомендаций A.D. Gruber и соавт. [25]. У заражённых животных совокупный балл, отражающий тяжесть воспалительного процесса, варьировал от 20,8 до 49,8, тогда как у незараженных животных был близок к нулю (рис. 3). В группе животных, зараженных Ухань-подобным вирусом, среднее значение совокупного балла тяжести составило 50 ± 6, Delta — 30 ± 5, BA.1.1 — 21 ± 7, BA.5.2 — 39 ± 6.
Рис. 3. Оценка тяжести пневмонии у хомячков на 4-е сутки после заражения разными штаммами SARS-CoV-2. *р < 0,05; **р < 0,01.
Fig. 3. Histopathology score of hamster lungs on day 4 post-infection with different SARS-CoV-2 strains. *р < 0.05; **р < 0.01.
Помимо выраженности патологических изменений в лёгких хомячков, важным критерием при оценке вирулентности разных штаммов SARS-CoV-2 была динамика массы тела. Наибольшая разница в массе заражённых и незаражённых животных наблюдалась на 3-и или 4-е сутки после заражения. В группе животных, заражённых Ухань-подобным вирусом, задержка в приросте массы составила 14,6% по сравнению с незаражёнными животными. Аналогичный показатель у животных, заражённых Delta, BA.1.1 и BA.5.2, составил в среднем 2–3% (рис. 4).
Рис. 4. Динамика массы тела хомячков, заражённых интраназально разными штаммами SARS-CoV-2. К– — незаражённые животные.
Fig. 4. Weight dynamics in hamsters infected intranasally with different SARS-CoV-2 strains. K– — uninfected hamsters.
Поскольку основными органами-мишенями для SARS-CoV-2 являются лёгкие, носовые ходы и головной мозг, в этих органах было исследовано не только содержание вирусной РНК, но и инфекционная активность вируса. Средние значения титра вируса в тканях и органах животных значительно различались в зависимости от штамма, использованного для заражения. Так, на 4-е сутки после заражения в гомогенатах лёгких наибольшие значения титра наблюдались в группах животных, заражённых вирусами Delta и Ухань-подобным, — в среднем 7,4 и 6,2 lg ТЦД50/мл гомогената, тогда как в группах, заражённых BA.1.1 и BA.5.2, титр вируса был значительно ниже — 4,6 и 5,0 lg ТЦД50/мл гомогената соответственно (рис. 5). В гомогенатах носовых ходов инфекционный вирус был обнаружен у животных всех групп в титре 4,9–6,8 lg ТЦД50/мл гомогената. В тканях мозга инфекционный вирус был обнаружен только у животных, зараженных Ухань-подобным вирусом (в среднем 3,7 lg ТЦД50/мл гомогената). Следует отметить, что гомогенаты тканей были токсичны для клеток Vero, в которых проводилось титрование, в связи с чем предел чувствительности составлял 2,0 lg ТЦД50/мл гомогената.
Рис. 5. Инфекционная активность разных штаммов SARS-CoV-2 в органах хомячков на 4-е сутки после заражения. *р < 0,05; **р < 0,01.
Fig. 5. Titer values of different SARS-CoV-2 strains in the organs of Syrian hamsters on the 4th day after infection. *р < 0.05; **р < 0.01.
В лёгких заражённых животных концентрация вирусной РНК варьировала в зависимости от штамма в среднем от 7,6 до 9,3, в носовых ходах — от 8,3 до 9,3, в головном мозге — от 3,8 до 7,6 lg копий РНК/мл гомогената (рис. 6). При этом для большинства органов наблюдалась тенденция к снижению концентрации вирусной РНК в ряду: Ухань-подобный вирус > Delta > BA.1.1 > BA.5.2. Наибольший уровень вирусной РНК в лёгких, носовых ходах, головном мозге и других органах хомячков наблюдался в группах животных, заражённых Ухань-подобным вирусом и Delta. При этом концентрация вирусной РНК в гомогенатах мозга животных, заражённых Ухань-подобным вирусом, составила 7,6, Delta — 5,6, BA.1.1 и BA.5.2 — 3,8 и 4,1 lg копий РНК/мл соответственно.
Рис. 6. Распределение вирусной РНК по органам хомячков, заражённых разными штаммами SARS-CoV-2. *р < 0,05; **р < 0,01.
Fig. 6. Distribution of viral RNA in the organs of hamsters infected with different SARS-CoV-2 strains. *р < 0.05; **р < 0.01.
В сердце, печени, почках, селезёнке и крови большинства заражённых животных вирусная РНК также была обнаружена, но на значительно более низком уровне, чем в лёгких и носовых ходах (рис. 6). Концентрация вирусной РНК в перечисленных органах животных, заражённых BA.1.1 и BA.5.2, была достоверно (р < 0,05) ниже, чем при заражении Ухань-подобным вирусом и Delta (рис. 6). Самое низкое содержание вирусной РНК в органах наблюдалось при заражении BA.5.2, при этом в крови, почках и селезёнке большинства животных вирусная РНК не была обнаружена. Примечательно, что во всех группах заражённых животных наблюдалось значительное содержание вирусной РНК в сердце — от 4,7 до 6,1 lg копий РНК/мл гомогената.
Обсуждение
Дизайн исследования подразумевал равенство всех условий, включая единую дозу заражения 104 ТЦД50/голову, кроме того, что животным разных групп вводили разные штаммы вируса. Поскольку SARS-CoV-2 является респираторным вирусом и передаётся воздушно-капельным путём, правильность выбора нами интраназального способа введения вируса при моделировании COVID-19 не вызывает сомнений. Данный способ введения имитирует естественный путь заражения и является наиболее простым, быстрым и неинвазивным способом заражения мелких лабораторных животных, таких как мыши и хомячки [4].
Проведённое нами исследование выявило различия в вирулентности и тканевой специфичности штаммов SARS-CoV-2, относящихся к разным эпидемически значимым вариантам. Наибольшей вирулентностью обладал Ухань-подобный штамм Dubrovka, что проявлялось в развитии субтотальной пневмонии и максимальной задержке прироста массы в среднем на 14,6%. Хомячки, заражённые штаммами Podolsk (Delta), Otradnoe и FEB2 (Omicron BA.1 и BA.5.2), теряли в массе значительно меньше — 2–3% (p > 0,05). Большая потеря массы и тяжёлая пневмония хомячков, заражённых Ухань-подобным вирусом, была ассоциирована с повышенным содержанием вируса в органах и вирусным поражением мозга. Нейровирулентность Ухань-подобного вируса проявлялась в достоверно более высоком содержании вирусной РНК в мозге и выделении из гомогенатов мозга инфекционного вируса. В ряде исследований [26, 27] выявлена различная тропность вариантов SARS-CoV-2 к клеткам головного мозга и меньшая нейровирулентность варианта Omicron по сравнению с Ухань-подобным вирусом и вариантами Alpha и Delta, доминировавшими ранее [26, 27]. Сопоставление данных литературы с собственными данными о повышенной тропности Ухань-подобного вируса к тканям мозга позволяет предположить, что именно поражение центральной нервной системы могло негативно повлиять на показатели массы тела и общее состояние животных [28].
Результаты гистологического исследования лёгких подтвердили данные о разной вирулентности использованных для заражения хомячков штаммов вируса. Ухань-подобный вирус вызывал наиболее тяжёлые поражения в лёгких с обширными очагами бронхоинтерстициальной пневмонии (совокупный балл тяжести — 50), чем Delta- и Omicron-подобные вирусы (совокупный балл тяжести от 21 до 39); p < 0,05. Полученные результаты, свидетельствующие о более низкой вирулентности для хомячков Omicron-подобных штаммов, по сравнению с родоначальным Уханьским вирусом, согласуются с данными о более низкой патогенности варианта Omicron для человека [29], что подтверждено меньшей репродуктивной активностью вируса в культуре клеток лёгких человека Calu-3 [30]. С другой стороны, ранние выводы о более низкой вирулентности Omicron-подобных штаммов, возможно, переоценивали их аттенуацию для человека, поскольку не отделяли реальное снижение вирулентности вируса от эффекта предшествующего иммунитета, т. к. привитые и переболевшие закономерно в более лёгкой форме переносят заболевание.
Выраженность патологических изменений в лёгких при заражении разными штаммами вариантов Omicron и Delta также значительно различалась: для BA.1.1 среднее значение совокупного балла тяжести составило 21 ± 7, для BA.5.2 — 39 ± 6, для Delta — 30 ± 5. Выявленная более высокая вирулентность BA.5.2 по сравнению с Delta (р < 0,05) не согласуется с данными, представленными в статье S. Mohandas и соавт. [31], которые обнаружили бо́льшую вирулентность Delta-подобного штамма по сравнению с сублинией BA.5.2 варианта Omicron. В связи с этим важно отметить, что вирулентность разных штаммов вирусов может определяться не только их принадлежностью к какому-либо геноварианту, но и штаммовыми отличиями, а также количеством пассажей, пройденных изолятом вируса в культуре клеток. Известно, что изоляция вируса и его пассирование в культуре клеток сопровождается накоплением мутаций, способствующих адаптации вируса к новому хозяину, при этом вирулентность для модельных лабораторных животных снижается [32]. Так, бо́льшую вирулентность штамма FEB2 (BA.5.2) можно объяснить тем, что в нашем исследовании этот штамм перед заражением хомячков прошёл в культуре клеток Vero 4 пассажа, тогда как штамм Podolsk (Delta) — 16 пассажей, а штамм Otradnoe (BA.1.1) — 8 пассажей.
Примечательно, что в сердце животных, заражённых различными штаммами SARS-CoV-2, было обнаружено значительное содержание вирусной РНК (до 6,1 lg копий РНК/мл). Поражение сердца вирусом SARS-CoV-2 у хомячков наблюдались в ряде исследований [33, 34]. Данное наблюдение интересно и в контексте высокой вероятности развития у человека миокардита после перенесённого COVID-19. Поскольку в миоцитах человека повышена экспрессия ACE2-рецептора [35], повышаются вероятность поражения вирусом SARS-CoV-2 тканей сердца и риск развития миокардита [36, 37].
Среди мелких лабораторных животных моделирование COVID-19 возможно на различных линиях мышей, при этом наиболее восприимчивыми к SARS-CoV-2 являются трансгенные мыши линии K18–hACE2 [5]. Однако на данный момент эта линия мышей является труднодоступной, а эффективная репродукция вируса в других органах, помимо лёгких, затрудняет использование этой модели животных для моделирования вирусной пневмонии, поскольку у этих животных наблюдается высокий процент смертности по причинам, не связанным с пневмонией. Так, основной причиной гибели мышей K18–hACE2 является поражение центральной нервной системы и развитие вирусного энцефалита и других неврологических заболеваний из-за высокой экспрессии ACE2-рецептора в клетках мозга [18, 38, 39]. Заболевание мышей линии K18–hACE2 протекает в более тяжёлой форме и имеет отличия в характере клинических проявлений по сравнению с таковыми у человека.
В связи с вышеизложенным модель коронавирусной пневмонии на основе хомячков является одной из самых адекватных, доступных и информативных среди мелких лабораторных животных. У хомячков при заражении SARS-CoV-2 проявляются клинические признаки респираторного заболевания и развивается пневмония лёгкой или средней степени тяжести [18, 40]. Кроме того, они обладают способностью распространять вирус с заражением контактных наивных животных [3, 39]. Животная модель на основе хомячков получила широкое применение при проведении доклинических испытаний противовирусных препаратов и вакцин, поскольку воспроизводит развитие вирусной пневмонии без случаев гибели животного [13, 18, 41, 42]. Проведённое исследование показало, что моделирование на хомячках COVID-19, вызванного новыми вариантами вируса (Delta, BA.1.1 и BA.5.2), сохраняет свою актуальность. Данные варианты вируса сохранили способность вызывать у хомячков пневмонию с обширными поражениями. Если динамика массы тела как показатель вирулентности стала менее информативной, то такие показатели, как вирусная нагрузка (инфекционная активность вируса и содержание вирусной РНК в органах), выраженность воспалительных изменений в лёгких, сохранили свою информативность в оценке тяжести заболевания. Особую ценность при сравнении тяжести пневмонии имеет балльная оценка выраженности патоморфологических изменений в лёгких, поскольку она снижает субъективизм в оценке результатов гистологического исследования и даёт полуколичественную оценку патологического процесса.
Заключение
Результаты проведённого исследования показали, что инфекция у сирийских золотистых хомячков, заражённых штаммами SARS-CoV-2, относящимися к разным эволюционным линиям, протекает по-разному. Выявлена более высокая вирулентность и нейротропность Ухань-подобного вируса по сравнению с вариантами Delta и Omicron, получившими широкое распространение позже. Моделирование на хомячках COVID-19, вызванного сублиниями варианта Omicron, сохраняет свою актуальность, несмотря на незначительную потерю массы животными, в отличие от заражения Ухань-подобным вирусом. При этом в оценке патогенности Omicron-подобных штаммов для хомячков решающую роль продолжают играть гистологическое исследование и такие показатели, как вирусная нагрузка в лёгких, носовых ходах, головном мозге, сердце и ряде других органов.
Об авторах
Анастасия Вячеславовна Грачева
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0001-8428-4482
н.с лаб. прикладной вирусологии
Россия, МоскваАндрей Олегович Дроков
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0009-0006-3300-8078
стажёр лаб. прикладной вирусологии
Россия, МоскваДарья Ильинична Смирнова
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0001-7325-0834
м.н.с. лаб. прикладной вирусологии
Россия, МоскваДарья Михайловна Хохлова
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0009-0003-5745-7589
м.н.с. лаб. прикладной вирусологии
Россия, МоскваЕкатерина Романовна Корчевая
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0002-6417-3301
м.н.с. лаб. прикладной вирусологии
Россия, МоскваАндрей Александрович Панкратов
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0001-7291-9743
к.б.н., зав. отделением экспериментальной фармакологии и токсикологии
Россия, МоскваГалина Владимировна Трунова
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
Автор, ответственный за переписку.
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0003-2917-4496
к.б.н., с.н.с. отделения экспериментальной фармакологии и токсикологии
Россия, МоскваВарвара Андреевна Хохлова
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0002-0339-2068
м.н.с. отделения экспериментальной фармакологии и токсикологии
Россия, МоскваМария Сергеевна Воронцова
Московский научно-исследовательский онкологический институт имени П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0002-9320-1746
к.б.н., м.н.с. отделения экспериментальной фармакологии и токсикологии
Россия, МоскваИрина Анатольевна Ленева
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0002-7755-2714
д.б.н., зав. лаб. экспериментальной вирусологии
Россия, МоскваОксана Анатольевна Свитич
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0003-1757-8389
д.м.н., профессор, член-корр. РАН, директор, профессор каф. микробиологии, вирусологии и иммунологии
Россия, Москва; МоскваВиталий Васильевич Зверев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0001-5808-2246
д.б.н., профессор, академик РАН, научный руководитель, зав. каф. микробиологии, вирусологии и иммунологии
Россия, Москва; МоскваЕвгений Бахтиерович Файзулоев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Российская медицинская академия непрерывного профессионального образования
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0001-7385-5083
к.б.н., зав. лаб. прикладной вирусологии, старший преподаватель кафедры вирусологии
Россия, Москва; МоскваСписок литературы
- Fan C., Wu Y., Rui X., et al. Animal models for COVID-19: advances, gaps and perspectives. Signal Transduct. Target. Ther. 2022;7(1):220. DOI: https://doi.org/10.1038/s41392-022-01087-8
- Roberts A., Vogel L., Guarner J., et al. Severe acute respiratory syndrome coronavirus infection of golden Syrian hamsters. J. Virol. 2005;79(1):503–11. DOI: https://doi.org/10.1128/jvi.79.1.503-511.2005
- Chan J.F., Zhang A.J., Yuan S., et al. Simulation of the clinical and pathological manifestations of coronavirus disease 2019 (COVID-19) in a golden Syrian hamster model: Implications for disease pathogenesis and transmissibility. Clin. Infect. Dis. 2020;71(9):2428–46. DOI: https://doi.org/10.1093/cid/ciaa325
- Qi F., Qin C. Characteristics of animal models for COVID-19. Animal Model. Exp. Med. 2022;5(5):401–9. DOI: https://doi.org/10.1002/ame2.12278
- Leneva I.A., Smirnova D.I., Kartashova N.P., et al. Comparative study of Wuhan-like and omicron-like variants of SARS-CoV-2 in experimental animal models. Vopr. Virusol. 2022;67(5):439–49. DOI: https://doi.org/10.36233/0507-4088-135
- Kirk N.M., Liang Y., Ly H. Pathogenesis and virulence of coronavirus disease: Comparative pathology of animal models for COVID-19. Virulence. 2024;15(1):2316438. DOI: https://doi.org/10.1080/21505594.2024.2316438
- Muñoz-Fontela C., Dowling W.E., Funnell S.G.P., et al. Animal models for COVID-19. Nature. 2020;586(7830):509–15. DOI: https://doi.org/10.1038/s41586-020-2787-6
- Fenollar F., Mediannikov O., Maurin M., et al. Mink, SARS-CoV-2, and the human-animal interface. Front. Microbiol. 2021;12:663815. DOI: https://doi.org/10.3389/fmicb.2021.663815
- Kutter J.S., de Meulder D., Bestebroer T.M., et al. SARS-CoV and SARS-CoV-2 are transmitted through the air between ferrets over more than one meter distance. Nat. Commun. 2021;12(1):1653. DOI: https://doi.org/10.1038/s41467-021-21918-6
- Ciurkiewicz M., Armando F., Schreiner T., et al. Ferrets are valuable models for SARS-CoV-2 research. Vet. Pathol. 2022;59(4):661–72. DOI: https://doi.org/10.1177/03009858211071012
- Martins M., Nooruzzaman M., Cunningham J.L., et al. The SARS-CoV-2 spike is a virulence determinant and plays a major role on the attenuated phenotype of Omicron virus in a feline model of infection. J. Virol. 2024;98(3):e0190223. DOI: https://doi.org/10.1128/jvi.01902-23
- Bao L., Deng W., Huang B., et al. The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice. Nature. 2020;583(7818):830–3. DOI: https://doi.org/10.1038/s41586-020-2312-y
- Xue Y., Yang D., Vogel P., et al. Cardiopulmonary Injury in the Syrian hamster model of COVID-19. Viruses. 2022;14(7):1403. DOI: https://doi.org/10.3390/v14071403
- Miao J., Chard L.S., Wang Z., Wang Y. Syrian hamster as an animal model for the study on infectious diseases. Front. Immunol. 2019;10:2329. DOI: https://doi.org/10.3389/fimmu.2019.02329
- Iwatsuki-Horimoto K., Nakajima N., Ichiko Y., et al. Syrian hamster as an animal model for the study of human influenza virus infection. J. Virol. 2018;92(4):e01693–17. DOI: https://doi.org/10.1128/JVI.01693-17
- Fan S., Gu C., Kong H., et al. Influenza viruses suitable for studies in Syrian hamsters. Viruses. 2022;14(8):1629. DOI: https://doi.org/10.3390/v14081629
- Toth K., Lee S.R., Ying B., et al. STAT2 knockout Syrian hamsters support enhanced replication and pathogenicity of human adenovirus, revealing an important role of type I interferon response in viral control. PLoS Pathog. 2015;11(8):e1005084. DOI: https://doi.org/10.1371/journal.ppat.1005084
- Rosenke K., Meade-White K., Letko M., et al. Defining the Syrian hamster as a highly susceptible preclinical model for SARS-CoV-2 infection. Emerg. Microbes Infect. 2020;9(1):2673–84. DOI: https://doi.org/10.1080/22221751.2020.1858177
- Xu J., Liu M., Niu X., et al. The cold-adapted, temperature-sensitive SARS-CoV-2 strain TS11 is attenuated in Syrian hamsters and a candidate attenuated vaccine. Viruses. 2022;15(1):95. DOI: https://doi.org/10.3390/v15010095
- Wang Y., Yang C., Song Y., et al. Scalable live-attenuated SARS-CoV-2 vaccine candidate demonstrates preclinical safety and efficacy. Proc. Natl. Acad. Sci. U.S.A. 2021;118(29):e2102775118. DOI: https://doi.org/10.1073/pnas.2102775118
- Faizuloev E.B., Gracheva A., Korchevaya E.R., et al. Single intranasal immunization with attenuated Wuhan-like SARS-CoV-2 provides highly effective cross-protection against Delta and Omicron variants of concern: 1. J. Microbiol. Epidemiol. Immunobiol. 2024;101(1):36–51. DOI: https://doi.org/10.21203/rs.3.rs-3279049/v1
- Ramakrishnan M.A. Determination of 50% endpoint titer using a simple formula. World J. Virol. 2016;5(2):85–6. DOI: https://doi.org/10.5501/wjv.v5.i2.85
- Gracheva A.V., Korchevaya E.R., Ammour Y.I., et al. Immunogenic properties of SARS-CoV-2 inactivated by ultraviolet light. Arch. Virol. 2022;167(11):2181–91. DOI: https://doi.org/10.1007/s00705-022-05530-7
- Chan J.F., Yip C.C., To K.K., et al. Improved molecular diagnosis of COVID-19 by the novel, highly sensitive and specific COVID-19-RdRp/Hel real-time reverse transcription-PCR assay validated in vitro and with clinical specimens. J. Clin. Microbiol. 2020;58(5):e00310-20. DOI: https://doi.org/10.1128/JCM.00310-20
- Gruber A.D., Osterrieder N., Bertzbach L.D., et al. Standardization of reporting criteria for lung pathology in SARS-CoV-2-infected hamsters: what matters? Am. J. Respir. Cell Mol. Biol. 2020;63(6):856–9. DOI: https://doi.org/10.1165/rcmb.2020-0280LE
- Bauer L., van Riel D. Do SARS-CoV-2 variants differ in their neuropathogenicity? mBio. 2023;14(1):e0292022. DOI: https://doi.org/10.1128/mbio.02920-22
- Bauer L., Rissmann M., Benavides F.F.W., et al. In vitro and in vivo differences in neurovirulence between D614G, Delta and Omicron BA.1 SARS-CoV-2 variants. Acta Neuropathol. Commun. 2022;10(1):124. DOI: https://doi.org/10.1186/s40478-022-01426-4
- Bauer L., Laksono B.M., de Vrij F.M.S., et al. The neuroinvasiveness, neurotropism, and neurovirulence of SARS-CoV-2. Trends Neurosci. 2022;45(5):358–68. DOI: https://doi.org/10.1016/j.tins.2022.02.006
- Trunfio M., Portesani F., Vicinanza S., et al. Real-life evidence of lower lung virulence in COVID-19 inpatients infected with SARS-CoV-2 Omicron variant compared to wild-type and Delta SARS-CoV-2 pneumonia. Lung. 2022;200(5):573–7. DOI: https://doi.org/10.1007/s00408-022-00566-7
- Purwono P.B., Vacharathit V., Manopwisedjaroen S., et al. Infection kinetics, syncytia formation, and inflammatory biomarkers as predictive indicators for the pathogenicity of SARS-CoV-2 Variants of Concern in Calu-3 cells. PLoS One. 2024;19(4):e0301330. DOI: https://doi.org/10.1371/journal.pone.0301330
- Mohandas S., Shete A., Kumar A., et al. Comparative pathogenicity of BA.2.12, BA.5.2 and XBB.1 with the Delta variant in Syrian hamsters. Front. Microbiol. 2023;14:1183763. DOI: https://doi.org/10.3389/fmicb.2023.1183763
- Li X.F., Cui Z., Fan H., et al. A highly immunogenic live-attenuated vaccine candidate prevents SARS-CoV-2 infection and transmission in hamsters. Innovation (Camb). 2022;3(2):100221. DOI: https://doi.org/10.1016/j.xinn.2022.100221
- Daems M., Liesenborghs L., Boudewijns R., et al. SARS-CoV-2 infection causes prolonged cardiomyocyte swelling and inhibition of HIF1α translocation in an animal model COVID-19. Front. Cardiovasc. Med. 2022;9:964512. DOI: https://doi.org/10.3389/fcvm.2022.964512
- Jones E.A.V. Mechanism of COVID-19-induced cardiac damage from patient, in vitro and animal studies. Curr. Heart Fail Rep. 2023;20(5):451–60. DOI: https://doi.org/10.1007/s11897-023-00618-w
- Liu H., Gai S., Wang X., et al. Single-cell analysis of SARS-CoV-2 receptor ACE2 and spike protein priming expression of proteases in the human heart. Cardiovasc. Res. 2020;116(10):1733–41. DOI: https://doi.org/10.1093/cvr/cvaa191
- Ishisaka Y., Watanabe A., Aikawa T., et al. Overview of SARS-CoV-2 infection and vaccine associated myocarditis compared to non-COVID-19-associated myocarditis: a systematic review and meta-analysis. Int. J. Cardiol. 2024;395:131401. DOI: https://doi.org/10.1016/j.ijcard.2023.131401
- Thaker R., Faraci J., Derti S., Schiavone J.F. Myocarditis in SARS-CoV-2: A meta-analysis. Cureus. 2023;15(10):e48059. DOI: https://doi.org/10.7759/cureus.48059
- Jiang R.D., Liu M.Q., Chen Y., et al. Pathogenesis of SARS-CoV-2 in transgenic mice expressing human angiotensin-converting enzyme 2. Cell. 2020;182(1):50-58.e8. DOI: https://doi.org/10.1016/j.cell.2020.05.027
- Sia S.F., Yan L.M., Chin A.W.H., et al. Pathogenesis and transmission of SARS-CoV-2 in golden hamsters. Nature. 2020;583(7818):834–8. DOI: https://doi.org/10.1038/s41586-020-2342-5
- Imai M., Iwatsuki-Horimoto K., Hatta M., et al. Syrian hamsters as a small animal model for SARS-CoV-2 infection and countermeasure development. Proc. Natl. Acad. Sci. U.S.A. 2020;117(28):16587–95. DOI: https://doi.org/10.1073/pnas.2009799117
- Yuan S., Ye Z.W., Liang R., et al. Pathogenicity, transmissibility, and fitness of SARS-CoV-2 Omicron in Syrian hamsters. Science. 2022;377(6604):428–33. DOI: https://doi.org/10.1126/science.abn8939
- Mohandas S., Yadav P.D., Sapkal G., et al. Pathogenicity of SARS-CoV-2 Omicron (R346K) variant in Syrian hamsters and its cross-neutralization with different variants of concern. EBioMedicine. 2022;79:103997. DOI: https://doi.org/10.1016/j.ebiom.2022.103997
Дополнительные файлы