Оценка вклада симбиотических отношений микроорганизмов ротовой полости в развитие воспалительных изменений слизистой оболочки рта при полном отсутствии зубов
- Авторы: Шулятникова О.А.1, Яковлев М.В.1, Годовалов А.П.1
-
Учреждения:
- Пермский государственный медицинский университет имени академика Е.А. Вагнера
- Выпуск: Том 101, № 4 (2024)
- Страницы: 512-519
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18571
- DOI: https://doi.org/10.36233/0372-9311-524
- EDN: https://elibrary.ru/ioeegb
- ID: 18571
Цитировать
Аннотация
Введение. Фиксация на открытых поверхностях съёмных пластиночных протезов и мягких тканей ротовой полости бактерий в виде биоплёнки обеспечивает повышение вирулентности и резистентности микробного сообщества. Микроорганизмы, входящие в состав биоплёнки, зачастую находятся в симбиотических отношениях, что позволяет им увеличивать свой патогенный потенциал и вызывать развитие протезных стоматитов.
Цель исследования — оценка вклада симбиотических отношений бактерий ротовой полости в развитие воспалительных изменений слизистой оболочки рта при полном отсутствии зубов.
Материалы и методы. Сформированы две группы пациентов в возрасте 60–74 лет (82 мужчины и 49 женщин) с полным отсутствием зубов (К08.1), различающиеся по наличию клинических проявлений воспаления. Биологический материал, отобранный из ротовой полости пациентов, изучали с использованием культурального метода и полимеразной цепной реакции для выявления микроорганизмов полости рта. Для количественного выражения взаимодействия между членами микробиоценоза использовали коэффициент сходства Жаккара.
Результаты. У пациентов с полным отсутствием зубов в микробиоте протезного ложа доминировали коагулазоотрицательные и коагулазоположительные Staphylococcus spp., Neisseria spp., Candida spp., Fusobacterium spp. и представители порядка Enterobacterales. Установлены выраженные симбиотические связи между микроорганизмами порядка Enterobacterales, родов Lactobacillus, Neisseria и Corynebacterium, а также Streptococcus salivarius, C. albicans, F. nucleatum. При этом характер этих отношений зависел от наличия воспалительных изменений слизистой оболочки рта и, в свою очередь, влиял на развитие последних. Так, в отсутствие воспаления устойчивый синергизм проявляют Corynebacterium spp., Lactobacillus spp. и S. salivarius. В случае присоединения воспаления в ассоциации этих бактерий наблюдается внедрение F. nucleatum и вытеснение S. salivarius.
Заключение. Условно-патогенные микроорганизмы, формируя микробные ассоциации с разнонаправленными симбиотическими отношениями, могут увеличивать свою вирулентность, что, вероятно, позволяет им занимать свободные ниши в ротовой полости, а в последующем обеспечивать развитие патологического процесса воспалительного характера тканей протезного ложа.
Ключевые слова
Полный текст
Введение
Комплексный подход к стоматологическому лечению требует детальной диагностики патологий зубочелюстной системы. Лечение пациентов с полным отсутствием зубов в большинстве клинических случаев, кроме основного стоматологического заболевания, сопровождается рядом сопутствующих патологий, которые связаны с острым, подострым или хроническим воспалительным процессом в мягких тканях протезного ложа [1]. Развитие протезных стоматитов обусловлено как общими, так и местными этиологическими факторами, зачастую способствующими быстрой хронизации патологического процесса. Среди таких факторов решающую роль играют представители микробиома ротовой полости.
В настоящее время различными авторами полость рта рассматривается как функционально и морфологически ограниченная экосистема, основной частью которой являются микроорганизмы (МО) [2, 3]. При этом непосредственный контакт с внешней средой создаёт условия для закрепления обширного спектра транзиторных микробов, многие из которых фиксируются на открытых тканях и в дальнейшем заселяют полость рта, входя в состав постоянной микробиоты биотопа [4, 5]. Следует отметить, что как различия в микроанатомии, влажности, подвижности и аэрации отдельных структур ротовой полости, так и наличие в ней стоматологических конструкций, пломб способствуют возникновению «комфортных» ниш для прикрепления и размножения условно-патогенных МО как с анаэробным, так и с аэробным типом метаболизма [6]. Последние, в свою очередь, обладают обширным спектром факторов патогенности, одним из которых является адгезионная способность. Фиксируясь на открытых поверхностях твёрдых и мягких тканей ротовой полости, а также искусственных твёрдых средах, бактерии формируют биоплёнку путём кооперации и сложного взаимодействия, за счёт чего повышаются их общая вирулентность и резистентность [7]. Такое пространственно-структурное объединение отдельных штаммов МО во внеклеточной полисахаридной матрице является основным фактором возникновения подавляющего спектра патологических процессов воспалительного характера, наблюдаемых в полости рта [8, 9]. Последние, в свою очередь, зачастую индуцированы экзо- и эндотоксинами, выделяемыми микробными клетками и представляющими собой активаторы опосредованного действия на макроорганизм. Опасность такой бактериальной экосистемы заключается не только в резистентности к большинству антибактериальных препаратов, но и в устойчивости к факторам клеточного и гуморального иммунитета макроорганизма, что особенно актуально для лиц пожилого возраста [10].
В середине 1970-х гг. с позиций клинической микробиологии была сформулирована «специфическая бляшечная теория», которая придерживается концепции моноэтиологичности инфекционно-воспалительных заболеваний [11]. В соответствии с данной теорией развитие воспалительного процесса должно быть связано с присутствием или относительным преобладанием либо в составе биоплёнки, либо в планктонном состоянии одного этиологически значимого вида МО. Однако, в силу высокой обсеменённости ротовой полости и наличия «комфортных» условий для формирования бактериальных плёнок, доктрины, описанные выше, несколько теряют свою актуальность.
Подтверждено [12, 13] не только значение бактериального состава биоплёнок, формирующихся в полости рта на поверхности твёрдых тканей зубов и элементов стоматологических конструкций, в развитии патологий слизистой оболочки (СО) ротовой полости воспалительного характера, но и количества зубного налёта, а также времени его пребывания в непосредственном контакте с мягкими тканями рассматриваемого биотопа.
В силу формирования тесного пространственно-структурного объединения бактерии, входящие в состав биоплёнки, зачастую находятся в симбиотических отношениях, что позволяет им увеличивать свой патогенный потенциал. При этом внедрение в такой симбиоценоз какого-либо вида МО может как существенно менять направленность симбиотических отношений, так и влиять на проявления клинической картины. Представляет интерес изучение характера взаимодействия МО полости рта при наличии и в отсутствие воспалительного процесса.
Цель исследования — оценить вклад симбиотических отношений МО ротовой полости в развитие воспалительных изменений СО рта при полном отсутствии зубов.
Материалы и методы
Основой для формирования групп пациентов для исследования являлась оценка состояния тканей протезного ложа при полном отсутствии зубов. В исследование вошли лица, относящиеся, согласно систематизации Всемирной организации здравоохранения, к пожилому возрасту (60–74 года; табл. 1).
Таблица 1. Состав групп исследования
Table 1. Study group composition
Участники Participants | 1-я группа | Group 1 | 2-я группа | Group 2 | ||
n | возраст, лет | age, years | n | возраст, лет | age, years | |
Мужчины | Males | 40 | 64,3 ± 1,2 | 42 | 66,1 ± 1,1 |
Женщины | Females | 26 | 65,7 ± 1,4 | 23 | 64,8 ± 1,5 |
С целью установления изменения межвидовых отношений МО ротовой полости при наличии/отсутствии воспалительных изменений тканей протезного ложа проводили разделение пациентов на две группы. Первая группа (n = 66) включала пациентов, пользующихся ранее изготовленными полными съёмными пластиночными протезами из акриловой пластмассы Этакрил-02 в течение не менее 6 мес до момента обследования, прошедших период адаптации и не имеющих клинических признаков воспалительных явлений со стороны СО рта и пародонта. Вторая группа (n = 65) включала лиц, пользующихся полными съёмными пластиночными протезами из акриловой пластмассы Этакрил-02 в течение не менее 6 мес до момента исследования, прошедших период адаптации, при объективном клиническом обследовании у которых выявлены признаки воспаления мягких тканей протезного ложа (хронический протезный стоматит), бактериальный генез которого подтверждён результатами микробиологического анализа.
Проведение клинико-экспериментальных исследований одобрено на заседании локального этического комитета ПГМУ им. акад. Е.А. Вагнера (протокол № 9 от 30.09.2021).
Материал для исследования получали с СО протезного ложа в области вершины альвеолярного отростка верхней челюсти (проекция 1-го, 2-го премоляров на верхней челюсти — с учётом выхода протока околоушной слюнной железы) с помощью тампон-зонда и транспортной среды Amies. После предварительного разведения материала осуществляли посев содержимого на кровяной агар, среды Эндо и Сабуро, селективные среды для выделения стрептококков. Инкубацию осуществляли при температуре 37оС, во влажной атмосфере в микроаэрофильных условиях. Выделенные штаммы идентифицировали по культуральным, тинкториальным и биохимическим признакам.
Проведены выявление и количественная оценка ДНК возбудителей заболеваний пародонта с использованием набора реагентов «Дентоскрин» (НПФ «Литех») посредством полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией в реальном времени в биологическом материале.
Для количественного выражения взаимодействия между членами микробиоценоза использовали коэффициент сходства Жаккара (q), рассчитываемый по формуле:
q = c/(a + b – c) × 100,
где a — число наблюдений с видом а; b — число наблюдений с видом b; c — число наблюдений, содержащих оба вида МО.
При q ≤ 30% условия в биотопе антагонистические, при q от 30 до 70% бактерии способны к сосуществованию, а их экологическая общность велика (синергизм), при q ≥ 70% возможно только совместное существование бактерий (состояние, близкое к мутуализму).
Статистический анализ данных осуществляли с помощью четырёхпольных таблиц сопряжённости и χ2-критерия.
Результаты
Характерными особенностями микробиоты полости рта пациентов с полным отсутствием зубов являлось большое разнообразие видов МО и сложные взаимоотношения между ними в составе микробных ассоциаций. Так, у пациентов с полным отсутствием зубов в микробиоте значительную долю составляли коагулазоотрицательные и коагулазоположительные Staphylococcus spp., не относящиеся к виду S. aureus, а также Neisseria spp., дрожжевые грибы рода Candida, Enterobacterales и Fusobacterium nucleatum (табл. 2). Из представителей порядка Enterobacteriaceae зачастую обнаруживали представителей родов Klebsiella spp. и Enterobacter spp. Среди комменсальных видов Streptococcus spp. доминировали штаммы с более широким набором факторов патогенности — S. pyogenes.
Таблица 2. Частота встречаемости МО в СО рта в области протезного ложа у пациентов (% случаев)
Table 2. Frequency of MO detection in the oral mucosa in the denture bed of patients (% of cases)
МО | 1-я группа | Group 1 (n = 66) | 2-я группа | Group 2 (n = 65) | p между группами p between groups | |||
Staphylococcus spp. | 95,5 | 98,5 | 0,32 | |||
Коагулазоположительные стафилококки Coagulase-positive staphylococci | 33,3 | 76,9 | 0,19 | |||
в том числе: | including: | S. aureus | 45,5 | 66,0 | 0,001 | ||
S. intermedius | 4,5 | 32,0 | 0,001 | |||
S. hyicus | 50,0 | 2,0 | 0,003 | |||
Коагулазоотрицательные стафилококки Coagulase-negative staphylococci | 98,9 | 75,4 | 0,001 | |||
Streptococcus spp. | 83,3 | 50,8 | 0,001 | |||
S. salivarius | 33,3 | 6,2 | 0,001 | |||
S. pyogenes | 15,2 | 52,3 | 0,001 | |||
Neisseria spp. | 48,5 | 53,8 | 0,54 | |||
Candida spp. | 46,9 | 78,5 | 0,001 | |||
в том числе: | including: | C. albicans | 48,4 | 39,2 | 0,3 | ||
Enterobacterales | 66,7 | 50,8 | 0,065 | |||
в том числе: | including: | E. coli | 11,4 | 45,5 | 0,027 | ||
Klebsiella spp. | 25,0 | 51,5 | 0,19 | |||
Enterobacter spp. | 47,7 | 48,5 | 0,36 | |||
Lactobacillus spp. | 33,3 | 55,4 | 0,012 | |||
Corynebacterium spp. | 34,8 | 49,2 | 0,096 | |||
Enterococcus spp. | 18,2 | 26,2 | 0,27 | |||
F. nucleatum | 28,8 | 76,9 | 0,001 | |||
T. denticola | 0 | 0 | ||||
S. salivarius | Neisseria spp. | |||||
(q = 83,3) | (q = 42,4) | |||||
Lactobacillus spp. | (q = 2,4) | Enterobacterales | (q = 63,6) | C. albicans | ||
(q = 0,0) | (q = 25,7) | (q = 78,9) | ||||
Corynebacterium spp. | (q = 75,0) | F. nucleatum | ||||
Согласно проведённому исследованию, развитие воспалительных осложнений со стороны СО в области протезного ложа у пациентов с полным отсутствием зубов соответствовало колонизации биотопа коагулазоположительными видами рода Staphylococcus, увеличением доли S. pyogenes и снижением — S. salivarius, повышением встречаемости дрожжевых грибов рода Candida и Escherichia coli. Кроме этого, выявлено, что с наличием протезного стоматита ассоциирована более частая детекция маркеров F. nucleatum.
В настоящем исследовании в моноварианте не выделено ни одного штамма МО, а минимальное число участников ассоциаций составило не менее 3. При этом значимой разницы по числу ассоциантов в микросимбиоценозах среди сравниваемых групп не установлено. При оценке парных отношений по коэффициенту Жаккара обнаружены выраженные симбиотические связи между МО порядка Enterobacterales, родов Lactobacillus, Neisseria и Corynebacterium, а также S. salivarius, C. albicans, F. nucleatum. При этом характер этих отношений зависел от наличия воспалительных изменений СО рта. Среди коагулазоотрицательных стафилококков, населяющих ротовую полость пациентов 2-й группы, отмечено, что S. epidermidis проявляют способность к сосуществованию с S. pyogenes (q = 50), а S. schleiferi — с бактериями рода Lactobacil- lus (q = 50). В 1-й группе коагулазоотрицательные стафилококки проявляли антагонистические свойства по отношению к E. coli, S. mitis и Neisseria spp.
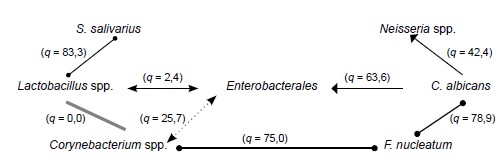
Характерными симбионтами для СО полости рта пациентов 1-й группы являются Corynebacterium spp. и Lactobacillus spp. при активном участии S. salivarius (рис. 1), которые встречаются в подавляющем большинстве случаев, а между ними и S. salivarius формируются мутуалистические взаимоотношения (q > 70). Формирование такой ассоциации позволяет участникам оказывать антагонистическое действие на представителей порядка Enterobacterales, наиболее часто встречаемых при сухости СО ротовой полости [14]. Негативным моментом у пациентов 1-й группы следует признать стойкую экологическую общность между Corynebacterium spp. и Fusobacterium spp. (q = 75), что может быть обусловлено синтрофией этих бактерий. Так, Corynebacterium spp. синтезируют ряд свободных жирных кислот, необходимых для Fusobacterium spp., которые, в свою очередь, облегчают доступность аминокислот Corynebacterium [15]. Ассоциации этих видов, по данным некоторых авторов, наиболее часто регистрируются при плоскоклеточном раке ротовой полости [16].
Рис. 1. Характер симбиотических отношений МО ротовой полости пациентов 1-й группы.
Fig. 1. The nature of the symbiotic relationship of the oral MOs of group 1 patients.
В 46,9% случаев у пациентов 1-й группы обнаружены дрожжевые грибы рода Candida, которые проявляли синергизм с Neisseria spp. (q = 42,4) и Enterobacterales (q = 63,6). Neisseria spp., вероятно, в этом сообществе приспособились к сосуществованию с кандидами, поскольку грибы являются уникальными биохимическими преобразователями, и продукты такого метаболизма удобны для использованиями Neisseria spp. [17]. Синергизм между грибами рода Candida и представителями порядка Enterobacterales обусловлен в большей степени усилением резистентности к антимикробным препаратам [18].
Установлено, что штаммы S. salivarius, изолированные у пациентов 1-й группы, проявляют выраженные (вплоть до мутуалистических) симбиотические взаимоотношения с Lactobacillus, продуцирующими молочную кислоту. Однако, как показано в исследовании [19], бактериоцины Streptococcus spp. могут подавлять продукцию этого метаболита Lactobacillus spp.
S. salivarius, проявляющие выраженные (вплоть до мутуалистических) симбиотические взаимоотношения с Lactobacillus spp. в 1-й группе, не принимают участия в формировании стойкой ассоциации МО при полном отсутствии зубов и присоединении воспаления (рис. 2). Такая ситуация приводит к формированию синергизма не только между Corynebacterium spp. и Fusobacterium spp. (q = 60,8), но и между Lactobacillus spp. и Fusobacterium spp. (q = 62,3), что указывает на более тесное внедрение Fusobacterium spp. в микробиоценоз ротовой полости и требует комплексного таргетированного подхода к антибактериальной обработке ротовой полости перед протезированием.
Рис. 2. Характер симбиотических отношения МО ротовой полости пациентов 2-й группы.
Fig. 2. Nature of symbiotic relationship of oral MOs of group 2 patients.
Синергизм между представителями порядка Enterobacterales, грибами рода Candida и Neisseria spp. (q = 30–70) у пациентов 2-й группы сохраняется и приводит к вытеснению S. salivarius. Кроме того, F. nucleatum формирует более разнонаправленные связи, чем штаммы этого же вида, выделенные от пациентов 1-й группы. Так, если у пациентов 1-й группы между Fusobacterium spp. и Neisseria spp. выявлен нейтрализм, то у пациентов 2-й группы эти виды проявляют синергизм (q = 66,7). Характер взаимоотношений в паре Fusobacterium spp. и C. albicans меняется в случае воспалительных изменений СО на антагонистические (q = 18,6), что, на первый взгляд, кажется не логичным, но вполне объяснимо тем, что при антагонистических отношениях между бактериями меняется спектр их метаболитов, что отражается на клинической картине. Антагонистические отношения между бактериями порядка Enterobacterales и рода Lactobacillus сохраняются у пациентов как с клиническими маркерами воспалительного процесса, так и без них.
Обсуждение
Микробиом ротовой полости населён представителями более чем 300 видов только бактериальных таксонов. При этом внутри такой системы формируются сложные взаимоотношения между отдельными участниками ассоциаций, зачастую не всегда относящиеся к мутуалистическим или синергичным. Для изучения взаимоотношения бактерий предложены разные методики, которые, однако, характеризуются сложностью воспроизведения и трудностью интерпретации. В настоящем исследовании предложено использовать индексный подход, основанный на коэффициенте Жаккара, который позволяет выявить не только направленность связи, но и отчасти её выраженность.
Среди всех МО полости рта следует выделить S. salivarius, который относится к автохтонным симбионтам этого биотопа. Показано, что этот вид обладает выраженной антимикробной и антибиоплёночной активностью [20], что и было подтверждено в настоящем исследовании, когда у пациентов без воспалительных изменений СО этот вид усиливает антагонистические свойства за счёт Lactobacillus spp. и Corynebacterium spp. Однако в случае присоединения воспалительных изменений, которые, вероятно, обусловлены изменениями в микробиоме ротовой полости, наблюдается почти полное вытеснение этого вида Streptococcus spp.
По результатам проведённого исследования, представители порядка Enterobacterales являются аллохтонными микробами, сохраняющими антагонистический характер взаимоотношений с автохтонными МО (Lactobacillus spp., Corynebacterium spp.) и синергизм с дрожжевыми грибами рода Candida как при отсутствии клинических проявлений воспалительного процесса (протезного стоматита), так и при их наличии. Подобная картина свидетельствует о том, что бактерии с широким набором факторов патогенности и, соответственно, более выраженной вирулентностью (например, Enterobacterales), не характерные для ротовой полости, путём фиксации на конструкционном материале съёмных зубных протезов занимают свободные ниши, а в последующем, при снижении активности иммунной системы, плохой гигиене или действии других провоцирующих факторов, именно эти таксоны обеспечивают развитие в мягких тканях протезного ложа процесса воспалительного характера, совместно с автохтонными условно-патогенными МО (Candida spp. и др.). В то же время смена направленности отношений между Enterobacterales и F. nucleatum с мутуалистических на антагонистические при наличии воспалительных явлений тканей протезного ложа у пациентов с полным отсутствием зубов, вероятно, будет коррелировать с ухудшением клинической картины при обнаружении ассоциации данных МО.
Заключение
Полученные результаты позволяют считать S. pyogenes, E. coli, F. nucleatum и Candida spp. инициаторами патологических изменений воспалительного характера со стороны мягкотканного пародонта у лиц, эксплуатирующих полные съёмные пластиночные протезы с базисом из акрилового полимера Этакрил-02. Условно-патогенные МО, формируя микробные ассоциации с разнонаправленными симбиотическими отношениями, могут увеличивать свою вирулентность, что позволяет им занимать свободные ниши в ротовой полости, а в последующем обеспечивать развитие патологического процесса воспалительного характера тканей протезного ложа.
Об авторах
Оксана Александровна Шулятникова
Пермский государственный медицинский университет имени академика Е.А. Вагнера
Email: agodovalov@gmail.com
ORCID iD: 0000-0002-2033-5903
д.м.н., доцент каф. ортопедической стоматологии
Россия, ПермьМихаил Владимирович Яковлев
Пермский государственный медицинский университет имени академика Е.А. Вагнера
Email: agodovalov@gmail.com
ORCID iD: 0000-0002-2895-387X
к.м.н., врач стоматолог-ортопед Городской стоматологической поликлиники
Россия, ПермьАнатолий Петрович Годовалов
Пермский государственный медицинский университет имени академика Е.А. Вагнера
Автор, ответственный за переписку.
Email: agodovalov@gmail.com
ORCID iD: 0000-0002-5112-2003
к.м.н., доцент, доцент каф. микробиологии и вирусологии, в.н.с. Центральной научно-исследовательской лаборатории
Россия, ПермьСписок литературы
- Арутюнов С.Д., Грачев Д.И., Мартыненко А.В. Медико-социальная работа с лицами пожилого и старческого возраста с полной утратой зубов. Проблемы социальной гигиены, здравоохранения и истории медицины. 2021;29(3):509–13. Arutyunov S.D., Grachev D.I., Martynenko A.V. The medical social work with individuals of elderly and senile age with total loss of teeth. Problems of Social Hygiene, Public Health and History of Medicine. 2021;29(3):509–13. DOI: https://doi.org/10.32687/0869-866X-2021-29-3-509-513 EDN: https://elibrary.ru/atnenu
- Романова Ю.М., Гинцбург А.Л. Бактериальные биопленки как естественная форма существования бактерий в окружающей среде и организме хозяина. Журнал микробиологии, эпидемиологии и иммунобиологии. 2011;88(3):99–109. Romanova Yu.M., Gintsburg A.L. Bacterial biofilms as a natural form of existence of bacteria in the environment and host organism. Journal of Microbiology, Epidemiology and Immunobiology. 2011;88(3):99–109. EDN: https://elibrary.ru/rsyplj
- Arweiler N.B., Netuschil L. The oral microbiota. Adv. Exp. Med. Biol. 2016;902:45–60. DOI: https://doi.org/10.1007/978-3-319-31248-4_4
- Вечеркина Ж.В., Шалимова Н.А., Чиркова Н.В. и др. Анализ этиопатогенеза дисбиоза в стоматологии (обзор литературы). Вестник новых медицинских технологий. 2020;27(3):11–9. Vecherkina Zh.V., Shalimova N.A., Chirkova N.V., et al. Analysis of etiopathogenesis of dysbiosis in (literature review). Journal of New Medical Technologies. 2020;27(3):11–9. DOI: https://doi.org/10.24411/1609-2163-2020-16684 EDN: https://elibrary.ru/xrebnl
- Zhang Y., Wang X., Li H., et al. Human oral microbiota and its modulation for oral health. Biomed. Pharmacother. 2018;99: 883–93. DOI: https://doi.org/10.1016/j.biopha.2018.01.146
- Царев В.Н., Ипполитов Е.В., Трефилов А.Г. и др. Особенности адгезии анаэробных пародонтопатогенных бактерий и грибов Candida albicans к экспериментальным образцам базисной стоматологической пластмассы в зависимости от шероховатости поверхности и способа полировки. Журнал микробиологии, эпидемиологии и иммунобиологии. 2014;91(6):21–7. Tsarev V.N., Ippolitov E.V., Trefilov A.G. Features of adhesion of anaerobic periodontopathogenic bacteria and Candida albicans fungi to experimental samples of basis dental plastic depending on surface roughness and polishing method. Journal of Microbiology, Epidemiology and Immunobiology. 2014;91(6):21–7. EDN: https://elibrary.ru/tucmgf
- Marsh P.D., Zaura E. Dental biofilm: ecological interactions in health and disease. J. Clin. Periodontol. 2017;44(Suppl. 18):12–22. DOI: https://doi.org/10.1111/jcpe.12679
- Дзампаева Ж.В. Особенности этиологии и патогенеза воспалительных заболеваний пародонта. Кубанский научный медицинский вестник. 2017;24(5):103–10. Dzampaeva Zh.V. Etiology and pathogenesis features of inflammatory periodontal diseases. Kuban Scientific Medical Bulletin. 2017;24(5):103–10. DOI: https://doi.org/10.25207/1608-6228-2017-24-5-103-110 EDN: https://elibrary.ru/zsjalb
- Фукс Е.И., Карева Ю.А., Гализина О.А., Таболина Е.С. Современные аспекты этиологии и патогенеза заболеваний пародонта. Российский медико-биологический вестник имени академика И.П. Павлова. 2013;21(3):153–60. Fuks E.I., Kareva Yu.A., Galizina O.A., Tabolina E.S. Modern aspects of etiology and pathogenesis of diseases of parodont. I.P. Pavlov Russian Medical Biological Herald. 2013;21(3):153–60. EDN: https://elibrary.ru/rkxtmn
- Морозов А.М., Сергеев А.Н., Кадыков В.А. и др. О развитии антибиотикорезистентности в аспекте поликлинической службы. Вестник современной клинической медицины. 2021;14(5):43–50. Morozov A.M., Sergeev A.N., Kadykov V.A., et al. Development of antibiotic resistance in the aspect of outpatient services. The Bulletin of Contemporary Clinical Medicine. 2021;14(5):43–50. DOI: https://doi.org/10.20969/VSKM.2021.14(5).43-50 EDN: https://elibrary.ru/lgswxr
- Варшакидзе К.А., Гулам А., Камчибекова Н.Т., Касымахунов И.Б. Золотистый стафилококк как причина развития заболеваний слизистой оболочки полости рта и влияние антибиотикотерапии. Forcipe. 2020;3(S1):772–3. Varshakidze K.A., Gulam A., Kamchibekova N.T., Kasymakhunov I.B. Staphylococcus aureus as a cause of diseases of the oral mucosa and the effect of antibiotic therapy. Forcipe. 2020;3(S1):772–3. EDN: https://elibrary.ru/jtkehr
- Арутюнов С.Д., Царев В.Н., Ипполитов Е.В. и др. Формирование биопленки на временных зубных протезах: соотношение процессов первичной микробной адгезии, коагрегации и колонизации. Стоматология. 2012;91(5-1):5–10. Arutiunov S.D., Tsarev V.N., Ippolitov E.V., et al. Biofilm formation on temporary dentures: correlation of primary adhesion, coaggregation and colonization. Stomatology. 2012;91(5-1):5–10. EDN: https://elibrary.ru/puafwr
- Афанасьев В.В., Арутюнов С.Д., Деев М.С. и др. Клинико-микробиологические аспекты формирования микробной биопленки на конструкционных материалах, используемых для починки и перебазировки съемных зубных протезов. Российский стоматологический журнал. 2015;19(2):44–6. Afanasyeva V.V., Arutyunov D.S., Deev M.S., et al. Clinical and microbiological aspects of the formation of microbial bio-films on the structural materials used for repair and perebazirovka removable dentures. Russian Journal of Dentistry. 2015;19(2):44–6. EDN: https://elibrary.ru/twjwur
- Leung W.K., Jin L.J., Yam W.C., Samaranayake L.P. Oral colonization of aerobic and facultatively anaerobic gram-negative rods and cocci in irradiated, dentate, xerostomic individuals. Oral Microbiol. Immunol. 2001;16(1):1–9. DOI: https://doi.org/10.1034/j.1399-302x.2001.160101.x.
- Treerat P., Redanz U., Redanz S., et al. Synergism between Corynebacterium and Streptococcus sanguinis reveals new interactions between oral commensals. ISME J. 2020;14(5):1154-1169. DOI: https://doi.org/10.1038/s41396-020-0598-2
- Григорьевская З.В., Терещенко И.В., Казимов А.Э. и др. Микробиота полости рта и ее значение в генезе рака орофарингеальной зоны. Злокачественные опухоли. 2020;10(3S1):54–9. Grigor'evskaya Z.V., Tereshchenko I.V., Kazimov A.E., et al. The microbiota of the oral cavity and its significance in the genesis of cancer of the oropharyngeal zone. Malignant Tumours. 2020;10(3S1):54–9. DOI: https://doi.org/10.18027/2224-5057-2020-10-3s1-54-59 EDN: https://elibrary.ru/zjbyge
- Donati C., Zolfo M., Albanese D., et al. Uncovering oral Neisseria tropism and persistence using metagenomic sequencing. Nat. Microbiol. 2016;1(7):16070. DOI: https://doi.org/10.1038/nmicrobiol.2016.70
- Mishra K., Bukavina L., Ghannoum M. Symbiosis and dysbiosis of the human mycobiome. Front. Microbiol. 2021;12:636131. DOI: https://doi.org/10.3389/fmicb.2021.636131
- Gönczi N.N., Strang O., Bagi Z., et al. Interactions between probiotic and oral pathogenic strains. Biol. Futur. 2021;72(4):461–71. DOI: https://doi.org/10.1007/s42977-021-00091-3
- Stašková A., Sondorová M., Nemcová R., et al. Antimicrobial and antibiofilm activity of the probiotic strain Streptococcus salivarius K12 against oral potential pathogens. Antibiotics (Basel). 2021;10(7):793. DOI: https://doi.org/10.3390/antibiotics10070793