Влияние углеводных адъювантов в составе экспериментального хантавирусного вакцинного препарата на динамику нейтрализующих антител в сыворотках крови морских свинок
- Авторы: Курашова С.С.1, Егорова М.С.1, Ветрова А.Н.1, Баловнева М.В.1, Попова Ю.В.1, Теодорович Р.Д.1, Мироненко А.А.2, Апарин П.Г.2, Львов В.Л.2, Ткаченко Е.А.1, Дзагурова Т.К.1
-
Учреждения:
- Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
- Государственный научный центр «Институт иммунологии»
- Выпуск: Том 101, № 3 (2024)
- Страницы: 383-392
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18570
- DOI: https://doi.org/10.36233/0372-9311-523
- EDN: https://elibrary.ru/kjcoua
- ID: 18570
Цитировать
Полный текст
Аннотация
Введение. Вакцинация могла бы стать наиболее эффективным способом контроля геморрагической лихорадки с почечным синдромом (ГЛПС), которая занимает ведущее место среди зоонозов и одно из первых мест среди природно-очаговых заболеваний человека. В связи с этим актуальны разработка эффективного вакцинного препарата, а также поиск новых нетоксичных и эффективных адъювантов, которые могут способствовать усилению и пролонгированию иммунного ответа, снижению концентрации антигена и уменьшению кратности введения препаратов.
Цель исследования — определить зависимость иммуногенной активности экспериментального хантавирусного препарата на основе вируса Пуумала (ХП) от дозы антигена как в нативном виде, так и в сочетании с углеводными адъювантами.
Материалы и методы. Исследован иммуноадъювантный эффект Ac3-ЛПС Shigella sonnei и S. flexneri 1B и эмульсии наноэмульгированного сквалена Sepivac SWE (SWE) в составе ХП в оптимальной и минимальной дозах по индукции нейтрализующих антител после 3-кратной иммунизации (0, 14, 182-й день) морских свинок (Cavia porcellus). Различия в иммуногенной активности ХП оценивали в реакции нейтрализации по 50% подавлению фокусобразующих единиц в культуре клеток Vero E6.
Результаты. Статистически значимое повышение уровня нейтрализующих антител отмечали уже после 1 иммунизации как для ХП в оптимальной дозе, так и для его комбинации с адъювантами. Наиболее выраженный иммуноадъювантный эффект проявили Ac3-ЛПС S. sonnei и SWE, в концентрации 50 и 100 мкг/дозу соответственно. Иммуноадъювантный эффект, обусловленный комбинацией ХП с Ac3-ЛПС S. sonnei и SWE, способствовал как усилению иммунного ответа, так и его продолжительности. Уменьшение дозы антигена в 10 раз в присутствии SWE позволяет оптимизировать иммунный ответ для вакцинного препарата.
Вывод. Результаты исследования показали перспективность использования Ac3-ЛПС S. sonnei и Sepivac SWE в вакцине для профилактики ГЛПС.
Полный текст
Введение
Основную роль в структуре заболеваемости геморрагической лихорадкой с почечным синдромом (ГЛПС) играет вирус Пуумала, на долю которого приходится 97,7% случаев заболеваний ГЛПС в России, а на долю вирусов Хантаан, Сеул, Амур и двух подтипов (Куркино и Сочи) вируса Добрава/Белград — менее 3% [1]. Такая эпидемиологическая обстановка на территории России представляет собой серьёзную угрозу населению. Ввиду отсутствия этиотропного лечения ГЛПС актуальна разработка вакцинного препарата для её профилактики [2].
Этап лицензирования прошли 6 хантавирусных вакцин: 3 культуральных и одна мозговая в Китае и по одной мозговой вакцине в КНДР и Южной Корее, которые производятся на основе хантавирусов Хантаан или Сеул. Ни одна из этих вакцин не может применяться в европейских регионах России, поскольку не обладает защитным действием против вируса Пуумала — основного возбудителя ГЛПС на этой территории [3]. В России разработка технологии изготовления инактивированных формалином или бета-пропиолактоном цельновирионных вакцинных препаратов на перевиваемой линии клеток Vero началась в 1990 г., когда удалось оптимизировать получение высокотитражного урожая вируса Пуумала [4]. Успешно прошли доклинические исследования 3 кандидатных вакцинных препарата: моновакцина с использованием вируса Пуумала «PUUVAX» в 1990 г. [4], двухкомпонентная вакцина «Комби-ГЛПС-Вак» на основе вирусов Пуумала и Добрава/Белград (подтип Куркино) в 2008 г. [5], трёхкомпонентная вакцина «ГЛПС-Вак» на основе вирусов Пуумала, Добрава/Белград (подтип Сочи) и Хантаан в 2018 г. [6].
Иммуногенную активность и протективность инактивированных цельновирионных вакцинных препаратов для профилактики различных инфекций можно повысить с помощью адъювантов, которые способствуют пролонгированию иммунного ответа, снижению концентрации антигена и уменьшению кратности введения препаратов, обеспечивая рациональное соотношение доза–ответ [7, 8]. Вакцинный препарат для профилактики ГЛПС не является исключением. Ранее в рамках доклинических исследований мы оценивали возможное влияние различных групп адъювантов на повышение иммуногенной активности моновалентного и поливалентного вакцинных препаратов для профилактики ГЛПС в ответ на их введение мышам BALB/c [9]. Установлены наибольшая эффективность и целесообразность применения группы углеводных адъювантов на примере низкоэндотоксичного апирогенного липополисахарида (ЛПС), содержащего триацильные производные липида А — Ac3-ЛПС Shigella sonnei, в вакцинном препарате для профилактики ГЛПС [10]. Также на мышах линии BALB/c и морских свинках были установлены оптимальная и минимальная иммунизирующие дозы хантавирусного вакцинного препарата (ХП) [9, 11]. Для решения вопроса о влиянии адъювантов на силу и длительность иммунного ответа в данном исследовании в качестве модели экспериментальных животных были выбраны морские свинки Cavia porcellus.
Адъюванты характеризуются большим разнообразием, поэтому подбор осуществляется путём сравнения их эффективности на моделях животных, а также оценки их безопасности и переносимости [12]. Они способны усиливать формирование иммунного ответа, генерируя долговременную Т- и В-клеточную память [13], определять конкретный тип иммунного ответа, который может быть смещён в сторону ответов цитотоксических Т-клеток, определённых классов Т-хелперов и изотипов антител [14]. Врождённая иммунная система может распознавать патогены напрямую через различные образ-распознающие рецепторы, среди которых наиболее важными являются Toll-подобные рецепторы (TLR) [15, 16]. Они экспрессируются на дендритных, эндотелиальных и тучных клетках, макрофагах, нейтрофилах и т. д. и обладают широкой специфичностью в отношении консервативных молекулярных паттернов патогенов [17]. Традиционно применяемые адъюванты на основе алюминия и MF59 малоэффективны и не оказывают заметного воздействия на клеточный иммунный ответ [18]. В последнее время особое внимание стали уделять адъювантам на основе углеводов [12], которые безопасны, биосовместимы и способны стимулировать сильные и длительные гуморальные и клеточные иммунные реакции [19] через TLR [20, 21], нуклеотид-связывающие домены олигомеризации, содержащие белок 2 [22], C-типа лектины [23] или CD1d-зависимые естественные киллеры [24], которые впоследствии стимулируют продукцию цитокинов [25]. Было показано, что монофосфориллипид A, являясь нетоксичным компонентом ЛПС [26] и вместе с тем единственным агонистом TLR4 [27], одобрен в качестве адъюванта в вакцинах для лечения рака, аллергии и инфекционных болезней [28]. Другой углеводный адъювант — глюкопиранозиллипид A — в доклинических исследованиях индуцировал выработку цитокинов в составе вакцинных препаратов за счёт стимуляции иммунных клеток [29]. Углеводные адъюванты растительного происхождения могут осуществлять доставку антигена к антигенпрезентирующим клеткам [30], являясь агонистами TLR4 [27] или усилителями иммунного ответа [31]. Эти сигнальные каскады в конечном итоге генерируют антигенспецифические Т- и В-клеточные реакции, которые алюминий не может индуцировать [32], что сделало их пригодными для разработки вакцинных препаратов, в том числе против вирусов ветряной оспы, иммунодефицита человека, папилломы человека и гепатита В [33].
Безопасность и клиническая применимость Ac3-ЛПС как класса молекул показана в клинических исследованиях кандидатной дизентерийной вакцины против Shigella flexneri «Флексвак» на основе Ac3-ЛПС S. flexneri 2a [34]. В исследованиях иммуногенной активности вакцины против гриппа H7N9 добавление адъюванта Sepivac SWE (SWE; эмульсия сквалена в воде) усиливало функциональные реакции антител у хорьков, а также позволяло снижать дозу антигена по меньшей мере в 6 раз [35]. В составе белковых субъединичных вакцин против COVID-19 адъювант SWE на модели мышей BALB/c позволял сократить количество доз, способствовал увеличению количества нейтрализующих антител (нАТ) и индуцировал сбалансированные иммунные ответы Th1/Th2 по сравнению с гидроксидом алюминия [36]. SWE-адъювантная вакцина против COVID-19 COVAC-2 вышла на клинические испытания NCT047021781 и NCT052090092.
Целью данного исследования являлось определение эффективности углеводных адъювантов различного происхождения в составе экспериментального ХП на основе вируса Пуумала на модели морских свинок.
Материалы и методы
Использовали культуры клеток Vero (ATCC CСL-81) — перевиваемая культура клеток почки зелёной мартышки, Vero-E6 (ATCCNo. CRL-1586) — клон Vero C1008 культуры VERO.
Вирус Пуумала, штамм PUU-ТKD-VERO, депонирован в Государственной коллекции вирусов (Национальный исследовательский центр эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи МЗ РФ) под номером № 1026. Полногеномные сиквенсы штамма PUU-ТKD-VERO зарегистрированы в GenBank под номерами: S — MH251331, M — MH251332, L — MH251333.
Для выявления и титрования хантавирусов в культуре клеток Vero E6 применяли метод фокусобразующих единиц (ФОЕ) [37]. Вируснейтрализующие антитела (нАТ) выявляли по подавлению ФОЕ в культуре клеток Vero E6 в реакции нейтрализации [38]. За титр нАТ принимали разведение сыворотки, подавляющее 50% ФОЕ (РН/ФОЕ50), выявленных в контрольном образце вируса. Каждая проба сыворотки крови трижды исследована в РН/ФОЕ50.
Получение экспериментального хантавирусного препарата
Для исследований сравнительной эффективности адъювантов готовили полуфабрикаты ХП, используя вирус Пуумала [6, 38]. После хроматографической очистки первичного концентрата вируса Пуумала на мультимодальном сорбенте «Сapto Сore 700» («GE Healthcare») титр вируса до инактивации составлял 5,0 ± 0,4 lg ФОЕ/мл, 2,32 × 106 ± 98 копий вирусной РНК/мл, общий белок 30 ± 6 мкг/мл. Выделение РНК и определение количества копий РНК/мл методом ПЦР в реальном времени описаны ранее [39]. Этап инактивации проводили бета-пропиолактоном в конечном разведении 1 : 6000 при комнатной температуре в течение 1 ч на мешалке [40]. Оптимальной дозе ХП соответствовало содержание вируса 4,5 ± 0,3 lg ФОЕ/мл (1 × 104 ± 98 копий вирусной РНК/мл) и общего белка 20 ± 6 мкг/мл, а за минимальную дозу принимали ХП, разведённый физиологическим раствором в 10 раз [9].
Инактивированный препарат хранили при температуре 6 ± 2ºС. Остаточную инфекционность ХП определяли по описанной методике [40]. При отсутствии инфекционности после 5 последовательных пассажей в культуре клеток Vero приступали к контролю иммуногенной активности экспериментальных вакцинных препаратов.
Эксперименты с использованием инфекционных материалов проводили в лаборатории, оборудованной специальным блоком для работы с вирусами 2-й группы патогенности, на работу с которыми имеется разрешение Роспотребнадзора.
Адъюванты
Варианты низкоэндотоксичных ЛПС рода Shigella для исследования влияния на иммуногенную активность в составе ХП, полученные в ГНЦ «Институт иммунологии» [11, 34]:
1) низкоэндотоксичный апирогенный ЛПС, содержащий гомогенные длинные О-полисахаридные домены Ac3-ЛПС S. sonnei (ЛПСГ-S. sonnei, 50 мкг/дозу);
2) низкоэндотоксичный апирогенный ЛПС, содержащий смесь коротких и длинных О-полисахаридных доменов Ac3-ЛПС S. sonnei (ЛПС-S. sonnei, 50 мкг/дозу);
3) гомогенный низкоэндотоксичный апирогенный ЛПС, содержащий гомогенные длинные О-полисахаридные домены Ac3-ЛПС S. flexneri 1B (ЛПС-S. flexneri, 50 мкг/дозу).
Эмульсия наноэмульгированного сквалена животного происхождения по типу «масло в воде» (аналог MF-59) SEPIVAC SWE (SWE, в концентрации 100 мкг/дозу3) была безвозмездно передана компанией «Seppic» для проведения данных исследований.
Иммунизация животных
Перед началом исследования животные, отвечающие критериям включения в эксперимент, были распределены рандомизированно на группы. Исследования выполняли на самках аутбредных морских свинок Hartley массой 290–330 г (n = 6), поставляемых филиалом «Андреевка» Научного центра биомедицинских технологий. Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с правилами, принятыми Европейской конвенцией по защите животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986), и правилами лабораторной практики (Приказ Министерства здравоохранения РФ от 19.06.2003 № 267). Одобрение исследования подтверждается выпиской из протокола этического комитетом ФНЦИРИП им. М.П. Чумакова РАН (Институт полиомиелита) от 10.06.2022 № 100622-5.
К ХП с оптимальной и минимальной концентрациями антигена добавляли адъюванты. Животным контрольных групп вводили физиологический раствор в том же объёме и с соответствующей концентрацией адъюванта, что и экспериментальным.
Животных экспериментальных групп (ХП, ХП-ЛПСГ-S. sonnei, ХП-ЛПС-S. sonnei, ХП-ЛПС-S. flexneri, ХП-SWE) иммунизировали антигеном в оптимальной или сниженной в 10 раз концентрации.
Животным опытных групп вводили исследуемый препарат в дозе 0,3 мл трёхкратно внутримышечно (0, 14, 182 дня). Проведены 3 серии экспериментов в идентичных дозах. Забор крови у морских свинок проводили каждые 14 дней от начала эксперимента пункцией сердца в течение года.
Сыворотки крови морских свинок прогревали при 56ºC в течение 30 мин и хранили до исследования при 6 ± 2ºС.
Статистический анализ
Минимальный объём выборки рассчитывали при помощи базовой функции power.t.test для уровня статистической значимости не менее 95%. Результаты экспериментов (совокупные данные 3 независимых опытов) были проанализированы, сгенерированы и графически представлены в программном обеспечении «GraphPad Prism v. 9.4.0». Уровень значимости различий между несколькими группами определяли с использованием непараметрического метода трёхстороннего дисперсионного анализа ANOVA с тестом множественного сравнения Тьюки. Иммуногенную активность выражали в виде среднегеометрических значений титра нАТ в двоичных логарифмах ± стандартное отклонение. Статистически значимыми принимали различия при p ≤ 0,05.
Результаты
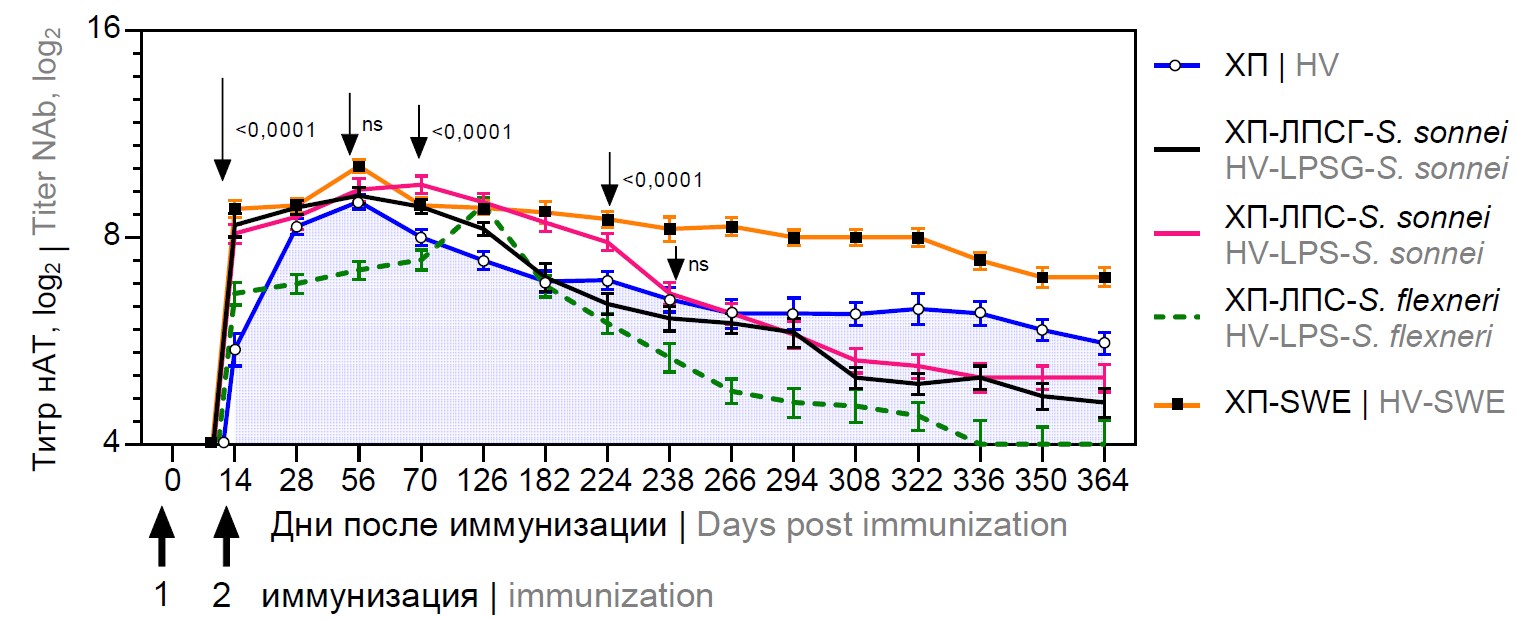
Титры антител у животных до начала иммунизации во всех группах были отрицательными, а в группах отрицательного контроля оставались отрицательными (титры нАТ ≤ 4) в течение всего эксперимента. Средние геометрические титры нАТ, вырабатываемых в ответ на различные комбинации вакцины против Пуумала с адъювантами и без, приведены на рис. 1–4. Группами сравнения являлись ХП и ХП-1/10. Сравнение титров нАТ проводили между ними и другими группами, иммунизированными ХП с добавлением различных адъювантов в соответствующий день отбора сыворотки крови. В экспериментальных группах нАТ определялись через 14 дней после 1-й иммунизации у всех животных. Анализ динамики нарастания титра нАТ в сыворотках крови морских свинок в экспериментальных группах продемонстрировал существенные различия. Первичный ответ выражался в повышении уровня нАТ в сыворотках крови уже после 1-й иммунизации во всех группах по сравнению с контролем. Пиковые значения для разных групп наблюдали в разные дни: на 56-й день — для ХП (9,0 ± 0,2log2), ХП-ЛПС-S. sonnei (9,2 ± 0,25log2), ХП-SWE (10,15 ± 0,22log2), на 70-й день — ХП-ЛПСГ-S. sonnei (9,54 ± 0,28log2), на 126-й день — ХП-ЛПС-S. flexneri (8,92 ± 0,22log2).
Рис. 1. Кинетика титра нАТ в сыворотках крови морских свинок в ответ на двукратное введение ХП в оптимальной дозе.
Fig. 1. Kinetics of neutralizing antibody titers in guinea pig blood sera in response to two doses of HV administered at optimal dosage.
Рис. 2. Кинетика титра нАТ в сыворотках крови морских свинок в ответ на трёхкратное введение ХП.
Fig. 2. Kinetics of neutralizing antibody titers in guinea pig blood sera in response to three doses of the HV.
Рис. 3. Кинетика титра нАТ в сыворотках крови морских свинок в ответ на двукратное введение минимальной дозы антигена в ХП.
Fig. 3. Kinetics of neutralizing antibody titers in guinea pig blood sera in response to two doses of HV administered at minimal dosage.
Рис. 4. Кинетика титра нАТ в сыворотках крови морских свинок в ответ на бустерное введение минимальной дозы иммуногена в составе ХП.
Fig. 4. Kinetics of neutralizing antibody titers in guinea pig blood sera in response to booster administration of HV at a minimal dose.
Для ХП-ЛПСГ-S. sonnei и ХП-ЛПС-S. sonnei наблюдали плавное снижение титров нАТ ниже такового для ХП. К 364-му дню титр нАТ составлял 4,6 ± 0,2; 5,00 ± 0,23 и 5,6 ± 0,21log2 соответственно. В группе ХП-ЛПС-S. flexneri наблюдали более стремительное снижение титров нАТ, достигшее порога отсечения на 336-й день. В присутствии SWE наблюдали крайне медленное снижение титров нАТ. На 364-й день титр нАТ оставался на уровне 7,0 ± 0,2log2. В сыворотках крови всех экспериментальных морских свинок к 364-му дню после двукратной иммунизации сохранялись нАТ.
На фоне снижения нАТ в сыворотках крови морских свинок бустерное введение препарата на 182-й день от начала иммунизации приводило к формированию аналогичного профиля нАТ для всех исследуемых групп (рис. 2). Нарастание до пиковых значений наблюдали: к 238-му дню для ХП (9,48 ± 0,3log2), на 266-й день — ХП-ЛПС-S. flexneri (8,92 ± 0,2log2) и ХП-SWE (9,19 ± 0,22log2), на 294-й день — ХП-ЛПСГ-S. sonnei (9,4 ± 0,25log2) и ХП-ЛПС-S. sonnei (9,7 ± 0,25log2), с последующим плавным снижением.
При этом уменьшение концентрации иммуногена в ХП в 10 раз индуцировало аналогичную динамику нарастания титра нАТ пропорционально вводимой дозе, но иммуномодулирующая эффективность адъювантов в таких условиях также была различна (рис. 3). Пиковые значения для разных групп наблюдали в разные дни: на 14-й день — для ХП-1/10-ЛПС-S. flexneri (5,34 ± 0,3log2), на 28-й — ХП-1/10 (6,50 ± 0,26log2), ХП-1/10-ЛПС-S. sonnei (5,43 ± 0,26log2) и ХП-1/10-SWE (6,35 ± 0,30log2), на 56-й — ХП-1/10-ЛПСГ-S. sonnei (5,7 ± 0,2log2). Снижение уровня нАТ в сыворотках крови ниже порога отсечения наблюдали на 266-й день для ХП-1/10-ЛПСГ-S. sonnei (4,00 ± 0,2log2), на 294-й — ХП-1/10-ЛПС-S. sonnei (4,0 ± 0,2log2), на 308-й — ХП-1/10-ЛПС-S. flexneri (4,0 ± 0,2log2) и ХП-1/10-SWE (4,0 ± 0,2log2), на 364-й — ХП (4,32 ± 0,25log2).
Бустерная иммунизация этими же препаратами через 182 дня приводила к пиковым значениям нАТ в сыворотках крови морских свинок: на 224-й день для ХП-1/10-ЛПС-S. sonnei (6,50 ± 0,26 log2) и ХП-1/10-ЛПС-S. flexneri (6,1 ± 0,3log2), на 238-й — ХП-1/10-ЛПСГ-S. sonnei (6,76 ± 0,2log2), на 294-й — ХП-1/10 (7,57 ± 0,20log2) и ХП-1/10-SWE (8,23 ± 0,26log2) (рис. 4). После максимальных значений титра нАТ наблюдали их плавное снижение к 364-му дню (выше порога отсечения).
Обсуждение
Впервые рассмотрена эффективность адъювантов в составе экспериментального ХП на основе вируса Пуумала на морских свинках, которые часто используются в качестве модели для ряда инфекционных заболеваний человека из-за сходства индукции иммунного ответа [40].
Анализ динамики продуцирования нАТ в экспериментальных группах показал существенное различие степени их иммуногенной активности в зависимости от комбинации ХП с адъювантом. Подобные результаты мы наблюдали в наших предыдущих экспериментах на модели BALB/c, когда была установлена индукция гуморального и клеточного иммунного ответа для нативного ХП и его комбинации с адъювантами различного происхождения [9]. Однако модель морских свинок позволила подтвердить формирование иммунологической памяти и выявить существенные различия в нарастании титров нАТ для разных экспериментальных групп, несмотря на одинаковую схему иммунизации. В целом наблюдалась схожая динамика титров нАТ после иммунизации ХП как в оптимальной, так и в сниженной в 10 раз концентрации антигена [11]. Выраженный для обоих вариантов бустерный эффект характеризовался более высоким уровнем нАТ в сыворотках крови экспериментальных животных, что подтверждает эффективность иммунизации и позволяет судить о возможности применения сниженной дозы антигена для определённых групп граждан [11]. Стоит отметить, что в данном исследовании важным критерием эффективной иммунизации было определение влияния бустерной иммунизации ХП в комбинации с углеводными адъювантами через 182 дня после 1-й иммунизации, особенно для минимальных доз иммуногена, что может значительно увеличивать доступность вакцины в условиях эпидемиологических вспышек.
Для низкоэндотоксичного апирогенного ЛПС рода Shigella, использованного в качестве адъюванта, наблюдали различную картину в динамике нарастания нАТ. ХП-ЛПСГ-S. sonnei и ХП-ЛПС-S. sonnei в концентрациях 50 мкг/дозу индуцировали ранний гуморальный иммунный ответ, с формированием «плато» нАТ с высоким титром с 14-го по 126-й день после 1-й иммунизации. Для ХП-ЛПСГ-S. sonnei отмечалось значительное пролонгирование индукции нАТ до 224-го дня с менее выраженным подъёмом после бустерного введения на 294-й день, как и для ХП-ЛПС-S. sonnei. Такой эффект можно связать с избыточной стимуляцией иммунной системы и для уменьшения подобного воздействия целесообразно увеличить интервал для бустерной иммунизации до 1 года либо снизить концентрацию антигена в вакцинном препарате. Таким образом, иммуноадъювантный эффект ЛПСГ-S. sonnei заключается в пролонгировании гуморального иммунного ответа, что позволит увеличить интервалы в схеме иммунизации. Безусловно, низкоэндотоксичные апирогенные Ac3-ЛПС являются многообещающими адъювантами с подтверждённым в клинических исследованиях отсутствием стимуляции продукции провоспалительных цитокинов (фактора некроза опухоли-α, интерлекинов-1β и -6), системных и местных эндотоксичных побочных реакций при парентеральном введении добровольцам в дозе 50 мкг [34]. Данные нашего исследования показали существенный подъём титра нАТ в ответ на бустерную иммунизацию препаратом, содержащим в 10 раз меньше антигена в комбинации с тремя ЛПС, однако титр нАТ не поднимался в сыворотках крови морских свинок статистически значимо выше, чем при введении ХП-1/10. Таким образом, наиболее выраженный иммунноадъювантный эффект ЛПС заключался в пролонгировании индукции нАТ при оптимальной дозе антигена.
Менее выраженный иммунный ответ ХП-ЛПС-S. flexneri в концентрации 50 мкг/дозу выражался в более отдалённом формировании пика нАТ (к 126-му дню) в сравнении с ХП (на 56-й день). Для ХП-ЛПС-S. flexneri первичный ответ выражался в более значительном повышении уровня нАТ в сыворотке крови морских свинок по сравнению с нативным ХП после первой иммунизации. Бустерное введение препарата приводило к повышению уровня нАТ с формированием повторного пика на 266-й день.
Для SWE в концентрации 100 мкг/дозу наблюдали наиболее выраженный иммуноадъювантный эффект. Однако из-за избыточной стимуляции иммунной системы бустерное введение препарата на 182-й день не приводило к ожидаемому подъёму уровня нАТ в сыворотках крови морских свинок. Вероятно, увеличение интервала в схеме иммунизации позволило бы компенсировать нагрузку на иммунную систему. Наиболее выраженный иммунный ответ был получен в ответ на ХП-1/10-SWE. Это подтверждает теорию об усилении иммунного ответа за счёт оптимального соотношения антиген : адъювант [11]. Для адъюванта Sepivac SWE в концентрации 100 мкг/дозу показана иммунологическая и экономическая целесообразность применения низких доз антигена. Подобная комбинация на фоне усиления антигенспецифических иммунных реакций и формирования иммунологической памяти позволяет уменьшить оптимальную дозу антигена и/или количество инъекций.
Заключение
Результаты свидетельствуют о раннем формировании иммунного ответа, интенсивность которого зависела от дозы вводимого иммуногена и комбинации с адъювантами. Наблюдаемые закономерности при иммунизации оптимальными и сниженными в 10 раз концентрациями антигена в ответ на бустерное введение обосновывают целесообразность меньших доз или увеличение интервалов между бустерными инъекциями во избежание избыточной стимуляции иммунной системы, что было показано нами ранее [11]. Обобщая результаты исследования, можно сделать вывод о том, что наиболее перспективными в составе ХП против ГЛПС можно рассматривать низкоэндотоксичный апирогенный Ac3-ЛПС S. sonnei, содержащий гомогенные длинные О-полисахаридные домены, и эмульсию наноэмульгированного сквалена животного происхождения по типу «масло в воде» (аналог MF59) Sepivac SWE в концентрациях 50 и 100 мкг/дозу соответственно.
1 A Clinical trial of COVAC-2 in healthy adults. URL: https://clinicaltrials.gov/study/NCT04702178
2 A Clinical trial of COVAC-2 in adults. URL: https://clinicaltrials.gov/study/NCT05209009
3 SEPIVAC SWE. URL: https://www.seppic.com/en/sepivac-swe-pharma
Об авторах
Светлана Сергеевна Курашова
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Автор, ответственный за переписку.
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0001-9934-699X
к.м.н., в.н.с. лаб. геморрагических лихорадок
Россия, МоскваМария Сергеевна Егорова
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0003-3642-6444
к.б.н., с.н.с. лаб. геморрагических лихорадок
Россия, МоскваАнна Николаевна Ветрова
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0003-1143-9732
м.н.с. лаб. геморрагических лихорадок
Россия, МоскваМария Владимировна Баловнева
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0003-2198-7521
к.б.н., в.н.с. лаб. геморрагических лихорадок
Россия, МоскваЮлия Валерьевна Попова
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0002-8231-1018
н.с. лаб. геморрагических лихорадок
Россия, МоскваРостислав Дмитриевич Теодорович
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: teodorovich_rd@chumakovs.su
ORCID iD: 0000-0003-2117-597X
н.с. лаб. геморрагических лихорадок
Россия, МоскваАнна Александровна Мироненко
Государственный научный центр «Институт иммунологии»
Email: kurashova_ss@chumakovs.su
ORCID iD: 0009-0006-4809-1433
к.б.н., с.н.с. лаб. полисахаридных вакцин
Россия, МоскваПетр Геннадьевич Апарин
Государственный научный центр «Институт иммунологии»
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0001-7899-2626
д.м.н., зав. лаб. полисахаридных вакцин
Россия, МоскваВячеслав Леонидович Львов
Государственный научный центр «Институт иммунологии»
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0002-0609-8331
к.х.н., зав. лаб. препаративной биохимии
Россия, МоскваЕвгений Александрович Ткаченко
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0002-6829-1241
д.м.н., профессор, рук. научного направления учреждения
Россия, МоскваТамара Казбековна Дзагурова
Федеральный научный центр исследований и разработки иммунобиологических препаратов имени М.П. Чумакова РАН (Институт полиомиелита)
Email: kurashova_ss@chumakovs.su
ORCID iD: 0000-0002-6656-1682
д.м.н., зав. лаб. геморрагических лихорадок
Россия, МоскваСписок литературы
- Tkachenko E.A., Ishmukhametov A.A., Dzagurova T.K., et al. Hemorrhagic fever with renal syndrome, Russia. Emerg. Infect. Dis. 2019;25(12):2325–8. DOI: https://doi.org/10.3201/eid2512.181649
- Tkachenko E., Kurashova S., Balkina A., et al. Cases of hemorrhagic fever with renal syndrome in Russia during 2000–2022. Viruses. 2023;15(7):1537. DOI: https://doi.org/10.3390/v15071537
- Дзагурова Т.К. Геморрагическая лихорадка с почечным синдромом: этиология, специфическая лабораторная диагностика, разработка диагностических и вакцинных препаратов: Дисс. … д-ра мед. наук. М.;2014. Dzagurova T.K. Hemorrhagic fever with renal syndrome: etiology, specific laboratory diagnostics, development of diagnostic and vaccine preparations: Diss. Moscow;2014.
- Ткаченко Е.А., Дзагурова Т.К., Набатников П.А. и др. Разработка экспериментальной вакцины против геморрагической лихорадки с почечным синдромом. Медицинская вирусология. 2009;26:194–6. Tkachenko E.A., Dzagurova T.K., Nabatnikov P.A., et al. Development of an experimental vaccine against hemorrhagic fever with renal syndrome. Medical Virology. 2009;26:194–6.
- Бархалёва О.А., Воробьёва М.С., Ладыженская И.П. и др. Вакцина против геморрагической лихорадки с почечным синдромом. Биопрепараты. Профилактика, диагностика, лечение. 2011;(1):27–30. Barkhaleva O.A., Vorobieva M.S., Ladyzhenskaya I.P., et al. Vaccine against hemorrhagic fever with renal syndrome. Biological Products. Prevention, Diagnosis, Treatment. 2011;(1):27–30. EDN: https://elibrary.ru/rdteeh
- Dzagurova T.K., Siniugina A.A., Ishmukhametov A.A., et al. Pre-clinical studies of inactivated polyvalent HFRS vaccine. Front. Cell. Infect. Microbiol. 2020;10:545372. DOI: https://doi.org/10.3389/fcimb.2020.545372
- Kaech S.M., Wherry E.J., Ahmed R. Effector and memory T-cell differentiation: implications for vaccine development. Nat. Rev. Immunol. 2002;2(4):251–62. DOI: https://doi.org/10.1038/nri778
- Plotkin S.A. Vaccines: past, present and future. Nat. Med. 2005;11(4 Suppl.):S5–11. DOI: https://doi.org/10.1038/nm1209
- Kurashova S.S., Ishmukhametov A.A., Dzagurova T.K., et al. Various adjuvants effect on immunogenicity of Puumala virus vaccine. Front. Cell. Infect. Microbiol. 2020;10:545371. DOI: https://doi.org/10.3389/fcimb.2020.545371
- Курашова С.С., Дзагурова Т.К., Егорова М.С. и др. Влияние адъювантов различных групп на иммуногенные свойства кандидатных вакцин против геморрагической лихорадки с почечным синдромом. Биотехнология. 2020;36(2):74–85. Kurashova S.S., Dzagurova T.K., Egorova M.S., et al. The effect of adjuvants of different groups on the immunogenicity of vaccines against hemorrhagic fever with renal syndrome. Biotechnology in Russia. 2020;36(2):74–85. DOI: https://doi.org/10.21519/0234-2758-2020-36-2-74-85 EDN: https://elibrary.ru/lthwli
- Курашова С.С., Баловнева М.В., Ишмухаметов А.А., и др. Гуморальный иммунный ответ после иммунизации морских свинок вакцинным препаратом на основе вируса Пуумала. Инфекция и иммунитет. 2022;12(5):971–5. Kurashova S.S., Balovneva M.V., Ishmukhametov A.A., et al. Immune response evaluation in the guinea pigs after immunization with the experimental Puumala virus vaccine. Russian Journal of Infection and Immunity. DOI: https://doi.org/10.15789/2220-7619-IRE-1956 EDN: https://elibrary.ru/avymst
- Курашова С.С., Дзагурова Т.К., Ишмухаметов А.А. и др. Адъюванты на основе углеводов для производства вакцин. Биопрепараты. Профилактика, диагностика, лечение. 2018;18(2): 81–91. Kurashova S.S., Dzagurova T.K., Ishmukhametov A.A., et al. Carbohydrate-based adjuvants for vaccine production. Biological Products. Prevention, Diagnosis, Treatment. 2018;18(2): 81–91. DOI: https://doi.org/10.30895/2221-996X-2018-18-2-81-91 EDN: https://elibrary.ru/xqrejv
- Pulendran B., Ahmed R. Translating innate immunity into immunological memory: implications for vaccine development. Cell. 2006;124(4):849–63. DOI: https://doi.org/10.1016/j.cell.2006.02.019
- Pulendran B. Modulating vaccine responses with dendritic cells and Toll‐like receptors. Immunol. Rev. 2004;199:227–50. DOI: https://doi.org/10.1111/j.0105-2896.2004.00144.x
- Germain R.N. An innately interesting decade of research in immunology. Nat. Med. 2004;10(12):1307–20. DOI: https://doi.org/10.1038/nm1159
- Janeway Jr. C.A., Medzhitov R. Innate immune recognition. Annu. Rev. Immunol. 2002;20(1):197–216. DOI: https://doi.org/10.1146/annurev.immunol.20.083001.084359
- Beutler B. Inferences, questions and possibilities in Toll-like receptor signalling. Nature. 2004;430(6996):257–63. DOI: https://doi.org/10.1038/nature02761
- Savelkoul H.F.J. et al. Choice and design of adjuvants for parenteral and mucosal vaccines. Vaccines (Basel). 2015; 3(1):148–71. DOI: https://doi.org/10.3390/vaccines3010148
- Garcia-Vello P., Speciale I., Chiodo F., et al. Carbohydrate-based adjuvants. Drug Discov. Today: Technol. 2020;35-36:57–68. DOI: https://doi.org/10.1016/j.ddtec.2020.09.005
- Di Lorenzo F., De Castro C., Silipo A., et al. Lipopolysaccharide structures of Gram-negative populations in the gut microbiota and effects on host interactions. FEMS Microbiol. Rev. 2019;43(3):257–72. DOI: https://doi.org/10.1093/femsre/fuz002
- Jin J.W., Tang S.Q., Rong M.Z., et al. Synergistic effect of dual targeting vaccine adjuvant with aminated β-glucan and CpG-oligodeoxynucleotides for both humoral and cellular immune responses. Acta Biomater. 2018;78:211–23. DOI: https://doi.org/10.1016/j.actbio.2018.08.002
- Pazos M., Peters K. Peptidoglycan. Subcell. Biochem. 2019;92:127–68. DOI: https://doi.org/10.1007/978-3-030-18768-2_5
- Stocker B.L., Kodar K., Wahi K., et al. The effects of trehalose glycolipid presentation on cytokine production by GM-CSF macrophages. Glycoconj. J. 2019;36(1):69–78. DOI: https://doi.org/10.1007/s10719-018-09857-9
- Clark K., Yau J., Bloom A., et al. Structure-function implictions of the ability of monoclonal antibodies against α-galactosylceramide-CD1d complex to recognize β-mannosylceramide presentation by CD1d. Front. Immunol. 2019;10:2355. DOI: https://doi.org/10.3389/fimmu.2019.02355
- Longet S., Abautret-Daly A., Davitt C.J.H., et al. An oral alpha-galactosylceramide adjuvanted Helicobacter pylori vaccine induces protective IL-1R-and IL-17R-dependent Th1 responses. NPJ Vaccines. 2019;4:45. DOI: https://doi.org/10.1038/s41541-019-0139-z
- Pirahmadi S., Zakeri S., Mehrizi A.A., et al. Combining monophosphoryl lipid a (MPL), CpG oligodeoxynucleotide (ODN), and QS-21 adjuvants induces strong and persistent functional antibodies and T cell responses against cell-traversal protein for ookinetes and sporozoites (CelTOS) of Plasmodium falciparum in BALB/c mice. Infection Immun. 2019;87(6): e00911-18. DOI: https://doi.org/10.1128/iai.00911-18
- Fox C.B., Friede M., Reed G.S., Ireton G.C. Synthetic and natural TLR4 agonists as safe and effective vaccine adjuvants. Subcell. Biochem. 2010;53:303–21. DOI: https://doi.org/10.1007/978-90-481-9078-2_14
- Cluff C.W. Monophosphoryl lipid A (MPL) as an adjuvant for anti-cancer vaccines: clinical results. Adv. Exp. Med. Biol. 2010;667:111–23. DOI: https://doi.org/10.1007/978-1-4419-1603-7_10
- Coler R.N., Bertholet S., Moutaftsi M., et al. Development and characterization of synthetic glucopyranosyl lipid adjuvant system as a vaccine adjuvant. PloS One. 2011;6(1):e16333. https://doi.org/10.1371/journal.pone.0016333
- Gu P., Liu Z., Sun Y., et al. Angelica sinensis polysaccharide encapsulated into PLGA nanoparticles as a vaccine delivery and adjuvant system for ovalbumin to promote immune responses. Int. J. Pharm. 2019;554:72–80. DOI: https://doi.org/10.1016/j.ijpharm.2018.11.008
- Bobbala S., Gibson B., Gamble A., et al. Poloxamer 407‐chitosan grafted thermoresponsive hydrogels achieve synchronous and sustained release of antigen and adjuvant from single‐shot vaccines. Immunol. Cell Biol. 2018;96(6):656–65. DOI: https://doi.org/10.1111/imcb.12031
- Jin J.W., Tang M.Z., Ring M.Z., Zhang M.Q. Synergistic effect of dual targeting vaccine adjuvant with aminated β-glucan and CpG-oligodeoxynucleotides for both humoral and cellular immune responses. Acta Biomater. 2018;78:211–23. DOI: https://doi.org/10.1016/j.actbio.2018.08.002
- Taleghani N., Bozorg A., Azimi A., et al. Immunogenicity of HPV and HBV vaccines: adjuvanticity of synthetic analogs of monophosphoryl lipid A combined with aluminum hydroxide. APMIS. 2019;127(3):150–7. DOI: https://doi.org/10.1111/apm.12927
- Ledov V.A., Golovina M.E., Markina A.A., et al. Highly homogenous tri-acylated S-LPS acts as a novel clinically applicable vaccine against Shigella flexneri 2a infection. Vaccine. 2019; 37(8):1062–72. DOI: https://doi.org/10.1016/j.vaccine.2018.12.067
- de Jonge J., van Dijken H., de Heij F., et al. H7N9 influenza split vaccine with SWE oil-in-water adjuvant greatly enhances cross-reactive humoral immunity and protection against severe pneumonia in ferrets. NPJ Vaccines. 2020;5(1):38. DOI: https://doi.org/10.1038/s41541-020-0187-4
- Xu S., Duan H., An Y., et al. Effect of adjuvanting RBD-dimer-based subunit COVID-19 vaccines with Sepivac SWE™. Vaccine. 2023;41(17):2793–803. DOI: https://doi.org/10.1016/j.vaccine.2023.03.035
- Егорова М.С., Курашова С.С., Ишмухаметов А.А. и др. Разработка метода количественного определения вирусной РНК для контроля специфической активности вакцины против геморрагической лихорадки с почечным синдромом. Вопросы вирусологии. 2021;66(1):65–73. Egorova M.S., Kurashova S.S., Ishmukhametov A.A., et al. Real-time PCR assay development for the control of vaccine against hemorrhagic fever with renal syndrome. Problems of Virology. 2021;66(1):65–73. DOI: https://doi.org/10.36233/0507-4088-30 EDN: https://elibrary.ru/ntgzwx
- Курашова С.С., Ишмухаметов А.А., Егорова М.С. и др. Сравнительная характеристика инактивирующих агентов для создания вакцины против геморрагической лихорадки с почечным синдромом. Эпидемиология и вакцинопрофилактика. Kurashova S.S., Ishmukhametov A.A., Egorova M.S., et al. Comparative characteristics of inactivation agents for HFRS vaccine development. 2018;17(4):26–8. DOI: https://doi.org/10.31631/2073-3046-2018-17-4-26-29 EDN: https://elibrary.ru/xxfrbj
- Perepelov A.V., Shekht M., Liu B., et al. Shigella flexneri O-antigens revisited: final elucidation of the O-acetylation profiles and a survey of the O-antigen structure diversity. FEMS Immunol. Med. Microbiol. 2012;66(2):201–10. DOI: https://doi.org/10.1111/j.1574-695x.2012.01000.x
- Рыбакова А.В., Макарова М.Н. Использование морских свинок в биомедицинских исследованиях. Международный вестник ветеринарии. 2018;(1):132–7. Rybakova A.V., Makarova M.N. Using guinea pigs for biomedical research. International Bulletin of Veterinary Medicine. 2018;(1):132–7. EDN: https://elibrary.ru/yucint
Дополнительные файлы