Интегративный подход к оценке патогенного потенциала штаммов Escherichia coli, выделенных из мочи
- Авторы: Макарова М.А.1,2, Матвеева З.Н.1, Кафтырева Л.А.1,2
-
Учреждения:
- Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
- Северо-Западная медицинская академия имени И.И. Мечникова
- Выпуск: Том 101, № 1 (2024)
- Страницы: 72-79
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18554
- DOI: https://doi.org/10.36233/0372-9311-493
- EDN: https://elibrary.ru/ytaqsf
- ID: 18554
Цитировать
Аннотация
Актуальность. Уропатогенные/Uropathogenic Escherichia coli (UPEC) характеризуются способностью к выживанию и размножению в мочевом тракте за счёт наличия специфических факторов вирулентности. В рутинной практике выявление диагностически значимой бактериурии не даёт представления о локализации инфицирования мочевой системы (почечная паренхима, мочевой пузырь), патогенном потенциале выделенного штамма в прогрессировании и хронизации инфекционного процесса, возникновении жизнеугрожающих состояний (уросепсис, менингит).
Цель — охарактеризовать популяционную структуру, генетическое разнообразие и патогенный потенциал штаммов E. coli, выделенных из мочи.
Материалы и методы. Изучены 194 штамма E. coli, выделенные из мочи. Детекцию 17 генов, кодирующих синтез: адгезинов (pap, fimH, sfa, focG, afa), токсинов (hlyA, cvaC, cnf, cdtB), капсульных антигенов (kpsMTII, kpsMTIII, kpsMT K1), сидерофоров (fyuA, iutA), инвазинов (ibeA), генетических маркеров острова патогенности UPEC CFT073, гена traT, кодирующего фактор резистентности к бактерицидному действию сыворотки и принадлежность к филогенетическим группам, выполняли методом ПЦР. Для оценки статистической значимости различий применяли точный критерий Фишера. Достоверными считали различия при 95% доверительном интервале (р < 0,05).
Результаты. Штаммы E. coli чаще (р < 0,05) принадлежали к филогенетической группе В2 (57,7%). Патогенетически значимые детерминанты вирулентности выявлены у 97,9% штаммов. По сочетанию 17 генов установлены 134 индивидуальных генотипа вирулентности. У 93,3% штаммов выявлена генетическая предрасположенность к возникновению рецидивов инфекций мочевыводящих путей, у 6,9% — потенциал развития пиелонефрита и рецидивирующего цистита. Маркеры жизнеугрожающих осложнений инфекций мочевыводящих путей выявлены у 12% штаммов, из них 10,7% свидетельствовали о развитии уросепсиса, 1,3% — менингита.
Заключение. Детекция комплекса генов в штаммах E. coli, выделенных из мочи, подтверждает этиологическую значимость изолята и позволяет оценить патогенный потенциал развития хронических форм и тяжёлых жизнеугрожающих осложнений.
Полный текст
Введение
Мочевыводящие пути являются распространённым локусом бактериальной инфекции, а Escherichia coli — наиболее частым возбудителем этого биотопа. Инфекции мочевыводящих путей (ИМП) могут иметь различную клиническую картину — от бессимптомной бактериурии, восходящих инфекций (острого пиелонефрита) до тяжёлого уросепсиса [1–3].
Уропатогенные/Uropathogenic E. coli (UPEC) характеризуются повышенной адаптационной способностью к выживанию и размножению в мочевом тракте за счёт наличия специфических липополисахаридов, капсул, белков наружной мембраны, фимбрий, пилей, секретируемых токсинов, сидерофоров, а также резистентности к бактерицидному действию сыворотки. Уропатогенный потенциал E. coli последовательно реализуется на различных этапах инфекционного процесса: адгезии, колонизации, персистенции [4].
Для успешной колонизации тканей мочевыводящей системы E. coli необходимы конкретные адгезины. К основным факторам адгезии относят пили или фимбрии. Типичными для UPEC являются пили 1-го типа (FimH), P, S и F1C-фимбрии. Адгезины FimH, кодируемые геном fimH, играют важную роль в начале развития ИМП и считаются самым распространённым фактором вирулентности UPEC [5, 6]. Штаммы, вызывающие цистит, всегда экспрессируют фимбрии типа 1; при отсутствии других фимбрий инфекция ограничиватся поражением мочевого пузыря. Главной разновидностью пилей, специфичных для UPEC, являются Р-фимбрии, кодируемые геном pap. Они отсутствуют у комменсальных и диареегенных E. coli и получили такое название, т.к. чаще обнаруживаются у штаммов, ассоциированных с пиелонефритом [7]. Маннозорезистентные S-пили подразделяют на Sfa-, F1C-пили (Foc) и S/F1C-связанные пили (Sfr). Эти адгезины имеют высокую степень гомологии, но различаются рецепторной специфичностью; S-пили экспрессируются преимущественно штаммами сепсис- (SEPEC) и менингит-ассоциированными E. coli (NMEC), но могут встречаться и у штаммов UPEC, вызывающих восходящие ИМП. Кроме фимбриальных адгезинов, у UPEC широко распространены афимбриальные, кодируемые геном afa, способствующие адгезии к уротелиальным клеткам. Штаммы, синтезирующие афимбриальные адгезины, имеют высокий потенциал развития пиелонефрита и рецидивирующего цистита [8].
Токсины играют важную роль при ИМП, поскольку способствуют распространению бактерий в тканях, повышению цитотоксичности, устойчивости к нейтрофилам, повреждению и нарушению метаболизма клеток хозяина. Наиболее изученным токсином, секретируемым UPEC, является α-гемолизин — HlyA (продукт гена hlyА), который не только стимулирует апоптоз клеток-мишеней, включая нейтрофилы, Т-лимфоциты и почечные эпителиоциты, но и вызывает деградацию регуляторных и структурных компонентов цитоскелета, способствуя отшелушиванию клеток мочевого пузыря и разрушению фагоцитов. Токсин CNF1 (цитотоксический некротический фактор 1), кодируемый геном cnf, препятствует полиморфноядерному фагоцитозу, способствует выработке биологически активных компонентов, вызывая функциональные и структурные повреждения, а также апоптоз эпителиальных клеток мочевого пузыря [6, 8]. Токсин с ДНКазной активностью CDT (фактор расширения цитолетального токсина), кодируемый геном cdt, приводит к апоптозу клеток; встречается более чем у 90% штаммов UPEC [9, 10].
К факторам персистенции UPEC относят капсулы (синтез К-антигенов), которые защищают бактерии от фагоцитоза и бактерицидного действия системы комплемента [8].
Решающее значение для выживания UPEC в уретральном тракте имеет продукция сидерофоров (железосвязывающих белков), определяющих способность бактериальных клеток к захвату железа. Синтез сидерофоров увеличивает вирулентность UPEC. К основным сидерофорам относят аэробактин (iutA) и иерсинебактин (fyuA) [11].
В рутинной практике бактериологического исследования методы типирования E. coli, вызывающих ИМП, не используют. Критерием диагноза при ИМП является обнаружение микроорганизмов в концентрации как минимум 103 КОЕ в 1 мл мочи. Выявление диагностически значимой бактериурии не дает представления о локализации инфицирования мочевой системы (почечная паренхима, мочевой пузырь) [1]. Поэтому одной из наиболее важных задач лаборатории клинической микробиологии является осмысленный анализ полученных результатов, а также оценка этиологической значимости выделенного микроорганизма [12]. Основную сложность при интерпретации результатов представляют изоляты, выделенные из мочи, за счёт возможной контаминации E. coli представителями нормобиоты кишечника. Врач-микробиолог должен не только определить, является ли выделенный изолят E. coli истинным возбудителем или это следствие контаминации пробы на преаналитическом этапе, но и оценить патогенный потенциал конкретного изолята в развитии хронических форм ИМП или тяжёлых жизнеугрожающих состояний, таких как сепсис или менингит. Несмотря на то что научные исследования продолжаются в течение многих лет, конкретные критерии для отнесения штаммов к UPEC не установлены.
В результате вышесказанного цель работы — охарактеризовать популяционную структуру, генетическое разнообразие и патогенный потенциал штаммов E. coli, выделенных из мочи.
Материалы и методы
Объектами исследования явились 194 штамма E. coli, выделенные из мочи пациентов с неосложнёнными ИМП. Предметом исследования служили биологические свойства штаммов, отражающие патогенность (гены вирулентности, ассоциированные с адгезией, инвазией, токсинообразованием, персистенцией и др.).
Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен Этическим комитетом Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера (протокол № 27 от 02.07.2020).
Выделение ДНК проводили с использованием набора «InstaGene Matrix» («BioRad»). ПЦР выполняли в режиме автоматической амплификации в термоциклере «СXT-1000» («BioRad»). Использовали готовую смесь с Taq ДНК-полимеразой, «PCR Master Mix» («ThermoFisher Scientific»). Праймеры вносили в пределах 0,5–1,5 мкл при неизменённом объёме пробы (20 мкл), что достигалось соответствующим изменением объёма стерильной дистиллированной воды. Использовали ранее исследованные праймеры («Синтол», «Сибэнзим», «Евроген») [13–15]. Разделение амплифицированных фрагментов ДНК проводили в 0,5×ТВЕ буфере с добавлением бромистого этидия при 120 В в течение 60 мин в камере для электрофореза («BioRad») в горизонтальном геле. Для визуализации результатов ПЦР использовали систему документирования «GelDoc» («BioRad»). В качестве маркеров молекулярного веса применяли ДНК-маркер «100 bp + 1,5 Kb + 3 Kb» («Сибэнзим»).
Штаммы тестировали на наличие 17 генов, кодирующих синтез факторов вирулентности: адгезинов (pap, fimH, sfa, focG и afa), токсинов (hlyA, cvaC, cnf и cdtB), капсульных антигенов (kpsMTII, kpsMTIII, kpsMT K1), сидерофоров (fyuA и iutA), инвазинов (ibeA), а также на присутствие генетических маркеров острова патогенности (PAI) UPEC CFT073 и гена (traT), кодирующего фактор резистентности к бактерицидному действию сыворотки.
Филогенетическую принадлежность штаммов E. coli определяли методом мультиплексного филотипирования на основе ПЦР с использованием праймеров, нацеленных на три маркера: chuA, yjaA и TspE4.C2 [16].
Полученные данные обрабатывали с помощью компьютерной программы «Excel» («Microsoft»). Для оценки статистической значимости различий средних величин применяли точный критерий Фишера. Статистически значимыми считали различия при доверительном интервале 95% (р < 0,05).
Результаты
При анализе комбинации генов chuA, yjaA и TspE4.C2 установлено, что штаммы E. coli статистически значимо чаще (р < 0,05) принадлежали филогенетической группе В2 (57,7%) по сравнению со штаммами филогрупп А (4,6%), В1 (7,2%) и D (30,4%); значимо реже (р < 0,05) — к филогруппам А и В1 по сравнению с В2 и D.
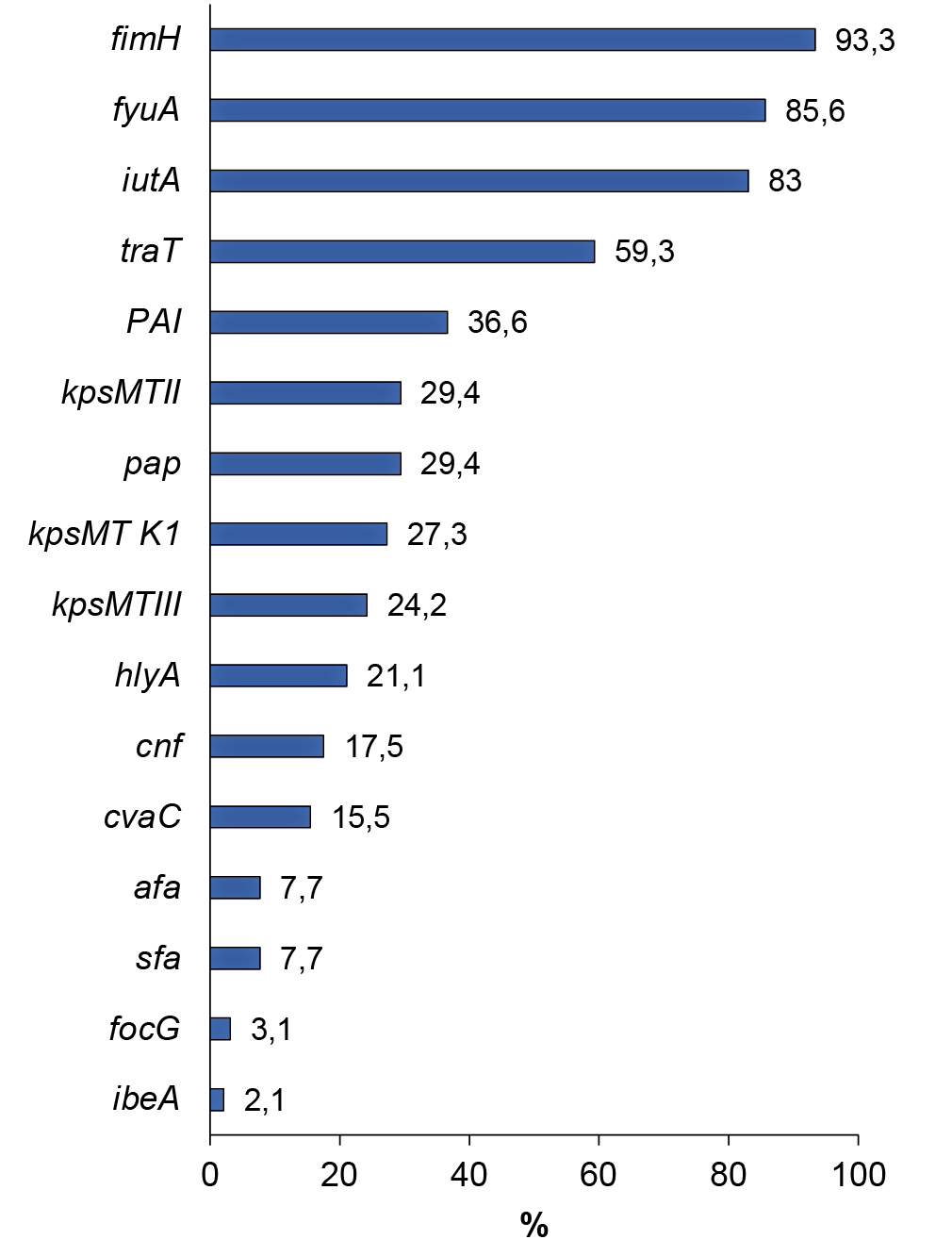
Распространённость генов, кодирующих синтез факторов вирулентности UPEC, колебалась от 2,1% (ibeA) до 93,3% (fimH). Ген, ответственный за продукцию цитолетального расширяющего токсина (cdtB), участвующего в подавлении пролиферации клеток с последующей их гибелью, ни у одного штамма не выявлен. Частота встречаемости генетических детерминант, кодирующих факторы вирулентности UPEC, представлена на рисунке.
Распространённость генов, кодирующих факторы вирулентности UPEC.
Prevalence of genes encoding UPEC virulence factors.
Анализ детекции генов, ассоциированных с адгезией, показал, что практически все штаммы содержали ген fimН (93,3%), кодирующий маннозочувствительные фимбрии 1-го типа. Ген pap, ответственный за синтез пиелонефрит-ассоциированных пилей, встречался практически у каждого третьего штамма (29,4%); ген afa, кодирующий афимбриальные адгезины, — у 7,7% изученных штаммов E. coli; детерминанты sfa и focG, ассоциированные с фимбриальными адгезинами, — у 7,7 и 3,1%; гены hlyA и cnf, кодирующие синтез токсинов (α-гемолизина и цитонекротического фактора), — у 21,1 и 17,5%; ген cvaC, ответственный за продукцию колицина V, — у 15,5%. Ответственный за инвазию эндотелиальных клеток гематоэнцефалического барьера ген ibeA обнаружен у 4 (2,1%) штаммов E. coli. Частота встречаемости генетических детерминант, кодирующих синтез сидерофоров: иерсинебактина (fyuA) и аэробактина (iutA), составляла 85,6 и 83,0%. Гены, кодирующие синтез капсульных антигенов, выявлены у 61,9% изученных штаммов. Гены kpsMTII и kpsMTIII, кодирующие комплексы антигенов К1, К5, К12 и К3, К10, К54, были выявлены у 29,4 и 24,2% штаммов. «Типоспецифический» ген kpsMT K1, кодирующий антиген К1, по химической структуре и иммунохимическим характеристикам идентичный К-антигену Neisseria meningitidis, обнаружен у 27,3% штаммов. Кодирующий фактор устойчивости бактериальной клетки к бактерицидному действию сыворотки крови — ген traT — выявлен у 59,3% штаммов. У 36,6% штаммов были выявлены PAI — UPEC CFT073.
Генетические детерминанты вирулентности UPEC в изученных штаммах присутствовали в сочетаниях и изолированно. В геноме 4 (2,1%) штаммов не выявлено ни одного из тестируемых генов вирулентности. У 1 (0,5%; 95% ДИ 0,1–2,9%) штамма был выявлен 1 ген. Остальные 99,5% штаммов характеризовались наличием комбинаций генов, из них 1,5% (95% ДИ 0,5–4,5%) — сочетанием 2 генетических детерминант, 10,3% (95% ДИ 6,8–15,4) — 3. Статистически значимо чаще (р < 0,05) встречались штаммы, содержащие комбинации из 4 генов, — 16,0% (95% ДИ 11,5–21,8%), 5 генов — 23,2% (95% ДИ 17,8–29,6%), 6 генов — 33,0% (95% ДИ 26,8–39,9%). Семь маркеров вирулентности были выявлены у 9,8% (95% ДИ 6,4–14,8%) штаммов, 8 — у 3,1% (95% ДИ 1,4–6,6%), 9 — у 2,1% (95% ДИ 0,8–5,2%). Геном 1 штамма (0,5%; 95% ДИ 0,1–2,9%) был представлен индивидуальным профилем и характеризовался комбинацией 10 генов.
Встречаемость генов и кодируемые ими факторы вирулентности E. coli различных филогенетических групп представлены в таблице. В штаммах всех филогенетических групп значимо чаще (р < 0,05), по сравнению с другими генами, ассоциированными с адгезией, присутствовал ген fimН. Ген pap встречался в штаммах E. coli филогенетической группы В2 (36,6%), что значимо чаще (р < 0,05) по сравнению со штаммами групп А (11,1%), В1 (14,3%) и D (1,7%). Кодирующий афимбриальные антигенсвязывающие адгезины ген afa чаще присутствовал в штаммах филогенетической группы В1 (64,3%). Кодирующий синтез фимбриальных адгезинов ген sfa без значимых различий был выявлен в штаммах филогенетических групп В1 (4,8%) и В2 (11,8%). Ген focG, кодирующий фимбриальный адгезин F1C уропатогенных E. coli, выявлен только в штаммах филогенетической группы В2 (4,5%).
Встречаемость генов и факторов вирулентности в штаммах E. coli различных филогенетических групп
Occurrence of genes and virulence factors in E. coli strains of various phylogenetic groups
Гены и факторы вирулентности Genes and virulence factors | Филогенетические группы | Phylogenetic groups | |||||||||||
А (n = 9) | В1 (n = 14) | В2 (n = 112) | D (n = 59) | |||||||||
абс. abs. | % | 95% ДИ 95% CI | абс. abs. | % | 95% ДИ 95% CI | абс. abs. | % | 95% ДИ 95% CI | абс. abs. | % | 95% ДИ 95% CI | |
Адгезины | Adhesins | 7 | 77,8 | 45,3–93,7 | 14 | 100,0 | 78,5–100 | 110 | 98,2 | 93,7–99,5 | 27 | 45,8 | 33,7–58,7 |
fimH | 5 | 55,6 | 26,7–81,1 | 14 | 100,0 | 78,5–100 | 104 | 92,9 | 86,5–96,3 | 27 | 45,8 | 33,7–58,7 |
pap | 1 | 11,1 | 2,0–43,5 | 2 | 14,3 | 4,0–40,0 | 41 | 36,6 | 28,3–45,8 | 1 | 1,7 | 0,03–9,0 |
afa | 2 | 22,2 | 6,3–54,7 | 9 | 64,3 | 38,8–83,7 | 2 | 1,8 | 0,5–6,3 | 0 | 0 | 0–6,1 |
sfa | 0 | 0,0 | 0–29,9 | 0 | 0,0 | 0–21,5 | 14 | 12,5 | 7,6–19,9 | 1 | 1,7 | 0,03–9,0 |
focG | 0 | 0,0 | 0–29,9 | 0 | 0,0 | 0–21,5 | 1 | 4,5 | 0,2–4,9 | 0 | 0 | 0–6,1 |
Токсины | Toxins | 3 | 33,3 | 12,1–64,6 | 3 | 21,4 | 7,6–47,6 | 50 | 46,4 | 35,8–53,9 | 6 | 10,2 | 4,8–20,5 |
hlyА | 0 | 0,0 | 0–29,9 | 1 | 7,1 | 1,3–31,5 | 28 | 25,0 | 17,9–33,8 | 3 | 5,1 | 1,7–13,9 |
cnf | 2 | 22,2 | 6,3–54,7 | 0 | 0,0 | 0–21,5 | 22 | 19,6 | 13,3–27,9 | 0 | 0 | 0–6,1 |
cvaС | 1 | 11,1 | 2,0–43,5 | 2 | 14,3 | 4,01–39,95 | 9 | 8,0 | 4,3–14,6 | 4 | 6,8 | 2,7–16,2 |
Инвазины | Invasins | 0 | 0,0 | 0–29,9 | 0 | 0,0 | 0–21,53 | 3 | 2,7 | 0,92–7,58 | 0 | 0 | 0–6,11 |
ibeA | 0 | 0,0 | 0–29,9 | 0 | 0,0 | 0–21,53 | 3 | 2,7 | 0,92–7,58 | 0 | 0 | 0–6,11 |
Сидерофоры | Siderophore | 3 | 33,3 | 12,1–64,6 | 14 | 100,0 | 78,5–100 | 110 | 98,2 | 93,7–99,5 | 28 | 47,5 | 35,3–59,9 |
fyuA | 3 | 33,3 | 12,1–64,6 | 11 | 78,6 | 52,4–92,4 | 98 | 87,5 | 80,1–92,4 | 23 | 39,0 | 27,6–51,7 |
iutA | 2 | 22,2 | 6,3–54,7 | 11 | 78,6 | 52,4–92,4 | 91 | 81,3 | 73,0–87,4 | 20 | 33,9 | 23,1–46,6 |
Капсулы | Capsules | 1 | 11,1 | 2,0–43,5 | 6 | 42,9 | 21,4–67,4 | 63 | 56,3 | 47,0–65,1 | 9 | 15,3 | 8,2–56,5 |
kpsMTIII | 1 | 11,1 | 2,0–43,5 | 4 | 28,6 | 11,7–54,7 | 26 | 23,2 | 16,4–31,8 | 0 | 0 | 0–6,1 |
kpsMT K1 | 0 | 0,0 | 0–29,9 | 0 | 0,0 | 0–21,5 | 21 | 28,6 | 12,6–27,0 | 3 | 5,1 | 1,7–13,9 |
kpsMTII | 0 | 0,0 | 0–29,9 | 4 | 28,6 | 11,7–54,7 | 31 | 27,7 | 20,2–36,6 | 6 | 10,2 | 4,6–20,5 |
Другие | Others | ||||||||||||
traT | 6 | 66,7 | 35,4–87,9 | 10 | 71,4 | 45,4–88,3 | 21 | 18,8 | 12,6–27,0 | 48 | 81,4 | 69,6–89,3 |
PAI | 1 | 11,1 | 2,0–43,5 | 7 | 50,0 | 26,8–73,2 | 37 | 33,0 | 25,0–45,2 | 49 | 83,1 | 71,5–90,5 |
Анализ встречаемости генов, ассоциированных с продукцией токсинов, показал, что статистически значимо чаще (р < 0,05) генетические маркеры токсинообразования присутствовали в штаммах филогенетической группы В2 (46,4%) по сравнению со штаммами других филогрупп.
Генетические маркеры, ответственные за синтез сидерофоров, без достоверных различий присутствовали в штаммах, принадлежащих к различным филогенетическим группам.
Гены, кодирующие синтез К-антигенов (kpsMTIII, kpsMT K1, kpsMTII), защищающих бактериальную клетку от фагоцитоза, статистически значимо (р < 0,05) чаще присутствовали в штаммах филогенетической группы В2 (56,3%) по сравнению со штаммами других филогенетических групп.
Ген traT — фактор резистентности к бактерицидному действию сыворотки крови и PAI — маркер осторова патогенности UPEC в сопоставимых долях встречались в штаммах всех филогенетических групп.
Обсуждение
Основную сложность интерпретации результатов культурального метода при детекции патогенных штаммов — возбудителей заболеваний внекишечной локализации (ExPEC) представляют изоляты, выделенные из мочи, в связи с отсутствием чётко сформулированных критериев оценки этиологической значимости конкретного изолята, а также из-за возможной контаминации пробы. К истинным возбудителям ExPEC, включая UPEC, относят штаммы, содержащие 2 или более основных генов вирулентности (pap, sfa, afa, kpsMTII, iutA). Другие, так называемые дополнительные гены (fimН, hlyA, cvaC, cnf, cdtB, kpsMTIII, ibeA, traT и PAI), могут быть потенциально связаны с ExPEC, т.к. способствуют адаптивной и конкурентной колонизации [17, 18]. Штаммы E. coli, которые, помимо основных генов вирулентности ExPEC, имеют и потенциальные, характеризуются повышенной способностью адаптироваться к новым нишам, что позволяет им вызывать широкий спектр заболеваний.
Выделенные из мочи штаммы E. coli принадлежали к различным филогенетическим группам, причём большинство (88,1%) — к группам В2 (57,7%) и D (30,4%), к которым, как правило, относят возбудителей заболеваний внекишечной локализации [19]. К группам А и В1, с которыми ассоциируют комменсальные E. coli, были отнесены 4,6 и 7,2% штаммов [16]. Патогенетически значимые генетические детерминанты вирулентности выявлены у 97,9% штаммов. По сочетанию 17 генов, ассоциированных с адгезией (fimН, pap, afa, sfa и focG), синтезом сидерофоров (fyuA и iutA), капсул (kpsMTII, kpsMTIII и kpsMT K1), токсинов (hlyA, cnf, cdt и cvaC), инвазинов (ibeA), обеспечивающих резистентность к бактерицидному действию сыворотки крови (traT), наличию острова патогенности UPEC (PAI) выявлены 134 индивидуальных генотипа вирулентности. Подавляющее большинство (99,5%) штаммов содержали от 2 до 10 генов вирулентности. Полученные результаты, свидетельствующие о выраженной генетической гетерогенности штаммов UPEC, согласуются с данными российских исследователей [20, 21]. Проведённое исследование показало, что 95,9% (186/194) штаммов, выделенных из мочи, удовлетворяли критериям UPEC — имели 3–10 генов, принадлежали к филогруппам В2 и D. Восемь (4,1%) штаммов принадлежали к филогруппам А и В1, не имели основных и дополнительных генов вирулентности и были расценены как контаминанты.
Генетическая предрасположенность к рецидивам ИМП была у выявлена 93,3% штаммов за счёт наличия адгезинов FimH, кодируемых геном fimH, содействующих персистенции UPEC [5–7]. Кроме фимбриальных адгезинов, у UPEC широко распространены кодируемые геном afa афимбриальные адгезины семейства Afa/Dr, способствующие адгезии с уротелиальными клетками. В проведённом исследовании у 13 обследованных пациентов были выявлены штаммы, синтезирующие афимбриальные адгезины, которые, согласно данным других исследователей, имеют высокий потенциал возникновения пиелонефрита и рецидивирующего цистита [22].
Распространённой причиной бактериальных менингитов новорождённых с летальностью до 40%, а также тяжёлых неврологических последствий являются менингит-ассоциированные E. coli (NMEC) [23, 24]. В большинстве случаев инфицирование новорождённых происходит при наличии NMEC в мочеполовых путях рожениц, носительстве их в кишечнике или как осложнение неонатального сепсиса [25]. Эшерихиозный сепсис нередко рассматривают как вторичную инфекцию. Каждый третий случай — это уросепсис, который может возникнуть при любом урологическом заболевании (нарушение уродинамики при ИМП, гнойные формы пиелонефрита, задержка мочи, острый простатит) [26]. Риск развития сепсиса повышается при инфекционном процессе, вызванном штаммами E. coli, которые имеют в своей структуре Р-пили и S-фимбрии, продуцирующие гемолизин, цитонекротический фактор и синтезирующие капсульный антиген K2 [8, 14]. Маркеры неблагоприятного прогноза течения ИМП выявлены у 12% штаммов, из них 10,7% имели генетические детерминанты, ассоциированные с развитием сепсиса (уросепсиса), 1,3% — менингита.
Наличие достаточно противоречивых результатов при применении традиционного бактериологического метода лабораторного исследования заставляет критически переоценить его диагностическую значимость в сторону, бесспорно, перспективного молекулярно-генетического метода. Общепринятая практика безоговорочного признания этиологической значимости конкретного изолята, количественно преобладающего в пробе при культуральном исследовании, выглядит, по меньшей мере, сомнительной [27]. Тем не менее отказаться от общепринятого метода культивирования микроорганизмов невозможно в силу того, что он позволяет получить информацию о клинически значимых штаммах, их количестве и ассоциациях, оценить чувствительность к антибиотикам, бактериофагам и дезинфектантам, а также является неотъемлемым этапом выделения ДНК для последующих молекулярных исследований, включая полногеномное секвенирование.
Заключение
Проведённое исследование показало, что детекция комплекса генов в штаммах E. coli, выделенных из мочи, не только подтверждает этиологическую значимость изолята, но и позволяет оценить патогенный потенциал развития хронических форм и острых угрожающих жизни осложнений. Выявленная гетерогенность популяции UPEC свидетельствует о необходимости оптимизации алгоритма и разработки стандартов лабораторной диагностики и профилактики осложнений заболеваний, вызванных уропатогенными E. coli. Результаты интегративного подхода в лабораторной диагностике ИМП с использованием всех адекватных методов (традиционных, современных, инновационных), сосредоточенных на принципах доказательной медицины — достоверности научных доказательств их эффективности, необходимо учитывать в практике специалистов различного профиля.
Об авторах
Мария Александровна Макарова
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера; Северо-Западная медицинская академия имени И.И. Мечникова
Автор, ответственный за переписку.
Email: makmaria@mail.ru
ORCID iD: 0000-0003-3600-2377
д.м.н., в.н.с., зав. лаб. кишечных инфекций Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера, Санкт-Петербург, Россия; доцент каф. медицинской микробиологии Северо-Западного государственного медицинского университета им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургЗоя Николаевна Матвеева
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера
Email: makmaria@mail.ru
ORCID iD: 0000-0002-7173-2255
к.м.н., в.н.с. лаб. кишечных инфекций Федерального бюджетного учреждения науки Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургЛидия Алексеевна Кафтырева
Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии имени Пастера; Северо-Западная медицинская академия имени И.И. Мечникова
Email: makmaria@mail.ru
ORCID iD: 0000-0003-0989-1404
д.м.н., в.н.с., зав. отделом микробиологии Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера; профессор каф. медицинской микробиологии Северо-Западного государственного медицинского университета им. И.И. Мечникова
Россия, Санкт-Петербург; Санкт-ПетербургСписок литературы
- Бухарин О.В., Гриценко В.А., Вялкова А.А. Факторы уропатогенности бактерий: роль в патогенезе и значение в диагностике пиелонефрита. Нефрология и диализ. 2001;3(4): 469–75. Bukharin O.V., Gritsenko V.A., Vyalkova A.A. Factors of uropathogenicity of bacteria: role in pathogenesis and significance in the diagnosis of pyelonephritis. Nephrology and Dialysis. 2001;3(4):469–75. EDN: https://elibrary.ru/wjcffv
- Ali I., Rafaque Z., Ahmed I., et al. Phylogeny, sequence-typing and virulence profile of uropathogenic Escherichia coli (UPEC) strains from Pakistan. BMC Infect. Dis. 2019;19(1):620. DOI: https://doi.org/10.1186/s12879-019-4258-y
- European Association of Urology. Guidelines on urological infection; 2018. Available at: https://uroweb.org/wp-content/uploads/EAU-Guidelines-on-Urological-Infections-2018-large-text.pdf
- Кузнецова М.В., Гизатуллина Ю.С. Генетические профили адгезии и адгезивная вариабельность уропатогенных штаммов Escherichia coli. Инфекция и иммунитет. 2021;11(3):481–90. Kuznetsova M.V., Gizatullina J.S. Genetic adhesion profiles and adhesive variability of uropathogenic Escherichia coli strains. Russian Journal of Infection and Immunity. 2021;11(3):481–90. DOI: https://doi.org/10.15789/2220-7619-GAP-1413 EDN: https://elibrary.ru/edkmlc
- Hancock S.J., Lo A.W., Ve T., et al. Ucl fimbriae regulation and glycan receptor specificity contribute to gut colonisation by extra-intestinal pathogenic Escherichia coli. PLoS Pathog. 2022;18(6):e1010582. DOI: https://doi.org/10.1371/journal.ppat.1010582
- Etefia E.U., Ben S.A. Virulence markers, phylogenetic evolution, and molecular techniques of uropathogenic Escherichia coli. J. Nat. Sci. Med. 2020;3(1):13–22. DOI: https://doi.org/10.4103/JNSM.JNSM_31_19
- Захарова И.Н., Османов И.М., Мачнева Е.Б. и др. От бактериурии до микробиома мочевых путей: эволюция взглядов ученых и клиницистов. Медицинский совет. 2018;(17):168–77. Zakharova I.N., Osmanov I.M., Machneva E.В., et al. From bacteriuria to the urinary tract microbiome: the evolution of the views of researchers and clinicians. Medical Council. 2018;(17):168–77. DOI: https://doi.org/10.21518/2079-701X-2018-17-168-176 EDN: https://elibrary.ru/ylhwzv
- Sarowska J., Futoma-Koloch B., Jama-Kmiecik A., et al. Virulence factors, prevalence and potential transmission of extraintestinal pathogenic Escherichia coli isolated from different sources: recent reports. Gut Pathog. 2019;11:10. DOI: https://doi.org/10.1186/s13099-019-0290-0
- Meza-Segura M., Zaidi M.B., Maldonado-Puga S., et al. Cytolethal distending toxin-producing Escherichia coli strains causing severe diarrhoea in young Mexican children. JMM Case Rep. 2017;4(2):e005079. DOI: https://doi.org/10.1099/jmmcr.0.005079
- Starčič Erjavec M., Žgur-Bertok D. Virulence potential for extraintestinal infections among commensal Escherichia coli isolated from healthy humans – the Trojan horse within our gut. FEMS Microbiol. Lett. 2015;362(5):fnu061. DOI: https://doi.org/10.1093/femsle/fnu061
- Banerjee R., Weisenhorn E., Schwartz K.J., et al. Tailoring a global iron regulon to a uropathogen. mBio. 2020;11(2):e00351-20. DOI: https://doi.org/10.1128/mbio.00351-20
- Камалов А.А., Ходырева Л.А., Дударева А.А., Низов А.Н. Факторы риска развития инфекционно-воспалительного процесса нижних мочевых путей. Вестник дерматологии и венерологии. 2015;91(2):63–7. Kamalov A.A., Khodyreva L.A., Dudareva A.A., Nizov A.N. Risk factors causing the development of infection and inflammation of the lower urinary tract. Bulletin of Dermatology and Venereology. 2015;91(2):63–7. DOI: https://doi.org/10.25208/0042-4609-2015-91-2-63-67 EDN: https://elibrary.ru/tyjeip
- Abe C.M., Salvador F.A., Falsetti I.N., et al. Uropathogenic Escherichia coli (UPEC) strains may carry virulence properties of diarrhoeagenic E. coli. FEMS Immunol. Med. Microbiol. 2008;52(3):397–406. DOI: https://doi.org/10.1111/j.1574-695x.2008.00388.x
- Daga A.P., Koga V.L., Soncini J.G.M., et al. Escherichia coli bloodstream infections in patients at a University Hospital: virulence factors and clinical characteristics. Front. Cell. Infect. Microbiol. 2019;9:191. DOI: https://doi.org/10.3389/fcimb.2019.00191.
- Nojoomi F., Ghasemian A. The relation of phylogroups, serogroups, virulence factors and resistance pattern of Escherichia coli isolated from children with septicemia. New Microbes New Infect. 2019;29:100517. DOI: https://doi.org/10.1016/j.nmni.2019.100517
- Clermont O., Bonacorsi S., Bingen E. Rapid and simple determination of the Escherichia coli phylogenetic group. Appl. Environ. Microbiol. 2000;66(10):4555–8. DOI: https://doi.org/10.1128/aem.66.10.4555-4558.2000
- Johnson J.R., Russo T.A. Molecular epidemiology of extraintestinal pathogenic Escherichia coli. EcoSal Plus. 2018;8(1). DOI: https://doi.org/10.1128/ecosalplus.esp-0004-2017
- Russo T.A., Johnson J.R. Medical and economic impact of extraintestinal infections due to Escherichia coli: focus on an increasingly important endemic problem. Microbes Infect. 2003;5(5): 449–56. DOI: https://doi.org/10.1016/s1286-4579(03)00049-2
- Hernández-Chiñas U., Ahumada-Cota R.E., Navarro-Ocaña A., et al. Phenotypic and genotypic characteristics of Escherichia coli strains isolated during a longitudinal follow-up study of chronic urinary tract infections. Front. Public Health. 2023;11:1240392. DOI: https://doi.org/10.3389/fpubh.2023.1240392
- Казанцев А.В., Осина Н.А., Глинская Т.О. и др. Факторы вирулентности и филогенетическая характеристика уропатогенных штаммов Eschericihia coli, выделенных на территории г. Саратова. Проблемы особо опасных инфекций. 2019;(4):56–60. Kazantsev A.V., Osina N.A., Glinskaya T.O., et al. Virulence factors and phylogenetic characteristics of uropathogenic Eschericihia coli strains isolated in Saratov. Problems of Particularly Dangerous Infections. 2019;(4):56–60. DOI: https://doi.org/10.21055/0370-1069-2019-4-56-60 EDN: https://elibrary.ru/gplihe
- Слукин П.В., Асташкин Е.И., Асланян Е.М. и др. Характеристика вирулентных штаммов Escherichia coli, выделенных от пациентов с урологической инфекцией. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(6):671–84. Slukin P.V., Astashkin E.I., Aslanyan E.M., et al. Characterization of virulent Escherichia coli strains isolated from patients with urological infection. Journal of Microbiology, Epidemiology and Immunobiology. 2021;98(6):671–84. DOI: https://doi.org/10.36233/0372-9311-134 EDN: https://elibrary.ru/rquaau
- Whelan S., Lucey B., Finn K. Uropathogenic Escherichia coli (UPEC)-associated urinary tract infections: the molecular basis for challenges to effective treatment. Microorganisms. 2023;11(9):2169. DOI: https://doi.org/10.3390/microorganisms11092169
- Zhu N., Liu W., Prakash A., et al. Targeting E. coli invasion of the blood-brain barrier for investigating the pathogenesis and therapeutic development of E. coli meningitis. Cell Microbiol. 2020;22(10):e13231. DOI: https://doi.org/10.1111/cmi.13231
- Rudd K.E., Johnson S.C., Agesa K.M., et al. Global, regional, and national sepsis incidence and mortality, 1990–2017: analysis for the Global Burden of Disease Study. Lancet. 2020;395(10219):200–11. DOI: https://doi.org/10.1016/s0140-6736(19)32989-7
- Багирова Н.С. Бактериемия истинная или ложная: значение критериев оценки клинической значимости положительной гемокультуры. Клиническая лабораторная диагностика. 2015;60(8):55–61. Bagirova N.S. The true or false bacteriemia: the significance of evaluation criteria of clinical significance of positive hemoculture. Clinical Laboratory Diagnostics. 2015;60(8):55–61. EDN: https://elibrary.ru/uiqjnx
- Мельников В.Л., Митрофанова Н.Н., Суменкова А.О., Терина Н.А. Гнойно-септические осложнения в урологическом отделении стационара (обзор литературы). Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2019;(3):39–53. Mel'nikov V.L., Mitrofanova N.N., Sumenkova A.O., Terina N.A. Purulent-septic complications in the urology unit (literature review). University Proceedings. Volga Region. Medical Sciences. 2019;(3):39–53. DOI: https://doi.org/10.21685/2072-3032-2019-3-4 EDN: https://elibrary.ru/wkgtvt
- Годовалов А.П., Николаева Н.В., Карпунина Т.И., Оборин Д.А. К оценке этиологической значимости бактерий, детектированных в генитальном тракте мужчин. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(4): 428–35. Godovalov A.P., Nikolaeva N.V., Karpunina T.I., Oborin D.A. On the assessment of the etiological significance of bacteria detected in the male genital tract. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(4):428–35. DOI: https://doi.org/10.36233/0372-9311-257 EDN: https://elibrary.ru/npmvrq
Дополнительные файлы