Однократная интраназальная иммунизация аттенуированным Ухань-подобным SARS-CoV-2 обеспечивает высокоэффективную перекрёстную защиту от заражения вариантами Delta и Omicron
- Авторы: Файзулоев Е.Б.1,2, Грачева А.В.1, Корчевая Е.Р.1, Аммур Ю.И.1, Смирнова Д.И.1, Хохлова Д.М.1, Дроков А.О.3, Панкратов А.А.4, Трунова Г.В.4, Хохлова В.А.4, Воронцова М.С.4, Ленева И.А.1, Свитич О.А.1,3, Зверев В.В.1,3
-
Учреждения:
- Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
- Российская медицинская академия непрерывного профессионального образования
- Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
- Московский научно-исследовательский онкологический институт имени П.А. Герцена
- Выпуск: Том 101, № 1 (2024)
- Страницы: 36-51
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18552
- DOI: https://doi.org/10.36233/0372-9311-496
- EDN: https://elibrary.ru/zqbojh
- ID: 18552
Цитировать
Аннотация
Введение. Несмотря на окончание пандемии COVID-19, проблема вакцинопрофилактики этого заболевания сохраняет актуальность. Появление и широкое распространение варианта SARS-CoV-2 Omicron и его сублиний привело к резкому снижению эффективности вакцинопрофилактики COVID-19. Возможным подходом к решению этой проблемы является разработка назальной живой аттенуированной вакцины, способной активировать гуморальный, мукозальный и клеточно-опосредованный иммунитет, обеспечивая стойкий иммунный ответ и перекрёстную защиту от различных антигенных вариантов вируса.
Целью исследования была оценка эффективности иммунизации аттенуированным холодоадаптированным Ухань-подобным штаммом SARS-CoV-2 D-D2 при гомологичном и гетерологичном заражении.
Материалы и методы. Исследование проведено на животной модели коронавирусной пневмонии на основе золотистых сирийских хомячков. Эффективность иммунизации оценивали путём сравнения динамики веса, вирусной нагрузки в органах и гистопатологических изменений лёгких у иммунизированных и неиммунизированных животных.
Результаты. Однократная интраназальная иммунизация золотистых сирийских хомячков штаммом D-D2 показала его высокую иммуногенность: сероконверсия проявилась у всех иммунизированных животных. Аттенуированный Ухань-подобный штамм D-D2 обеспечивал высокоэффективную защиту хомячков от развития продуктивной инфекции и пневмонии при заражении как родительским вирусом, так и гетерологичными штаммами, относящимися к вариантам Delta (AY.122) и Omicron (сублинии BA.1.1 и BA.5.2).
Заключение. Аттенуация SARS-CoV-2 является перспективной стратегией для разработки высокоэффективной назальной живой вакцины против COVID-19.
Полный текст
Введение
Несмотря на объявленное ВОЗ завершение пандемии COVID-19, проблема вакцинопрофилактики этого заболевания остаётся актуальной. Для специфической профилактики COVID-19 применяются инактивированные, векторные, субъединичные, мРНК-вакцины, которые показали высокую эффективность против гомологичного заражения (т.е. заражения вариантом вируса, на основе которого разработана вакцина) [1]. Появление и широкое распространение варианта Omicron и его сублиний резко снизило эффективность вакцинопрофилактики [1–3]. Это связано с тем, что активность большинства лицензированных вакцин против COVID-19 направлена на формирование гуморального иммунитета, обусловленного индукцией нейтрализующих антител к S-белку SARS-CoV-2. Однако эволюция вируса и возникающее при массовой иммунизации давление делают данную мишень очень изменчивой, что приводит к ускользанию вируса от иммунологического надзора и быстрому снижению эффективности вакцин против возникающих новых вариантов SARS-CoV-2 [2–4].
Для поддержания эффективности вакцинации на высоком уровне необходимо своевременно оптимизировать состав существующих вакцин в соответствии с актуальным набором циркулирующих вариантов SARS-CoV-2 [5]. Альтернативным подходом к решению проблемы было бы создание «универсальной» вакцины, обладающей перекрёстной протективной активностью в отношении разных антигенных вариантов вируса. Такой подход включает разработку живой аттенуированной вакцины (ЖАВ), способной активировать не только гуморальное, но и клеточное звено иммунитета, обеспечивая стойкий иммунный ответ и перекрёстную защиту от разных геновариантов вируса [6–8]. В настоящее время потенциал ЖАВ в профилактике COVID-19 остаётся нереализованным.
Вместе с тем к настоящему моменту yже накоплен определённый опыт получения аттенуированных штаммов SARS-CoV-2, показавших высокую иммуногенность и эффективность иммунизации на животных моделях инфекции. Одни авторы для аттенуации вируса используют методы генной инженерии и обратной генетики, такие как сайт-направленный мутагенез и деоптимизация кодонов [9–13]. Другие используют традиционный подход, направленный на получение мутантов вируса путём длительного пассирования в культуре клеток в селективных условиях [14–17]. Независимо от методологии, применяемой для аттенуации вируса, важным вопросом, который определяет практическую значимость ЖАВ на настоящем этапе, является: сможет ли она обеспечить эффективную защиту не только при заражении «родительским» штаммом SARS-CoV-2, но и новыми, филогенетически отдалёнными вариантами вируса?
Ранее путём длительного пассирования Ухань-подобного штамма SARS-CoV-2 Dubrovka (D) в клетках Vero при пониженной температуре мы получили его холодоадаптированный (ca) вариант, названный штаммом D-D2 [18]. Штамм D-D2 проявлял температурочувствительный (ts) фенотип (не размножался при 39ºC), что определяло его сниженную репродуктивную способность в лёгких и аттенуационный (att) фенотип для золотистых сирийских хомячков. При интраназальной иммунизации хомячков штамм D-D2 проявлял высокую иммуногенность и защищал от заражения гомологичным родительским штаммом D и развития пневмонии [15].
Целью настоящего исследования было определение защитной эффективности иммунизации аттенуированным Ухань-подобным штаммом SARS-CoV-2 при гетерологичном заражении штаммами, которые относятся к варианту Delta, и двум сублиниям варианта Omicron — BA.1.1 и BA.5.2. Для иммунизации в качестве модельного вакцинного штамма использовали ca/ts/att штамм D-D2.
Материалы и методы
Вирусы
Для моделирования коронавирусной пневмонии на золотистых сирийских хомячках (далее — хомячки) использованы лабораторные штаммы SARS-CoV-2 (семейство: Coronaviridae, род: Betacoronavirus, подрод: Sarbecovirus, вид: Severe acute respiratory syndrome-related coronavirus): Dubrovka (Wuhan-подобный), Podolsk (Delta); Otradnoe (Omicron BA.1.1), FEB2 (Omicron BA.5.2), изолированные и генетически охарактеризованные в НИИВС им. И.И. Мечникова в разные периоды пандемии (табл. 1). Для иммунизации животных использован холодоадаптированный штамм D-D2, обладающий ts и att фенотипом, полученный нами ранее путём адаптации штамма Dubrovka к росту в культуре клеток Vero CCL-81 при пониженной температуре (23ºC) [18].
Таблица 1. Штаммы SARS-CoV-2, использованные в исследовании
Table 1. SARS-CoV-2 strains used in the study
Штамм Strain | Дата получения Collection date | GenBank ID | Вариант Variant | Линия по Pangolin Pangolin lineage | Пассаж Passage level | Температура культивирования, ºC Cultivation temperature, ºC |
Dubrovka | Июнь 2020 June 2020 | MW514307.1 | Wuhan-like (дикий | wild-type) | B.1.1.317 | 17 | 37 |
D-D2 | Июнь 2020 June 2020 | ON040961.1 | Wuhan-like (холодоадаптированный | cold-adapted) | B.1.1.317 | 47 | 23 |
Podolsk | Август 2021 August 2021 | ON032860.1 | Delta | AY.122 | 16 | 37 |
Otradnoe | Январь 2022 January 2022 | ON032857.1 | Omicron | BA.1.1 | 8 | 37 |
FEB2 | Октябрь 2022 October 2022 | OP920753.1 | Omicron | BA.5.2 | 4 | 37 |
Культивирование клеток и вируса
Лабораторные штаммы SARS-CoV-2 культивировали на клетках эпителия почек африканской зелёной обезьяны Vero CCL-81 (ATCC), как описано ранее [19]. Монослой клеток Vero инфицировали SARS-CoV-2 при низкой множественности заражения (MOI ≤ 0,001) и инкубировали при температуре 37ºC (штаммы Dubrovka, Podolsk, Otradnoe и FEB2) или 23ºC (штамм D-D2) в течение 3–8 дней (в зависимости от штамма вируса) в атмосфере 5% CO2. Вируссодержащую культуральную среду осветляли центрифугированием и хранили при температуре –80ºC до использования.
Животные
Четырёхнедельные самки золотистых сирийских хомячков массой 40–50 г (Mesocricetus auratus) были получены из питомника лабораторных животных Филиала ИБХ РАН в г. Пущино (Московская обл.). Хомячки были случайным образом распределены по группам. Содержание животных соответствовало правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник. Кормили животных брикетированными кормами в соответствии с утверждёнными нормами.
При проведении экспериментального исследования на животных авторы соблюдали институциональные и национальные стандарты по использованию лабораторных животных. Проведение исследования одобрено Этическим комитетом ФГБНУ НИИВС им. И.И. Мечникова (протокол № 2 от 24.05.2021).
Титрование вируса
Титр SARS-CoV-2 определяли по конечной точке проявления цитопатического действия в культуре клеток Vero, как описано ранее [19]. Титр вируса рассчитывали методом Reed–Muench, используя онлайн-калькулятор1, и выражали в lg ТЦД50 (тканевая цитопатогенная доза, вызывающая гибель 50% клеток монослоя) на 1 мл.
Количественное определение РНК SARS-CoV-2
Количественное определение РНК SARS-CoV-2 проводили методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ОТ-ПЦР-РВ) [20]. Вирусную РНК выделяли из образцов с использованием набора реагентов «MagnoPrime UNI» («NextBio»), рекомендованного производителем для выделения вирусной РНК из широкого спектра биологических и клинических образцов. Для обнаружения вирусной РНК использовали праймеры и зонд, направленные к гену N нуклеокапсида SARS-CoV-2: CoVN-F GCGTTCTTCGGAATGTCG; COVN-R TTGGATCTTTGTCATCCAATTTG; COVN-P FAM-AACGTGGTTGACCTACACAGGT-BHQ1 [21]. Для проведения одноэтапной реакции ОТ-ПЦР-РВ использовали 2,5-кратную реакционную смесь для ПЦР-РВ с Taq ДНК-полимеразой и обратную транскриптазу MMLV («Синтол»). Реакционная смесь объёмом 50 мкл содержала 5 ед. Taq ДНК-полимеразы, 30 ед. обратной транскриптазы MMLV, по 10 пмоль каждого праймера и 5 пмоль зонда. Температурно-временной режим: 45ºC — 10 мин (1 цикл); 95ºC — 5 мин (1 цикл); 95ºC — 5 с, 55ºC — 45 с (45 циклов). Для построения калибровочного графика использовали синтетический олигонуклеотид, соответствующий амплифицируемому фрагменту генома SARS-CoV-2: COVN-PC CAGCGTTCTTCGGAATGTCGCGCATTGGCATGGAAGTCACACCTTCGGGAACGTGGTTGACCTACACAGGTGCCATCAAATTGGATGACAAAGATCCAAA. Аналитическая чувствительность ОТ-ПЦР-РВ, установленная путём анализа 10-кратных разведений олигонуклеотида COVN-PC (модель кДНК SARS-CoV-2), составила 5 × 102 копий/мл. С поправкой на потери на этапах выделения РНК и обратной транскрипции чувствительность определения РНК SARS-CoV-2 оценена в 103 копий РНК/мл. График зависимости значений пороговых циклов от концентрации вирусной РНК описывался уравнением:
Y = 48,816 × 3,5348X,
где Y — это значение порогового цикла; X — концентрация вирусной РНК (lg копий/мл).
Результаты количественной ОТ-ПЦР-РВ выражали в копиях вирусной РНК на 1 мл гомогената ткани.
Оценка эффективности иммунизации
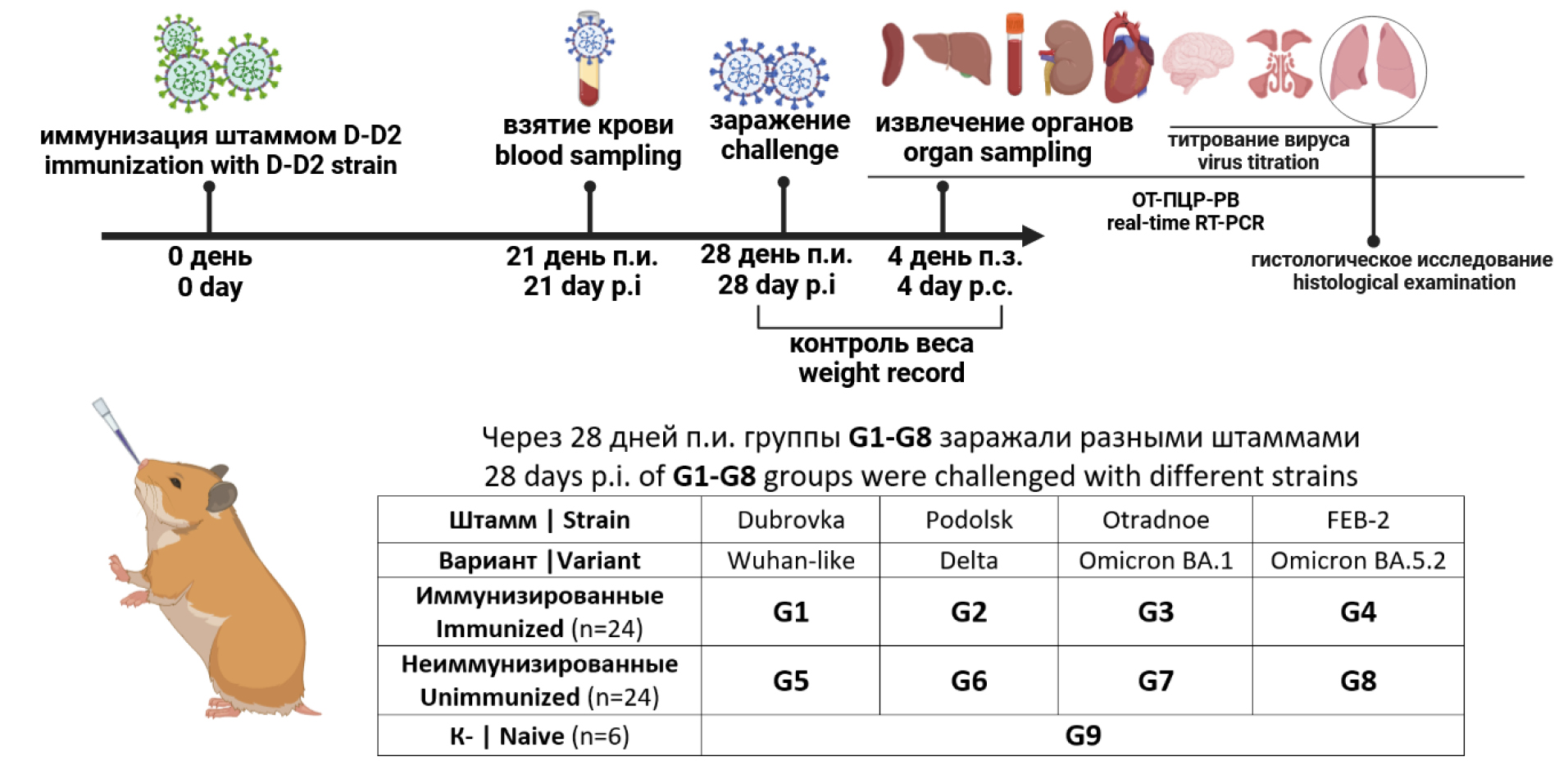
Эффективность иммунизации оценивали в соответствии со схемой (рис. 1). Сирийских хомячков разделили на 9 групп (G1–G9) по 6 животных в каждой. Каждому животному групп G1–G4 интраназально под лёгким эфирным наркозом вводили по 100 мкл штамма D-D2 в дозе 4,0 lg ТЦД50. Неиммунизированным животным групп G5–G9 интраназально вводили фосфатно-солевой буфер pH 7,2. Через 21 день после иммунизации (п.и.) у животных брали кровь для оценки суммарных и нейтрализующих антител к SARS-CoV-2. Для оценки эффективности иммунизации через 28 дней п.и. каждого животного из групп G1–G8 интраназально заражали вирулентным штаммом SARS-CoV-2 в дозе 4,0 lg ТЦД50. Группы G1 и G5 заражали родительским штаммом Dubrovka; группы G2 и G6 — штаммом Podolsk (Delta); группы G3 и G7 — штаммом Otradnoe (Omicron ВА.1.1); группы G4 и G8 — штаммом FEB2 (Omicron ВА.5.2). Группе отрицательного контроля (К–) G9 вводили эквивалентный объём фосфатно-солевого буфера.
Рис. 1. Схема эксперимента по оценке эффективности иммунизации.
Fig. 1. The design of the experiment for evaluating the immunization efficacy.
За хомячками проводили ежедневное наблюдение, контроль массы проводили с 0-го по 4-й день после заражения (п.з.). Через 4 дня п.з. животных гуманно умерщвляли под хлороформным наркозом. Левое лёгкое было взято для гистологического исследования. Лёгкие, головной мозг и другие органы извлекали, гомогенизировали в среде DMEM с гентамицином (40 мкг/мл) с использованием гомогенизатора «Tissue Lyser LT» («Qiagen») и центрифугировали при 10 000 об/мин в течение 5 мин при 4ºC. Надосадочную жидкость собирали и хранили при температуре –80ºC для последующего титрования и определения вирусной РНК. Эффективность иммунизации оценивали путём сравнения динамики массы, вирусной нагрузки в органах и гистопатологических изменений лёгких у иммунизированных и неиммунизированных животных.
Гистологическое исследование лёгких
Для морфологического исследования у хомячков проводили забор левых лёгких, которые фиксировали в 10% забуференном формалине в течение 24 ч. После фиксации органы заключали в гистомикс, изготавливали серийные срезы толщиной 3–5 мкм. На окрашенных гематоксилином и эозином гистологических срезах лёгких хомячков оценивали выраженность патоморфологических изменений и выражали её в баллах. Для этого каждому зашифрованному гистологическому препарату присваивали совокупный балл тяжести альтеративно-воспалительного процесса, рассчитанный путём сложения баллов (от 0 до 3) по критериям морфологической оценки, предложенным A.D. Gruber и соавт. [22]:
- доля (%) поражённой площади лёгких;
- характер распределения очагов пневмонии;
- повреждение эпителиальной выстилки бронхов и бронхиол;
- клеточный дебрис в просвете бронхов и бронхиол;
- бронхит;
- бронхоинтерстициальная пневмония;
- интерстициальная пневмония;
- диффузное повреждение альвеол (некроз альвеолоцитов, клеточный дебрис в просветах альвеол, интраальвеолярное кровоизлияние, интраальвеолярный отёк, интерстициальный отёк, воспалительный инфильтрат в межальвеолярных перегородках);
- внутриальвеолярные нейтрофилы и макрофаги;
- васкулит;
- некроз и десквамация клеток эндотелия сосудов;
- гиперплазия клеток мерцательного эпителия бронхов;
- гиперплазия альвеолоцитов II типа.
Максимально возможное количество баллов — 60. Проводили фотофиксацию полученных гистологических срезов.
Определение антител к SARS-CoV-2
Антитела к SARS-CoV-2 в сыворотках крови хомячков определяли методом иммуноферментного анализа (ИФА), как описано ранее [15]. Для постановки ИФА в 96-луночные планшеты сорбировали препарат SARS-CoV-2 штамма Dubrovka, инактивированного УФ-излучением, приготовленный, как описано ранее [20].
Реакция нейтрализации
Оценку нейтрализующих SARS-CoV-2 антител проводили в клетках Vero, как описано ранее [19]. Для определения нейтрализующей активности антител в отношении различных антигенных вариантов SARS-CoV-2 были использованы штаммы Dubrovka, Podolsk, Otradnoe и FEB2, адаптированные к росту в клетках Vero. Нейтрализующим титром считали величину, обратную последнему разведению, при котором в двух или более лунках не было обнаружено признаков цитопатического действия.
Статистический анализ
Статистическая обработка проводилась с использованием программного обеспечения «GraphPad Prism v. 5.03». Данные на графиках представлены в виде среднего ± стандартное отклонение (SD) или ± стандартная ошибка (SE). Достоверность разницы оценивали с использованием t-критерия для парных выборок. Различия считали значимыми при p < 0,05.
Требования к безопасности работ
Все работы с вирусом SARS-CoV-2 проводили в условиях, отвечающих требованиям безопасности работ с ПБА II группы патогенности.
Результаты
Оценку иммуногенности и эффективности аттенуированного штамма D-D2 (ca/ts мутанта штамма Dubrovka) проводили в эксперименте по иммунизации золотистых сирийских хомячков согласно схеме (рис. 1). Хомячков групп G1–G4 (n = 24) интраназально иммунизировали штаммом D-D2 в дозе по 4,0 lg ТЦД50 на голову.
Оценка иммуногенности
Через 21 день п.и. в сыворотках всех иммунизированных животных методом ИФА обнаруживались IgG к структурным белкам SARS-CoV-2 в титре от 12 800 до 204 800 (в среднем 54 933 ± 44 257) (рис. 2, а). Вируснейтрализующая активность сывороток хомячков после иммунизации штаммом D-D2 была максимальной для гомологичного штамма Dubrovka — 793 ± 524 (рис. 2, б). Для гетерологичных штаммов нейтрализующая активность сывороток была ниже: для штамма Podolsk (Delta) — в 4 раза, для штаммов Otradnoe и FEB2 (Omicron) — в 46 раз. В 56% образцов сывороток нейтрализующая активность в отношении штаммов Otradnoe и FEB2 не обнаружена. В сыворотках неиммунизированных животных (группы G5–G9; n = 30) антитела к вирусу не были обнаружены ни методом ИФА, ни в реакции нейтрализации.
Рис. 2. Иммуногенность штамма D-D2 для хомячков при однократной интраназальной иммунизации. а — титр IgG к SARS-CoV-2 в ИФА; б — титр нейтрализующих антител к различным штаммам SARS-CoV-2 в крови животных групп G1–G4 (n = 24) — Dubrovka (Wuhan), Podolsk (Delta), Otradnoe (BA.1.1), and FEB2 (BA.5.2). Предел чувствительности — 20. ***р < 0,001.
Fig. 2. Immunogenicity of the D-D2 strain in hamsters following single intranasal administration. Hamsters of G1–G4 groups were immunized with the D-D2 strain. a — titer of IgG antibody to SARS-CoV-2 proteins by ELISA; b — titers of neutralizing antibodies against different SARS-CoV-2 strains in the sera of all animals from groups G1–G4 (n = 24) — Dubrovka (Wuhan), Podolsk (Delta), Otradnoe (BA.1.1), and FEB2 (BA.5.2). The limit of detection was 20. ***p < 0.001.
Оценка эффективности иммунизации
Через 28 дней п.и. животных заражали разными штаммами SARS-CoV-2 (рис. 1). Заражение неиммунизированных сирийских хомячков (группы G5–G8) разными штаммами выявило различия в их вирулентности. Штамм Dubrovka проявил наибольшую вирулентность и приводил к потере массы в среднем на 14,6% (р = 0,0002) на 4-й день п.з. (рис. 3), наиболее тяжёлой пневмонии (рис. 4, 5), инфицированию не только дыхательных путей, но и головного мозга (рис. 6, 7), что сопровождалось снижением аппетита, вялостью и сонливостью. При заражении неиммунизированных животных штаммами Podolsk, Otradnoe и FEB2 потеря массы была незначительной (р > 0,05) — в среднем 2,15, 1,2 и 2,4% по сравнению с группой G9 (К–), при этом гистопатология лёгких и вирусная нагрузка в головном мозге были ниже, чем при заражении штаммом Dubrovka (рис. 4–7).
Рис. 3. Изменение массы иммунизированных и неиммунизированных хомячков на 1–4-й день п.з.
Fig. 3. Weight change of immunized and unimmunized hamsters at days 1–4 post-challenge.
Рис. 4. Морфологические изменения в лёгких хомячков на 4-й день после заражения разными штаммами SARS-CoV-2. Окрашивание гематоксилином и эозином. Размер масштабной линейки выражен в мкм.
Fig. 4. Morphological changes of hamster lungs on day 4 post-challenge with different SARS-CoV-2 strains. Hematoxylin and eosin staining. The size of the scale bar is expressed in microns.
Рис. 5. Оценка гистопатологии лёгких хомяков на 4-й день после заражения разными штаммами SARS-CoV-2. *р < 0,05; **р < 0,01; ***р < 0,001.
Fig. 5. Histopathology score for hamster lungs on day 4 post-challenge with different SARS-CoV-2 strains. *р < 0.05; **р < 0.01; ***р < 0.001.
Рис. 6. Титр вируса в лёгких, носовых ходах и головном мозге иммунизированных и неиммунизированных хомячков. Предел чувствительности — 2,0 lg ТЦД50/мл.
Fig. 6. Virus titer in lungs, nasal passages, and brain of immunized and unimmunized hamsters. The limit of detection was 2.0 log10 TCID50/mL.
Рис. 7. Концентрация вирусной РНК в органах иммунизированных и неиммунизированных хомячков через 4 дня п.з. a — лёгкие, носовые ходы, кровь и головной мозг; б — печень, сердце, почки и селезёнка. Предел обнаружения — 3,0 lg копий РНК/мл. *р < 0,05; **р < 0,01; ***р < 0,001.
Fig. 7. Concentration of viral RNA in organs of immunized and unimmunized hamsters on 4 days post-challenge. a — lungs, nasal passages, blood, and brain; b — liver, heart, kidneys and spleen. The limit of detection was 3.0 log10 RNA copies/mL. *p < 0.05; **p < 0.01; ***p < 0.001.
У всех иммунизированных хомячков не наблюдалось задержки в наборе массы и изменений в поведении по сравнению с неиммунизированными животными (рис. 3). Среди иммунизированных животных (группы G1–G4) наиболее выраженная защита от потери массы наблюдалась в группе G1, заражённой штаммом Dubrovka, — 12,7% (р < 0,0001) на 4-й день п.и. При заражении штаммами Podolsk (группа G2) и FEB2 (группа G4) разница в массе иммунизированных и неиммунизированных животных была незначительной (р > 0,05), достигнув 2,61 и 2,48% на 4-й день п.з. соответственно. При заражении штаммом Otradnoe (группа G3) разница в массе иммунизированных и неиммунизированных животных была слабо выраженной, но достоверной (р = 0,02) — 2,45% на 3-й и 4-й дни п.з.
Морфологическая картина воспалительных изменений в лёгких у заражённых неиммунизированных хомячков (группы G5–G9) соответствовала интерстициальной пневмонии, но выраженность и распространённость поражений зависела от штамма (рис. 4). На 4-е сутки после заражения Ухань-подобным штаммом Dubrovka (группа G5) в гистологических препаратах лёгких животных наблюдали выраженные альтеративно-воспалительные изменения, которые по морфологической картине соответствовали интерстициальной пневмонии в вирусной стадии. Участки пневмонии занимали 50–90% площади гистологического среза органа, что позволило охарактеризовать степень распространённости воспалительного процесса в лёгких хомячков как субтотальную. В гистопрепаратах хомячков группы G6, заражённых штаммом Podolsk (Delta), очаги интерстициальной пневмонии занимали 15–50% площади среза органа. Морфологическая характеристика лёгких хомячков групп G7 и G8, заражённых штаммами Otradnoe (Omicron BA 1.15) и FEB-2 (Omicron BA 5.2), сильно отличалась, несмотря на филогенетическую близость этих штаммов. После заражения штаммом Otradnoe в гистопрепаратах выявлены очаги интерстициальной пневмонии, которые занимали не более 5–7% площади среза органа. Напротив, при заражении штаммом FEB-2 очаги пневмонии занимали 40–60% площади среза органа, а морфологическая картина воспалительных изменений была схожей с таковой у хомячков, заражённых штаммом Dubrovka (рис. 4).
Гистологическое исследование лёгких иммунизированных хомячков (группы G1–G4) через 4 дня п.з. не выявило патоморфологических изменений, либо воспалительные изменения были слабо выраженными (рис. 4). В гистопрепаратах лёгких хомячков, иммунизированных и заражённых штаммами Dubrovka (группа G1) и Podolsk (группа G2), патоморфологические изменения не установлены. Гистологическое строение воздухоносных путей и респираторного отдела лёгкого соответствовало варианту нормы. В гистопрепаратах лёгкого иммунизированных хомячков, заражённых штаммами Otradnoe (группа G3) и FEB-2 (группа G4), выявлены очаговые слабо выраженные воспалительные изменения в бронхах, при этом гистоструктура остальных элементов лёгкого хомячков не отличалась от таковой у животных отрицательного контроля (группа G9).
При гистологическом исследовании в препаратах лёгких неиммунизированных незаражённых хомячков (группа G9) патологических изменений не выявлено (рис. 4).
Таким образом, гистологическое исследование лёгких показало, что иммунизация штаммом D-D2 защищает животных от развития вирусной пневмонии независимо от штамма SARS-CoV-2, использованного для заражения.
На основании гистологического исследования степень патологических изменений в лёгких животных групп G1–G9 была выражена в баллах по A.D. Gruber и соавт. [22] (рис. 5). У иммунизированных животных (группы G1–G4) совокупный балл тяжести варьировал в среднем от 3,2 до 6,9 балла, в то время как у неиммунизированных животных (группы G5–G9) — от 20,8 до 49,8. Иммунизация хомячков штаммом D-D2 снижала совокупный балл тяжести при заражении штаммом Dubrovka в 15,7 раза (р < 0,01), Podolsk — в 8,4 раза (р < 0,01), Otradnoe — в 4,0 раза (р < 0,01), FEB2 — в 5,7 раза (р < 0,01). В то же время иммунизированные животные, заражённые Omicron-подобными штаммами Otradnoe и FEB2, имели значительно более высокие показатели гистопатологии лёгких (5,2 ± 1,5 и 6,9 ± 0,9 балла соответственно) по сравнению с хомячками, заражёнными родительским штаммом Dubrovka (3,2 ± 0,1 балла).
Однократная интраназальная иммунизация штаммом D-D2 защищала хомячков от развития продуктивной инфекции при заражении всеми штаммами SARS-CoV-2, о чём свидетельствует отсутствие инфекционного вируса в лёгких, носовых ходах и головном мозге всех животных групп G1–G4 (рис. 6). У всех неиммунизированных животных (группы G5–G8) развилась продуктивная инфекция, что проявлялось выделением вируса из лёгких и носовых ходов (рис. 6). Средние значения титра вируса в лёгких неиммунизированных животных варьировали от 4,57 до 7,28 lg ТЦД50/мл, а в носовых ходах — от 4,78 до 6,74 lg ТЦД50/мл. В образцах головного мозга всех неиммунизированных хомячков группы G5, заражённых штаммом Dubrovka, обнаружен инфекционный вирус. Напротив, в образцах головного мозга животных из других групп инфекционный вирус не идентифицирован.
В лёгких, головном мозге, сердце, печени, почках, селезёнке и крови иммунизированных животных (группы G1–G4) вирусная РНК не была обнаружена у подавляющего большинства особей, за исключением отдельных хомячков, у которых РНК была обнаружена на пределе чувствительности метода. В носовых ходах иммунизированных животных содержание вирусной РНК было низким — в среднем 4,7–5,8 lg копий РНК/мл (рис. 7). Разница в содержании вирусной РНК в носовых ходах между группами иммунизированных и неиммунизированных хомячков варьировала в зависимости от штамма, использованного для заражения, от 2,9 до 5,5 lg: штамм Dubrovka — 3,7 lg (р < 0,001), Podolsk — 4,5 lg (р < 0,05), Otradnoe — 2,9 lg (р < 0,05) и FEB2 — 3,2 lg (р < 0,05).
В лёгких неиммунизированных животных (группы G5–G9) концентрация вирусной РНК варьировала в среднем от 7,60 до 9,25 lg, в носовых ходах — от 8,22 до 9,34 lg, в головном мозге — от 3,76 до 7,46 lg копий РНК/мл гомогената. В сердце, печени, почках, селезёнке и крови большинства неиммунизированных животных вирусная РНК также была обнаружена, но на более низком уровне, чем в лёгких и носовых ходах (от 3,02 до 6,15 lg копий РНК/мл гомогената; рис. 7). Примечательно, что при заражении штаммом FEB2 вирусная РНК не была обнаружена в печени и селезёнке ни у одного животного.
Обсуждение
Наиболее выдающиеся достижения общественного здравоохранения связаны с массовым применением ЖАВ: глобальная ликвидация натуральной оспы, ликвидация полиомиелита в большинстве стран, многократное снижение заболеваемости корью, краснухой, эпидемическим паротитом, ротавирусным энтеритом и ветряной оспой. В связи с этим исследование потенциала ЖАВ в специфической профилактике COVID-19 представляется актуальным. В настоящей работе мы исследовали эффективность прототипа ЖАВ против COVID-19 (штамм D-D2) на золотистых сирийских хомячках при заражении как родительским, так и гетерологичными штаммами SARS-CoV-2.
Однократная интраназальная иммунизация сирийских хомячков ca/ts/att штаммом SARS-CoV-2 D-D2 показала его высокую иммуногенность — сероконверсия через 21 день п.и. наблюдалась у всех 24 иммунизированных животных (рис. 2, а). Титры антител к SARS-CoV-2 в сыворотках иммунизированных хомячков, измеренные методом ИФА с использованием в качестве иммуносорбента вирионов родительского штамма Dubrovka, составили в среднем 5 × 105. В то же время максимальной нейтрализующей активностью сыворотки обладали в отношении гомологичного Ухань-подобного штамма Dubrovka. Для гетерологичных штаммов, относящихся к вариантам Delta и Omicron, нейтрализующая активность была предсказуемо ниже или отсутствовала (рис. 2, б), что определяется изменениями антигенных свойств S-белка вируса в ходе эволюции и согласуется с результатами предыдущих исследований [2, 3, 15, 23, 24].
Несмотря на сниженную (или отсутствующую) нейтрализующую активность поствакцинальных антител против гетерологичных штаммов, иммунизация штаммом D-D2 защищала хомячков от заражения не только предковым штаммом Dubrovka, но и штаммами, принадлежащими к вариантам Delta и Omicron. Значительная защита от потери массы была продемонстрирована при заражении штаммом Dubrovka: на 4-й день п.з. иммунизированные животные прибавили в массе на 13% больше (р < 0,01), чем неиммунизированные (рис. 3). Гетерологичные штаммы Podolsk, Otradnoe и FEB2 проявили меньшую вирулентность для сирийских хомячков, что отразилось в незначительном снижении массы неиммунизированных животных. В связи с этим защита иммунизированных животных от потери массы при заражении штаммами Podolsk, Otradnoe и FEB2 была незначительной — на 2–4%.
Более информативными при оценке эффективности иммунизации были уровни вирусной репродукции в лёгких и других органах, а также выраженность воспалительных изменений в лёгких. Отсутствие инфекционного вируса в основных органах-мишенях (лёгких, носовых ходах и головном мозге) у иммунизированных животных (группы G1–G4) на 4-й день п.з. позволяет нам охарактеризовать сформировавшийся иммунитет к SARS-CoV-2 как «стерильный». Этот вывод подтверждается тем фактом, что у подавляющего большинства иммунизированных животных вирусная РНК в гомогенатах лёгких, головного мозга, крови и других органов была ниже предела чувствительности ОТ-ПЦР-РВ (рис. 7). Вирусная РНК была обнаружена в носовых ходах всех иммунизированных животных, при этом её концентрация была на 2,9–4,5 lg ниже, чем у неиммунизированных животных (рис. 7, а). В то же время в носовых ходах иммунизированных хомячков не обнаружено инфекционного вируса (рис. 6). Возможным объяснением этого является то, что заражение проводилось путём инокуляции вируса непосредственно в носовые ходы, следовательно, слизистая оболочка носа в первую очередь контактировала с вирусом и инфицировалась. В результате в клетках эпителия носа происходила ограниченная репликация вирусной РНК, но выделению инфекционного вируса, а также инфицированию лёгких и других органов препятствовали факторы приобретённого иммунитета.
Отсутствие репродукции вируса в лёгких иммунизированных животных согласуется с данными гистологии (рис. 4, 5). Слабо выраженные очаговые воспалительные изменения в бронхах, выявленные у иммунизированных хомячков, инфицированных гетерологичными штаммами Otradnoe и FEB2 (рис. 4, 5), вероятно, указывают на ограниченную репродукцию вируса в результате «ускользания» сублиний BA.1.1 и BA.5.2 варианта Omicron от адаптивного иммунитета, сформировавшегося после иммунизации Ухань-подобным штаммом. Таким образом, однократная интраназальная иммунизация сирийских хомячков штаммом D-D2 защищала животных от развития продуктивной инфекции и пневмонии не только при гомологичном, но и при гетерологичном заражении через 4 нед п.и.
Примечательно, что в сердце неиммунизированных животных, заражённых различными штаммами SARS-CoV-2, обнаружено значительное содержание вирусной РНК (до 6,0 lg копий РНК/мл в группе, заражённой Ухань-подобным вирусом, — рис. 7, б). Эти результаты согласуются с данными других исследований, в которых были обнаружены патологические изменения, вирусная РНК и инфекционный вирус в сердце сирийских хомячков, заражённых SARS-CoV-2 [25, 26]. Эти данные имеют особое значение в контексте того факта, что COVID-19 увеличивает риск развития миокардита у людей [27, 28], что, вероятно, связано с повышенной экспрессией рецептора ACE2 в миоцитах человека [29].
Генетическая стабильность штамма D-D2 и возможность реверсии его вирулентности не исследовались. Поэтому мы рассматриваем штамм D-D2 не в качестве кандидата для разработки ЖАВ против COVID-19, а как модельный вакцинный штамм для изучения поствакцинального иммунитета.
Массовая вакцинопрофилактика COVID-19 показала, что лицензированные вакцины обладают низкой эффективностью при заражении штаммами, относящимися к варианту Omicron. Они обеспечивали необходимый уровень защиты от тяжёлого течения COVID-19 и смерти в период доминирования варианта Omicron [30, 31]. Однако поствакцинальная защита от инфицирования и симптоматической инфекции Omicron-подобными штаммами составляла всего 40–50% даже для мРНК вакцин (заявленных как наиболее эффективные) в первые 3 мес после вакцинации, после чего быстро снижалась до 10–20% [30–33]. Бустерная иммунизация была способна восстановить эффективность до исходных значений, но продолжительность защиты на данном уровне не превышала 3-6 мес [31, 32, 34–36]. Лицензированные вакцины (инактивированные, векторные, рекомбинантные и мРНК-вакцины) преимущественно основаны на S-белке SARS-CoV-2 и стимулируют как гуморальный, так и клеточный иммунитет [37–39]; однако в большей степени их эффективность определяется индукцией нейтрализующих антител. Изменчивость S-белка и появление новых эпидемиологически значимых вариантов вируса (VOC) приводит к «ускользанию» вируса из-под иммунологического надзора и снижению эффективности таких вакцин [2, 3, 23, 24, 40]. Более того, продолжающаяся эволюция варианта Omicron привела к появлению таких его сублиний, которые «ускользают» от адаптивного иммунитета, индуцированного даже предыдущим заражением вирусами родительских сублиний Omicron. Так, вирусы сублинии BF.7, BQ.1 и XBB (которые появились после сублинии BA.4/5) «ускользают» от нейтрализации антителами, антителозависимой клеточной цитотоксичности и фагоцитоза, индуцированных «прорывной» инфекцией вируса сублинии BA.1 [41]. Кроме того, вирусы сублинии BF.7 и BQ.1 обладают высокой устойчивостью к нейтрализации панелью из 77 моноклональных антител, которые эффективно нейтрализуют Ухань-подобный вирус [42].
Более высокая эффективность ЖАВ с интраназальным введением основана на тех же механизмах, которые участвуют в развитии адаптивного иммунитета при естественной респираторной вирусной инфекции [37, 43, 44]. Сочетанная активация гуморального и клеточного звеньев системной и мукозальной (местной) иммунной защиты способна обеспечивать эффективную защиту от инфекции SARS-CoV-2 [8, 37, 45]. Кроме того, иммунный ответ на ЖАВ развивается против всех вирусных белков — как структурных, так и неструктурных, что повышает её эффективность. Так, структурные белки M и N обладают высокой иммуногенностью и, наряду с неструктурными белками, более консервативны, чем S-белок. Многие Т-клеточные эпитопы филогенетически родственных видов коронавирусов и различных вариантов SARS-CoV-2 локализованы не только в S-белке [46, 47]. Так, J. Zhao и соавт., используя мононуклеары периферической крови, выделенные от пациентов с COVID-19, идентифицировали 5 иммунодоминантных Т-клеточных эпитопов в N-белке SARS-CoV-2 [47]. Следует также отметить, что протективный иммунитет, опосредуемый Т-клетками, в меньшей степени зависит от мутаций, определяющих образование новых вариантов VOC SARS-CoV-2 [48, 49]. Действительно, появление новых вариантов VOC SARS-CoV-2 определяется главным образом мутациями в наиболее вариабельном S-белке, тогда как Т-клеточные эпитопы присутствуют не только в S-белке, но и в более консервативных вирусных белках.
В недавних исследованиях иммуногенность и эффективность аттенуированных штаммов SARS-CoV-2 были исследованы на животных моделях коронавирусной инфекции на основе золотистых сирийских хомячков (Mesocricetus auratus), хомячков Phodopus roborovskii и трансгенных мышах линии K18-hACE2. Обнаружено, что иммунизация восприимчивых животных аттенуированными штаммами SARS-CoV-2 обеспечивает высокоэффективную защиту от гомологичного заражения и развития пневмонии [9–17]. Однако потенциал перекрёстной протективной активности ЖАВ против гетерологичных вариантов вируса остаётся малоизученным. J. Trimpert и соавт. показали, что иммунизация аттенуированным SARS-CoV-2 приводит к развитию иммунитета у лабораторных животных при заражении не только родительским штаммом вируса, но и гетерологичными штаммами вариантов Alpha and Beta [50]. A. Yoshida и соавт. показали развитие перекрёстной защиты от заражения штаммом варианта Omicron (BA.1) у хомячков, иммунизированных рекомбинантным аттенуированным вирусом с геном S-белка варианта Omicron [13]. Наше исследование показало, что аттенуированный Ухань-подобный штамм SARS-CoV-2 способен обеспечить высокоэффективную защиту не только при гомологичном заражении, но и при заражении гетерологичными штаммами, относящимися к варианту Delta и сублиниям BA.1.1 и BA.5.2 варианта Omicron.
Перекрёстная защита, показанная в нашем исследовании, была предсказуемой, поскольку на момент проведения исследования было известно, что естественная SARS-CoV-2-инфекция предотвращает до 90% случаев повторного заражения вирусами вариантов Alpha, Beta и Delta и 56% случаев — вирусами варианта Omicron, тогда как большинство случаев повторного заражения происходит только через год после первичного заболевания [51]. Кроме того, защитная эффективность первичной инфекции против развития тяжёлого заболевания или смерти при повторном заражении Omicron-подобным вирусом составляет 97,3% (95% ДИ 94,9–98,6%), независимо от варианта вируса, вызвавшего первичную инфекцию [52]. Чрезвычайно низкий уровень тяжёлых и летальных случаев при повторном заражении указывает на то, что ЖАВ против COVID-19 потенциально способна обеспечить эффективную защиту от пневмонии и летального исхода, вызванных гетерологичными штаммами. Высокий потенциал ЖАВ для профилактики COVID-19 подтверждается наблюдением, что гибридный иммунитет (формируется при вакцинации с последующей «прорывной» инфекцией) и повторное заражение SARS-CoV-2 снижают риск последующего заражения, вызванного штаммами Omicron, на 60 и 85% соответственно [53]. Между тем «бустеризация» в результате «прорывной» инфекции Omicron-подобным вирусом индуцирует более высокие уровни В-клеток памяти и вирусспецифичных Т-клеток, особенно против штаммов Omicron, по сравнению с бустерной вакцинацией инактивированными или векторными вакцинами [54].
Примечательно, что практически все разработчики ЖАВ против COVID-19 демонстрируют эффективную защиту от заражения вирулентным штаммом при интраназальном способе введения [9–17]. В связи с этим показательным является успешное массовое применение таких «мукозальных» вакцин, как живая полиомиелитная и ротавирусная вакцины (пероральное введение) и живая гриппозная вакцина (интраназальное введение). Пероральное или интраназальное введение этих вакцин обеспечивает не только индукцию системного клеточного и гуморального адаптивного иммунного ответа, но и формирование мукозального (местного) иммунитета, включая секрецию специфических IgA-антител в слизистой оболочке дыхательных путей или кишечника. При интраназальной иммунизации с последующим заражением вирулентным штаммом специфические секреторные IgA-антитела нейтрализуют вирус непосредственно на слизистой оболочке дыхательных путей, являющейся «входными воротами» инфекции, подавляя его адгезивную способность и снижая эффективность трансмиссии [8, 55, 56].
Заключение
Результаты настоящего исследования показали, что однократная интраназальная иммунизация сирийских хомячков аттенуированным Ухань-подобным штаммом SARS-CoV-2 обеспечивает высокоэффективную защиту животных от развития продуктивной инфекции и пневмонии при заражении не только гомологичным вирусом, но и гетерологичными штаммами, относящимися к вариантам Delta (AY.122) и Omicron (сублинии BA.1 и BA.5.2). Таким образом, аттенуация SARS-CoV-2 является перспективной стратегией для разработки высокоэффективной назальной живой вакцины против COVID-19.
1 URL: https://www.virosin.org/tcid50/TCID50.html
Об авторах
Евгений Бахтиерович Файзулоев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Российская медицинская академия непрерывного профессионального образования
Email: faizuloev@mail.ru
ORCID iD: 0000-0001-7385-5083
к.б.н., зав. лаб. прикладной вирусологии НИИВС им. И.И. Мечникова, Москва, Россия; старший преподаватель кафедры вирусологии РМАНПО
Россия, Москва; МоскваАнастасия Вячеславовна Грачева
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: faizuloev@mail.ru
ORCID iD: 0000-0001-8428-4482
н.с. лаб. прикладной вирусологии НИИВС им. И.И. Мечникова
Россия, МоскваЕкатерина Романовна Корчевая
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: faizuloev@mail.ru
ORCID iD: 0000-0002-6417-3301
м.н.с. лаб. прикладной вирусологии НИИВС им. И.И. Мечникова
Россия, МоскваЮлия Игоревна Аммур
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: faizuloev@mail.ru
ORCID iD: 0000-0003-0223-5738
к.б.н., зав. лаб. онколитических вирусов НИИВС им. И.И. Мечникова
Россия, МоскваДарья Ильинична Смирнова
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: faizuloev@mail.ru
ORCID iD: 0000-0001-7325-0834
м.н.с. лаб. прикладной вирусологии НИИВС им. И.И. Мечникова
Россия, МоскваДарья Михайловна Хохлова
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: faizuloev@mail.ru
ORCID iD: 0009-0003-5745-7589
м.н.с. лаб. прикладной вирусологии НИИВС им. И.И. Мечникова
Россия, МоскваАндрей Олегович Дроков
Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: faizuloev@mail.ru
ORCID iD: 0009-0006-3300-8078
стажер лаб. прикладной вирусологии НИИВС им. И.И. Мечникова
Россия, МоскваАндрей Александрович Панкратов
Московский научно-исследовательский онкологический институт имени П.А. Герцена
Email: faizuloev@mail.ru
ORCID iD: 0000-0001-7291-9743
к.б.н., зав. отделением экспериментальной фармакологии и токсикологии МНИОИ им. П.А. Герцена
Россия, МоскваГалина Владимировна Трунова
Московский научно-исследовательский онкологический институт имени П.А. Герцена
Автор, ответственный за переписку.
Email: faizuloev@mail.ru
ORCID iD: 0000-0003-2917-4496
к.б.н., с.н.с. отделения экспериментальной фармакологии и токсикологии МНИОИ им. П.А. Герцена
Россия, МоскваВарвара Андреевна Хохлова
Московский научно-исследовательский онкологический институт имени П.А. Герцена
Email: faizuloev@mail.ru
ORCID iD: 0000-0002-0339-2068
м.н.с. отделения экспериментальной фармакологии и токсикологии МНИОИ им. П.А. Герцена
Россия, МоскваМария Сергеевна Воронцова
Московский научно-исследовательский онкологический институт имени П.А. Герцена
Email: faizuloev@mail.ru
ORCID iD: 0000-0002-9320-1746
к.б.н., м.н.с. отделения экспериментальной фармакологии и токсикологии МНИОИ им. П.А. Герцена
Россия, МоскваИрина Анатольевна Ленева
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова
Email: faizuloev@mail.ru
ORCID iD: 0000-0002-7755-2714
д.б.н., зав. лаб. экспериментальной вирусологии НИИВС им. И.И. Мечникова
Россия, МоскваОксана Анатольевна Свитич
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: faizuloev@mail.ru
ORCID iD: 0000-0003-1757-8389
д.м.н., профессор, член-корр. РАН, директор НИИВС им. И.И. Мечникова, Москва, Россия; профессор каф. микробиологии, вирусологии и иммунологии Медико-профилактического факультета Первого МГМУ им. И.М. Сеченова (Сеченовский Университет)
Россия, Москва; МоскваВиталий Васильевич Зверев
Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова; Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет)
Email: faizuloev@mail.ru
ORCID iD: 0000-0001-5808-2246
д.б.н., профессор, академик РАН, научный руководитель НИИВС им. И.И. Мечникова, Москва, Россия; Заведующий кафедрой микробиологии, вирусологии и иммунологии Медико-профилактического факультета Первого МГМУ им. И.М. Сеченова (Сеченовский Университет)
Россия, Москва; МоскваСписок литературы
- Feikin D.R., Higdon M.M., Abu-Raddad L.J., et al. Duration of effectiveness of vaccines against SARS-CoV-2 infection and COVID-19 disease: results of a systematic review and meta-regression. Lancet. 2022;399(10328):924–44. DOI: https://doi.org/10.1016/s0140-6736(22)00152-0
- Bowen J.E., Addetia A., Dang H.V., et al. Omicron spike function and neutralizing activity elicited by a comprehensive panel of vaccines. Science. 2022;377(6608):890–4. DOI: https://doi.org/10.1126/science.abq0203
- Dejnirattisai W., Huo J., Zhou D., et al. SARS-CoV-2 Omicron-B.1.1.529 leads to widespread escape from neutralizing antibody responses. Cell. 2022;185(3):467–84.e15. DOI: https://doi.org/10.1016/j.cell.2021.12.046
- Xiang T., Wang J., Zheng X. The humoral and cellular immune evasion of SARS-CoV-2 Omicron and sub-lineages. Virol. Sin. 2022;37(6):786–95. DOI: https://doi.org/10.1016/j.virs.2022.11.007
- Chalkias S., Harper C., Vrbicky K., et al. A bivalent omicron-containing booster vaccine against COVID-19. N. Engl. J. Med. 2022;387(14):1279–91. DOI: https://doi.org/10.1056/NEJMoa2208343
- Chen J.M. Should the world collaborate imminently to develop neglected live-attenuated vaccines for COVID-19? J. Med. Virol. 2022;94(1):82–7. DOI: https://doi.org/10.1002/jmv.27335
- Goławski M., Lewandowski P., Jabłońska I., Delijewski M. The reassessed potential of SARS-CoV-2 attenuation for COVID-19 vaccine development – a systematic review. Viruses. 2022;14(5):991. DOI: https://doi.org/10.3390/v14050991
- Nouailles G., Adler J.M., Pennitz P., et al. Live-attenuated vaccine sCPD9 elicits superior mucosal and systemic immunity to SARS-CoV-2 variants in hamsters. Nat. Microbiol. 2023;8(5):860–74. DOI: https://doi.org/10.1038/s41564-023-01352-8
- Liu S., Stauft C.B., Selvaraj P., et al. Intranasal delivery of a rationally attenuated SARS-CoV-2 is immunogenic and protective in Syrian hamsters. Nat. Commun. 2022;13(1):6792. DOI: https://doi.org/10.1038/s41467-022-34571-4
- Liu Y., Zhang X., Liu J., et al. A live-attenuated SARS-CoV-2 vaccine candidate with accessory protein deletions. Nat. Commun. 2022;13(1):4337. DOI: https://doi.org/10.1038/s41467-022-31930-z
- Trimpert J., Dietert K., Firsching T.C., et al. Development of safe and highly protective live-attenuated SARS-CoV-2 vaccine candidates by genome recoding. Cell Rep. 2021;36(5):109493. DOI: https://doi.org/10.1016/j.celrep.2021.109493
- Ye Z.W., Ong C.P., Tang K., et al. Intranasal administration of a single dose of a candidate live attenuated vaccine derived from an NSP16-deficient SARS-CoV-2 strain confers sterilizing immunity in animals. Cell. Mol. Immunol. 2022;19(5):588–601. DOI: https://doi.org/10.1038/s41423-022-00855-4
- Yoshida A., Okamura S., Torii S., et al. Versatile live-attenuated SARS-CoV-2 vaccine platform applicable to variants induces protective immunity. iScience. 2022;25(11):105412. DOI: https://doi.org/10.1016/j.isci.2022.105412
- Abdoli M., Shafaati M., Ghamsari L.K., Abdoli A. Intranasal administration of cold-adapted live-attenuated SARS-CoV-2 candidate vaccine confers protection against SARS-CoV-2. Virus Res. 2022;319:198857. DOI: https://doi.org/10.1016/j.virusres.2022.198857
- Faizuloev E., Gracheva A., Korchevaya E., et al. Cold-adapted SARS-CoV-2 variants with different temperature sensitivity exhibit an attenuated phenotype and confer protective immunity. Vaccine. 2023;41(4):892–902. DOI: https://doi.org/10.1016/j.vaccine.2022.12.019
- Seo S.H., Jang Y. Cold-adapted live attenuated SARS-CoV-2 vaccine completely protects human ACE2 transgenic mice from SARS-CoV-2 infection. Vaccines (Basel). 2020;8(4):584. DOI: https://doi.org/10.3390/vaccines8040584
- Xu J., Liu M., Niu X., et al. The cold-adapted, temperature-sensitive SARS-CoV-2 strain TS11 is attenuated in Syrian hamsters and a candidate attenuated vaccine. Viruses. 2022;15(1): 95. DOI: https://doi.org/10.3390/v15010095
- Файзулоев Е.Б., Корчевая Е.Р., Грачева А.В. и др. Биологическая характеристика холодоадаптированных вариантов коронавируса SARS-CoV-2. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022;99(4):397–409. Faizuloev E.B., Korchevaya E.R., Gracheva A.V., et al. Biological characterization of cold-adapted SARS-CoV-2 variants. Journal of Microbiology, Epidemiology and Immunobiology. 2022;99(4):397–409. DOI: https://doi.org/10.36233/0372-9311-280 EDN: https://elibrary.ru/llgegh
- Грачёва А.В., Корчевая Е.Р., Кудряшова А.М. и др. Адаптация МТТ-теста для определения нейтрализующих антител к вирусу SARS-CoV-2. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(3):253–65. Gracheva A.V., Korchevaya E.R., Kudryashova A.M., et al. Adaptation of the MTT assay for detection of neutralizing antibodies against the SARS-CoV-2 virus. Journal of Microbiology, Epidemiology and Immunobiology. 2021;98(3):253–65. DOI: https://doi.org/10.36233/0372-9311-136 EDN: https://elibrary.ru/jglovv
- Gracheva A.V., Korchevaya E.R., Ammour Y.I., et al. Immunogenic properties of SARS-CoV-2 inactivated by ultraviolet light. Arch. Virol. 2022;167(11):2181–91. DOI: https://doi.org/10.1007/s00705-022-05530-7
- Chan J.F.W., Yip C.C.Y., To K.K.W., et al. Improved molecular diagnosis of COVID-19 by the novel, highly sensitive and specific COVID-19-RdRp/Hel real-time reverse transcription-PCR assay validated in vitro and with clinical specimens. J. Clin. Microbiol. 2020;58(5):e00310-20. DOI: https://doi.org/10.1128/JCM.00310-20
- Gruber A.D., Osterrieder N., Bertzbach L.D., et al. Standardization of reporting criteria for lung pathology in SARS-CoV-2-infected hamsters: what matters? Am. J. Respir. Cell Mol. Biol. 2020;63(6):856–9. DOI: https://doi.org/10.1165/rcmb.2020-0280LE
- Aiano F., Ireland G., Baawuah F., et al. Antibody persistence after primary SARS-CoV-2 infection and protection against future variants including omicron in adolescents: national, prospective cohort study. Pediatr. Infect. Dis. J. 2023;42(6):496–502. DOI: https://doi.org/10.1097/inf.0000000000003890
- Wang Y., Ma Y., Xu Y., et al. Resistance of SARS-CoV-2 Omicron variant to convalescent and CoronaVac vaccine plasma. Emerg. Microbes Infect. 2022;11(1):424–7. DOI: https://doi.org/10.1080/22221751.2022.2027219
- Daems M., Liesenborghs L., Boudewijns R., et al. SARS-CoV-2 infection causes prolonged cardiomyocyte swelling and inhibition of HIF1α translocation in an animal model COVID-19. Front. Cardiovasc. Med. 2022;9:964512. DOI: https://doi.org/10.3389/fcvm.2022.964512
- Jones E.A.V. Mechanism of COVID-19-induced cardiac damage from patient, in vitro and animal studies. Curr. Heart Fail. Rep. 2023;20(5):451–60. DOI: https://doi.org/10.1007/s11897-023-00618-w
- Ishisaka Y., Watanabe A., Aikawa T., et al. Overview of SARS-CoV-2 infection and vaccine associated myocarditis compared to non-COVID-19-associated myocarditis: A systematic review and meta-analysis. Int. J. Cardiol. 2024;395:131401. DOI: https://doi.org/10.1016/j.ijcard.2023.131401
- Thaker R., Faraci J., Derti S., Schiavone J.F. Myocarditis in SARS-CoV-2: a meta-analysis. Cureus. 2023;15(10):e48059. DOI: https://doi.org/10.7759/cureus.48059
- Liu H., Gai S., Wang X., et al. Single-cell analysis of SARS-CoV-2 receptor ACE2 and spike protein priming expression of proteases in the human heart. Cardiovasc. Res. 2020;116(10):1733–41. DOI: https://doi.org/10.1093/cvr/cvaa191
- Menegale F., Manica M., Zardini A., et al. Evaluation of waning of SARS-CoV-2 vaccine-induced immunity: a systematic review and meta-analysis. JAMA Netw. Open. 2023;6(5):e2310650. DOI: https://doi.org/10.1001/jamanetworkopen.2023.10650
- Paul P., El-Naas A., Hamad O., et al. Effectiveness of the pre-Omicron COVID-19 vaccines against Omicron in reducing infection, hospitalization, severity, and mortality compared to Delta and other variants: A systematic review. Hum. Vaccin. Immunother. 2023;19(1):2167410. DOI: https://doi.org/10.1080/21645515.2023.2167410
- Amir O., Goldberg Y., Mandel M., et al. Protection against Omicron BA.1/BA.2 severe disease 0–7 months after BNT162b2 booster. Commun. Biol. 2023;6(1):315. DOI: https://doi.org/10.1038/s42003-023-04669-6
- Lau J.J., Cheng S.M.S., Leung K., et al. Real-world COVID-19 vaccine effectiveness against the Omicron BA.2 variant in a SARS-CoV-2 infection-naive population. Nat. Med. 2023;29(2):348–57. DOI: https://doi.org/10.1038/s41591-023-02219-5
- Chemaitelly H., Ayoub H.H., AlMukdad S., et al. Duration of mRNA vaccine protection against SARS-CoV-2 Omicron BA.1 and BA.2 subvariants in Qatar. Nat. Commun. 2022;13(1):3082. DOI: https://doi.org/10.1038/s41467-022-30895-3
- Espíndola O.M., Fuller T.L., de Araújo M.F., et al. Reduced ability to neutralize the Omicron variant among adults after infection and complete vaccination with BNT162b2, ChAdOx1, or CoronaVac and heterologous boosting. Sci. Rep. 2023;13(1):7437. DOI: https://doi.org/10.1038/s41598-023-34035-9
- Huiberts A.J., de Gier B., Hoeve C.E., et al. Vaccine effectiveness of primary and booster COVID-19 vaccinations against SARS-CoV-2 infection in the Netherlands from July 12, 2021 to June 6, 2022: A prospective cohort study. Int. J. Infect. Dis. 2023;133:36–42. DOI: https://doi.org/10.1016/j.ijid.2023.04.401
- Корчевая Е.Р., Грачева А.В., Дьяков И.Н. и др. Живые аттенуированные вакцины против COVID-19: подходы к разработке и перспективы клинического применения. Журнал микробиологии, эпидемиологии и иммунобиологии. 2023;100(3):225–36. Korchevaya E.R., Gracheva A.V., Dyakov I.N., et al. Live attenuated COVID-19 vaccines: approaches to development and prospects for clinical use. Journal of Microbiology, Epidemiology and Immunobiology. 2023;100(3):225–36. DOI: https://doi.org/10.36233/0372-9311-404 EDN: https://elibrary.ru/psdxzr
- Park H., Park M.S., Seok J.H., et al. Insights into the immune responses of SARS-CoV-2 in relation to COVID-19 vaccines. J. Microbiol. 2022;60(3):308–20. DOI: https://doi.org/10.1007/s12275-022-1598-x
- Rahman M.M., Masum M.H.U., Wajed S., Talukder A. A comprehensive review on COVID-19 vaccines: development, effectiveness, adverse effects, distribution and challenges. Virusdisease. 2022;33(1):1–22. DOI: https://doi.org/10.1007/s13337-022-00755-1
- Seidel A., Jacobsen E.M., Fabricius D., et al. Serum neutralizing capacity and T-cell response against the omicron BA.1 variant in seropositive children and their parents one year after SARS-CoV-2 infection. Front. Pediatr. 2023;11:1020865. DOI: https://doi.org/10.3389/fped.2023.1020865
- Guo L., Zhang Q., Zhong J., et al. Omicron BA.1 breakthrough infections in inactivated COVID-19 vaccine recipients induced distinct pattern of antibody and T cell responses to different Omicron sublineages. Emerg. Microbes Infect. 2023;12(1):2202263. DOI: https://doi.org/10.1080/22221751.2023.2202263
- Chen J., Yang J., Chang F., et al. Identification of broad neutralizing antibodies against Omicron subvariants from COVID-19 convalescents and vaccine recipients. Virol. Sin. 2023;38(2): 313–6. DOI: https://doi.org/10.1016/j.virs.2023.01.005
- Brown B., Ojha V., Fricke I., et al. Innate and adaptive immunity during SARS-CoV-2 infection: biomolecular cellular markers and mechanisms. Vaccines (Basel). 2023;11(2):408. DOI: https://doi.org/10.3390/vaccines11020408
- Shen J., Fan J., Zhao Y., et al. Innate and adaptive immunity to SARS-CoV-2 and predisposing factors. Front. Immunol. 2023; 14:1159326. DOI: https://doi.org/10.3389/fimmu.2023.1159326
- Miteva D., Peshevska-Sekulovska M., Snegarova V., et al. Mucosal COVID-19 vaccines: Risks, benefits and control of the pandemic. World J. Virol. 2022;11(5):221–36. DOI: https://doi.org/10.5501/wjv.v11.i5.221
- Mateus J., Grifoni A., Tarke A., et al. Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science. 2020;370(6512):89–94. DOI: https://doi.org/10.1126/science.abd3871
- Zhao J., Wang L., Schank M., et al. SARS-CoV-2 specific memory T cell epitopes identified in COVID-19-recovered subjects. Virus Res. 2021;304:198508. DOI: https://doi.org/10.1016/j.virusres.2021.198508
- Sette A., Crotty S. Adaptive immunity to SARS-CoV-2 and COVID-19. Cell. 2021;184(4):861–80. DOI: https://doi.org/10.1016/j.cell.2021.01.007
- Tarke A., Sidney J., Kidd C.K., et al. Comprehensive analysis of T cell immunodominance and immunoprevalence of SARS-CoV-2 epitopes in COVID-19 cases. Cell Rep. Med. 2021;2(2):100204. DOI: https://doi.org/10.1016/j.xcrm.2021.100204
- Trimpert J., Adler J.M., Eschke K., et al. Live attenuated virus vaccine protects against SARS-CoV-2 variants of concern B.1.1.7 (Alpha) and B.1.351 (Beta). Sci. Adv. 2021;7(49):eabk0172. DOI: https://doi.org/10.1126/sciadv.abk0172
- Altarawneh H.N., Chemaitelly H., Hasan M.R., et al. Protection against the Omicron variant from previous SARS-CoV-2 infection. N. Engl. J. Med. 2022;386(13):1288–90. DOI: https://doi.org/10.1056/nejmc2200133
- Chemaitelly H., Nagelkerke N., Ayoub H.H., et al. Duration of immune protection of SARS-CoV-2 natural infection against reinfection. J. Travel Med. 2022;29(8):taac109. DOI: https://doi.org/10.1093/jtm/taac109
- Sun K., Tempia S., Kleynhans J., et al. Rapidly shifting immunologic landscape and severity of SARS-CoV-2 in the Omicron era in South Africa. Nat Commun. 2023;14(1):246. doi: 10.1038/s41467-022-35652-0
- Yu P., Liu Z., Zhu Z., et al. Omicron variants breakthrough infection elicited higher specific memory immunity than third dose booster in healthy vaccinees. Virol. Sin. 2023;38(2):233–43. DOI: https://doi.org/10.1016/j.virs.2022.12.008
- Jacobson R.M., Poland G.A. Universal vaccination of healthy children against influenza: a role for the cold-adapted intranasal influenza vaccine. Pediatr. Drugs. 2002;4(1):65–71. DOI: https://doi.org/10.2165/00128072-200204010-00007
- Nian X., Zhang J., Huang S., et al. Development of nasal vaccines and the associated challenges. Pharmaceutics. 2022;14(10):1983. DOI: https://doi.org/10.3390/pharmaceutics14101983
Дополнительные файлы