Вариабельность preCore/Core-региона вируса гепатита В у беременных женщин в Гвинейской Республике
- Авторы: Останкова Ю.В.1, Бальде Т.А.2, Бумбали С.3, Серикова Е.Н.1, Зуева Е.Б.1, Рейнгардт Д.Э.1, Щемелев А.Н.1, Давыденко В.С.1, Ануфриева Е.В.1, Эсауленко Е.В.1, Тотолян А.А.1
-
Учреждения:
- ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
- Научно-исследовательский институт прикладной биологии Гвинеи
- Международный исследовательский центр по тропическим инфекциям в Гвинее
- Выпуск: Том 101, № 1 (2024)
- Страницы: 61-71
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://microbiol.crie.ru/jour/article/view/18522
- DOI: https://doi.org/10.36233/0372-9311-447
- EDN: https://elibrary.ru/waiiez
- ID: 18522
Цитировать
Аннотация
Актуальность. Вертикальный путь передачи вируса гепатита В (ВГВ) является одним из наиболее значимых в странах Африки, для которых характерны позднее выявление заболевания и высокая смертность. Причиной высокой распространённости гепатоцеллюлярной карциномы в Африке может быть вариативность preCore/Core-региона ВГВ, мутации в котором способствуют прогрессированию заболевания. Молекулярно-генетическая характеристика штаммов, циркулирующих среди беременных женщин, может отражать общий мутационный профиль патогена в популяции.
Целью нашей работы был анализ вариабельности preCore/Core-региона ВГВ, циркулирующего среди беременных женщин в Гвинейской Республике.
Материалы и методы. Исследовали 480 образцов плазмы, полученных от ВГВ-позитивных беременных женщин из Гвинейской Республики. Для всех образцов проводили секвенирование и анализ нуклеотидных последовательностей preCore/Core-региона генома ВГВ.
Результаты. Аминокислотная изменчивость в preCore-регионе определена у 211 (43,96%) пациенток, в Core-регионе — у 473 (98,54%). Выявлены 12 полиморфных участков preCore-региона, в которых происходили аминокислотные замены, в том числе для генотипов Е, А и D определены 8, 2 и 5 позиций соответственно. В Core-регионе определены 67 позиций замен, в том числе 46 в образцах генотипа Е, 23 — генотипа А, 26 — генотипа D. Распределение замен в preCore- и Core-регионах у ВГВ-генотипов Е, А и D значительно отличается с преобладанием мутаций среди генотипа Е (p < 0,0001). Для каждого генотипа определены индивидуальные характерные мутации. Выявлены наиболее распространённые клинически значимые мутации в preCore/Core-регионе в обследуемой группе, в том числе pc-H5D (27,08%), pc-W28* (35,21%), c-E64D (33,54%), c-L116I/V/G (91,46%), c-T146N (73,13%). Двойная мутация A1762T/G1764A в базальном ядерном промоторе показана в 74 образцах генотипа Е, что составило 15,42% от общей группы и 16,59% от пациентов с генотипом Е.
Заключение. Определена частота встречаемости клинически значимых мутаций preCore/Core среди беременных женщин Гвинейской Республики. Полученные данные отражают их распространённость в общей популяции и могут быть использованы для прогноза прогрессирования хронического гепатита В среди населения данного региона.
Полный текст
Введение
Вирус гепатита В (ВГВ), способный вызывать как острое, так и хроническое заболевание печени и являющийся 7-й причиной смертности в мире, остаётся серьёзной проблемой общественного здравоохранения, несмотря на все меры, принимаемые для его элиминации. По данным разных исследователей, количество больных хроническим вирусным гепатитом В (ХГВ) в мире достигает 360 млн человек1. Более 75 млн из них проживает в странах Африки к югу от Сахары, где встречаемость среди населения поверхностного антигена ВГВ (HBsAg), представляющего собой главный лабораторный диагностический маркер, превосходит 8%, а в некоторых регионах достигает 25% [1]. К естественным путям передачи патогена относят половой (прямой сексуальный контакт), вертикальный (от матери плоду во время или после родов, а также пренатальное (трансплацентарное) инфицирование, бытовой путь, в том числе прямой и непрямой, включающий пользование общими с инфицированным лицом предметов гигиены и тому подобные контакты. Одним из наиболее значимых путей распространения ВГВ в Африке является вертикальный [2]. Без терапевтического вмешательства частота передачи вируса от матери к ребёнку превышает 31% [3]. Особая значимость раннего инфицирования связана с тем, что при заражении в возрасте до 5 лет в подавляющем большинстве случаев развивается ХГВ [4]. Кроме того, именно раннее инфицирование ВГВ является одним из наиболее значимых факторов риска развития цирроза печени (ЦП) и гепатоцеллюлярной карциномы (ГЦК) [5]. Ещё одной причиной огромного количества больных ГЦК и высокой смертности от неё в Африке является позднее выявление заболевания и, соответственно, позднее обращение больных в медицинские учреждения [6]. Самой пострадавшей страной является Гамбия, за ней следуют Гвинейская Республика, Либерия и Сьерра-Леоне [7]. Связано это как с недостаточностью методов диагностики, так и с крайне низкой информированностью населения о вирусных гепатитах, путях передачи и последствиях инфицирования. Помимо социальных факторов на прогрессирование заболевания способны влиять вирусные факторы. Так, высокая вирусная нагрузка и, соответственно, активная репликация вируса повышают риск развития ЦП и ГЦК, но даже вирусная нагрузка менее 200 МЕ/мл не исключает прогрессирования болезни [8]. Высокая гетерогенность вируса, для которого в настоящее время описаны 10 генотипов и более 40 субгенотипов, также оказывает влияние на прогрессирование заболевания [9, 10]. Например, для ВГВ субгенотипа C2 характерны более частая хронизация и тяжёлое течение болезни, включая развитие ГЦК, чем для В2, а вирусы генотипов А и В более чувствительны к терапии, чем D и C [11].
Однако генотипический фактор не является единственным параметром, способствующим прогрессированию заболевания, весомый вклад вносят естественные и возникающие под селективным воздействием мутации вируса. За исключением редких случаев делеций, большинство мутаций в preCore/Core-регионе представляют собой точечные мутации, преимущественно связанные со снижением уровня HBeAg и/или снижением вирусной нагрузки. Причём в Core-регионе мутации локализуются в основном в иммуноактивных областях (MHC классов I + II) и, таким образом, могут влиять на развитие заболевания. Например, известны связанные с тяжёлым течением заболевания печени и развитием ГЦК мутации в preCore-регионе (G1896A) и в базальном ядерном промоторе (basal core promoter — BCP) — T1753C, A1762T/G1764A, описаны также аминокислотные замены в Core-регионе — F24Y, E64D, E77Q, A80I/T/V, L116I, E180A [12]. Молекулярно-генетическая вариативность вирусов может проявлять связь с пространственно-временными изменениями, т.е. эволюционировать с течением времени, распространением в географических регионах, группах риска, ключевых группах населения, изменением путей передачи [13]. Поэтому для прогнозирования эпидемиологической ситуации высокую значимость имеет динамический мониторинг циркулирующих вариантов вируса в группах населения, отражающих ситуацию в популяции, а также потенциально способных распространять патоген. Беременные женщины являются такой группой, т.к. фактически демонстрируют эпидемиологический профиль половозрелого гетеросексуального населения того или иного исследуемого географического региона.
Гвинейская Республика — страна с населением более 13,6 млн человек, расположенная на Атлантическом побережье Западной Африки, являющаяся одной из беднейших стран мира2, где медицина остаётся наименее финансируемым государством направлением. Так, в 2019 г. вклад ВВП страны в секторы здравоохранения и социальной работы не превышал 3,2%3. Значительно сократилась работа по профилактике вертикальной передачи ВИЧ, являющаяся одним из ключевых факторов улучшения здоровья матери и ребёнка, уменьшилось среднее число посещений клиник дородовой помощи [14, 15]. В то же время распространённость ВГВ в стране крайне велика: в отличие от ВИЧ, анализ на маркеры вирусных гепатитов проводят редко, даже при дородовом обследовании беременных, поэтому у большинства больных заболевание не диагностировано. Поскольку скрининг на вирусные гепатиты не проводят, то и профилактики вертикальной передачи ВГВ не осуществляют. Встречаемость ДНК ВГВ среди условно здоровых лиц составляет 22,36% [16], среди доноров крови — 30,4% [17], а среди беременных женщин в некоторых регионах страны — 26,5% [18, 19]. Ранее было показано, что практически все HBsAg-позитивные женщины, родившие естественным путём, передавали вирус ребёнку [20].
Несмотря на внедрение в стране вакцинации против ВГВ в 2006 г., охват вакцинацией в настоящее время не превышает 47% жителей, что связано как с отсутствием налаженной системы хранения и транспортировки вакцин, требующих соблюдения холодовой цепи, так и с социокультурными особенностями населения, недоверием местных жителей к медицинскому персоналу [21].
Данных о молекулярно-генетических особенностях циркулирующего в Гвинейской Республике вируса сравнительно мало, характеристика preCore/Core-региона представлена в литературе очень ограниченно [22].
Целью нашей работы было проанализировать вариабельность preCore/Core-региона ВГВ, циркулирующего среди беременных женщин в Гвинейской Республике.
Материалы и методы
В работе были использованы образцы плазмы крови, полученные от 480 инфицированных ВГВ беременных женщин, проживающих в Гвинейской Республике [19]. Лабораторные исследования проводили на базе Российско-Гвинейского научного исследовательского центра эпидемиологии и профилактики инфекционных болезней, расположенного на территории Института прикладной биологии Гвинеи в префектуре Киндия. На проведение данного этапа работы было получено согласие Этического комитета Гвинеи (протокол № 129/CNERS/16 от 31.08.2015). Все обследованные дали письменное информированное согласие на участие в исследовании.
ДНК ВГВ в плазме крови определяли методом полимеразной цепной реакции (ПЦР) в реальном времени с гибридизационно-флуоресцентной детекцией, применяя разработанный в Санкт-Петербургском НИИ эпидемиологии и микробиологии имени Пастера способ, позволяющий обнаруживать ДНК ВГВ при низкой вирусной нагрузке. Чувствительность метода составляет 10 МЕ/мл при экстракции из 100 мкл плазмы [23]. Нуклеотидные последовательности полных геномов ВГВ получали, используя гнездовую ПЦР на базе перекрывающихся пар праймеров с последующим секвенированием по Сэнгеру [22]. Полученные последовательности ВГВ были проанализированы с целью определения мутаций в исследуемом регионе генома ВГВ относительно консенсусной последовательности вируса Mart-B47 (HE974377.1, генотип D) [23] для единообразия обозначения позиций замен и выявления замен, характерных для одних генотипов, но не представленных или мало представленных в других. Дополнительно все последовательности генотипов А, D и Е анализировали относительно референсных последовательностей соответствующих генотипов (номера в международной базе GenBank — AY128092.1, NC_003977.2 и AB032431.1 соответственно). Использовали онлайн-инструмент базы данных «Geno2Pheno HBV»4, а также «Hepatitis B Virus Phylogenetic Typing Tool»5, где в качестве референсных штаммов из предложенных выбирали также AY128092.1, NC_003977.2 и AB032431.1.
Статистическую обработку данных производили с помощью программ «MS Excel», «Prizm 5.0» («GraphPad Software Inc.»), «Statistica 8.0» («StatSoft Inc.»). При оценке статистической погрешности использовали «точный» интервал Клоппера–Пирсона. Результаты представлены с указанием 95% доверительного интервала (95% ДИ). Для оценки достоверности различий данных, полученных при парных сравнениях, использовали, в зависимости от характеристик выборок, точный критерий Фишера или критерий χ2 с поправкой Йетса. В качестве порога достоверности отличий было определено значение вероятности p < 0,05.
Результаты
Возраст обследованных варьировал от 13 до 55 лет и составил в среднем 25,8 года. Число HBsAg-негативных случаев составило 188 (39,17%; 95% ДИ 34,77–43,69%). Генотипы ВГВ, определённые на основании филогенетического анализа, представлены в табл. 1 [19].
Таблица 1. Генотипы ВГВ, циркулирующие среди беременных женщин обследованной группы
Table 1. Hepatitis B virus genotypes circulating among pregnant women in the survey group
Генотип Genotype | Количество Quantity | Доля, % Share, % | 95% ДИ 95% CI |
А1 | 8 | 1,67 | 0,72–3,26 |
А3 | 7 | 1,46 | 0,59–2,98 |
D1 | 3 | 0,63 | 0,13–1,82 |
D2 | 5 | 1,04 | 0,34–2,41 |
D3 | 11 | 2,29 | 1,15–4,06 |
E | 446 | 92,9 | 90,24–95,05 |
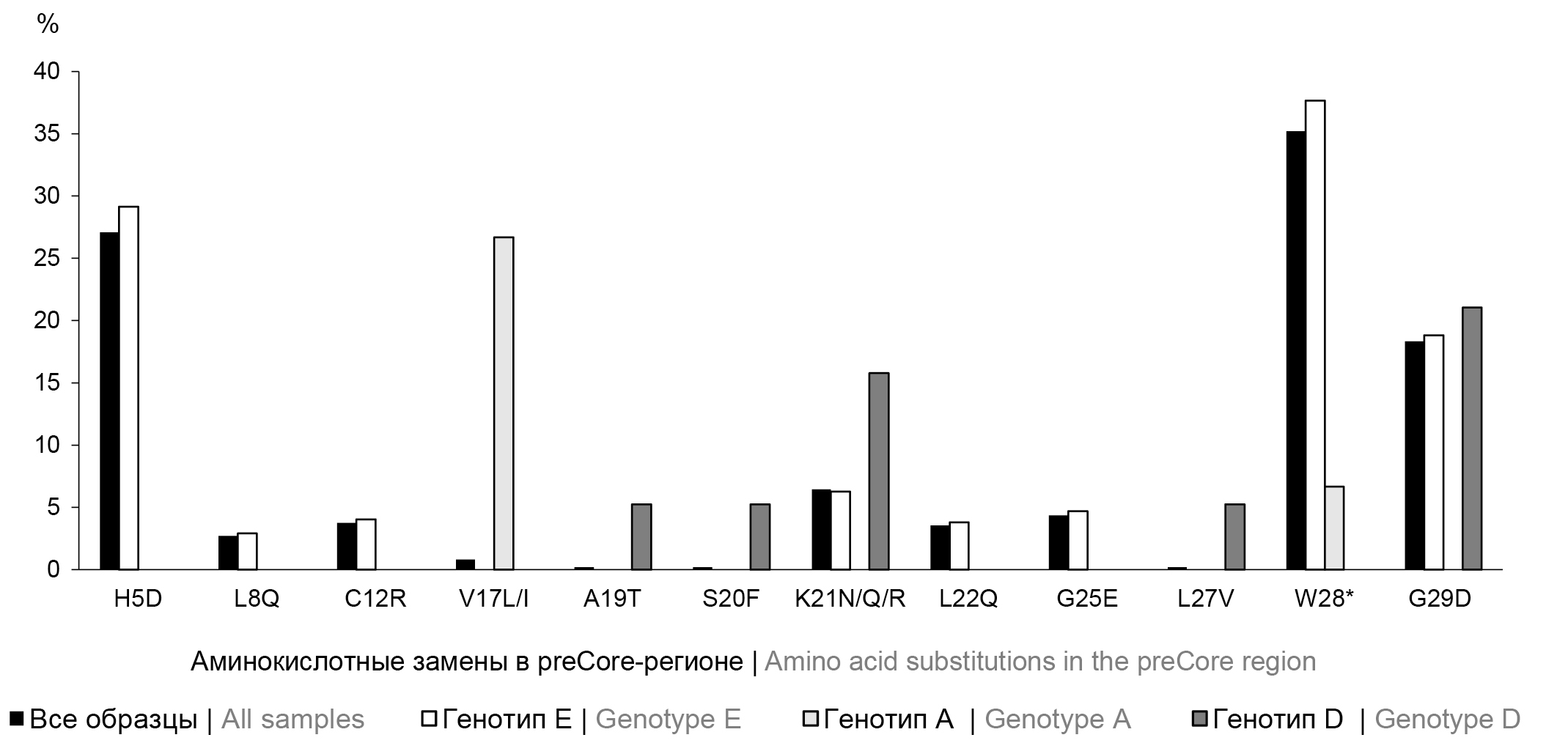
Для изучения вариабельности preCore/Core-региона ВГВ в обследованной группе были проанализированы нуклеотидные последовательности вирусного генома каждого образца. Аминокислотная изменчивость preCore-региона определена у 211 человек (43,96%; 95% ДИ 39,46–48,53%), а Core-региона — у 473 (98,54%; 95% ДИ 97,02–99,41%). При анализе preCore-региона выявлены 12 полиморфных участков, в которых происходили аминокислотные замены, в том числе для генотипа Е определены 8 позиций, для генотипа D — 5, для генотипа А — 2. Встречаемость аминокислотных замен в preCore-регионе представлена на рис. 1.
Рис. 1. Частота встречаемости аминокислотных замен в preCore-регионе генома ВГВ в обследованной группе и в соответствии с генотипами.
* — стоп-кодон. Аминокислотные замены представлены относительно консенсусной последовательности вируса Mart-B47 (HE974377.1, генотип D) с дополнительным анализом относительно генотип-специфичных референсных последовательностей AY128092.1 (генотип А), NC_003977.2 (генотип D) и AB032431.1 (генотип Е).
Fig. 1. Frequency of amino acid substitutions occurrence in the preCore region of the hepatitis B virus genome in the examined group and according to genotypes.
* — stop codon. Amino acid substitutions are presented relative to the consensus sequence of the Mart-B47 virus (HE974377.1, genotype D) with additional analysis relative to genotype-specific reference sequences AY128092.1 (genotype A), NC_003977.2 (genotype D) and AB032431.1 (genotype E).
При сравнительном анализе установлено, что распределение мутаций среди ВГВ генотипов Е, А и D значительно отличаются (p < 0,0001). Для генотипа Е среди прочих определены замены H5D, L8Q, C12R, не представленные среди изолятов генотипов А и D. В свою очередь, мутация V17L/I показана только для ВГВ генотипа А, замены A19T, S20F, L27V выявлены только у ВГВ генотипа D. При анализе распределения аминокислотных замен, представленных, по крайней мере, в 2 генотипических группах, также определены достоверные отличия с преобладанием мутаций среди ВГВ генотипа Е: χ2 = 16,206; df = 8; p = 0,0395.
В Core-регионе определены 67 позиций аминокислотных замен, в том числе для генотипа Е — 46, для генотипа А — 23 позиции, для генотипа D — 26. Встречаемость наиболее распространённых аминокислотных замен в Core-регионе представлена на рис. 2.
Рис. 2. Частота встречаемости наиболее распространённых аминокислотных замен в Core-регионе генома ВГВ в обследованной группе и в соответствии с генотипами.
Аминокислотные замены представлены относительно консенсусной последовательности вируса Mart-B47 (HE974377.1, генотип D) с дополнительным анализом относительно генотип-специфичных референсных последовательностей AY128092.1 (генотип А), NC_003977.2 (генотип D) и AB032431.1 (генотип Е).
Fig. 2. Frequency of the most common amino acid substitutions occurrence in the Core region of the hepatitis B virus genome in the examined group and according to genotypes.
Amino acid substitutions are presented relative to the consensus sequence of the Mart-B47 virus (HE974377.1, genotype D) with additional analysis relative to genotype-specific reference sequences — AY128092.1 (genotype A), NC_003977.2 (genotype D) and AB032431.1 (genotype E).
Распределение мутаций Core-региона среди ВГВ генотипов Е, А и D также значительно отличается (p < 0,0001). Для генотипа Е выявлены замены S21H, V27I, R28K, Y38F, R39G, E46D, P79Q, M93V/I, G94A, F103L, I105T, T114P/V, F122C, W125T, R133T, S141P, L143T, T146N, V149I, R152G, R166P, R181P, Q184R/K/H, не представленные среди образцов ВГВ генотипов А и D. Только среди ВГВ генотипа А обнаружены мутации A11S, A34S, G63V, E77D/Q, L95I, T142I/S, D153G, R159G, S183P, среди ВГВ генотипа D — I3L, D4Y, F9I, V13G, L15F, S17L, L19F, D29G, Q57R, L162N, S178T. Оценка распределения полиморфных вариантов, выявленных не менее чем в 2 генотипических группах, продемонстрировала достоверные (p < 0,0001) отличия с большей частотой встречаемости и разнообразием замен среди ВГВ генотипа Е. Сравнительный межгенотипный анализ встречаемости наиболее распространённых в обследованной группе аминокислотных замен в Core-регионе также показал отличия (p < 0,0001).
Двойная мутация A1762T/G1764A была выявлена в BCP 74 образцов ВГВ генотипа Е, что составило 15,42% (95% ДИ 12,3–18,96%) от общей группы и 16,59% (95% ДИ 13,26–20,38%) от пациентов с ВГВ генотипа Е. Информация о наиболее часто встречающихся в группе клинически значимых мутациях BCP и preCore/Core-региона представлена в табл. 2.
Таблица 2. Наиболее распространённые клинически значимые мутации, выявленные в BCP и preCore/Core-регионе в обследуемой группе
Table 2. The most prevalent clinically significant mutations identified in the BCP and preCore/Core region in examined group
Область генома ВГВ HBV genome region | Мутация Mutation | Частота встречаемости в группе (n = 480) Frequency of occurrence in the group (n = 480) | Генотип Genotype | Клиническая значимость мутации Clinical significance of the mutation | ||
n | % | 95% ДИ 95% CI | ||||
BCP | A1762T/G1764A | 74 | 15,42 | 12,30–18,96 | E | |
PreCore | H5D | 130 | 27,08 | 23,16–31,30 | E | HBsAg-негативный ВГВ генотип Е связан с тяжёлым заболеванием печени. Может частично объяснить высокую распространённость ГЦК в Африке [26] Associated with severe liver disease in HBsAg-negative HBV genotype E. This mutation could partially explain the high prevalence of HCC in Africa [26] |
PreCore | K21N/Q/R | 31 | 6,46 | 4,43–9,04 | E, D | Предположительно связан с прогрессированием заболевания, особенно у HBsAg-негативных пациентов [26] Presumably associated with disease progression, especially in HBsAg-negative patients [26] |
PreCore | W28* (G1896A) | 169 | 35,21 | 30,93–39,67 | E, A | |
PreCore | G29D (G1899A) | 88 | 18,33 | 14,97–22,09 | E, D | |
Core | E64D | 161 | 33,54 | 29,33–37,96 | E, A, D | Прогрессирование заболевания, ЦП и ГЦК, ускользание от иммунного ответа [24, 25] Disease progression, liver cirrhosis and HCC, immune escape [24, 25] |
Core | E113Q | 19 | 3,96 | 2,40–6,11 | E, A | Ускользание от иммунитета, отбор специфических антител, хроническая персистенция вируса, прогрессирование заболевания, ЦП и ГЦК [24, 25] Immune escape, selection of specific antibodies, chronic persistence of the virus, disease progression, liver cirrhosis and HCC [24, 25] |
Core | T114P/V | 44 | 9,17 | 6,74–12,11 | E | |
Core | L116I/V/G | 439 | 91,46 | 88,59–93,8 | E, D | |
Core | F122C | 11 | 2,29 | 1,15–4,06 | E | |
Core | W125T | 13 | 2,71 | 1,45–4,59 | E | |
Core | P130T | 29 | 6,04 | 4,08–8,56 | E, D | |
Core | A131P | 67 | 13,96 | 10,98–17,38 | E, A | |
Core | R133T | 11 | 2,29 | 1,15–4,06 | E | |
Core | S141P | 12 | 2,5 | 1,30–4,33 | E | Усиливают образование ккзДНК ВГВ при внутриклеточной амплификации и ослабляют при инфицировании [27]. Ускользание от иммунитета, отбор специфических антител, хроническая персистенция вируса, прогрессирование заболевания, ЦП и ГЦК [24, 25] Enhance the formation of HBV cccDNA during intracellular amplification, but impair cccDNA formation during infection [27]. Immune escape, selection of specific antibodies, chronic persistence of the virus, disease progression, liver cirrhosis and HCC [24, 25] |
Core | L143T | 14 | 2,92 | 1,60–4,85 | E | |
Core | T146N | 351 | 73,13 | 68,92–77,04 | E | |
Обсуждение
Ген С и регион Pre-C протяжённостью 555 н.т. и 87 н.т. соответственно кодируют два белка: HBcAg размером 185 аминокислот и HBeAg размером 150 аминокислот, являющихся продуктом альтернативной инициации трансляции с двух AUG-кодонов и посттрансляционной модификации. С внутреннего AUG-кодона строится структурный полипептид вирусного капсида Core-белок размером 21 кДа. С расположенного выше по цепи AUG-кодона кодируется белок preCore размером 24 кДа. Белок Core играет ключевую роль в жизненном цикле ВГВ, а изменения в его последовательности способны служить потенциальными маркерами прогрессирования заболевания [12]. HBcAg служит основной мишенью для иммунного ответа хозяина, особенно атаки цитотоксических Т-лимфоцитов CD4 и CD8, при которой несинонимичные мутации, изменяющие иммунные эпитопы, могут привести к образованию вариантов ускользания от иммунного ответа, что приводит к персистенции ВГВ. Более того, поскольку замены в Core-регионе могут привести к одновременным заменам в HBeAg, ключевом иммунорегуляторном белке вируса, то и способны оказать значительное влияние на естественное течение ХГВ [28]. Решающую роль в репликации вируса играет также BCP, способствуя образованию preСore и прегеномной РНК [29], значит, мутации в этой области также могут способствовать развитию заболевания. Ведущие к таким изменениям мутации в разных областях генома вируса могут быть следствием как естественной эволюции вируса, так и внешнего влияния, поскольку и эндогенное, и экзогенное селективное воздействие приводят к модификации структуры генома патогена за счёт его высокой вариабельности, особенно при длительном течении заболевания [24].
В обследованной группе у 15 человек выявлен ВГВ генотипа А, включая 8 случаев генотипа А1, который эндемичен для Африки и прошёл длинный эволюционный путь на континенте. Ранее было показано, что у африканцев, инфицированных субгенотипом А1, риск развития рака печени в 4,5 раза выше, чем у инфицированных другими геновариантами, причём рак развивается в более раннем возрасте [30].
Бóльшую часть изученной в рамках настоящей работы группы составляют пациентки с ВГВ генотипа Е. Этот геновариант является одним из наиболее распространённых в странах Африки к югу от Сахары, в том числе в Гвинейской Республике и её странах-соседях. Несмотря на широкую встречаемость, этот вариант вируса имеет сравнительно низкую относительно других вариабельность генома, что может свидетельствовать о его более коротком эволюционном пути [31]. В то же время некоторые исследователи высказывали опасения по поводу эффективности вакцины против ВГВ при генотипе Е, т.к. при таком геноварианте нередко наблюдали прорывные инфекции. Предположительно, это может быть связано с двойной мутацией A1762T/G1764A в BCP, ассоциированной не только с прогрессированием заболевания печени, но и со сниженным уровнем секретируемого HBeAg, с ускользанием от иммунного ответа [32]. Таким образом, известная для ВГВ генотипа Е высокая заболеваемость ГЦК может быть связана как с распространённостью изменений генома, ведущих к прогрессированию заболевания, так и с упомянутым ранее поздним обнаружением инфицирования, причём один фактор не исключает другой [31]. В обследованной нами группе была показана высокая встречаемость двойной мутации A1762T/G1764A (15,42%). Кроме того, обнаружено значительное количество мутаций в preCore/Core-регионе ВГВ, в том числе показана высокая частота мутации preCore G1896A (35,21%), приводящая к появлению стоп-кодона (W28*), преждевременному обрыву предшественника HBeAg, отвечающей более чем за 90% случаев дефектной секреции HBeAg и, соответственно, отмены экспрессии антигена, что характерно для больных, инфицированных ВГВ генотипа Е [33]. Отметим, что столь же высокая распространённость мутации G1896A (47,11%) была показана ранее у жителей Гвинейской Республики с ВГВ генотипа Е [22]. Выявленная в настоящей работе аминокислотная замена preCore-региона ВГВ генотипа Е H5D при HBsAg-негативном генотипе Е связана с тяжёлыми заболеваниями печени. Эта мутация также может частично объяснить высокую распространённость ГЦК в Африке. Ещё две значимые для развития ГЦК мутации, связанные с тяжёлым заболеванием у HBsAg-отрицательных лиц, — K21N/Q/R и G29D в preCore-области, выявлены среди изолятов генотипов Е и D [26]. В обследованной группе обнаружено значительное количество мутаций в Core-регионе в позициях 113–143, влияющих, как известно, на антигенность и стабильность частицы и приводящих к появлению ускользающих от иммунитета мутантов, ведущих к хронической персистенции вируса.
Для большинства выявленных в Core-регионе аминокислотных замен нет достоверных сведений об их клинической значимости, однако известны сайты иммунного распознавания HBcAg, в том числе эпитопы-мишени для CD4+-Т-клеток человека (аминокислотные позиции 1–20, 50–69, 81–105, 117–131, 141–165), цитотоксические Т-лимфоциты/CD8+-Т-клетки (аминокислотные позиции 18–27, 88–96, 130–140, 141–151), эпитопы В-клеток (аминокислотные позиции 74–89, 107–118, 127–138). Мутации в таких иммуноактивных участках HBcAg имеют жизненно важное значение для персистенции вируса, иммунного ответа хозяина и прогрессирования заболевания [25]. Таким образом, среди обнаруженных аминокислотных замен ряд мутаций имеет потенциальное клиническое значение, способствуя развитию ХГВ, например, локализованные в участках эпитопов Т-клеток (T12S, E64D, L65V, M66I, T67N/S, A69S, N87G/S, T91N/S, M93V/I, G94A, I97F, F103L, I105T, F122C, W125T, P130T, A131P, S141P, L143T, T146N, V149I, R151Q, R152G, S157I) и В-клеток (N74V/A, P79Q, A80T, N87G/S, L108I, E113Q, T114P/V, L116I/V/G, P130T, A131P, R133T). Аминокислотные замены в основных иммунных эпитопах потенциально способны нарушить иммунный ответ, что, в свою очередь, может стать одной из причин развития HBsAg-негативного гепатита В, привести к персистирующей инфекции и высокой вариабельности всех регионов генома вируса [34]. Отметим, что среди перечисленных мутаций есть те, которые достоверно связаны с развитием ЦП и ГЦК, в том числе расположенные в эпитопах B-клеток E77D/Q, A80T и L116I/V/G, а также в эпитопах T-клеток — E64D и T91N/S. Учитывая высокую встречаемость таких замен, нельзя исключать их значительную роль в повышенной распространённости тяжёлых заболеваний печени в странах Африки, особенно в случаях ВГВ генотипа Е. Особое внимание привлекают аминокислотные замены, выявленные абсолютно у всех обследованных лиц генотипа Е — E40D, N74V/A, N87G/S, I97F, R181P, E182A/P, которые, учитывая их 100% представленность, могут быть характерны для генотипа Е в целом или связаны с особенностями этого геноварианта вируса в Гвинейской Республике, но, с другой стороны, связаны с прогрессированием заболевания печени.
В рамках исследования показана большая вариабельность preCore/Core-региона генотипа Е по сравнению с А и D, в то время как известно, что в целом для ВГВ генотипа Е характерна относительная гетерогенность в сравнении с другими генотипами. По всей видимости, полученные нами противоречащие этому факту результаты связаны с тем, что в группе преобладали изоляты генотипа Е, в то время как генотипы А и D представлены единичными случаями.
За последние 15 лет встречаемость мутаций среди изолятов ВГВ генотипа Е значительно возросла. В 2009 г. P. Garmiri и соавт. продемонстрировали, что в Гвинейской Республике 26,0% случаев ВГВ генотипа E имели 1 или более мутаций в положениях 1762, 1764 и/или 1896, преждевременный стоп-кодон, связанный с мутацией G1896A, наблюдался в 20,8% последовательностей, а 5,2% имели тройную мутацию [35]. В нашем исследовании G1896A представлена в 1,5 раза чаще (35,21%), а тройная мутация показана у 47 человек — 9,79% (95% ДИ 7,28–12,81%) от общей группы и 10,54% (95% ДИ 7,85–13,77%) от лиц с генотипом Е. Вероятнее всего, такие мутации представляют собой следствие естественного полиморфизма вируса. Однако мутации в позициях 1762, 1764, 1896 относятся к самым распространённым. В Пакистане A1762T/G1764A отмечена в 30% случаев, G1896A — в 38% [36]. В Эфиопии частота A1762T/G1764A составила 25,9% случаев, G1896A — 25,2% [37]. В Бразилии встречаемость A1762T/G1764A составила 59,3% случаев, G1896A — 84,1% [38]. Кроме того, встречаемость указанных мутаций нередко связана с генотипом вируса. Так, встречаемость A1762T/G1764A во Вьетнаме составила 93,3% при генотипе С и 50% при генотипе В, а G1896A — 74,2% при генотипе B и 2,2% при генотипе С [39]. Анализ 6479 последовательностей ВГВ разных генотипов из международной базы данных позволил определить общую частоту A1762T/G1764A — 28,9%, представленность этой двойной мутации относительно генотипов была следующей: А — 26,9%; В — 15,5%; С — 46,1%; D — 21,5%; Е — 11%; F — 22,5%; G — 97,5%; H — 3,8%, однако следует отметить, что объём выборок генотипов Е–H оказался в разы меньше, чем остальных генотипов [40]. По всей видимости, именно с этим была связана сравнительно низкая встречаемость A1762T/G1764A при генотипе Е, в то время как, например, в Нигерии, где обследованная группа была представлена преимущественно генотипом Е, A1762T/G1764A выявлена в 43% случаев, G1896A — в 57% [41].
Следует отметить, что в нашей когорте HBsAg-негативные образцы и образцы с низкой вирусной нагрузкой были более вариабельны на протяжении preCore/Core-региона, что может быть связано в том числе с ингибированием репликации ВГВ мутациями preCore/Core-региона. В многочисленных исследованиях описана связь между частотой мутаций в preCore/Core-регионе и прогрессированием заболевания печени у пациентов, инфицированных ВГВ, однако ассоциация между аминокислотными заменами и клинической тяжестью заболевания существенно различается как в разных популяциях, так и в разных исследованиях одних и тех же популяций. Это очевидное несоответствие можно объяснить различными факторами, включая генотип вируса, этническую принадлежность пациента, иммунную компетентность хозяина и коинфекцию другими вирусами. Тем не менее ряд мутаций, для которых показана достоверная связь с ЦП и ГЦК, а также влияющие на серологический статус HBeAg, могут служить диагностическими и прогностическими маркерами для раннего выявления прогрессирования заболевания печени у инфицированных ВГВ лиц.
Заключение
Распространённость у терапевтически наивных беременных женщин Гвинейской Республики клинически значимых аминокислотных замен preCore/Core-региона ВГВ отражает их встречаемость в популяции и косвенно объясняет причины крайне высокой частоты ГЦК в африканских странах. Ряд таких аминокислотных замен, ассоциированных, как показано для генотипов D и А, с прогрессированием заболевания, характерны для генотипа Е. Определение генотипов и мутаций генома вируса может быть использовано для прогноза прогрессирования заболевания. Выявленная изменчивость свидетельствует о необходимости исследования особенностей патогена и иммунного ответа хозяина, в том числе при HBsAg-негативном ВГВ. Полученные нами результаты свидетельствуют о необходимости уделить особое внимание нарастающему эпидемическому кризису ВГВ в странах Африки к югу от Сахары. Этот регион находится в самом конце списка по доступности целого ряда медицинских услуг, включая скрининг, диагностику и лечение людей, инфицированных этим вирусом. Результаты исследования могут служить исходными данными для оценки национальной заболеваемости ВГВ и планирования массовой иммунизации против ВГВ в Гвинейской Республике.
1 ВОЗ. Гепатит В: Информационный бюллетень; 2023. URL: https://www.who.int/ru/news-room/fact-sheets/detail/hepatitis-b
2 Countrymeters. Население Гвинеи. URL: http://countrymeters.info/ru/guinea (дата обращения: 09.03.2023).
3 INS GUINÉE. Annuaire Statistique; 2019. URL: https://www.stat-guinee.org/images/Documents/Publications/INS/annuelles/annuaire/ANNUAIRE_STATISTIQUE_AGRICOLE__2019_INS_FINALISE.pdf (дата обращения: 20.12.2022).
4 URL: https://hbv.geno2pheno.org/
5 URL: https://www.genomedetective.com/app/typingtool/hbv/
Об авторах
Юлия Владимировна Останкова
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Автор, ответственный за переписку.
Email: shenna1@yandex.ru
ORCID iD: 0000-0003-2270-8897
к.б.н., зав. лаб. иммунологии и вирусологии ВИЧ-инфекции, с.н.с. лаб. молекулярной иммунологии Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургТьерно Амаду Лабе Бальде
Научно-исследовательский институт прикладной биологии Гвинеи
Email: shenna1@yandex.ru
ORCID iD: 0000-0002-3808-4380
сотрудник НИИ прикладной биологии Гвинеи, Киндия, Гвинейская Республика
Гвинея, КиндияСанаба Бумбали
Международный исследовательский центр по тропическим инфекциям в Гвинее
Email: shenna1@yandex.ru
ORCID iD: 0000-0002-4506-6033
к.б.н., зав. аспирантурой НИИ прикладной биологии Гвинеи, Киндия, Гвинейская Республика, директор Международного центра исследований тропических инфекций в Гвинее
Гвинея, НзерекореЕлена Николаевна Серикова
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0002-0547-3945
м.н.с. лаб. иммунологии и вирусологии ВИЧ-инфекции Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургЕлена Борисовна Зуева
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0002-0579-110X
к.б.н., биолог отделения ВИЧ-инфекции и СПИД-ассоциированных заболеваний Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургДиана Эдуардовна Рейнгардт
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0002-0931-102X
врач клинической лабораторной диагностики отделения ВИЧ-инфекции и СПИД-ассоциированных заболеваний Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургАлександр Николаевич Щемелев
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0002-3139-3674
м.н.с. лаб. иммунологии и вирусологии ВИЧ-инфекции Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургВладимир Сергеевич Давыденко
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0003-0078-9681
м.н.с. лаб. иммунологии и вирусологии ВИЧ-инфекции Санкт-Петербургского НИИ эпидемиологии и микробиологии имени Пастера
Россия, Санкт-ПетербургЕкатерина Владимировна Ануфриева
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0009-0002-1882-529X
м.н.с. лаб. иммунологии и вирусологии ВИЧ-инфекции Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургЕлена Владимировна Эсауленко
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0003-3669-1993
д.м.н., профессор, зав. лаб. вирусных гепатитов Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургАрег Артемович Тотолян
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера»
Email: shenna1@yandex.ru
ORCID iD: 0000-0003-4571-8799
д.м.н., профессор, академик РАН, зав. лаб. молекулярной иммунологии, директор Санкт-Петербургского НИИ эпидемиологии и микробиологии им. Пастера
Россия, Санкт-ПетербургСписок литературы
- Schweitzer A., Horn J., Mikolajczyk R.T., et al. Estimations of worldwide prevalence of chronic hepatitis B virus infection: a systematic review of data published between 1965 and 2013. Lancet. 2015;386(10003):1546–55. DOI: https://doi.org/10.1016/S0140-6736(15)61412-X
- Kean E., Funk A.l., Shimakawa Y. Systematic review with meta-analysis: the risk of mother to child transmission of HBV infection in Sub-Saharan Africa. Aliment. Pharmacol. Ther. 2016;44(10):1005–17. DOI: https://doi.org/10.1111/apt.13795
- Yao N., Fu S., Wu Y., et al. Incidence of mother-to-child transmission of hepatitis B in relation to maternal peripartum antiviral prophylaxis: A systematic review and meta-analysis. Acta Obstet. Gynecol. Scand. 2022;101(11):1197–206. DOI: https://doi.org/10.1111/aogs.14448
- Shimakawa Y., Lemoine M., Njai H.F., et al. Natural history of chronic HBV infection in West Africa: a longitudinal population-based study from The Gambia. Gut. 2016;65(12):2007–16. DOI: https://doi.org/10.1136/gutjnl-2015-309892
- Wang C.C., Cheng P.N., Kao J.H. Systematic review: chronic viral hepatitis and metabolic derangement. Aliment. Pharmacol. Ther. 2020;51(2):216–30. DOI: https://doi.org/10.1111/apt.15575
- Kew M.C., Welschinger R., Viana R. Occult hepatitis B virus infection in Southern African blacks with hepatocellular carcinoma. J. Gastroenterol. Hepatol. 2008;23(9):1426–30. DOI: https://doi.org/10.1111/j.1440-1746.2008.05481.x
- Ladep N.G., Lesi O.A., Mark P., et al. Problem of hepatocellular carcinoma in West Africa. World J. Hepatol. 2014;6(11):783–92. DOI: https://doi.org/10.4254/wjh.v6.i11.783
- Mulrooney-Cousins P.M., Michalak T.I. Persistent occult hepatitis B virus infection: experimental findings and clinical implications. World J. Gastroenterol. 2007;13(43):5682–6. DOI: https://doi.org/10.3748/wjg.v13.i43.5682
- Lin Y.Y., Liu C., Chien W.H., et al. New insights into the evolutionary rate of hepatitis B virus at different biological scales. J. Virol. 2015;89(7):3512–22. DOI: https://doi.org/10.1128/JVI.03131-14
- Lin C.L., Kao J.H. Hepatitis B virus genotypes and variants. Cold Spring Harb. Perspect. Med. 2015;5(5):a021436. DOI: https://doi.org/10.1101/cshperspect.a021436
- Cao G.W. Clinical relevance and public health significance of hepatitis B virus genomic variations. World J. Gastroenterol. 2009;5(46):5761–9. DOI: https://doi.org/10.3748/wjg.15.5761
- Yll M., Cortese M.F., Guerrero-Murillo M., et al. Conservation and variability of hepatitis B core at different chronic hepatitis stages. World J. Gastroenterol. 2020;26(20):2584–98. DOI: https://doi.org/10.3748/wjg.v26.i20.2584
- Mixson-Hayden T., Lee D., Ganova-Raeva L., et al. Hepatitis B virus and hepatitis C virus infections in United States-bound refugees from Asia and Africa. Am. J. Trop. Med. Hyg. 2014;90(6):1014–20. DOI: https://doi.org/10.4269/ajtmh.14-0068
- Camara B.S., Delamou A., Diro E., et al. Effect of the 2014/2015 Ebola outbreak on reproductive health services in a rural district of Guinea: an ecological study. Trans. R. Soc. Trop. Med. Hyg. 2017;111(1):22–9. DOI: https://doi.org/10.1093/trstmh/trx009
- Leno N.N., Delamou A., Koita Y., et al. Ebola virus disease outbreak in Guinea: what effects on prevention of mother-to-child transmission of HIV services? Reprod. Health. 2018; 15(1):60. DOI: https://doi.org/10.1186/s12978-018-0502-y
- Бумбали С., Серикова Е.Н., Семенов А.В. и др. Значимость лабораторной диагностики парентеральных вирусных гепатитов в Гвинейской Республике. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021;98(4):440–9. Bumbali S., Serikova E.N., Semenov A.V., et al. Significance of parenteral viral hepatitis laboratory diagnostics in the Republic of Guinea. Journal of Microbiology, Epidemiology and Immunobiology. 2021;98(4):440–9. DOI: https://doi.org/10.36233/0372-9311-116 EDN: https://elibrary.ru/wdbxjj
- Бумбали С., Балде T.Л., Семенов А.В. и др. Распространенность маркеров вирусного гепатита В среди доноров крови в Гвинейской Республике. Вопросы вирусологии. 2022;67(1):59–68. Bumbali S., Balde T.L., Semenov A.V., et al. Prevalence of viral hepatitis B markers among blood donors in the Republic of Guinea. Problems of Virology. DOI: https://doi.org/10.36233/0507-4088-92 EDN: https://elibrary.ru/zybhjz
- Балде T.A.Л., Бумбали С., Серикова Е.Н. и др. Сравнительный анализ вертикального риска передачи некоторых гемоконтактных инфекций в Гвинейской Республике. Проблемы особо опасных инфекций. 2021;(1):87–94. Balde T.A.L., Bumbali S., Serikova E.N., et al. Comparative analysis of the vertical risk of transmission of some blood-borne infections in the republic of Guinea. Problems of Particularly Dangerous Infections. DOI: https://doi.org/10.21055/0370-1069-2021-1-87-94 EDN: https://elibrary.ru/upnyfx
- Балде T.A.Л., Останкова Ю.В., Бумбали С. и др. Частота встречаемости мутаций лекарственной устойчивости и ускользания от иммунного ответа в геноме вируса гепатита В, выявленного у беременных в Гвинейской Республике. Вопросы вирусологии. 2023;68(3):228–41. Balde T.A.L., Ostankova Yu.V., Bumbali S., et al. Frequency of drug resistance and immune escape mutations in the hepatitis B virus genome detected in pregnant women in the Republic of Guinea. Problems of Virology. DOI: https://doi.org/10.36233/0507-4088-175 EDN: https://elibrary.ru/scvbmy
- Kaba D., Bangoura M.A., Sylla M.M., et al. Prevalence and factors associated with hepatitis B in a cohort of HIV-infected children in the Pediatric Department at Donka National Hospital, Guinea. Pan. Afr. Med. J. 2019;34:182. DOI: https://doi.org/10.11604/pamj.2019.34.182.16275
- Попова А.Ю., Кутырев В.В., Тотолян А.А., ред. Гепатит B в странах Западной Африки: эпидемиология, диагностика, профилактика. СПб.; 2021. Popov A.Y., Kutyrev V.V., Totolyan A.A., ed. Hepatitis B in West African Countries: Epidemiology, Diagnosis, Prevention. St. Petersburg; 2021. EDN: https://elibrary.ru/lpjvsd
- Бумбали С., Серикова Е.Н., Балде Т.Л. и др. Аминокислотные замены в регионах CORE и HBsAg вируса гепатита В при моноинфекции и ВГВ/ВИЧ-коинфекции в Гвинейской республике. ВИЧ-инфекция и иммуносупрессии. 2021;13(3):96–107. Boumbaly S., Serikova E.N., Balde T.A.L., et al. Amino acid substitutions in core and HBsAg regions of hepatitis B virus in patients with monoinfection and HBV/HIV-coinfection in the Republic of Guinea. HIV Infection and Immunosuppressive Disorders. 2021;13(3):96–107. DOI: http://doi.org/10.22328/2077-9828-2021-13-3-122-133 EDN: https://elibrary.ru/vnjjas
- Останкова Ю.В., Серикова Е.Н., Семенов А.В., Тотолян АА. Метод выявления в биологическом материале ДНК вируса гепатита В при низкой вирусной нагрузке на основе гнездовой ПЦР с детекцией по трем вирусным мишеням в режиме реального времени. Клиническая лабораторная диагностика. 2022;67(9):530–7. Ostankova Yu.V., Serikova E.N., Semenov A.V., Totolyan A.A. Method for hepatitis b virus DNA detecting in biological material at low viral load based on nested PCR with detection on three viral targets in real-time mode. Clinical Molecular Studies. 2022;67(9):530–7. DOI: https://doi.org/10.51620/0869-2084-2022-67-9-530-537
- Brichler S., Lagathu G., Chekaraou M.A., et al. African, Amerindian and European hepatitis B virus strains circulate on the Caribbean Island of Martinique. J. Gen. Virol. 2013;94 (Pt. 10):2318–29. DOI: https://doi.org/10.1099/vir.0.055459-0
- Kumar R. Review on hepatitis B virus precore/core promoter mutations and their correlation with genotypes and liver disease severity. World J. Hepatol. 2022;14(4):708–18. DOI: https://doi.org/10.4254/wjh.v14.i4.708
- Al-Qahtani A.A., Al-Anazi M.R., Nazir N., et al. The correlation between hepatitis B virus precore/core mutations and the progression of severe liver disease. Front. Cell Infect. Microbiol. 2018;8:355. DOI: https://doi.org/10.3389/fcimb.2018.00355
- Mendenhall M.A., Hong X., Hu J. Hepatitis B virus capsid: the core in productive entry and covalently closed circular DNA formation. Viruses. 2023;15(3):642. DOI: https://doi.org/10.3390/v15030642
- Kim H., Lee S.A., Do S.Y., Kim B.J. Precore/core region mutations of hepatitis B virus related to clinical severity. World J. Gastroenterol. 2016;22(17):4287–96. DOI: https://doi.org/10.3748/wjg.v22.i17.4287
- Quarleri J. Core promoter: a critical region where the hepatitis B virus makes decisions. World J. Gastroenterol. 2014;20:425–35. DOI: https://doi.org/10.3748/wjg.v20.i2.425
- Kew M.C., Kramvis A., Yu M.C., et al. Increased hepatocarcinogenic potential of hepatitis B virus genotype A in Bantu-speaking sub-Saharan Africans. J. Med. Virol. 2005;75(4):513–21. DOI: https://doi.org/10.1002/jmv.20311
- Ingasia L.A.O., Kostaki E.G., Paraskevis D., Kramvis A. Global and regional dispersal patterns of hepatitis B virus genotype E from and in Africa: A full-genome molecular analysis. PLoS One. 2020;15(10):e0240375. DOI: https://doi.org/10.1371/journal.pone.0240375
- Malagnino V., Salpini R., Maffongelli G., et al. High rates of chronic HBV genotype E infection in a group of migrants in Italy from West Africa: Virological characteristics associated with poor immune clearance. PLoS One. 2018;13(3):e0195045. DOI: https://doi.org/10.1371/journal.pone.0195045
- Bannister E.G., Yuen L., Littlejohn M., et al. Molecular characterization of hepatitis B virus (HBV) in African children living in Australia identifies genotypes and variants associated with poor clinical outcome. J. Gen. Virol. 2018;99(8):1103–14. DOI: https://doi.org/10.1099/jgv.0.001086
- Sanaei N., Hashemi S.M.A., Dehno S.Z.S., et al. Precore/core mutations of hepatitis B virus genotype D arising in different states of infection. Clin. Exp. Hepatol. 2022;8(1):21–8. DOI: https://doi.org/10.5114/ceh.2022.114253
- Garmiri P., Loua A., Haba N., et al. Deletions and recombinations in the core region of hepatitis B virus genotype E strains from asymptomatic blood donors in Guinea, west Africa. J. Gen. Virol. 2009;90(10):2442–51. DOI: https://doi.org/10.1099/vir.0.012013-0
- Ahmad I., Ahmad K. Molecular characterization of hepatitis B virus basal core promoter and precore region of isolates from chronic hepatitis B patients. J. Pak. Med. Assoc. 2021;71(6): 1575–82. DOI: https://doi.org/10.47391/JPMA.1254
- Belyhun Y., Liebert U.G., Maier M. Analysis of HBV basal core promoter/precore gene variability in patients with HBV drug resistance and HIV co-infection in Northwest Ethiopia. PLoS One. 2018;13(2):e0191970. DOI: https://doi.org/10.1371/journal.pone.0191970
- Chachá S.G.F., Gomes-Gouvêa M.S., Malta F.M., et al. Basal core promoter and precore mutations among hepatitis B virus circulating in Brazil and its association with severe forms of hepatic diseases. Mem. Inst. Oswaldo Cruz. 2017;112(9): 626–31. DOI: https://doi.org/10.1590/0074-02760160540
- Ho P.T., Balzanelli M.G., Distratis P., et al. Characteristics of hepatitis B virus genotype and sub-genotype in hepatocellular cancer patients in Vietnam. Diagnostics (Basel). 2022;12(10): 2393. DOI: https://doi.org/10.3390/diagnostics12102393
- Araujo N.M., Teles S.A., Spitz N. Comprehensive analysis of clinically significant hepatitis B virus mutations in relation to genotype, subgenotype and geographic region. Front. Microbiol. 2020;11:616023. DOI: https://doi.org/10.3389/fmicb.2020.616023
- Grant J., Agbaji O., Kramvis A., et al. Hepatitis B virus sequencing and liver fibrosis evaluation in HIV/HBV co-infected Nigerians. Trop. Med. Int. Health. 2017;22(6):744–54. DOI: https://doi.org/10.1111/tmi.12873
Дополнительные файлы